Изобретение относится к области молекулярной биологии и биотехнологии и мо- : жет быть использовано для получения нуклеотидов, меченных фосфором-32 и фос- фором-33. Указанные соединения широко используются в молекулярной биологии, биохимии и т.д. для исследования первичной структуры нуклеиновых кислот, а также для исследования структуры и функций различных ферментов. . ,
. Известен способ очистки нуклеотидов, меченных радиоактивным фосфором, с использованием ВЭЖХ на колонках, заполненных амино.пропилсиликагелем (АПС), в градиенте водного триэтиламмонийбикар- боната (ТЭАБ). Этот способ позволяет получать меченые нуклеотиды высокого качества.
В то же время, указанный способ обладает рядом существенных недостатков, а именно:
при очистке малых (5-10 мКи) количеств меченых нуклеотидов целевой продукт содержит значительное количество ТЭАБ, т.е.
не может быть использовано без предварительного упаривания;
колонки с АПС обладают малым сроком службы и при разовой загрузке 50-100 мКи подлежат замене после 10 хроматографий, что приводит к повышению себестоимости готового продукта и к дополнительному облучению персонала;
для получения продукта с низким содержанием ТЭАБ приходится использовать колонки малого размера, что неудобно при работе в перчаточном боксе;
. для получения меченых нуклеотидов с высокой объемной активностью (20-50 мКи/мл) в водном растворе приходится упаривать готовый продукт для удаления ТЭАБ, что отрицательно схазыЕается на его качестве.,
Цель изобретения - создание метода очистки меченых нуклеотидов, свободного от перечисленных недостатков.
Цель достигается тем, что для очистки нуклеотидов, меченных радиоактивными изотопами фосфора, используют ион-пар-.
(Л
С
vj
00
о о GO
.N
ную хроматографию на колонках с ОДС в линейном градиенте этанола, а в качестве ион-парного реагента используют ТЭАБ.
С целью оптимизации условий разделения при разработке метода были опробованы хроматографические колонки различного размера. При этом выяснилось, что использование колонок малого размера нецелесообразно, так как в этом случае продукт выходит с колонки в малом обьеме (0,03-0,05 мл) и его трудно собрать. Кроме того, с такими колонками неудобно работать в перчаточном боксе. В то же время использование колонок размером 4x150 мм (объем 1,8 мл) позволяет получить продукт в объеме 0,2-0,5 мл. Экспериментально обнаружено, что использование колонок объемами 1,5-2 мл наиболее рационально для достижения цели.
Дальнейшее увеличение размеров колонки приводите увеличению объема выхо- - да, что нежелательно, поэтому для массовой очистки меченых нуклеотидов были выбраны колонки с размером 4x150 мм. Было экспериментально установлено, что колонка такого размера выдерживает 200-250 хроматографий при разовой загрузке 50- 100 мКи; т.е. в 20-25 раз больше, чем указано в работе 1. Как было установлено экспериментально, ТЭАБ обеспечивает хорошее удерживание нуклеотидов на колонках с ОДС в концентрациях 0,04-0,06 М. Столь низкая концентрация соли позволяет избежать разложения соли на колонке и дает возможность получить готовый продукт с вьгсо кой объемной активностью без обессо- ливания. Снижение концентрации ТЭАБ до 0,025-0,03 М существенно снижает время удерживания нуклеотидов и ухудшает воспроизводимость результатов. Увеличение концентрации ТЭАБ до 0,08-0,15 М не дает существенного выигрыша и приводит к дополнительному солевому загрязнению продукта (табл. 1).
Определение концентрации ТЭАБ в готовом продукте показало, что даже в случае получения последнего в количестве 1-2 мКи она не превышает 0,03 М, такой продукт был пригоден для дальнейшей работы без предварительного упаривания.
Примеры конкретного исполнения.
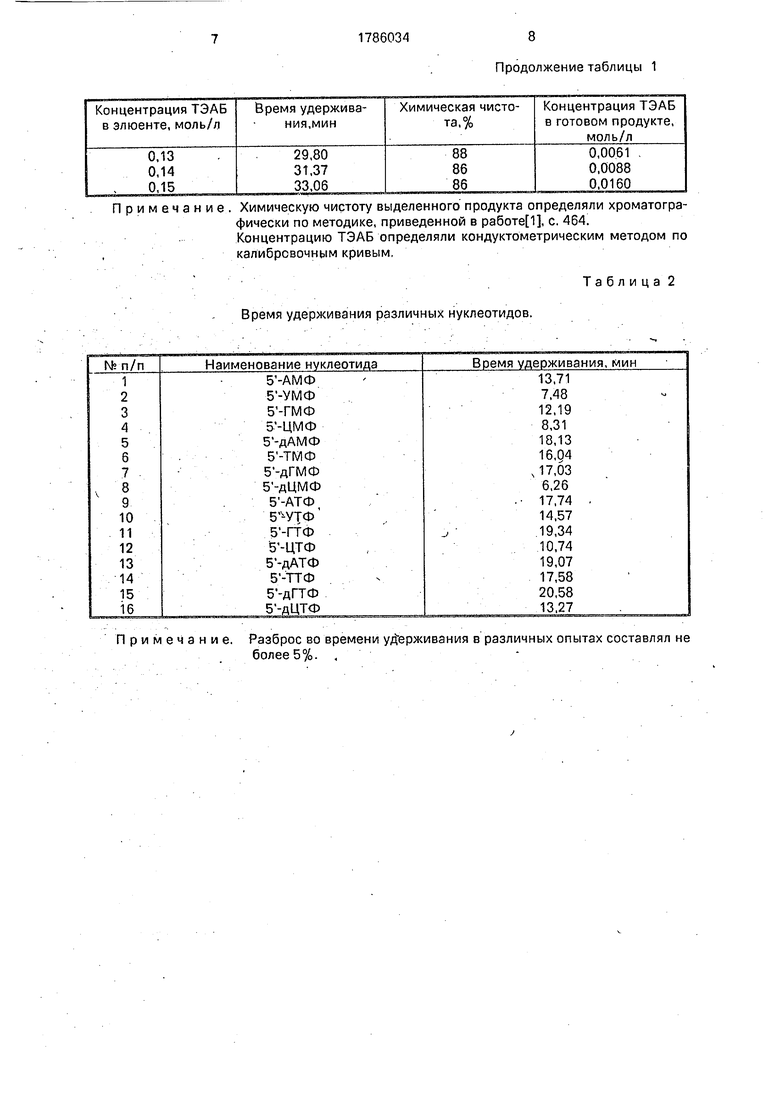
Пример 1. Выделение дезоксиаденозин-5 - э 2Р трифосфата..
К реакционной смеси объемом 0,5 мл, содержащей 90 мКи (18 нмоль)« , 10 мКи (2 нмоль) , 3 нмоль АДФ, 50 нмоль АТФ, 0,1 мг белка, 2 мкмоль , 1 мкмоль KCI, 5 мкмоль Trls-HCI, добавляли 0, мл 1 М раствора ТЭАБ, затем
32 г
наносили на колонку Sllasorb Cis размером 4x150 мм, предварительно уравновешенную 0,05 М ТЭАБ. Элюцию проводили градиентом концентрации этанола от 0 до 10%
за 25 мин со скоростью потока 0,5 мл/мин. Время удерживания дАТФ составляло 19,07 мин, объем фракции, содержащей продукт 0,2 мл, концентрация ТЭАБ в готовом продукте 0,00025 М,
Из фиг. 1 приведен профиль элюции а- , цифрами отмечены: 1 - АДФ; 2 - АТФ; 3 - а- Р дАМФ; 4 - а .
Аналогичное выделение 100 мКи а- позволило получить готовый продукт с объемной активностью 10-50мКи/мл в водном растворе с концентрацией ТЭАБ 0,002-0,02 М без дополнительного обессо- ливания. . .
Пример 2. Выделение гуанозин-5 а-32Р монофосфата.
К реакционной смеси объемом 0,20 мл, содержащей 80 мКи (16 нмоль)а , 20 мКи (4 нмоль) у , 100 нмоль/3
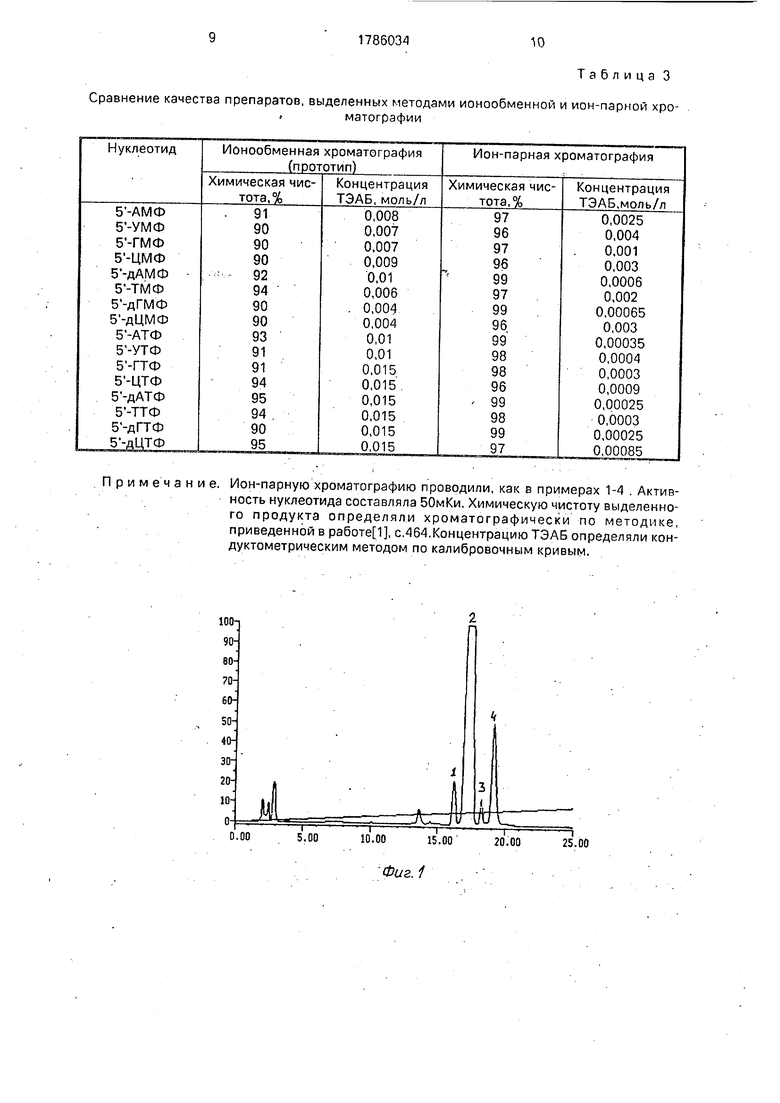
-NAD, 40 нмоль АДФ, 5 мкмоль Tris-HCl, 1 мкмоль KCI, 2 мкмоль MgCia и 0,1 мг белка, добавляли 0,01 мл 1 М раствора ТЭАБ, затем наносили на колонку Silasorb CIB размером 4x150 мм, предварительно уравновешенную 0,05 М водным ТЭАБ. Монофосфат элю- ировали градиентом концентрации этанола от 0 до 10% за 25 мин, скорость потока 0,5 мл/мин. Время удерживания а составляло 12,19 мин, объем фракции содержащей ГМФ 0,3 мл. /На фиг. 2 приведен профиль элюции а
, цифрой 1 отмечен . Выделенный таким образом продукт далее подвергался ферментативному фосфо- рилированию до соответствующего
трифосфата с выходом 95-100% без какой- либо дополнительной обработки.
Пример 3. Выделение аденозин-5,- у-32Р трифосфата.
К реакционной смеси объемом 0,15 мл,
содержащей 85 мКи (16 нмоль) у-32Р АТФ, 40 нмоль АДФ, 100 нмоль/3-NAD, 5 мкмоль Tris-HC, 1 мкмоль КС, 2 мкмоль MgCl2 и 0,2 мг белка, добавляли 0,01 мл 1 М раствора ТЭАБ, затем наносили на колонку Silasorb
Счв размером 4x150 мл, предварительно уравновешенную 0,05 М водным ТЭАБ. Три- фосфатэлюировали градиентом концентрации этанола от 0 до 10% за 25 мин, скорость потока 0,5 мл/мин.
Время удерживания у-АТФ составляло 17,74 мин, объем фракции, содержащей .у- АТФ 0,2 мл, концентрация ТЭАБ в готовом продукте 0,00035 М.
На фиг. 3 приведен профиль элюции у
, цифрами отмечены: 1 - АДФ; 2 - у-32Р АТФ.
Пример 4. Выделение уридин-5,
-32Р трифосфата.
К реакционной смеси объемом 0,5 мл, содержащей 70 мКи (14 нмоль) а-32Р УТФ, 10 мКи а-32Р УМФ, 50 нмоль АТФ, 0,1 мг белка, 2 мкмоль MgCte, 5 мкмольТг з-НС1, добавляли 0,025 мл 1 М раствора ТЭАБ, затем наносили на колонку Silasorb da размером 4x150 мм, предварительно уравновешенную 0,05 М ТЭАБ.
Элюцию проводили градиентом концентрации этанола от 0 до 10% за 25 мин со скоростью потока 0,5 мл/мин. Время удерживания а-32Р УТФ составляло 14,57 мин, объем фракции, содержащей продукт, 0,3 мл, концентрация ТЭАБ в готовом продукте 0,0004 М.
На фиг. 4 приведен профиль злюции а
, цифрами отмечены: 1 - а- 32Р УМФ;2- а 32Р УТФ;3-АТФ,
Время удерживания для других нуклео- зид-5 -моно- и трифосфатов, меченных фос- фором-32 и фосфором-33, приведено в табл. 2.
J Q
( Р)-нуклеотиды не отличались от сооветствующих (32Р)-нуклеотидов по своим
хроматографическим параметрам (время
удерживания, ширина пика, объем элюции
.и т.д.).
Химическая чистота и концентрация .ТЭАБ в готовых препаратах приведены в табл. 3. Радиохимическая чистота всех выделенных продуктов составляла 97-99% даже при выделении смеси, содержащей 150 и более мКи меченого соединения.
Таким образом, совокупность известных признаков с предложенными существенными отличиями, а именно использование ион-парной высокоэффективной хроматографии на колонках определенных размеров с определенным наполнителем, а также экспериментально
подобранных условий и режимов проведения элюирования обеспечили достижение цели - высокую химическую чистоту; снижение облучения персонала за счет более удобных условий работы в боксе и значительного увеличения срока службы колонок.
Формула изобретения Способ очистки нуклеотидов, меченных фосфором-32 и фосфором-33, путем пропускания реакционной смеси через высокоэф- фективную колонку с производным силикагеля г последующим элюированием нуклеотидов,с использованием триэтилам- моний карбоната, отличающийся тем,
что, с целью повышения химической чистоты целевого продукта, увеличения срока службы колонок и повышения безопасности процесса., используют ион-парную высокоэффективную жидкостную хроматографию
на колонках, заполненных октадецилсили- кагелем, объемом 1,5-2 мл, а элюирование проводят линейным градиентом вода - эта- нол от 0 до 10% за 25 мин, причем в качестве ион-парного реагента используют триэтиламмонийбикарбонат в конечной концентрации 0,04-0,06 М.
Таблица


| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ СИНТЕЗА НУКЛЕОЗИД-5'-ТРИФОСФАТОВ, МЕЧЕННЫХ РАДИОАКТИВНЫМИ ИЗОТОПАМИ ФОСФОРА В АЛЬФА-ПОЛОЖЕНИИ | 2007 |
|
RU2355768C2 |
| Способ определения аденозинтрифосфата | 1986 |
|
SU1439508A1 |
| Способ получения аденозин-5-монофосфата,меченного фосфором-32 | 1982 |
|
SU1127888A1 |
| Способ получения рибо- и дезоксирибонуклеозид-5 @ -трифосфатов, меченных изотопами @ С и @ Н | 1984 |
|
SU1251509A1 |
| АНАЛОГИ ПРИРОДНЫХ ДЕЗОКСИРИБОНУКЛЕОЗИДТРИФОСФАТОВ И РИБОНУКЛЕОЗИДТРИФОСФАТОВ, СОДЕРЖАЩИЕ РЕПОРТЁРНЫЕ ФЛУОРЕСЦЕНТНЫЕ ГРУППЫ, ДЛЯ ИСПОЛЬЗОВАНИЯ В АНАЛИТИЧЕСКОЙ БИООРГАНИЧЕСКОЙ ХИМИИ | 2014 |
|
RU2582198C1 |
| Способ очистки нуклеазы из проростков ячменя | 1989 |
|
SU1703688A1 |
| Способ получения рекомбинантной ДНК,кодирующей нуклеотидную последовательность инсулина | 1978 |
|
SU1308199A3 |
| СПОСОБ СИНТЕЗА МОДИФИЦИРОВАННЫХ ПО АТОМУ ФОСФОРА НУКЛЕИНОВЫХ КИСЛОТ | 2009 |
|
RU2572826C2 |
| Способ получения рибо- и дезоксирибонуклеозид-5 @ -трифосфатов | 1987 |
|
SU1493644A1 |
| Способ получения аффинного сорбента | 1980 |
|
SU883060A1 |
Использование: молекулярная биология, биотехнология, очистка нуклеотидов. Сущность: использование ион-парной хро- матографии на колонках, заполненных окта- децилсиликагелем объемом 1,5-2 мл( элюирование линейным градиентом вода - этанол от 0 до 10% за 25 мин, в качестве ион-парного реагента используют триэтм- ламмонийбикарбонат в конечной концентрации 0,04-0,06 М. 4 ил., 3 табл.
Зависимость времени удерживания,химической чистоты нуклеотида и концентрации ТЭАБ в готовом продукте от концентрации ТЭАБ в элюирующем растворе для дезоксиаденозин5 - а-32Р трифосфата (см. пример 1)
Примечание. Химическую чистоту выделенного продукта определяли хроматогра- фически по методике, приведенной в работе 1, с. 464. Концентрацию ТЭАБ определяли кондуктометрическим методом по калибровочным кривым,
Время удерживания различных нуклеотидов.
Примечание.
Разброс во времени удерживания в различных опытах составлял не более 5%. ч
Продолжение таблицы 1
Таблица 2
Таблица 3
Сравнение качества препаратов, выделенных методами ионообменной и ион-парной хро матографии
Примечание. Ион-парную хроматографию проводили, как в примерах 1-4 . Активность нуклеотида составляла 50мКи, Химическую чистоту выделенного продукта определяли хроматографически по методике, приведенной в работе 1, с.464.Концентрацию ТЭАБ определяли кон- дуктометрическим методом по калибровочным кривым.
Фаг. 1
0.00
Редактор Е.Хорина
Фиг. 4
Составитель Л.Панфилова Техред М.Моргентал
Фиг.З
Корректор С.Шекмар
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Высокоэффективная жидкостная хроматография в биохимии, Под ред | |||
| А.Хеншен и др., М.: Мир, 1988, с, 451-488. | |||
Авторы
Даты
1993-01-07—Публикация
1990-06-04—Подача