Настоящее изобретение относится к новым аллиламноэтилазолам, которые обладают фунгицидной и противогрибковой активностью, общей формулы I
Аг-СН- N-CHf-CH-CH-Ar1
i
СН0
ХО
л--
N
где X - атом азота или группа СН;
R - водород или метилрадикал;.
Аг - 2,4 - дигалоидфенил или нафтилра- дикэл;
Аг - незамещенный или галоидом, метилом, метокси или нитроодноэамещенный
фенильный остаток или галогеном двузаме- щенный, фенильный остаток или однозаме- щенный галогеном тиенильный остаток или их фармакологически переносимым или переносимым растениями кислотно-аддитивным солям.
Известны замещенные 2-фенилэтила- мино-1,2,4-триэзолы, обладающие фунгицидной активностью.
Совершенно неожиданно обнаружено, что полученные новые аллиламиноэтилазо- лы отличаются более сильным фун гицидным и противогрибковым действием.
Галоген означает фтор, хлор, бром и иод, предпочтительно хлор.
Наиболее предпочтительным являются следующие соединения: 1-/2/2,4-дихлорфе- нил/-2-/3-фенилаллиламино//этил-1Н-им- идаэол; 1-/2-/2,4-дихлорфенил/-2-/3-/4- метоксифенил/аллиламино//этил-1Н-ими- дазол; 1-/2-/2,4-дихлорфенил/2-/3-/4-ме(Л
С
00
со
N
О Os
СА
тилфенил/аллиламино//этил-1 Н- и.мида- зол; 1-/2-/2,4-дихлорфенил/-2-/3-/2-хлор- фенил/аллилэмино//этил-1Н-имидэзол: Ь //2-/2,4 -дихлорфенил /-2-/3-/4-хлорфенил/ аллиламино//этил-1 Н-триазол.
Новые соединения могут быть также в форме переносимых растениями или фармакологически приемлемых кислых аддитивных солей.
Такими кислыми аддитивными солями могут быть соли неорганических или органических кислот, например гидрохлориды, гидробромиды и гидроиодиды, нитраты, гидросульфаты, метосульфаты.-трифторме- тилсульфонаты, тозилаты, ацетаты, трифто- рацетаты, лактаты, малаты и бензоаты, Новые аллиламиноэтилазолы формулы I получают тем, что
а) соединение формулы II
где X и Аг имеют вышеуказаннные значения подвергают взаимодействию с соединением общей формулы VI
О
5
Н
С-СН СН-Аг
Ю при необходимости в инертном разбавителе, с получением соединения общей формулы VII
Ar-CH-N CH-CH CH-Ar
СН
1 .
NVII









| название | год | авторы | номер документа |
|---|---|---|---|
| Фунгицидное средство | 1979 |
|
SU1055313A3 |
| Способ получения производных 1-азолил-2-арил-3-фторалкан-2-ола | 1983 |
|
SU1326194A3 |
| СПОСОБ ПОЛУЧЕНИЯ ПИПЕРАЗИНИЛАЛКИЛ-3(2H)-ПИРИДАЗИНОНОВ ИЛИ ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫХ СОЛЕЙ | 1990 |
|
RU2024517C1 |
| АСИММЕТРИЧНО ЗАМЕЩЕННЫЕ ПРОИЗВОДНЫЕ ДИАМИНОДИКАРБОНОВОЙ КИСЛОТЫ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 1994 |
|
RU2142450C1 |
| Способ получения производных 1Н-1,2,4-триазола | 1983 |
|
SU1431677A3 |
| Способ получения производных простых арилфениловых эфиров или их кислотно-аддитивных солей,или их металлических комплексов | 1982 |
|
SU1148564A3 |
| Способ получения производных азола или их фитофармацевтически приемлемых кислотно-аддитивных солей | 1981 |
|
SU1396966A3 |
| Способ борьбы с грибками | 1973 |
|
SU648045A3 |
| Способ борьбы с фитопатогенными грибами | 1982 |
|
SU1436855A3 |
| Фунгицидное средство | 1977 |
|
SU698513A3 |
Использование: в медицине в качестве веществ с фунгицидной и противомикроб- ной активностью. Сущность изобретения: продуктф-лы I Ar-CH{CH2 -N-CHN-CHX}-NR- СНа-СНСН-Аг, где R-H, СН: X-N или -СН. Аг - 2,4-дигалоидфенил или нафтил: Аг не- или замещенный фенил или тиенил. Реагент 1: соединение ф-лы II Аг-С(0)- CH9-N-CHN-CHX. Реагент 2: соединение ф- лы III Ar-CHCH-CH2-NH2. Условия реакции: в среде инертного разбавителя. 2 табл.
снг
N
И
LJ
N
где Аг и X имеют вышеуказанные значения, подвергают взаимодействию с соединением формулы 111 .
NH2-CH2-CH CH-Ar III
где Аг имеет вышеуказанные значения, при желании в инертном разбавителе, с получением соединения общей формулы IV
Ar-C N-CHrCH CH-Arl
IV.
или .в) соединение формулы V Ar-CH-NH2 V
СНг
ыч
О
N
5
0
и в заключении полученные соединения общей формулы IV или VII в присутствии инертного разбавителя путем добавления восстанавливающего средства восстанавливают до соединения общей формулы I, в которой R означает водород, и при желании последнее метилируют до соединения общей формулы I, гдеН означает метилгруппу,
Взаимодействие соединений формул II и III, соотвтственно взаимодействие соединений формул V и VI целесообразно прово- 5 дить в среде органического разбавителя.
В качестве разбавителей можно использовать алифатические или ароматические углеводороды, которые могут быть хлорированы, такие как различные бензиловые фракции, дихлорэтан, бензол, толуол, хлорбензол, ксилол, простые эфиры, такие как-ди- бутиловый эфир, диоксан, спирты, такие как бутанол, пентанол, этиленгликоль, амиды кислот, такие как диметилформамид, и их смеси с вышеуказанными разбавителями, Предпочтительным разбавителем является толуол.
Реакцию проводят при температуре 0-180°С, предпочтительно при температуре кипения используемого разбавителя. Образующуюся в результате реакцию воду удаляют, предпочтительно путем азеотропной перегонки. Обычно исходные соединения берут в стехиометрическом соотношении. В отдельных случаях однако может оказаться целесообразным брать один из них в избытке. По предпочтительному варианту осуществления исходные соединения, взятые в стехиометрическом соотношении, растворяют или суспендируют в толуоле, после чего кипятят смесь с обратным холодильни0
5
0
5
ком и вордоотделителем до тех пор. пока не перестанет отделяться вода.
Образующиеся иминосоединения формулы IV, соответственно VII, после удаления разбавителя можно не подвергая их допол- нительной очистке, восстанавливать в соединении формулы I, у которых R означает атом водорода. Для этого растеряют или Суспендируют иминосоединения в органическом разбавителе и добавляют к раствору или суспензии восстановитель. В качестве разбавителя в зависимости от природы используемого восстановителя можно применять спирты, например метанол, этанол и т.п., или простые эфиры. например диэтиловый, ди- изопропиловый эфир или тетрагидрофуран.
В качестве восстановителя можно использовать, например, комплексные гидриды металлов, такие как натрий-, литий-, или алюминийборгидрид, натрий- или литийци- аноборгидрид, литийалюминийгидрид и т.п. Можно однако осуществлять гидрирование и с помощью водорода в присутствии подходящего катализатора. Предпочтительно восстановление осуществляют с помощью натрийборгидрида в среде метанола, причем гидрид металла обычно берут з 1,1-20- кратном избытке. Реакцию проводят при температуре от примерно -20°С до температуры кипения используемого растворителя, предпочтительно при-5 - 65°С.
После окончания реакции избыток гидрида металла разрушают путем добавления к реакционной смеси кислоты, предпочтительно соляной кислоты, причем раствори- тель при желании удаляют до или после добавления кислоты. Для дальнейшей переработки путем добавления щелочи, предпочтительно водного раствора едкого натра соединение формулы IV или VII выделяют в виде свободного основания и экстрагируют с помощью органического, несмешивающегося с водой -растворителя, например уксус- ноэтилового эфира или дихлорметана. После высушивания и удаления органического рас- твОрителя соединение формулы 1, у которого R означает атом водорода, можно перевести обычным способом алкилирования в соединение формулы I, у которого R означает метил.
Для введения метильного остатка можно также подвергнуть соединению формулы 1, у которого R означает атом водорода, обработка в водном растворе формальдегида в присутствии восстановителя, например муравьиной кислоты.
Очистку соединений формулы I можно осуществлять путем перекристаллизации, колоночной хроматографии или образования и высаживания кислых аддитивных солей. Для получения кислых аддитивных
солей соединения формулы 1 растворяют в органическом растворителе, например диэ- тиловом эфире, уксусноэтиловом эфире, ацетоне или изопропиловом спирте и осаждают путем добавления неорганической или органической кислоты соответствующую кислую аддитивную соль, которую выделяют и при желании лерекристаллизовывают и,з органического растворителя, например уксусноэ- тилового эфира, изопропанола, этанола и т.п. Во всех указанных реакциях исходные соединения, как правило, берут в стехио- метрическом соотношении. В отдельных случаях однако может оказаться целесообразным брать то или другое из исходных соединений в избытке.
Новые аллиламиноэтилазолы эбщей формулы 1 и их соли отличаются высокой фунгицидной активностью и поэтому пополняют арсенал существующих средств. Они являются эффективным средством для борьбы с широким спектром потогенных грибков растений, например Oomyceten, Ascomycoteu, Basidtomyceteu и Deuteromy- ceteu.
Хорошая переносимость растениями и систематическое действие в необходимых для лечения болезней растений концентрациях позволяет использовать их для обработки наземных частей растений, саженцев и посевного материала.
В качестве примеров растений можно назвать зерновые культуры, такие как пшеница, рожь или овес, кукурузу, ягоды, декоративные культуры, картофель, а также различные овощные культуры, такие как огурцы, фасоль или томаты.
Особенно эффективно описываемые в соответствии с настоящим изобретением средства можно использовать для лечения следующих болезней рстений:
Botryotinia fuckeliaпа (серая плесень)на ягодичных
Cercospora beticola
(пятнистость листьев) на свекле
Pseudocercosporeblaher potrlchoides
(ломкость стебля)на зерновых
Cochliobolus satleres
(гельминтоспориоз) на зерновых
Pyrenophora teres
(пятнистость листьев) на ячмене
Phacosphaerta nodorucu (сухость листьев) на зерновых
Septoria apiicoba
(пятнистость листьев) на сельдерее
Veuturia Inaequalls . на яблонях
FusarJmu culmorumна зерновых
Afteruaria alterucota на зерновых
Aspergillus nlger
(черная плесень)на зерновых
Monograpnella nlvakls
(снежная плесень)
Новые активные вещества в зависимо- сти от области применения могут использоваться для приготовления обычных препаратов, например растворов, смачивающихся порошков, концентратов эмульсий, эмульсий, суспензий, порошков, пен, паст, гранулятов, аэрозолей, пропитанных активным веществом природных и синтетических материалов, микрокапеулятов с полимерной оболочкой и масс с оболочкой для посевного материала, далее в препаратах с горючими зарядами, например патронах для окуривания, дымовых шашках и спиралях и т.п., а также для препаратов с ультра малым объемом и получения холодных и теп/тых туманов.
Все эти препараты получают обычными способами, например путем смешивания активных компонентов с наполнителями, жидкими растворителями, находящимися под давлением ожиженными газами и/или твердыми носителями, при желании с йс- пользова,нием поверхностно-активных веществ, эмульгаторов и/или диспергаторов, и/или вспенивателей. При использовании в качестве наполнителя воды в качестве вспомогательных средств можно использовать шелуху ореха, кукурузных початков и стеблей табака. В качестве эмульгаторов и/или вспенивателей могут использоваться, например, неионогенные и ионные поверхностно- активные вещества, такие как полиоксиэти- ленсорбитановые эфиры таллового масла, олеилметилтаурид натрия, полиоксиэтиле- новые эфиры жирных кислот, полиоксиэти- леновые эфиры жирных спиртов, и в частности алкиларилполигликолевые эфиры, алкилсульфонаты,алкилсульфаты,арил- сульфаты и аридалкилсульфонаты, а также гидролизаты белков. В качестве диспергаторов можно использовать, например, лиг- нинсульфонаты или продукты конденсации арилсульфонатов и формальдегида.
В состав указанных препаратов могут также входить прилипательные добавки и загустители, такие как карбоксиметилцел- люлоза, метилцеллюлоза, природные и синтетические порошкообразные, зернистые и латексообразные полимеры, такие как гуммиарабик, поливиниловый спирт и поливи- нилацетат.
В них могут также входить красители, например, неорганические пигменты, такие как оксид железа, оксид титана, ферроциа- новый голубой, и органические красители, такие как ализариновые, азо- и металлфта- лоцианиновые красители, и микроэлементы, такие как соли железа, марганца, бора, меди, кобальта, молибдена и цинка.
Указанные препараты содержат, как правило, 0,1-95, предпочтительно 0,5-50
мас.% активного вещества.
Активные вещества могут применяться как таковые, а также в виде приготовленных на их основе препаратов или полученных из этих последних путем их разбавления гото0 вых к употреблению форм, таких как растворы эмульсии, суспензии, порошки, пасты и грануляты. Обработка этими препаратами осуществляется обычными способами например, путем полива, окунаний, опрыски5 вания, опыления, распыления, спарения, инжецирования, обработки суспензиями, внесения в почву, сухого, влажного или мокрого протравливания, протравливания суспензиями или инкрустирования.
0 При обработке частей растений концен- трация активного вещества в используемых для обработки препаратов может варьироваться в более широком интервале. Как правило, он находится в пределах 1-0, 0001,
5 предпочтительно 0,5-0,001 мас.%.
При использовании заявляемых активных веществ для лечения грибковых заболеваний расход их составляет 0,015-4 кг активного вещества на га обрабатываемой
0 поверхности.
Для защиты поверхности деревьев и плодов активные вещества могут также применяться в сочетании с дисперсиями полимеров в концентрации 0,25-5% в расчете
5 на все дисперсии..
При обработке семенного материала расход активного вещества составляет, как . правило, 0,001-50, предпочтительно 0,01-10 г на кг семенного материала.
0 При обработке почвы концентрация активного вещества составляет 0,00001-0,1 предпочтительно 0,0001-0,02 мас.% в расчете на обрабатываемую поверхность.
Как совершенно неожиданно оказа5 лось,новые соединения общей формулы I, в частности те из них, у которых X означает группу СН, а также их кислые аддитивные соли обладают необыкновенно сильной ан- тимикотической активностью. Они являются
0 чрезвычайно эффективными по отношению к возбудителям, вызывающим микоз у людей и животных, например по отношению к дрожжам, плесневым грибкам и дерматофи- там, и могут поэтому найти применение в
5 качестве лечебных среды, например в виде фармацевтических препаратов, содержащих соединения в соответствии с настоящим изобретением в смеси с подходящим для местного, внутреннего или парентерального применения фармацевтически
приемлемого органического или неорганического носителя.
Фармацевтически приемлемым нетоксичными носителями, использующимися обычно для получения твердых препаратов, являются трикальцийфосфат, карбонат кальция, каолин, бентонит, тальк, желатин, лактоза, крахмал и т.п. Примерами носителей, которые могут использоваться для при- готовления полутвердых препаратов, являются полиалкиленгликоли, вазелин петролат и другие мазевые основы. Для получения жидких препаратов в качестве носителя можно использовать, например воду, растительные масла и низкокипящие растворители, такие как изопропанол, гидрированный нафталин и т.п.
Фармацевтические препараты могут выпускаться в твердой форме, например, а. виде таблеток, драже, свечей, капсул; в жидкой форме, например, в виде растворов, суспензий или эмульсий, или в полутвердой форме, например в виде кремов, лосьонов, гелей или мазей. При желании они могут быть стерилизованы и/или содержать вспомогательные добавки, например консерваторы, стабилизаторы или эмульгаторы, соли .для изменения осмотического давления или буферы. Они могут также вводиться в комбинации с другими терапевтическими активными материалами.
Предлагаемые препараты содержат, как правило, 0,1-99.9 мае.% активного вещества.
В случае препаратов для местного применения это количество может, например, составлять примерно 0,1-10% от общего веса фармацевтического препарата. В других же препаратахономожетсостэзлятьотпри- мерно 5 до примерно 95 или более процентов.
При использовании в фармации местное применение является предпочтительно. Для этой цели поверхность, пораженную или.которую нужно защитить от поражения грибками или бактериями, можно обрабатывать соединениями в соответствии с настоящим изобретением или содержащими их средствами, например путем припудривания, смачивания, опыления аэрозолями, промывания, растирания щетками, смазывания, с помощью венночек, нанесения покрытий и пропитанных повязок и т.п.
Точные указания по фармацевтическому применению предлагаемых в соответствии с настоящим изобретением соединений и средств зависит от конкретных заболеваний, способа применения (в лечебных или профилактических целях), вида организма
и, естественно, от заболеваний лечащего врача.
П р и м е р 1. 1-/2-/2,4-Дихлорфенил/-2- /3-фенилаллиламино//этил/-1 Н-имидазол 5а) 1-/2-/2,4-Дихлорфенил/-2-/3-фенилаллилимино/этил-1 Н-имидазол 12.34 о (0,048 моля) 2,4-дихлорфенацилимидазола и 6,66 г (0,05 моля) циннамиламина дис/ieprn- руют в 100 мл толуола и кипятят с водоотде- 10 лителем до тех пор, пока не прекращается отделение образующейся в результате реакции воды. После этого растворитель отгоняют в вакууме, 8 результате получат 17,4 г (98% от теоретического выхода) вязкой мас- 15 лянистой жидкости.
в) 1-/2-/2,4-дихлорфенил/-2/3-фени- лаллиламино//этил-1 Н-имидазол 17,4 г (0,047 моля) продукта, полученного на стадии а), растворяют в примерно 400 мл мета- 0 нола, раствор охлаждают до 0°С и добавляют к нему порциями 6,5 г (0,17 моля) боргидрида натрия таким образом, чтобы температура не поднималась выше 5°С, После прекращения охлаждения смесь перемешива- 5 ют в течение 2 ч при 20-30°С, растворитель отгоняют и студнеобразный остаток смешива- ют со 150 мл разбавленной в два раза соляной кислоты для разложения избытка боргидрида натрия. Затем с помощью 40%- 0 ного раствора едкого натра рН смеси устанавливают 13-14 и образующиймя водный щелочный раствор несколько раз экстрагируют дихлорметаном. Органические фазы промывают водой, высушивают и упаривают. 5 Маслянистый остаток растворяют в ацетоне и смешивают с концентрированной азотной кислотой. При этом выпадает кристаллический осадок динитратэ целевого соединения.
0 Выход; 11,2 г (49% от теоретического выхода). Температура плавления: 190- 192°С.
Пример 2. 1-/2-/2,4-Дихлорфенил/- 2-/3-/4-хлорфенил/аллиламино//этил-1Н 5 -1,2,4-триазол.
а) 1-/2-/2,4-дихлорфенил/-2-3-/4-хлор- фенил/-2-пропенилиденимино//этил- 1Н- 1,2,4-триазол.
9,0т (0,035 моля) 1-/2-амино-2-/2,4-дих- 0 лорфенил//этил-1Н-1,2,4-триазола и 5.83 г (0Г035 моля) 4-хлор-коричного альдегида суспендируют в 80 мл толуола и кипятят с водоотделителем до тех пор, пока не превращается отделение образующейся в ре- 5 зультате реакции воды. После удаления растворителя в вакууме маслянистый остаток перемешивают с метанолом. При этом получают 14 г (98,5% от теоретического выхода) кристаллического продукта с температурой плавления 144-147 С.
в) 1-/2-/2,4-Дихлорфенил/-2/3-4-хлор- фенил/аллиламино//этил-1Н- 1,2,4-триазол
11,8 г (0,029 моля) продукта, полученного на стадии а), суспендируют в 500 мл метанола, суспензию охлаждают до 0°С и добавляют к ней порциями 3,78 г (0,1 моля) боргидридэ натрия таким образом, чтобы температура не поднималась выше 5°С. При этом получают прозрачный раствор. После пркращения охлаждения реакционную смесь перемешивают в течение еще при-, мерно часа при 20-30°С, растворитель отго- нют в вакууме и для разложения избытка боргидрида натрия смешивают ее с разбавленной в два раза соляной кислотой. Затем путем добавления 40%-ного водного раствора едкого натра рН смеси устанавливают равным 13-14, образующийся водный ще- лочный раствор нескольько раз подвергают экстракции дихлорметаном. органическую фазу промывают водой, высушивают и упаривают. Маслянистый остаток растворяют в ацетоне и полученный раствор смешивают с концентрированной азотной кислотой, в результате чего выпадает кристаллический осадок динитрата целевого соединения.
Выход: tO,9 г (80% от теоретического выхода); температура плавления: 195- 1Э7°С.
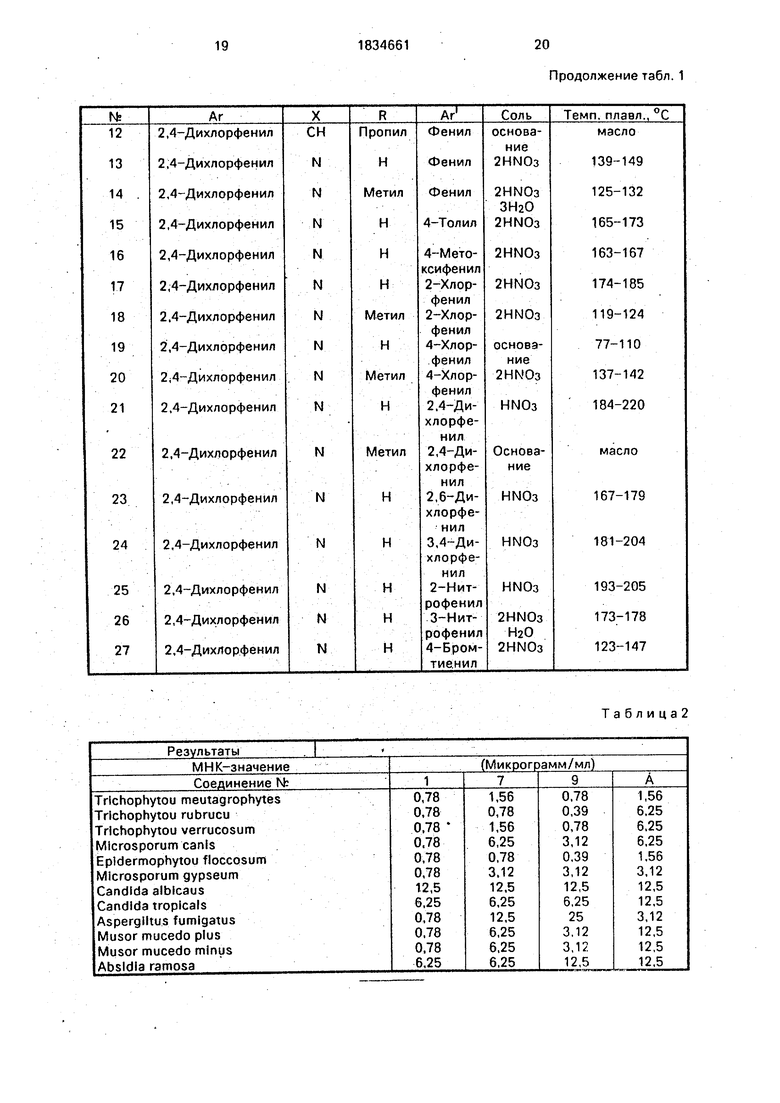
Аналогичным образом, используя соответствующие исходные материалы, получают приведенные в таблице соединения 3-27 общей формулы I.
П р и ме р28. Концентрат эмульсии 10% активного вещества (соединение № 3) 25% 4-бутиролактона,55% ксилола, 10% атлокса 3335-В.
П р и м е р 29. Концентрат эмульсии 25% активного вещества (соединение № 2) 20% этоксилированного динонилфенола (40 молей зтиленоксида на моль нонилфенола) 65% диметилсульфоксида.
Из этих концентратов путем разведения водой можно получить эмульсии любой концентрации.
П р и мер 30. Смачивающийся порошок 20% активного вещества (соединение № 1), 50% каолина, 20% вессалони SV, 10% ар- копона TR.
П р и м е р 31. Смачивающийся порошок 50% активного вещества (соединение №2), 30% каолина, 10% вессалона SV,10% ap- копона TR.
Активные вещества вместе с добавками тщательно перемешивают в смесителе и затем измельчают в вальцах и мельницах, В результате получают смачивающийся порошок с отличной смачиваемостью, из которого путем разведения водой можно получить суспензию нужной концентрации.
П р и м е р 32. 1(2-/2,4-дихлорфенил/2-/N-мети л- -(3-(2-хлорфенил)аллиламино)этил-1 Н-1,2,4-триазол (соединение № 18).
2,97 г (0.0073 мол) 1-{2-(2-{2.4-дихлорфенил)-2-(2-хлорфенил)-аллиламино)этил-1 Н- 2,2,4-триазола, полученного по типу и способу примера 2, смешивают с 4,0 г (0,073 мол) 85%-ной водной муравьиной кислоты и 1,5 г(0,018 мол)33%-ного водногоформаль0 дегида при перемешивании и нагревают 2 часа до температуры кипения флегмы. После охлаждения до комнатной температуры при перемешивании добавляют 5 мл концентрированной соляной кислоты и непос5 родственно после этого 40%-ную водную натриевую щелочь до достижения значения рН около 14. Водную фазу экстрагируют трижды дихлорметаном порциями по 50 мл, соединенные органические фазы промыва0 ют водой и растворитель испаряют.
Маслянистый остаток вносят в ацетон и смешивают с концентрированной азотной кислотой, при этом осаждается динитрат в виде кристаллов.
5Выход 3,4 г 85% от теории, Т.пл. 119124°С.
Нижеследующие примеры из испытания A-G относятся к новым аллиламиноазо- лам при использовании их в качестве
0 фунгицидов в сельском хозяйстве. П р им е р А. Испытания
а) Охлажденную питательную среду заражали водной суспензией частей гиф
5 и/или спорами конидий исследуемых грибков. Фильтрующие пластинки диаметров 5 мм пропитывали 0,001-0,2%-процентной суспензией соответствующего препарата активного вещества и помещали в питатель0 ную среду. Активность соединений оценивали по минимальной ингибирующей концентрации (МНК), представляющей собой ту концентрацию активного вещества в дисперсии, при которой полностью прекра5 щается рост грибков. В качестве стандартных соединений использовали:
А тиабендазол: 2-/4-тиазолил/-бензи- мидазол
В пропикноназол: 1-/2-/2,4-дихлорфе0 нил/-4-пропил-1,3-диоксолан--2- илметил/- 1 Н-1,2,4-триазол
С прохлораз: 1-/М-пропил-М-/2-/2,4- трихлорфенокси/-этил-карбамоил/- имида- зол.
5 Использовали питательные среды следующего состава: питательная среда I: пептон, солодовый экстракт, агар питательная среда II: вытяжка из овсяных хлопьев, агар питательная среда III: морковный экстракт, картофельный экстракт, агар питательная
среда IV: солодовый экстракт, агар питательная среда V: дрожжевой экстракт глю1/ Alternaria alternate
стандарт С
соединение I
2/ Asperglllumlges
стандарт А
соединения 1,6
соединения 5,7
3/ Bots yotinia fuchelian
стандарт А
соединения 1
соединения 4,7, 15
4/ Cereospora botlcofa
стандарт С
соединения 2, 3. 5, 6, 19
соединения 1, 4, 15, 16,
соединения 9, 14
соединения 4
5/ Cochhobolus saturus
стандарт С
соединение 19
соединения 1, 2,13
6/ Fusarimu culmorum
стандарт А
соединения 1, 3, 4, 5, 6
7/ Fusarium oxysporum
стандарт А
соединения 1, 14
8/ Gibberella arenacea
стандарт А
соединение 1
9/ Gibberella pullcoris
стандарт А
соединение 1
10/ Monographella nlval
стандарт А
соединения 1, 6, 9
11/ Phaeosphacria nodo
стандарт В
соединения 1,4,5, 16, 1
соединения 2, 3, 7, 14, 1
соединения 6, 13,15
12/ Psendocercosporella choides
стандарт А
соединение 13
13/ Pyrenophora teres
стандарт А
соединения 3, 4, 5, 6, 7
соединения 1,27
14/ Venturia inaegualis
стандарт В
соединения 1, 15,17, 24
коза, агар питательная среда VI: пептон, солодовый экстракт, агар.
езультаты МНК
/м.д.активного вещества/
10 10
100
25
50
50 10 25
5-10
2,5
5
10
10
5
10
100 25
100 50
100 Ю
100 50
80 25
50 2,5 5 10
питательная среда
IV
V
VI
ПримерВ.
Защитное действие соединений по отношению к мучнистой росе (Erysiphe clchoracearum) на огурцах.
Растения огурцов возрастом 10 дней опрыскивали разбавленным водой препаратом активного вещества.
После высыхания жидкости растения заражали спорами конидиоспорами с больных растений. Обработанные таким образом растения выдерживали в теплице в нужных условиях.
Через 14 дней после искусственного заражения производили оценку поражения растения.
При этом, например, соединения 1 и 13 при концентрации активного вещества 50- 100 м.д, полностью предотвращали развитие болезни,,.
ПримерС. Защитное действие соединений по отношению к мучнистой росе (Etyslphe gramirus) на пшенице и ячмене. Растения ячменя и пшеницы на стадии появления у них 2 листьев опрыскивали разбавленным водой препаратом активного вещества до появления капель.
После высыхания жидкости растения заражали конидиоспорами с пораженных растений. Обработанные таким образом растения выдерживали затем в теплице в определенных условиях.
Через 8-10 дней после искусственного заражения оценивали степень поражения растений.
При этом, например, соединения 1,13,24 и 25 при концентрации активного вещества 100 м.д. полностью предотвращали развитие болезни.
П р и м е р 9. Защитное действие соединений по отношению к бурой гнили пшеницы /Puccinia recondita/. Растения пшеницы на стадии появления у них 2 листьев опрыскивали разбавленным водой препаратом активного вещества. После высыхания жидкости растения заражали уредоспорами, собранными с зараженных растений. После этого испытуемые растения выдерживали в течение 24 ч климатической камере при 20°С и влажности воздуха около 95%.
. Затем растения выдерживали в теплице в определенных условиях до появления явных признаков болезни у контрольных растений.
Результаты испытаний свидетельствуют о том, что. например, соединения 1,2,7,10 и 13 при концентрации их 50-200 м.,д. полностью предотвращают развитие болезни.
П р и м е р Е.
Защитное действие по отношению к бурой гнили овса /Puccinta coronata/.
Растения овса на стадии появления у них 2 листьев опрыскивали разбавленным водой препаратом активного вещества до появления капель. После высыхания жидкости растения заражали уредоспорами, собранными с пораженных растений. После этого растения выдерживали в теплице при 20°С и влажности воздуха около 95% в течение 24 часов.
В этих условиях растения выдерживали затем в теплице до появления явных при- знаков болезни у контрольных растений.
Результаты испытаний свидетельствуют о том, что, например соединения 1,10 и 13. при концентрации их 50-200 м.д., в достаточной степени тормозят развитие бо- лезни растений, П р и м е р F.
Защитное действие соединений по отношению к сухости листьев пшеницы /Phacosphaeria nodorum/, Растения пшеницы на стадии появления у них 2 листьев опрыскивали разбавленным водой препаратом активного вещества до появления капель. После высыхания жидкости растения заражали водной суспен- зией пикнидоспор Phacosphaeria nodorum. После этого обработанные растения выдерживали в течение 36-40 часов в климатической камере при 20°С и влажности воздуха около 95%.
Затем растения выдерживали в теплице в заданных условиях до появления явных признаков болезни у контрольных растений.
Результаты испытаний свидетельствуют о том, что, например, соединения 1,6 и 13
при концентрации активного вещества 200
м.д. полностью или в достаточной степени
предотвращают поражение растений.
П р и м е р G.
Защитное действие по отношению к гельминтоспориозу /Cochliobolus sativus/ на пшенице.
Растения пшеницы на стадии появления у них 2 листьев опрыскивали разбавленным водой препаратом активного вещества до появления капель. После высыхания жидкости растения заражали водной суспензией конидоспор Cochliobodus sativus.
После этого испытуемые растения выдерживали в течение 24 часов в климатической камере при 200°С и влажности воздуха около 95%.
Затем растения выдерживали в заданных условиях в теплице до появления явных
признаков болезни у контрольных растений.
Результаты испытаний свидетельствуют о том, что. например, соединения 1,6 и 17 при концентрации активного вещества 200 м.д. полностью или в достаточной степени предотвращают поражение растений.
П р и м е р Н.
Антимикотическое действие соедине- ний по отношению к дрожжам, плесневым грибкам и дерматофитам. Испытуемые соединения растворяли в диметилсульфоксиде и полученный раствор разбавляли стерильной водой до различных концентраций (0,19-10 мкг/мл). По 0,5 мл разбавлений добавляли к жидкой питательной среде.
Отдельные штаммы выращивали на Sabourad-B-lerwiikl ктсом агаре и перед использованием проводили пассаж на моди- фицированной жидкой питательной среде Sabourad, после чего делали сбор, проводили промывку и готовили суспензию Мс Faerlaud 3 в случа дрожжей и плесневых грибков и суспензию Me Faerlaud 4-5 в слу- чае дермотофитов.
В пробирки помещали по 100 мкл подготовленного выше описанным образом материала и проводили инокуляцию (плотность засева: дрожжей около 103/мл, плес- невых грибков и дерматофитов около 104/мл). рН жидкой питательной среды составляло 6,0. После инокуляции грибки выращивали в течение 14 дней при 22°С.
Для оценки антиммкотической активно- сти соединений определяли МНК, т.е. концентрацию, при которой уже не наблюдался рост грибков.
Для сравнения использовали известный фунгицид-тиабендаэолни.трат 1-/2- /2.4-дихлорфенил /-2//2.4-дихлорфенил/ -ме- ТОКСИЭТИЛ/-1 Н-имидазола (соединение А).
Таким образом, новые зллиламиноэти- лаэолы обладают высокой фунгицидной и противогрибковой активностью.
Формула изобретения
Лллиламиноэтилазолы общей формулы
R
Дг-СН- N-CH2-CH-CH-Ar Ct-Ц
N
О
N
где X - азот или группа СН;
R - водород или метильная группа;
Аг - 2,4-дигалоидфенильный остаток или нафтильный остаток;
Аг - незамещенный, или галогеном, метилом, мётокси или нитро-однозамещенный фенильный остаток, или галогеном двузаме- щенный фенильный остаток, или однозаме- щенный галогеном тиснильный остаток, а также их фармакологически переносимые или переносимые растениями кислотно-аддитивные соли, обладающие фунгицидной и противогрибковой активностью.
Таблица1
Продолжение табл. 1
Таблица2
| Европейский патент № А-0 061 798, кл | |||
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
| Приспособление для изготовления в грунте бетонных свай с употреблением обсадных труб | 1915 |
|
SU1981A1 |
Авторы
Даты
1993-08-15—Публикация
1991-09-26—Подача