1
Изобретение относится, к способу получения новых производных .бензодиазепина, обладаюЩих ценными фармакологическими свойствами.
Основанным на известной в органической химии реакции ацилировалия предлаг.аемым способом 1получают новые соединения, обладающие большей активностью, чем известные соединения.
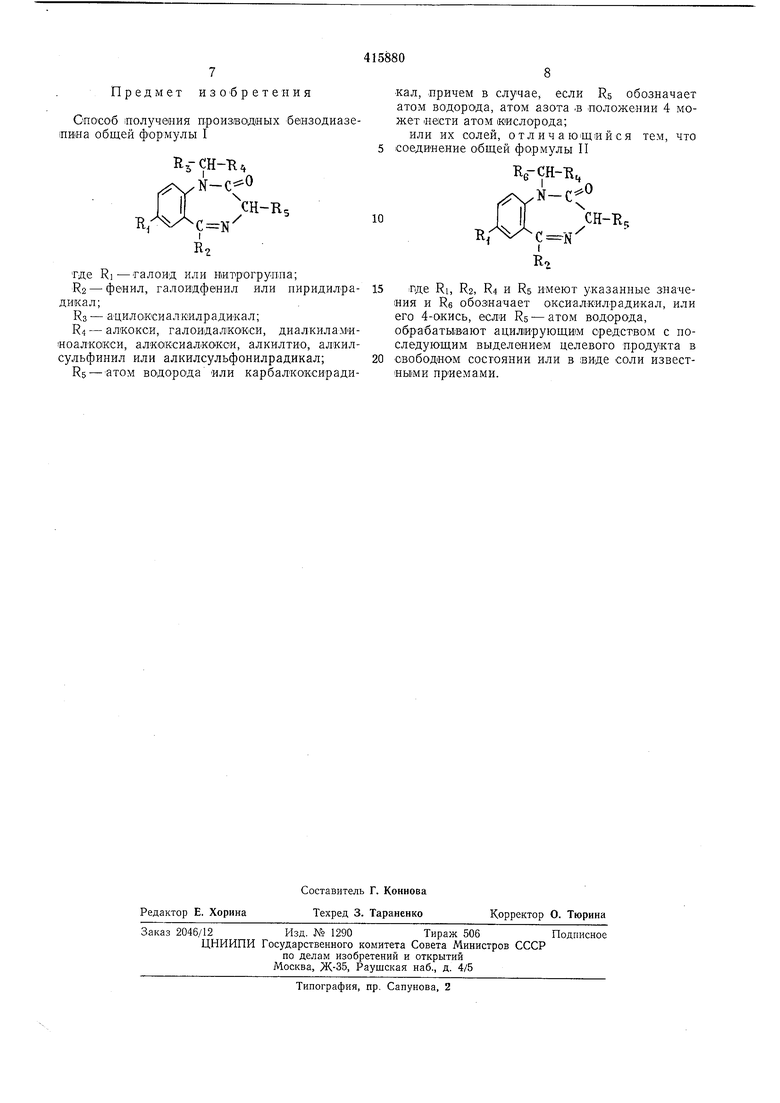
Предлагается способ получения производных бензодиазепина общей формулы I
CH-RS
лде Ri - галоид или нитрогруппа; R2 - фенил, галоидфенил или лирлздилрадикал;
Rs - ацилоксиалкилрадикал;
Ri - алкокси, 1галоидал1какси, диалкнламиноалкокси, алкоксиалкокси, алкилтио, алкилсульфинил или алкилсульфонилрадикал;
RS - атом водорода или карбалкоксирадикал, причем, если Rs обозначает атом водорода, атом азога в положении 4 может иметь атом кислорода;
1ИЛИ их солей, заключающийся в том, что соединение общей формулы II
Ил-СН-К,
0
N-C
сн-к.
/
где RI, R2, R4 и Rs имеют указанные значения и Ra обозначает оксиалкилрадИКал, или его 4-ожись, если Rs-атом водорода, обрабатывают ацилИрующ« М средством. Целевой продукт выделяют в свободном состоянИИ или в виде соли известными приемами. Соединения формулы II получить, если соединения общей формулы III
CH-R
где Ri, R2 и RS имеют указанные зи-ачения, или его 4-оки Сь, если Ro обозначает атом водорода, подвергают реакции обмена с соединеиием общей формулы IV
R,
X-CH-Rg
где R - галоидалкил; Rg - алкокси, галоидалкокои, алкилтио- или алко кси алкоксирадикал;
X - галойд, причем переводят галоидалкильный заместитель в оксиалкильный, галоидалкоксизаместитель переводят, если желательно, в диалкиламиноалкокси и/или алкилтио-, окисляют, при необходимости в алкилсульфинильный или алкилсульфонильный заместитель. Этерификацию соединения формулы II проводят любым ацилирующйм средством, например ангидридом кислоты (уксусной кислоты и другой), галоидаигидридом кислоты, например ацетилхлоридом, беизоилхлоридом и т. н. Реакционные условия не являются крит1ическими и зависят от выбранного средства этерификации. Процесс целесообразно вести в органическом растворителе - углеводородах, например бензоле, толуоле, хлорированных углеводородах, например -метиленхлоридг, диметилформамиде, Н1ириди1не и т. in.
Реакцию обмена соединения формулы III или его 4--ОКИСИ, если Rs означает атом водорода, целесообразно про водить в инертном органическом растворителе (нли их смесях), например углеводородах - бензоле, толуоле, диметилфор.мамиде, нростых эфирах, наатример диоксане, тетрагидрофуране, спиртах, например грег-бутаноле и т. п. Температуры реакции лежат между -50 и 120°С. В качестве X вместо галоида ,можпо применять любую эквивалентную отщепляемую группу, например мезилОкситоэилокоипруппу. Целесообразно переводить соединение формулы III перед реакцией обмена с соединением формулы IV сначала в Ьнроизводное щелочного металла. Это (Последнее люжно получить, например, подвергая реакции обмена соединение формулы III с НИЗШИМ алкоголято М щелочного металла, «аггример метилатом натрия, гидридом щелочного металла, например гидридом натрия, амидом шелочного металла, например амидом натрия и подобными средства1ми. Реакция обмена соединения фор.мулы III с соединением формулы IV может происходить также в присутствии основания - гидроокисей щелочных металлов, например гидроокиси натрия или триэтилаМИна.
Галоидалкоксигруппу переводят в диалкиламиеоалкоксигруипу, применяя диалкиламин. Эту реакцию обмена обычно .проводят в одном или нескольких инертных органических растворителях - нростых эфирах, например диоксане, диметилформамиде, углеводородах - бензоле, толуоле, кетонах -
ацетоне, лгетилэтилкетоне и т. п. Применяемые температуры и давления не являются критическими.
Перевод галоидалкильной группы в оксиалкилБную может осуществляться, например,
гидролизом или алкоголизом нри помощи каталитических количеств основания соответствующего ацетата. Процесс целесообразно вести в органическом растворителе - спиртах, кетонах, нанример ацетоне, эфирах, например диоксане, диметилформамиде, дИМетилсульфоксиде, при тем1пературе между комнатной и температурой кипения реакционной смеси. Окисление алкилтиогруппы в алкилсульфиНИЛ- или алкилсульфонилгрулпу может происходить при помощи окислителя - надкислот, например надуксуоной, надбензойной кислоты, перекиси водорода. Процесс в этом случае также целесообразно вести в инертпом органическом растворителе - галогенированных углеводородах, например тетрахлорметане, уксусной кислоте и т. п. Надлежащие температуры находятся, например, между - 50 и 80°С.
Соединения общей формулы I, имеющие основной характер, образуют кислотно-аддитивные соли с неорганическими или органическими кислотами, например хлористоводородной,
фосфорной, брОМИСТОВОДОрОДНОЙ, ЛИМОННОЙ,
серной, уксусной, муравьиной, янтарной, малеиновой, л-толуолсульфо1новой кислотой.
Понятие «алкил одно или в комбинации, как «алкокси о.Хватывает прямоцапные и разветвленные углеводородные остатки с
одним шесгью, предпочтительно с одним - четырьмя углеродными атомами, например метил, этил, изопропил и т. л. Понятие «ацил охватывает ацилтруппы, как алканоилостатки, например ацетил, пропионил,
трет - бутирил, циклоалканкарбонилостатки, как циклопропанкарбонил, ароил или аралкаиоилостатки, как бензоил, фенацетил, фенилнропионИл, которые в соответствующем случае могут также имегь метоксизаместители. Понятие «галоидалкокси охватывает МОНО-, а также ди- и тригалоидалкоксигруппы, как хлорацетил, дихлорацетил и т. п. Понятие «галоид охватывает все четыре атома галогена, т. е. фтор, хлор, бром и йод.
Пример 1. К раствору 10,3 г 7-хлор-1,3дигидро-1- (2-окси-1- метокси) -этил - 5 - фенил-2Н-1,4-бензодиазенин-2-она в 125 мл пиридина прибавляют но каплям нри температуре 30-35°С 9,6 г пивалоилхлорида. После
прибавления реакционную смесь продолжают
перемешивать в течение 1 при комнатной темяературе ,и затем вышаривают при уменьшеиноМ давлении. Остаток поглощают в метиленхлориде, .раствор промывают водой, сушат над сульфатом натрия и концентрируют до небольшого объема. Оставшееся масло кристаллизуют лри растир ании с гексадом с получением продукта-сырца с т. лл. 95- 100°С. Перекристаллизация из смеси лростого эфира :и гексана дает 7-хлор-1,3-дигидро-1(1-метокси-2-ПИвалоилоксиэтил) -5- фенил-2Н1,4-бензодиазбпин-2-он, т. пл. 101 - 103°С.
Исходные продукты получают следующИМ образом.
К охлажйбнпому до -20°С раствору 21,7 г У-хлОр-1,3-.дилийро-5 - фенил- 2Н-1,4-бензодиазепии-2-о«а в 100 мл диметилформамида Прибавляют 8 г метсжсида натрия и перемеши1вают в течение 5 мин. После охлаждения до -60°С постепенно лриба-вляют 19,5 г 1,2дихлор-1-мето1ксиэтана. В течение 30 мин температуру повышают до -10°С. После обычной обработки продукт-сырец получают путем кристаллизации из метанола. После перекристаллизации из с.меси метиленхлорида и .метанола получают чистый 7-хлор-1-{2хлор-1-метоксиэтил) - 1,3 - дигидро - 5-фенил2П-1,4-бензодиазепин-2-он, т. пл. 152-155°С.
Суспензию 16 г безводного ацетата калия в 300 мл толуол:а и 500 мл диметилформамида на.лрбвают при перемешивании. После дистилляции 400 мл растворителя прибавляют 36 г 7-хлор-1-(2-хл(р - 1-мегокси)-этил -1,3дигидро-5-фенил-2Н-1,4 - бензодиазепип-2-она. Реакционную смесь нагревают в течение 5 мин в атмосфере азота до тем-пературы кипения. После охлаждения до 5°С прибавляют 800 мл воды и отделяют выделившуюся смолу, растворяют в метиленхлориде, раствор промывают водой, сушат над сульфатом патрия и выпаривают. Из раствора остатка в эфире выкристаллизовывают сначала 4 г 7-хлор - 1,3 - дигидро - 1- {2-окси-1-метокси)этил -5-фенил-2П-1,4-бензодиазепин - 2- она. Маточный раствор кипятят с небольшим количеством активированного угля, фильтруют, Прибавляют гексан и после затравливания выкристаллизовывают. Затравочные кристаллы 1- (2-ацетокси - 1-метокси) - этил -7-хлор1,3-дигидро-5-фвпил-2Н-1,4-бензодиазепин - 2она с т. пл. 110-111°С ,(из спирта) получают путем хроматографии на силикагеле при помощи 20%-ного этилацетата в метиленхлориде.
Выкристаллизовавшийся из затравленного раствора продукт (14 г) плавится после перекристаллизации из спирта при 110-111°С.
3 г 1-(2-ацетокси-l-Метокси)-этил -7-хлор1,3-дигидро-5-фен Ил-2Н - 1,4 - бензодиазепин 2-она растворяют в 30 мл метанола в горячем состоянии и к нему прибавляют 0,1 г метокоида натрия. Выкристаллизовываюшийся за почь из о.хлажденного раствора продукт отсасывают, про.мывают метанолом и сушат. После перекристаллизации из спирта -получают 7-хлор-1,3 - дигидро-1-(2-гидрокси-1-метокси)-этил - 5 - фенил - 2П - 1,4 - бензодиазеПИН-2-ОН, т. пл. 157-159°С.
Пример 2. Согласно описанному в примере 1 способу получают из 10,3 г 7-хлор-1,3дигидро-1(2 - окси - 1 - метокси)-этил -5-фенил-2Н-1,4-бензодпазепин-2-она и 18,4 г 3,4,5триметоксибензоилхлорида 19,9 г продуктасырца. Последний .хроматографпруют на
600 г силпкагеля с 20%-ным этилацетатом в метилен.хлориде. Однородные фракции соединяют, сушат до небольшого объема и перекристаллизовывают из смеси метиленхлорида и гексана. Получают 7-хлор-1,3-дигидро-1- 1метокси - 2-(3,4.5 - триметоксибензоилокси)этил -5-фенил-1П-1,3-ббнзодиазепип - 2 - он, 146-148°С.
Пример 3. Аналогично примеру 1 путем
реакции 10,3 г 7-хлор-1,3-дигидро-1- (2-окси1-метокси)-этил - 5 - фенил-2Н-1,4-бензодиазепин-2-она с 7.8 г хлорида циклопропанкарбоновой кислоты после хроматографии продукта-сырца на 450 г силикагеля с 20%-иым
этилацетатом в метиленхлориде получают 7-хлор - 1 - (2 - циклoпpoиaнкapбoнилoкcи-lмeтoкcиэтил)-l,3-дигпдpo - 5 - фенил-2И-1,4бензодиазепин-2-он, плавящийся после перекристаллизации из этанола при ИЗ-115°С.
Пример 4. Суспензию 8,0 г N,N-Kap6oнилдиимидазола в 40 мл тетрагидрофурана перемешивают после прибавления 7,8 г л-метоксифенилуксусной кислоты в течение 2 час в атмосфере азота и при комнатной температуре; получают прозрачный раствор имидазолид-п-метоксифенилуксусной кислоты. Приготовленный из 0,16 г натрия и 1,6 г имидазола в 20 мл тетрагидрофурапа нагреванием с обратным холодильником без доступа влажности раствор патрийимидазола после охлаждения до комнатной температуры прибавляют к суспензии 8,1 г 7-хлор-1,3-дигидро-1- (2-окси1-метокси)-этил -5 - фенил - 2Н-1,4-бензодиазепин-2-она в 50 мл метиленхлорида. Затем
прибавляют при комнатной температуре полученный раствор имидазолида и продолжают перемешивать в течение ночи. Осадок отфильтровывают и фильтрат выпаривают в вакууме. Маслянистый остаток растворяют в
метиленхлориде, раствор промывают раствором бикарбоната и водой, сушат над сульфаТОМ патрия и упаривают до небольшого объема. Оставшееся .масло очищают путем хроматографии па 200 г силикагеля с 20%-пым
этилацетатом в метилен.хлориде. Однородные фракции после перекристаллизации из смеси простого эфира и гексана дают 7-хлор-1,3-дигидро- 1 - метокси-2-(/г - метоксифенилацетокси)-этил -5-фенил-2П-1,4-бензодиазепин -2-он,
т. пл. 95-97°С.
Аналогичным путем, описанным в указанных примерах, получают 1- (2-ацетокси-1метокси)-этил -7хлор - 1,3 - дигидро-5-фенил2П-1,4-бензодиазепин-2-оп, т. пл. 110-111°
(из алкоголя).
Предмет изобретения
Способ яолучания производных бензодиазе1пи«а общей формулы I
кал, причем в случае, если Rs обозначает атом водорода, атом азота .в положении 4 может «всти атом кислорода;
или их солей, отличающийся тем, что соединение общей формулы II
VCH-;R,
СН-Кс
где RI -галоид или нитрогрупла;
Кг - феиил, галоидфенил или пиридилрадикал;
Кз - ацило-исиалкилрадикал;
R4 - алкокси, галоидалкокси, диалкилами«оалкокси, алкоксиаЛКокои, алкилтио, алкилсульфинил или алкилсульфонилрадикал;
RS -атом водорода «ли карбалкоксирадигде Ri, Rg, R4 и RS имеют указанные значения и Re обозначает оксиалкилрадикал, или его 4-окись, если Rs - атом водорода, обрабатывают ацилирующим средством с иоследующим выделением целевото продукта в свободном состоянии или в 1виде соли известными приемами.


| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения производных бензодиазепина | 1970 |
|
SU497774A3 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ БЕНЗОДИАЗЕПИНА | 1970 |
|
SU430552A1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ БЕНЗОДИАЗЕПИНА | 1970 |
|
SU428603A3 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ 1,4-БЕНЗОДНАЗЕПИНОНА-2 ИЛИ ИХ СОЛЕЙ | 1970 |
|
SU417948A3 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ БЕНЗОДИАЗЕПИНА | 1970 |
|
SU453841A3 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ БЕНЗОДИАЗЕПИНА | 1970 |
|
SU421195A3 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ БЕНЗОДИАЗЕПИНА | 1971 |
|
SU436495A3 |
| Способ получения производных бензодиазепина | 1973 |
|
SU550980A3 |
| Способ получения производных бензодиазепина | 1971 |
|
SU558643A3 |
| Способ получения производных 1,4-бензодиазепина | 1974 |
|
SU563916A3 |

Даты
1974-02-15—Публикация
1970-02-10—Подача