Изобретение отиоситса к способу получения новых нронзводных азепина, которые обладают лекарстБенны1 1и свойствами и могут найти 1фименение в фармацевтической промышленности. Известен способ получения конденсированных амииотиазольных или аминооксазоль : Hbix соединений циклизацией соответствую- шёго кетосоединения с мочевиной или тио- мочеьиной. Основанный на известной реакции пред- лагаемый способ получения производных азенина обшей формулы /-NH-Rj В.-К v. где R - водород, незамешенный mivi замещенный на гидроксил С -С .-алкил с или разветвленной цепью, аллил, алкил, цик/юалкил, гексагидробензил, фенил фенилэтил или бензил, причем бензил може быть замещен в ядрена один или два атома галог ;на, одну- три метоксигруапы, трифторметил или С,-С -алкил, и, если Z - сера, R - водород, неразветвленный или разветвленный С -С -алкил, аллил, циклоалкил, фенил, бензил или фенилэтил, или, если 2. - кислород, Ro водород, или их кислотно-аддитивных солей заключается в том, что мочевину обшей формул1 1 . I : -, H O- H-R2 где Rg. 2. имеют вышеуказанное зиа.чение, обрабатывают гапоидводородной солью 5-галоидазепинона-4 общей формулы RrN H-X /, как указано выш«; X - хлор. бром или йод, в расплаве или в растворителе или подвергают взаимодействию с азепиноном-4 общей формулы гО где RI имеет указанное выше значение, в присутствии хлора, брома или йода в расплаве или растворителе, если 2 - сера, с последуюШмм выделением целевых соединений известньими приемами в свободном виде или в виде солей с неорганическими или органическими кислотами. Обычно реакцию проводит в присутствии каталитич€ско1о количества кислоты., например ледяной уксусной кислоты, предпоч тительно в штервале температур между О°С и темп« ратурой кипения применяемого растворителя.... . . В качестве растьорителя можно исполь зовать диметиЛ11)ормамид, ледйную уксусную кислоту, воду, этанол, изопропанол, трет-бутанол, диоксан или Их смеси. В некоторых случаях использутют акцеп торы 1Сислоты, например неорганические ос нований, такие как карбонат натрия или ка бонат калия третичные органические осно вания, такие, как триэтиламин или пиридин Органические основания могут быть взяты Б Избытке в качестве растворителя Из гюлучейных соеди11ений рбьшными 1етодами можно син-.-езировать KHCJJOTHP- .-аддитивные соли с неорганическими и орг ническими кислотами, такими, как срляная бромисто.БОдбродная, серная, фосфорная, винная, янтарная, лимоннйя, аднйиноваа, эмбся1овая фумаровая или малёиноВая. Исходные азепиноны-4, замёШёНные в полокейми 1, получают при конденсации Дикмшша этиловых эфиров: N -замещенно N-2 {-этйксикарбонилэ-гил )-4--ам .хНомасляной. Кислоты: в lipHcy-iCTBiiM в качестве к.онде1юирующего средства Грет- утилата калия НИИ Гидрида натрия с последующим амылйннеы: и дёкйрбоксилированием. вромежуточиого продукта, состояиюго Из 1цен«ого 1ексаг Вдро-4Н-аэепинона-4 Или этнловоГо эфира 5-карбоновой кислоты, в присутствии кислот ИК-спектры. этиго со единения содержат полосу поглощений;, ха:)актерную карбонильной грушгы, при 1вЭ5-17ОО ., а МК-споктры их соleil- ярИ 1720 См (бромид калия). .Исходный 5-1алоидаз1бпиноны-4 получает при гапоидировании соОтвеа ствующих 1зенинбнов-4 в ледяной уксусн й кислоте эквимолярным количеством хлора, брома или йода. Пример 1. Дигидрохлорид 2-амино-6-бензил-4, S ,7,8-тетрагидро-6Н-тиазоло- б, 4-4 Т-азепииа. 11 г (36,6 ммояь) гидрохлорида 1-бензил-5-бромгексаРидро-4Н-ааешшона-4, т. йл. 158 С, полученного при бромировании гидрохлорида 1- нзилгексагидро-1Н зепинона-4, т. пл. 189°С, эквимоПярнь1М количеством брома в ледяной уксусной кислоте, в SO мл Воды в течение 12 час размешивают с 2,63 г (34,6 ммоль) тиоЫочевины при комнатной тем: пературе, подщелачивают едким натром до рН 12, смешивают с 20 мл метанола и экстрагируют хлороформом. Высушенный над сульф Уом натрия экстракт упаривают в вакууме, горячий о СтатОк раство зяют в этаноле, подкисляют йзодропанольным растворсем соляной кислоты, охлаждают и вы.делают 6,2 г- (51%) целевого продукта, т. пл. 233°G (разл,),; . Вычислено,; %:j С 50,70; Н N12,65, C...V-2HCl (332,30).; Найдено, %: С 50,30; М 5.84; N 12,8О. П р и м е р 2. ДйгидрохлОрид-2-амино-6-бензИл-4,5,7,8-тетрагидро-6Н-тиазоло- 5,4- 4 -азепина. 77,5 г (208 ммоль) пщробромида 1-бёнзИл-5-бромгексагидро-4Н-азен1шона- , -4 в 600 мл этанола Ки1штят 2 час с ; 15i 8 г (203 ммоль) т:иомочевины, охлаж- дакзт, отсасьшают кристаллы гидробромида, растворяют его в воде, подщелачивают раствор едким натром до рН 12 и экстрагируют основание хлороформом. Полученное из экстракта основание при нагревании растворяют в 100 мл этанола, с:Мещивают с 50 .мл насыщонного изОпропанольного раствора соляной кислоты и 100 мл уксусНого , охлаждйю - и выделяют 4О г (69%) целевого дшидрохлорида, т. пл. 233°е (разл).I Пример 3. Дщ-идрохлорид 2-амино-в-бензил-4,5,7,8-тб1рагидро-6Н-тИазоло-- S,4-dl- эеяина. 11 г (. ммопь) гмд1Х)бромида 1-бензил-5 ром.гбксагидро-4Н-азбпинона-4 и 2,63 г (34j6 ммоль) тйомочевипы тиютельно смеи1ивают и проводят реакцию в расплаве 8О-100°С в течешге 10 Мя.н. Остывший ;плаВ растворяют Б Воде, подщелачивают едким натром и вкх траги- . руют хлороформом. Высушенный экстракт упаривают досуха, горячий остаток растворяют в этаноле, смешивают с иоопропанольным раствором соляно.й кислоты, до- 1
бавляют зтллацетат и выделяют г
(25,5%) яелевого продукта, т. пл. 233°С (разл.). .
Пример 4. Дигидрохлорид 2-ами- но-6-бензил-4,5,7,&-тетрагидро-бН-тиаэоло- 5,4-43 -азёйина.
Раствор 6,1 г (ЗО. ммоаь) 1-бензилгексагидро-4Н-аэешшояа 4, т. кип. 981OO°G/O,1 мм, в ЮО мл ледяной уксусной кислоты и 15 мл 4О%-ного раствора бромистрводородной кислоты в ледяной уксусной кислоте смешивают с 4,8 г (3d ммоль) брсина, растворенного в бОмд ледяной уксусной кислоты japH комнат ной температуре Ледяную уксусную кислоту и бромистый водород отгоняют в вакууме, оставшийся маслянистый гидроброМИД 1-бензил-5г рок гвксагидро-4Н-азепинона-4 в 20О мл этанола и 2,28 г (30 ммоль) тиомочевины кипятят 2 час, охлаждак т, выделяют гидробром-л, которы переводят в дигидрозшорид, как в примере 2. Выход 6 г (60%), Т; пл. 232°С.
Пример 5. Дигидрохлорид 2-амино-6-бензкл-4,5,7,8-тетрагидро-6Н -тиазоло- 5,4- (jj -азепина.
К смеси 1О,2 г (5О ммоль ) 1-бензилгексагидро-4Н-азепинона-4 и 7,6 г
,(1ОО ммоль) тиомочевины добавляют 12,7 г йода, ногревшуюся до смесь нагревают 2 час в водяной бане, охлаждают, растворявЬт плав в воде, фильтруют, подщелачивают едким натром до рН 12 и экстрагируют хл9рофо.мом. Полученное из высушенного экстракта сырое основание в горячем состояния растворяют в этаноле, добавляют изопропанольный раствор соляj ной кислоты и уксусный эфир и получают
1,6 г (10%) целевого продукта, т. пл. 232 С (разл).
Пример 6. Аналогично примеру 4, исходя из г|цдрохлоридов 1- f -гексагидро-4Н-азешшона-4, получают дигндрохлориды 2-амино-6- Я j - 4,5,7,8-тетраг1адро-6Н-тиазоло- 5,4-d3 эепина, перечисленные в табл. 1. гт гл
Таблица 1





| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения производных 2-амино-4,5,7,8-тетрагидро-6н-тиазоло(5,4- )азепина | 1971 |
|
SU461507A3 |
| Способ получения производных 2-амино-4,5,7,8-тетрагидро-6нтиазоло(5,4- )азепина | 1971 |
|
SU461508A3 |
| Способ получения производных 2-амино-4,5,7,8-тетрагидро-6н-тиазоло(5,4- )азепина | 1971 |
|
SU474151A3 |
| Способ получения производных оксазоло(4,5- ) азепина | 1973 |
|
SU474990A3 |
| Способ получения производных 2-амино-4,5,7,8тетрагидро-6н-тиазоло (5,4- ) азепина | 1973 |
|
SU503526A3 |
| Способ получения производных хинолина,их солей или их изомеров | 1974 |
|
SU535034A3 |
| Способ получения производных тиазолоазепина или их аддитивных солей с неорганическими или органическими кислотами | 1989 |
|
SU1731061A3 |
| СПОСОБ ПОЛУЧЕНИЯ ГЕКСАГИДРО-7Я-АЗЕПИНОВЫХ ПРОИЗВОДНЫХ ИЛИ ИХ СОЛЕЙ | 1969 |
|
SU425396A3 |
| ПРОИЗВОДНЫЕ ГУАНИДИНА И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ АНТАГОНИСТОВ РЕЦЕПТОРА НЕЙРОПЕПТИДА FF | 2004 |
|
RU2337911C2 |
| ТИОФЕНИЛЬНЫЕ И ПИРРОЛИЛЬНЫЕ АЗЕПИНЫ В КАЧЕСТВЕ ЛИГАНДОВ СЕРОТОНИНОВОГО 5-HT РЕЦЕПТОРА И ИХ ПРИМЕНЕНИЕ | 2007 |
|
RU2434872C2 |

.yf-- - ИК-спектр (KBt ) исходного VKap6oHim).
Вещество плавится без разложения. :.....- . . .. .....-..-.-- - соединения содержит полосу поглощения при 172О см
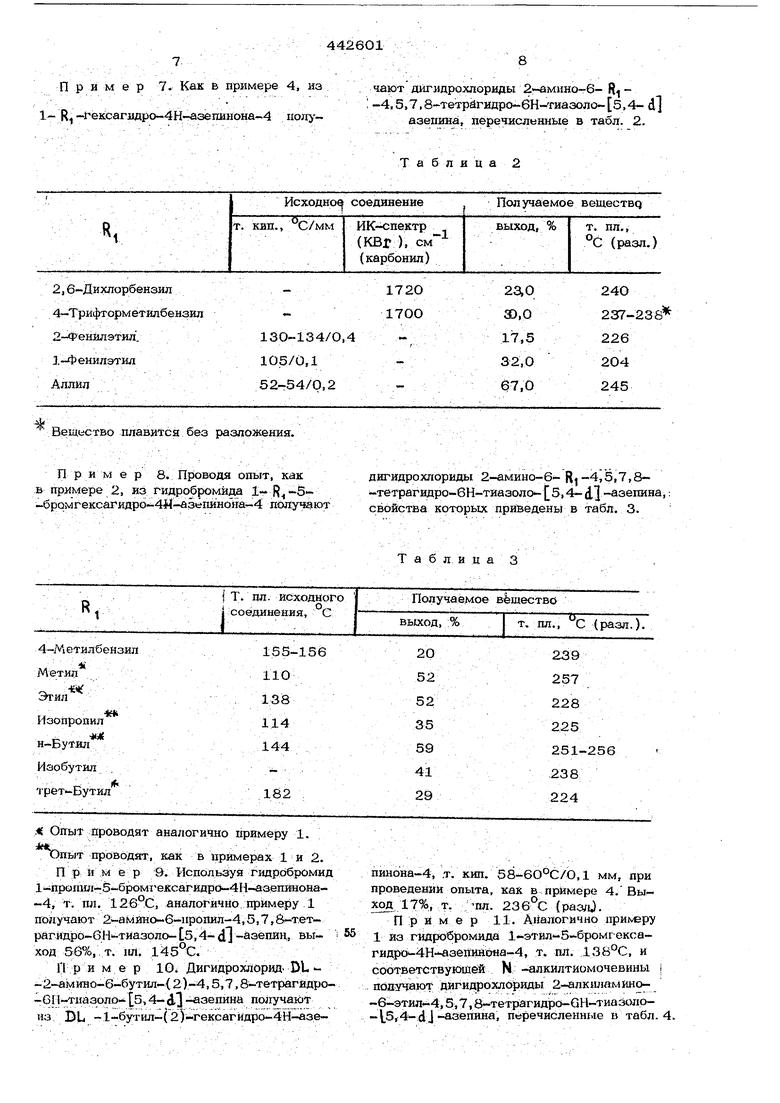
П р и м е р 7. Как в примере 4, из 1 g -1-е1ссагидро-4Н-азе11Инона-.4 полу
Вещество плавится без разложения.
Пример 8. Проводя опыт, как в примере 2, из гидробрюмйда l-R -S-брамгексагидро- 4 4-азё1шнона-4 пблучдют
л
155-156
110
13S
114
144
182
. Опыт проводят аналогично примеру i.
Опыт проводят, как в примерах 1 и 2.
П р им ер 9. Используя гидробромид 1- пропил-5-бром1е КсагВдрсх-4 И-аз.епйнона-4, т. пл. 126°G, аналогично примеру 1 получают 2-амйно-в-пропил-4,5,7, б тетрагйд рЬ-6Н-тиазоло- 5,4- d 1 -азепин, выход 5б%,.т. im, .
При мер 10. Дигидрохлорид- DU. -2-а1у1Ино-6-бутил- 2)-4,5,7,8-тетрагйдро-GI 1-тиазоло- о, 4-ДЗ - зепина получают из DL -1-бутил-(2)-гексагидро-4Н-азечают дйгидрохпориды 2 -амнно-6- R -4,5,7.8-тетрагидро-6Н-Гиаэоло- б,4- d азепина, пбречисльнные в табл. 2,
Т а б л и Ц а 2
дигидрохлориды 2-амиио-6- ,5,7,8 тетрагвдро-6Н-тйазоло 5,4-- -азепина,; свойства которых приведены в табл. 3.
Т а б л и ц а 3
239
257
228
225
251-256
.238
224
пинона-4, т. кип. 58-6О°С/0,1 мм, при проведении опыта, как в примере 4. Выход 17%, т. пл, (раз/и).
Пример 11. Аналогично прилеру 1 Из гадробромида 1.этил-5-бромгексагидро 4Н-азб«инона-4, т. пл. 138°С, и соответствуюшёй N -алкилтиомочевины | поиучают дигидрохлориды 2-алкшшмино-6-этил-4,5,7,8-тетрагидро-аН-тиазоло- 5,4-dJ-азепина, перечисленные в табл. 4.
9
Пример 12. Исходя на 1-аллилгёкт15-б-алпил-4,5,7,8-тетрагидро-6Н-тиаэолосагидро-4Н-азепинона-4; т. кип. 52-54С/ ..Гд 4-Л-лзепины, свойства которых ука/0,2 мм, и N -алкилтиомочевины, анало-
гичио примеру 4 получают 2-алкиламиног заны в табл. 5.
Алкил или арил
Этил н-Амил
Аллкп Циклогексил Пример 13. Как в примере 4, дигидрохпорид-2-фениламино-6-аллкп 4,5,7,8-тетрагидро-бН-тиазоло- 5,4- (Ц-азепина получают из 1-маллилгексагидро-4Н-азепи- ; нона-4, т. кип. 52 -54°С/0,2 мм, и N -фенилтиомочевины. Выход 52%, т. пл. 195,
Пример 15. Дигидрохлорид 2-амино-6-этил-4,5,7,8-:тетрагидро-6Н-оксаэоло- fi.-l-d -азепииа.
10 Таблица 4
Таблицаб
Получаемое вещество
выход, %
т. пл., С
60 2О
20 20 35 : 40
Таблица 6
17 г (56,6 ммоль) гидробромида 1-этил-5-бромгексагидро-4П-аз ПИ1нина-4хорошо размешивают с 10,5 г (175 м...оль) Пример 14. Исходя из 1-беизилгексагидро-4Н-азепинона-4, т. кип. 981ОО С/О,1 мм, и N .-алкилтиомочевиыы аналогично примеру 4 получают 2-алкиламин6-6-бензил-4,5,7,8-тетраг1здро-6Н-ти азоло-| 5,4-(1 -азепины, перечисленные в табл. 6,
11
мочешшы и смешивают с-1 мл хледяной
уксусной кислоты, расплавляют при 70ЭО-С, нагревают 5-8 час при этой температуре, охлаждают, растворяют плав в воде, подшелачивают едким натром до рН 12 и
экстрагируют хлороформом. Полученное из высушенных экстрактов сьфое основание перекристаллизовьшают из уксусного эфира и получают 4,2 г (41%) продукта, т. пл. 132-153 С. Очищенное основание раст воряТ. пл. основания 122 С (эфир). Приведены, выход и т, пл. основания, П р и м е р 17. Дигидрохлорнд 2-амн ао в-бензил-4,5,7,8-тетрагидро-6Н-оксазоло- 5,4-d,3-азепина. 2,4 г (10 ммоль) гидрохлорида 1-бен.зилгексагидро-4Н-азеш1Нона-4 и 1,8 г (30 ) мочев1шы хорошо размешиваю и смешивают с 0,5 мл ледяной уксусной кислоты., добавляют порциями 1,6 г брома наблюдая разогрев смеси до. v 100 С, Нагревают при этой температуре 6-8 час, охлаждаю-г, растворяют плав в воде, подщелачивают едким натром до рН 12 и экстрагируют . хлороформом. Полученное из высушенных экстрактов сырое основание растворяют в этаноле, подкисляют изо иропапольным раствором сол5шой кислоты и образовавишйся дигидрохлирид осажда мг (9,5%), т. ют эфиром. Выход 300 Ш1. 2О9°С. 11 р им е р 18. Дигидрохлорид 2-амино-5-этил-4,5,7,8-тетрагидро-6Н-оксазоло- 5,4-4 зепина. 9 г (ЗО ммоль) гидробромида 1-Э1 ил-5-бром1ексагиДро-411-азепинона-4,
12
ют Б этс.ноле, подкисляют изопропанольным раствором соляной кислоты, и добавлжот простой эфир, вьоделяя целевой продукт, т. пл. 217 219°С (разл).
Приме р 16. Проводят опыт, как в примере 15, из гидробромида 1- R -5-бромгексагндро-4Н-аае11инона-4 и мочевины получают дигидрохлориды 2-амино-6- RI -4,5,7,8-тетрагидрооксазолр- 5, -азепина, указанные в табл. 7.
Т а б л и ц а 7 плавящегося без разложения т. пл. 142°С, и 9 г (150 ммоль) Мочевины в 30. мл. изопропанола в течение 2 час нагревают до кипения, наблюдая переход суспензии в раствор. После отгонки растворителя растворяют остаток в воде, подщелачивают едким натром до рН 12 и экстрагируют хлороформом. Высушенные экстракты упаривают, перекристаллИзовывают остаток из ацетона и получают 1,4 г (26%) осиования, т. пл. 152-153 С. Для перевода в дигидрюхлорид суспендиру.ют основание в 4 мл смеси метанол-аде-тон (1:3), насьидают соляной кислотой и охлаждают раствор. Выход 96%, т. пл. i 217-219°С (разл). Пример 19. Аналогично примеру 18 получают дигидрохлориды 2-аминс.)-6 PI-4,5,7,8-тетрагидрооксазоло- 5,4- 1-азепина при использовании гидрибромида 1- R, 5-бром-гексагйдро-4Н-азепинона-4 и мочевины, и проведении реакции в различных растворителях. Свойства полученных соединений приведены в табл. 8.
13
14
Т а 6л и ц а 8
Авторы
Даты
1974-09-05—Публикация
1971-08-05—Подача