где R - алкил с 1-5 атомами углерода, аллил или пропаргил; Ш равно О или 1; где У - фтор, хлор, бром, алкил или апкоксш с 1-4 атомами углерида или трифторметил; У -V означает водород, фтор, хлор, бром, i ал кил или алкоксил с 1-4 атомами угле- рода, осно анный на известной реакции. Способ заключается в том, что соединение общей формулы 3 . . / RI R2. Rg и Jn имеют приведенные значения, подвергают взаимодействию с фосгено Реакцию проводят при предпочтительно np«t 10-30°С. Реакцию можн осуществлять в инертном органическом растворителе, например в бензоле, толуо ле или ксилоле, причем предпочтителен беНзол. Мольное соотношение фосгена и соединения общей формульг 3 не играет особенной роли, но лучше применять иабы ток фосгена и проводить процесс в прИсу .ствии связывающего кислоту-средства, на I дример карбоната натрия или калия, или третичного амина, например триалкиламнна или пиридина, гфичем желателен триэтиJfaмин. . Выходы целевых продуктов общей формулы 1 составляют 62-85%, их выделяю и очищают Ик-звёстными методами. Пример 1. 2-Изопррпиламино-4-метилбензофенонимин (исходное вещество 4-М«тил-2-.нитробеизонитрия. Смесь 100 г 4-хлор-3-нитротолуола, бО г цианида меди и 150 мл диметилацетамида нагревают в течение 4 час ЗО ми с обратным холоДильниюм. Полученную при этом коричневую массу вьшивают в 10ОО мл ледяной воды, фильтруют ее для отделения осевшего темно-коричневого комплекса меди и разлагают после этого, обрабатывая 60О мл метиленхлорида при ыеремешивании и комнатной температуре. Нерастворимый неорганический продукт отфипьтровьтают, после чего сушат фильтрат Над безводным сульфатом натрия, обра батьшают 5 г активированного угля и 5Qr ОКИСИ алюминия и опять отфильтровываю для удаления нерастворимого вещества. Фильтрат испаряют в вакууме досуха, из полученйого при этом сырого кристаллического остатка выделшот после перёкрис таллизации из дизтилового эфира 4-метил-2-нитробензонитрил.т. пл. 96-97 С. 4-МетШ1аитранилонитрил. К раствору Cbiporo 4- 1мгётйл-2-нитробензонитрйла в 115О мл горячего этанола приливают 29О мл концентрированной соляной кислоты. Полученную смесь нагреваjpr до кипения и прибавляют к ней в течерие 1 час четырьмя порциями 75 г железных ошадок. Полученную смесь нагревают еще 1 4iac 30 мин с обратным холодильником, охлаждают н фильтруют, после чего концентрируют концентрат в вакууме jtio объема приблизительно 250 мл. Концентрат разбавляют примерно 1000 мл воды и получают твердый кристаллический продукт, который после отфильтровывания и промывки на фильтре петролейным эфиром {т.кип. 60-80 С) даст 4-метрлантра-. нилонитрил, т.пл. 88-90 С. 2-ИзЬгфопиламш10-4-метШ1бензонитрил. Смесь 36 г 4-метилантранилонитрш1а, 36 г карбоната калия, 0,5 г порощка ме-ди в 120 мл 2-йодпропана нагревают в течение 8 дней при: перемешивании с обратным холоштьником. Избыток 2-йодпропана испаряют Б вакууме и полученный твёрдый остаток экстрагируют трижды, употребляя по 1ОО мл метиленхлорида, Об единеш1ые экстракты фильтруют через; j 250 г окиси Дпюминия и сгущают в вакууме. Причем получают 2-изопропиламино-4-меТ31лбензрнитрил в виде низкоплавяще- гос.я кристаллического остатка. 2-Изопропиламино-4-ме тилбензофенонимин. Раствор 5,22 г 2-изопропш1амино-4- метилбензонитрила в 4О мл дизтияового эфира прибавляют при перемещивании в те.чение приблизительно 10 при комнатной температуре к раствору 90 ммоль феншшития, растворенного в смеси диэтнлового эфира и бензола (1:1). После этого массу перемещивают в течение еще 15 мин и выливают образовавшийся светло-желтый раствор в 20О мл ледяной воды. Органическую фазу отделяют, сушат над безводным сульфатом натрия, испаряют в вакууме досуха и получают сырой 2-Изояропиламино- -4-метилбензофёнонймин в виде желтого масла. Это соединение обрабатывают маленно- вой Кислотой Известным образом и Получают 2-изопгропШ1амяно-4-метш1бензофенонимин-малеат, т. пл. 119-122°С., П р и м е р 2. 2-Изопропш1амино-4-метклбёнэофенонимин (исходное вещество). 4-Метил- 2-изопропиламииобензофено41. Смесь 7 Р 4-метил-2- минобензофвнона, 6,35 г карбоната натрия и 18,8 мл
j2-йодпроаана иагреванл при леремешивани с обратным холодильником в течение 3 дней. Охлажденную реакционную массу разбавляют 2ОО мл бензола к промывают по два раза водой и солянокислым раствором. Органическую фазу отделяют, сушат над безводным сульфатмМ натрия и сгущают в вакууме для удаления бензола. Полученное при этом желтое масло растворяют в приблзительно 1О мл мет1шенхлорида ij хрома- , т графируют на колонне, применяя примерно 4ОО г окиси алюминия и метиленхлорид причем первая фракция после сгущения в вакууме дает 4-метш1-2-изопропиламино|бензофенон.
2-Изопропиламино-4-метилбензофенони-
МиН..
Смесь 2,0 г 4-метил-2 изопропш1ам}1- нобензофенона, 15 мл безводного аммиака (с небольшим содержанием влаги воздуха) ; и 20 мг хлорида цинка нагревают в закры-том реакционном сосуде из нержавеющей стали в течение 3 дней до 110-120 С. После испарения избыточного аммиака из реакционной смеси перекристаллизовывают остаток из этанола и получают 2-изопропиламино-4-метилбензофенонимин в виде желтого масла.
Пример 3. 1-Изопропил-7-метил--4-фенил-2( 1Н)-хиназолинон.
Реакция обмена с фосгеном. К раствору 5 г 2-изопропиламино-4-метилбензофенонимина, полученного по примеру 1 или 2, в
50 мл бензола прибавляют при бОмл 12%-ного раствора фосгена в бензоле.
Полученный растьор оставляк стоять еще в течение приблизительно 10 мин при комнатной температуре и экстрагирую г после этого 5О мл 2 н, гидроокиси натрия. После отделения органической фазы, сушки над безводным сульфатом натрия, испарения в вакууме и перекристаллизации из диэтилового эфира получают 1-изопропил-7-метил-4-фенш1-2( 1Н )-хиназолинон, т. пл, 135-137°С, выход &О%.
Пример 4. Аналогично способу, приведенному в примере 3 при примене- , НИИ соответствующих исходных веществ в необходимых Количественных соотношениях получают следующие соеш1иения;
1-метш1-4-фенил-2 (1Н)-хиназолинон, т. пл. 141-143°С, выход 8О%;
1-метил-4-( Д-хлорфенил)-2( 1Н)-хииазопинон, т. пл. 122-123 С, выход 7 6%;
1-этил-4-фенил-2(1Н)-хиназолинон,
т. пл. 18i-1850C, выход 82%;
6-хлор-1-метил-4-фенил-2( 1Н)-хиназолинон, т. пл. 223-224°С, выход 68%;
1-метил-4-т-{/7-метоксифеиагг)-2 (1Н )-хиназолинод, т. пл. 184°С, выход 69%; I 6-хлор-4-1о-хлорфени;1)1-изопропш1-2(1Н;-хиназолинон, т. пл. 147-149°С, выход 68%;
1-изопропил-4-фенил-2( 1Н )-хиназолинор, т. пл. 140°С, выход 72%;
6-хлор-1-изопропил-4-фенил-2( 1 HJ -Хиназолинон, т. пл. 149-150 С, выход 70%;
6-нитро-1-изопропш1-4-фенил-2 (1Н )-хиназолинон, т. пл. 19О-192 С, выход
6-ме ил-4-4 енш1-1-изопропил-2( 1Н )-хиназолинон, т. Ш1.17О-171 с, выход 69%;
. 7-метокси-4-феннл-1-изопропил-2(1Н1-хиназолинон, т. пл. 137-138°С, выход 69%;
7-хлор-1-этил-4-фенил-2 (1Н )-хиназолинон, т. пл. 187-188°С, выход 85%;
1-изопропил-6,7-диметил-4-фенил-2(1Н)-хиназолинон, т, пл. 135-137°С;
1-аллил-4-фенил-2 (1Н )-хиназолинон, ;т. пл. 159-16О°С.
Предмет изобретения
Способ получения 211Н)-хнназолинонов общей формулы
R.
где R. - алкил с 1-5 атомами углерода, алкил или пропаргил; ГГ1 равно О или 1;
„ - фтор, хлор или бром или, если -изопропил, R - фтор, хлор, бром, алкш
алкоксил или алкилтиогруппа с 1-4 ai-омами у1лерода, нитро- или трифторметильная группа и tn равно 1 или 2, причем, если m равно 1, то R 3
не может быть гаравно 2, заместитет
логеном, а если
ли 1 могут быть одинаковыми и различными и обозначают 4Ор, хлир, бром, алкил или алкоксил с 1-4 атомами углерода;
п. 2 - фенил или замещенный фенил общей формулы
Yгде У - фгор, хлор, бром, алкил шш гижоксил с 1-4 атомами углерода Ш1И трифторметил;
. - , 7 . , ..:
у. - водород, фтор, хлор, бром, алкил или алкоксил с 1-4 атомами углерода,
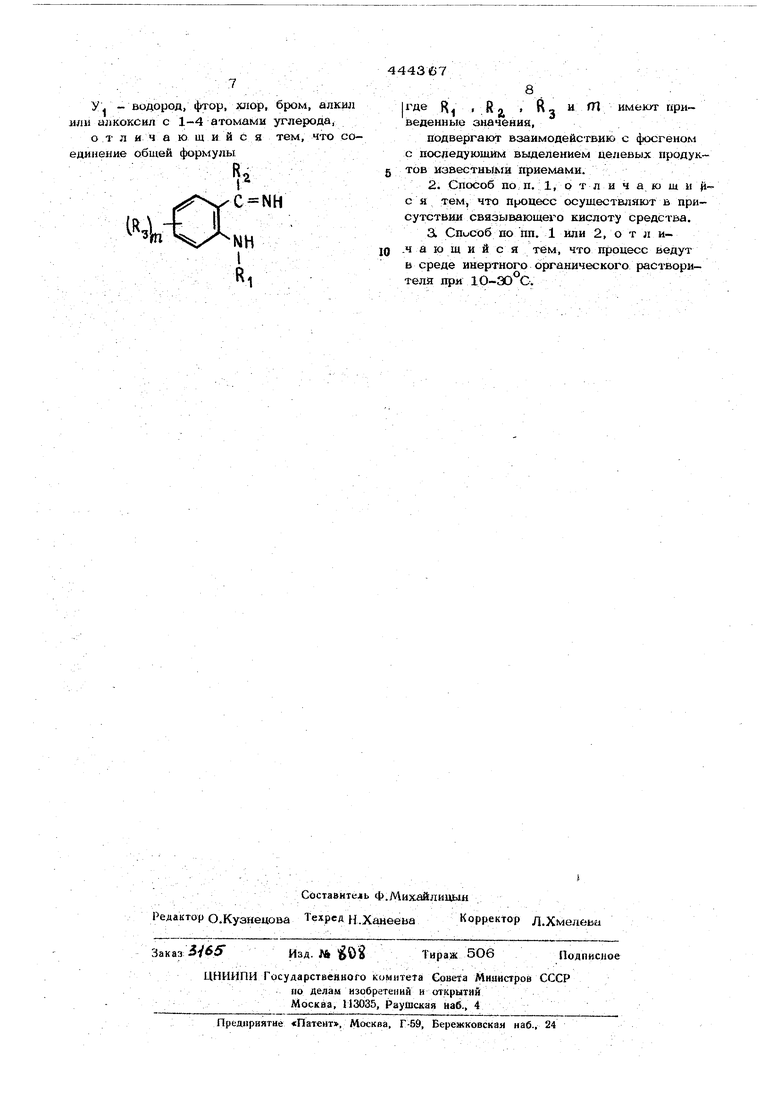
о т л и ч а ю щи и с
а тем, что соединение общей формулы.
R8
|где R . R, ; R,
и Ш имеют гфиведенные значения,
подвергают взаимодействию с фосгеном с последующим выделением целевых продуктов известными приемами.
2. Способ по п. 1, о тли ч а ю ш и |iс я тем, что Процесс осушествляют в присутствии связывающего кислоту Средства.
3k Списоб по пп. 1 или 2, о т л и.чающийся тем, что процесс ведут в среде инертного органического растворителя при 1О-ЭО°С.


| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения 1-алкил-4-фенилили-4-(2"-тиенил)-2(1н)-хиназолинонов | 1972 |
|
SU528032A3 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ 2 | 1972 |
|
SU345684A1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ ХИНАЗОЛИН-2-ОНА | 1973 |
|
SU396022A1 |
| вСЕСОЮЗНАЯ/ | 1973 |
|
SU376942A1 |
| СПОСОБ ПОЛУЧЕНИЯ 2 | 1972 |
|
SU360774A1 |
| СПОСОБ ПОЛУЧЕНИЯ 2 | 1973 |
|
SU365889A1 |
| Способ получения 4-фенил- или 4(2-тиенил)-6,7-метилендиокси-2(ин)хиназолинонов или -2(ин) хиназолинтионов | 1972 |
|
SU454740A3 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ 2(Ш)-ХИНАЗОЛИНОНА | 1972 |
|
SU359818A1 |
| Способ получения производных 6,7метилендиокси-2(1н)-хиназолинона | 1973 |
|
SU496732A3 |
| В П Т Б -SfJ'.; .i^ Л" V-^.-.--{Ynin | 1973 |
|
SU400096A1 |


Авторы
Даты
1974-09-25—Публикация
1969-06-30—Подача