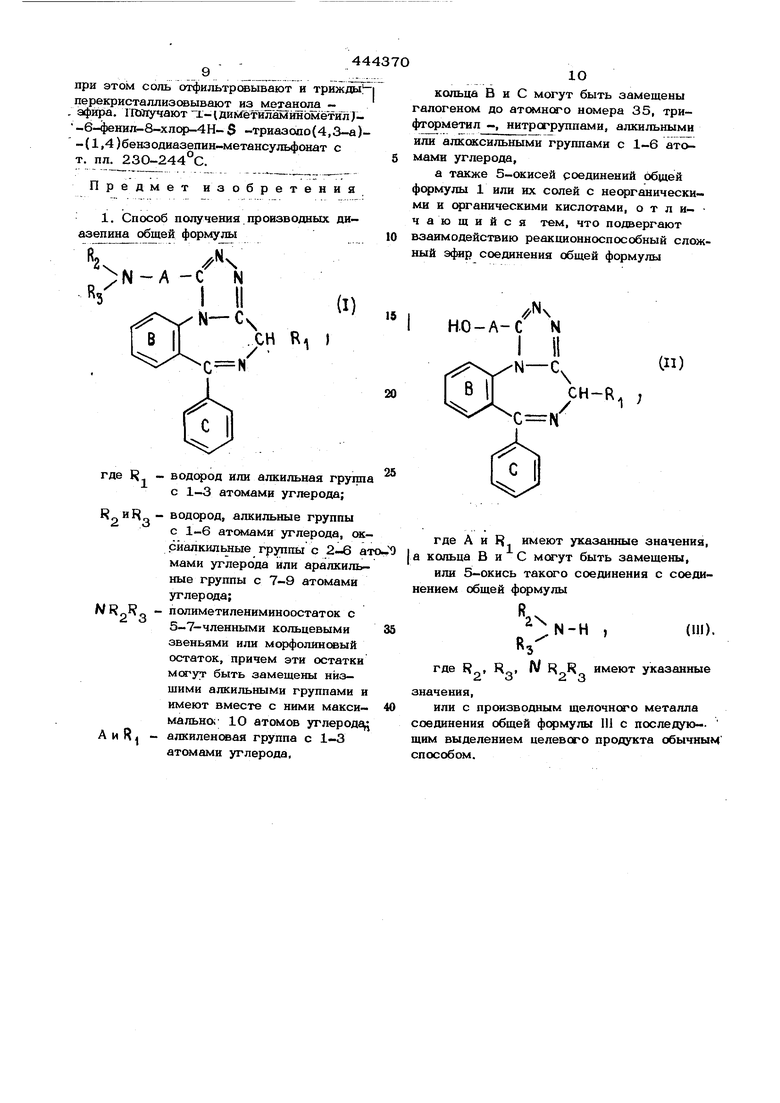
I Изобретение относится к способу полуЗ UOITUGT U T-v 4. «.- - --, чения новых производных диазепина, обладающих ценными фармакологическими свойствами. 1 Основанный на известной реакции нукле- офильного замещения у насыщенного ато|ма углерода предлагаемый способ позвоfлявт получать соединения, обладающие лучшими свойствами, чем известные ранее. 5Описывается получение соединений обшей формулы
алкильные группы с 2-6 ато-j мами углерода или аралкиль-/ ные группы с 7-Э атомами уг пер ода;
/ R2«3полиметилениминоостаток с ч ленными кольцевыми звеньями или морфолиновый остаток, причем эти остатки могут быть замещены низшими алкильными группами и . имеют вместе с ними максимально 10 атомовуглерода:, .
1-3
А - алкиленовая группа с атомами углерода,
кольца В и С могут быть замешены галогеном до атомнсго номера 35, трифтор- метилгруппалли ,нитрсгруппами, алкильными или алкоксигруппами с 1-6 атомами углерода, . J
их 5-окисей или солей с с ганическимич и неорганическими кислотами,
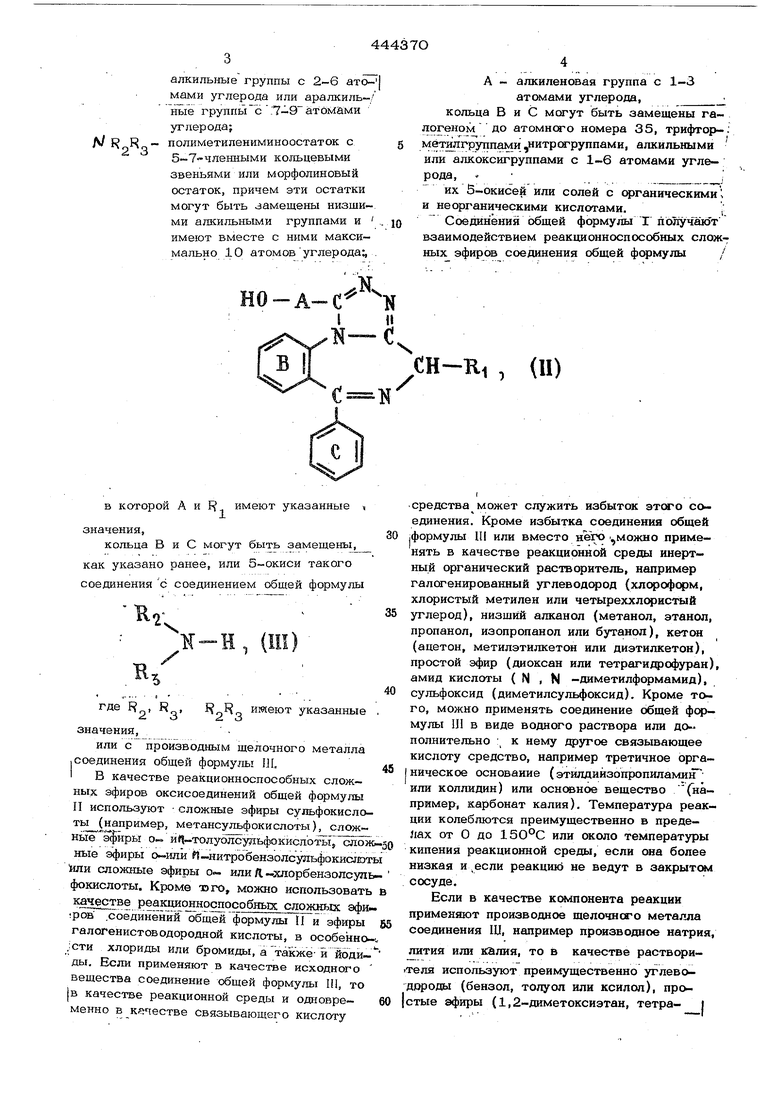
Соединения общей формулы Г получакУт взаимодействием реакционноспособных сложных эфиров соединения общей формулы /
-RI , (U) в которой А и F имеют указанные , значения, кольца В и С могут быть замещены, как указано ранее, или 5-окиси такого соединения с соединением общей формулы К-Н имеют указанные 2 3значения, или с производным щелочного металла .соединения общей формулы Л, I В качестве реакционноспособных сложных эфиров оксисоединений общей формулы И используют сложные эфиры сульфокислоть1(например, метансульфокислоты), слож ные эфирЫ о .толуолсул:ьфокислЬть1,сло ные эфиры -нитробензолсульфокислот или сложные эфиры о или /I хлорбензолсуп фокислоты. Кроме , можно использовать K SSS-T реакционноспособных сложных эфи Фов- .соединений общейформулы П и эфиры галогенистоводородной кислоты, в особенно .:сти хлориды или бромиды, а также-и йодиды. Если применяют в качестве исходного вещества соединение общей формулы HI, то IB качестве реакционной среды и одновременно в к«1естве связывающего кислоту средства может служить избыток этсяо соединения. Кроме избытка соединения обшей .формулы UI или вместо нетю можно применять в качестве реакционной среды инертный органический растворитель, например галогенированный углеводсчэод (хлс оформ, хлористый метилен или четыреххлсчэистый углерод), низщйй алканол (метанол, этанол, пропанол, изопропанол или бутанол), кетон (ацетон, метилэтилкетон или диэтилкетон), простой эфир (диоксан или тетраги/Ц)офуран), амид кислоты ( N , N -диметилформамид), сульфоксид (диметилсульфоксид). Кроме того, можно применять соединение общей формулы III в виде водного раствора или дополнительно : к нему другое связывающее кислоту средство, например третичное органическое основание (этилдийзопропиламин или коллидин) или основное вещество (например, карбонат калия). Температура реакции колеблются преимущественно в пределах от О до 150°С или около температуры кипения реакционной среды, если она более низкая и .если реакцшб не ведут в закрытсм«1 сосуде. Если в качестве компонента реакции применяют производное щелочного металла соединения Щ, например производное натрия, лития или калия, то в качестве растворителя используют преимущественно углеводороды (бензол, толуол или ксилол), простые эфиры (1,2-диметоксиэтан, тетрагидрофуран или диоксан) или амиды кисло ты ( N . N -диметилформамнд или триамид N N N N. N -гексаметилфосфорной кислоты), или сульфоксиды (ка метилсульфоксид). Образование производны щелочного металла соединений общей форк мулы III, кроме аммиака, осуществляется преимущественно Ш Situ . Если соединение, общей формулы IJI содержит одну или две оксиалкильные группы, то надо применять по меньщей мере двойное или трой ное молярное количество соединений щелоч ного металла. Необходимые в качестве исходных веществ соединения общей формулы II полу- чают конденсацией соединений общей формулыCH-K-t , (IV) в которой X - меркаптогруппа, ннзщая алкокси- или алкилтиогруппа, причем эти группы в соответствующем случае активи зированы заместителем, R имеет указанное значение, кольца В и С могут быть замещены, с соединением общей формулы FJ О - А -СО -NH - ЫН, водород, арилметил- или диарилметилгруппа. I Соединения общей формулы II переводят путем взаимодействия схлорангидрид сульфрккслоты (например, с хлорангифи- дом метансупьфокислоты или с хлорангидридом П -толуолсульфокислоты) в инертном органическом растворителе (например в хлористом метилене) в присутствии орг нического основания (например, риэтила- мина или этилдиизопропиламина) или путё взаимодействия с тиошшхяоридом или трибромидом фосфора в галогениды. Пример 1. К раствору 3,25 г (0,010 моля) б-фенил-8-хлор-4Н-S -триазоло, 3-а)-(1,4)бензодиазепин-130 мл абсолютного хлороI -метанола в форма прибавл$пот 3,ОЗ г триэтиламина | и 3,44 г метансульфохлорида. Реакционную смесь лерамешивают в течение 90 мин при 20 и затем промывают дважды во- : дои и дважды насыщенным раствсром хлорида натрия, высущивают над сульфатом магния и выпаривают. В качестве остатка получают сырой сложный эфир метансульфокислоты 6-фенил-8-хлор-4Н- S -триазоло (4,3-а)-,ензодиазепиН.1-метанола. Сырой продукт растворяют в 15 мл диметилсульфокснда и гфи1 апывают, перемещи- вая, при 0-5 к раствору 3 мл (приблизительно 0,03О моля) чистого диэтиламина B 10 мл диметилсульфоксида. Затем раствор, окращивающийся в фиолетовый цвет перемещивают в течение 2 час при 2О . Затем растворяют в хлфистом метилене, прерывают водой и насыщенным раствором хлсрида натрия, высущивают над сульфатом магния и выпаривают. Путем кристаллизации остатка из этилацетата - петролейнсго эфира получают 1-(диэтиламиноетил)--6-фенил-8-хлор-4 Н- S -триазоло(4,3-а)-(1,4)бензодиазепин с т. пл. 126128°С. Аналогичным образом получают из 6-фенил-8-хлор-4Н- S -триазоло(4,3-а)-(1,4 )бензодиазепин-1-метанола, метансульфохлорида, вторичного или первичного I амина или аммиака следующие целевые продукты: 1-(диметиламинометил )-6-фенил-8-ХЛОР-4Н- S -триазоло(4,3-а)-(1,4)бензодиазепин с т. пл. 165-166 С; 1- (метиламинометил)-6-фенил-8-хлор- -4Н- S -триазоло(4,3-а)-(1,4)бензодиазепин с т. пл. 145-147 С (из этилацетатапростого эфира); 1-(аминометил)-6-фенил-8-хлсф-4Н- S -триазоло(4,3-а)-(1,4)бензодиазепин с т. пл. 164-166°С; 1-(этиламинометил)-6-фенил-8-хлор- -4H- S -триазоло(4,3-а)-(1,4)бензодиазепин с т. пл. 153-154°С; 1-( 1 пирролидинилметил)-6-фенил-8-ХЛОР-4Н- S -триазоло(4,3-а)-(1,4)бэнзодиазепин с т. пл. 178-179 1-(морфолинометил)-6-фенил-8-хлор-4Н- S .-триазоло(4,3-а)-(1,4)бензодиазепин с т. пл. 212-213 С; 1(2-оксиэтиламинометил)-6-фенил-8-ХЛОР-4Н- S -триазоло(4,3-а)-(1,4)беизодиазепин (6-фенил-8-хлс -4Н- S -триазоло(4, 3-а)-(1,4)бензодиазепин-1-ил(ме тиламиноэтанол) с т. пл. 165-167 i Аналогичным образом получают при .применении указанных замещенных 4H-S-триазоло(4,3-а)-{1,4)бензодиазепин-1-метанолов, метансульфохлорида и диметиламина целевые продукты, которые кристаллизуют из этилацетата - петролейного эфира: из б-фенил-4Н- S -триазоло(4,3-а)-{1,4)бензодиазепин-1-.ме анола 1-(диметиламинометил)-6-фенш1 4Н-5 -триазо (4,3-а)-(1,4)бензодиазепин с т. пл. 180 180,5°С; из б-(о-фторфенил)-8-хлор-4Н-S -триазоло(4,3-а)-(1,4)бензодиазепин-1|-метанола 1-(диметиламинометил)-6-(о-фторфенил)-8-хлор-4Н- S -триазоло(4,3-а)-{1,4)бензодиазепин с т. пл. 143144,50С; из 6-{о-хлорфенил)-8-хлор-4Н- S -триазоло(4,3-а)-(1,4)бензодиазепин-1-метанола 1-(диметиламинометил)-6-(о-хлорфенил -8-ХЛОР-4Н-3-триазоло{4,3-а)-(1,4)бензодиазепин с т. пл. 198-200 из 4-метил-6-фенил-8-хлор-4Н- S -триазоло(4,3-а)-(1,4)бензодиазепин-1-метанола 1-(диметиламинометил )-4-метил-6-фенил-8-хлор-4 Н- S -тpиaзoлo(4,3-a)-(l,4)бeнзoдиaзeпин с т. пл. 200202 С. Применяемые в качестве исходных ве.- ществ замещенные 6-фенил-4Н- S -триазо ло(4,3-а)-(1,4)бензодиазепин-1-метанолы получают следующим образом. А. Раствор 15,0 г 2-(метилтио)-5-фенил-7-хлор-ЗН-1,4-бензодиазепина и 11,5 г гидразида 2-(;| ме-гоксибензилокси -уксусной кислоты в 10О мл триамйда гексаметил-фосфорной кислоты нагревают в течение 10 час до 14О°С. Реакционную смесь обрабатывают аналогично примеру 1 и сырой перекристаллизовывают из этилацетата - петролейного эфира. Получают 1-( fi -мeтoкcибeнзилoкcи-мeтил)-6-фeнил-8-xлop-4H- 5 -триазоло(4,3-а)-(1,4)бензодиазепин с т. пл. 157-159°С Аналогично получают из 2-(метилтио)-5-( о-хлорфенил)-7-хлор-ЗН-1,4-бензодиазепина 1-( П, -метоксибензилокси-ме- тил)-6-(о-хлорфенил)-8-хлор-4Н- 5 -триазоло(4,3-а)-(1,4)бензодиазепин с т. пл. , 2О0-203 С (из этилацетата), из 2-(метилтио)-5-фенил-ЗН-1,4-бенз диазепин .-( П -метоксибензилокси-метвл -6-фенил-4 Н- S -трйазол6( 4,3-а) - (1,4) бе зодиазепин; из 2-(метилтио)-5-(о-фторфенил)-7 -хлор-ЗН-1,4-бензодиазепина 1-(}г-ме- токсибензилокси-метил)-б-(о-фторфенил)- . -8-хлор-4Н- S -триазоло(4,3-а)-(1,4)бензодиазепин с т. пл. 163,5-165 С (из этилацетата - петролейного эфира). Необходимые в качестве исходных ве- шеств для указанных целевых продуктов замещенные 2- (метилтио) -5-фенил-3 Н-1,4-бензодиазепины можно получить из соответствующих замещенных 1,3-дигидро- -5-41енил-2Н-1,4-бензодиазепин-.2-тионов. Применяемый во всех случаях в качестве второго компонента реакции гищ)азид 2-( п -метоксибензилокси)-уксусной кислоты получают путем взаимодействия 58 г сложного эфира 2-(м-метоксибензилокси)-уксусной кислоты с 22,7 г гидразингидрата в абсолютном эталоне при комнатной температуре с последующим выпарением растворителя. Б. К раствору 3,0 г 1-{/г,-метоксибензилокси-метил)-6-фенил-8-хлор-4Н-5 -триазоло(4,3-а)-(1,4)бензодиазепина в ЗО мл ледяной уксусной кислоты прибавля- ют при 25 24 мл 48%-ной водной бромистоводородной кислоты. Реакционную смесь в течение 20 мин перемешивают, затем доводят ЗО%-ным раствором едкого натра до нейтрального рН и кстрагируютхлорирть1м метиленом. Органическую фазу отде- пяют, промывают водой, высушивают над сульфатом натрия и выпаривают. После кри-, .сталлизации остатка из этилацетата - npo-J стого эфира - петролейного эфира получают/ 6-фенил-8-хлор-4 Н- S -триазоло(4,3-а)- I -(1,4Убензодиазепин-1-метанол с т. пл. | 209-211°С. ;. Аналогичным образом получают: из 1-( -метоксибенэилоксй-метил)-6- (фенил-4Н-1 - триазоло (4,3-а-( 1,4) диазепина 6-фенил-4Н- -триаз6ло 14,3-а- (1,4) бензодиазепин-1-ме«анол с т.ш1.2О5-, 2О6 С ,(из этилацетата-петролейного эфйра); из 1( П -метоксибензилокси-метил) 0 -фторфенил)-8 хлор-4Н-8-триазоло (4,3-а)-(1,4)бензодиазепина б-()торфв- I нил)-8-хлор-4Н-5-триазоло (4,3-а)-(1,4) I бензодиазепин-1-метанол с т.ш1.195-197 С; (из этилацетата - петролейного эфир). из 1-( fi-метоксибензилокси-метил)-6- -(о-хлорфенил)-8-хлор-4Н- S -триазоло(4,3-а)-(1,4)бензодиазепина б-(о-хлорфенил)-8-ХЛОР-4Н- S -триазоло(4,3-а)-(1,4)бензодиазепин.-1-метанол с т. пл. 235-237°G (из этилацетата - петролейшя о эфира); Пример 2. 10,0 г 1-(диметил,аминометил)-6-фенил-8-хлор-4Н- $ -триазоло(4,3-а)-(1,4)бензодиазепина pacTBOpsnoT в 10О мл метанола, прибавляют 2,73 г метансуяьфокислоты и смесь перемащивают в течение 15 мин при 2О°. „ . .Затем смесь концентрируют в половину объема и прибавляют эфир. Выделенную


| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения производных диазепина | 1973 |
|
SU488414A3 |
| Способ получения производных диазепина | 1971 |
|
SU523639A3 |
| Способ получения производных диазепина или их солей | 1974 |
|
SU578877A3 |
| Способ получения производных диазепина или их солей | 1975 |
|
SU578004A3 |
| Способ получения производных бензодиазепина или их 5-окисей или солей | 1975 |
|
SU568366A3 |
| Способ получения производных бензодиазепина | 1973 |
|
SU517257A3 |
| Способ получения производных диазепина | 1973 |
|
SU482045A3 |
| Способ получения производных диазепина | 1972 |
|
SU481156A3 |
| Способ получения производных триазолбензодиазепина | 1972 |
|
SU499808A3 |
| Способ получения производных диазепина | 1972 |
|
SU472505A3 |


Авторы
Даты
1974-09-25—Публикация
1972-01-19—Подача