рами таких органических сульфокислот, как, например, метан-, бензол-, п-толуолсульфокислоты, диалкилсульфатами IB среде инертного рЗСТВорителп в нрН|Сутст1вии ОСновного конденсирующего :редст1за.
П р и ,м е р 1. 4-(1-изо1Прапил-4- Нит ер1Идилиден) - 4Я-бензо 4,5 циклогепта 1,2-6 тиофен-10(9//)-он.
Смесь 25 г 4-{4-пи1леридили1ден) -4Я-бензол 4,5 циклогепта 1,2-6 тиофен-10 (9Я) - онового сснозаиия, 375 сл1 толуола, 28,8 г пзопропилиод1ида и 45 г карбоната натрия в течение 30 час ,иеремеш явают при темлературе масляной ванны (95° С). Затем смесь фильтруют и фильтрат сгущают IB вакууме. Остато-к от -выпаривания растворяют :в 50 слг хлороформа и адсорбируют над 500 г силикагеля. Элюируют хлороформом, содержащим 3% метанола. Первые 3 л элюата удаляют, остальные 4 л сгущают. В остатка получает маслянистое осно1ваиие. Для получения ;ГИ1дрогенфумарата 10 г этого осиО|ваиия ic 3,6 г фумаровой кислоты растворяют в 50 сл кипящего а|бсолютного этанола, фильтруют, сста1вляют выкристаллизовываться на ночь нри О-5° С. Затем отфильтровывают соль и перекристаллизовывают из кратного количества этанола (95%).
Получают ЧИСТЫЙ 4-(-изапрОИил-4-1ПИиеридилиден) - 4Я - бензо 4,5 циклогепта 1,2-& тиофен - 10(9Я)-он-гидрогенфумарат, тестература разложения С. Микроанализ подтверждают формулу C2iH23NOS C4H4Ot. Структуру определяют с помощью ЯМРсиелтро1в.
Необходимый в качестве исходного продукта 4- (4-пи:перидилидел1) -4Я-бензо 4,5 циклогеита 1,2-& тиофен - 10(9Я)-он .получают, иа.иример, следующим образом. Смесь 129 г 9,10-1ДИпидро-4Я - беизо 4,5 циклогепта 1, тиофен-4-она, 214 г Ы-бромсукцинимица, 1,2 г перекиси бензоила и 2000 слг абсолютного четыреххлористого углерода в течение 3 час, размешивая, нагревают с обратньгм холодильником. Затем отфильтровывают 1В горячем состоЯН1ИИ и сгущают фильтрат |до Vs пер ВО|начального объема. После выдержки в течение иссколькиХ часов при ко.мнатной темиературе отфильтровывают продукт кричсталлизации и сушат. Этот сырой продукт шерекристаллизовьивают из семикратного количсст1ва хлороформа. Таким образом получают чистый 9,10дибром-9,10-дигидро - 4Я-бензо 4,5 циклогепта 1,2-6 тиофен-4-он, который разлагаясь плавится три 134-135° С. Микроанализ иодтверждает формулу С1зН8Вг205. Структуру определяют при помощи ЯМР- аноктра.
Смесь 70 г 9,10-дибром-9,10-дипидро - 4Ябензо 4,5 циклоге,,2-6 тиофен - 4 - она, 31,6 г гидроокиси калия и 3200 слг метанола в течение 2 час при размешивании нагревают с обратным холодильникам. Затем с течение приблизительно 4 час неремещнвают при О- 5° С и отфильтровывают продукт кристаллизации. После перекристаллизации из 100-кратного количества метанола получают чистый 9(10)-бром- 4Я - бензо 4,5 циклогепта 1,2-& тиофеи-4-он, т. ил. 134-135° С. Микроанализ подтверждает формулу CisH/BrOS. Атом брома согласно ЯМР-спектру находится в положеиии 9 или 10 (вероятно в положении 10). 5 г активированного йодом магния смешивают 15 см абсолютного тетрагидрофурана и смесь нагревают до температуры кипения. Затем добавляют 2 г овежедистиллированного -|метил-4-хлорпи1перидина и .несколько капель 1,2-дибромэтан;а, вследспвие чего идет реакция Гриньяра. Затем без нагревания так быстро прикапывают 22,8 г овежедистиллироваиного 1-метил-4-хлорпиперидина, растворенного в 30 слгз абсолютного тетрагидрофурана, что смесь все время кипит. -По окончании .прикапывания еще в течение 2 час нагревают смесь с обратным холодильником, «вследствие чего
магнлй нрактичеоки превращается полностью.
Затем, охлаждая, при 20-25° С в течен е
1 час .прикапывают теплый раслвор 30 г 9(10)бром - 4Я-|бензо 4,5 циклогапта 1,2-6 тиофен4-она в 160 с.из абсолютного тетрагидрофурана. После 1,5 час перемешивания при 20- 25° С реакционную с.месь выливают на cNJCCb 250 г ледяиой воды и 35 г -хлорида аммония и (выделившееся основалие пор:циями экстрагируют общим количеством хлороформа
600 см. Соединенные хлороформные фазы промывают 50 слг воды, сушат над еульфатом натрия и сгущают в вакууме. В остатке получают сырое 9(10)-бpoм-4-(l-мeтил-4-пипepидил)-4Я - бензо 4,5 циклогепта 1,2-& тиофен4-оловое основание, которое непосредственно перерабатывают дальше.
Раствор 51 г сырого 9(10)-бром-4-(1-метил4-ниперидил) - 4Я - беизо 4,5 циклогепта 1,2-/ тиофен-4-ола и 420 слг 14%-ной этанольной
бромистоводородной кислоты в течение 1 час при 100°С (температура масляной ванны) нагревают с обратным холодильником. Затем сгущают в вакууме н остаток растворяют s 100 слгз воды. После подщелачивания коннентрированным натровым щелоком выделенное основание трижды экстрагируют 100 CAf- хлороформа. Соединенные хлороформные экстракты промывают 50 слг- воды, сушат над сульфатом } атрия и выпаривают в вакууме. Остаток растворяют в 70 см хлороформа, содержащего 5% метанола, и адсорбируют над 1000 г силикагеля. Элюируют хлороформом, содержащим 5% метанола. Первые (S л элюата , следующие 4 л сс; местно выпаривают.
Получают маслянистый остаток, который растворяют при к;1 ияченпг; с 50 слг изои1ропанола и за ночь кристаллизуют при О-5° С. После отфильтровывания продукта -кристаллизации и сущки получают чистое 9(10)-бром-4-(1-метил-4-пиперидилиден) - 4Я - бензо 4,5 циклогепта 1,2-6 тиофеновое основание, т. пл. 149- 150° С. Микроанализ подтверждает формулу CigHisBrXS. Атом брома согласно ЯМР-спектр находится в положсии1И 9 пли 10 (вероятно
в положении 10).
Смесь 24,2 г 9(10)-бром-4-(1-мегил-4-п1гпсридилиден)-4Я - бензо 4,5 циклогепта 1,2-6 тнофена, 160 сл;3 пиперидина, 330 с.и абсолютного диоксана и 14,6 г трет-бутилата калия при размешивании и температуре масляной ванны (130° С) в течение 2 час нагревают с обратным холодильничком. Затем маСсу охлаждают, |фильтруют и сгущают в вакууме. Остаток растворяют в 300 с.из бензола и этот расTiBop промывают трижды тю 50 с.ч воды. После сушкп бензольного раствора над сульфатом натрия его Сгупдают IB вакууме. В остатке inoлучают смесь 1из сырого маслянистого 4-(метил - 4-1:ТИ1перидилиден)-9-1ПИ|Перидино - 4Ябензо 4,5 циклогопта 1,2-6 тиофенозого основания и 4-(l-мeтил-4-пипepидилидeн)-10-пIIпepидинo-4Я - бензо 4,5 ци1клогапта 1,2 - & тиофенового основания, которую непосредственно перерабатьивают дальше.
24,6 г смеси сырого 4-(1-.метил-4-пипериднЛ1Иден)-9 - т1И1иеридино-4Я- бензо 4,5 циклогелта 1,2-6 тиофеногвого основания и 4-(1-метил4 - пи(пери1дилиден)-10-,пи1пер 1дино-4Я-бензо 4,5 циклоге1пта 1,2-6 тиофенового основания растворяют в 250 см 2н. соляной кислоты и в течение 1 час нагревают с обратным холодильником. Затем, охлаждая до 20-25° С. поди1,ела-чи:вают массу жонцентрярованным натровым шелоком и выделившееся основание экстрагируют лорциялп хлороформом (400 с.н общее количество). Соединенные хлороформные экстракты промывают трижды (по 30 c.w) водой, сушат над сульфатом натрия и сгущают. Остаток растворяют в 50 см хлороформа и адсорбируют над 1000 г силикагеля, элюируют хлороформом, содержащим 3% метанола. Первые 6 л элюата удаляют, следующие 4 л сгущают совместно. В остатке получают маслянистое вещество, состоящее главным образом из обоих изомеров 4-(1-метил-4-пиперидилиден - 4Я-бензо 4,5 циклогепта 1,2-6 тиофен9-(10Я)-она и 4-(-метил-4-пиперидилиден)4Я - бензо 4,5 циклогепта 1,2-6 тпофен - 10 (9Я)-она (см. пример 2). Для разделения смеси 19,7 г остатка растворяют в 200 слг изопропанола и смешивают с 7 г фумаровоп кислоты.
С целью изолирования 4-(1-метил-4-пиперидилиден)-4Я - бензо 4,5 циклогепта 1,2-6 тиофен-10( применяют изопропанольпый фильтрационный маточный раствор.
Изапропанольный фильтрационный маточный раствор сгущают IB ва кууме. К остатку добавляют 100 слг- воды и 6 г иоташа и .выделенное основание порция.ми экстрагируют 200 хлороформа. Хлороформные экстракты промывают 50 слг 1воды и сушат над сульфатом натрия. После сгущения хлороформного раствора иолучают маслянистый остаток, который Кристаллизуют из 20 с.из уксусного эфира. После охлаждения в течение ноч.ч при С- 5° С отфильтровьгвают .продукт и сушат его. Таким образом получаЕот чистое 4-(1-метил-4пи1неридилиден) - 4Я - бензо 4,5 циклогепта 1,2-6 тиофен-10(9Я)-оновое основание, плавящсеся прм 152-153° С. МикроанаЛИЗ подтверждает формулу C nigNOS. Структуру определяют посредством ПК-, и accспе.ктров.
К предварительно нагретой до 80°С смгси 31,6 г этилового эфира хлормуравьиной кислоты и 100 с.1/3 толуола при ,вaнии в течение 5 .V.HH прикапывают раствор 30 г 4-(1метил-4 - пи1перидилпден)-4Я-:бензо 4,5 циклогепта 1,2-6 тиофен-10(9Я)-она в 200 с. толуола, npii этом улетучивается газообразный хлористый метил. Затем в течение 4 .ос смесь нагревают с обратным холодильником ри температуре масляной ванны (140° С), вследствие чего заверщается выделение газа. Далее реакционную массу сгущают а .вакууме. Твердый остаток дважды выкристаллизовывают из 10-кратного количества абсолютного этанола. Получают чистый 4-(1-этоксикарбонил4-пиперидил;1ден)-4Я - бензо 4,5 шжлогепта01,2-6 тиофен-10(9Я)-он, который плавится при 174-175° С. Микроанализ .подтверждает формулу С2 П21ХСз5. Структуру определяют с по.мощью ПК- и УФ-апектрО;В.
Смесь 27,4 г 4-(1-этоксикарбонил-4-.ппперидил15ден)-4Я - бензо 4,5 циклогепта 1,2 - 6 тиофен- 0(9Я)-она, 280 см- 50%-ной серной кислоты и 280 с.С н-бутанола в течение 16 час нагревают с обратным холодильником. Затем
0 бутанол отгоняют в вакууме- Остающийся кис лый водный раствор разбавляют 500 слг воды и при охлаждении делают среду щелочной 500 гл/з концентрированного натрового щелока.
Выделившееся основание |;10рциями экстрагируют xлopoфop :oм (общее количество 600 . Соединенные хлороформные экстракты промывают -водой, сушат над сульфатом натрия и сгущают в .вакууме. В остатке получают твердое основание, которое -перекристаллизовывают из шестикратного количества абсолютного этанола. Таким образом получают чистое 4-(4-ПИ1перид1Илиден)-4Я-бензо 4,,клогепта 1,2-6 тиофен-10(9Я) - оновое основание, т. ал. С. Микроанализ подтверждает формулу CieHi-NOS. Структуру определяют с ,помо1цью ЯМР-апектра.
Пример 2. 4-(1-н-бутил-4-пипер)дилпдеи) - 4Я-бензо 4.5 ци-клогопта 1,2-6 тиофсн10(9Я)-он.
0
Слесь 12 г 4-(4-п11перидилиден)-4Я-бензо 4,5 диклогепта 1.2-6 тиофен - 10(9Я)-oHOisoго ос.нозания. 180 гл/ толуола, 11,1 г н-бутилбромида и 21.5 г карбоната натргя в течение 20 час размешивают при температуре масляной ванны (100°С). Затем охлаждают, фильтОруют и фильтрат сгущают в iBaKyyNie. Остаток растворяют в 30 с.ч хлороформа и адсорбирую;т над 500 г силлка.геля. Элюируют хлороформом, содержащим 1% метанола. Первые 4,5 л элюата удаляют, а остальные 3,2 л со0вместно сгущают. В остатке получают кристаллическое оеног-ание. 8,2 сэтого основания растворяют в 30 сл;3 кипянтсго изопропанола и оставляют кристаллизоваться в теченпе ночи при О-5°С. Таким образом получают чистое
4-(1-н-бутнл-4-т1илеридллнден) - 4Я - бензо 4,5 циклогепта 1,2-6 тиофен - 10(9Я)-оновое основание, плавящееся .при 104-105° С. Микроанализ июдпверждает формулу C22H25NOS. Структуру определяют с помощью ИК- и ЯМР-спектров.
Аналогично примерам 1 и 2 .получают
4-(1-метил-4-.пи1перидилиаен) - 4Я бензо 4,5 цикло1геПта 1,2-6 тиофен-10(9Я)-он (т. пл. 1.52-153° С); 4-(1-этил - 4-пиперидилиден)-4Ябензо 4,5 циклокепта 1,2-& тиофен - 10 (9Я)он (т. пл. 113-115° С);
6-хлор - 4-(1-метял-4-пи;пери,дилиден)-4Я-бе:Нзо 4,5 диклоге1пта 1,2-& т 1офен - 10(9Я) - он (т. пл. 168-169° С);
7-хлор-4-(1-метил-4-1Пиперидилиден) - 4Я-бензо 4,5 |циклогелта 1,2-6 тиофен - 10(9Я) - он (т. пл. 150-151° С);
6-бром-4-(1-метил-4-пи1перидилиден) - 4Я-бензо 4,5 -циклогепта 1,2-6 тиофен - 10(9Я) - он (т. 1:1Л. 172-173° С);
7-метокси-4-(1 - мет:Ил-4-1ПИ1перидилиден) - 4Ябензо 4,5 циклоге1пта 1,2 - 6 тиофен - 10(9Я)он (т. ,пл. 157-158° С).
Предмет изобретения
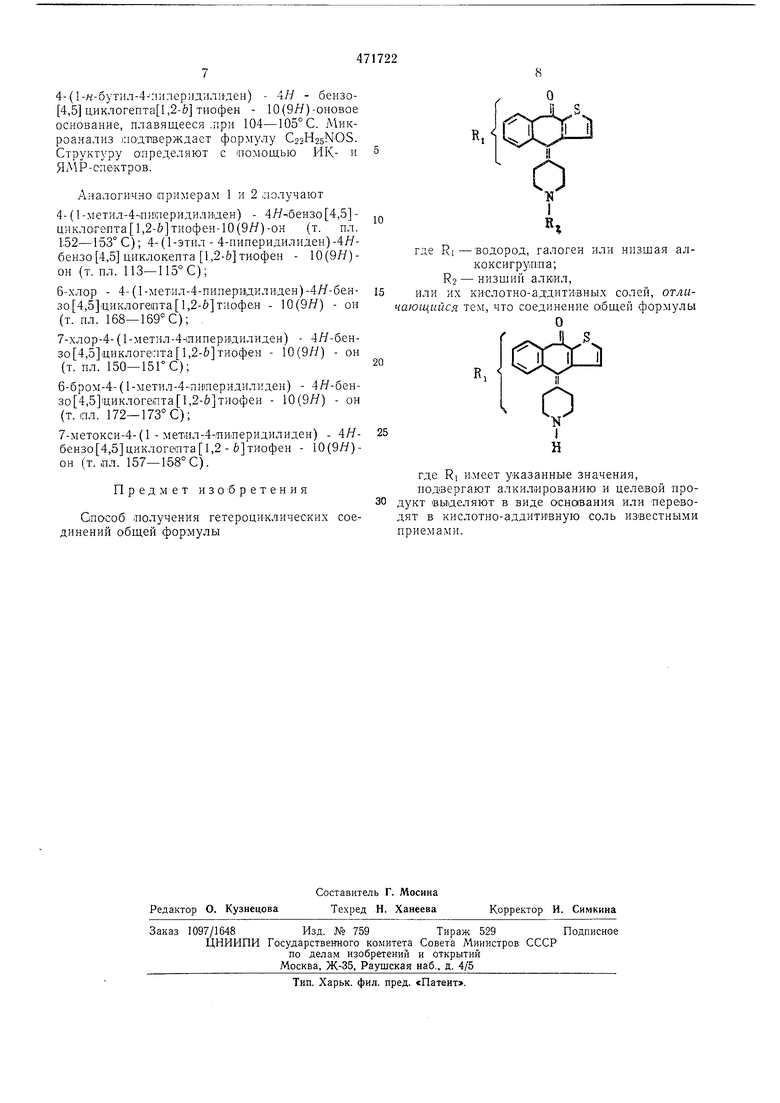
Способ (Получения гетероциклических соединений общей формулы
где RI -водород, галоген или низшая алкоксигрутпа;Кг - низщий алкил,
или их кислотно-аддитИВ.ных солей, отличающийся тем, что соединение общей формулы
где RI и.меет указанные значения, подвергают алкилированию и целевой продукт выделяют в виде основания или переводят в кислотно-аддитивную соль известными приемами.




Авторы
Даты
1975-05-25—Публикация
1971-03-05—Подача