подвергают циклизации при обработке основанием.
0829
3. Способ по п.2, 3 а к л ю чающийся в том, что в качестве оснований ирпользуют гидроокиси. 5 щелочных и щелочно-земельных металлов
. Способ по п.2, 3 а к л ю ц а ю щи и с я в том, что в качестве органического растворителя используют диметилформамид или низшие спирты.


1.. Производные дипиримидо ^(^,5- Ь)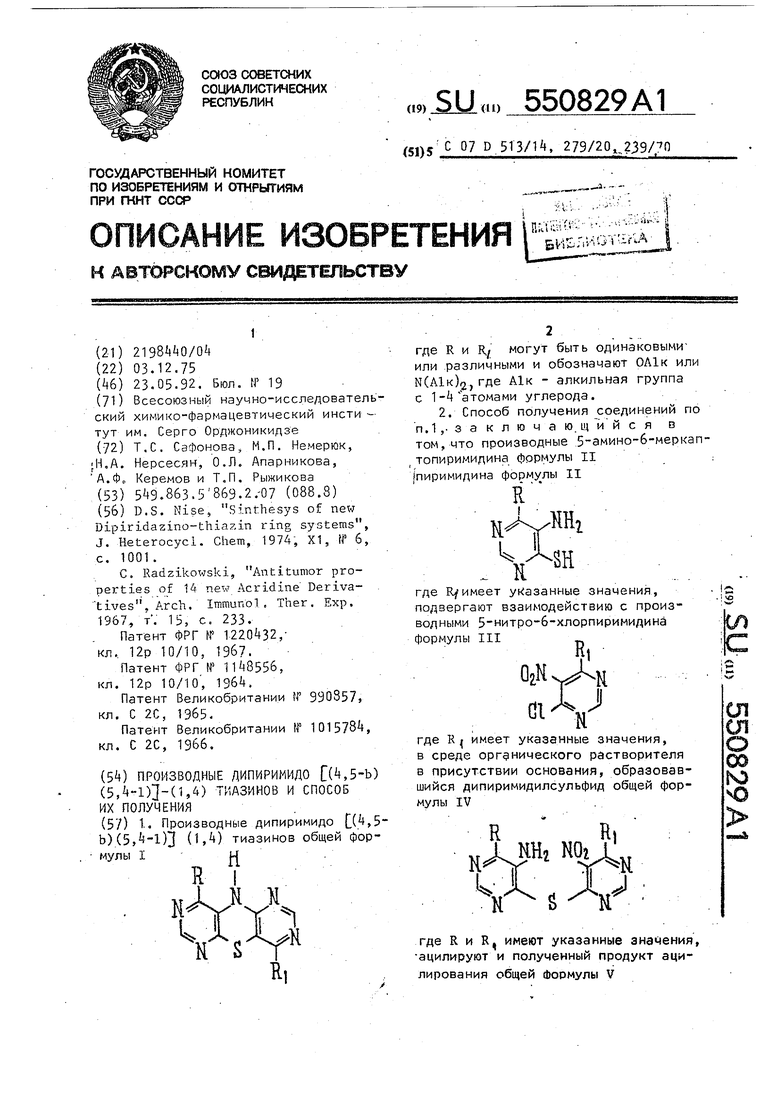

Изобретение относится к области синтеза неизвестной ранее гетероциклической системы - производных дипиримидо- (,5-Ь) (5,-lO (1) тиазинов, которые могут найти применение в синтезе биологически активных соединений.
Известно, что различные производные фентиазина находят практическое применение в качестве лекарственных препаратов. Известно также, что производные аналогов фентиазинов обладают ценными биологическими свойствами
Целью изобретения ябляется разработка способа получения новой гетероциклической системы - тетраазааналога известных биологически активных производных фентиазина, которые могут найти применение в синтезе биологически активных соединений.
Предлагается новая гетероциклическай система - производные дипири мидор1,5-Ь) (5,-1) (1,) тиазинов общей формулы I
где R и RJ могут быть одинаковыми или различными и обозначают ОА1к или М(А1к)2., где А1к - алкильная группа с 1-4 атомами углерода.
Способ получения дипиримидо Р,5b)( (1,А) тиазинов формулы 1 заключается в том, что производные 5-амино-6-меркап.топиримидина форму.лы II подвергают взаимодействию с производными 5 нитро-6-хлорпиримидина формулы III в среде органического растворителя в присутствии основания, образовавшийся дипиримидилсульфид формулы IV ацилируют и полученный продукт ацилирования формулы V подвергают циклизации при обработке основанием по следующей схеме
К/уШг . ,
01V.. Ч-Ч.Л.,.
Г
.N и
R
,
он н S Л. Значения R и R приведены выше ие
Структура производных дипиримидо |(,5-Ь) (5,t-l)(l )тиазинов подт- верждена данными ИК-спектров.;,В -примерах температура указана в градусах Цельсия.
Пример 1. ,9-Диметокси5Н-дипиримидо(,5-Ь) (5,-1) (Ь) тиазин..
а) -Метокси-5-амино-6-тио-( метокси-5-нитропиримидил-6)-пиримидин. К раствору 1 г (6,t ммоль) Jметокси-5-амино-6-меркаптопиримиди на в 30 мл метанола, содержащего 0, г КОН, прибавляют раствор 1,2 г (6,k ммоля) i -MeTOKCM-5-HHTpo-6хлорпиримидина в 20 мл метанола.
Реакционную смесь оставляют на сутки при комнатной температуре, выпавший осадок отфильтровывают, промывают водой и сушат на воздухе. Получают 1,2 г (,5%) желтого кристаллического порошка с т.пл. 226-228°(спирт), Упариванием фильтрата получают дополнительное коли чество. Общий выход составляет 7883%.
НайденоД: С 38,55; Н 3,19. CioH oN604S
Вычислено,%t С 38,70; Н 3,2. ИК-спектр: 3120 , 3300 см (NHg). .
б)4-Метокси-5 ацетиламино-6тио-{А-метокси-5-нитропиримидил-6)пиримидин. Смесь 1 г (3,2 ммоль) +-метокси-5-амино-6-тио- (4-метокси5-нитропиримидил-6)-пиримидина и АЗО мл уксусного ангидрида нагревают при 65-70. в течение 2 час, уксусный ангидрид отгоняют,, остаток растирают с водой, осадок отфильтровывают и высушивают на воздухе. Получают 1 г (91%) белого кристаллического порошка с т.пл. (спирт). ИК-спектр: 1730 см ().
НайденоД: С 40,85: Н 3,19.
,
ВычисленоД: С 40,90; Н 3,43. .
в)|,9-Диметокси-5Н-дипиримидр з|1(,5-Ь)(5,-1)3(1,4)тиазин -(la)
К раствору 3,5 г ПО ммоль) -меток- си-З-ацетиламино-б-тио-(-метокси5-нитропиримидил-б)-пиримидина в 30 мл диметилформамида при 60-70 прибавляют 5 мл i -ного раствора КОН в метаноле. Реакционную смесь перемешивают при 60-70° в течение 1 час, охлаждают до 20° и выпавший осадок отфильтровывают. Получают 1,83 г. (71,2%) ярко-желтого кристаллического порошка с т.пл. 2t6-2 8 (из диметилформамида) . ИК-спектр: 3220 см (NH)-. . ,
НайденоД: С 45,49; Н 3,46; N 26,68; S 12,23.
ВычисленоД: С 45,62; Н 3,44; N 26,60; S 12,18.
П р и м е р 2. 4-Метокси-9-диме-и тиламино-5Н-дипиримидо-Г(А,5-Ь) (5,1) (1 ,)тиази н.
а) 4-Метокси-3-амино-6-тио-(4-диметиламино-З-нитропиримидил-6)-пиримидии. К раствору 1,6 г (10 ммоль) -метокси-З-амино-б-меркаптопиримидина в 30 мл метанола, содержащего , ,0,6 г КрН, прибавляют раствор 2,02 (10 ммоль) -диметиламино-З-нитро-6хлорпиримидина в 30 мл метанола. Реакционную смесь оставляют на сутки при комнатной температуре. Выпавший осадок отфильтровывают, промывают водой и сушат на воздухе. Получают 3г (95) желтых кристаллов с
т .пл. 185-187 (из этанола). ЙКспектр: 3t50 см, 3320 (NH).
Найдено,: С 40,94; Н 4,21.
Вычислено,%: С 40,86; Н 4,03.
б) -Метокси-9-диметиламино-5НдипиримидоС(,5-Ь) (3,-1) (1,)тиазин. Смесь 3,6 г (11 ммоль) -ме0 токси-5-амино-6-тио(-диметиламино5-нитропиримидил-6)-пиримидина и 30 мл уксусного ангидрида нагревают при 65-70° в течение 2 час, уксусный ангидрид отгоняют, остаток растирают с водой, отфильтровывают и вы5сушивают на воздухе. Полученное вещество растворяют в 30 мл диметилформамида и при 60-70 прибавляют 5 мл А%-ного раствора КОН в метаноле. Реакционную .смесь перемешивают при
0 60-70° в течение 1 час, охлаждают до комнатной температуры. Осадок отфильтровывают. Получают 1,7 г (63%) желтого кристаллического вещества, с т.пл. 180° (из этанола). ИК-спектр: 3200 см-ЧмН)
Найдено,: С 47,9; Н 4,35; N 30,61; S 11,85. , , , Вычислено,%: С ,8l; Н 4,38;
0 N 30,42; S 11,6.
ПримерЗ- -Лиметиламино-9 метокси-ЗН-дипиримидои(,5-Ь) (3,-1-)J (1 ,А)тиазин.
а)4-Диметиламиио-5-амино-6-тио5 (-метокси-З-нитропиримидил-6)-пиримидин. К раствору 1,7 г (10 ммоль) +-диметиламино-5-амино-6-меркаптопиримидина в 30 мл метанола, содержащего 0,64 г КОН, прибавляют раствор
1,9 г (Ю ммоль) -метокси-5-нитро6-хлорпиримидина в 30 мл метанола. Реакционную смесь оставляют на сутки при комнатной температуре. Растворитель отгоняют досуха, остаток, растирают с водой, осадок отфильтровывают и высушивают на воздухе. Получают 3 г (92) желтых кристаллов с т.пл. 213-213 (из этанола). ИКспектр: 3110 , 3260 см- (NHg).
0 Найдено,%: С 40,84; Н 4,06.
С,, К ЫуОзЗ.
Вычислено,%: С 40.,86; Н 4,03.
б) -Диметиламино-3-ацетиламино6-тио-(4-метокси-5-нитропиримидил5 6)-пиримидин. Смесь 3,2 г (10 ммоль) 4-диметиламино-3-амино-6-тио-(-метокси-5-нитропиримидил-6)-пиримидина и 30 мл уксу сного ангидрида нагревают при 65-70° в течение 2 час, растворитель отгоняют досуха, остаток растирают с водой и отфильтррвы вают. Получают З, г (95) белого кристаллического порошка с т.пл. (из водного метанола).ИК-спектр: см- ().
НайденоД: С А2,42; Н 4,03.
Вычислено : С 42,73; Н 4,14.
в) -Лиметиламино-9-метокси-5Ндипиримидо С(5-Ь) (S.i-lOd )тиазин. К раствору г (10 ммоль) Лиметиламино-5-ацетиламино-6-тио(4-метокси-5-нитропиримидил-6)-пиримидина в 30 мл диметилформамида при 160-70 прибавляют 5 мл %-ного растJBopa КОН в метаноле. Реакционную смесь перемешивают при 60-70° в течение 1 час, охлаждают до 20°, выделившийся осадок отфильтровывают. Получают 1,75 г (б5%) зеленовато-, желтых кристаллов с т.пл. 205-206 (из этанола).
Найдено,%: С 47,96; Н 4,50; N 30,56; S 11,15.
C «N60S . Вычислено,%: С 47,81; Н 4,38; N 30,42; S 11,6.
Авторы
Даты
1992-05-23—Публикация
1975-12-03—Подача