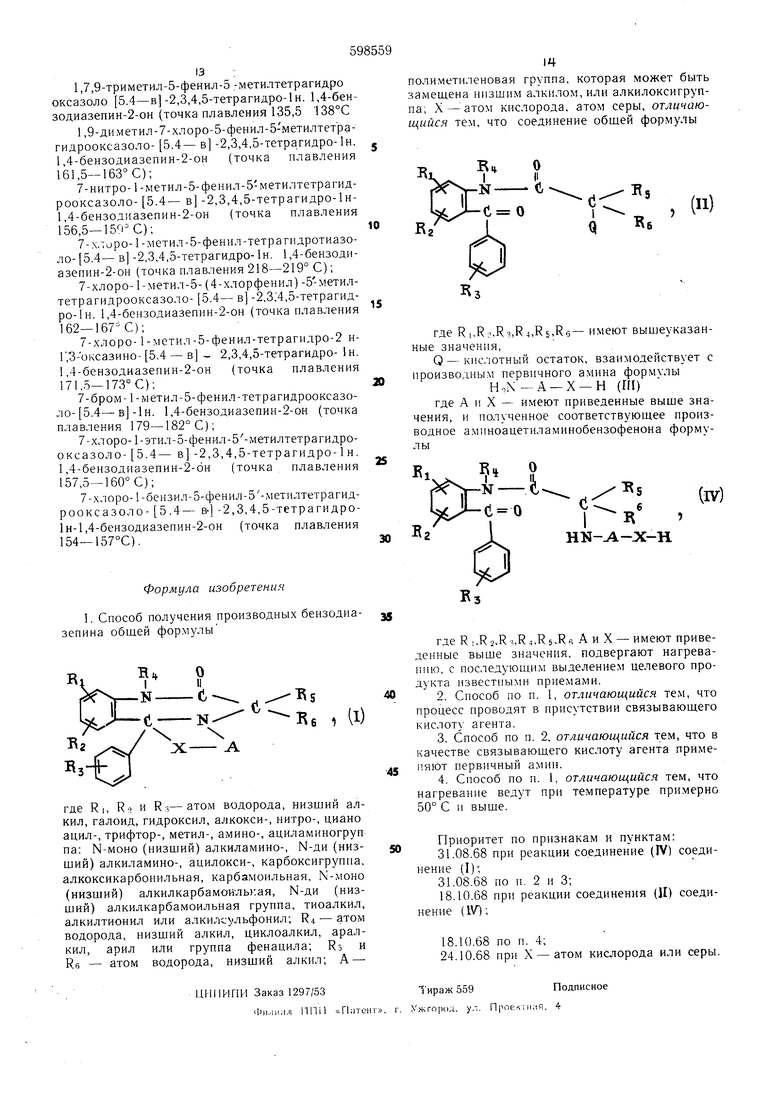
(54)СПОСОБ «ЮЯУЧЕНИЯ ПРОИЗВОДНЫХ БЕНЭОДИАЗЕПИНА
Кз
где Ri,R2,R:bR bRi.Re, А и X имеют приведенные выше значения, при нагревании с носледуlOHUiM выделением целевого продукта известными нриемами.
В формуле (I) низшая алкильная группа может быть нормальной нлн разветвленной, как например, метил, эти.1, н,- нропи.ч, изопропил, н.- б)тил, втор.- бутил, трет.- бутил и т.п. Низшая алко1ссигрупна может быть, например, меТОКСИ-, тгокеи-, нропокси-, изоиропокси-, бутокси- и т.п. том галогена может быть представлен фторо.м, A.iupOM, бромом или йодом, ациловая группа быть алифатической или ароматической, например формилом, ацетилом, нропионилом, бутирило.м, бензоилом, толуолом и т.п. Ацилоамииная группа может быть представлена, например, ацетил-, пропионил-, бутиРИЛ-, бензоил-, толуоил-, нафтоиламинными и подобными веществами. Моно (низншй алкил) аминогруппа может быть представлена, например, н.-метил-, и.-пропил-, н.-эти;1-, или н.-бутилоаминными группами; п.-ди (низ1иий алкил) амииогруппа, наиример н.-диметиловои, н. диэтиловой, н.-Д1П1роииловой или н.-дибутиламииовой группой; ацик:Гокеигруппа, нагфимер ацетокси-, пропионилокси-, бутирилокси-, бензоилоксигруппами и т.п.; алкоксикарбонильная группа, например метокси-, этокеи-, пропокси-, бутоксикарбонилом и т.п. н.-.моно{низший алкил)-карбамоильная группа может быть, например, н.-метиловым, н.-этиловым, и.-проииловым или и.-бутиловым карбамоилом; Н-ди (низший алкил) карбамоильная группа - например, н.-димети,1ов1)1м, Н.-ДИЭТИ.ЯОР,ЫМ, и.-дииропиловым или н.-дибутиловым карба.мои;1ом; низшая алкилтиогруппа, например метилтио-, этилтио-пропилтио-, бутилтио- и т. п., 11из1пая алкилтиониловая группа - например метилсульфидо.м, этил-, пропил-, бутилтиони;1ом и т. п., низшая алкилсульфуриловая - например метил-, этил-, пропил-, бутилсульфурилом и т. п. Циклоалкиловая группа может быть представлена, например циклопропилом, циклопентилом, циклогексилом и т.п.; аралкильная группа - например бензилом, фенети, и т.п.; арильная группа, например нафтилом, фенилом и т.п.; полиметиленовая группа - например, этиленом, пропиленом, триметиленом, 1,2-бутиленом, 1,3-бутиленом, 2,3-бутилено.м, тетраметиленом, 1 -гидроксиметилэтиленом, 1 -фенилметиленом, I-фен ил мети л эти леном и т.н.
Групна Q в формуле (It) предусмотрена для введения радикала сложных эфиров галогенводородной, СуЛЬфО-, ОрТОфОсфОрНОЙ КИСЛОТ 1. Наиболее представительными радикалами этих кислот янляк)тси .viop, бром, йод, паратолуолсульфопоксигрупи-а. метансульфопокси группа, дис)ени;1(рос(|}орил()вая rpyTina и т.и.
В качестве реакционного растворители могут употребляться любые о)ганпческие растворители, которые не могут противодс1 :ств()Бать ходу реакции по настоящему изобрете1шю. Типичиыми примерами таких г.нертных органических растворителей являются, например, низшие алканоли; метанол, этанол, ироианол. изопропанол или бутанол; ди-(низший алкил) кетоны; ацетон, метилэтилкетон и;и1 диэти.чкетон; циклический эфир, как например, тетрагидрофуран или диоксан; галогенозамешенный углеводород, как напри.мер, хлорофор.м, или дихлорэтан; эфир алифатической карбоновой кислоты, как иаиример, этиловый эфир уксусной кислоты; ацетонитрил; дн-щизпшй алкил) фор.ма.мид, как нап|)и.мер, ,к| ормамид или диэтилфорчамид; г: т.н. Г1|.)1м:10ч- ительнь низшие алканоли. как . нанримср. мс-танол, этанол, nporia)io:i. изоироиано.1, бхтано.л и т.п. и циклические э(зиры, панример тетраг;1дрофура1, диоксан и :.н.
Cor.iaciio пастояше.му изобретению предис чтительно, чтобь реакция проходила в присутствии вешеств. связующих кислоту. Так как амипопроизводиое формулы (III) может также играть роль вещества, связующего кислоту, то можно не вводить в систему реакции какиелибо другие связующие веи;ества. Когда аминоироизводные употреб.ляют одновременно как реагент и как связующее кислоту вешество, желательно (но не необходимо) вводить их в количестве, превышающем по крайней мере на одни объем норма.1ьно предусматриваемое. Другими связуюишми веп1ествами могут быть как органические, так и иеоргапические основания, например, третичные амины (тримеТИЛ-, триэтил-, трибутиламин-, н.-метилморфолин, н.-метилииперидии, н.п -диметилпиперазин или диметиланилин), ненасыщенные гетероциклические основания (например, пиридин, пиколин или хиноли {--в качестве органических оснований; например,соединения щелочных металлов, например их гидроокиси (натрия, лития, калия); карбонат или бикарбонат шелочного .металла (например, углекихльш двууглекислый натрий, углекис:1ый и;и1 двууглекислый калий); соль шелочного металла слабой карбоновой кислоты (например, ацетат натрия или ацетат калия)-в качестве неорганических соединений. Предпочтительны соли шелочного металла слабой карбоиовой кис,поть.
Нагревание может благоприятно воздействовать па ускорение реакции согласно этому изобретению, лучше нроводить реакцию при температуре приблизительно 50°С или более высокой. Обычно проводят при температуре кипения реакционного растворителя.
Длительность реакции также не имеет сушественного значения и может варьироваться от нескольких минут до-60 ч в зависимости от рода и THiia унотребляе.мого и.сходного материала и реакционного растворителя, от реакционной температуры и других факторов.
Но окончаиии реакции продукт (I) легко извлекают из реакционной смеси обычными приемами, напри.мер, уда;1ением реакционного растворителя перегонкой, извлечением остатка при помощи соответствующего экстракционного растворителя, (например, дихлорметана), промыванием и просушиванием вытяжки с последующим удалением экстракционного растворителя. При желании полученный таким образом сырой продукт может быть рафинирован общепринятыми способами, например рекристаллизацией или хроматографическими приемами. 13 ходе реакционного процесса согласно настоящему изобретению установлено, что бензодиазепиновое соединение согласно формуле (I) формируется из исходного бензофенонного соединения формулы (II), проходя через промежуточное бензофенонное соединение формулы (IV); бензодиазепиновое соединение формулы (I), равно как и промежуточное бензофенонное соединение формулы (IV), формируется на месте при сравнительно низкой температуре (приблизительно ниже 50° С), после чего технологический процесс может проводиться последовательно при изоляции промежуточного соединения (IV) от реакционной смеси любым общепринятым способом, например дробной кристаллизацией или хроматографией и последующей конверсией промежуточного соединения (rV) в бензодиазепиновое соединение.
Вторая стадия проведения процесса заключается в конверсии промежуточного бензофенонпого соединения формулы (IV) в бензодиззепинное соединение формулы (1) дегидратацией и замыканием кольца. Для этого промежуточное соединение (IV), изолированное от результата первой стадии, подвергают термической обработке (нагрев до более высокой температуры, предпочтительно превыщающей 50°С, например, до температуры кипения употребляемого растворителя) предпочтительно в присутствии каталитического количества какой-либо кислоты. Реакция на этой стадии может успешно проводиться как в присутствии инертного органического растворителя, так и без него. В качестве инертных органических растворителей, могут быть применены те же, что и прр непосредственном получении бeнзoдиaзeпиFlнoго соединения формулы (I). Катализаторами на этой стадии процесса являются неорганические кислоты, например, хлористоводородная, бромистоводородная, серная и фосфорная; органические кислоты, например, уксусная, пропионовая, лимонная и винная; кислота по Льюису, например, трехфтористый бор; и подобные кислоты, причем уксусная предпочтительна. Длительность реакции различная, она зависит от термической обработки, рода и типа исходного материала, реакционного растворителя, если таковой употребляется. Обычно, если применяется нагрев, то реакционный период длится от 5 до 30 ч; если же работа производится при сравнительно более низкой, например при комнатной температуре, то длительность реакции превосходит 20 ч и предпочтительно 100-200. По окончании реакции, продукт ее, т.е. бензодиазепинное соединение, формулы (I) может быть легко извлечен из реакционной смеси и очищен, например путем удаления растворителя перегонкой и последующей рекристаллизацией остатка из соответствующего растворителя.
Пример 1. 7-хлоро-5-фенилтетрагидрооксазоло 5,4- в -2,3,4,5-тетрагидро-1н. 1,4-бензодиазепин-2-он. К раствору 3,5 г 5-хлоро-2-бромоацетиламинобензофенона в 80 мл диоксана прибавляют 0,6 г 2-аминоэтанола и 0,85 г уксуснокислого натрия. Эту смесь нагревают в течение 14 ч с обратным холодильником. По окончании реакции растворитель удаляют перегонкой, а остаток извлекают дихлорметаном, промывают водой, высущивают над безводным сернокислым натрием, после чего растворитель отгоняют. Остаток перекристаллизовывают из этанола и получают 1,9 г искомого продукта с температурой плавления 175-176° С.
Пример 2. 7-хлор-5-фенилтетрагидро-211.
1,3-оксазоло (5,4- ,3,4,5-тетрагидро-1н. 1,4-бензодиазепин-2-он. Смесь 4,3 г 5-хлоро2-бромоацетиламинобензофенона, 0,9 г 3-амино-н.-пропанола, 1,2 г триэтиламина в 80 мл
метанола нагревают в течение 8 ч с обратным холодильником. Реакционную смесь обрабатывают, как указано в примере 1, получают 3,4 г искомого продукта с температурой плавления 220-223° С.
Пример 3. 7-хлоро-5-фенил-5-метилтетрагидрооксазоло 5.4- ,3,4,5-тeтpaгидpolн.l,4-бeнзoдиaзeпинa-2-oн. К раствору 12 г 5-хлор-2-.лорацетиламинобензофенона и 3,2 г изопропаноламина в 100 мл этанола прибавляют 3,3 г уксуснокислого натрия. Смесь в течение 12 ч нагревают с обратным холодильником при размешивании. По заверщении реакции, смесь обрабатывают, как указано в примере 1 и получают 10,6 г искомого продукта, плавящегося при 186-188°С.
Пример 4. 7-хлоро-5-(2-хлорфенил)-тетрагидрооксазоло 5,4 - ,3,4,5-тетрагидро-1н. 1,4-бензодиазепи11-2-он. К раствору из 5,6 г 5-хлоро-2-бромацетиламино -о-хлоробензофенона в 120 мл этанола прибавляют 0,95 г .этаноламина и 1,3 г уксуснокислого натрия. Смесь в течение 16 ч нагревают с обратным
холодильником, по заверщении реакции обрабатывают, как указано в примере 1. Получают 3,25 г искомого продукта, плавящегося при 202-204° С с разложением.
Пример 5.7-хлоро-5-фенил-тетрагидротиазоло 5,4,,3,4,5-тетрагидро-1н. 1,4-бензодиазепин-2-он. К раствору 2,1 г 5-хлоро-2-бромоацетиламино-бензофенона и 0,5 г 2-хлоргидрата меркаптоэтиламина в 60 мл этанола добавляют 4,9 г уксуснокислого натрия. Смесь в течение 14 ч нагревают с обратным холодильником. По
окончании реакции реакционную смесь обрабатывают, как указано в примере 1, и получают 1,3 г желаемого продукта, плавящегося при 243-245° С.
Пример 6. 7-нитро-5-фенил-5-метилтетрагидрооксазоло 5.4 -в -2,3,4,5-тетрагидро-1 н. 1,4-бензодиазепин-2он. К раствору из 3,6 г 5-нитро-2-бромацетиламинобензофенона в 80 мл этанола прибавляют 0,8 г изопропаноламина и 0,9 г уксуснокислого натрия. Смесь подвергают в течение 16 часов нагреванию с обратным
холодильником. По окончании реакции, реакционную слтесь обрабатывают, как указано в вышеприведенном примере 1 и получают 2,9 г искомого продукта, плавящегося при 209°С. Пример 7. 7,9-диметил-5-фенил-5-метилтетрагидрооксазоло 5,4- в -2,3,4,5-тетрагидро1н. 1,4-бензодиазепин-2-он. К раствору 3,4 i ЗJ -димeтил-2-бpoмoaцeтилaминoбeнзoфeнoнa в 100 мл этанола прибавляют 1,8 г изопропаноламина и 2 г уксуснокислого натрия. Смесь в течение 16 ч нагревают с обратным холодильником. По завершении реакции реакционную смесь обрабатывают как указано в примере 1, получают 2,8 г искомого продукта, плавяпхегося при 273° С. Пример 8. 7-.хлоро-5- ,(2-хлорофенил)-5-метилтетрагидрооксазоло 5.4-в 2,3,4,5-тетрагидро-1н. 1,4-бензодиазепин-2-он. К раствору 3,9 г 5-хлоро-2-бромоацетиламино-о-хлоробензофенона в 100 мл этанола прибавляют 0,8 г изопропаноламина и 1 г уксуснокислого натрия. Эту смесь в течение 14 ч нагревают с обратным холодильником. По завершении реакции реакционную смесь обрабатывают, как указано в примере 1, и получают 2,08 г искомого продукта, плавящегося при 190-192° С (с разложением). Применяя в основном описанный технологический процесс приготовляют следующие бензодиазепинные производные: 7-хлоро-5- (2-фторфенил) -тетрагидрооксазоло 5.4-в -2,3,4,5-тетрагидро-1н.-1,4-бензодиазепин-2-он, точка плавления 181 -183°С; 7-хлоро-5- (2-фторфенил) -5-метилтетрагидрооксазоло 5,4 - 2,3,4,5-тетрагидро-1н.1,4-бензодиазепин-2-он, точка плавления 197- 199° С (с разложением); 7-бромо-5-фенил-5-метилтетрагидрооксазоло 5,4-в -2,3,4,5-тетрагидро-1н. 1,4-бе 13одиазепин-2-он, точка плавления 181 - . 7-бромо-5-фенил-тетрагидрооксазоЛо .5.4- в -2,3,4,5-тетрагидро-1 н. 1,4-бензодиазепин2-он, точка плавления 189,5-191,5° С; 7-нитро-5-фенил-тетрагидрооксазоло 5.4- в -тетрагидро-1н. ,4-бензодиазепин-2-он, точка плавления 218-221° С; 7-бромо-5- (2-хлорфенил) -тетрагидрооксазо ло 5.,3,4,5-тетрагидро-1н. 1,4-бензодиазепин-2-он, точка плавления 205-207° С ( раз.-ожением); 7-бромо-5- (2-хлорфенил) -5-метилтетрагидрооксазоло 5.4- в -2,3,4,5-тетрагидро-.1н. 1,4-бензодиазепин-2-он, точка плавления 196- 198° С (с разложением). Пример 9. 7-хлоро-5-фенил-тетрагидрооксазоло 5,,3,4,5-1н. 1,4-бензодиазепин2-он. К раствору 3,5 г 5-хлоро-2-бромоацетиламинобензофенона в 80 мл диоксана прибавляют 0,6 г 2-аминоэтанола и 0,85 г уксуснокислого натрия. Эту смесь в течение 100 ч размешивают при комнатной температуре. По окончании реакции растворитель отгоняют, остаток извлекают дихлорметаном, промывают водой и высушивают над безводным сернокислым натрием. Остаток перекристаллизовывают из этанола, получают иско.мый продукт, плавяш.ийся при 175-176° С. Пример 10. 7-хлоро-5-фенил-тетрагидро2н.Г,3-оксазино 5,,3,4,5-тетрагидро1 н.-1,4-бензодиазе1П1Н-2-он. Смесь 4,3 г 5-хлоро2-бромоаиегиламинобензофенона, 0,9 г 3-амино.-н. пропанола и 1,2 г триэтиламина в 80 мл метанола подвергают в течение 150 ч, размешивают при ко.мнатной те.мпературе. По завер1иении реакции растворитель отгоняют, а остаток экстрагируют дихлорметаном. Экстракт промывают водой, высушивают над безводным сернокислым натрием, после чего растворитель отгоняют. Остаток перекристаллизовывают из этанола; получают кристаллы искомого продукта, плавящиеся при температуре 220-223°С. Пример 11. 7-хлоро-5-фенил-5-метилтетрагидрооксазоло 5.4- в -2,3,4,5-тетрагидро-1н. 1,4-бензодиазепин-2-он. К раствору 12 г 5-хлоро-2-хлорацетиламинобензофенона и 3,2 г изопропаноламина в 100 мл этанола добавляют 3,3 уксуснокислого натрия. Эту смесь в течение 140 ч размешивают при ко.мнатной температуре. По завершении реакции реакционную смесь обрабатывают, как указано в примере 10, и получают искомый продукт, точка плавления которого колеблется между 186 и 188,5° С. Следуя, в основном, указаниям технологического цесса, который описан выше, изготовляют следующие производные бензодиазепина:7-хлоро-5-фенил-тетрагидротиазоло 5.4- -в -2,3,4,5-тетрагидро- 1н. 1,4-бензодиазепин2-он, точка плавления 241-243°С; 7-нитро-5-фенил-5-метилтетрагидрооксазоло 5.4- в -2,3,4,5-тетрагидро-1н. 1,4-бензодиазеПИН-2-ОН, точка плавления 209° С; 7,9-ди метил-5-фенил-5-метилтетрагидрооксазоло 5.,3,4,5-тетрагидро-1н. 1,4-бензодиазепин-2-он, точка плавления 273° С; 7-хлоро-5- (2-хлорфенил)-5-метилтетрагидрооксаЗоло 5.4- в -2,3,4,5-тетрагидро-1н. 1,4-бензодиазепин-2-он, точка плавления 190- 192° С (с разложение.м); 7-хлоро-5- (2-хлорфенил) -тетрагидрооксазоло 5.4- в -2,3,4,5-тетрагидро-1н.1,4-бензодиазепин-2-он, точка плавления 202-204° С (с разложением); 7-хлоро-5- (2-фторфенил) -тетрагидрооксазоло 5.,3,4,5-тетрагидро-1н. 1,4-бензодиазепин-2-он, точка плавления 181 -183° С; 7-.хлоро-5- (2-фторфенил) -5-метилтетрагидрооксазоло 5.4- в -2,3,4,5-тетрагидро- 1н. 1,4-бензодиазепин-2-он, точка плавления 197- 199° С (с разложением); , 7-бромо-5-фенил-тетрагидрооксазоло 5.4- ,3,4,5-1н. 1,4-бензодиазепин-2-он, точка плавления 189,5-191,5° С; 7-бромо-5-фенил-5-метилтетрагидрооксазоло 5.,3,4,5-тетрагидро-1н. 1,4-бензодиазепин-2-он, точка плавления 181 -183° С; 7-нитро-5-фенил-тетрагидрооксазоло 5.4- -в -2,3,4,5-тетрагидро-1н. 1,4-бензодиазепин2-он, точка плавления 218-221°С; 7-бромо-5-(2-хлорфенил)-5-метилтетрагидро 5.,3,4,5-тетрагидро-1н. 1,4-бензодиазенин-2-он, точка плавления 196-198° С (с разложением). Пример 12. 7-хлоро-3-метил-5-фенил-5-метилтетрагидрооксазоло- 5,4- в -2,3,4,5-тетрагидро-1н. 1,4-бензодиазепин-2-он. Э К раствору 7,3 г 5-хлоро-2-(альфа-бромопроП11они.л)-ам11нобензофенона в 100 мл этанола прибавляют 1,6 г изопропаноламина и 1,7 г уксуснокислого натрия. Эту смесь в течение 12 ч нагревают с обратным холодильником. По завершении реакции растворитель отгоняют из реакционной смеси при пониженном давлении и остаток экстрагируют дихлорметаном. Экстракт нромывают водой, высушивают над безводным сернокислым натрием, после чего растворитель отгоняют. Остаток перекристаллизовывают из этанола, получают искомый продукт, плавящийся при 216-217С. Следуя, в основном, указанному технологическому процессу, изготовляют следующие производные бензодиазепина: 3,7,9-триметил-5-фенил-тетрагидрооксазоло 5.4- в -2,3,4,5-тетрагидро-1н. 1,4-бензодиазеПИН-2-ОН, точка плавления 219-221°С; 7-бромо-3-метил-5-фенил-тетрагидрооксазоло 5.,3,4,5-тетрагидро-1н 1,4-бензодиазепин-2-он, точка плавления 198-201°С; 7-хлоро-3-метил-5-(|)енил-тетраг 1Дро,.оксазоло 5.,3,4,з-тетрагидро-1н 1,4-бензодиазепин-2-он, точка плавления 205-207°С; 7-хлоро-3-этил-5-фенил-тетрагидрооксазоло- 5.4- в -2,3,4,5-тетрагидро- 1н. 1,4-бензодиазепин-2-он, точка плавления 183-184 С; 7-хлоро-5-{4-хлорфенил) -3-метил-тетрагидрооксазоло 5.4- в -2,3,4,5-тетрагидро- 1н. 1,4-бензодиазепин-2-он, точка плавления 204- 205,5° С; Пример 13. 7-хлоро-3-метил-5-фенил-тетрагидро-2н. 13-оксазино 5.,3,4,5-тeтpaгидpo-lн. 1,4-бензодиазепин-2-он. К раствору 3,6 г 5-хлоро-2-(гх-бромопропионил)-а.минобензофенона в 80 мл этанола прибавляют 0,8 г 3-амино-н. пропанола и 0,9 г уксуснокислого натрия. Эту смесь в течение 16 ч размешивают и нагревают с обратным холодильником. По завершении реакции растворитель отгоняют и остаток растворяют в дихлорметане. Раствор промывают водой, высушивают над безводным сернокислым натрием, а растворитель отгоняют. Растворенный в бензоле остаток хроматографируют на колонке силикагеля. Элюируют эту колонну бензолом, затем смесью бензола и уксусноэтилового эфира (9:1). Частичною продукты .промывки собирают вместе со смесью, и растворитель отгоняют. Остаток перекристаллизовывают из этанола и получают 0,6 г искомого продукта с температурой плавления колебляюшейся между 172,5° и 176°С. Следуя, в основном, описанно.му технологическому процессу, приготовляют следующие производные бензодиазепина: 7-нитро-3-метил-5-фенил-тетрагидроокса5оло 5.,3,4,5-тетрагидро-1н. 1,4-бензодиазепина-2-он, точка плавления 221-225°С (с разложением); 7-хлоро-Зн. пропил-5-фенил-5-метилтетрагидрооксазоло- 5.4- в ,5-тетрагидро1н. - 1,4-бензодиазепин-2-он, точка плавления 178-181,5 С; 7-хлоро-3-этил-9-метил-5-фенил-5-метилтетрагидрооксазоло- 5.4- в -2,3,4,5-тетрагидро-1н.1,4-бензодиазепин-2-он, точка плавления 231-235° С; 9 / -.:opo-3.3-дп ieтilЛ-5-фcjiи,-тeтpaгидpooкcaзo.lO- |5.4- в -2.3,4.5-тетрагидро- 1н.-1,4-бензодиазе1и Н-2-(Я1. точка плавления 151 - 154,5 С; 7-хлор-З-метил-Ь- (2-метилфенил) -тетрагидрооксазоло- 5.4- ,3,4,5-тeтpaгидpo-lн.l,4-бeнзo.иaзeпilн-2-oн. точка плавления 213- 7-хлоро-3-метил-5- (4-нптрофенил) -тетрагидрооксазоло-(5.4- ,3,4,5-тетрагидро-1н. 1.4-бензодиазепин-2-он, точка плавления 203- 206°С: 7-хлоро-3-метпл-5-феиил-тетрагидротиазоло 5.4- в -2,3,4,5-тетрагидро-1 и. 1,4-бензодиазеПИН-2-ОН, точка плавления 205-207° С. Пример 14. 7-хлоро-5-фенил-тетрагидрооксазоло- 5.4- и -2.3,4.5-тет )агидро-1н.-1,4-бензодиазепин-2-он. К растпору 3,5 г 5-хлоро-2-тозилоксиацетиламинобензофенона в 80 мл этанола прибавляют 0,6 г этаиояамина и 80 г уксуснокислого натрия. Эту смесь в течение 14 ч нагревают с обратным холодильником.По завершеНИИ реакции растворитель отгоняют и остаток растворяют в дихлорметане. Раствор промывают водой, высушивают над безводным сернокислым натрием, растворитель отгоняют. Остаток перекристаллизовывают при помощи этанола и получают ).4 г искомого продукта, кристаллы котор(го плавятся при 175- 176,5° С. Пример 15. 7-хлоро-5-фенил-5-метилтетрагидрооксазоло- 5.4- в -2,3.4,5-тетрагидро-1н.1,4-бензодиазепиь -2-о11. К, раствору 7,9 г 5-.лоро-тозилоксиацетиламшобензофенона в 120 мл метанола добавляют 1.5 г изопропаноламина и 1,65 г уксуснокислого натрия. Эту смесь в течение 18 ч размешивают и нагревают с обратным холодильником. По завершении реакции реакционную смесь обрабатывают, как указано в примере 14. Получают 3,7 г искомого продукта в виде .1лов, плавяш.ихся при 186- 188° С. При.меняя описанный технологический процесс изготовляют 113 соответствующих бензофенонов и аминов следующие бензодиазепинные производные: 7-хлоро-5-фенпл-тетрагидро-2н-1,3-оксазино- 5.4- - в -2,3,4,5-тетрагидро-1н. 1,4-бензодиазепин-2-он, (точка плавления 220,5-223° С): 7-нитро-5-фенил-5-метилтетрагидрооксазоло- 5.4- в -2,3.4,5-тетрагидро- 1н,-1,4-бензодиазепин-2-он (точка плавления 208-209° С); 7,9-диметил-5-фенил-5-метилтетрагидрооксазоло- 5.4- в -2,3,4,5-тетрагидро- 1н.- 1,4-бензодпазепин-2-он (точка плавления 271 - 273.5° С); /-нитро-5-фенил-тетрагидрооксазоло- 5.4- в -2,3,4,5-тетрагидро-1н.-1,4-бензодиазеиин2-он, точка плавления 217-22ГС (с разложением) ; 7-бромо-5-фенил-5-мети,лтетрагидрооксазоло- 5.,3,4,5-тетрагидро-1н. 1,4-бензодиазепин-2-он (точка плавления 180-182° С); 7-бромо-5-фенил-тетрагидрооксазоло- 5.4- - в -2,3,4,5-тетрагидро- 1н. 1,4-бензодиазепин2-он (точка плавления 189-191° С); 7-хлоро-9-метил-5-фенил-5-метилтетрагидрооксазоло- 5.4- в -2,3,4,5-тетрагидро-1н,
Л 4-беизодиазепин-2-он (точка плавления 252- 253°С); 7,8-ди.лоро-5-фенил-5-метилтетрагидрооксазоло- 5,4- в -2,3,4,5-тетрагидро-1н. 1,4-бензодиазепин-2-он, (точка плавления 196- 197,5° С); 7,9-дихлоро-5-фенил-5-метилтетрагидрооксазоло- 5.4- в -2,3,4,5-тетрагидро- 1н. 1,4-бензодиазепин-2-он, (точка плавления 226- 228°С); 7-хлор-1-метил-5-фенил-тетрагидрооксазоло- 5.4- в -2,3,4,5,6-тетрагидро-1н. 1,4-бензодиазепин-2-он, (точка плавления 181 -183° С); 7-нитро- 1-1метил-5-фенил-5-метилтетрагидрооксазоло- 5.4- в -2,3,4,5-тетрагидро-1н. 1,4-бенз.одиазепин-2-он (точка плавления 156,5-158° С); 7-хлоро-1-метил-5- (2-.хлорфенил)-тетрагидрооксазоло- 5.4- в -2,3,4,5-тетрагидро- 1н. 1,4-бензодиазепин-2-он (точка плавления 155- 158°С); 7-хлоро-1-этил-5-фенил-5-метилтетрагидро 5.4- ,3,4,5-тетрагидро-1н. 1,4-бензодиазе ПИН-2-ОН, (точка плавления 158-160°С); 7-хлоро-5- (2-хлорфенил) -5-метилтетрагидрооксазоло- 5.4- в -2,3,4,5-тетрагидро-1н. 1,4-бензодиазепин-2-он, точка плавления 190- 192° С (с разложением); 7-хлоро-5- (2-.хлорфенил)-тетрагидрооксазоло- 5.4- в -2,3,4,5-тетрагидро- 1н. 1,4-бензодиазепин-2-он, точка плавления 201-204° С (с разложением); 7-хлоро-5- (4-нитрофенил) -5метилтетрагидр 00 КС а зол о- 5.4- в -2,3,4,5-тетрагидро- 1н. 1,4-бензодиазепин-2-он, (точка плавления 193-195° С); 7-хлоро-5- (2-метилфенил) -5-метилтетрагидрооксазоло- 5.4- в -2,3,4,5-тетрагидро-1н. 1,4-бензодиазепин-2-он, точка плавления 203- 205° С (с разложением); 7-.хлоро-5- (2-фторфенил) -5-метилтетрагидрооксазоло- 5.4- в -2,3,4,5-тетрагидро-1н. 1,4-бензод1 азепин-2-он, точка плавления 197- 199° С (с разложением); 7-хлоро-5- (2-фторфенил) -тетрагидрооксазоло- 5.4- в -2,3,4,5-тетрагидро- 1н. 1,4-бензодиазепин-2он (точка плавления 181 -183°С); 7-бромо-5-(2-.хлорфенил) -тетрагидрооксазоло- 5.4- ,3,4,5-тетрагидро-1н. 1,4-бензодиазепин-2-он, точка плавления 204,5-207°С (с разложением); 7-бромо-5- (2-хлорфенил)-5-метилтетрагидрооксазоло- 5.4- в -2,3,4,5-тетрагидро-1н. 1,4-бензодиазепин-2-он, точка плавления 196- 198° С (с разложением); 7-хлоро-3-.1етил-5-фенило-5-метилтетрагидрооксазоло- 5.4- в -2,3,4,5-тетрагидро-1н. 1,4-бензодиазепин-2-он (точка плавления 216- 217°С); 7-бро ю-3-метнл-5-фенил-тетраг 1дрооксазоло- 5.4- ,3,4,5-тетрагидро-1н. 1,4-бензодиазепин-2-он (точка плавления 198-201° С); 3,7,9-триметил-5-фенил-тетрагидрооксазоло 5.4- в -2,3,4,5-тетрагидро-1н. 1,4-бензодиазеПИН-2-ОН (точка плавления 218-221° С);
12 7-хлоро-3-этил-5-фенил-тетрагидрооксазоло- 5.4- в -2,3,4,5-тетрагидро-1 н. 1,4-бензодиа.Зепин-2-он (точка плавления 183- 184° С). Пример 16. 7-хлоро-5-фенил-тетраг11дротиазоло- 5.4- в -2,3,4,5-тетрагидро-1н. 1,4-бензодиазепин-2-он. К раствору 5,7 г5-хлоро-2-този локсиацетиламинобензофенона в 150 .мл этанола добавляют 1,63 г 2-.меркаптоэтиламинного гидрохлорида и 2,4 г уксуснокислого натрия. Эту смесь в течение 20 ч раз.мешивают при нагревании с обратным холодильником. По завершении реакции растворитель отгоняют из реакционной смеси и остаток извлекают дихлор.метаном. Экстракт промывают водой, высушивают над безводным сернокислым натрием, после чего растворитель отгоняют. Растворенный в бензоле остаток абсорбируют на колонке с силикагелем. После элюирования бензолом колонку элюируют смесью бензола и уксусноэтилового эфира (9:1), после чего частичный, продукт собирают совместно с указанной смесью и растворитель отгоняют. Остаток перекристаллизовывают из этанола и получают 2,08 г иско.мого продукта в виде кристаллов, плавящихся при 241-243° С. Пример 17. 7-хлоро-1-метил-5-фенил-тетрагидрооксазоло 5.4- в -2,3,4,5-тетрагидро-1 н. 1,4-бензодиазепин-2-он. К раствору 4 г 5-хлоро-2-бромацетилметиламинобензофенона в 60 мл тетрагидрофурана добавляют 1,5 г sTaHOviaMHHa. Эту смесь размешивают при комнатной температуре в течение 4 ч. По завершении реакции растворитель отгоняют из реакционной смеси, а остаток растворяют в дихлорметане. Раствор про.мывают эфиром и высушивают над безводны.м сернокислы.м натрием. По удалении растворителя путем дистилляции вязкий остаток растворяют в 100 мл этанола и к этому раствору добавляют несколько капель уксусной кислоты. Полученную смесь нагревают в течение 12 ч с обратным холодильником. Реакционную смесь концентрируют, охлаждают для отделения кристаллического веш,ества, которое зате.м отфильтровывают. Получают 2,6 г искомого продукта, плавлящегося при 181 . Пример 18. 7-хлоро-1-метил-5-фенил-5метилтетрагидрооксазоло 5.4- в -2,3,4,5-тетрагидро- 1н. 1,4-бензодиазепин-2-он. К раствору 3,3 г5-хлоро-2-бро 1ацетилметил аминобензофенона в 40 мл дихлорметана добавляют 1,5 г изопропаноламина. Смесь размешивают при комнатной температуре в течение 10 -ч. При завершении реакции реакционную месь промывают водой, высушивают над безводным сернокислым натрием, растворитель отгоняют. Вязкий остаток растворяют в 100 мл этанола и нагревают в течение 16 ч с обратным холодильником после того, как к нему было добавлено несколько капель уксусной кислоты. Затем реакционную смесь концентрируют и охлаждают. Выпавшие кристаллы отфильтровывают и получают 1,9 г искомого продукта, точка плавления которого колеблется 143- 146° С. При применении вышеописанного технологического процесса изготовляют следуюшие бензодиазепинные производные:





| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения производных бензодиазепина | 1969 |
|
SU482947A3 |
| Способ получения производных бензодиазепина | 1969 |
|
SU474987A3 |
| Способ получения производных бензодиазепина | 1969 |
|
SU496733A3 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ БЕНЗОДИАЗЕПИНА | 1973 |
|
SU400100A1 |
| Способ получения /1,2/-аннелированных 7-фенил-1,4-бензодиазепинов или их солей | 1979 |
|
SU904526A3 |
| КОНДЕНСИРОВАННЫЕ ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ И ИНГИБИТОРЫ СКВАЛЕН-СИНТЕТАЗЫ | 1994 |
|
RU2129547C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ БЕНЗОДИАЗЕПИНА | 1969 |
|
SU436496A3 |
| Способ получения 2-замещенных 1,4-бензодиазепинов | 1976 |
|
SU1126209A3 |
| СПОСОБ ПОЛУЧЕНИЯ ТЕТРАГИДРО [1,4]-БЕНЗОДИАЗЕПИН-2-ТИОНОВ ИЛИ ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫХ КИСЛЫХ АДДИТИВНЫХ СОЛЕЙ ИЛИ СТЕРЕОХИМИЧЕСКИХ ИЗОМЕРОВ | 1990 |
|
RU2024523C1 |
| Способ получения 2-ациламинометил-1 @ -2,3-дигидро-1,4-бензодиазепиновых соединений,а также их оптических изомеров и их солей кислотного присоединения | 1982 |
|
SU1245259A3 |


Авторы
Даты
1978-03-15—Публикация
1969-01-27—Подача