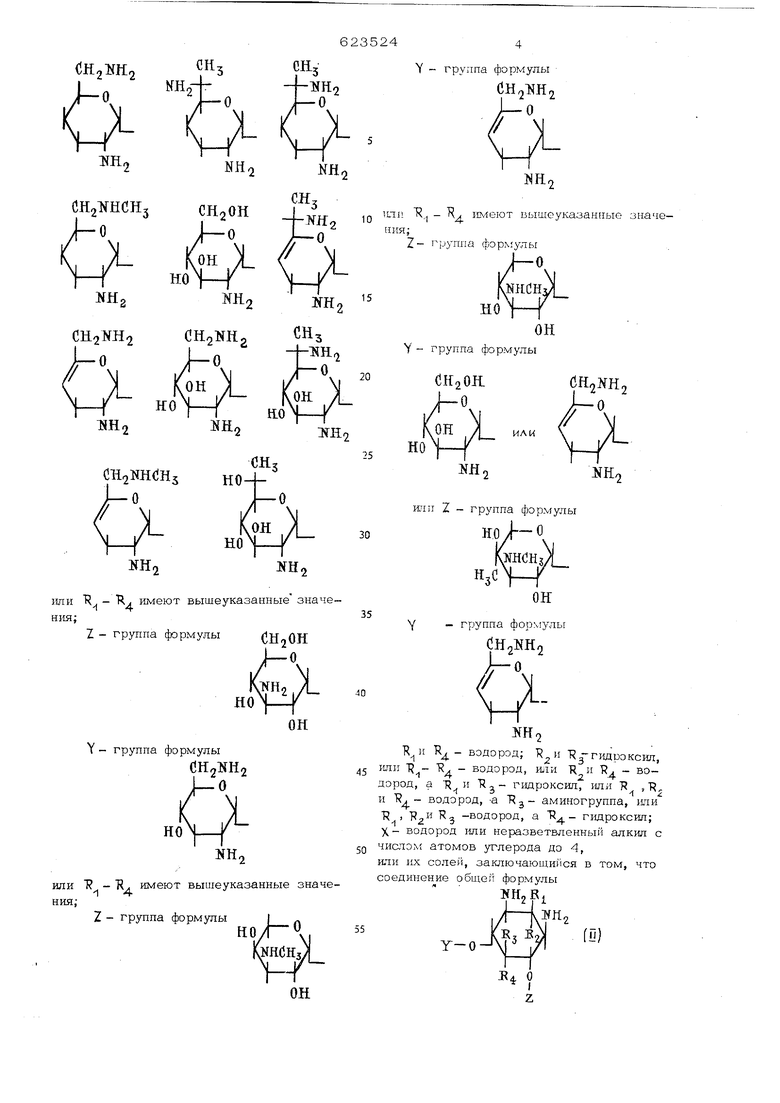
СНз KH2-J{V/NHY - группа формулы
CH.NHo I J-О
Х
NH.


| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения псевдотрисахаридов или их солей | 1974 |
|
SU685158A3 |
| Способ получения 2-дезоксистрептаминаминогликозидов или их солей | 1977 |
|
SU865128A3 |
| Способ получения аминоацильных или пептидных производных фосфоновой или фосфиновой кислоты или их солей | 1976 |
|
SU679131A3 |
| Способ получения производных 7-ациламино-7-метокси-3-цефем4-карбоновых кислот | 1972 |
|
SU450413A3 |
| Способ получения производных пролина или их основных солей | 1979 |
|
SU1066460A3 |
| Способ получения 6-N-замещенного 3-N-формилканамицина | 1979 |
|
SU873889A3 |
| Способ получения аминогликозидов | 1976 |
|
SU700066A3 |
| Способ получения N-арилсульфонил-L-аргининамидов | 1978 |
|
SU965353A3 |
| ЗАМЕЩЕННЫЕ В КОЛЬЦЕ 2-АМИНО-1,2,3,4-ТЕТРАГИДРОНАФТАЛИНЫ ИЛИ 3-АМИНОХРОМАНЫ ИЛИ ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ КИСЛОТНО-АДДИТИВНЫЕ СОЛИ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 1992 |
|
RU2057751C1 |
| Способ получения 1-N-( @ -амино- @ -оксиалканоил)канамицина А или В | 1978 |
|
SU1480774A3 |

но
IfHr
,
или R, - R имеют вышеуказанные значения:
Z - группа формулы
группа формулы
dH2lJH2 J-О
OL
HoN-к
iJH.
или R - R,1 имеют вышеуказанные значения;
группа формулы
°/:N
RNHCHj)
.j/он
taOHsyL
он
- группа формулы (ЗН,ЖНл
j 2 2
/-
УПг
-l 4 водород; R rmpOKcwi, илп 1 - - водород, HJiH Я н R. - водород, а R и Г1-щроксш1, или 1 ,Т, и J - водород, -а аминогруппа, 1ши R , 3 -водород, а R4 - гидроксил; X - водород юти неразветвленный алкил с чи&чом атомов углерода до 4,
или их солей, заключающийся в том, что соединение общей формулы
УП,
fH)
Кз В2
Y-Q
4 о
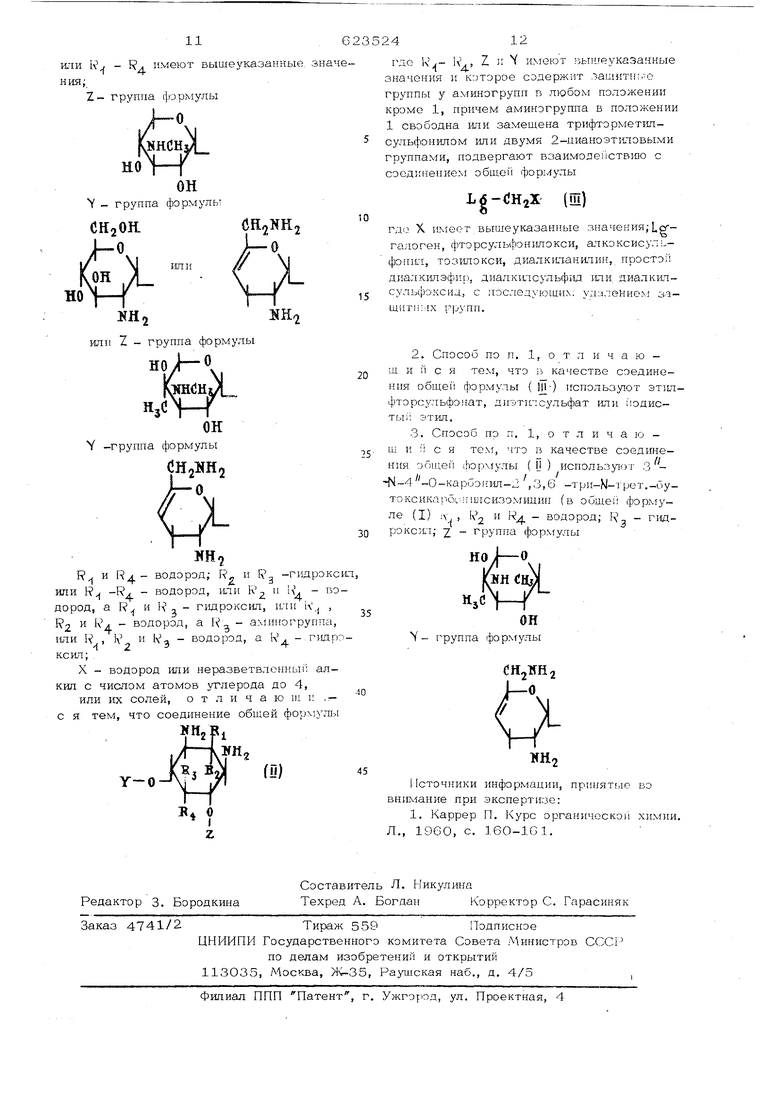
Z где R- - R,, Z и Y имеют вышеу1-1азанные значения и которое содержит защитные группы у аминогрупп в любом положении кроме 1, причем аминогруппа в положе1ш 1 свободна или замещена трифторметилсульфонилом или двумя 2-пианоэтиловым группами, подвергают взаимэдеиствшо с соединением o6meii формулы Ьб-СНгХ (Щ) о где X имеет вышеуказанные значо)пи;Ьргалоген, фторсульфонкпокси, алкоксисульфонил, ТОЗШ10КСИ, диалкиланилин, простой диалкилэфир, диалкилсульфид или диалкил сульфоксид, с поспедующи% удалением за щитных групп. В качестве соединения .Щеи формулы (Ш ) предпочтительно используют этилфто сульфонат, диэтилсульфат или йодисты) этил. В качестве соединения общей формулы (Н ) предпочтительно использ тот з -М-4 -0-карбонип- 2,3,6-три-Н-трет-бу ксикарбонилси (в общей формуле (I) R Рр . водороду Rg - гидроксил;Z- группа формулы дд 1о |(4нсщ) Y - группа формулы Пример 1. UD-Карбонил-2 ,3,6-три-|(-трет-бутоксикарбонилсизоА. Пента-Ы-карбобензоксисизомицин. 25 г сизомицина и 13 г карбоната на трия растворяют в 625 мл дистиллирован ной воды. К перемещанному раствору при 25 С добавляют 100 мл карбобензоксихлорида. Твердые частицы отфильтровывают, тщательно промывают водой, сушат в вакууме и затем промывают гексаном. Получают 62 г пента-М-карбобензоксисизомицина в виде бесцветного аморфного твердого вещества, т. пл. 165 - 173°С, + 96,2° (). ИК cneKTp.(CHCe3) 3400 1720, 1513, 1215, 1050, 695. Б. TeTpa-N-Kap6o6eH30KCH-3 -N-4 -0-карбонилсизомицин. 5 г пента-Ы-карбобензоксисизомицина растворяют в 50 мл диметилформамида. К перемешанному раствору прибавляют 2оО мг пщрида натрия и реакционную смесь перемещивают в течение 2 ч при комнатной температуре в присутствии аргона, затем фильтруют, к фильтрату приливают 2 мл ледяно yKcycHOii кислоты и кониелтрируют его в вакууме. Остаток экстрагируют хлороформом (200 мл предварительно пропущенного через ocHOBHjT. окись алюминия), экстракт промыва от водоГ; и сушат над сульфатом натрия. Раствор упаривают и получают 3,5 г тетра-Н-карбооепзокси-3 -N-4 -0-карбон1шсизом1щина в В1ще аморфного порощка, т. пл. 210-213 С, 68,8 (с. 0,22%), ИК спектр,см : Лдддц ;-(нюГ)ол) 3550, 1840, 1760, 1580. В. 3 - N-4 -О -Kapбoнилcизo ицин. К раствору 10,1 г тетра-Л/-карбобензокси-З - Н -4 -0-карбонилсизомпцина в 2ОО мл тетрагидрофурана приливают 1 л жидкого (дважды перегнанного над натрием) и к перемещанному раствору добавляют небольщими порциями 6 г натрия. После перемешивания в течение 3 ч добавлением хлорида аммон1-ш удаляют избыток натрия. Растворитель упар шают под потоком азота. Остаток растворяют в воде и пропускают через смолу амберлит CJRC-50 (Н -форма), последнюю тщательно промывают водоГ) и затем продукт элюируют 2 Н. раствором гидроокиси аммония. Аммиачный элюат упар1тают в вакууме и получают 3 -N-4/-0-K;ap6oH iсизомицин. Выход примерно 1 г. ИКспектр, см 1(у,а() 1745. Этот продукт без дальнейщей очистки можно использовать для последующих ступеней. .Можно, однако,получить очень чистую пробу хроматографией продукта через силикагель, применяя нижнюю фазу системы растворителей хлороформ-метанол-концентрированная гидроокись аммония (1:1:1) в качестве элюента. Г, 3-Ы-4 -0-Карбонил-2 , 3,6-триЫ-грет. .-бугоксикарбонилсизомицин. 1,4 г (3 ммоль) )-карбонилсизомицина растворяют в 10 мл 50%-ного метанола, содержащего 3,5 ммоль триэтиламина, после чего при размещивании прикапывают 3,5 ммоль азида трет.-бутоксикарбонила. Смесь перемещивают в течение двух дней при комнатной температуре. Затем добавляют 5 мл ионообменной смолы амберлит ORA-40IS (ОН- форма) и 5 МП метанола и перемешивают в течение 30 мин. Далее смолу удаляют фильтрованием и промывают водой. Фильтрат концентрируют и остаток хроматографируют через колонну с силикагелем (60-100 меш, 20,0 г), применяя смесь хлороформ -метанол- гидроокись аммония (30:10: : 0,4) в качестве системь растворителе После этого смешивают гомогенные фрак ции, содержащие целевой продукт, и раст воритель удаляют упариванием в Остаток растворяют в метаноле и осажда ют избытком эфира. Твердое вещество вы , деляют ф1иьтрованием и cyinar, -f-К-Метилсизомицин из -0 - карбонка-2 ,3,б -три-1 трет.-бутоксикар бонилсизомгщина. 0,77 г з -М-4 -0-карбониЛ-2, 3,6-три - N -трет утоксикарбонилсизомицина растворяют в 20 мл тетрагидрофурана и охлаждают в ледяно ванне. Затем добавляют 0,12 г метилфторсульфоната и нагревают до комнатно температуры, после чего удаляют растворитель и остаток растворяют в трифторуксусноп кислоте. iI еле выдержки в течение 5 мин при комнатной температуре в вакууме удаляют трифторуксусную кислоту и остаток обрабатывают 10%-ным раствором гидроокиси кагп1Я в течение 5 ч при 100 С. Охлаясденны; раствор пропускают чере колонну ио ионообменной смолы амберлит DRC-50 (И ) и элюируют, 2н. водным рас твором подроокиси аммония. Элюент концентрируют и лиофилизируют с получением nfjporo целевого продукта, Последни хро матографирзаот через сш1икагель в нижней фазе Сдмеси растворителей хлороформ-мета нол-7 о-ная гвдроокись аммония (2:1:1), Получают -1-М-метилсизомицин, с4.Л-р.+ +153 (с 0,3%, Н2.О). Г р к м е р 2.-М Метилсизомицин. з -Ы-4 О-карбон ил -три-N-TpeT. бутоксикарроналсизомицин 25 мл тетрагидрофурана обрабатывают 101 мг метиламина -и мг ангидрида трифторметилсульфоново кислоты в течение 18 ч при О С. f-acTBop упаривают досуха, остаток растворяют в 10 мл диметилформамид-а и размешивают с 300. мг метилйодида и 130 мг карбоната калия в течение дальнейших 18 ч. Затем растворитель удаляют упариванием и остаток обрабатывают 10%-ным водным раствором гидроокиси калия в течение 12 ч и при 100 С. Охлажденный раствор пропускают через колонну с ионообменной смолой амберлит GRC-50 (). Сырой продукт элюируют 2 н. водным раствором гидроокиси аммония. Соединенные элюенты упаривают в досуха и остаток хроматографируют на 200 г сштикагеля в нижней фазе смеси растворителей хлороформметанол - 7%-ная гидроокись аммо- ншт (2:1:1). Получают -J-N-метатсизомипин, о1 + 153 (с 0,3/0, ); р 3,-i -Ы-Метилсизоминин. Т р и м е 0,77 г 2, 3, 6 - rpH-N -третХЗутоксикарбэнил-3-™ -4 -О-карбонилсизомицина в 100 мл дихпорметана обрабатывают 0,25г акрилонитрила и в; ;держ1-тают 24 ч при комнатной температуре. Затем растворитель удаляют в вакуу1 1г и растворенный в диметтшформамиде остаток обрабатывают 180 мг метилйодцца в течение 12 ч Q при 50 С. Далее растворитель зДаляют и остаток обрабатывают 10%-ным водным pacTr,oj)OM гидроокиси калия в течение 8 ч нри 100 С. Охлаждегиил;; раствор пропускают чере.з кэложу с ионообменной смо;:o;i a,бepaпт dkC-oO (Ht-if.iop.x-ia) и продукт элюируют 2 н. водным раствором ri-щроокиси аммония. Смешанные элюенты упаривают досуха в вакууме и остаток хроматографируют на 200 г силикагеля в нижней фазе смеси растворителей х.лороформметанол-7%-ная гидроокись аммония (2:1:1), Получают -i-1Ч-метилсизомицин, 153 (с 0,3%, HzO); Аналогично примерам 1-3 получают следующие соединения: g (н-пропил)-вердамицип, . 122 (с 0,3%, Н,0).26 LC(.-IT,+ 121 1 -М- (н-бутил)-вердам1щин (с 0,3%, ); -f-N- (н-бутил )-сизомици11, (с 0,3%, ); I | этилмутамицин 6, т. нл. 118-122 С (разл,),-.26 -| М (н проп1и)-сизомицин, ГС(.-Р, + 140 (с 0,3%, );26 1-М-этилантибиотик Q-52, Т) 122,1(с 0,3%, );3 - Н этилм тамицин 2, т. пл. 80-84 С; йС) -N-этилгeнтaмицин С, cLj 114 (с 0,3%, НуО); 2 -26о 4-этилгентамш1ин В, + 119,7 1 Ч-этилгептам1щнп С. ) (с 0,3%, );26О -1-М-этилантибиотик 3-20В, ld.,5 (с 0,3% ); р4 этилсизомицин, с СЗ-л+ 164 (с 0,3%, ). Строение новых соединений подтверждено данными ЯМР, ПМР- и масс-снектров. Пример 4„ Кислотноаддитивные соли. А. Сульфатные соли (аддитивные соли серной кислоты). 5,0 r-i-Н-этилсизомицина растворяют в 25 мл воды и доводят рН раствора 1 н. раствором серной кислоты до 4,5. Затем при сильном перемешивании раствор вли962вают в 300 мл метанола, продолжают пе ремешивать ewe 10-2О мин и фильтруют, Осадок промывают метанолом и сушат в вакууме примерно при 60 С. Получают сульфат i- эпиюизомнцнна. Б. Гидрохлорицн;ле солп. 5,0 г -Ni-эт1овердам1щина раст)зоря1-:;т в 25 мл воды, подкисляют 2 и. pacTacjpoM хлористоводородной кислоты до рМ о и ЛИОФ1ИИЗИpyijT. Получа; эт Г1щро :. - -М-этцаверд амидйна. Ф о р м у л а изобретения 1. Способ получения -f-N-замещенных произ-одмых 4,6-ди(аминогликоз1ш)-1,3-дпам 1 -:-;|;икл; толов o6uieii формулы vlfHCHaX где К , Ь(,,, R - водород; - nupoKcin; Z - группа формулы |( J t« Г N меют вышеуказанные знамулыCHjOH
Y -группы формул
С11зМн+
Г
V-Л
нн.
Сиз
С/ J-о
1-г
ш.
ifttj
он
У- f-pyi-nia Ьормулы
CHjNHj J-O
HoV-ЛNH
или К - FV имеют вышеуказанные значения;45Z - группа формулы
о
НО
шсн
-QH
у - 1руппа формулы
//
Авторы
Даты
1978-09-05—Публикация
1975-12-26—Подача