Изобретение относится к способу получения новых производных пиридо (2,3-d)пиримидина, которые являются исходными соеднненнямн в синтезе биологически активных пкримндинкарбоновых кислот. В лнтературе 1 описаны производные пиридо (2,3-d) пнримиднна общей формулы N И где R - морфолнно-, пиперидино-, пирролиднногруппа;R - водород, этил, обладающие высокой биологической активностью. Однако в литературе отсутствуют сведения о производных пиридо (2,3-d)пиримидина общей формулы , J N/и V где RI - водород, низший алкил, ацил; Rt - цианогруппа, низщнй алкокснкарбонил, низший алканоил. Использование известной в органической химии реакции циклизации этил-4-(этил-2-цианоэтил)-амино-2-фенилпиримнднн-5-карбоксилата под действием этилата натрия с образованием соответствующего производного тетрагидропиридо(2,3-d) пиримидина 2 применительно к производным пиримидина общей формулы II г- R,-li JЦ S-CKj-CHj-, i l«rftI где RI и Rj имеют указанные значения; Rj - низщий алкил. гюзвадило получить новые производные пиpHflo(2,3-d) пиримидина, общей формулы , являющиеся полупродуктами в синтезе био логически активных соединений. Согласно изобретению предложенный способ получения производных пиридо (2,3-d) пиримидина общей формулы заключается в том, что производное пиримидина общей формулы П подвергают взаимодействию с сильным основанием, например гидридом натрия, в среде инертного органического растворителя, например диметоксиэтана, диоксана, диметилового эфира этилеигликоля, предпочтительно при нагревании, например при температуре кипения реакционной смеси, гтолученное при этом соединение общей формулыо .-0-Ч где RI и Rz имеют указанные значения, подвергают дегидрированию, предпочтительно хлоранилом при кипячении в среде бензола, с последующим выделением целевого продукта. Из ацильных групп, обозначенных символом Rb могут быть выбраны формильная, ацетильная, этоксикарбонильная, бензилоксикарбонильная и бепзонльная группы, особенно предпочтительна ацетильная группа. Под низшей алкильной группой, обозначенной символом RI, подразумевается алкнльная группа, имеющая 1-4 углеродных атомов, например метнльная, этильная или бутильная группа. Предпочтительны метильная и этильная группы. Под низшей алкоксикарбонйльной или низшей алканоильной группой, обозначенными символом RS, подразумевается соответственно алкоксикарбонильная или алканоильная группа, содержащая 2-5 углеродных атомов, например этоксикарбонильная, метоксикарбонильная, пропоксикарбонильная, ацетильная или пропионильная группа. Реакция циклизации протекает при нагревании в растворителе в присутствии основного катализатора, обычно используемого в реакции Дикмана, например металлического натрия или калия, гидрида натрия или этоксида натрия, способствующего реакции внутримолекулярной циклизации исходного соединения с образованием соединения II. В этой реакции можно достичь лучших результатов, если добавить каталитическое количество метанола, этанола или лк)бого другого низшего спирта. В качестве растворителей для использования в этой реакции пригодны такие ароматические углеводороды, как бензол или толуол, такие эфиры. как дкоксан, тетрагидрофуран, 1,2-диметокСИЭТЛ НОЛ или диметиловый эфир диэтиленГ.МНКОЛЯ. Температура реакции практически не ограничение предпочтительна температура { 0--180 С. Соединение II и какой-либо известный агент дегидрогенизации, такой как 2,3-дихлор-5,6-дициано-1,4-бензохинон, тетрахлрр-1,4-бензохинон (хлоранил), тетрацианоэтилен, палладийуглерод, N-бромсукцинимид, двуокись марганца или двуокись селена, совместно нагревают в течение короткого промежутка времени при температуре, близкой к температуре кипения взятого растворителя. Соединение П можно нагревать в среде названного растворителя без использования агента дегидрогенизации или соединение П можно непосредственно нагревать до температуры, превышающей Точку его плавления, в результате чего образуется соединение 1. Предпочтителен инертный растворитель, например ароматический углеводород, такой как бензол, толуол, или ксиЛол, эфир, такой как диоксан, или спирт, как метанол или этанол. Температура реакции 60- 2бО°С. Пример I. 8-Этил-2-(4-метил-1-пнперазинил)-5,8-дигидро-5-оксопнридо (2,3-d) пиримидин-б-карбоновая кислота. Смесь, содержащую 3,0 г 8-этил-2-(4-метил-1-пиперазинил)-5,8-дигидро-5-оксопиридo(2,3-d)пиpимидин-6-кapбoнитpнлa, 270 мл уксусной кислоты и 150 мл концентрированной соляной кислоты, нагревают при 90°С 25 ч. Затем смесь выпаривают под вакуумом досуха. Полученный остаток подвергают нейтрализации путем добавления 5°/о-ного йодного раствора гидроокиси натрия и экстрагируют хлороформом. После высушивания экстракт выпаривают, получают кристаллический остаток, который затем перекристаллизовывают из этанола и получают 2,6 г продукта, т.пл. 232-233°С. Пример 2. 8-Этил-2-(4-этил-1-пиперазйнил) -5,8-днгидро-5-оксопиридо (2,3-d) пиримидин-6-карбоновая кислота. Повторяют ту же процедуру, что описана в примере 1, но с использованием 8-этил-2- (4-этил-1 -пиперазинил) -5,8-днгидро-5-оксопиpидo(2,3-d)пиpимидин-6-кapбoнитpилaПoлученный продукт имеет т.пл. 228-230°С. Пример 3. Гидрохлорид 8-этил-5,8-дигидро-5-оксо-2-(1-пиперазинил)-пиридо (2,3-d)nHримидин-6-карбоновой кислоты. Смесь, содержащую 5,0 г 2-(4-ацетил-1-пиперазинил)-8-этил-5,8-дигидро-5-оксопиридо (2,3-d) пнримидин-6-карбонитрила, 200 мл уксусной кислоты и 200 мл концентрированной соляной кислоты, нагревают 3 ч при 90°С. Смесь выпаривают под вакуумом досуха. К полученному остатку добавляют небольшое количество концентриропанной соляной кислоты. Образовавшийся гндрохлорид собирают и промывают этанолом, получают 4,7 г продукта с т.пл. выше 300°С. Пример 4. 8-Этил-5,8-дигидро-2-{4-метил-l-пипepaзинил)-5-oкcoпиpидo(,3-d)пиpимидин-6-карбоновая кислота. К растаору гигюбромида натрия, полученного добавлением 3,8 г брома к смеси, содержащей 10 мл диоксана и 16 мл 15%-ного водного раствора гидроокиси натрия, при охлаждении до температуры ниже 10°С добавляют 2,0 г 6-ацетил-8-этил-5,8-дигидро-2-(4-метил-1-пиперазинил)-5-оксопиридо(2,3-d)пиримидина при постоянном перемешивании. После выстаивания смеси в течение 2 ч при комнатной температуре бромоформ, образовавшийся в качестве побочного продукта реакции, удаляют экстракцией хлороформом. Водный щелочной слой нейтрализуют уксусной кислотой, выпадает кристаллический осадок, который собирают и перекристаллизовывают из разбавленного этанола. При этом получают продукт с т.пл. 232--233°С. Пример 5. Этил-8-этил-2-(4-метил-1-пиперазинил) -5,8-дигидро-5-оксопирндо(2,3-д) пиримидин-6-карбоксилат. К раствору 3 г этил-8-зтил-2-(4-метил-1-пиперазинил)-5-оксо-5,б,7,8-тетрагидропиридо(2,3-д)пиримидин-6-карбоксилата в 100 мл сухого бензола добавляют 2,8 г хлоранила и в течение 30 мин смесь нагревают с обратным холодильником. После охлаждения выпавщий осадок отфилътровывают и кристаллизуют из диметнлформамида, получают 2,8 г продукта с т.пл. 146-147°С. Пример 6. 8-Этил-2-(4-метил-1-пиперазинил)-5,8-дигидpo-5 oкcoпиpидo(2,3-d)пиpимидин-6-карбонитрил. 2 г 8-этил-2-(4-метил-1-пиперазинил)5-oкгo-5,6,7,8-тeтpaгидpoпиpидo(2,3-d)пиpимидин-6-карбонитрила непосредственно нагревают при 220°С 7 мин и после охлаждения перекристаллизовывают из метанола, получают 1,7 г продукта с т.пл. 255-258°С. Пример 7. Этил-8-этил-2-(4-метил-1-пиперазинил) -5,8-дигидpo-5-oкcoпиpидo{2,3-d) пиримидин-6-карбоксилат. К раствору 4,0 г этил-4-(этил-2-этоксикарбонилэтил) -амино-2- (4-метил-1 -пиперазинил)-пиримидин-5-карбоксилата в 10 мл 1,2-диметоксиэтана добавляют 0,75 г 50°/о-ного гидрида натрия и смесь нагревают с обратным холодильником. После удаления растворителя полученный остаток нейтрализуют уксусной кислотой и экстрагируют хлороформом. Экстракт промывают водой, сушат безводным сульфатом натрия, растворитель отгоняют и получают промежуточный продукт, который в случае необходимости перекрнсталлизовывают из смеси н-гексан-ацетон с образованием 8-этнл-2- (4-метил-1-пиперазинил)-5-oкco-5,6,7,8-гeтpaгидpoпиpидo(2.3-d) пиримидин-6-карбоксилата в чистом виде. т.пл. 97-100°С. Полученный таким образом промежуточный тетрагидроэфир растворяют в бензоле и смесь нагревают с обратным холодильником 1,5 ч. Выпавшее после охлаждения вещество отфильтровывают и перекристаллизовывают из диметнлформамида, получают продукт с т.пл. 146-147°С. Пример 8. 8-Этил-2-(4-метил-1-пиперазйиил)-5,8-дигидpo-5-oкcoпиpидo(2,3-d)пиpими дии-б-карбонитрил. К смеси, содержащей этнл-4-(этил-2-цианоэтил)-амино-2-(4-метил-1-пиперазинил )1Мримидин-5-карбоксилат и 10 мл диоксана, добавляют 0,8 г 50%-ного гидрида натрия при комнатной температуре и постоянном перемешивании и смесь нагревают 30 мин с обратным холодильником. После удаления растворителя полученный остаток нейтрализуют уксусной кислотой и экстрагируют хлороформом. Экстракт обрабатывают, как в примере 7, и получают промежуточное соединение, которое в случае необходимости перекристаллизовывают из «-гексана-ацетона с образованием 8-этил-2-(4-метил-1-пиперазинил) -5- OKCO - 5,6,7,8 - тетрагидропиридо(2,3-d}пиpимидин-6-кapбoнитpилa в чистом виде, т.пл. 172-174С. Тетрагидрокарбокитрил растворяют в 100 мл обезвоженного бензола и к раствору добавляют 2,5 г хлоранила. Смесь нагревают 30 мин с обратным холодильником. Выпавшее после охлаждения вещество отфильтровывают и перекристаллизовывают из мет нола, в результате получают 2,9 г продукта с т.пл. 255-258°С. Пример 9. 2-(4-Ацетил-1-пиперазинил)-8-этил-5,8-дигидpo-5-oкcoпиpидo(2,3-d)пиpимидин-6-карбонитрил. К смеси, содержащей 5,0 г этил-2-(4-ацетил - 1 -пиперазинил) - 4 -(этил-2-цианоэтил)-аминопиримидин-5-карбоксилата и 50 мл диметилового эфира этиленгликоля, добавляют 2,0 г 50%-ного гидрида натрия. Затем смесь 1 ч нагревают при 95°С. Смесь выпаривают под вакуумом до постоянного веса и полученный остаток нейтрализуют уксусной кислотой и экстрагируют хлороформом. Растворитель выпаривают из экстракта, получают промежуточное соединение масляной консистенции - 2-(4-аце1ИЛ-1-пиперазинил)-8-этил-5-oкco-5,5,7,8-тeтpaгидpoпиpидo(2,3-d) пиримидик-6-карбонитрил. Без последующей очистки полученный нитрил растворяют в 50 мл бензола и добавляют к раствору 2,5 г хлоранила. В течение 30 мин смесь нагревают с обратным холодильником. Припавшее после охлаждения пещсстпо отфильтровывают, промывают бензолом и перекристаллизовывают из метано-па, получают 3,4 г продукта с т.пл. 317°С. Пример 10. Этил-2-(4-ацетил-1-пипера.чинил)-8-этил-5,8-дигидро-5-)КСОпиридо(2,3-и) 1 иримидин-б карбоксилат. Следуя методике, описанной в примере 9. но используя в качестве исходного материала этил-2-(4-ацетил-1-пиперазинил)-4-(этил-2-этоксикарбонилэтил)-аминопирнмидин-5««арбоксилат, получают продукт, т.пл. которого 208-210°С (с разложением). Пример 1/. 6-Ацетил-8-этил-5,8-дигидро-2- (4-метил-1- пиперазинил)-5-оксопиридо(2,3-d) пиримидин. Следуя методике, описанной в примере 9, но используя в качестве исходного соединения этил-2-(4-ацетил-1 -пиперазинил)-4- (этил -3-оксобутил) -аминопиримидин-5-карбоксилат, получают продукт, т.пл. которого 198- 200°С. Пример 12. 8-Этил-5,8-дигидро-5-оксо-2-{I -пиперазинил) -пиридо (2,3-d) пиримидин-6-карбоновая кислота. Используя в качестве исходного соедииения 5,0 г (4-этйл-2-этоксикарбонилэтил)-амино-2- (1 -пиперазинил) -пиримидин-5-карбоксилата, тем же способом, что в примере 9, получают промежуточное соединение - этил-5,8-дигидро-8-этил-5-оксо-2-(1-пиперазинил -пиpидo(2,3-d)пиpимидин-6-кapбoкcилaт. При желании это промежуточное соединение перекристаллизовывают из .ацетона, т.пл. чистого вещества 156-158°С. Карбоксилат растворяют в 30 мл 7%-ного водного раствора гидроокиси натрия при нагревании в течение 20 мин при 90С, После охлаждения полученный раствор нейтрализуют уксусной кислотой, получают в осадке вещество, которое отфильтровывают, перекристаллизовывают из диметилформамида. Таким образом получают 4,3 г продукта, т.пл. 253-255°С. Пример 13. 8-Этил-5,8-дигидро-5-оксо-2-(1 -пиперазинил) -пиридо (2,3-d) пиримидин-б-карбоновая кислота. Используя в качестве исходного соединения 10,0 г этил-(4-этил-8-оксобутил)-амино-2- (I -пиперазинил) -пиримидин-5-карбоксилата, на основе методики, описанной в примере 9, получают 6-ацетил-8-этил-5,8-дигидро -5- оксо -2- (I -пипepaзинил)-пиpидo(2,3-d)пиримидин. Промежуточное соединение в количестве 7,8 г без дополнительной очистки обрабатывают и окисляют, как в примере 4, получают продукт с т.пл. 253-255°С. Пример 14. Этил-4-(этил-2-этоксикарбонил9тил)-амино-2-(4-метил-1-пиперазинил)-пиримидин-5-карбоксил ат. К раствору 3,9 г этил-4-хлор-2-(4-метил-i -пимеразинил) -пиримидин-5-карбоксилата н 10 мл диметилового эфира диэтиленгликоля добав.чяют 2,4 г этил-3-этиламинопропионата и 1,3 г бикарбоната натрия. Полученную смесь 2 ч нагревают при 140-ISO C. После удаления растворителя остаток помепгают в хлоро4н рм. Хлороформениый растнор промывают водой, сушат и выпаривают, образуется маслянистое вещество, которое пропускают через силикагель с хлороформом в качестве элюента, получают продукт в чистом виде. Структура его подтверждена ИК-спектрами и спектром ЯМР. Пример 15. Этил-4-(этил-2-цианоэткл)-амино-2-(4-мет ил-1-пиперазинил )-пиримидин-5-карбоксилат. Следуя методике, описанной в примере И, и используя 1,6 г 3-этиламинопропионитрила вместо этил-3-этиламннопропионата, получают маслянистый продукт. Пример 16. 5,8-Дигидро-8-этнл-2-(1-пиперазинил)-5-оксопиридо (2,3-d) пирнмидин-6-карбоновая кислота. 5,0 г этнл-5,8-днгидро-8-этил-5-оксо-2-(1-пиперазинил) - пиpидo(2,3-d)пиримидин-6-карбоксилата растворяют в 30 мл Т /о-ного водногораствора гидроокиси натрия, нагревая при 90°С 20 мин. После охлаждения полученный раствор нейтрализуют уксусной кислотой, выпадает осадок, который отфильтровывают и перекристаллизовывают из диметилформамида. Таким образом получают 4,3 г продукта с т.пл. 253-255С. Пример 17. 5,8-Дигидро-8-этил-2-(4-метил-1-пиперазинил)-5-оксопиридо (2,3-tl) ни- . римидин-6-карбоиовая кислота. 4.5г пропил-5,в-дигидро-8-этил-2-(4-метил-1-пиперазинил) -5-оксопиридо (2,3-d) пи- , римидин-6-карбоксилата растворяют в 30 мл lOVo-Horo водиого раствора карбоната иатрия при нагревании в течение 30 мин при 95°С. После охлаждения полученный раствор нейтрализуют уксусной кислотой, выпадает осадок, который отфильтровывают и перекристаллизовывают из диметилформамида. Таким образом получают 3,8 г продукта, т.пл. которого 232-233°С. Припер 18. 5,8-Дигидро-8-этил-2-(1-пиперазинил) -5-оксопиридо (2,3-d) пиримидин-6-карбоиовая кислота. 1.6г этил-2-(4-ацетил-1-пиперазинил)-5,8-дигидро-8-этил-5-оксопиридо (2,3-d )пиримидин-6-карбоксилата растворяют в 30 мл Ю /оного водного раствора гидроокиси натрия при нагреваиии в течение J ч при 90-95°С. В результате нейтрализации реакционной смеси уксусной кислотой после ее охлаждения получают твердое вещество, которое перекристаллизовывают из диметилформамида и получают 1,1 г продукта в чистом виде. Формула изобретения I. Способ получения производных пиридо(2,3-Н)пиримиднна общей формулы
TTY
Л,-к (П
Ч
С2«5 .
где Ri - водород, низший алкил, аиил; Ri - цианогруппа, низший алкоксикарбонил, низший а.:1каноил, отличающийся тем, что производное пиримидина общей формулы
N N-COORj
- ,-сн-в
J( 2
СгНб
(II)
где RI и R имеют указанные значения;
Ra - низший алкил,
подвергают взаимодействию с сильным основанием; напри.мер гидридом натрия, в среинертного органического растворителя, например диметоксиэтана, дйоксана, диметилового эфира этиленгликоля, полученное при этом соединение общей фор.мулы
О
-1 у-4 X J
(III)
N N
HS
где RI и Ra имеют указанное значение; подвергают дегидрированию с последующим выделением целевого продукта.
2.Способ по п. 1, отличающийся тем, что взаимодействие с гидридом щелочного металла осуществляется при нагревании, например при температуре кипения реакционной смеси.
3.Способ по п. 1, отличающийся тем, что дегидрирование осуществляют хлоранилом при кипячении в среде бензола.
Источники информации, принятые во внимание при экспертизе;
1.Патент США № 3673184. кл. 260/247, 2R, 1972.
2.Патент США .Чо 3641027, кл. 260-256.4F, 1972.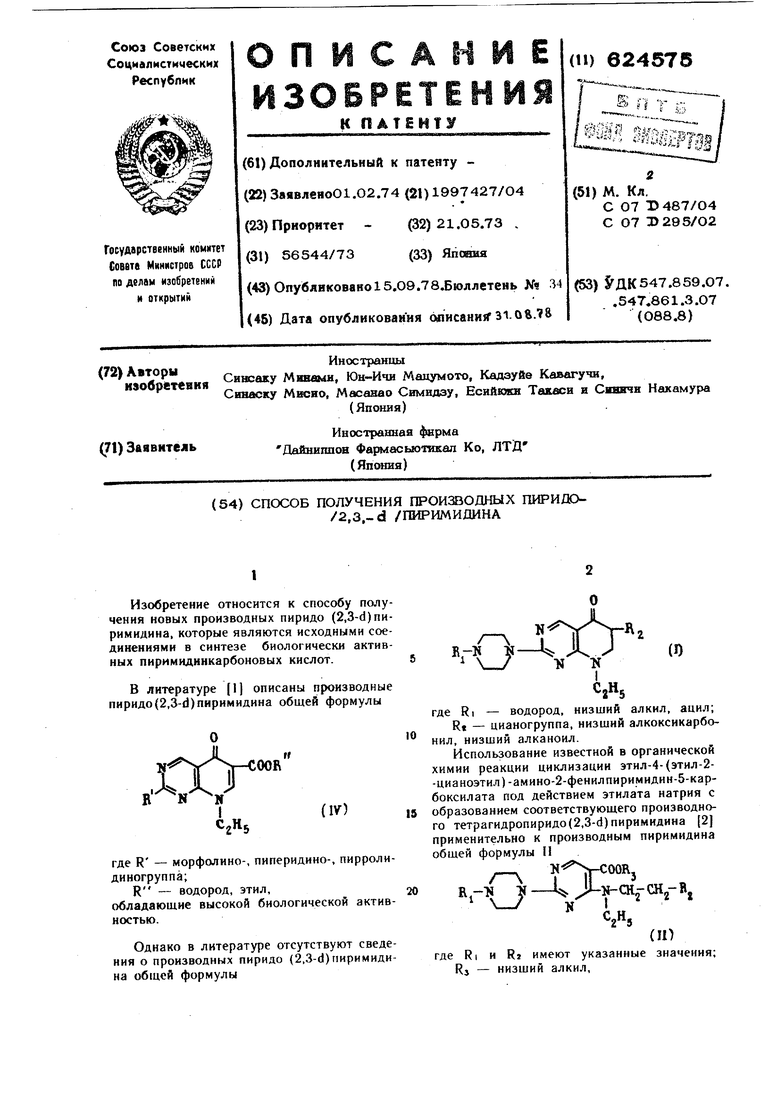






Авторы
Даты
1978-09-15—Публикация
1974-02-01—Подача