#N.X 4 CeKHCHCONH
Ч |Г Л
-,
, 11 т I
рснз и-1
Со он
Соединения . I могут существовать в виде гидратов.
Известен способ получения О-изомеров производных (-(5,8-дигидро-Ь-оксопиридо 2,3-dj пиримидин 6-кар6оксамидо)-бенэилпенициллина, в частности, содержащих в положении 2 пиримидинового ядра амино- или диалкиламиногруппу, ацилирование о -амино-п-оксибензилпенициллина соответствующей карбоновок кислотой или ее производным l .
Целью предлагаемого изобретения является создание новых пенициллиновых соединений с повышенной антибактериальной активностью по отношению к грамм-положительным бактериям и грамм-отрицательным бактериям.
Другой целью изобретения является создание НОВЕЛХ пенициллиновых соединений, обладающих повьш енной антибактериальной активностью по отношению к микроорганизмам рода Pseudomohas, включая Pseud отonas aJruginosa, к бактериям, устойчивыг-i к ампициллину, и обладающих весьма небольшой токсичностью по отношению к теплокрОЕНЬкл животнь1М, включая человека
Эта цель достигается основаиньИ/; ка известной реакции настоящим способом получения О -изомеров произэодных пенициллина формулы I или их солей, который заключается в том, что соединение формулы tI, представлкмщее собой 2-замещекную пиридопири чи динкарбоновую кислоту О
где R имеет вышеуказанные значения, или его со.ль или реакционноспособное; производное, образуемое карбоксильной группой, выбранное из группы, включающей ангидрид, эфир, амид, галоидангидрид, азид, подвергают взаимодействию с 0-6-о6-амино-п-оксибензилпенициллином формулы I i (называемое как АОБП)
ОН
или с его солью или его эфиром по карбоксильной и г-идроксильной группам, при тгэмпературе от -40 до +40° С в водном или безводном растворителе, и полученный продукт в случае, если он представляет собой эфир, подвергают гидролизу или каталитическому гидрогенолизу и выделяют целевой продукт в виде свободной кислоты или а виде фармацевтически приемлемой золи.
Замеи)енные у карбоксильной i-py; iiu реакционноспособные прон.дводные 2-замещенной пиридопиримидинкарбоновоИ кислоты формулы 1I, .включают ангидриды, образованные такими кислотами, как алкилугольные, например, этилугольная, изопропилугольная или изоили втор-бутилугольная кислота, алкилкарбоновые, например триметилуксусиая, валериановая, изовалериановая, 2-этилмасляная или 2-этилгексановая кислота, фосфорные, например, диэтилфосфорная кислота С; или сульфокислоты, например метансульфокислота; реакционкоспособные сложные эфиры, такие как п-нитрофе1 иловый эфир, трихлорфениловый эфир, п-нитрофенилтиозфир, сложный эфир N-оксипиперидина, N-оксисукцинимида или N-оксифталимида; реакционноспособные амиды как N-карбонилимидазол или N-карбонилтетразол; галоидангидриды, такие, как хлорангидриды; или азиды кислот.
Производными, превращаемыми соед} ;нение формулы I I I являются триэтилсилиловый сложный эфир, трифенил 1етиловый сложный эфир, п-нитрсбензи,1овый хсложный эфир и фенациловый эфир. Можно также использовать производные, получаемые блокированием гидроксильной группы бензольного кольца, например производные с этоксикарбонильной или бензилоксикарбокильной группой.
Неорганические или органические соли 2-замещенной пиридопиримидинкарбоновСй кислоты формулы I t и/или с/;га-мино-п-оксибензилпенициллина (АОБП) формулы III включают соли .j4Hb;x. металлов , такие как соли нат-:.i:-; или калия, или соли с органичес;сиУ1и основаниями, такими,как триг-тиламкн или М-эт -:лморфолин.
Вышеуказанную реакцию проводят в течение 1-1Э ч в среде растворителя, :;:: эдпочтительно в присутствии основа1:-- Я. Растворитель, основание и другие условия реакции в основном соответстйуют применяемым в химии пеницилликон Например, при использований ангидрида 2-за;иещенной пиридопиримидинкарбоновоИ к-ислоты формулы I I и этилового эфира хлормуравьиной кислоты реакцию осуществляют при охлаждении или при комнатной температуре в присутствии третичного амина, такого, как триэтила; 1ин или N , N-диметйланилин , в инертном растворителе, таком, как ацетон, тетрагидрофуран, диметилформамид. хлорофОрм, дихлометан или гексаметилфосфорамид, в смеси таких инертных растворителей, в воде или безводном органическом растворителе.
При использовании сложного эфира М оксисукцинимида 2-заме1Денной пиридопиримидинкарбоновой кислоты формулы ( ( Г ), реакцию осуществляют при в течение 1-2 ч в присутствии основания, такого, как триэтиламин,
лутидин, гидроокись натрия или карбонат натрия, в диметилформамиде, дихлорметане, диоксане, воде или смеси этих растворителей.
Реакцию 2-замещенной пиридопиримидинкарбоновой кислоты формулы I I или ее соли с АОБП формулы III или ее солью преимущественно осуществляю в присутствии конденсирующего средства, такого, как N,N-дициклогексил- карбодиимида.
При реакции 2-Зс1мещенной пиридопиримидинкарбоновой кислоты формулы II или ее соли, или ее реакционноспособного производного карбоксильной группы с производным, превращаемым в АОБП формулы III, в условиях реакции иногда происходит образование продукта реакции, содержащего остаток ДОВП превращаемый в пенициллиновое соединение данного изобретения. Например, это может быть, если карбоксильная группа продукта реакции находится в виде сложного эфира, например силилового эфира, или если гидроксильная группа, присоединенная к бензольному кольцу продукта реакции, блокирована например, ацилом, В таких случаях продукт подвергают последующему гидролизу или каталитическому гидрогенолизу с образованием пенициллиновых соединений данного изобретения.
При желании, образующееся пенициллиновое соединение формулы .(I) можно преврацдать в его нетоксичную фармацевтически приемлемую соль.
Карбоновую кислоту превращают в соль обработкой веществом основного характера, например 2-этилгексаноато натрия, гидроокисью натрия или карбонатом натрия.
Соль, с другой стороны, можно обрабатывать веществом кислого характера с образованием свободной карбоновой кислоты.
Примеры, приведенные ниже, иллюстрируют получение как исходных, так и целевых продуктов.
Получение исходных продуктов.
Пример 1. К дифениловому эфиру (16 мл) при температуре 250255С добавляют при перемешивании дйэтиловый эфир (4-aцeтил-l-пипepaзинил)-4-пиpимидинил -aминoмeтилмaлoнoвoй кислоты (2,0 г). Смесь осторожно кипятят с обратным холодильником в течение 10 мин, а затем постепенно охлаждают до комнатной температуры. К смеси добавляют н-гексан (12 мл). Полученный осадок собирают, промывают этанолом и перюкристаллизовывают из этанола, что приводит к получению этилового эфира 2-(4-ацетил-1-пиперазинил)-5,8-дигидро-5-оксопиридо 2,3-dJ пиримидин-6-карбоновой кислоты (1,52 г);т.пл. 300-302°С (разложение).
Пример 2. Суспензию этилового эфира 5,8-ДИГЙДРО-2-(4-ацетил-1-пиперазинил) -5-оксопиридо 12 , J-dlniiримидин-6-карбоновой кислоты (1000 г) и концентрированной соляной кислоты (800 мл) в смеси воды (12(ГО мл) и этанола (1000 мл) кипятят с обратным холодильником и оставляют на ночь. Выпавшие в осадок кристаллы собирают, промывают этанолом и растворяют при нагревании в водном растворе (10 л) гидроокиси натрия (250 г).Раствор фильтруют, доводят рН до 7-8 доДавлением уксусной кислоты и выдерживают в течение ночи при охлаждении льдом. Кристаллический оса,цок собирают, промывают водой и высушивают при 110°С с получением 5,8-дигидро-2-(1-пиперазинил)-5-оксопиридо 2,3-d пиpимидин-б-кapбoнoвoй кис- лоты (625 г); т.пл. 299-305°С (раз-, ложение).
Вычислено для С Н н Q .
С 52,36; Н 4,76; N 25,45.
Найдено,%: С 52,18; Н 4,63; N 25,32.
Пример 3. К уксусному ангидРИДУ (200 мл) охлаждаемому на ледяной бане, добавляют муравьиную кислоту (140 мл). Раствор нагревают при 5оС в течение 15 мин, а затем охлаждают до 5°С. К раствору добавляют 5,8-ДИГИДРО-2-(1-пиперазинил)-5-оксопиридо 2,3-б пиримидин-6-карбоновую кислоту (70 г). Смесь нагревают при 80°С в течение 3 ч, а затем охлаждают . Впавшие в осадок кристаллы собирают фильтрованием и промывают этиловым эфиром. Получают 5,8-дигидро-2-(4-формил-1-пиперазинил)-5-оксопирйдо 2,3-d пиpимидин-6-кapбoнoвyю
кислоту (72,5 г); т.пл. выше 300°С.
Вычислено для %5
С 51,48; Н 4,32; N 23,09.
Найдено,%: С 51,41; Н 4,47; 23,04.
Пример 4. По методике, описанной в примере 3, получают 5,8-дигидро-2-(4-ацетил-1-пиперазинил)-5-оксопиридо 2,3-d пиримидин-6-карбоновую кислоту (933 г) из 5,8-дигидро-2-(1-пиперазинил)-5-оксопиридо t2,3-d 3 пиримидин-6-карбоновой кислоты (900 г) и уксусного ангидрида
(3200 мл); т.пл. 298-300С.
Вычислено для , %: С 52,99; Н 4,77; N 22,07.
Найдено,%: С 52,92; Н 4,57; N 21,91.
Пример 5. Суспензию 5,8-дигидро-2-(4-формил-1-пиперазинил)-5-оксопиридо f2,3-d пиримидин-6-карбановой кислоты (273 г) и триэтиламина (299 мл) в высушенном дихлорметане
(3500 мл) тща;тельно перемешивают при комнатной температуре в течение одного часа. К суспензии добавляют по каплям изопропиловый эфир хлормуравьиной кислоты (221 г) при охлаждении
при , и реакционную смесь перемешивают в точение 2 ч. К смеси лобавляют раствор N-OKCucyKuHHitMiuia (207 г) в димь тилформамиде (350 мл) , и полученную смесь вьщерживают при в теченне еще 2 ч. KpHCTajiimческий продукт собирают фильтрование и промывают последовательно водой (2000 мл) и ацетоном (2000 мл) с получением ,8-ДИГИДРО-2-(4-формил-1-пиперазинил-) -5-оксопиридо 2 , 3-d пиримидин-б-карбонилокси -сукцинимида (326 -г); т. гтл. вшие . Вычислено для , %:
С 51,оо; н 4,03; N 20,99.
Вычислено, %: С 50,70, Н 3,89, N 2 О , 8 4 .
Пример 6. Суспензию 5,8-дигидро-2-(4-формил-1-пиперазинил)-5-оксопиридо 2 ,3-d пиримидин-6карбоновой кислоты (6 г) и триэтиламина (6,1 л) в высушенном дихлорметане (100 мл) тщательно перемешивают при комнатной температуре в течение одного часа. К суспензии добавляют по каплям этиловый эфир хлормуравьиной кислоты (3,9 мл) при 0-5°С, и реакционную смесь перемешивают в течение одного часа при те 1пературе . Нерастворимый материал отфильтровывают и к фильтрату добавляют раствор N-оксифталймида (7,19 г в дйметилформамиде (10 мл). Полученную смесь вьщерживают при комнатг;ок температуре в течер1ие 2 ч. Кристаллический продукт собирают фильтрованием и пpo 1ывaют последовательно дихлорметаном и ацетоном с получением ,8-дигидро-2(-4-формил-1-пиперазинил)-5-оксопиридо 2,3-d пиримилин-б-карбонилокси -фталимида (8,4 г); т.пл. 288-285°С (разложением). Подсчитано для Cj-iH е 6 С 56,25; Н 3,60; N 18,74.
Найдено,%: С 56,03, Н 3,54, N 18,59.
П р и м е р 7. Суспензию 5,В-дигидро-2-(4-формил-1-пиперазинил)-5-оксопиридо 2 , 3-d пиримидин-б-карбоновой кислоты (6 г) и триэтиламина (6,1 мл) в высушенном дихлорметане (100 мл) интенсивно перемешивают при комнатной температуре в течение 1 ч. К суопензии добавляют этиловый эфир хлормуравьиной кислоты (3,8 мл) при 0-5с и реакционную смесь перемешивают в течение 1 ч при 5-7с. Нераствор мый материал отфильтровывают, и KJфильтрату добавляют раствор 2,4, б-офкхлорфенола (8,68 г) в дихлорметане (30 мл). Реакционную смесь выдерживают при комнатной температуре в течение 3 ч. Кристаллический продукт собирают фильтрованием и промывают дихлорметаном с получением :, 4 , &-трихлорфенилового эфира 5,8-дигидро-2-(4-формил-1-пипора :шнил)-5-оксопиридо 2,3-d пиримидин-б-карбонспой кислоты (8,2 г); т.пл. 285290 С; (разложение).
,3 С 47,28; Н 2,29; N 14,51.
Найдено,: С 47,12; Н 3,22; N .15,72.
Получение целевых продуктов.
Пример 1. К водному раствору (2000 мл) гидроокиси натрия (22 г) добавляют последовательно при 0-2°С при охлаждении O-rf-амино-п-оксибензилпенициллин (230 г) и ,8-дигил.ро-2- ( 4-формил-1-пиперазинил) - 5 -оксопиридо р , 3-d пиримидин-6-карбонилокси -сукцинимид (200 г) и смесь перемешиваьпт в течение 30 мин. К смеси добавляют 1 н раствор гидроокиси натрия (550 мл) и полученную смесь 5 выдерживают в течение еще 1 ч, а затем фильтруют.
К фильтрату добавляЮТ ледяную воду (3000 мл). Значение рН раствора доводят до 2 добавлением 10% соляной кислоты. Выпавший осадок собирают фильтрованием, промывают дважды ледяной водой (4000 мл) и растворяют в достаточном объемном количестве 4% раствора гидроокиси натрия для доведения значения рН до 6,5. Водный раствор отфильтровывают, и фильтрат лиофилиэируют. Получают натриевую соль D-oL- Ъ , 8-ДИГИДРО-2- ( 4-формил-1-пиперазинил)-5-оксопиридо 2,3-d пиримидин-б-карбоксамидо -п-оксибензилпенидилЛина (324 г).
ИК-спектр (КВг) : л) С О 1760 см .
Спектр ЯМР (ДМСО Ль,):
N-CHO) ;
,.„ 78,10, (1Н, синглет, -N
(1Н, синглет,у С0) )
К
, 3.8HZ, --- г-ОН-со- )
(1Н, дуплет
)
(1Н синглет.
Вычислено, для Од SNa 2Н20 , % :
С 49,15; Н 4,69; s 4,53} N 15,8l: .
Найдено, %: С 49,11; Н 4,78; N 15,75; S 4,63.
Пример 2. К раствору D-oi.-амино-п-оксибенэилпенициллина
(230 г) и триэтиламина (76 мл) в высушенном дйметилформамиде (1000 мл) добавляют N- 5 ,8-ДИГИДРО-2-(4-формил-1-пиперазинил)-5-оксрпиридо- 2, 3-d пиримидин-6-карбонилокси -сукцинимид (200 г) при 0-2°С и реакционную смесь перемешивают в течение
1,5ч. К смеси добавляют последовательно 30%-ный раствор 2-этилгексаноата натрия в н-бутаноле (335 мл) и ацетон (7000 мл). Выпавший осадок собирают фильтрованием, промывают ацетоном и растворяют в ледяной воде. ВоднЕ й раствор подкисляют 10% соляной кислотой, и кристаллы собирают фильтрованием, тщате льно промывают водой и растворяют в 2% растворе гидроокиси натрия. Значение рН раствора доводят до 6,5 и раствор фильтруют. Фильтрат лиофилизируют, и получают натриевую соль D-oi-fS , 8-дигидро-2-(4-формил-1-пиперазинил)-5-оксопиридо 2 ,3-d}пиримидин-б-карбоксамидо -п-оксибензилпенициллина (289 г).
Это соединение идентифицируют с соединением примера 1 путем сравнения ИК-спектра и спектра ЯМР.
Пример 3. К раствору D-Q/,-амино-п-оксибензилпенициллина(4,61 г) и триэтиламина (1,53 мл) в высушенном диметилформамиде (30 мл) добавляют ,8-дигидро-2-(4-формил-1-пиперазинил)-5-оксопиридо 2, 3-d пиримидин-6-карбонилокси -фталимид (4,48 г) и реакционную смесь перемешивают при комнатной температуре в течение 1 ч. Нерастворимый материал отфильтровывают, и к фильтрату добавляют последовательно 30%-ный растьор 2-этилгексаноата натрия в н-бутаноле (7,3 мл) и ацетон (300 мл) Выпавший осадок собирают фильтрова- кием, промывают ацетоном и растворяют в ледяной воде.
Доводят значение рН водного раствора до 2 добавлением 10% соляной кислоты. Осадок собирают, промывают водой и растворяют в диметилформамиде ХбО млТ. Раствор обрабатывают углем ;(1,5 г) и фильтруют. К фильтрату добавляют последовательно 30%-ный раствор 2-этилгексаноата натрия в н-бутаноле (7 мл) и ацетон (300 мл). Осадок собирают и растворяют в ледяной воде. Доводят значение рН водного раствора до 2 добавлением 10% соляной кислоты. Полученный осадок собирают, промывают водой и растворяют в 2% растворе гидроокиси натрия для доведения значейия рН до 6,5. Водный-раствор фильт-; руют и лиофилизируют. Получают натриА евую соль D-ot- 5 , 8-ДИГИДРО-2-{4-формил-1-пиперазинил)-5-оксопиридо 2,3-dj пиримидин-6-карбоксамидо -п-оксибензилпенициллина (4,83 г).
Это соединение идентифицируют с соединением примера 1 путем сравнения ИК-спектра и спектра ЯМР.
Пример 4. К раствору В-об-амино-п-оксибензилпенициллина(1/11 г) и триэтиламина (0,38 мл) в высуагенном диметилформамиде (10 мл) добавляют 2,4,6-трихлорфениловый эфир 5,8-ДИГИДРО-2-(4-формил-1-пиперазинил) -5-оксопиридо , 3-d nHpHMHдин-6-карбоновой кислоты (2,16 г) и реакционную смесь перемешивают при комнатной температуре в течение 2 дней. Нерастворимый материал отфиль.тровывают и к фильтрату добавляют последовательно 30%-ный раствор 2-этилгексаноата натрия в ,1 HOKJ (1,5 мл) и ацетон (150 MJI.I. ,: осадок собирают фильтроБа1;; СМ, пр- мывают ацетоном н растис рйют в челяной воде. Доводят значо ;ие рН раствора до 2 добавленном 10. соляной кислоты. Осадок собирают, промывают водой и растворяют в диметилформамиде. Диметилформамидный раствор обрабатывают углем и фильтруют. К фильтрату добавляют последователь0но 30% раствор 2-этилгексаноата натрия в н-бутаноле и ацетон. Осадок собирают и растворяют в ледяной воде. Доводят значение рН водного раствора до 2 добавлением 10% соляной кисло5ты. Осадок собирают, промывают водой и растворяют в 2% растворе гидроокиси натрия для доведения значения рН до 6,5. Водный раствор фильтруют и лиофилизируют с получением натриевой соли O-d-f5,8-ДИГИДРО-2-(4-формил0-1-пиперазинил)-5-оксопиридо 2 ,3-d пиримидин-6-карбоксамидо -п-оксибензилпенициллина (1,14 г).
Это соединение идентифицируют с соединением примера 1 путем сравне5ния ИК-спектра и спектра ЯМР.
Пример 5. Суспензию 5,8-дигидро-2-формил-2-(4-формил-1-пиперазинил) -5-оксопиридо 2., 3-d пиpимидин-6-карбоновой кислоты (90 г) и три0этиламина (42 мл) в высушенном дихлорметане (1000 мл) тщательно перемешивают при комнатной температуре в течение 1 ч. К суспензии добавляют изопропиловый эфир хлормуравьиной
5 кислоты при охлаждении, и смесь выдерживают при 5-7°С в течение 1 ч. К смеси добавляют раствор О-с гамино-п-оксибензилпенициллина (126 г) и триэтиламин (46 мл) в высушенном диметилформамиде (350 мл). Полученную
0 смесь перемешивают при 5-7°С в течение дополнительно 1,5 ч и оставляют на ночь при -10°С.
Нерастворимый материал отфильтро,вывают, И к фильтрату добавляют по5следовательно 30%-ный раствор 2-этил гексаноата натрия в н-бутаноле (250 мл) и ацетон (3000 мл).
Выпавший осадок собирают фильтрованием и растворяют в ледяной воде.
0 Доводят значение рН водного раствора до 2 добавлением 10% соляной кислоты. Осгщок промывают водой и растворяют в диметилформамиде (380 мл). После обработки раствора углем (20 г) к
5 раствору добавляют последовательно 30%-ный раствор 2-этилгексаноата натрия в бутаноле (130 мл) и ацетон (5000 мл).
Выпавший осадок собирают, промы0вают ацетоном и растворяют в ледяной воде. Доводят значение рН водного раствора до 2 добавлением 10% соляной кислоты. Осадок собирают, промывают водой и растворяют в 2%-ном растворе
5 гидроокиси натрия для доведения знаЧения. рН до 6,5. Раствор отфильтровывают и лиофилизируют с получением натриевой соли s , 8-дигидро-2--( 4-формил-1-пиперазинил) -5-оксопири-до 2 , 3-djпиримидин-б-карбоксамидо |-п-оксибенэилпенициллина (78,7 г).
Это соединение идентифицируют с соединением примера 1 путем сравне;ния ИК-спектра и спектра ЯМР.
Пример 6. По методике, описанной в примере 5, получают натриевую соль O-fi- 5, 8 дигидро-2-(4-формил-1-пиперазинил) -5-оксопиридо {,2 , 3-d пиримидин-6-карбоксамидо -п-оконбензилпенициллина (155 г) из 5,8-дигидро-2-(4-формил-1-пиперазинил}5-оксопкридо 2,3-d пиримидин-6-карбоновой кислоты (152 г) и изобутиловог эфира хлормуравьиной кислоты (79 мл)
Это соединение идентифицируют с соединением примера 1 путем сравнения КК-спектра и спектра ЯМР.
Пример 7. По методике, описанной в примере 5, получают натриевую соль D-c(- 5 , 8-ДИГИДРО-2- (4-формил-1-пиперазинил) -5-оксопиридо 2,. 3-( пиримидин-б-к арбоксамидоЗ п-оксибензилпенициллина (29 г) из 5,8-дигидро-2-(4-формил-1-пиперазинил)-5-оксопиридо 2 ,3-d}пиpимидин-б-кapбoновой кислоты (3.0 г} и втор-бутилового эфира хлормуравьиной кислоты.
Это соединение идентифицируют с соединением примера 1 путем сравнения .ИК-спектра и спектра ЯМР.
Пример 8. По методике, описанной в примера 5, за иcклIoчeниe i того, что реакцию проводят при получают натриевую соль D-oi.-{5 . 8-дигидро-2-(4-формил-1-пиперазинил)-5-оксопиридо 2 , 3-{ Зпиримидин-6-карбоксамидоj-п-оксибензилпенициллина(15 г) из 5,8-ДИГИДРО-2-(4-формил-1-пиперазинил) -5 -оксопи-ридо 2 , 3-(}пиримидин-б-карбоновой кислоты (30 г) и хлорангидрида 2-этилгексановой кислоты (19,5 г).
; Это соединение идентифицируют с Ьоеэдинением примера 1 путем сравнения ИК-спектра и спектра ЯМР.
Пример 9. Суспензию 5,8-ди гидро-2-(4-формил-1-пиперазинил)-5-оксопиридо 2 ,3-d пиримидин-б-карбоновой кислоты (2,0 г) и триэтиламина (1,, 66 мл) в высушенном диметилформам.де (50 мл) перемешивают при комнатной температуре в течение 30 мин. К реакционной смеси добавляют этиловый эф11Ьхлормуравьиной кислоты (1,14 мл при , и смесь перемешивают в течение 1ч. С другой стороны, суспензию 0- з -амино-п-оксибензилпенициллина, (5,0 г) триэтиламина (2,77 мл) и безводного сульфата магния (2,0 г) в высушенном диметилформамиде (60 мл перемешивают при комнатной температуре в течение 30 мин, и. нерастворимый материал отфильтровывают. Фильтрат добавляют к вышеуказанной суспензии при 5-10°С и смесь перемешивают в течерше еще 2 часов.
Нерастворимый материал отфильтровывают и к фильтрату добавляют 20%ный раствор 2-этилгексаноата натрия в н-бутаноле (10 мл). Затем к смеси добавляют этиловый эфир (500 мл). Выпавшие кристаллы собирают и растворяют в воде (300 мл). Водный раствор подкисдяют разбавленной соляной кислотой. Осадок собирают, промывают, водой и высушивают с получением ci 5 ; 8-ДИГИДРО-2- (4-формил-1-пиперазинил)-5-оксопиридо 2 , 3-(пиримидин-б-карбоксамидо}-п-оксибензилпенициллина (3,4 г).
ИК-спектр (КВг): Л) С О 1770 см Спектр .ЯМР (ДМСО ):
-S/ N-CHOi;
8,10 (1н синглет, 4,19 (1Н синглет,
5,77 (1Н дуплет D
9,12(IH,синглет,группа формулы
Вычислено для S ЗН20,%: 19,43; Н 5,15; N 15,90; S 4,55.
Найдено,%: С 49,64; Н 4,91; i 15,86; S 4,72.
l р И м е р 10. Суспензию 5,8-дигидро-2-(4-ацетид-1-пиперазинил)-5-о.ксопиридо 2, 3-d пиpимидин-6-кapбoнолой кислоты (9,31 г) и триэтиламина (4,98 мл) в высушенном дихлорметане (160 I/in) тщательно перемешивают при комнатной .температуре в течение одного часа. К суспензии добавляют по каплям этиловый эфир хлормуравьиной кислоты (3,42 мл) при охлаждении до , и смесь перемешивают при 3-Вс в течение 1 ч. К реакционной смеси добавляют раствор О-с -амино-п-оксибензилпенициллина (15 г) и триэтиламина (7,5 мл) в высушенном диметил-формамиде (120 мл) и полученную смесь перемешивают в течение 2 ч. Нерастворимый материал отфильтровывают, и к фильтрату добавляют последовательно 20%-ный раствор 2-этилгексаноата натрия в н-бутаноле (27 мл и ацетон (1000 мл). Выпавший осадок собирают фильтрованием и растворяют в ледян-ой воде. Доводят значение рН водного раствора до 2 добавлением 10% соляной кислоты, и осадок собирают, промывают водой и растворяют диметилформамиде(250 мл). После обр ботки диметилформамидного раствора углем к раствору добавляют последов тельно 20%-ный раствор 2-этилгексано ата натрия в н-бутаноле (27 мл) и ацетон (1000 мл). Осадок собирают и отгоняют в ледяной воде. Доводят зн чение рН водного раствора до 2 добавлением 10%-ной соляной кислоты. Выпавшие кристаллы собирают, промыва ют водой, растворяют в 2%-ном раство гидроокиси натрия, и доводят значени рН до 6,5. Полученный раствор фильт руют и лиофилизируют с получением на риевой соли D-(- 5 , 8-ДИГИДРО-2- ( 4-ацетил-1-пиперазинил)-5-оксопиридо 2 , 3-d пиримидин-6-карбоксамидо)-п-оксибенэилпенициллина (8,5 г). НК-спектр (КВг) : - С О 1760 см Спектр ЯМР (ДМСО - d6, f) : 2,05 (ЗН, синглет, CH,), sCCOO-V, 3,95 (1И, синглет. н 5,79 (1Н, дуплет 3 8 Гц, -N-сн-СО9,12(1Н синглет,группа формулы Н 35
Подсчитано для Cij,Hj NgOgSNa , % С 47,49; Н 5,18; N 14,77; S 4,23.
Найдено,%: С 47,58; Н 4,95; N 14,56; S 4,02.
Пример 11. Суспензию этилово го эфира 5,8-ДИГИДРО-2-(4-ацетил-1пиперазинил)-5-оксопиридо 2, 3-d пиримидин-6-карбоновой кислоты (20 г) в смеси 4%-ной соляной кислоты (60 м и этанола (20 мл) кипятят с обратным холодильником при 120с в течение 1,5 ч. После охлаждения выпавший осадОк робирают, промывают водой, а затем горячей водой, и растворяют в Г0%-ном растворе гидроокиси натрия. Нерастворимый материал отфильтровывают, и фильтрат подкисляют разбавленной соляной кислотой. Выпавший осадо собирают и перекристаллизовывают из диметилсульфоксида с получением 5,8-дигидро-2-(4-ацетил-1-пиперазинил)-5-оксопиридо 2 , 3-d пиримидин-6-карбоновой кислоты (10 г);т.пл. 298300°С.
Суспензию 5,8-ДИГИДРО-2-(4-ацетил-1-пиперазинил)-5-оксопиридо 2, 3-d3пиримидин-6-карбоновой кислоты (1,57 г) и триэтиламина (0,73 мл) в высушенном диметилформамиде (20 мл) перемешивают при комнатной температуре в течение 30 мин. К реакционной k Дч
и 5,78 (1Н, дуплет, 3-8 Гц,- N-t-CO-l,
i
9,12 (IH, синглет, N-k,4).
Вычислено для О S- «НдО , % : С 48,91; Н 5,47; N 15,21; S 4,35.
Найдено,%: С 48,81; Н 4,99;N 14,78; S 4,19.
Пример 12. По методике, описанной в примере 1, получают натриевую соль D ti- 5 ,8-ДИГИДРО-2-(4-ацетил-1-пиперазинил)- 5-оксопиридо- 12, 3-(J} пиримидин-6-карбоксамидо -п-оксибензилпенициллина из O-cL-амино-п-оксибензилйенициллина и ,В-дигидро-2-(4-ацетил-1-пиперазинил)-5-оксопиридо 2,3-dЗпиримидин-б-карбонилокси сукцинимида.
Это соединение идентифицируют с соединением примера 10 путем сравнения ИК-спектра и спектра ЯМР,
Пример 13. По методике, описанной в примере 5, получайт натриевую соль D-ct-tS, 8-дигидpo-2-(4-aцeтил-l-пкпepaзинил) -5-оксопиридо 2,3смеси добавляют этиловый эфир хлормуравьиной кислоты (0,5 мл) при температуре от -5 до -10с и смесь пере мешивают в течение часа. С другой стороны, суспензию T)-oi -амино-п-оксибензилпенициллина (2,10 г) триэтиламина (1,05 мг) и безводного сульфата магния (1,0 г) в высушенном диметилформамиде (20 мл) перемешивают при комнатной температуре и нерастворимый материал отфильтровывают. Фильтрат добавляют к вышеуказанной суспензии при температуре от -5 до -10°С и смесь переме .1ивают в течение еще 2 ч. Нерастворимый материал отфильтровывают и к фильтрату добавляют 20%-ный раствор 2-этилгекс ноата натрия в н-бутаноле (7,5 мл), а затем к смеси добавляют этиловый эфир 200 мл. Выпавшие кристаллы собирают и растворяют в растворе бикарбоната Н41ТРИЯ. Водный раствор подкисляют разбавленной соляной кислотой, осадок собирают, промывают водой и высушивают с получением D-c,- , 8-дигидро-2-(4-ацетил-1-пиперазинил)-5-оксопйридо 2,3-d пиpимидин-6-кapбoксамидо)-п-оксибензилпенициллина (1,35 г).. ИК-спектр: liC О 1770 см . Спектр ЯМР (mCO-d(,,S}: 2,06 (ЗН синглет. CHACON N-), 4,20 (IH, синглет, СН-СОО-);
-dlnHpHMHflHH-6-Kap6oKcaMHflo -n-OKCnбенэилпенициллина из 5,8-дигидро 2-(4-ацетил-1-пиперазинил)-5-оксопиридо 2,3-а пиримидин-б-карбоновой кислоты и изопропилового эфира хлормуравьиной -кислоты.
Это соединение идентифицируют с
CONHCHCONH-T-г Ксн
-N14Г ИО
л
I
и
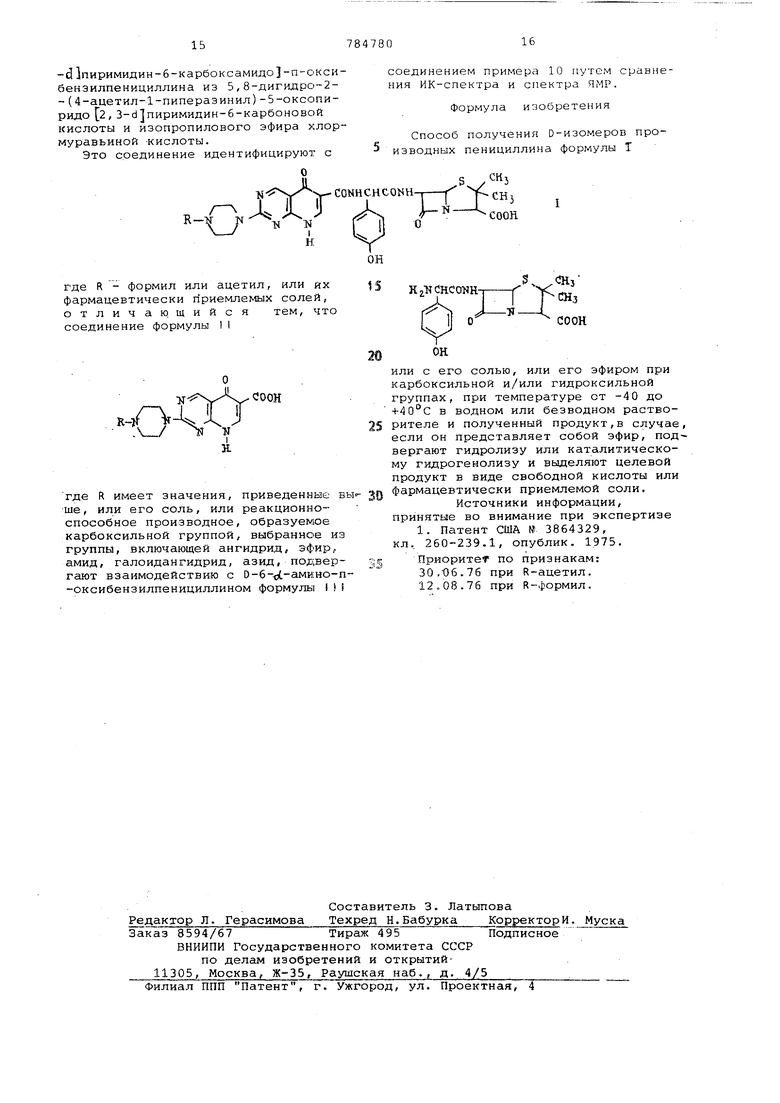
где R - формил или ацетил, или их фармацевтически приемлемых солей, отличающийся тем, что соединение формулы II
соединением примера 10 путем сравнения ИК-спектра и спектра ЯМР.
Формула изобретения
Способ получения D-изомеров производных пенициллина формулы Т
СН}
J
соон
5,.,
Kj.HdHCONH1 рснз
-7J1
СООН
RH
где R имеет значения, приведенные выше, или его соль, или реакционноспособное производное, образуемое карбоксильной группой, выбранное из группы, включающей ангидрид, эфир, амид, галоидангидрид, азид, подвергают взаимодействию с 0-6- -амино-п-оксибензилпенициллином формулы
или с его солью, или его эфиром при карбоксильной и/или гидроксильной группах, при температуре от -40 до +40°С в водном или безводном растворителе и полученный продукт,в случае, если он представляет собой эфир, под вергают гидролизу или каталитическому гидрогенолизу и выделяют целевой продукт в виде свободной кислоты или фармацевтически приемлемой соли.
Источники информации, принятые во внимание при экспертизе
1. Патент США № 3864329, кл, 260-239.1, опублик. 1975, Приоритет ПО признакам: 30,t)6.76 при R--aцeтил, 12.08.76 при R-формил.






| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения производных пиридо (2,3- )пиримидина | 1974 |
|
SU624575A3 |
| Способ получения производных 2,3алкилен-бис (окси)бензамидов или их оптических изомеров,или их солей | 1977 |
|
SU716523A3 |
| ПРОИЗВОДНЫЕ АМИНОХИНОЛОНА, ЗАМЕЩЕННЫЕ ФЕНИЛЬНОЙ ИЛИ ГЕТЕРОАРОМАТИЧЕСКОЙ ГРУППОЙ | 1993 |
|
RU2124510C1 |
| Способ получения производных 1,8-нафтиридина или их солей | 1979 |
|
SU1075976A3 |
| Способ получения пенициллиновых производных или их солей | 1974 |
|
SU578888A3 |
| Способ получения производных 1,8-нафтиридина или их фармацевтически пригодных солей | 1980 |
|
SU1029829A3 |
| Способ получения производных хинолина или их солей | 1981 |
|
SU1181544A3 |
| Способ получения производного хинолона | 1990 |
|
SU1836367A3 |
| Способ получения 8-этил-5-оксо-5,8-дигидро-2-пиперазинопиридо [2,3- @ ] пиримидин-6-карбоновой кислоты | 1980 |
|
SU982543A3 |
| ПРОИЗВОДНЫЕ ХИНОЛОН- И НАФТИРИДОНКАРБОНОВОЙ КИСЛОТЫ В ВИДЕ СМЕСИ ИЗОМЕРОВ ИЛИ ОТДЕЛЬНЫХ ИЗОМЕРОВ, ИХ ГИДРАТЫ И СОЛИ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1993 |
|
RU2105770C1 |


Авторы
Даты
1980-11-30—Публикация
1977-06-29—Подача