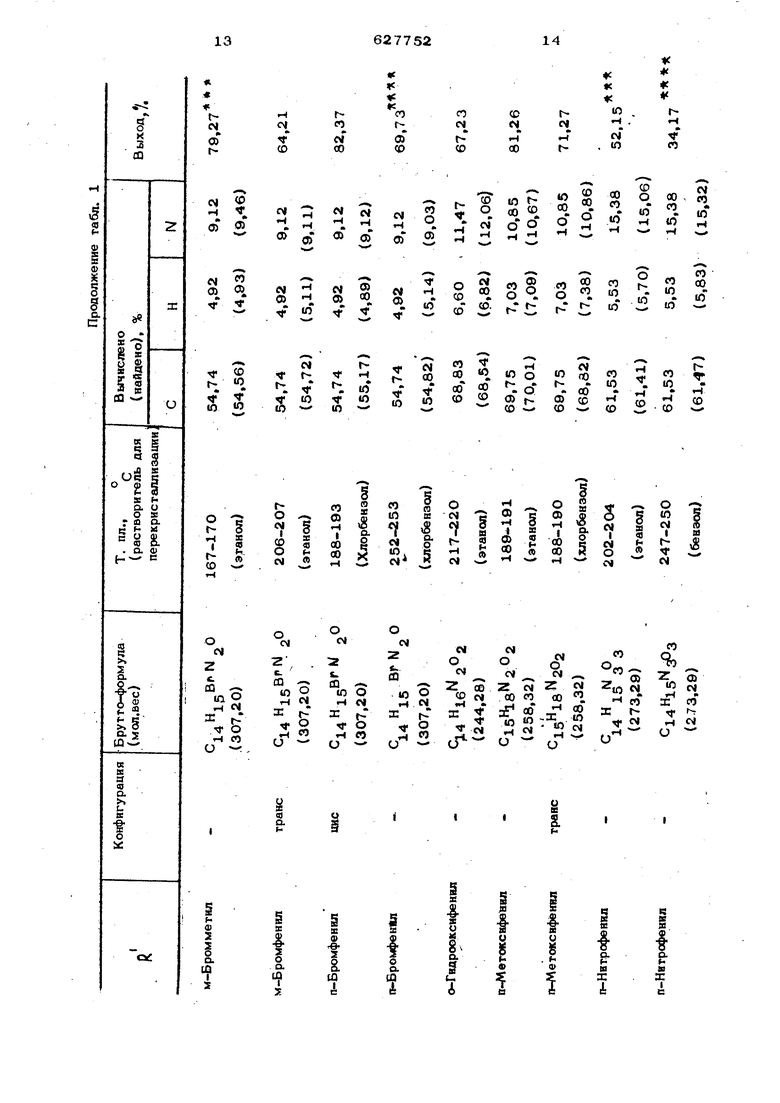
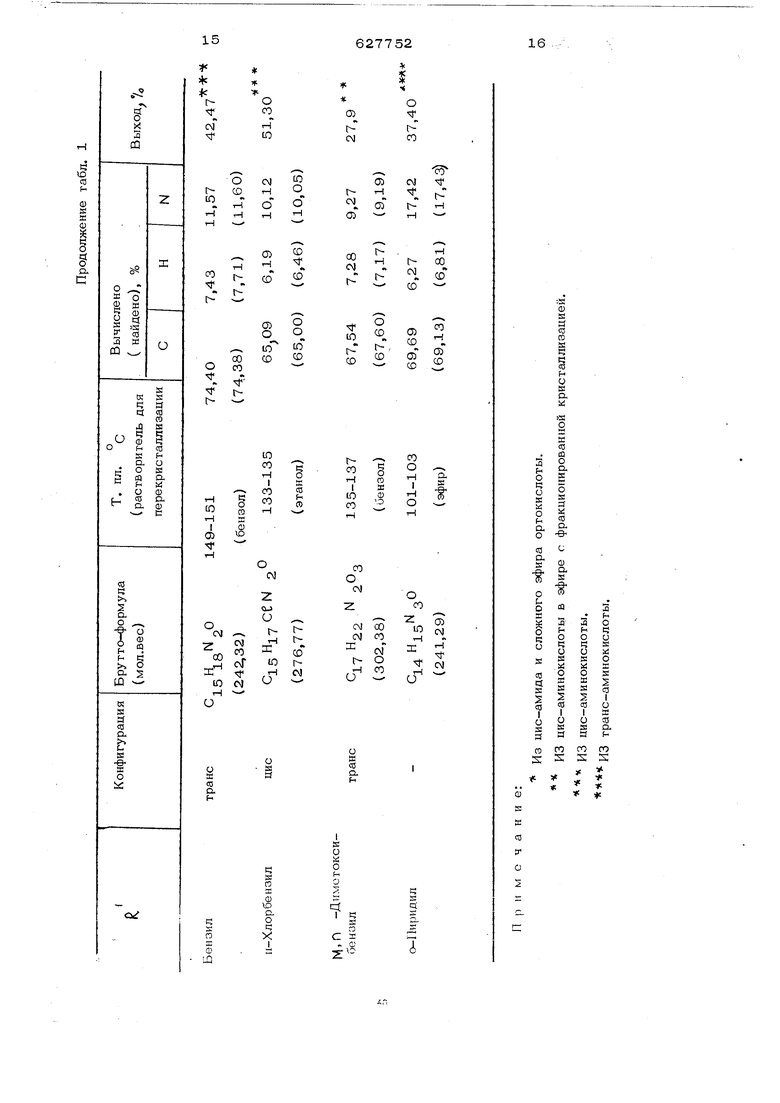
3 п имеют указанные выше зн чения, подвергают взаимодействию с со динением общей формулы А - В ( iTi ) где А - водород, алкокс или аминогруппа; В - группа WHR, иди ISf -к 17 К и R имеют указанные выше значе R - водород или замещенный фенил, в присутствии инертного .органичес кого растворителя при 20-150 С. В качестве инертного ор анического растворителя предпочтительно использую ацетон, галоидуглеводороды, предпочтительно хлорбензол, хлороформ, или эфир предпочтительно диоксан. Обычно 2-амино-1-циклоалканкарбоно вые кислоты формулы || подвергают вза модействию с алкил - пли арилимидатам формулы JII . Имидатх могут быть замещенными или незамещенными. Из замещенных имидатов { R. - не водород) получают 3-замещенные производные 5,6-алкилен-5,б-дигидропиримидин-4-(ЗН)-она, предпочтительно в хлорбензоле при 20- 150 С в течение 4 -ЗО Контроль по данным тонкослойной хроматографии (тех). По окончании реакци смесь выпаривают и остаток перекриста лизовывают. 2-Амино-1-циклоалканкарбоксамиды формулы И можно обрабатывать сложны ми эфирами ортокислот формулы III в указанных выше условиях. При использо вании пара-замещенного карбоксамида получают 3-замещенные производные пи римидина. Кроме того, можно проводить взаимо действие 2-амино-1-цнклоалканкарбоновой кислоты фбрмулы И с амидинами фо мулы Ш , предпочтительно после обработки соли амидина рассчитанным количеством алкоголята щелочного или щелочноземельного металла (выделение амидинового основания). При необходимости смесь нагревают. Реакционную смесь фильтруют в горячем состоянии и кристаллизуют продукт. Boзv oжlJO также взаимодействие слож ного эфира 2-амино-1-1и1Клоалка11кар5оновой кислоты с N ,1)-д11метилформа П1д хлоридом с образовиниоч, хлоргидрата N. N -Д --1 Л- N (этоксикао2бонил)-циклогексил -формачлпдина. Реакцию предпочтительно проводят в растворителе. Примерами подходящих растворителей являются алифатические и ароматические углеводороды, галоидированные углеводороды и простые эфиры. Температура реакции О- 60 С. Продукт получают выпариванием смеси и затем очищают перекристаллизацией. После взаимодействия полученного формамида с аммиаком или аминами получают производные 5,6-алкилен-5,6-дигидропиримидин-4(ЗН)-она. Во время реакции реагирующий амин замещает расщепляемую диметиламинную группу, после чего образующееся производное формамидина реагирует с вицинальной этоксикарбонилыюй группой. Реакция циклизации приводит к образованию производного 5,6-алкилен-5,6-дигидропиримидин-4(ЗН)-она и спирта. Реакция может быть осуществлена в диоксане, но могут быть использованы и другие инертные растворители, например простые эфиры, углеводороды, хлорированные углеводороды. Выпадающие во время реакции в осадок соли аммония и замещенные соли аммония отфильтровывают и продукт получают выпариванием реакционной смеси. Он мохсет быть очищен различными физическими методами, например методом ТСХ. Для проведения реакции могут быть использованы цис- или транс-2-амино-2-циклоалканкарбоновые кислоты или их производные, а также смесь цис- и транс-изомеров. Пример. Цис - или транс-2-амино-1-циклогексанкарбоновую кислоту (0,01 моль) суспендируют в хлорбензоле (20 мл) и прибавляют производное этилимидата (0,012 моль), кипятят с обратным холодильником в течение 15-20ч (контроль по данным ТСХ на силикаг ле в системе бензол-этанол, 4:1), выпаривают смесь при пониженном давлении и кристаллизуют остаток. Свойства полученных 2-замешенных пис- и транс-4а, ,5,6,7,8,8а-гексагидрохиназолин-4(ЗН)-онов формулы / , где R - водород П -2, представлены в табл. 1. П р и м е р 2. Следу методике примера 1, из цис- или трсИ1С-2-ах;ино-1-nHKnorenTaHKap6oi OBoii кислоты (0,01 моль) в хлорбензоле (20 мл) и пгюиаводиого эгилихпща (0,012 моль) г олуч;1ют поре- в табл. 2 за -;еи1оаныо цис1 Ti;nfic-5,6-гептамет ШО1 -5,6-дигндгюпиримидин-4(ЗН)-оны формулы, где R - водород; п - 3. П р и м е р 3, Аналогично примеру из цис- или гранс-2-амино-1-циклогекс карбоновой кислоты (0,01 моль) в хлор бензоле (20 мл) и N -замещенного этилимидата получают цис- и транс-2,3замещенные-4а,5,6,7,8,8а-гексагидрохиназолин-4(ЗН)-оны формулы J. где П - 2, перечисленные в табл.3 П р и м е р 4. 11-замещенный 2-амино-1-циклогексанкарбоксамид(0,01 моль) суспендируют в хлорбензоле (25 мл) и кипятят со сложным эфиром ортокислоты (0,01 моль) в течени 8-10 ч. Хлорбензол отгоняют при пониженном давлении, остаток перекристалли зовывают и получают 2,3-дизамещенные ,4а, 5,6,7,8,8а-гексагидрохиназолин-4(ЗН)-оны, представленные в табл.3 П р и м е р 5. цис-2-Амино-1-циклопентанкарбоновую кислоту (12,92 г, 0,1 моль) кипятят с этилбензимидатом (16,41 г, 0,11 моль) в течение 20 ч по методике примера 1 и получают 14,1 2-фенил-цис-5,6-триметилен-5,6-дигидропиримидин-4(ЗН)-она, т.пл. 130-140 (этанол). Вычислено, %: С 72,86; Н 6,59; N13,07. С 13 Н, N1,0. Найдено, %: С 73,43; Н 6,74; N13,13. П р и м е р 6. ЦИС-2-АМИНО-1-циклогексанкарбоновую кислоту ( 1 г 0,005 моль) и хлор гидрат п-метоксибензамидина (1,3 г, 0,005 моль) суспендируют в хлорбензоле (50 мл), прибавляют метилат натрия (0,4 г, 0,005 мо и кипятят 20 ч. Хлористый натрий и непрореагировавшую аминокислотную компоненту отфильтровывают в гор чем состоянии. При О С выпадает в ос док 2- (п-ме токсифенил) -цис-4а, 5,6,7,8 ,8а-гексагидрохиназолин-4(ЗН)-он, кот рый отфильтровывают и перекристаллизо вывают из бензола до постоянной темпе ратуры плавления . Выход О,8 г, т. пл. 188-191°С. Вычислено, % : С 69,75; Н 7,03; N10,85. , Найдено, %: С 69,91; Н 7,11; N10,68. Пример7.К смеси М , -диметилформамидхлорида (12,99 г. 0,01015 моль) и абсолютного хлорофора (20 мл) по каплям прибавляют эгил(щ1с-2-амино-1-циклогексанкарбокси:лат) (14,32 г, 0,1 моль) в абсолютном хлооформе (40 мл),поддерживая температуу не выше 40 С. Отгоняют хлороформ, ерекристаллизовывают остаток из диоксаа и получают 22,38 г белого гигроскоичного хлоргидрата N. N диметил- цис-2(этоксикарбонил)-циклoгeкcилфopмaмIЩИнa,т. пл. 137 °(3 - 142°С. Вычислено, %: С 54,84; Н 8,82; N10,66; се 13,4. С ,2Н 2зС N2,0. Найдено, %: С 54,38; Н 8,94; N11,08; се 13,55. Т. пл. пикрата 114ОС -116°С. Вычислено, %: С 47,48; Н 5,53; N15,38. Найдено, %: С 47,51; Н 5,78; N15,31. Н р и м е р 8. Хлоргидрат N . N -диметил- М - цис-2-(этоксикарбонил)-циклогексилформамидина (1 г, 0,038 моль) суспендируют в абсолютном диоксане (20 мл) и в смесь в течение 1,5 ч пропускают сухой газообразный аммиак. Хлористый аммоний отфильтровывают, раствор выпаривают досуха, остаток растворяют в хлороформе и хроматографируют (ТСХ) на силикагеле в системе петролейный эфир - хлороформ (8:2). Гексагидрохипазолиновое пятно соскабливают, растворяют в хлороформе и получают О,2 г цис-4а, 5,6,7,8,8а-гексагидрдхиназолин-4(ЗН)-она, т. пл. 133-134 С. Вычислено, %: С 63,13; Н 7,95; N 18,41. с О. Найдено, %: С 63,11; Н 7,84;N18,31, Пример 9. N -п-Толил-цис-2-амино-1-циклогексанкарбоксианилид(2,32 г, 0,О1 моль) растворяют в хлорбензоле (40 мл), прибавляют этилортоформиат (1,63 г), кипятят с обратным холодильником в течение 6 ч, отгоняют растворитель при пониженном давлении, перекристаллизовывают остаток из петролейного эфира и получают 1,25 г (51,51%) белого кристаллического 3-(п-толил)-4а, 5,6,7,8,8а-гексагидрохиназолин-4(ЗН)-она, т.пл. 79-82 С. Вычислено, %: С 74,35; Н 7,49; N 11,56. . Найдено, %: С 73,93; Н 7,43; N11,76. Пример О. N -Бутил- нпи N -фенип-цис-2-а /ино-Д циклогексанкарбоксамид (0,01 моль) растворяют в хлорбензоле (4О мл),- прибавляют этилфенилимидат (0,011 моль) и кипятят с обратным холодильником в течение 50 ч Растворитель отгоняют при пониженном давлении (2,5 мм .) и остаток перекристаллизовывают, получая 2-фенил -4а,5,6,7,8,8а-гексагидрохиназолин-4(ЗН)-он в виде белого кристаллического вещества, т. пл. 165-167 или 165 168°С (этанол), с выходом 73,81 или 69,65% соответственно. Вычислено, %: С 73,65; Н 7,02; N12,28. . (228,30). Найдено, %: С 73,25 или 73,65; Н 7,05 или 7,28; N12,15 или 11,79. При использовании цис-2-с1мино-1-циклo кcaнкapбoкcavшдa получают то же соединение, т. пл. 168-170 С (эта нол), с выходом 65,27%. Найлено, %: С 73,22; Н 7,20; N11, Прим е р 11.N-Мет илбензамидим и хлорид (0,01 моль) растворяют в абсолютном ацетоне (20 мл) и по каплям при 0°С прибавляют этилгексагидроантр 6 8 нилат (0,02 моль) в ацетоне (40 мл). Смесь оставляют при комнатной температуре на ночь, затем отгоняют ацетон, помешают остаток в анионообменник марки Вариан АД и непрореагировавший сложный эфир отгоняют при пониженном давлении (2,5 мм рт. ст). Остаток перекристаллизовывают из петролейного эфира. Получают 2-фенил-3-метил-4а,5,6,7, ,8,8а-гексагидрохиназолин-4(ЗН)-он, т. пл. 79-82° С, с выходом 38,25%. Вычислено , %:С 74,36; Н 7,49; N 11,56. С,5 Hjj NjO (242,32). .. Найдено, %: С 74,68; Н 7,38; /М 11,32. П р и м е р 12. Следуя методике примера 1, цис-2-амино-1-циклопентанкарбоновую кислоту (12,92 г) и этил-м-хлорбензимидазол (20,2 г) кипятят 20 ч и получают 17 г 2-(м-хлорфе НИЛ)-цис-5,6-гриметилен-5,6-дигидропиримидин-4(ЗН)-она т. пл. 138-140°С (этилацетат). Вычислено, %: С 62,78; Н 5,27; N 11,26. С . Найдено, %: С 62,85; Н 5,42; N 11,06.
IT
«
CM
r-i
со
со
г- 00
h
0)
hг00 f, С9
г« ЙГ-.
Ф со
со
. «о
2 f :4
О) of
к
«с 4(
«
1|С
te
со 05
о о
о
ю
ю о
со
н
о
-I
ч00
«п гсосо
ю
о
со
о









- о (О со и :: :: - о ®. « « ciS, h-« h-tOn S О « 5 2 5 н . t о о со со. со I g| g g gj S S « Ф . ™ h00о о со S ,, соо юсо . нТм - О я ч я ч ч . SS S S S S
§
га
со см
в
-т:
.. «8
I О ч
в
со 2
iS м и н я
А
см
(О
аз
О)
I
BE
Ф
§CO .Ф
S
CO
vg g
CM
H
0
S « о
qj
Q.
(
2 01
3
CO CO
g
л
f
n
л CO
rCM
CM
CM
оо
-ч
,Ф %зш
CD «
Hч H ч
S
з:CO X CO
J5
сГЗ
a
f
i
fn
§
я
8tg
b i i
%
%
CM
г
z
u.
о.)
«L
aj
(U
u -.
4,7
о -
и
5 Ф
03
ю Ч
lO
Tl c CM н гх-.
:5-. H ri
со
X см
X
:z смсм
CM r со5Г со
CO ят со Д см
бЗ
,н м с
о и
о
s
4 Q.
I
ав
о
о
S
I
S
о is; о
I
-.
О
а; ш хо о.
g о
X с. а:
. .Ф
Ч
п
21627752
Формула изобретения
О /-1 (dH2ln I i (Л / где Я - С,- С/, -алкип, фенип, галоидфенил, нигрофенил, грифтормегплфенил, фенил, замещенный одним или двумя С - CjTj алкилами или алкоксигруппами, бензил, бензил, замещенный одной или двумя С k лкоксигруппами, галоидом, пиридил; R - водород; Cj - Cjj - алкил фенил, фенил, замещенный С - С,-алкилом или алкоксигруппой, пиридил; П - 1,2 или 3, о т л и ч а ющ и и с я тем, что производные 2-ами но-1-циклоалканкарбоновой кислоты общей формулы -Ч ,v . Н2(2fH где К - гидрокси, С - алкоксигруппа или группа - N Н R ; Я - водород или группа ( fj , Р и П имеют указанные выше зна чения, подвергают взаимодействию с сое динениями общей формулы А - В( Ш ). где А - водород, С - Сл - алкокСИ-, аминогруппа;
В - группа - Nf)R
,/
Й-Е ипи N i R и R. имеют указанные выше значеводород или замещенный фенил. в присутствии инертного органического растворителя при 20-150 С. Г. Способ по п. 1, о т л и ч а ющ и и с я гем, что в качестве инертного органического растворителя используют ацетон, галоид углеводороды или эфиры. 3.Способ по п. 1, о т л и ч а ющ и и с я тем, что 2-амино-1-циклоалканкарбоновые кислоты формулы Л подвергают взаимодействию с алкил- или арилимидатами формулы ( . 4.Способ по п. 1, о т л и ч а ющ и и с я тем, что 2-амино-1-циклоалканкарбоновые кислоты формулы {, подвергают взаимодействию с амидинами формулы 1(1 5.Способ по п. 1, о т л и ч а ющ и и с я тем, что 2-амино-1-цикло- алканкарбоксамид формулы I/ подвергают взаимодействию с алкил- или арилимидатами формулы /// . 6.Способ по п. 1, т л и ч а ющ и и с я тем, что 2-алкиловый эфир амино-1-циклоалканкарбоновой кислоты формулы I/ подвергают вз имодействию с ах1идинами формулы /// . 7.Способ по п. 1, а т чающийся тем, что 2-амино-1- циклоалканкарбоксамид формулы подвергают взаимодействию с эфиром ортокислоты формулы W Источвгаки информации, принятые во вни тание при экспертизе: 1 J.Chem. Зое (с) i97i, 238.
Авторы
Даты
1978-10-05—Публикация
1976-10-03—Подача