Использование известной реакции позволяет получать простангландины общей формулы I ГтЗ. Цель изобретения - расширение ассортимента простагландинов и способ их получения. Поставленная цель достигается способом получения простагландинов общей формулы 1, заключающимся в том что срединение общей формулы (II) {СН,пО(СНг)СбН ОГГП где Z, R, ТГП, пит имеют указанное значение, подвергают взаимодействию с илидом общей формулы (CfeHfbP СНССНг)/, (III) где X имеет указанное значение, и в случае необходимости гидрируют последующим выделением целевого продукта. Гидрирование проводят с палладиро ванным углем в качестве катализатора П р и м е р 1 о -полуацеталь-2- 5а-окси-3о- -тетрагидропиран-2-илокси(-26-3 -тетрагидропиран-2-илокси-4-фенокси-транс-1-бутенил)-циклопент-1-ил -ацетальдегида„Раствор 690 мг (1 ,А6 ммоль/ -лакто на-2- 5о/- -окси-3о1- (тетрагидропиран-2 -илкоси) -26- (З cL -тетрагидропиран-2-илокси- -фенокси-транс-1-бутен-, -1-ил)циклопент-1d -ил -уксусной кис лоты в 8 мл сухого толуола охлаждают до -78°С в атмосфере сухого азота« К охлажденному раствору по каплям добавляют 2 мл 20 -ного раствора диизобутилалюмогидрида в н-гексане с такой скоростью, чтобы температура не поднималась выше (15 мин) После перемешивания еще 45 мин при добавляют безводный метанол до прекращения выделения газа и реак ционной смесидают нагреться до комнатной температуре с К реакционной смеси добавляют 100 мл эфира, промывают 50%-ным раствором калий-натрий тартрата (х20 мл) , сушат сульфатом натрия, выпаривают и получают 613 м f-пoлyaцeтaля-2- 5 (--окси-З oL- (тетрагидропиран-2-илокси) -2В- (3cL -тетрагидропиран-2-илокси- -фенокси4-транс-1-бутен-1-ил)циклопент-1-1-ил -ацетальдегида. Пример 2„ 9(v-окси-1 lot, 15 i--бис-(тетрагидропиран-2-илокси-)-16-фенокси-цис-5-транс-13-w-TeTpaHopпростадиеновая кислота. К раствору 1,6 г (3,6 ммоль) бромистого (4-карбокси-бутил) -трифенилфосфония в атмосфере сухого азота в 6 мл сухого диметилсульфоксида добавляют 3j24 мл (6,5 ммоль) 2М раствора метилсульфинилметида натрия в диметилсульфоксиде и 613 мг (1,29 ммоль) -пояуацеталя-2-Г5с -окси-3 d,- (тетрагидропиран-2-илокси)-20-(ЗА -тетрагидропиран-2-илокси- -фенокси-транс- 1-бутен-1-ил) циклопент-1с1-ил -ацетальдегида в 5 мл сухого диметилсульфоксида в течение 20 мин. После перемешивания в течение 2 ч при комнатной температуре реакционную смесь выливают в воду со льдом, Водный раствор дважды промывают этилацетатом по 20 мл и подкисляют до рН 310%-ной соляной кислотой. Кислый раствор экстрагируют этилацетатом (3x20 мл), органические экстракты соединяют и промывают 10 мл воды, сушат сульфатом магния, выпаривают, остаток растирают с этилацетатом, фильтрат выпаривают и получают 75 мг 9ci-окси-11 cL , 15 -бис-(тетрагидропиран-2-илокси)-16-фенокси-цис-5-транс-13-м-тетранорпростадиеновой кислоты ИК-спектр (CHCli): 1720 см-(СООН). Пример Зо 9с---окси-1 loU ,15 -бис-(тетрагидропиран-2-илокси)-16-фенокси-ы-тетранорпростановая кислотаСмесь 190 мг (0,33 ммоль) 9 : -окси-11 cL , 1 5о1 -бис- (тетрагидропиран-2-илокси)-16-фенокси-цис-5-транс-13-W- тетранорпростадиеновой кислоты, 5% палладия на угле (150 мг) в 10 мл метанола перемешивают в атмосфере водорода 60 ч при комнатной температуре. Смесь фильтрируют и выпаривают, получают Sd- -окси-1 Id., (тетрагидропиран-2-илокси) -1 б-фснокси-vj-тетранорпростановую кислоту, Пример 4. 9(1-окси-1 Id, 15cL-бис (тетрагидропиран-2-илокси)-1б-фенокси-13-транс-ы-тетранорпростановая кислота. Гетерогенную смесь 800 мг 9с{, -окси-1 Id, (тетрагидропиран-2-илокси)-1б-фенокси-цис-5-транс-13 -w-тетранорпростадиеновой кислоты и 80 мг 5 -ного палладия на угле в
5893)30
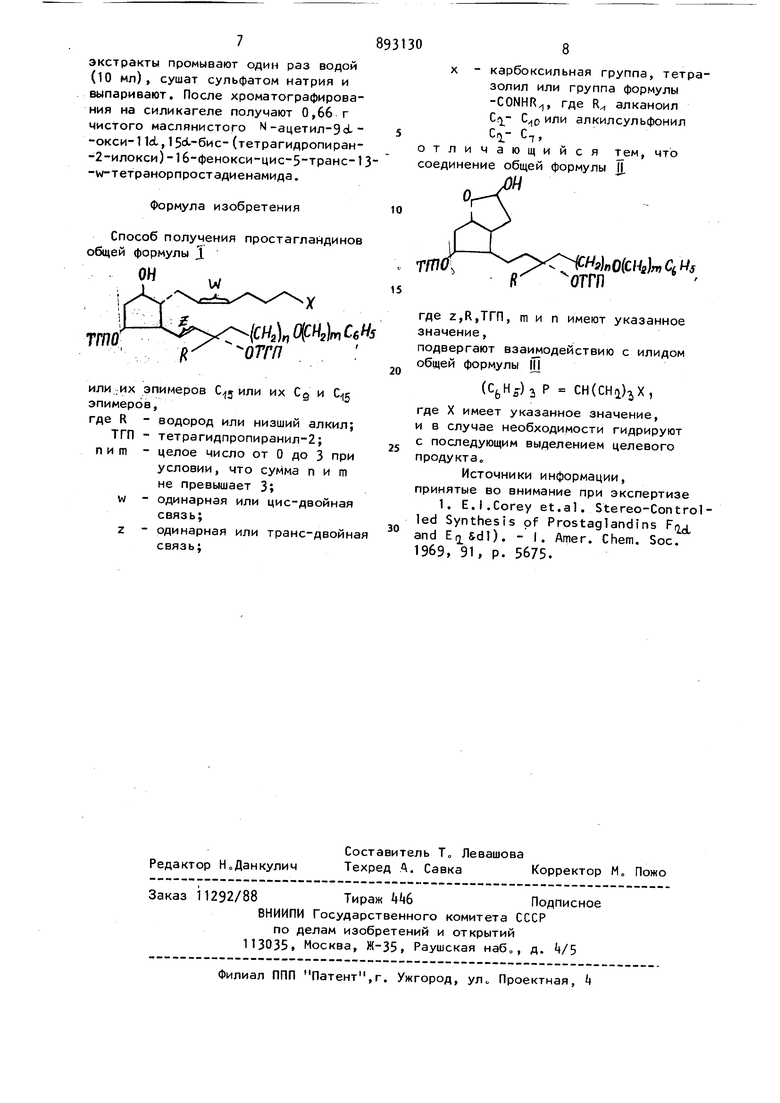
10 мл абсолютного метанола перемеши- , -(тетразол-5-ил)-9о1 окси-}1в1,15 i 6«cвают 5 ч при -22° под давлением воде--(тетрагидропиран-2-илокси)-16-фенокрода в 1 атм. Затем смесь фильтруютcM-MMc-5 TpaHc-13 w-T.eTpaHopnpocTaи фильтрат выпаривают, получают 9с1 -окси-11dL, 15ii -бис(тетрагидропиран-2-илокси)-1б-фенокси-13 TpaHC-w-тетранорпростановую кислоту. Пример 5 1-(тетразол-5-ил) -9et -окси-1 Id, 15 d -бис- (тетрагидропиран-2-илокси)-1б-феиокси-цис-5-транс-13 w-тeтpaнopпpocтaдиeн. К раствору 1,9 г t-(тетразол-5-ил)бутилфенилфосфоний бромида в атмосфере азота в 6 мл сухого диметилсульфоксида добавляют 3,2 мл 2М раствора метилсульфинилметида натрия в диметилсульфоксиде. К этому раствору по каплям добавляют раствор 615 мг 2Г-полуацеталя-2-Г5с1-окси-3(Х (тетрагидропиран-2-илокси)-26-(3 1-тетрагидропиран-2-илокси- -фенокси-транс-1-бутен-1-ил) и циклопент-1с1-ил -ацетальдегида в 5 мл сухого диметилсульфоксида в течение 20 мин„ После перемешивания в течение 2 ч при комнатной температуре реакционную смесь выливают в ледяную воду„ Щелочной водны раствор подкисляют 0,1 н.НС1 и экстра гируют этилацетатом. Остаток после вы паривания растворителя хроматографируют и получают чистый 1-(тетразол-5 -ил)-9с1-окси cL, 1 5о1-бис (-тетрагидропиран-2-илокси)- 16-фенокси-цис-5-транс-1З-м-тетранорпростадиен. Пример 6 о 1(-тетразол-5-ил)-9с1 окси-1 Id/ -15d- -бис (-тетрагидропиран-2-илокси)-1б-фенокси-цис-5-транс-13-w-тeтpaнopпpocтaдиeн, К раствору 4-(тетразол-5-ил)бутилтрифенилфосфоний бромида (1,+9 г) в атмосфере сухого азота в 6 мл диметилсульфоксида (сухого) добавляют 3,24 мл 2 М раствора метилсульфинилметида натрия в диметилсульфоксиде. К этому раствору добавляют по каплям раствор 615 мг7-полуацеталя-2- 5 oL-окси-3с1-- (тетрагидропиран-2-илокси)-26-(Зс1-тетрагидропиран-2-илокси-А-фенокси-транс-1-бутей-1-ил)циклопентен-1-ил -ацетальдегида в 5 мл сухого диметилсульфоксида в течение 20 мин,, После перемешивания в течение 2 ч при комнатной температуре реакционную смесь выливают в ледяную воду. Щелочной водный раствор подкисляют 0,1 Н.НС1 и экстрагируют этилацетатом„ Остаток после выпаривания растворителя хроматографируют и получают 680 мг чистого бесцветного маслянистого1диена, Пример 7. N-метансульфонил-9с1 окси-1 IdL, -бис-(тетрагидропиран-2-илокси)-1б-фенокси-цис-5-транс-13 м-тетранорпростадиенамид. К раствору 1,7 г бромистого С -метансульфониламинокарбонилбутил -трифенилфосфония в атмосфере сухого азота в 6 мл сухого диметилсульфоксида добавляют 3,2 мл (6,5 ммоль) 2 М раствора метилсульфонилметида натрия в диметилсульфоксиде, К этому раствору по каплям добавляют раствор 610 мг (1,29 ммоль) 7 полуацеталя-2- Г5с1--окси-3г - - (тетрагидропиран-2-илокси) -20- (Зс1-тетрагидропиран-2-илокси)-4-фенокси-транс-1-будбн-1ил(-циклопент-1)-ил -ацетальдегида в 5 мл сухого диметилсульфоксида в течение 20 мин. После перемешивания в течение еще 2 ч при комнатной температуре реакционную смесь выливают в ледяную воду. .Щелочной водный раствор дважды промывают этилацетатом (2x20 мл), соединенные органические экстракты промывают один раз 10 мл воды, сушат сульфатом натрия и выпаривают После хроматографирования на силикагеле получают бВ мг чистого маслянистого М-метансульфонил-9° -окси-1loL, 15 -бис-(тетрагидрЬпиран-2-илокси)-1б-фенокси-цис-5 транс-1 3 w-тeтpaнopпpocтaдиeнaмидa, Пример 8. М-ацетил-9н,-окси-11 ct, 15 oL-бис- (тетрагидропиран-2-илокси-)16-фенокси-цис-5 транс-13 -w-тетранорпростадиенамид, К раствору 5,32 г (ацетамидкарбонил)-бутил -трифенилфосфоний бромида в 10 мл сухого диметилсульфоксида в атмосфере сухого азота добавляют 17,7 мл 2 М раствора метилсульфинилметида натрия в диметилсульфоксиде. К этому раствору по каплям добавляют раствор 0,52 г (1,1 ммоль) jT -полуацеталя-2- 5о1-окси-3А - (тетрагидропиран-2-илокси) -26- (Зс1- -тетрагидропиран-2-илокси)- -фенокси-траис-1 -бутен-1-ил)-циклопент-id. -ил -ацетальдегида в 10 мл сухого диметилсульфоксида в течение 20 мин.После перемешивания в течение 2 ч при комнатной температуре смесь выливают в ледяную воду о Щелочной водный раствор дважды промывают этилацетатом (3x25 мл), соединенные органические экстракты промывают один раз водой (10 мл), сушат сульфатом натрия и выпаривают. После хроматографирования на силикагеле получают 0,66 г чистого маслянистого N-ацетил-Эс-окси-11cL, 15с -бис- (тетрагидропиран-2-илокси)-16-фенокси-цис-5 транс-1 -w-тетранорпростадиенамида. формула изобретения Способ получения простагландинов общей формулы Д 1СН,0(СЙг)тСб или их эпимеров или их Сд и эпимеров, где R - водород или низший алкил; ТГП - тетрагидпропиранил-2; пит - целое число от О до 3 при условии, что сумма пит не превышает 3; W - одинарная или цис-двойная связь; Z - одинарная или транс-двойна связь; 8 X - карбоксильная группа, тетразолил или группа формулы -CONHR, где R алканоил 1. -10 алкилсульфонил С, тличающийся тем, что оединение общей формулы II л f f}nO{CHa}rf,CiHs ОГГП где z,R,Trn, тип имеют указанное значение, подвергают взаимодействию с илидом общей формулы Ц ()2 Р CH(CHQ.)X, где X имеет указанное значение, и в случае необходимости гидрируют с последующим выделением целевого продукта. Источники информации, принятые во внимание при экспертизе 1. E.I.Corey et.al. Stereo-Control led Synthesis of Prostaglandins Fr and ). - I. Amer. Chem. Soc. 1969, 91, p. 5675.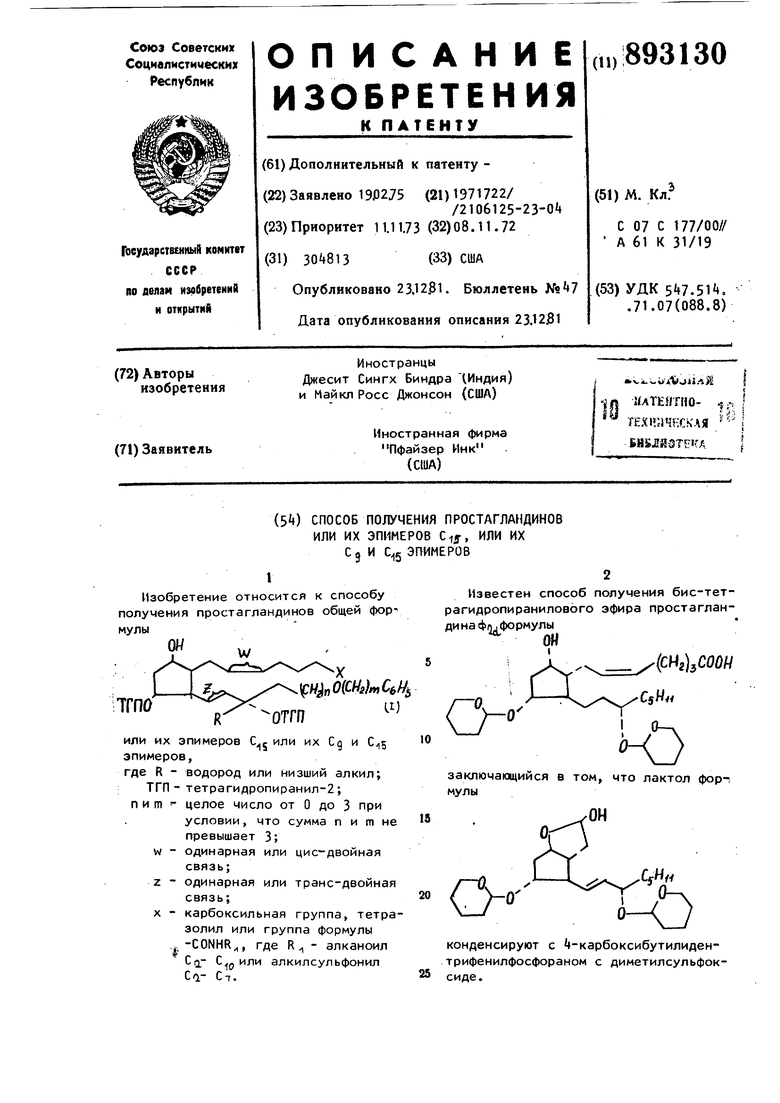


| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения производных -тетранорпростагландинов или их эпимеров по с -или их солей | 1973 |
|
SU584766A3 |
| Способ получения 11-дезокси-16арилокси- -тетранорпростагландинов или их солей | 1976 |
|
SU679134A3 |
| Способ получения аналогов природных простагландинов | 1974 |
|
SU522789A3 |
| Способ получения промежуточных соединений для получения простагландинов | 1975 |
|
SU645563A3 |
| Способ получения аналогов природных простагландинов | 1973 |
|
SU665799A3 |
| Способ получения промежуточных соединений для синтеза простагландинов и их -эпимеров | 1976 |
|
SU640660A3 |
| Способ получения аналогов природных простагландинов | 1974 |
|
SU515438A3 |
| Способ получения производных простагландинов или их с и с эпимеров | 1978 |
|
SU745362A3 |
| Способ получения производных простагландина | 1977 |
|
SU900806A3 |
| Способ получения 15-замещенных простановых производных или их солей | 1973 |
|
SU644384A3 |


Авторы
Даты
1981-12-23—Публикация
1975-02-19—Подача