..1 , .
Изобрет.ение относится к способу получения нового гликозвда-гидрохлорида 4 -эпи-6 ксидауноми1шна, обладающего ценными фармакологическими свойствами. Цель изобретения - получение нового ценного соединения, расширяющего ассор/тимент средств воздействия на живой ор:ганйзм.;
. . Цель достигается путем синтеза данного соединения, основанного на известной реакции образования гликозидной связи. Описывается способ получения гидрохйорида 4 -эпи-б-оксидауномицина формулы
О
doCHs
-он (1)
но но
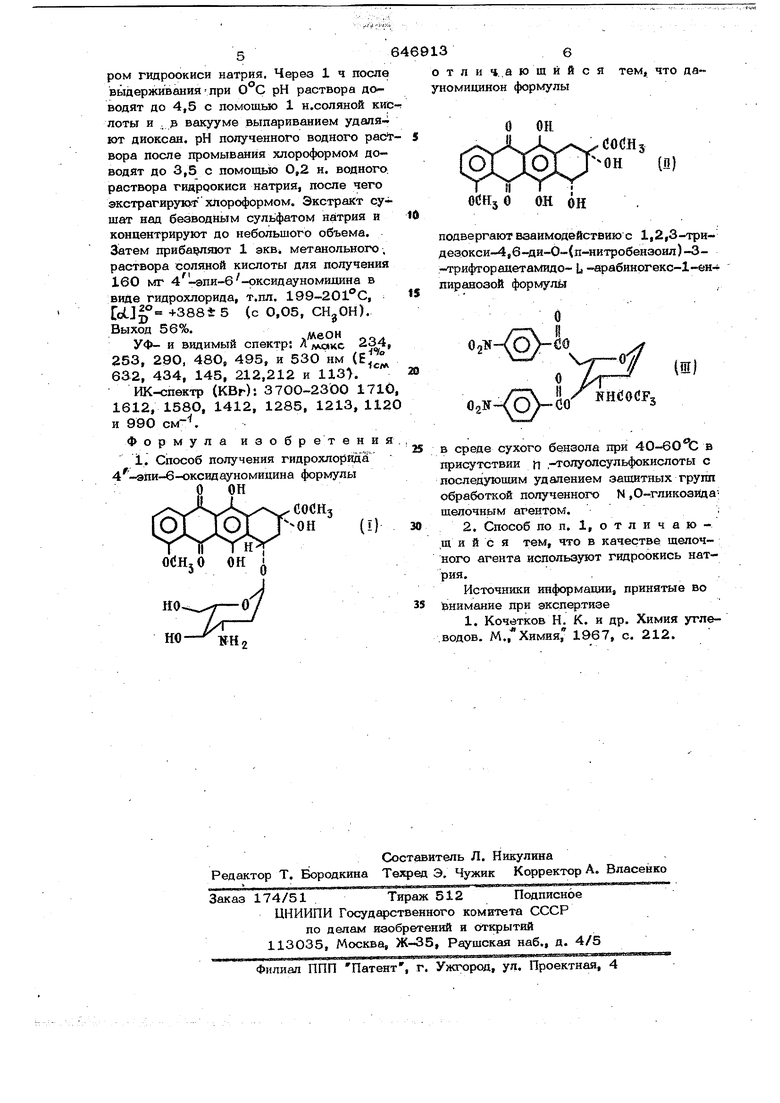
заключающийся во взаимодействии .дауномицинона формулы О ОН
.coCHj он (п)
OOHjO
он он
с 1,2,3-триде3окси-4,6-ди-о-(п-нитробензоил)-3-трифторацетамидо- U-арабиi нргекс-1-енпиранозой формулы. О
IS
(ш)
20 . в среде сухого бензола при 40-60 С в присутствии п-зюлуолсульфокислоты с последующим удалением защитных групп обработкой N ,О-гликозида щелочным агентом.
В качестве щелочного агента предпочтительно используют гвдроокись натПример, Получение 1,2,3-трид езокси-4,6 -д и-О- (п-нитробензоил) -3 :-трифторадетамидо- Ц -.арабиногекс 1-енпираноэы ( llf ),
2,85 г метил-:3-аэвдо-4,6-0-бензилийен-2,3-двдезокси-с -арабиногексопи-, раыозида растворяют в 40 мл безводного метанола и гидрируют при 4,2 атм Э присутствии никеля Ренея в течение 3 ч. Катализатор отфильтровывают и фильтрат выпаривают досуха в вакууме, Остаток перекристаллизовывают из этиль ацетата для получения 2,17 г метил-3 -амино 4,6-О-бензилиден-2,3-двдеаокси-ci- i-арабиногексопиранозида (соединекие А). Выход 84%, т.пл, 95-96 Cj ; -86 (с 0,5, СНСез ).
Строение соединения А подтверждено ПМР и масс-спектрами.
2,15 г соединения А растворяют в 4О мл 0,5 н,метанольного раствора со-н . ляной кислоты и смесь перемешивают при комнатной температуре в течение 1ч, Раствор выпаривают до половины объема, прибавляют к нему безводный эфир, образовавшиеся кристаллы соёира- ют отсасыванием и промыЬают алыми количествами сухого эфира для получения 1,5 г метил-3-амвдо-2,3-дидезоксй ot L-арабиногексопиранозвда (соедине-i ние Б), т.пл. (с разл.), oCj -92 (с 0,4, ). Выход 87%,
Строение полученного соединения подц тверждено ПМР- и масс-спектрами,
1,5 г соединения Б кипятЯт с обратным холодильником ;В 1 н.соляной кислоте в течение 5 ч. Раствор встряхивают при комнатной температуре в присутствии смолы Амберлит, 1R 45 (ОН) до тех пор, пока рН не достигнет 5. Смолу отфильтровывают и фильтрат выпаривают в вакууме до половины объемами затем высушивают при температуре ниже , Остаток кристаллизуют из смеси метанол-этилацетат для получения 1,33 г 3-амино-2,2-дидезой6и- L -арабиногексо-н :зы (соединение в) в Виде хЛоргШра а, т.пл. 155 157С (с разл.),Со13 °-55° (с 0,5, НгО). Выход 95%. Строение полученного соединения подтверждено ПМР-спе,ктрами..
К суспензии 1,25 г соединения В в безводном эфире прибавляют 7,6 мл антгидрида трифторуксусной кислоты при охлаждении и перемешивании. Смесь перемешивают при комнатной температуре в
течение 20 ч и образовавшийся прозрачный раствор выпаривают в вакууме. остаток растворяют в 20 мл безводного метанола и выдерживают при комнатной температуре в течение 20 часов. После удаления растворителя остаток пё.рёкристаллизовывают из смеси ацетон-хлороформ для получения 1,72 г 2,3-дидезокси-З-трифторацетамидо- L -арабиногексозы (соединение Г), т.пл, , 58° (с 0,5, диоксан). Выход 90%.
Строение соединения Г подтверждено масс-спектром,
1Д г полученного соединения Г до
S бавляют небольшими порциями в течение 30 мин при перемешивании и комнатной температуре к раствору 3,17 г хлористого п-нитробензоила в 30 мл безводного пиридина и перемешивание продолжа-. ют при комнатной температуре В течение 20 ч. К раствору, охлажденному до , добавляют охлаааденный льдом, раствор 1,44 г бикарбоната натрия в 20 мл воды и смесь выливают в 350 мл ледяной воды, . .
Осайок удаляют фильтрованием, промывают водой и высушивают над пятиокисью фосфора. Высушенный продукт кристаллизуют из смеси хлористый метилен-эфир для получения 2,3 г целевой ls2,3-TpHдезокси-4,6-ди-0-(п-нитробензоил)-3-трифторацетамидо- U -apaбинoгeкc-l-eнпиpaнoзы (Ш ), т.пл. 214-215С, ct - 117° (с 0,5, СНСбз ). Выход 95%Г
Строение полученного соединения подтверждено ПМР-спектрами и масс-спектром.
Получение 4 -эпи-6 -юксидауномицина (I,) ..
200 мг дауномицина ( Ц ) растворяют в 100 мл безводного бензола и к раствору добавляют 540 мг 1,2,3-трид езокси-4,6-ди-0-(п-нитробензоил)-3 Трифторацетамидо- 4 -арабиногекс-1-енпиранозы (Ш) и 2О мг п-толуолсульфоновой кислоты. Реакционную смесь перемешивают при 55С в течение 20 ч охлаждают до комнатной температуры, обjg разовавшийся осадок отфильтровывают и -кристаллизуют из этанола для получения 340 мг защищенного d -7-0- 4,б-ди-О-(п-нитробензоил)-3-трифторацет амидо- L -арабиноЗ-дауномицинона, т.пл, 55 282°С, ГоС J. +260 t 5 (с 0,05, .
снсе 3 .). ..
Защищенный гликозид растворяют в 2О мл диоксана и после охлаждения до О С обрабатывают 0,2 н.водным раство5ром гидроокиси натрия. Через 1 ч после выдерживания-при рН раствора доводят до 4,5 с помощью 1 н.соляной кис лоты и , р вакууме выпариванием удаляют диоксан. рН полученного водного расТ вора после промывания хлороформом доводят до 3,5 с помощью 0,2 н. водного, раствора гидроокиси натрия, после чего экстрагируют хлороформом. Экстракт сушат над безвод ньтм сульфатом натрия и концентрируют до небольшого объема. Затем приба яют 1 экв метанольного, раствора соляной кислоты для получения 160 мг 4 -эпи-б-оксидауномидина в виде гидрохлорида, т.пл. 19 9-201 С, ,°-+388 5 (с 0,05, СНдОН). Выход 56%. Уф- и видимый спектр: А лмакс 234, 253, 290, 480, 495, и 530 нм (Ef 632, 434, 145, 212,212 и 113, ИК-спектр (КВг): 3700-2300 1710 1612, 158О, 1412, 1285, 1213,1120 и 990 . Формула изобретени 1, Способ получения гидрохлорйда 4 -эпи-6-оксидауиомицина формулы ОН 13 отлич.,ающйй с я тем, что да номицинон формулы (JodHj он подвергают взаимодействию с 1,2,3-тридезокси-4,6-ди-0- п-нитробенэоил) -3-трифтораиетамидо- Ь -арабинргекс-1-енпиранозой формулы в среде сухого бензола при 40-60 Ъ в гфисутствии п ,-толуолсульфокислоты с последующим удалением защитных групп обработкой полученного N ,0-гликозИдащелочным агентом. 2. Способ по п. 1, о т л и ч а ю ,щ и и с я тем, что в качестве щелочного агента используют гидроокись натрия. Источники информации, принятые во внимание при экспертизе 1. Кочетков Н. К. и др. Химия углеводов. М., Химия, 1967, с. 212.

| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения хлоргидрата 4 -эпи-6 оксиадриамицина | 1976 |
|
SU628822A3 |
| Способ получения гликозидов антрациклина | 1980 |
|
SU993822A3 |
| СПОСОБ ПОЛУЧЕНИЯ ГИДРОХЛОРИДА АНТРАЦИКЛИНгЖ5^ИДА | 1977 |
|
SU826956A3 |
| Способ получения антрациклин-глико-зидОВ | 1979 |
|
SU797583A3 |
| Способ получения гидрохлоридов оптически активных антрациклинонгликозидов | 1976 |
|
SU646914A3 |
| Способ получения гидрохлорида 4-деоксидауномицина | 1976 |
|
SU670226A3 |
| Способ получения гидрохлорида оптически активных дауносаминилпроизводных антрациклинонов | 1977 |
|
SU724087A3 |
| Способ получения гликозидных антибиотиков или их гидрохлоридов | 1975 |
|
SU650507A3 |
| Способ получения гликозидов антрациклина | 1976 |
|
SU728719A3 |
| Способ получения гликозидов | 1979 |
|
SU963471A3 |


Авторы
Даты
1979-02-05—Публикация
1975-10-27—Подача