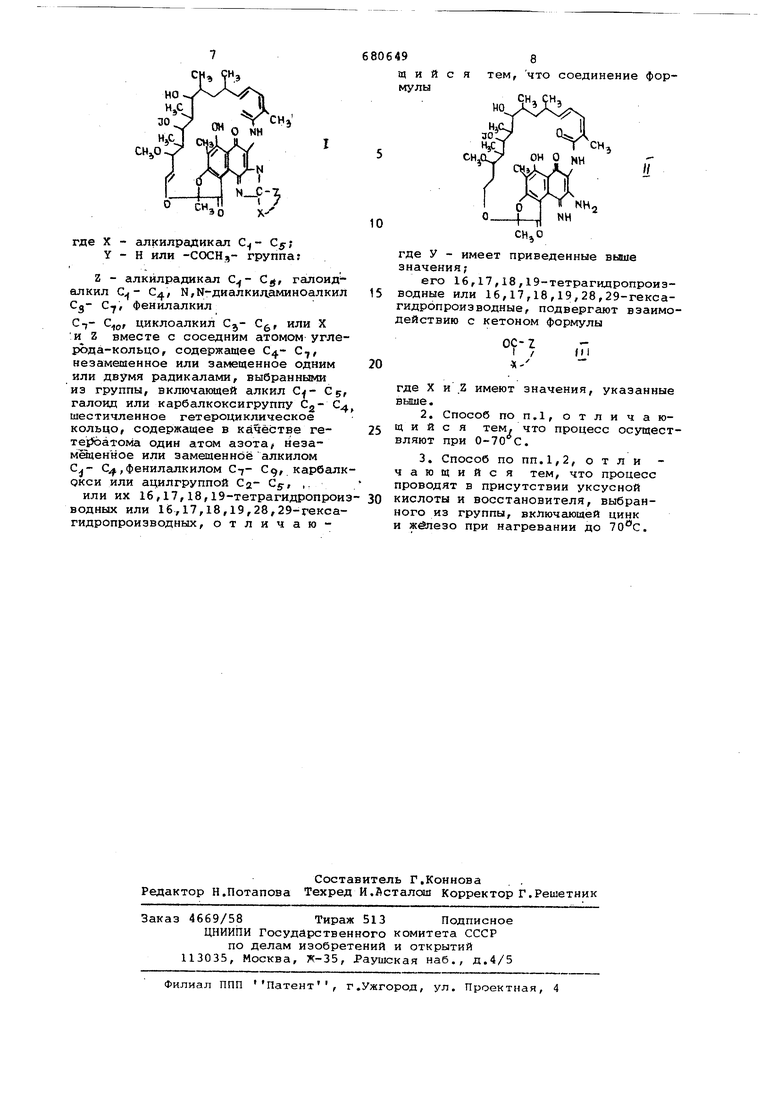
|Где Y имеет приваленные выше значения, его 16,17,18,19-тетрагидропроиз водные или 16,17,18,19,28,29-гекса гидропроизводные, подвергают взаимодействию с кетовом Формулы ОС - 1 где X и Z имеют значения, указанны выше. Процесс обычно проводят при 0-70Cfпредпочтительно, в присутст уксусной кислоты и восстановителя, выбранного из группы, включающей цинк и железо, причем в последнем случае при нагревании до 10°С. Пример. 10 г З-амино-4-деоксо 4-иминорифамицина S растряют в 20 мл циклогексанона К рас вору добавляют 1 г цинка, 20 мл уксусной кислоты и смесь перемешивают в течение 60 мин при комнатно температуре. Непрореагировавший цинк отфильтровывают, реакционный раствор добавляют к 100 мл дихлорметана, промывают водой, высушивают над сульфатом натрия и выпаривают досуха. Остаток вновь растворяют в 30 мл дихлорметана, раствор смешивают с 200 мл петролейно эфира, полученный осадок отфильтро вываюа-, после этого раствор концентрируют до 50 мл. Получают 4,8 г продукта формулы (Г), где У - COCHj, X и Z вместе с атомом С, с которым они связаны, образую циклогексилиденовую группу. Пример2. Юг З-амино-4десксо-4-иминорифамицина S раст воряют в 25 мл метилизобутилкетон Раствор смешивают с 1 г цинка, 30 мл-уксусной кислоты и нагреваю при 40 С в течение 30 мин. Избыто цинка отфильтровывают, реакционны раствор добавляют к 100 мл дихлор тана и промьшают водой. После выс шивания над сульфг.том натрия и ко центрирования до 20 мл добавляют 100 мЛ циклогексана и 50 мл петро лейного эфира. Раствор отфильтровывают и выпаривают досуха. Выход 4,4 г продукта формулы (I) t где У - СОСНз, метильная и Z -. изобутильная группа. Примерз. 8г З-амино-4-деоксо-4-иминорифамицина S-смеши вают с 2,5 г железа и растворяют в 15 мл ацетона и 15 мл уксусной кислоты. После перемешивания при 35°С в течение 15 мин избыток жел за Отфильтровывают и раствор выливают Б 600 мл воды. Раствор пос этого отфильтровывают, промывают водой, водную фазу экстрагируют толуолом после корректировки рН до 7 посредством кислого (вторичного) фосфата натрия. Толуол концентрируют до 20 мл и после этого разбавляют 80 мл циклогексана. После фильтрования смесь двух растворителей выпаривают и получению 3,5 г продукта формулы Г, где У - COCHj Z и X - метильные группы. Пример4, 8 г З-амино-4-деоксо-4-иминорифамицина S растворяют в 25 мл диоксана, смешивают с 6 г 1-метил-4-пиперидона, растворенного в 5 мл диоксана, и раствор нагревают,при в течение 10 мин. Раствор вЕдливают после этого в 400 мл води, содержащей 20 г хлористого натрия, осадок отфильтровывают, фильтрат экстрагируют хлороформом, органическую фазу высушивают нащ сульфатом натрия и растворитель выпаривают. Полученный остаток растворяют в бензоле и раствор экстрагируют водным / раствором кислого (вторичного) фосфата натрия. Бензол отмывают водой, раствор высушивают нал сульфатом натрий и после .этого выпаривают досуха. Выход 2,2 г продукта формулы Т, где У - COCHj a X и Z вместе с атомом С, с которым они связаны, образуют 4-(1-метил)-пиперидинилияеновую группу. .Пример 5. Вг З-амино-4-деоксо-4-иминорифамицина S подвергают взаимодействию с 1 г цинка, 15 мл тетрагидрофурана, 8,5 мл 1-ка;рбэтокси-4-пиперидина и 2,5 мл уксусной кислоты при в течение 10 мин. Реакционную смесь после этого фильтруют и разбавляют 200 мл ксилола, промьшают раствором фосфатного буфера при р 7,5, после этого водой и наконец высушивают над сульфатом натрия. После этого ксилол выпаривают до получения 100 МП раствора, которай разбавляют 150 мл петролейного эфира, отфильтровывают и выпаривают досуха. Полученный остаток вновь смешивают с петролейным эфиром, отфильтровывают и высушивают.Выход 5 г продукта формулы Т, где У - COCHj,а X и Z вместе с атомом G, с которым они связаны, образуют 4-(1-карбэтокси)-пиперидинилиденовую группу. . , f Пример 6. 8 г З-амино-4-яеоксо-4-иминорифамицина S подвергают взаимодействию с 1 г цинка, 10 мл тетрагидрофурана, 12 мл хлорацетона и 25 мл уксусной кислоты. Через 5 мин при реакция завершается и после отфильтровывания непрореагировавшего цинка раствор выливают в 800 мл буферного раствора при рН 7,5, содержащего 5 г аскорбиновой кислоты. Полученный осадок отфильтровывают, промывают водой и высушивают в йакууме при 40°С. Затем остаток экстрагируют длительное время петролейным эфиром и после выпаривания растворителя получают 3,6 г продукта формулы Г, гле У - СОСН2;,Х - метильная, а Z - хлорметильная группа, Пример. 8.г З-амино-4 деоксо-4-иминорифамицина S подвергают взаимодействию с 1 г цинка 15 мл тетрагидрсфурана, 8 мл 1-бензил-4-пиперидона и 30 мл уксусной кислоты. После перемешивания при в течение 15 мин непрореагировавший цинк отфильтровывают, затем добавляют 1 г аскорбиновой кислоты, при последующем разбавлении 300 мл ксилола и промы вают раствором фосфатного буфера при рН 7,5 и после этого водой. После высушивания раствора над сульфатом натрия растворитель выпаривают до сухого остатка, который после этого длительное время экстрагируют петролейным эфиром. Получают 2,5 г продукта формулы Т, где У - ССХ:Нз, а X и Z вместе с атомом С, с которым они связаны, образуют 4-{1-бензил)-пиперидинилиденовую группу. П р-и м.е р 8. 8 г З-амино-4-деоксо-4-имино-1б,17, 18,19-тетрагидрорифамицина S подвергают взаим действию с 1 г цинка, 15 мл тетра|гидрофурана, б мл диэтиламиноацето на и 30 мл уксусной кислоты. После перемешивания при комнатной темпер ууре в течение 15 мин избыток цинк отфильтровывают,добавляют 1 г аскор биновой кислоты и раствор по капля выливают в 700 мл воды. Полученный осадок отфильтровыва и вновь растворяют в минимальном объеме метилового спирта. Метаноль ный раствор разбавляют 25% мл этил вого эфира и после этого экстрагир ют раствором фосфатного буфера при рН 7,5. Водный слой подкисляют до рН 3 и после этого экстрагируют хл роформом. Хлороформный слой промывают водой, высушивают над сульфатом натрия и выпаривают досуха. Таким образом получают 0,8 г 16,17 18,19 ,-тё1рагидропроизводного продукта формулы t, где У - СОСНд, X - метильная, Z - диэтиламинометильная группа. Пример 9. 8г З-амино-4-де ОКСО-4-ИМИНО-16,17,18,19,28,29-гекс гидро-25-дезацетилрифамицина S подв гают взаимодействию с 1 г цинка, 15 мл тетрагидрофурана, 4,5 г 1-аце тил-4-пиперидона и 25 мл уксусной кислоты. После перемешивания при комнатной температуре в течение 30 мин непрореагировавший цинк отфильтровывают, добавляют 1 г аскор биновой кислоты и раствор разбавля ют 300 мл этилового эфира. Эфирный раствор тщательно промывают водой и после этого высутлйвают над сульфатом натрия. После этого остаток разбавляют 50 мл петролейного- эфир отфильтровывают и выпаривают досух 96 Таким образом получают 1,7 г 16,17, 18,19,28,29-гексагидропроизводного продукта формулы Т, где У - Н, а X и Z вместе с атомом С, с которым они связаны,образуют 4-(1-ацетил)пиперидинилиденовую группу. ПримерЮ. 8 г З-амино-4-деоксо-4-иминррифамицина S подвергают взаимодействию с 1 г цинка, 15 мл тетрагидрофурана, 2,5 г метилциклопропилкетона и 25 мл уксусной кислоты. Через 30 мин при непрореагировавишй цинк отфильтровывают раствор разбавляют 100 мл бензола и 300 мл этилового эфира и после этого промывают раствором фосфатного буфера при рН 7,5 и водой. Органический слой выпаривают, остаток смешивают с 30 мл метилового спирта и после добавления 5 мл воды, содержащей 1 г аскорбиновокислого натрия, раствор по каплям выливают в 300 мл насьпценного водного раствора метабисульфита натрия. Полученный осадок отфильтроввлвают, промывают водой и высушивают. Таким образом получают 2,2 f продукта формулы I, где У - СОСН2,Х - ме.тильная, а Z циклопропильная группа. ; Пример11.8г З-амино-4-деоксо-4-.аминорифамицина S растворяют в 25 мл тетрагидрофурана и раствор по каплям добавляют к смеси, содержащей 35 мл уксусной кислоты, 1 г цинка и 5 г 4-фенил-бутан-2-она, предварительно нагретых до 60°С. После перемешивания при 60°С в течение 30 мин непрореагировавший цинк -отфильтровывают, к смеси добавляют 1 г аскорбиновой кислоты и смесь разбавляют 250 мл бензола. После этого смесь тщательно промывают водой, высушивают над сульфатом натрия и бензол выпаривают. Полученный остаток растворяют в минимальном объеме метилового спирта, раствор обрабатывают 5 мл воды, содержащей 1 г аскорбинового натрия и после этого выливают в 1000 мл воды. Полученный осадок отфильтровывают, промывают водой и высушивают. Продукт вновь растворяют в 40 мл бензола, добавляют 80 мл петролейного эфира, отфильтровывают и раствор выпаривают. Полученный остаток фиолетовой окраски обрабатывают водой и отгфильтровывают. После высушивания, получают 2,8 г продукта формулы 1, где У - ССЮН, X - метильная, а Z - фенэтильн-ая группг-о Строение полученных соединений подтверждено данными ИК, УФ и ЯМ- спектров. Формула изобретения 1, Способ получения рифамшдиновых соединений общей формулы Г где X - алкилрадикал Cgj У - Н или -СОСН,- группа: Z - алкилрадикал С,, галоид алкил С - С, Ы,К-диалкил.аминоалкил Сд- С, фенилалкил С-у- , циклоалкил С, или X и Z вместе с соседним атомом углерЬда-кольцОг содержсодее 04- С,, незамешенное или замещенное одним или двумя радикалами, выбранными из группы, включаквдей алкил Ср, галоид или карбалкоксигруппу Cg- С шестичленное гетероциклическое кольцо, содержащее в качестве геTejfoaTOMa один атом азота# незамещенное или замещенное алкилом Cj- С,фенилапкилом С7- Сд,. карбгшк окси или ацилгруппой Са- Cg, ,. или их 16,17,18,19-тетрагидропрои водных или 16,17,18,19,28,29-гексагидропроизводных, отличаю498 тем, что соединение форщ и и с я мулы НО -- где У - имеет приведенные выше значения; его 16,17,18,19-тетрагидропроизводные или 16,17,18,19,28,29-гексагидропрои3водные, подвергают взаимодействию с кетоном формулы где X и Z имеют значения, указанные выше. 2.Способ ПОП.1, отличающийся тем, что процесс осуществляют при 0-70 с. 3.Способ попп.1,2, отли чающийся тем, что процесс проводят в присутствии уксусной кислоты и восстановителя, выбранного из группы, включающей цинк и при нагревании до 70с.


| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения рифамициновых соединений | 1976 |
|
SU674676A3 |
| Способ получения производных рифамицина | 1976 |
|
SU686620A3 |
| Способ получения производных рифамицина | 1981 |
|
SU1047391A3 |
| Способ получения производных тетрациклина | 1973 |
|
SU574145A3 |
| Способ получения гликозида | 1987 |
|
SU1590045A3 |
| Амиды циклометилен-1,2-дикарбоновых кислот, обладающие гипотензивной активностью | 1989 |
|
SU1838294A3 |
| Способ получения 9-дезокси-9 @ -метиленизостеров @ или их лактонов или их солей | 1979 |
|
SU1053745A3 |
| Способ получения рифамициновых соединений их 16,17,18,19-тетрагидроили 16,17,18,19,28,29-гексагидропроизводных | 1976 |
|
SU645584A3 |
| Способ получения производных 8,12-диизопростановой кислоты | 1975 |
|
SU626692A3 |
| Способ получения производных цефалоспорина или их солей с щелочными металлами | 1980 |
|
SU1005664A3 |


Авторы
Даты
1979-08-15—Публикация
1976-06-11—Подача