где Ry R и R- имеют-вьлшеукааанные значения, подвергают взаимодействию с трехокипью хрома в смеси уксусной кийлбты и ацетона при температуре от (-50) до (-65)°С и полученный целевой продукт выделяют в виде сво;бодного основания или в виде соли. ; П р-и м е р 1. Получение 4-дезок сивинкристина. 582 мг трехокиси хрома растворяют в 5,8 мл уксусной кислоты -и 0,6 мл воды, по каплям добавляют в течение 5 мин к перемешиваемому раствору 462 мг 4-дезоксивинбластина .А в 58 мл ацетона и 2,9 мл ледянойуксусной кислоты при (-50)С, перемешивают при этой температуре Зб мин, охлаждают до (-65)°С и при этой тем Перйтуре резко охлаждают добавлением 12 Мл 14 н.растворагидроокиси аммо ния. Подщелоченную массу переливают .3 400 MJi смеси льда и воды и водный слой экстрагируют 150 мл простого эфирас последующей трехкратной экст ракцией 150 мл хлороформа.Органичес ;КЙе слои объединяют, отмывают разбав ленным раствором бисульфата натрия, сушат, упаривают и получают4-дезокСИВИНКрЙСТЙН . ,--.--... Для дальнейшей очистки соединени хроматографируют на 50 г активной двуокиси кремния, элюируя 300 мл см си этилацетат-метанол (3:1) в сочетании с промывкой смесью .эт1илацетат метанол (1:1). После отбора первой фракции 10б -мл) собирают фракции п 2(3 мл. Фракции 8-20 упаривают и получаю 279 мг светло-коричневого : твёрдог& вещества, которое дает- одно пятно (чистый материал) при тонкослойной хроматографии (ТСХ).. Масс-спектр7 т/е: 808 (М ), 806, 807. ИК-спектр: 3465; 1745, 1687, 1220 см-. УФ-спектр: 210, 222, 255, 2906, ja98 им. ЯМР-спектр (100 МГц): метильные синглеты- при 3,88, 3,67 и 2,07d ..4-Дезо.ксивинкристин (свободное основание, коричневое твердое вещест во) растворяют в ацетоне, обрабатывают 0,9 мл 0,36 М (2 об.%) серной кислоты в абсолютном этаноле. Полученный зелёный раствор оставляют на ночь при О°С.: Кристаллизацию вызывают .соскабливанием или введением затравочных кристаллов и полученное Твердое кристаллич.еское вещество - сульфат 4-деэоксивинкристина отфильт ровывают. Осадок на фильтре промыва ГОТ холодньм ацетоном. Сульфат нескол ко растворим в ацетоне, так что филь рат выпаривают досуха и остаток перекрйсталлизовывают из этанола.;Вес сульфат промывают этанолом, общий выход сульфата 4-дезоксивинкристина 266 мг. Аналогичным образом окисляют 794 мг 4-дезоксивинбластина в в растворе 900 мг трехокиси хрома в 10 мл ледяной уксусной кислоты и 1 мл воды и получают 4-дезокси-1-формиллейрозидин. ТСК остатка, полученного непосредственно после окисления смеси до ее очистки, показывает наличие большого и малого пятна и присутствие следов других компонентов . Перекристаллизацией остатка из безводного этанола получают высокочистый кристаллический материал (одно пятно), который отфильтровыва- ют и промывают холодным этанолом. хроматографируют полученное кристаллическое свободное основание на 50 г двуокиси кремния, элюируя 200, 100, 100 и 400 мл смеси дихлорметанэтилацетат (1:1), содержащей 20, 30, 45 и 60 об.% метанола соответственно. объем фракций 1-7 составляет 160, 100, 50, 50, 50, 120, 120 мл соответственно. Фракции 4-7 объединяют и получают 597 мг коричневого остатка,из которого выделяют 435 мг белого кристаллического 4-дезокси-1-формиллейрозиДина перекристаллизацией из этанола. Масс-спектр, т/е: 808 (М) , 806, 777, 775, 335, 138,, 136. ИК-спектр (хлороформ, О ): 3470, 1743, 1690, 1222 см Уф-с,пёктр (этанол) : 210, 222, 254, 290, 298 нм. ЯМР-спектр (100 МГц): метильные синглеты 3/87; 3,65 и 2,07(рКд, - 9,0 и 4,9 (в 66%-ном диметилформамиде). Сульфат этого соединения получают растворением 435 мг свободного .основания в 10 мл горячего этанола и добавлением 1,5 мл 2%-й серной кислоты в этаноле. Кристаллический сульфат 4-дезокси-1-формиллейрозиЙина осаж;цают при охлаждении. Пример 2. Получение 4-дезокси-4-дезацетил-1-формиллейрозина. Смесь, содержащую 1,48 г 4-дезоксивинбластина В , 1 г карбоната натрия и 100 мл мetaнoлa, нагревают с обратным холодильником,в атмосфере азота. ТС5( продуктов реакции через 2ч показывает, что гидролиз с удалением 4-ацетильной группы наполовину закончен, оставляют смесь на ночь при комнатной температуре, затем нагревают с обратным холЬдильником в течение 8,5 ч. ТСХ кратных количеств продуктов реакции в системе простой эфир - диэтиламин - толуол - метанол (20:1:1:1) показывает, что реакция закончена. Реакционную массу упаривают, остаток растворяют в смеси дихлорметан - вода. Фазу дихлЬрметана отделяют, сушат и упаривают, тех остатка показывает наличие очень полярного вещества и 4-деацетиллейроэидина, Остаток (1,33 г) растворяют в бензоле. Очень полярное вещество в значительной мере нерастворимо в бензоле и отделяется фильтрацией. Фильтрат упаривают досуха и остаток (500 мг) хроматографируют на силикагеле в системе простой эфир - диэтиламинтолуол (20:lsi) . (с увеличивающимися количествами метанола). Фракции, содержащие по |данных тех 4-деэокси-4-дезацетиллейрозидин, объединяют, упаривают и получают 348 мг свободного основания. Остаток обрабатывают 1,28 мл 2%ной серной кислоты в метаноле (0,36 М), полученный раствор фильтруют. Выход сульфата 4-дезокси-4-дезацетиллейрозидина 315 мг. 4-Дезокси-4-дезацетиллейрозидин ,имеет следующие характеристики; Масс-спектр, т/е: 752 () , 75-0, 693, 691; 555, 358, 240, 138. ИК-спектр (хлороформ, V): 3455, 1724, 1610, 1497,.1457, 1431 см-. ЯМР-спектр (100 МГц, СДСЕ,,, тетраметилсйлан) , (5 : 9,43 (шир. сингле 1, Cj-OH), 7,92 (шир. синглет, 1, индол N-rt) , 7,47-7,63 (м, 1, ), 06-7,31 (м, 3, С,,2,14-Н)А 6,58 (. 1, ) , 6,10 (с, 1, С п-Н), 5,/8-5,87 (м, 2, ), 4,10 (м, 1, С4-Н), 3,83 (с, 3, C 6-OCHj), :3,70 (с, 1, С„-Н) , 3,58- (с, 3, Cie-COg CK,,) , 2,75 (с, 3, N-CHj), О , 76-1 ,06 (мультиплет,. 6, ) . 4-Дезокси-4-дез.ацетиллейрозиДин (834 мг), полученный из фильтрата, и остаток после упаривания смешивают Смесь, вероятно содержащую 30-40% очень полярного продукта, растворяют в .100 мл ацетона, содержащего 7 мл уксусной кислоты, переметнивают при комнатной температуре в течение 15 мин и охлаждают до -65°С.смесью сухой лед-ацетон в атмосфере азота. llio мг трехокиси хрома растворяют в ТЗ мл ледяной уксусной кислоты и 2 мл воды. Этот раствор добавляют по каплям к раствору 4-дезокси-4-дезаце тиллейрозидина, перемешивают 1ч при (-60)- (-65)°С и резко охлаждают добавлением 35 мл 14 М раствора гидроокиси аммония. Реакционную смесь ,. выливают на лед, водную суспензию несколько раз экстрагируют хлороформом. Экстракты объединяют, отмывают водой и сушат. После удаления хлр- роформа в вакууме получают остаток, (794 мг), который при ТСХ дает одно пятно (несмотря на очень низкий первоначальный R). остаток хроматографируют на силикагеле Woelmа в системе простой эфир-диэтиламин-толуол (20:1:1) с увеличивающимся от 0,9 до 15% количеством метанола. Элюент применяют порциями по 150 мл. Фракции, по данным;тех содержащие 4-дезокси-4-дезацетил-1-формиллейрон, Объединяют, упаривают и полут 293 мг чистого 4-дезокси-4-дезтил.-l-фop 1иллeйpoзидинa. Сульфат учают, как указано выяе. 4-Дезокси-4-дезацетилвйнкристин т быть получен также гидролизом езоксивинбластина А и 4-дезок4-дезацетилБинбластина и затем лением этого соединения трехокихрома в уксусной кислоте при )°С. Формула изобретения пособ получения димерного 1-форндолдигидроиндола общей формулы R - ОН или один из водород, а другой - этил. R его солей, отличающийтем., что димерный 1-метилчндолдрриндол общей формулы c-o-dHj R, R и R имеют выиёуказанные ения, подвергают взаимодействию ехокисью хрома в смеси уксусной кислоты и ацетона при- температуре от (-50) Ro(-6)C и полученный целевой продукт выделяют в виде свободного основания или в виде соли. Источники информации, принятые во внимание при экспертизе 1. Патент США № 3899493, кл. 260-287, опублик, 12.08.75,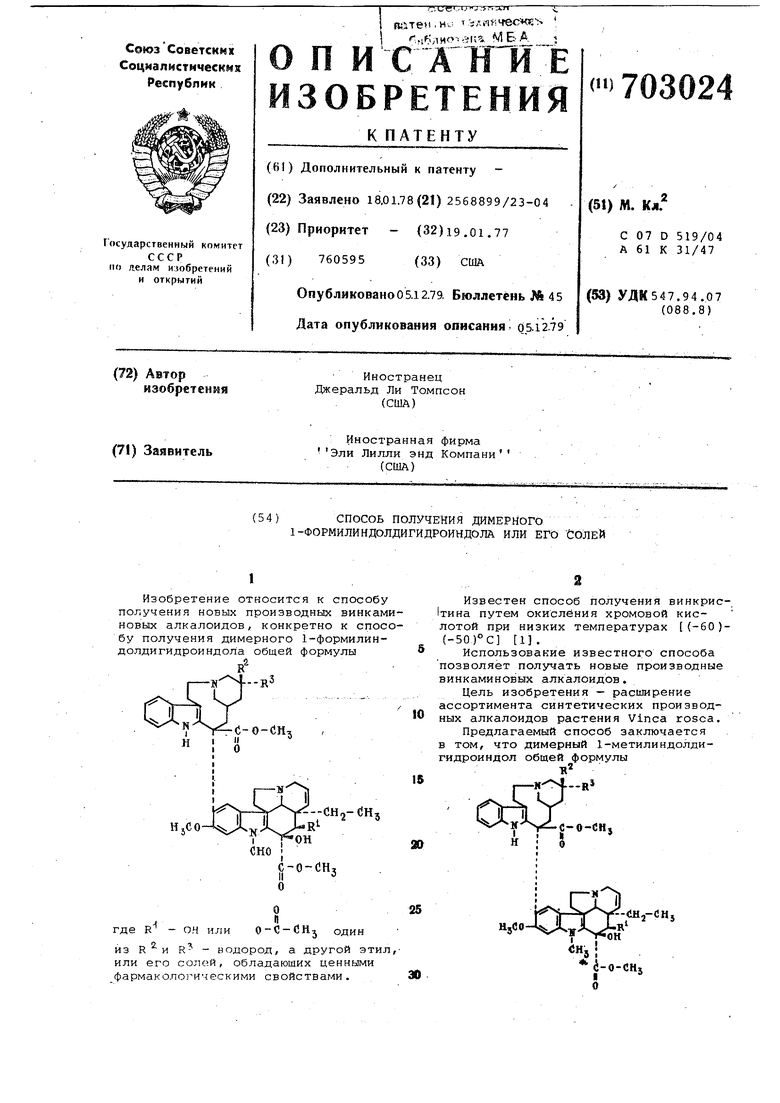




Авторы
Даты
1979-12-05—Публикация
1978-01-18—Подача