Изобретение относится к классу 1,2,4-триазолов, а именно к производным 1-фенил-5-(2'-оксифенил)-3-стирил-1,2,4-триазо- ла общей формулы I
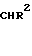 где R1 H, R2 3,4-диметоксифенил или R1 CH3, R2 фенил, обладающим транквилизирующим действием. Ближайшим структурным аналогом соединений I является 3,5-дифенил-1,2,4-триазол, обладающий гипотензивным действием.
где R1 H, R2 3,4-диметоксифенил или R1 CH3, R2 фенил, обладающим транквилизирующим действием. Ближайшим структурным аналогом соединений I является 3,5-дифенил-1,2,4-триазол, обладающий гипотензивным действием.
Одним из наиболее широко используемых в клинической медицине транквилизаторов является диазепам (7-хлор-1,3-дигид- ро-1-метил-5-фенил-1Н-1,4-бензодиазепин-2-он), который применяется для предотвращения и устранения отрицательных эмоций и облегчения характерологических и ситуационных трудностей.
Однако диазепаму свойственен такой нежелательный побочный эффект, как миорелаксация. кроме того, диазепам не обладает антидепрессивной активностью, а его острая токсичность составляет 400 мг/кг.
Целью данного изобретения являются новые соединения 1-фенил-5-(2'-оксифенил)-3-стирил-1,2,4-триазолы, обладающие иным профилем биологических свойств, чем известные структурные аналоги.
Поставленная цель достигается свойствами новых производных триазола, указанных выше. Описываются, согласно изобретению, 1-фенил-5-(2'-оксифенил)-3-стирил-1,2,4-триазолы общей формулы 1, обладающие транквилизурующим действием.
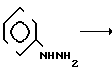
Способ получения соединений 1 основан на известной реакции и заключается во взаимодействии фенилгидразина с перхлоратами 2-стирил-4-оксо-1,3-бензоксазиния по схеме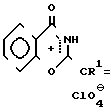
 +
+ 
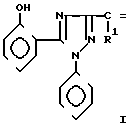
 R1 H, CH3, R2 фенил, 3,4-диметоксифенил структура полученных соединений подтверждена данными элементного анализа и ИК-спектроскопии.
R1 H, CH3, R2 фенил, 3,4-диметоксифенил структура полученных соединений подтверждена данными элементного анализа и ИК-спектроскопии.
П р и м е р 1.
1-Фенил-5-(2'-оксифенил)-3-(3,4-диметоксистирил)-1,2,4-триазол (Ia, R1 H, R2 3,4-диметоксифенил).
К суспензии 4,0 г (0,01 моль) перхлората 2-(3',4'-диметоксистирил)-4-оксо-1,3-бензо- ксазиния в 8 мл ледяной уксусной кислоты прибавляют 2 мл (0,02 моль) фенилгидразина. Нагревают до растворения соли и быстро охлаждают, добавляют 3-кратный избыток воды. Выделившийся осадок отфильтровывают и промывают 3 раза водой. Получают 2,5 г (73%) желтых кристаллов с т.пл. 167-168оС (из уксусной кислоты).
Найдено, C 71,9; H 5,2 N 10,3
C24H21N3O3
Вычислено, C 72,2; H 5,3; N 10,5
ИК-спектр: 1645, 1625, 1600, 1590, 1515, 1490, 1280, 1260, 1170, 1155 см-1.
П р и м е р 2.
1-Фенил-3-(α-метилстирол)-5 -(2'-оксифенил)-1,2,4-триазол (Iб, R1 CH3, R2 C6H5).
Получен описанным в примере 1 способом из перхлората 2-(α-метилстирил)-4-оксо-1,3-бензоксазиния. Выход 68% т.пл. 123-125оС (из пропанола).
Найдено, C 78,5; H 5,5, N 11,8
C23H19N3O
Вычислено, C 78,2, H 5,4, N 11,9
ИК-спектр: 1632, 1599, 1510 (пл.) 1155 см-1.
О транквилизирующей активности соединений I судили по их влиянию на пороги эмоционального реагирования по методике электроболевого раздражения, по влиянию на поведение крыс в условиях конфликтной ситуации, а также по антагонизму с коразолом.
Опыты проводились на половозрелых крысах-самцах весом 200-250 г. Указанные соединения вводили внутрь на рафинированном подсолнечном масле в дозах 20, 50, 70 и 100 мг/кг. В качестве эталонного препарата использовали широко используемый в клинической практике транквилизатор диазепам в дозе 5 мг/кг.
Пороги эмоционального реагирования изучали по изменению порогов писка, которые определяли при раздражении крыс постепенным импульсным электротоком частотой 100 Гц, подаваемым от электростимулятора ИСЭ-01 на электродный пол. Порог эмоционального реагирования оценивали по минимальному напряжению, вызывающему писк.
Как показали результаты испытаний соединения Ia и Iб в дозах, указанных в табл. 1 статистически достоверно понижали эмоциональную реактивность животных, о чем свидетельствует повышение порогов электротока, вызывающего эмоционально-выразительную реакцию писк. Наибольший эффект обнаружен у вещества Iб, которое в дозе 100 мг/кг увеличивало порог писка по сравнению с контрольной группой антактных животных, хотя и уступало соответствующей активности диазепама.
Оценку влияния вещества на поведение животных в условиях конфликтной ситуации проводили следующим образом: эксперимент начинали с тренировки создания у крыс чувства жажды и навыка взятия воды из поилки в камере. Животных содержали на сухом корме в течение 48 ч, затем в одно и то же время суток на протяжении 3 дней крыс помещали в камеру, где они получали воду из поилки в течение 10 мин. В день опыта через 5 с после начала питья крысе наносили электрическое раздражение пропусканием тока (80 В) через поилку. Таким образом, конфликтная ситуация создавалась столкновением двух рефлексов питьевого и оборонительного. Фармакологический эффект испытуемых соединений оценивали по их влиянию на количество взятий воды при электроболевом раздражении.
Данные, представленные в табл. 2, свидетельствуют, что все указанные вещества обладают достаточно четким антиконфликтным действием, которое выражалось в увеличении числа наказуемых взятий воды. Положительные результаты данного теста доказывают растормаживающее действие вещества, внешним выражением которого является активизация поведения крыс, направленного на удовлетворение важной биологической потребности. Наибольшей активностью по данному тесту обладало соединение Iб, незначительно уступающее по выраженности эффекта диазепаму.
Антагонизм с коразолом оценивали по способности данных веществ предупреждать тонико-клонический компонент судорожного припадка, вызванного коразолом. Коразол вводили внутрибрюшинно в дозе 120 мг/кг, которая вызывала судороги и летальный исход у 95% животных. Свойства веществ I препятствовали развитию эффекта коразола оценивали также по их способности защищать животных от гибели и увеличивать среднюю продолжительность жизни по сравнению с контролем. В отличие от диапзепама эти соединения не вызывали миорелаксацию, в то время как диазепам в дозе 5 мг/кг приводил к значительному снижению мышечного тонуса.
Все вещества I обладали выраженной антикоразоловой активностью (см. табл. 3), которая проявлялась защитой от гибели 100% животных. По данному виду активности соединения Ia и Iб уступали диазепаму, который в дозе 5 мг/кг полностью предотвращал развитие судорог, однако установленный нами антагонизм данных соединений коразолом является подтверждением транквилизирующей активности.
Об антидепрессивной активности соединений I судили по свойствам, наиболее характерным для типичных представителей класса антидпрессантов предупреждать или уменьшать апоморфиновую гипотермию, а также увеличивать длительность фенаминовой стереотипии (табл. 4).
Опыты проводили на половозрелых крысах обоего пола весом 120-250 г. Данные соединения вводили внутрь в дозах 25-50 и 100 мг/кг на рафинированном подсолнечном масле.
Оценку влияния веществ на апоморфиновую гипотермию проводили по следующей схеме. У животных опытной и контрольной групп проводили измерение температуры в прямой кишке с помощью электротермометра, после чего опытным крысам вводили соединения I. Через 30 мин после указанной процедуры повторно измеряли температуру, после чего опытным и контрольным крысам внутрибрюшинно вводили раствор апоморфина в дозе 5 мг/кг. Далее температуру у опытных и контрольных животных измеряли каждые полчаса на протяжении 2 ч.
Данные, приведенные в табл. 4, свидетельствуют о том, что все соединения I в дозе 100 мг/кг предотвращают развитие апоморфиновой гипотермии, незначительно уступая в активности мелипрамину. Наибольшая активность по данному тесту обнаружена у вещества Ia. Если снижение температуры под действием апоморфина в среднем составляет 4,1оС, то при введении апоморфина на фоне действия данных соединений температуры животных по сравнению с интактным состоянием снижается на 1,8-2,0оС.
Для исследования влияния веществ I на длительность фенаминовой стереотипии пользовались методическим приемом, согласно которому каждое животное служило своим собственным контролем. Для этого формировали группу крыс, у которых предварительно устанавливали фоновую длительность стереотипии путем подбора доз, добиваясь, чтобы она составляла 90-120 мин. Установив дозу для каждого животного индивидуально, опыт повторяли 3 раза с интервалом 3 дня. В день опыта животным за 1 ч до введения фенамина вводили данные соединения. Результаты эксперимента оценивали путем сравнения времени продолжительности "фоновой" фенаминовой стереотипии и фенаминовой стереотипии в условиях действия вещества. В качестве стандартного препарата использовали антидепрессант мелипрамин (N-(3-Диметиламинопропил)иминодибензила гидрохлорид) в дозе 45 мг/кг. Экспериментальные данные обрабатывали статистически. Вычисляли матожидание (М), стандартные ошибки (ш). Для оценки достоверности различий между средними величинами опытных и контрольных групп использовали критерий Стьюдента. Различия считали достоверными при уровне вероятности (Р) не менее 0,05.
При исследовании влияния веществ формулы I на продолжительность фенаминовой стереотипии было установлено, что эти соединения статистически достоверно увеличивают продолжительнсоть стереотипии по сравнению с фоном. Из данных табл. 5 следует, что наибольшей активностью обладает вещество Ia, которое в дозе 100 мг/кг увеличивает длительность стереотипии на 88% несколько уступая в выраженности эффекта мелипрамину.
Соединения I существенно отличаются от мелипрамина по мидриатической активности (эффект расширения зрачков), который является нежелательным побочным эффектом трициклических антидепрессантов. Если мелипрамин дает достаточно сильный и продолжительный мидриатический эффект, то у веществ Ia, Iб этот эффект практически отсутствует.
Результаты токсикологических исследований показали, что соединения Ia-б обладают относительно низкой острой токсичностью. Средние летальные дозы этих веществ при внутрибрюшинном введении крысам на растворе диметилсульфоксида находились в диапазоне 700-800 мг/кг. При введении внутрь вещества Ia-б не вызывали смертельных эффектов в дозах 1500-1800 мг/кг, а единичные смертельные случаи имели место при введении доз 2000-2200 мг/кг.
Указанные соединения обладают меньшей токсичностью по сравнению с диазепамом, ЛД50 которого при внутрибрюшинном введении крысам составляет 400 мг/кг, а также обладают меньшей токсичностью по сравнению с мелипрамином, средняя смертельная доза которого при внутрибрюшинном введении находится в диапазоне 156,0-196 мг/кг [4]
Существенным преимуществом соединений Ia-б по сравнению с диазепамом является то, что эти вещества в широком диапазоне доз не вызывают миорелаксацию и нарушение координации движений, а также обладают антидепрессивной активностью, приближающейся к активности мелипрамина. Это является практически перспективным сочетанием эффектов у соединений с транквилизирующей активностью.
Таким образом, соединения Ia-б обладают транквилизирующим действием, приближающимся к действию одного из наиболее эффективных транквилизаторов диазепама. Соединения Ia-б менее токсичным, чем диазепам (в 2 раза), и не обладают свойственным для этого препарата нежелательным побочным эффектом миорелаксацией. Кроме того, в отличие от диазепама испытуемые соединения обладают антидепрессивным действием, по которому приближаются к одному из широко используемых антидепрессантов мелипрамину и в 4 раза менее токсичны, чем данный препарат.



1-Фенил-5-(2'-оксифенил)-3-стирил-1,2,4-триазолы формулы
(2′-
где R1=H,  R2 = 3,4-диметоксифенил или R1 = СН3, R2 = фенил,
R2 = 3,4-диметоксифенил или R1 = СН3, R2 = фенил,
обладающие транквилизирующим действием.
1-Фенил-5-(2'-оксифенил)-3-стирил-1,2,4-триазолы формулы
(2′-
где R1= H,  R2 3,4-диметоксифенил или R1 СН3, R2 фенил,
R2 3,4-диметоксифенил или R1 СН3, R2 фенил,
обладающие транквилизирующим действием.
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Планетарная передача | 1933 |
|
SU34587A1 |
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Вихляев Ю.А | |||
| и Клыгуль Т.А | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| В кн | |||
| Успехи в создании новых лекарственных средств | |||
| М.: Медицина, 1973, с.70 | |||
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| Александровский Ю.А., Нисс А.И | |||
| Клиническая фармакология транквилизаторов | |||
| - В кн | |||
| Итоги науки и техники | |||
| М.: Фармакология, 1979, т.П, с.33 | |||
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1921 |
|
SU4A1 |
| Вихляев Ю.А | |||
| и Клыгуль Т.А | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| В кн | |||
| Успехи в создании новых лекарственных средств | |||
| М.: Медицина, 1973, с.80-82. | |||
Авторы
Даты
1996-05-27—Публикация
1983-07-08—Подача