1
Изобретение отнйсится к области химии фосфорорганических соединений, а именно к способу получения новых, триазолсодержащих эфиров фосфорных кислот общей формулы I
БО S И хр-о
2/
И - Э
R 1
3
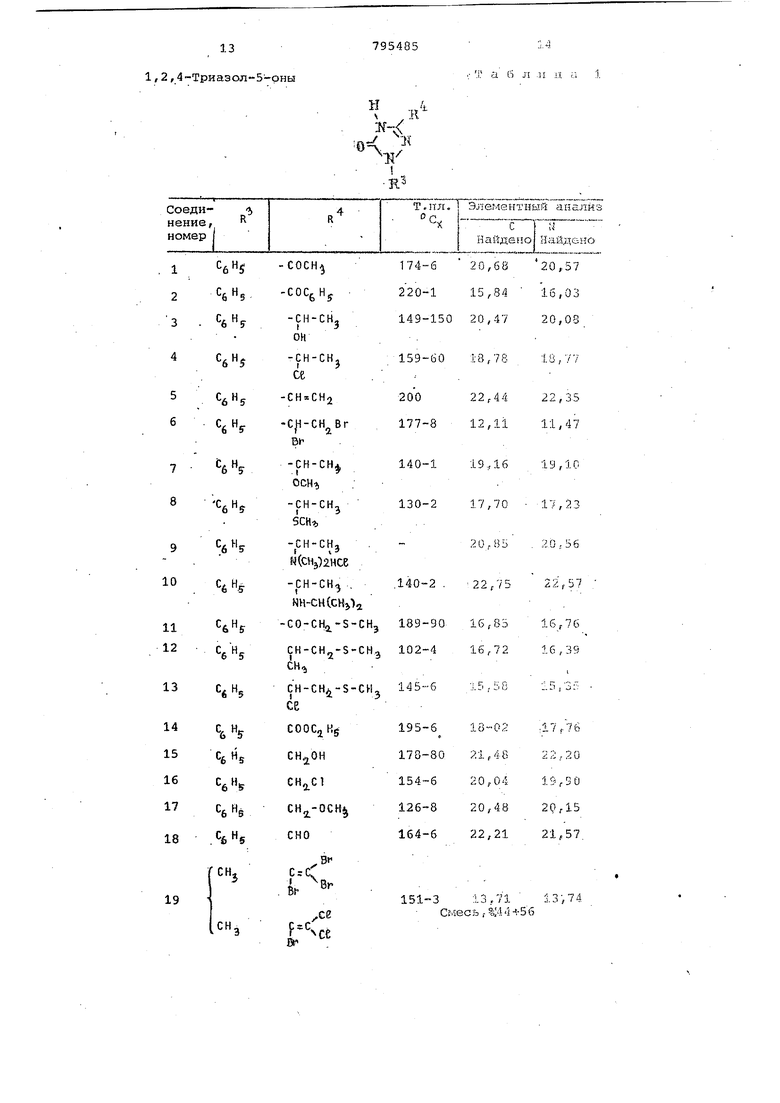
где R г алкил ,
R - этил, фенил, алкоксигруп.па С Сз или диметил аминогруппа, R - алкил или фенил, R - винил, галоидвинил, полигалойдвинил, винил, замещенный алкилом С -Сд , фенилом, S - алкильной группой С -С4 или алкоксигруппой C - С4 ;.
1-Ькси-2-тиометилэтил, карбалкоксиэтил, CO-CH2-SR -группа, ацетил, бензоил, 1-хлорциклогексенил или группа
-СН-К% где , ОВ, S-RlNCll/g, dHj
/хО 0-C-R,-0-C-/7D w
О . . . г алоидёинил или -О -d - галоидалмил, обладаиощих инсектицидной, нематоцидной и акариЦидной активностью. «
Триазолсодержащие эфиры фосфорных Q .кислот формулы 1 являются новыми и 3 литературе не описаны.
Из триазолсодержащих эфиров фосфорных кислот известен 0,0-диэтил (1изопропил-5-хлор-1,2,4-триазол-З-ил) тиофосфат (Мираль (R), который об5Лсщает эффективным действием против почвенных насекомых l. .
Известен способ получения триазолсодержащего эфира диэтилтиофос,форной кислоты формулы
0
К;СбН5
((12Н50)2Р-ОЧ
5 ОНз
5
путем взаимодействия 1-фенил-3-метил.5-триазол-5-она с карбонатом калия и медным порошком в среде, мётилэтил.кетона с последующей обработкой полученного продукта хлорангидридом
|0,С)-диэтилтиофосфорной кислоты при температуре 60°С 2.
Однако триазолсодержащие эфиры тиофосфорных кислот формулы I этим способом получены не были.
Целью изобретения является разработка способа получения тиазолсодержащих эфиров тиофосфорных кислот формулы 1.
Поставленная цель достигается описываемым способом получения триазолсодержаадих эфиров тиофосфорных кислот формулы 1, заключающимся в том, что соль щелочного металла l-R-3-R -1,2,4-триазол-5-она подвергают взаимодействию с хлорангидридом тиофосфорной кислоты в среде инертного растворителя при температуре 55-бО°С.
Соединения формулы 1 обладают инсектицидным действием широкого диапзона, поскольку они эффективны для борьбы с ортоптерой, тлей, двукрылыми, колеоптерой, чешуекрыльоми, а также обладают акарицидным и нематоцидным действием, являясь в то же время мало токсичными по отношению к -теплокровным животным.
Исходным соединением для получения производных 5 гидрокси-1,2,4триазола, в котором R -фенильная группа, является оС-хлор-«,замешенные формилиденфенилгидразины, которые обрабатывают аммиаком с последующей конденсацией аминопроизводного фосгеном или тиофосгеном. В результате образуются тиазолы, которые в щелочной среде дают соли В тех случаях, когда К содержит функциональные группы, для введения других групп в боковую цепь триазолона можно использовать различные реакции. Таким образом, из 1-фенилЗ-ацетил-1,2,4-триазол-5-она за сче специфических свойств ацетильных групп путем восстановления СО-групп получены соответствующие спирты, которые после обработки хлористым тионилом используют для получения соединений формулы 1.
Триазолы, в которых R -алкил, получают реакцией конденсации альдегида с 2-алкилсемикарбаэидом, а затем обрабатывают полученный таким образом семикарбазон бромом в ледяной уксусной кислоте, в результате чего получают триазол, который в свою очередь обрабатывают в щелочной среде.
Установлено, что если R предсталяет собой винильную группу, то после обработки бромом появляется возможность осуществления последовательности реакций присоединения и отщеплени:-.. В частности, когда в исходном альдегиде в /5 -положении содержатся атомы галогена, но не брома, то их можно заместить атомами брома в процессе циклизации.
В зависимости от температурных условий превалирующим направлением реакции может быть образование одного продукта циклизации, содержащего те же галоидвинильные группы, е ЧТО И исходный альдегид или смеси продуктов, содержащих атомы брома в винильных группах производных тиазола.
Винильные группы в положение
Q 3,1-фенил-1,2,4-триазол-5-она могут быть введены с помощью реакции, исходным соединением для которой является 1-фенил-3-ацетил-1,2,4-триазол5-он, протекающей по ацетильным группам.
5 Кроме того, установлено также, что циклизацию семикарбазонов общей, формулы
R -dH N-T5-e -i3H2
U к о
3 д
где R и R имеют указанные значения, можно осуществить в присутствии хлорного железа.;
5 Описанная реакция циклизации позволяет осуществить прямое получение триазола высокой степени чистоты . даже в тех случаях, когда группа R содержит двойные олефиновые связи, по 0 которым происходит присоединение брома, и таким образом, обладает преимуществами перед другими описанными выше методами.
Реакцию проводят в среде полярно5 о растворителя, предпочтительно в уксусной кислоте, при температуре / кипения.
Основные характеристики 1,2,4триазол-5-онов, полученным одним из описанных методов, представлены в та5л.1.
В присутствии.основания 1,2,4триазол- 5 -оны превращаются в соли щелочных металлов, которые, взаимодействуя с соответствующим хлоран5 гидридом тиофосфорной кислоты, образуют триазолсодержащие эфиры тиофосфорных . кислот формулы 1.
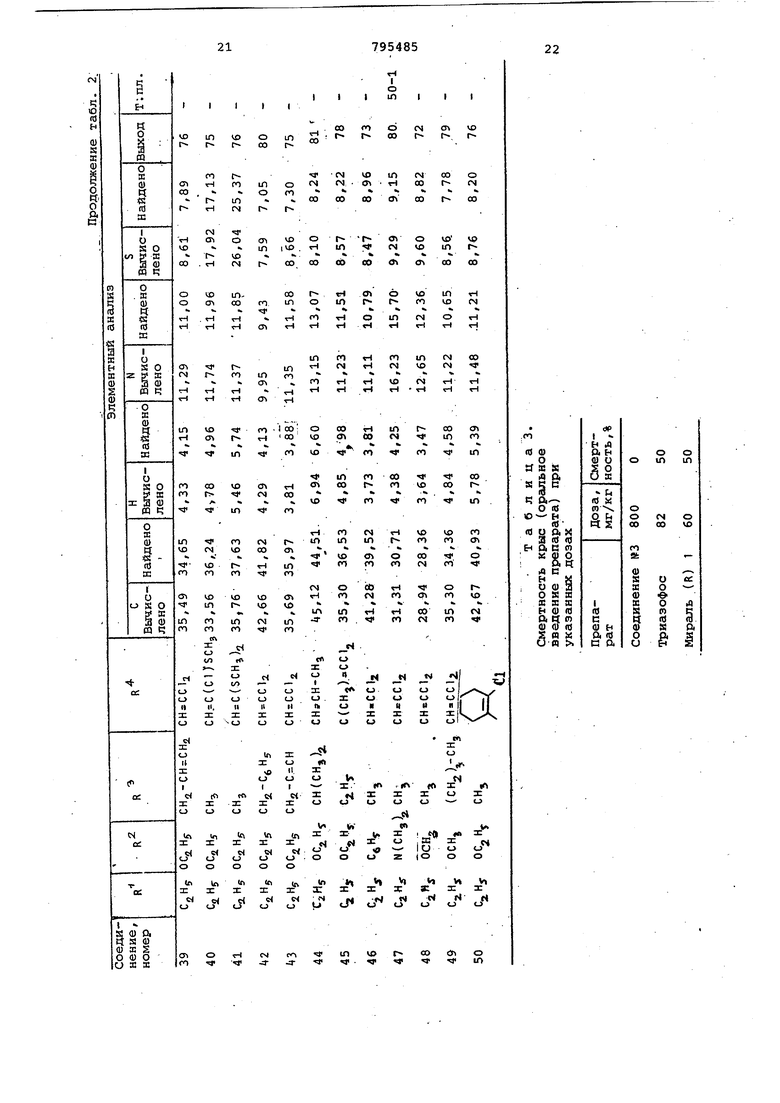
Полученные соединения формулы 1 , .представлены в табл.2. 0
Пример. Получение 1-фенил3-ацетил-1-2-4-триазол-5-она.
80 (лп водного 32%-ного раствора аммиака (1,32 моля) приливают 500мл
5 этанола, к этому раствору небольшими порциями добавляют раствор 60 г (0,305 моля) ci-хлор- ct-ацетилформилиденфенилгидразина. По окончании введения реагентов смесь перемешивают в течение 2 ч при комнатной температуре. Нерастворенный об-амин6-с6-ацетилформилиденфенилгидразкн . (2) (48 г) отфильтровывают и прфмы- . вают 200 мл воды (желтый осадок, т.пл. 182-184с).
42,5 г (0,24 моля) d. -амино-сбацетилформилиденфенилгидразина суспендируют в 300 мл бензола, к суспензии добавляют 57 мл (О, 72 моля) пиридина, а затем по каплям -т 40 мл бензольного, раствора фосгена концентрации 10% (вес/объем, 0,36 моля), поддерживая температуру 15-20°С.
ПЬ окончании введения реагента смесь перемешивают в течение 30 мин при комнатной температуре, а затем приливают к ней 100 мл воды и 10 lym концентрированной соляной кислоты. Смесь перемешивают при комнатной температуре еще в течение 2 ч. Нераство-римый осадок отфильтровывают через пористую диафрагму и промывают водой Выход 1-фенил-З-ацетил-1,2,4-триазол 5-он.а 25 г,(т.пл. 174-176° С.:)
Примеры 2-4. Описанным в : примере методом, исходя из ot-хлорci-бензоилформилиденфенилгидразина, получают 1-фенил-3-бензоил-1,2,4тpиaзoл-5-oн.
Исходя из ci-хлор- cL -метилтиоацетилформилиденфенилгидразина , получают 1-фенил- 3-(метилтиоацетил71,2,4-триазол-5-он.
Исходя из oi,-хлор-с -карбоэтоксиформилиденфенилгидразина получают 1-фенил-3--(карбоксиэтил)-1,2 ,4 ,триазол 5-он.
П р и м е р 5. Получение 1-фенилЭ-(1-окси-2-метилмеркапто)этил-1,2,4триазол-5-она.
К 2,3 г 1-фенил-3-метилтиоацетил1,2,4-триазол-5-ону, суспендированноглу в 40 мл .метанола, по каплям добавляют раствор О,3 боргидрида натрия в 5 мл воды.. Реакционную смесь перемешивают в течение 1 ч, а затем добавляют 0,5 мл концентрированной соляной кислоты и растворитель удаляют.
Остаток смешивают с 20 мл воды и 0,5 мл концентрированной соляной кислоты, водный слой экстрагируют этилацетатом (3x30 мл), а органический слой сушат над безводным сульфатом натрия.
Растворитель отгоняют под вакуумом, а твердый остаток перекристаллизовывают из бензола (10 мл), в результате чего получают 1 г 1-фенил-3-(1-окси-2-метилмеркапто)этил 1,2,4-триазол-5-она(остаток цвета слоновой кости, т.пл. 102-104°С).
П р и м е р,6. Получение 1-фенил3-й-оксиэтил1-1, 2,4-триазол-5-она.
Следуя методике, изложенной в примере 5, и используя в качестве исходного соединения 70 г 1-фенил-Зацетил-1,2,4-триазол-5-он, получают 56 г 1-фенил-З(1-окси тил) 1,2,4триазол-5-он (т.пл. 149-150 с) .
П р и м е р 7. Получение 1-фенил3- винил -1,2,4-триазол-5-она.
К 16 г продукта, полученного так, как описано в примере б, растворенном в 350 мл хлороформа, по каплям добавляют 7,6 мл хлористого тионила при перемешивании.
Раствор перемешивают при комнатной температуре в течение 2 ч, а затем смешивают его с 150 мл воды. Хлороформный слой отделяют и сушат. После удаления растворителя получают 17 г 1-фенил-3-(1-хлорэтил)-1,2,4триазол-5-она (т.пл. 159-160°С) .
5,5 г полученного таким образом
0 продукта растворяют в 150 мл бензола и подвергают дегидрохлорированию в условиях слабого кипения в присутствии 7,5 г триэтиламина. Сразу же по окончании реакции в реакцион5ную смесь вводят 10 мл воды и 10 мл концентрированной соляной кислоты. Бензольный слой отделяют, промывают водой и сушат над безводным сульфатом натрия. Часть растворителя от0гоняют под вакуумом до тех пор, пока объем раствора не составит 50 мл. По охлаждении из раствора выделяют 2 г 1-фенил-3-винил-1,2,4-триазол5-она (т.пл.200°С).
Примере. Получение 1-метил5З-трибромвинил-1,3,4-триазол-5-она и 1-метил (3) -с6-бром-р , р-дихлорвинил) 1,2,4-триазол-5-она.
3 г(0,0153 моля) 1-(р, |3-.диxлopaкpилидeн)-2-мeтилceмикapбaзидa
0 растворяют в 15 мл ледяной уксусной кислоты, затем к этому раствору медленно добавляют 1,6 мл брома ((1,031 моля). Затем смесь нагревают (при небольшом кипении в течение
5 30 минут, охлазкдают и добавляют 150 мл воды. Реакционную смесь экстрагируют этилацетатом (50 мл х 2). Этилацетатные экстракты промывают 50 мл воды и насыщенным раствором
0 бикарбоната натрия (40 мл х 3). Затем его сушат над безводным сульфатом натрия, отфильтровывают и упаривают .
W
Полученный остаток смешивают с
5 50 мл 10%-ного водного раствора гидроокиси натрия и всю смесь нагревают до кипения. После этого смесь охлаждают и отфильтровывают. Фильтрат подкисл5|ют концентрированной
0 соляной кислотой. При этом образуется желтоватый осадок, который экстрагируют этилацетатом (2x50 мл).
Затем органический раствор промы5вают водой (50 мл) сушат над безводным сульфатом натрия и растворитель отгоняют. В результате получают 1,9г желтоватого осадка, который перекристаллизовывают из бензола (т.пл 161163 С). Этот продукт представляет
О собой смесь соединений, о чем свидетельствуют результаты масс-спектрометрии, согласно которым обнаружены два молекулярных пика почти -равной интенсивности (,7 и М 273).
5 ПримерЭ. Получение 1-метил 3- ф ,|%-дихлорвинил)-1,2,4-триазол-5 она. 9,7 г (0,0494 моля) 1 - (р,(i-дихло акрилиден)-2-метилсемикарбаэида раст воряют в 50 мл ледяной уксусной кислоты. Раствор кипятят, добавляют по каплям 2,8 мл (0,054 моля) брома. По окончании введения брома раствор охлаждают. . Уксусно-кислый раствор медленно. по каплям добавляют к суспензии 120г бикарбоната натрия в 300 мл воды. По окончании бурного вьвделения газов к смеси добавляют 250 мл этилацетата и тщательно ее перемешивают. Органический слой отделяют, сушат над безводным сульфатом натрия и растворитель частично выпаривают, как только объем смеси достигает 40 мл, выпаривание прекращают и раст вор охлаждают примерно до 0°С. Выпав ший желтоватый осадок отфильтровываю через стеклянный фильтр. В результате этого получают 2 г 1-метил-3- (р,/ -дихлорвинил)-,3,4-триазол-5-она (т.пл.215-216 С после перекристаллизации из этилацетата). Примеры 10-11. Используя в качестве исходного соединения соответствующий 1-(полигалоидакрилиден) -2-метилсемикарбазид, по методике примера 9, получают следующие 1,2,4триазол-5-оны:1 -метил-3 (f,Jb-дибромвинил)-1,2, триазол-5-он и 1-метил-З-(трибромвинил)-1,2,4-триазол-5-он. И р и м е р 12. Получение 1-метил 3-(j, fi дихлорвинил)- ,2,4-триазол-5она в присутствии хлорного железа. Раствор 49 г (0,18 моля) гексагидрата хлорного железа в 100 мл воды добавляют к раствору 17,5 г (0,089 моля) 1-(ji ,р|-дихлоракрилиден) 2-метилсемикарбазида в уксусной кислоте (50 мл). Полученный раствор нагревают в условиях охлаждения в течение 3,5 ч .затем дают возможность самопроизволь но охлаждаться, после чего смешивают ;его с 150 мл воды. Затем раствор охлаждают примерно до 0°С (водно-ледяная баня), в результате чего получают 12 г 1-метил-3-(р,р-дихлорвинил)-,2,4-триазол-5-она (т.пл. 215-21б°С после перекристаллизации из этилацетата), . -П р и м е р 13. Получение 1-метил 3- (р1,р-Диметилвинил)-1,2,4-триазол5-она. К раствору 10,6 г (0,119 моля) 2-метилсемикарбазида в уксусной кислоте (100 мл), по каплям добавляют 10 г (0,11г1 моля) р ,р-диметилакролеина. Реакционную смесь перемешивают при темьературе 50с .в течение 15 ми а затем добавляют к нему раствор ,2 г (0,227)МОЛЯ гексагидрата хлорного железа в 60 мл воды. Всю смесь перемешивают при в течение 3ч, а затем выливают его в (400 мл) и экстрагируют этилацетатом (2x150 мл), органический .слой отделяют, промывают водой и насыщенным раствором бикарбоната натрия и сушат над безводным сульфатом натрия. . После удаления растворителя получают 4 г 1;-метил-3-(р,р-диметилвинил) 1,2,4-триа зол- 5-она (т.пл. 144- , 146°С).. Пример 14. Получение 1-метил-З- (р-хлор-р-метоксивинил)-1,2,4триазол-5-она. В круглодонную колбу, снабженную обратным холодильником помещают. 6,8г (0,035 моля) 1-метил-3-(/3,р-дихлорвинил)-1,2,4-триазол-5-она, 50 мл метанола и 8 г КОН. Реакционную смесь перемешивают при температуре кипения в течение 5ч, затем выливают ее в воду (150 МП), подкисленную концентрированной соляной кислотой (20 мл) и экстрагируют этилацетатом (ЗхЮОмл) . Органический слой сушат над безводным сульфатом натрия, растворитель удаляют и получают 3 г (1-метил-З(|%-хлор-р-метоксивинил) -1,2,4-триазол-5-она (т.пл. 198-199с) . П р и м е р 15. Получение 1-метил3-(2-хлор-1-циклогексенил)-1,2,4триазол-5-она. К раствору 27 г (0,1 моля) гексагидрата хлорного железа в 30 мл воды добавляют 50 мл уксусной кислоты. Полученный раствор перемешивают при температуре в течение 2ч, добавляя по каплям раствор 10,8 г (0,05 моля) семикарбазона в 50 мл уксусной кислоты. Нагревание смеси продолжают еще в течение 1 ч, а затем раствор охлаждают и вводят 300мл роды, после чего экстрагируют хлороформом (2x200 мл). Хлороформный экстракт отделяют, промывают насыщенным раствором, бикарбоната натрия и сушат над безводным сульфатом натрия. После удаления растворителя, получают 4,5 г маслянистого продукта. При стоянии маслянистый, продукт затвердевает и это твердое вещество промывают диэтиловым эфиром, в результате чего получают 4г 1-метил-З-(2-ХЛОР-1-ЦИКЛОгексенил)-1,2,4-триазол-5-она (т.пл. 183-185°С). По данным элементного анализа содержание С1 в нем 16/76% против расчетных 16,60%. Пример 16. Получение 0,0-диэтил-0-(1-метил-З-трибромвинил-5риазолил) тиофосфата. 3,82 г (0,01 моля) натриевой соли 1-метилгЗ-трибромвинил-5-окси-1,2,4,риазола растворяют в 100 мл ацетона. этому раствору добавляют 1,6 мл
(0,01 моля) хлорангидрида диэтилтиофосфорной кислоты. Затем раствор нагревают при температуре 55-60°С в течение 2 ч. После этого ацетон вьтаривают, а остаток растворяют в 100 мл диэт илового эфира и 50 мл воды. Смесь перемешивают. Органический слой отделяют, сушат над безводным сульфатом натрия и растт воритель выпаривают. Получают 4,7 г желтого масла,которое очищают хроматографически на силикагеле,использу в качестве элюента бензол: выход 0,0-диэтил-О-(1-этил-З-трибромвинил5-триазолил)-тиофосфата 3,5 г (белое кристаллическое вещество, (.т.пл. 45-50°С).
Аналогичным способом были получены и другие 0,0-диэтил-О-триазолилтиофосфаты, приведенные в табл.2
Пример17. Следуя методике, описанной в примере 16, и используя в качестве исходных соединений натриевую соль 1-метил-З (/3 ,-диxлopвинил)-5-oкcи-l,2,4-тpиaзoл и 0,0диметилхлор иофосфат, получают 0,0-диметилтиофосфорный эфир 1-метил-3-( /3 ,/}-дихлорвинил)-5-окси-1,2 4-трйазола. (т.пл. 102-103 С).
Элементный анализ: С1 (теорет). 22,3%, найдено 22,45%.
П р и м е р 18. Получение 0,0дизтилтиофосфата 1-метил-З- (/,р-дихлорвинил)-5-ОКСЙ-1,2,4-тиазола.
1-Метил-; (р,р-дихлорвинил)-1,2,4триазол-5-он (9,.15 г, 0,0466 моля) суспендируют в ацетоне (150 мл).К этой суспензии добавляют KjCO (6,9 г, 0,05 моля) и хлорангидрид 0,0-диэтилтиофосфорной кислоты (9,67 г 0,0466 моля). Реакционную смесь перемешивают при 55-60®С в течение 2 ч, затем отфильтровывают, и растворитель удаляют и получают твердое вещество желтого цвета (16,7г) , которое перекристаллизовьшают из гексана (250 мл). Таким образом полуг1ают 11,3 г продукта в виде белого твердого вещества с т.пл. 47-49 11::, выход продукта после кристаллизации 70%.
В ЙК-спектре продукта присутствуют полосы при 1538 и 1515 (триазольное кольцо) и 1026 см (-F-0-C- группа .
г Чистота соединения подтверждена с помощью тонкослойной хроматографии (тех) с использованием в качестве элюента бензола и раствора PdCl в качестве проявителя.
Пример19. Получение 0,0диэтилтиофосфата 1-мотил-З- (Jb-метилвинил)-5-окси-1,2,,4-триазола.
1-Метил-З- (|%-метилвинил)-1,2,4триазол-5-он (1,5 г 0,0108 моля) суспендируют в ацетоне (50 нл) и к полученной суспензии добавляют K-jCO ( г, 0,013 моля) и 0,0дйэтилтиофосфорилхлорид (2,03 г, 0,0108 моля).
Реакционную смесь перемешивают при температуре- 55-60 С в течение 3 ч, а затем отфильтровывают. Растворитель удсшяют, получая желтое масло (3,5 г), которое очищают с помощью хроматографирования на силикагеле (40 г, бензол в качестве элюента). Получают 2,5 г продукта в виде бесцветного масла, выход
O очищенного, продукта 80%. В ИК-спектре продукта Присутствуют полосы поглощения на 1520 (триазольное кольцо) и 1020 см (-Р-0-С- группа). Чистоту продукта проверяют с
5 помощью тонкослойной хроматографии (элюент бензол, проявитель раствор PdCl-j,).
Пример 20. Оценка биологи0ческой активности соединений.
1)Биологическое действие на Macrosiphum enphorbiae (тлю).
Сеянцы тоглатов, выращенные в горшках, заразили женскими особями
5 тли и через несколько часов опрыскали водной дисперсией исследуемых соединений (см. табл.5).
Процент смертности тли оценивали через 24 ч после обработки (необработанные растения 0).
0
2)Биологическое действие на Рiегisbrassiсае (чешуекрылые).
Срезанные листья cawliflour опрыскивсши водными дисперсиями исследуемых продуктов (см. табл.5).
5
После высыхания листья заражали пятидневными гусеницами. Процент их смертности определяли через 48 ч после обработки (необработанные листья 0).
0
3)Биологическое действие на Zeptinotarsa decemlineata (колеоптера).
Небольшие сеянцы томатов, выращенные в горшках, заражали четырехдневными гусеницами, а затем опрыс5кивали водными дисперсиями исследуемых продуктов (см.табл. 4 и. 5). Процент смертности (необработанные небольшие сеянцы 0) определяли через 48 ч после обработки.
O
4)Биологическое действие на Си lex pip tens (двукрылые). В два стакана с водными дисперсиями исследуемых продуктов (см. табл. 4 и 5 ) поместили трех- и четырехдневные личинки
5 москитов. Процент смертности личинок (стаканы с чистой водой 0) определяли через 24 ч после обработки. 5)Биологическое действие на взрослые особи l etranychus urticae (клещи).
0
Куски листьев бобовых заразили взрослыми особями клещей, а затем обрабатывали водными.дисперсиями исследуемых соединений (см. табл.4 и 5). Процент смертности определяли
через 24 ч после обработки (необработанные листья, смертность 0).
6). Биологическое действие на Fetranychuc игticae 1 (клещи).
Небольшие кусочки листьев бобовых заразили яйцами клещей, а затем опрыскали водными дисперсиями иссле дуемйх продуктов (см. табл. 5). Процент смертности определяли через б дней после обработки (необработанные листья, смертность 0),
7)Биологическое действие на Spodoptera Jittoralis (чешуекрылые).
Срезанные листья табака опрыскали водными дисперсиями исследуемых продуктов (см. табл. 4 и 5).
После высуишвания листья заразили пяти дневными личинками. Процент смертности личинок определяли через 48 ч после обработки (необработанные листья, смертность.0) .
8)Биологическое действие на Meloidogyne nicognita (нематоды).
Смесь почвенного грунта и песка , 1:1, зараженную вновь появившимися гусеницами и яйцами нематоды, подвергали обработке водными дисперсиями исследуемых продуктов, смешивая последние со смесью (см. табл.4,и 5). Затем грунт поместили в пластмассо ; вые горшки и через 5 дней в каждый горшок посадили 5 н еболвших сеянцев томатов высотой примерно 20 см.
Результаты оценивали через 21 день после посадки. Корни растений, извлеченных из грунта, оценивали по степени заряженности на основе количества образовавшихся галло.тз.
Нематоцидное действие выражали в процентном снижении заряженности в сравнении с контрольными образцами(небольшие сеянцы, высаженные в необработанный грунт, активность 0).
9) Биологическое действие на Нi1emylabrassiсае(двукрылые).
Небольшие порции грунта обработали водными дисперсиями исследуемых соединений путем равномерного смешения последних с грунтом (см. табл. 4 и 5) . Затем грунт поместили в . два горшка,, в каждый из которых высадили. 4 сеянца редьки. Затем
растения заразили, поместив в грунт в середину поверхности горшков 50 личинок Diptera.
Результаты оценивали через 10 дней после обработки путем извлечения растений из грунта и подсчета, количества личинок, находящихся в корнях и в окружающем грунте. .
Инсектицидную активность выражали в процентном снижении заражения в 0 сравнении с контрольными образцами (растения, высаженные в необработанную почву, активность 0).
10)Биологическое действие на Blatta oriental s(прямокрылые).
Дно и стенки стеклянного кристаллизатора обработали ацетоновь1М раствором исследуемых продуктов (см. табл. 4 и 5).
После испарения растворителя в каждый кристаллизатор поместили десять 80-100-дневных личинок. Затем кристаллизаторы закрыли металлическими, сетлсами. Через 24 ч после надчала обработки несекомых поместили в необработанные кристаллизаторы, . где их выращивали. Процент смертности (необработанные насекомые 0) определяли через 48 ч после начала обработки.
1,2,4-Триазол-5 рны
Продолжение табл.1.











| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения цефалоспорина или его солей | 1982 |
|
SU1274625A3 |
| Способ получения замещенного 6-фенил-1,2,4-триазол-/4,3-в/-пиридазина | 1977 |
|
SU793399A3 |
| Способ получения ациламинопроизводных гетероциклических соединений | 1976 |
|
SU648094A3 |
| Способ борьбы с грибками | 1973 |
|
SU648045A3 |
| Способ получения производных цефалоспорина или их солей | 1981 |
|
SU1190987A3 |
| Способ получения производных 1,2,4-триазола | 1979 |
|
SU784768A1 |
| КОМПОЗИЦИЯ ДЛЯ ЗАМЕДЛЕНИЯ РОСТА КУЛЬТУРНЫХ РАСТЕНИЙ | 1991 |
|
RU2043026C1 |
| ПРОИЗВОДНЫЕ ПРОПЕНОВОЙ КИСЛОТЫ, ОБЛАДАЮЩИЕ ФУНГИЦИДНОЙ АКТИВНОСТЬЮ | 1989 |
|
RU2024496C1 |
| Способ получения циклических ацеталей 1-( -арил) этил-1н-1,2,4-триазола или их солей или оптических изомеров | 1975 |
|
SU649316A3 |
| Способ получения производных простых арилфениловых эфиров или их кислотно-аддитивных солей,или их металлических комплексов | 1982 |
|
SU1148564A3 |

X) Температуры плавления не скорректированы.
dp
I(U
HД
aEH
о tn
о
0)и
1Л
a; in
sо
0к
A Oi
§«
- и ttл) X
О «
я v
о о со H «e
аё
м оо
о ш и Oi X
Я «j flj a ц (П
го
«g.
tt u
и
о
х ф
X
л
к
|в
(I) п)
8
ь
.
Р|
;«
о
&
с а
CJ
+ +
1 t
+
+
+
+ +
+1
+ 1
+ +
+ +
+ 1
+
+
+
+
+ + +
+ ( + +. +
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+ +
+ 1 +
+
+
+
+
+ +
+ +
ГМ
Ov
rH
« 00
+
4+
+
+
27
Формула изобретения
Способ получения триазолсодержащих эфиров тиофосфорных кислот общей формулы
„2 /,Г N -N ,
C,-Cj
- алкил
- ЭТИЛ, фенил, алкоксигруппа или диметиламиногруппа;
- алкил С -С или фенил, - винил, галоидвинил, полигалоидвинил, винил, замещенный алкилом С -С / фенилом;- алкильной группой С -С.
или алкоксигруппой , -тиометилэтил, карбалкоксиCO-CHj-SR -группа, ацетил, , 1-хлорциклогексенил или
,
NfR), O-C-R,
о
0 II
-0-C- полигалоидвинил галоидалкил),
:.Я
заключающийся в том, что соль щелочного металла 1-R-3-R -1, 2,4-триазол5-она подве1эгают взаимодействию с хлорангидридом тиофосфорной кислоты в среде инертного растворителя при температуре бЗ-бО С. Приоритет по признакам:14.07.1976 при
алкил ,
R - этил, фенил, алкоксигруппа
или диметиламиногруппа, алкил С -С или фенил, R - винил, галоидвинил, полиггшоидвинил, ацетил, карбалкоксиэтил,СО-СН2-5К -группа
или группа -CH-R
S({HO,
где R5-OH, N(R)a, O-C-R 0-C0 0
-полигаЛоидвинил или -О-С-галоидалкил. 3.03.1977 прио
ВИНИЛ, замещенный алкилом С -С4 фенилом , S - алкильной группой С -С или алкоксигруппой , По признакам:
бензоил, хлорциклогексенил или 1-окси-2-тиометилэтил устанавливается приоритет по дате поступления заявки.
Источники информации, принятые во внимание при экспертизе

Авторы
Даты
1981-01-07—Публикация
1977-11-16—Подача