(54) СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ ЦИКЛОГБКСАНКАРБОНОВОЙ КИСЛОТЫ






| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения циклогексанкарбоновой кислоты | 1978 |
|
SU704452A3 |
| СПОСОБ ПОЛУЧЕНИЯ ЗАМЕЩЕННЫХ 2-АЗАБИЦИКЛОАЛКАНОВ | 1973 |
|
SU368749A1 |
| Способ получения производных пиперазина или их солей или эфиров | 1973 |
|
SU524516A3 |
| i^" "БИБЛИОТЬНА I ^.fox-:^ | 1973 |
|
SU373945A1 |
| Амиды циклометилен-1,2-дикарбоновых кислот, обладающие гипотензивной активностью | 1989 |
|
SU1838294A3 |
| Способ получения оптически активных или рацемических 17-аза-производных простагландинов пгф | 1978 |
|
SU730297A3 |
| Способ получения производных -фенилжирной кислоты | 1971 |
|
SU486503A3 |
| Способ получения замещенных транс-хризантематов | 1979 |
|
SU1068033A3 |
| Способ получения производных - 7- -аминодезацетоксицефалоспорановой кислоты в виде смеси цис и трансизомеров или в виде одного из них | 1972 |
|
SU466662A3 |
| Способ получения 1-алкил-1( -алкоксикарбонилэтил)1,2,3,4,6,7,12,12в-октагидроиндоло (2,3-а) хинолизина или его солей | 1976 |
|
SU619107A3 |

Изобретение относится к органической хими конкретно к способу получения новых производных циклогексанкарбоновой кислоты общей формулой 1 СН И- или СНз; R - алкоксигруппа, содержащая Ь6 атомов углерода или остаток аминокислоты. Соединения проявляют высокую фармакологическую активность, такую как антиаллергическая, активоспалительная, антиязвенная или актитромботическая. Кроме того, эти соединения являются поверхностно-акт1 вными веществами и пригодны в качестве присадок для зубной пасты и щампуни, в качестве поверхностноактивных агентов для моющих средств, эмульгаторов и т.д. Известен способ получения производных карбоновой кислоты, содержащих вместо гидроксила, алкоксигруппу или аминокислотный остаток путем обработки карбоновой кислоты хлорагентом, с последующим взаимодействием образовавщегося соответствующего хлорангидрида со спиртом или аминосодержащим соедииением 1. Цель изобретения - разработка способа получения новых производных циклогексанкарбоновой кислоты, являющихся биологически-активными, а также поверхностно-активными веществами. Поставленная цель достигается способом получения производных циклогексанкарбоновой кислоты общей формулы Т где R - Н или СНз. R - алкоксигрупна, содержащая 1-6 атомов углерода или остаток аминокис. лоты, путем обработки соецинения общей формулы Т R СООЯ . где R -- имеет вышеуказанные значения; галогенирующим агентом с последующим взаимодействием образовавшегося соответствующего хлорангидрида со спиртом или аминокислотой. Реакцию галоидангидрида с низшим спиртом проводят в присутствий органических раст ворителей (например, тетрапщрофурана), которые не реактивны в присутствии щелочи (например, триэтиламин карбоната натрия и калия), при комнатной температуре или при шгревании до 100° С. Реакцию с аминокислотой проводят при растворении ее в таких растворителях, как вода, спирт, тетрагидрофуран, при этом к раствору по каплям добавляют щелочь и галоидангидрид в количестве, равном или большем количества аминокислотной группы, в присутствии щелочи (например, гидроокиси натрия). Во время добавления рН реакционной массы следует поддерживать в диапазоне, равном 912,5, и перемешивать при охлаждении или при комнатной температуре (5-30°С) и, при.необходимости, вслед за добавлением нагревать на водяной б.ане при 40-60 С. Соединения общей формулы 1 существуют в виде двух стереогеометрических изомеров, а именно цис-изомера и транс-изомера, которые могут быть разделены при использовании различий в активности из функциональных групп и различия их пространственной конфигурации (например, образованне клатратных составов, состоящих из мочевины, тиомочевины и циклодекстрина или стаби.льности в гидролитических реакциях). Пример 1.К раствору 30 г цис-4-изогексил-1-метилциклогексанкарбоновой кислоты в 150 мл бензола добавляют 30 г пятихлористого фосфора, смесь выдерживают при комнатной температуре в течение 30 мин, а затем кипятят в течение 1 ч. После окончания реакции растворитель отгоняют при пониженно давлении, получают 33,5 г цис-4-изогексил-1- метилциклогексанкарбонилхлорида. К раствору 11 г глицина в 100 мл дистиллированзюй воды добавляют 11,7 г гидроокис натрия и 21 мл воды при охлаждении и перемешивании, затем полученную смесь и вышеуказанный хлорангидрид попеременно добавляют по каплям в растворитель. Во время прибавления рН среды поддерживают в пределах 9-12,5, После добавления реакционную массу перемешивают при комнатной температуре в течение 3 ч. После того, как реакция закончена, рН среды доводят до 2 путем добавления разбавленной соляной кислоты, а затем проводят экстракцию простым эфиром. Эфир промывают, сущат и отгоняют, остаток, полученный таким образом, перекристаллизовывают из петролейного эфира. Получают 37 г N-(циc-4-изoгeкcил-l-метил-циклогексанкарбонил))-глицина в виде бесцветных иголок, плавящихся при 90-93°С. Пример 2. К раствору 12,7 г транс-4-изогексил-1-метилциклогексанкарбоновойкислоты в 50 мл бензола добавляют 11,6 г пятихлористого фосфора, смесь выдерживают в течение 30 мин при комнатной температуре и затем в течение 1 ч кипятят. После этого растворитель отгоняют из смеси при пониженном давлении. Получают 13,2 г транс-4-изогексил-1-метилциклогексанкарбонилхлорида. К раствору 4,3 г глицина в 30 мл дистиллированной воды добавляют 4,5 г гидроокиси натрия в 10 мл воды при охлаждении и при перемешивании и затем смесь и вышеуказанный хлоргидрид попеременно добавляют по куплям в растворитель. Во время добавления рН среды поддерживают в пределах 9-12,5. После окончания прибавления реакционную массу в течение 3 ч перемешивают при комнатной температуре. После завершения реакции рН среды доводят до 2 с помощью разбавленной соляной кислоты, проводят экстракцию простым эфиром. Слой эфира промывают, сушат и растворитель отгоняют. Остаток, полученный таким образом, перекристаллизовьтают из смешанного растворителя, состоящего из простого и петролейного эфиров. Получают 14,5 г Ы-(транс-4-изогексил-1-метилциклогексанкарбонил)-глицина в виде бесцветных чешуек, плавящихся при 108-111,5°С. Пример 3. К раствору 6,3 г €-аминокапроновой кислоты и 40 мл дистиллированной воды добавляют 3,6 г гидроокиси натрия, растворенной в 8 мл воды, при охлаждении и перемешивании, полученную смесь и 10,5 г цис-4-изогексил- 1-метилциклогексанкарбонилхлорида добавляют попеременно по каплям в растворитель. Во время добавления рН среды поддерживают в пределах 9-12,5. Смесь выдерживают при комнатной температуре в течение 3 ч, а затем в течение 15 мин нагревают при 50° С. После завершения реакции рН среды доводят до 2 путем прибавления разбавленной соляной кислоты, проводят экстракцию сложным зтиловым эфиром ледяной уксусной кислоты. Слой эфира промывают и сушат, растворитель отгоняют. Гэлученный таким образом остаток перекристаллизовывают из смешанного растворителя простого и петролейного эфиров. Получают 10,5 N- (цис-4-изогексил- 1-метилциклогексанкарбонил)-6.аминокапроновой кислоты в виде бесцветных призм, имеющих температуру плавления 72-74°С.
Пример 4. К раствору 4,6 г о-метио.нииа, 5 г карбоната натрия и 40 мл воды добавляют 2,5 г гидроокиси натрия, растворенной в 8 мл воды, при охлаждении, перемешивании, затем полученную смесь и 7,6 транс-4-изогексил-1-метилциклогексанкарбонилхлорида добавляют попеременно по каплям в растворитель. Во время добавления рН среды поддерживают в пределах 9- 12,5. После добавления реакционную массу выдерживают в течение 3 ч при комнатно температуре и затем в течение 15 мин нагревают при 50°С. После того, как реакция завершилась, рН среды доводят до 2 путем добавления разбавленной соляной кислоты в реакционную смесь, а затем зкстрагируют простым зфиром. Слой эфира промывают, сушат, растворитель отгоняют. Полученный таким образом остаток перекристаллизовывают из петролейного эфира, получают 8,8 г М-1раис-4-изогексил-1-метилциклогексанкарбонил-о-метионина в виде бесцветных иголок с температурой плавления 102104° С.
Пример 5. К раствору 4,1 г D, L норлейцина, 5 г карбоната натрия и 40 мл воды добавляют 2,5 г гидроокиси натрия, растворенной в 8 мл воды при охлаждении и пере мешивании, и затем полученную смесь и 7,6 г транс-4-изогексил-1-метил ЦИК логексанкарбонилхлорида добавляют по каплям попеременно в растворитель. Во время добавления рН среды поддерживают в пределах 9-12,5. Поело окончания добавления реакционную массу выдерживают при комнатной температуре в течение 3 ч и затем в течение 15 мин нагревают при 50 С. После завершения реакции рН среды доводят до 2 путем добавления разбавленной соляной кислоты и затем проводят экстракцию простым эфиром. Слой эфира промывают и сушат, а затем растворитель отгоняют. Полученный таким образом остаток перекристаллизовывают из петролейиого эфира. Получают 9,4 г М-(траис4-изогексил-1-метилциклогексанкарбоиил)-0,инорлейцииа в виде бесцветных иголок с температурой плавления 109 111°С.
Пример 6. К раствору 3,4 г саркозима, 6 г карбоната натрия и 40 мл воды добавляют 3,2 г гидроокиси натрия, растворенной в 8 мл воды при охлаждении и перемеишваиии, а затем полученную смесь и 8,7 г транс-4-изогексилциклогексанкарбонил хлорида
добавляют попеременно по каплям в растворитель.
Йо время добавления рП среды поддерж1шают в пределах 9-12,5. После добавления реакционную массу выдерживают при комнатной температуре в течение 3 ч и затем в течение 15 мин нагревают при 50°С. После завершения реакили рН среды доводят до 2 путем добавления разбавленной соляной кислоты в реакционную смесь и затем экстрагируют простым эфиром. Слой эфира промывают и сушат, растворитель отгоняют. Полученный таким образом остаток перекристаллизовывают из смешанного растворителя, простого и петролейного эфиров, что дает 9,5 г N-(транс-4-изогексилциклогексанкарбонил)-саркозина в виде бесцветных иголок с температурой плавления 131-132°С.
Пример 7. К раствору из 20 г сложного глицинэтилового эфира, 15 г триэтиламина и 100 мл тетрагидрофурана добавляют медленно по каплям 23,4 г цис-4-изогексил-1-метилциклогексанкарбонилхлорида при температуре льда. После добавления по каплям реакционную массу перемешивают при комнатной температур в течение 3 ч. После заверше1шя реакции триэтиламиновую соль соляной кислоты отфильтровывают. Растворитель отгоняют при пониженном давлении, получают остаток, к которому добавляют ледяную воду. Осажденные неочищенные кристаллы собирают фильтрованием и высушивают. . Перекристаллизация кристаллов из ацетонитрила даст 30 г М-(иис-4-изогексил-Ьметил-циклогексанкарбонил)-сложного глицик тилового эфира в виде бесцветных игл с температурой плaвлe rия 86-89 С.
Пример 8. К раствору 4,6 г глицина и 70 мл воды добавляют 10 г цис-4-изогексил-1-метилциклогексанкарбонилхлорида при охлаждении и перемешивании, а затем по каплям добавляют 13 г триэтиламина при комнатной температуре. После добавления смесь перемешивают в течение 1 ч и на 30 мин оставляют при 50° С. После того, как реакция завершилась, рН среды доводят до 2 добавлением разбавленной соляной кислоты в реакционную смесь, а затем прородят экстрак1шю простым эфиром. Слой эфира промывают и сушат, а затем отгоняют эфир.
Полученный таким образом остаток перекристаллизовывают из петролейного эфира, что дает И г N-(цис-4-изогексил-1-метилцикпогексанкарбонил)-глицина в виде бесцветных игл с температурой плавления 90-93°С.
Пример 9. К раствору 8,0 г цис-4-изогексил- 1-метилциклогексанкарбоновой кислоты и 30 мл бензола прибавляют 12,7 г хлористого тионила и смесь нагревают с обратным холодильником в течение 3 ч при 80° С. После за7
sepiJjejfflH реак1щи Г1спользованнын при реакции растворитель отгоняют ич смеси при пониженном давлении Ш1я получения 8,6 г хлорангидрида 1Ц1с-4-изогексил- 1-мети.пциклогексанкарбоновой кислоты. К раствору 9.6 г н-гексилового снирта и 30 мл тетрагидрофурана прибавляют по каплям указан1П)1й хлорангидрид кислоты. Пос.ге прибавляют 15 мл гриэгиламина и смесь иеремииивают в течение 1 ч при 55°С. После завер1леш1Я реакции астворитель отгоняют при пониженном давлении. Прибавляют некоторое количество ледяной воды и полученный остаток экстрагируют диэтиловым эфиром, Диэтиловый эфир отгоняют после промывания и обезвоживания эфирного слоя.
Остаток перегоняют в вакууме для получения 6,8 г н-гексилового эфира иис-4-изогексил-1-метилциклотексанкарбоновой кислоты в форме бесцветного масла, кипящего при 120122°С при давлении 0,7 мм рг. ст.
Результаты анализа; вычислено для Ci HjgOj: С 76,45%, И 12,83%. Найдено: С 76,42%,- Н 12,79%.
Пример 10. К раствору 7,2 г н-пропилового спирта и 35 мл тетрагидрофурана прибавляют по каплям 10,0 т хлорангидрида 1ЩС-4-изогексил-1 -метилциклогексанкарбо овой кислоты. По завершении прибавления по каплям прибавляют 16 мл триэтиламина и смесь перемешивают в течение 1 ч при 50-60°С. После, заверше1шя реакции растворитель отгоняют при пониженном давлении. Прибавляют некоторое количество ледяной воды и полученный остаток экстрагируют диэтиловым эфиром. Эфир отгоняют после промывания и обезвожив ния эфирного сдоя. Остаток перегоняют в вакууме для получения 7,2 г н-пропилового эфира цис-4-изогексил-1-метилциклогексанкарбоновой кислоты в форме бесцветного масла, кипящего при 158-160°С при давлении 30 мм. рт.ст.
Результаты анализа: вычислено для С17НзА: С 76,06%, Н 12,02%. Найдено.: С 75,98%, Н 12,03%.
Пример 11. К раствору 4,6 г транс-4-изогексил-1 -метилциклогексанкарбоновой кислоты и 20 мл бензола прибавляют 7,3 г хлористого тионила и смесь нагревают с обратным холодильником при 80° С в течение 3 ч. По завершении реакции растворитель отгоняют из смеси при пониженном давлении для получения 5,0 г хлорантидрида транс-4-изогексил-1-метилциклогексанкарбоновой кислоты. К раствору 3,1 г этилового спирта и 30 мл тетрагидрофурана прибавляют по каплям указашгый хпора}ггидрид кислоты. По завершении прибавления по каплям, прибавляют 12 мл триэтилам1иш и смесь перемешивают в течение 2 ч при 50 С. После завершения реакции растворитель отгоняют из смеси при пониженном
708
давлении. Прибавляют некоторое количество ледяной воды и полученньш остаток экстрагируют диэтиловым эфиром . Эфир отгоняют после промывания и обезвоживания эфирного слоя. Остаток перегоняют в вакууме для получения 3,8 г этилового эфира транс-4-иэогексил- 1-метилдиклогексанкарбоновой кислоты в форме бесцветного масла, кипящего при 157-159°С при давлении 30 мм рт,сТо
Результаты анализа: вычислено для QeHsoOa: С 75,53; Н 11,89%. Найдено: С 75,68%, Н 11,74%.
Примеры 12-15. Соединения, приведенные в помещенной ниже табл. 1, могут быть получены по методу, сходному с описанным в примерах 9-11.
В соответствии с предложенным способом получены соединения общей формулы
COR
Представленные в табл. 2.
30 Основные соединения изобретения общей формулы
транс
представлены в табл. 3.
Основные соединения изобретения общей формулы
СОЯ
цис
Э
представлены в табл. 4.
9797570
Основные соединения изобретения общей формулы
COR
I TpQHcJ
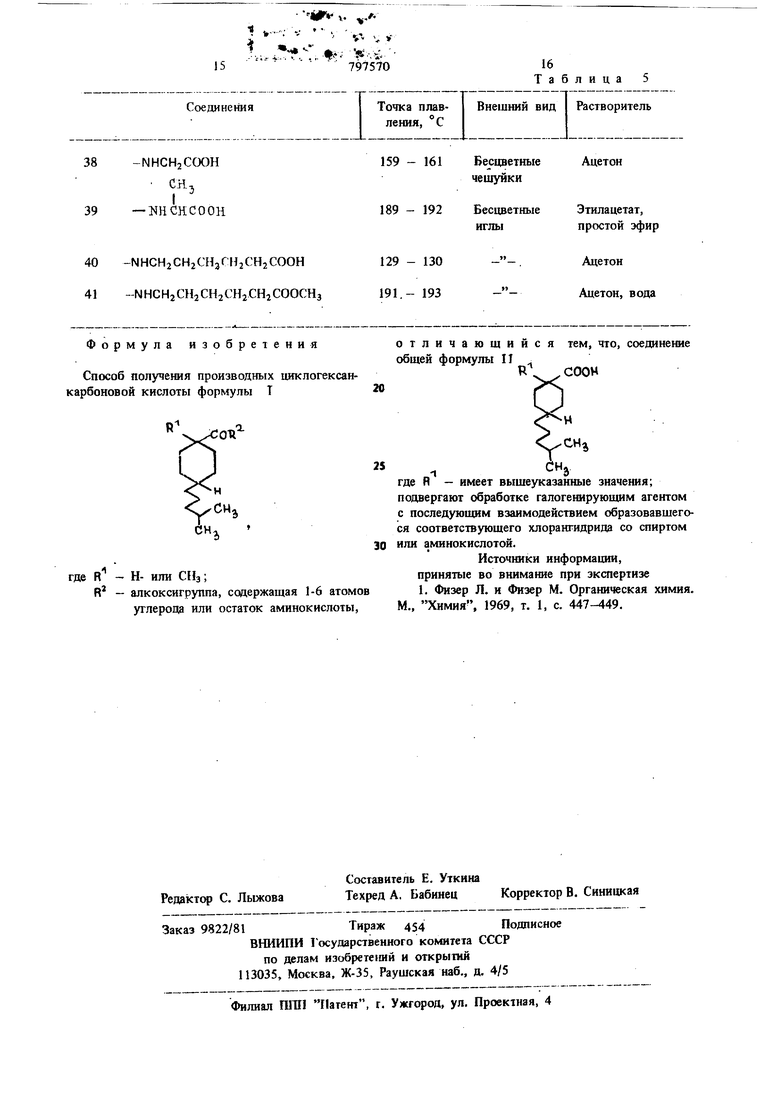
CKj представлены в табл. 5. Соединения, полученные с помощью предлагаемого способа, испытывают острую токсичность,15 антиаллергические и поверхностные свойства. Обнаружено, что некоторые соединения показы10
I а о л и ц а 1
12 Этиловый эфир иис-4-изогексил- Ьметияциклогексанкарбо новой кислоты154-155/30
10 13 Изопентиловый эфир цис-4изогексил- 1-метилциклогек116-117/07санкарбоновой кислоты 14 н-Бутиловый эфир цис-4-изогексил-1 -метилциклогексанкарбоновой кислоты100-101/07 н-Пропиловый эфир траси-4-изогексил-1-метилциклогексанкарбоиовой кислоты105-106/0,7
- COOH
11
-NHCH2CHjCH2COOH
СЛ2СН2С01 Н2
-1ЧНСН.СЗООН (L форма) СНгСНгСоон
-1QHCHCOOH(L форма
Hj -ЗЧСНзСООН
CHzCH SCHj
-тш сне ООН {L форма)
CHjSH -Ю1СЯСООН{L форма)
соон (-1IH -сн - СН2 3)2 (-L форма}
Соединение
-NHCHjCOOH
S сн J -тчЕСнСоон (1 форпа
СНаСНгСНгСНз --1«нсн:соон (Di форма)
снз
- Нз
-TQHCHCOOH (L форма)
-NHCHjCHjCOOH
снс:
I снз -инснсоон (L форма)
Продолжение табл.2
Эфир, петролейБесцветные
112 ный эфир иголки
Бесцветные
109 иголки
Ацетонитрил
Бесцветные 131 иголки
Бесцветные
135 иголки 82
Бесцветные чешуйки
136
Бесцветная призма
Бесцветное масло тр
82
Бесцветные
Ацетонитрил иголки
Т а б л и ц а 3
Внешний вид
Точка плавРастворительления, °С
111,5 Бесцветные
Простой эфир, чешуйки петролейный эфир
104
Бесцветные
Петролейный эфир иглы
111
Петролейный эфир
Ьесцветные
Простой эфир,
115
Изопропиловый
Ьесцветиые эфир чешуйки
- 114
Бесцветные чешуйки
86
Бесцветные
Лцетонигрил призмы
-NHCHjCHjCOOH
СНа
, 5
-ИНСНСООН (L форма)
сн, I
-БСН;,СООН
CH2,CHjCOOH:
-инснсоон (L форма)
36
37 -NHCHjCHjCHjCHjCHjCOOH
Продолжение табл. 3
105 - 110 Белые иглы
132- 135 Белые иглы Изопропиловый .
эфир
Петролейный
105 - 110 эфир
165 - 168 Белые призмы Этанол, изопропиловый эфир
121 - 124 Белые иглыЭтилацетат,
изопропиловый эфир Формула изобретения Способ получения производных циклогексанкарбоновой кислоты формулы Т Н- или СИэ; алкоксигруппа, содержащая 1-6 атомов углерода или остаток аминокислоты, 25 30 отличающийся тем, что, соединение общей формулы П CHj где R - имеет вышеуказанные значения; подвергают обработке галогенирующим агентом с последующим взаимодействием образовавшегося соответствующего хлорангидрида со спиртом или аминокислотой. Источники информащт, принятые во внимание при экспертизе 1. Физер Л. и Фнзер М. Органическая химия, М., Химия, 1969, т. 1, с. 447-449,
Авторы
Даты
1981-01-15—Публикация
1978-04-29—Подача