местителей R и К. обозначают водород, а другой обозначает 7- или 9-метильную группу, а R обозначает водород, то R и R одновременно не могут обозначать метильную груп пу, или если R2 обозначает метильную группу, R 5 этильнуто группу, RA водород, а один из заместителей R и R,j обозначает водород, то другой из заместителей R и К не может обозначать атом брома, или R , R , R обозначают вод то R 1 не может обозначать эти ную группу, или если R и R обозначают 6- или 8-метильную группу, Ro не может обозначать зтильную группу, или их солей, производное 2-аминопиридина формуль; или его аддитивную соль с кислотой и я 1 имеют указанные для этих символов значения) вводят во взаим действие при 20-200 С, при кипении реакционной массы с соединением фо мулы CiOOBs, где R2 принимают указанные дл этих символов значения, R низший алкильный радикал, при условии, что, в случае получения 2,3-дкметил-; 2-метил-3-этил2,3,7-триметил-; 2-метил-3-этил-7-бром- и 2,6,8-триметил-3-этил-4-оксо-4Н-пиридо(1,2-а)пиримидина, взаимодействие осуществляют в смес хлорокиси фосфора и полифосфорной кислоты и, в желаемом случае, полу ченное соединение формулы .;W где R, R , 2. Напринимают указан ные для этих символов значения, подвергают восстановлению. Целевые продукты выделяют в свободном состо нии или в виде солей. Предпочтительно используют 0,51,5 моля соединения формулы III на моль соединения формулы II . Взаимодействие между соединениями, отвечающими формулам II и III осуществляют в присутствии кислого конденсирующего средства. В качестве кислого конденсирующего средства используют смесь полифосфорной кислоты и хлорокиси фосфора. Предпочтительно используют 2-5 моля хлорокиси фосфора и 1-150 г полифосфорной кислоты на 1 моль соединения формулы II г Процесс осуществляют при 80-160 С Реакционкутв смесь разлагают низшим спиртом, водой или щелочью. В качестве кислого конденсирующего агента предпочтительно .также использовать полифосфорную кислоту. Полифосфорную кислоту используют в количестве 200-2000% в расчете на 1 моль соединения формулы II и процесс осуществляют при 60-180 С. Реакци50 проводят также с использованием в качестве кислого конденсирующего средства соляной кислоты, уксусной кислоты, или пропионовой кислоты. Восстановление соединений формулы IV осуществляют предпочтительно путем каталитического гидрирования, с использованием в качестве катализатора никеля Ренея, палладия, родия, платины или окиси платины, или восстановлением комплексным гидридом металла. В качестве комплексного гидри/та металла используют боргидрид натрия, цианборгидрид натрия или натрий-бис-(этоксиметокси)-алюминийгидрида. Время проведения реакции зависит от температуры и реакционных компонентов. В большинстве случаев вре|МЯ проведения реакции 0,5-10 ч. Обработку реакционной смеси осущест{вляют известными способами. ОбраЬотка может быть произведена таким образЪм, что реакционную смесь разбавляют водой, производят нейтрализацию щелочью и соединение формулы IV выделяют в форме свободного основания. В качестве растворителя, преимущественным образом, применяют галогенированные углеводороды (например, хлороформ, хпорбензол). 5 Если в качестве кислого конденсирующего средства применяют гапогенводороды, то сначала могут быть получены гидрогалогениды (соединени формулы И ) , которые затем вводят во взаимодействие с соединением фор мулы III в присутствии ароматического третичного соединения азота, применяемого в качестве растворителя. Полученные указанным способом соединения формулы 1 могут быть подвергнуты восстановлению. При каталитическом гидрировании соедине.НИИ формулы IV в присутствии никеля Ренея, палладия или родия образу ется производное тетрагидропиридо (1,2-а) пиримидина, отвечающее формуле ГRj и R принимают указан где R, R ные для этих символов значения. Если в качестве катализатора при меняют платину или окись платины, то получают производное октагидропи ридо (1,2-а) пиримидина, отвечающее формуле R, принимают указангде R, гч. , гч 2 и г ные для этих символов значения. Производные тетрагидрогшридо (1,2-а) пиримидина, соответствующие формуле V, в результате каталитического гидрирования в присутствии платины или окиси платины могут быть переведены в производные октагидроп ридо (1,2-а) пиримидина, отвечающие формуле VI. Гидрирование может быть осуществлено при атмосферном или повышенном давлении, В качестве рас ворителя могут быть применешл вода, спирты (например, метиловый, этиловый спирты и т.д.), органические ки слоты (например уксусная кислота), кетоны (например, ацетон, метилэтил кетон), сложные эфиры (например, эти ловый эфир уксусной кислоты) или смеси указанных веществ. 78 Соединения формулы I могут быть переведены в соли, полученные при применении приемлемых с фармацевтической точки зрения органических или неорганических кислот (например, в гидрохлориды, гидробромиды, гидроиодиды, сульфаты, нитраты, фосфаты, ацетаты, формиаты, малеаты, цитраты, лактаты и т,д.). Получение солей осуществляют известны « способами, например, посредством взаимодействия соед1; нения формулы t с соответствующей кислотой (взятой приблизительно в эквимолярном количестве) в среде органического растворителя. Соединения формулы I в результате взаимодействия с кватернизирующими средствами могут быть превращены в четвертичные соли. Для этой цели могут быть применены все обычные кватернизирующие средства, например алкилгалогениды (бромистый метил, бромистый этил, йодистый этил), диалкилсульфаты (диметилсульфат, ди- этилсульфат), сульфонаты (бензолсульфокислоты, паратолуолсульфокислота), триалкилфосфаты, оксоний фторбораты и т.д. В качестве реакционной среды могут быть применены растворители, обычно применяемые при осуществлении реакций такого типа, например ароматические углеводороды (бензол, толуол), галогенированные углеводороды (хлороформ, хлорбензол), кетоны (ацетон), алкнпг нитрилы (ацетонитрил), нитроапканы (например, нитрометан), формамиды (диметилформамид), диметилсульфоксид, гексаметшттриамид фосфорной кислоты и т.д. или смеси указанных растворителей. Четвертичные соли могут быть подвергнуты восстановлению. Это взаимодействие осуществляют известим способами. Может быть применено каталитическое гидрирование или могут быть использованы комплексные гидрида металлов, например боргидрид натрия, цианборгидрид натрия, бис-(этоксиметокси)-натрий-алюминийгидрид. Реакцию осуществляют так, что восстановление проводят с помощью комплексного гидрида металла в растворителе, зависящем от восстановителя, например в воде, алифатическом спирте, ароматическом углеводороде и т.д. Указанные новые соединения формулы I
или их соли или их четвертичные солн обладают обезболивающим действием на крысах и собаках и значительно превосходят такое не действие пробона. Кроме того, не наблюдается снмптомов и расстройств центральной нервной системы, которые появляются у крыс при больших дозах пробона и у собак лри низких дозах лробона. Ток факт, что соединения форму ЛЬ I, в особенности 2,б-диметил-3 этил-4 оксо-4Н пиридо (l,2-a) пиримидин, его соли, а также четвертич}ше cojm сильно тормозят действие пробона на центральную нервную сиетему, т,е имеют сродство к рецепторам, на которые пробон оказывает свое действие, но сам не обладает спегщфической активностью, поддерживает гипотезу о наливши в центральной нервной системе рецепторов, селективно чувствительных к пиридо (l,2-a) пиримидинам. Другим доказательством этой.связи является полная нетоксичность новых соединегшй формулы I для Beagle- собак. Даже в дозах 1 г/кг соединение 2,6-диметил-3-этил-4-оксо-4Н-пиридо {1,2-а) пиримидин пе вызывает токсических изменений и нел елательных эффектов. Однако это вещество уже в дозах менее 50 мг/кг тормозит действие двукратной смертельной дозы (600 мг/кг) пробона. Обработанные заказанным образом собаки показывают полнуго безболезненность без обнаружения малейших признаков атаксии и нарушений координации. Животные не погибают. Все это означает, что спектр действия новых соединений формулы 1 значительно отличаётся от спектра действия пробона. С терапевтической точки зрения эти соединения более предпочтительны, чем пробон. Они представляют собой намного более активное обезболивающее средство, не оказывающее влияния на центральную нервную систему. Препараты могут содержать обычные носители (например, тальк, стеарат магния, воду, полиэтиленгликоль и т.д.). Препараты также могут содержать обычные добавки и вспомогательные вещества (например, эмульгаторы, разрушаювдае вещества, буферные вещества и т.д.). Получают препараты известными способ ми, обычно прииеняемьп ш в фармацевтической прог 1шленности.
Предложенные фармацевтические препараты, кроме соединений формулы , могут содержать в качестве биологически активных веществ другие соединения, обладающие фармацевтической активностью. Для этой цели могут быт применены, например, другие обезболивающие средства (например, морфий) производнь1е бензоморфана (например, феназоцин, пентазоцин), производные фенилпиперидина (например, петидин, нисентил).
Суточная доза биологически активного вещества может колебаться в широких границах, причем доза во всех случаях зависит от имеющихся условий н потребностей и предписаний врача. При оральном введении суточная доза биологически активного вещества при- близительно 1-300 мг. Вводимая парентерально суточная доза приблизительно 0,1-lQO мг. Однако гщэименяемые дозы могут находиться как выше, так и ниже указангых границ.
Соединения формулы Г обладают ценными обезболиваюрщми и усиливающим действием морфия свойствами и могут находить применение в качестве обезболивающих средств, действующих по механизму нового типа, В табл.. 1 покзано усиливающее активность морфия действие соединений формулы I.
В табл. 2 показаны ярко выраженные свойства гидрохлорида 2,6-диметил-3-этил-4-оксо-4Н-пиридо (1,2-а) пиримидина (в дальнейшем соединение А в сравнений с имеющим близкое химическое строение гидрохлоридом 2-метил-3-этш1-4-оксо-4Н-пиридо (I,2-а) пиримидина (в дальнейшем соединение в) и гидрохлоридом 2,6,8-триметил-3-этил-4-оксо-4Н-пиридо (1,2-а) пиримидина (в дальнейшем соединение с) . Опыты осуществляют в соответствии с тестом с горячей пластиной и альголитическим тестом. Полученные в тестах результаты представлены в табл. 2.
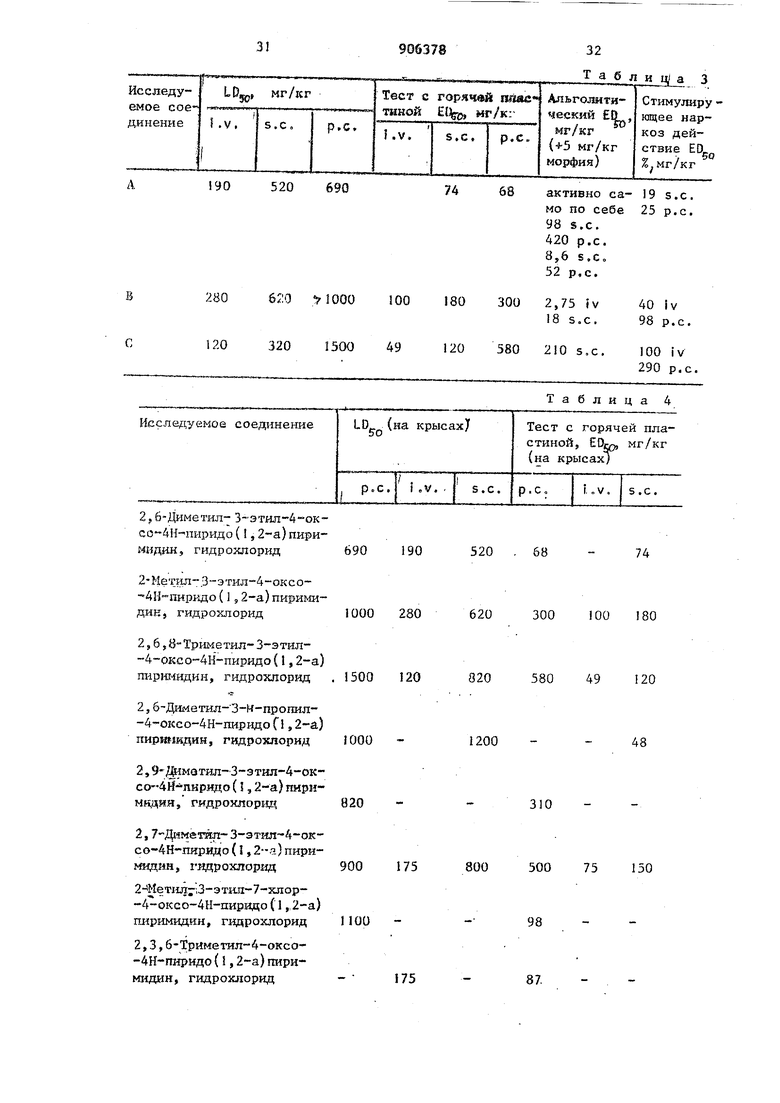
В табл. 3 приведены другие сравнительные опыты между соединениями А, В и Си ,
Приведенные числовые данные отчетливо показывают свойства соединения А, Это производное значительно пре,восходнт соединения, имеющие близкую химическую, структуру, а также активно в альголитическом тесте. Сравнительные данные болеутоляющее свойств соедине1шн формулы 1 и известного пробона приведены в табл. 4. Примененные исходные вещества, соответствующие формулам II и III , двляются известными соединениями. Пример I. 10,8г 2-амино-6-метилпиридина и 14,4 г этилового эфира 2-метилацетоуКсусной кислоты вводят во взаимодействие дру с другом в смеси, состоящей из 46 хлорокиси фосфора и 7,0 г полифосфорной кислоты, при 100 С 3 ч. Интенсивное сначала выделение хлорис того водорода постепенно ослаблевает и затем прекращается. Реакционную смесь разлагают 100 мл этило вого спирта при температуре, лежащей в интерйале 70-80 С, и затем в держивают в течение ночи в холодил нике, с целью проведения кристаллизации. Вьзделившийся в осадок кри сталлический продукт отфильтровыва промывают этиловым спиртом и сушат В результате, получают 20,2 г (90%) гидрохлорида 2,3,6-триметил-4-оксо -4Н-пиридо (1,2-а) пиримидина. Посл перекристаллизации из смеси этилов ГО спирта и диэтилового эфира полу ют продукт с т.пл. 215-220 С. Рассчитано, %: С 58,81; Н 5,83, N 12,47,- С1 15,78. C,2. Найдено, %: С 58,41; Н 5,83, N 12,28; С1 15,62. Если вместо этилового эфира 2-ме тилацетоуксусной кислоты в качестве исходного вещества применяют этиловый эфир 2-Н-пропилацетоуксусной кислоты,- то получают гидрохлорид 2,6-диметил-3-Н-пропил-4-оксо-4Н-пиридо (I,2-а) пиримидина, который имеет т.пл. 180-185 с. Рассчитано, %: С 61,78, Н 6,78, N 11,08, С1 14,03.q,,.HCl Найдено, %: С 61,52, Н 6,98, N 11,03, С1 13,95. Если вместо этилового 2- -метилацетоуксусной кислоты в качестве исходного вещества применяют этиловый эфир 2-М-бутилацетоуксусной кислоты, то получают гидрохлори 2,6-диметил-3-Н-бутил-4-оксо-4Н-пиридо (1,2-а) пиримидина, с т.ля 216-217с. Рассчитано, %: С 63,03; Н 7, N 10,50; С1 13,28, . HCI Найдено, %: С 62,65; Н 6,96; N 10,68; С1 13,46. Если вместо этилового эфира 2-метилацетоуксусной кислоты в качестве исходного вещества применяют этштовьц эфир 2-н-децилацетоуксусной кислоты, то получают гидрохлорид 2,6-диметил-3-Н-децил-4-окср 4Н-пиридо(,2-а)пиримидина, т.пл. 187 С. Рассчитано, %: С 68,45; Н 8,90v N 7,98; С1 10.10. Сг,,,О.НС1 Найдено, %: С 68,35; Н 8,72; N 7,92, С1 10,15. Если вместо этилового эфира 2-метилацетоуксусной кислоты в качестве исходного вещества применяют этиловый эфир 2-бензилацетоуксусной кислоты, то получают гидрохлорид 2,6-диметил-3-бензил-4-оксо-4Н-пиридо (1,2-а) пиримидина, т.пл. 18619IC. Рассчитано, %: С 68,в9, Н 5,70, 9,31, С1 11,79. 0,11, Найдено, %: С 68,25, Н 6,13; N 9,48; С1 11,06. Если вместо этилового эфира 2-метилацетоуксусной кислоты в качестве исходного вещества применяют этиловый эфир 2-изобутилацетоуксусной кислоты, то получают гидрохло- РИД 2,6-диметил-3-изобутил-4-оксо-4Н-пиридо (1,2-а) пиримидина, т.пл. 178-185 С, Рассчитано, %: С 63,03, Н 7,17; N 10,50; С1 13,28. g,4H j 20-nc Найдено, %: С 62,65- Н 6,80; N Ю,68; С1 13,46. Если вместо этилового эфира 2-метилацетоуксусной кислоты в качестве исходного вещества | 1рименяют этиловый эфир 2-метил-З-оксовале{жановой кислоты, то получают гидрохлорид 3,6-димеиш-2-этил-4-оксо-4Н-ПИРИДО (1,2-а) пиримидина, т.пл, 196-202 0. Рассчитано, %: С 60,38; Н 6,33; N il,73i С1 14,85, С,ИмН.ОНС1 Найдено, %: С 60,11; Н 6,70; N,11.68; С1 14,56. П Если в качестве аминокомпонента применяют 2-аминошфидин, а в каче стве оксосоединения - этиловый эфир 2-этилацетоуксусыой кислоты, то получают гидрохлорид 2-метил 3-этил-4-аксо-4Н-пиридо (l,2-а) пиримидина, с т,пл. 185 190С, Рассчитано, %: С 58,81; Н 5,83; N 12,47; С1 15,78. C,.O.-HCl Найдено, %: С 58,41, Н 5,83, N 12,62; С1 15,65. Если в качестве аминокомпонента применяют 2-аминопиридин, а в качес ве оксосоединения - этиловый эфир 2 ИНпррпидацетоуксусной;. кислоты, то получают гидрохлорид 2-метил-З-И-пропил-4-оксо 4Н-пиридо (1,2-а) пиримидина, с т.пл. 210-215 С. Рассвдтано, %: С 60,38-, Н 6,33, N 11,73; С1 14,85, Найдено, %: С 60,45; Н 6,20; N 11,32; С1 14,80. Если в качестве аминокомпонента применяют 2-аминопиридин, а в качестве оксосоединения - этиловый эфир 2-н-бутилацетоуксусной кислоты, то получают гидрохлорид 2-метил-3-Н-бутил-4-оксо-4Н-пиридо(1,2пиримидина, т.пл. 220-222С, Рассчитано, %: С 61,78; Н 6,78; N 11,08; С1 14,08. С, Найдено, %: С 61,89; И 6,80/ N J1,00; С1 13,95. Если в качестве аминокомпонента применяют 2-аминопиридин, а в каче стве оксосоединения - этиловый эфи 2-И-децилацетоуксусной кислоты, то получают лидрохлорид 2-метил-3-Н-д цил-4-оксо-4Н пиридо (1,2-а) пирим дина, т.пл. 200-202 0. Рассчитано, %: С 67,74; Н 8,68; N 8,3i; С1 10,52, .HCl Найдено, %: С 67,81, Н 8,75, N 8,19,- С1 10,40. Если в качестве аминокомпонента применяют 2-амииопиридин, а в каче стве оксосоединения - этиловый эфи 2-бензййацетоуксуснрй .кислоты, то получают гидрохлорид 2-метил-З-бен зил-4-оксо-4Н-пиридо (1,) пиримидинам, т.пл. 180-190 С. Рассчитано., %: С 67,02, И 5,27/ N 9,77; С1 12,36, C;,fcH,N O-HC1 8 Найдено, %: С 67,14, И 5,32; 9,90; С1 11,98. Если в качестве аминокомпонента применяют 2-аминопиридин, а в ка-, честве оксосоедннения - этиловый эфир 2-( 4-хлорфенил(-метил -ацетоуксусной кислоты, то получают гидрохлорид 2-метил-3-.(4-хлорфенил (-метил)-4-ОКСО-4Н-ПИРИДО (l,2-a) пиримидина, т.пл. 175-180°С. Рассчитано, %: С 67,25; Н 4,94, 9,80; С1 22,08, QgH iN OCI-HCl Найдено, %: С 67,01, Н 5,03, 9,86; С1 22,25. Пример 2. 10,8 2-амино-б-метилпиридина и 15,8 г этилового эфира2-этиладетатоуксусной кислоты вводят во взаимодействие друг с другом в смеси, состоящей иэ 46 г хлорокиси фосфора и 7 г полифосфорпричем взаимодействие ной кислоты, 3 ч при 120-130°С. Выосуществляютделение хлористого водорода, которое сначала бьшо интенсивньш, постепенно .замедляется и эатем прекращается. Реакционную смесь при 70-80 С разагают посредством пpибaвлej шя 100 мл этилового спирта и вьщерживают в течение ночи в холодильнике (с целью проведения кристаллизации). Выделившийся в осадок кристаллический продукт отфильтровывают, промывают этиловым спиртом и сушат. В результате получают 22 г (92%) гидрохлорида . 2,6-диметил-3-этил-4-оксо-4Н-пиридо (1,2-а) пиримидина. После перекристаллизации из смеси этилового спирта и диэтилового эфира продукт Рассчитано, %: С 60,38; Н 6,83; 11,74; С1 14,85. Найдено, %: С 60,44-,.Н 6,40; 11,90; С1 14,61. Пример 3. 12,8 г 2-амино-5-ююрпиридина и 15,8 г этилового эфира 2-этиладетоуксусной кислоты вводят во взаимодействие друг с другом в смеси, состоящей из 46 г хлорокис.и фосфора и 7 г полифосфорной кислоты, .причем взаимодействие осуществляют 3 ч при 120-130 0. Выделение хлористого водорода, которое сначала было интенсивным, постепенно замедляется и затем прекращается. Реакционную смесь разлагают при 70-80 с посредством прибавления
100 мл воды и после охлаждения производят нейтрализацию углекислым натрием. Водную реакционную смесь экстрагируют четыре раза хлороформом, используя каждый раз по 100 мл последнего.Объединенные хлороформные растворы сушат над сернокислым натрием и затем упаривают. От остатка отгоняют этиловый эфир уксусной кислоты, в результате получают 20,2 г (91%) 2-метил-3-этил-7-хлор-4-ОКСО-4Н-11ИРИДО (1,2-а) пиримидина,, который после перекристаллизации из смеси этилового спирта и диэтиловогого эфира имеет т.пл. 1 и-Пб С.
Рассчитано, %: С 59,33; Н 4,98; 12,58; С1 15,92.
N
Ч/t
Найдено, %: С 59,20; Н 5,02; 12,39; С1 16.07.
N
Если в качестве аминокомпонеита применяют 2-амино-З-метилпиридин , то получают 2,9-диметил-3-этил-4-оксо-4Н-пиридо (1,2-а) пиримидин который имеет т.пл. 90-92 С.
Рассчитано, %: С 71,26, Н 6,98, N 13,85.
С 71,20, Н 6,97,
Найдено, N 13,70.
Если в качестве аминокомпонента применяют 2-аминопиридин, а в качестве оксосоединения - этиловый эфир 2-(циклогексилметил)-ацетоуксусной кислоты, то получают 2-метил-З-(циклогексилметил ) -4-оксо-4Н-пиридо (1,2-а) пиримидин, который имеет т.пл. 112-П4с.
Рассчитано, %: С 74,97; Н 7,86;
N 10,93,
Найдено, %: С 75,10; Н 7,86,
М 10,95.
Если в качестве.амйнокомпонента применяют 2-амино-6-метилпиридин, а в качестве оксосоединения - эшловый эфир 2-(ЦИКлогексиметнл)-ацетоуксусной кислоты, то получают 2,6-диметил-3-(циклогексилметил)-4-оксо-4Н-пиридо (1,2-а) пиримидин, т.пл. 124-126°С.
Рассчитано, %: С 75,52; Н 8,20; N 10,36,
Найдено, %: С 75,40; Н 8,22; N 10,29.
Пример 4. 4,77 г гидрохлорида 2,6-диметил-3-этил-4-оксо-4Н-ПИРИДО (1,2-а) пиримидина растворяют в 50 мл воды и рН полученного раствора доводят до значения 7 посредством прибавления 10%-ногв раствора углекислого натрия. Затеи реакщюниую смесь экстра ируют четыре раза хлороформом, используя каждый раз по 25 мл последнего. Объединенные и высушенные иад сернокислым натрием хлороформные экстракты упаривают. От остатка отгоняют этиловый эфир уксусной кислоты. В
результате получают 4,О г (99%)
2,6-диметил-3-этил-4-:рксо-4Н-пиридо (1,2-а) пиримидина. После перекристаллизации из смеси этилового
спирта и диэтилового эфира продукт
ff
имеет т.пл. 127-128 С.
Рассчитано, %: С 71,26; Н 6,98; N 13,85.
Q H 4l20
Найдено, %: С 71,09, Н 6,98;
N
13,67.
Если в качестве исходного ма.териала применяют гидрсхлорид 2-метил-З-Н -децил-4-рксо-4Н-пиридо (1,2-а) пиримидина, то получают 2-метил-3-Н-децил-4-оксо-4Н-пиридо (1,2-а) пиримидин, который имеет т.пл. 66-67,5С.
Рассчитано, %: С 75,96; Н 9,39;
N 9,32.
Q.-Wz
Найдено, %: С 76,11, Н 9,40,
9,34.
N
Пример 5. 4,45 г 2-метил-3-этил-7-хлор-4-оксо-4-пиридо(1,2-а) пиримидина растворяют при нагревании в этиловом спирте. К приготовленному раствору прибавляют 25 мл этаиольного раствора хлористого водорода с концентрацией 28 вес.%. После охлаждения выделивпшйся в осадок кристаллический продукт отфильтровывают и прошлвают этиловым спиртом. Б результате получают 5,01 г (97%) гидрохяорида 2-метил-3-этил-7-хлор-4-ОКСО-4Н-ПИРИДО (1,2-а) пиримидина, который имеет т.пл. 176-180 С.
Рассчитано, %: С 50,98; Н 4,57; N 10,81-, С1 13,68,
(j H NgOCbHCl
Найдено, %: С 50,82, Н 4,74; 10,92; С1 13,44.
Пример 6. 4,04 г 2,6-диметнл-3-этил-4-оксо-4Н-пиридо (1,2-а) 15 пиримидина растворяют в 50 мл этило вого спирта и в присутствии 2 г никеля Ренея, промытого этиловым спир том до полного удаления воды, осуще ствляют гидрирование при атмосферном давлении. После поглощения теоретически рассчитанного количества водорода (приблизительно 7 ч) потребление водорода прекращается. Катализатор отделяют от реакционной смеси фильтровгчием и полученный этанольный раствор .упаривают. Б результате получают 4,10 г (99,5%) 2,6-диметил-3-этил-4-оксо-6,7,8,9-тетрагидро-4Н-пиридо (1,2-а) пири мидина. Продукт представляет собой окрашенное в бледно-желтый цвет не кристаллизующееся маслообразное вещество, которое может быть перегнано при в вакууме 25 мм рт.ст. Рассчитано, %: С 69,87; Н 8,80, N П,58. Найдено, %: С 69,82, Н 8,96, N 13,62. Если реакцию осуществляют предла гаемым способом, однако вместо никеля Ренея применяют в качестве катализатора 10%-ный палладий на акти вированном угле, то поглощение теоретически рассчитанного количества водорода происходит в течение 10 ч. Б результате получают 2,6-диметил-3-ЭТИЛ-4-ОКСО-6,7,8,9-тетрагидро-4Н-пиридо (1,2-а) пиримидин в виде не кристаллизующегося маслообразного вещества. Пример 7. 10,8г 2-амино-6 -метилпиридина и 15,8 г этилового эфира 2-этилацетоуксусной кислоты нагревают при перемешивании в 100 г полифосфорной кислоты 90 мин при 100 С. Затем реакционную смесь разбавляют 75-100 мл воды, после чего рН смеси доводят до значения 7 поср ством прибавления 10%-ного раствора гидроокиси натрия. Вьщеливгаийся в осадок кристаллический продукт отгфильтровывают, промывают водой и сушат. В результате получают 17,2 г (85%) 2,6-диметил-3-этил-4-оксо-4Н-пиридо (1,2-а) пириш-щина После перекристаллизации из смеси эти- лового спирта и диэтилового эфира продукт имеет т.пл. 127-128 С и не дает депрессии температуры плавле,юш при смешении с продуктам, полученнь м по примеру 6, 8 П р И м е р 8. 0,02 моля 2-амино-3-оксипиридина и 0,02 моля этилового эфира 2-этилацетоуксусной кислоты вводят во взаимодействие друг с другом согласно примеру 7. В результате с выходом 73% получают 2-метил-3-этил-9-окси-2-оксо-4Н-пиридо (1,2-а) пиримидин, который после перекристаллизации из 70%-ного этилового спирта имеет т.пл. 128°С. Рассчитано, %: С 64,6; Н 5,92. Найдено, %: С 64,90; Н 6,15. Пример 9 0,02 моля 2-амино-3-оксипиридина и 0,02 моля :этилового эфира 2-зтилацетоуксусной кислоты вводят во взаимодействие друг с другом согласно примеру 1. В результате с выходом 59% получают гидрохлорид 2-метш1-3-этил-9-окси-4-4Н-пиридо (1,2-а) пиримидина, который после перекристаллизации из смеси этилового спирта и диэтилового зфира имеет т.пл. 175-178 С. Рассчитано, %: С 55,12; Н 5,47; С1 14,79. C,.,H,, Найдено, %: С 55,22; Н 5,51; С1 14,67. Пример 10. 0,02 моля 2-амино-3-оксипиридина и 0,02 моля этилового эфира 2-бензилацетоуксусной кислоты вводят во взаимодействие друг с другом согласно примеру 7. В результате с выходом 70% получают 2-метил-3-бензил-9-окси-4-оксо-4Н-пиридо (1,2-а) пиримидин, который после перекристаллизации из этиловогй спирта имеет т.пл. 124-125 С. Рассчитано, %: С 72,16; Н 5,30. .i, Найдено, %: С 71,97; Н 5,41. Пример 11. 0,02 моля 2-амино-5-нитропиридина и 0,02 моля этилового эфира 2-этилацетоуксусной кислоты вводят во взаимодействие друг с другом согласйо примеру 7, В результате с выходом 38% получамт 2-мегш1-3-этил-7-нитро-4-оксо-4Н-пиридо (1,2-а) пиримидин. Продукт слегка загрязнен 2-амино-5-нитропиридином, что легко устраняют посредством перекристаллизации из этилового спирта. .После двухкратной перекристаллизации из этилового спирта получают соединение с Тчпл. 163-164 С. Рассчитано, ,А-( Найдено, %: Пример но-3-нитропиридина и 0,02 моля этило вого эфира 2-этилацетоуксусной кислоты вводят во взаимодействие друг с другом согласно примеру 3. В резул тате с выходом 51 % получают 2-метил-3-этил-7-нитро-4-оксо-4Н-пиридо(1,2-а) пиримидин, который после дву кратной перекристаллизации из этилового спирта имеет т.пл. 164-165 С и не дает депрессии температуры плав ления при смешении с продуктом, полученным по примеру 11. Пример 13. 0,02 моля гидрозщорида 2-амино-4-метилпиридина,, 50 м пиридина и 0,03 моля этилового эфир 2-этилацетоуксусной кислоты нагревают 16 ч при температуре кипения реакционной смеси с обратным холодильником Затем отгоняют от реакци ной смеси при пониженном давлении растворитель и не вступивший во вза имодействие кетоэфир. Полученный ос таток перекристаллизовывают из смеси этилового спирта и ДИЭТИ. эфира. В результате с выходом 39% получают гидрохлорид 2,6-диметил-З-этил-4-окср-,4К-пиридо (1,2-а)пиримидина, который имеет т.пл. 192-198 После перекристаллизации из этилово го спирта т.пл. продукта повьшается до 195-199 с. Рассчитано, %: С 60,38, Н 6,33, С1 14,85. С,2.Н(4 20-HCI Найдено, %: С 60,41, Н 6,38; С1 14,67 Пример 14. 0,02 моля гидробромида 2-аминопиридина и 0,03 моля этилового эфира 2-Н-пропилацетоуксус ной кислоты вводят во взаимодействие друг с другом согласно примеру 13. В результате с выходом 49% получают гидробромид 2-метил-З-Н-про- ПИЛ-4-ОКСО-4Н-ПИРИДО (1,2-а) пиримидина, который после перекристаллизации из этилового спирта сублимировался при 210 С. Рассчитано, %: С 50,90; Н 5,34. 0 гНмМ- Ч Найдено, %: С 50,81; Н 5,20. Основание, полученное а свободном виде из гидробромида известным способом, имеет т.пл. 57-58 С, 2-метил-3-Н-пропш1-4-оксо-4Н-пиридо90637818 %: С 56,65; Н 4,75. (l,2-a) пиримидин кристаллизуют из С 56,50; Н 4,60. 12. 0,02 моля 2-ами-. нормального гексана. При смешении с основанием, выделенным в свободном состоянии из гидрохлорида, соответствующего примеру 1, продукт не дает депрессии температуры плавления, Рассчитано, %: С 71,26; Н 6,98. С, Найдено, %: С 71,32, Н 6,86. Пример 15. 0,02 моля гидроиодида 2-аминопиридина и 0,03 моля этилового эфира 2-н-пропиладетоуксусной кислоты вводят во взаимодействие друг с другом согласно примеру 13. В результате с выходом 53% получают гидроиодил 2-метил-З-Н-пропил-4-оксо-4Н-пиридо (1,2-а) пиримидина, который после перекристаллизации из этилового спирта имеет т.пл. 200-210С. Рассчитано, %: С 43,66; Н 4,58. С, Найдено, %: С 43,41; Н 4,67. Основание, выделенное известным способом в свободном состоянии нз гидробромида, имеет т.пл. 58-59®С и не давало депрессии температуры плавления с продуктом, соответствующим примеру I4. Пример 16.О,02 моля 2-аминоникотиновой кислоты и 0,02 моля этилового эфира 2-этилацетоуксусной кислоты перемешивают 1 ч в 20 мл полифосфорной кислоты при 145°С. Затем реакционную смесь разбавляют 10 мл воды и При охлаждении производят нейтрализацию посредством прибавления 10%-ного раствора гидроокиси натрия. Выделив1т1Йся в осадок маслообразный продукт три раза экстрагируют хлороформом, используя каждый раз по 25 мл последнего. Объединенные экстракты сушат и упаривают. В результате с выходом 42% получают 2-метил-3-этил-9-карбоксил-4-ОКСО-4Н-ПИРИДО (1,2-а) пиримидина, который после перекристаллизации из этилового спирта имеет т.пл. 177-}79с. Рассчитано, %: С 62,02; Н 5,21. с,2. НайденЬ, %: С 62,10; Н 5,13. Пример 17. Из 0,02 моля 2-амино-4-этоксикарбонилпиридина;и 0,02 моля этилового эфира 2-этилаце.тоуксусиой . Vкислоты согласно примеру 7 получают с выходом 64% 2-метил-3-этш1-3-этоксикарбонил-4-оксо-4Н- , -пиридо (1,2-а) пиримидин, который после перекристаллизации из зтилово го спирта имеет т.пл. ЭА-Уб С. Рассчитано, %: С 64,60, Н 6,20. Найдено, %: С 64,44; Н 6,24. Пример 8. Смесь, содержащую 0,02 моля 2-амино-4-этоксикарбо нилпиридина 0,02 моля этилового эфира 2-этилацетоуксусной кислоты, 10 мш хлорокиси фосфора и 2 г полифосфорной кислоты, перемешивают 2 ч при 120 С. Затем реакционную смесь при 70-80 С разлагают 20 мл этиловог спирта и раствор при охлаждении льдо нейтрализуют посредством прибавления 10%-ного раствора гидроокиси натрия Непосредственно после этого прои водят отгонку растворителя, полученный остаток четыре раза экстрагируют хлороформом, используя каждый ра по 25 мл последнего. Объединенные экстракты сушат и упаривают. Получен ный после упаривания остаток кристал лизуется при растирании с диэтиловым эфиром. В результате с выходом 42% получают 2-метил-3-этил-8-этоксикарбонил-4-оксо-4Н-пиридо (1,2-а) пиримидин, который после перекристагшизации из этилового.спирта имеет т.пл. 95-96 С. Полученный продукт н дает депрессии температуры плавления с продуктом, соответствующим примеРУ 17. Пример 19. 0,01 моля 2,6-диметил-3-этил-4--оксо-4Н-пиридо(1,2-а) пиримидина растворяют в 20 м ацетона. Приготовленный раствор смешивают с 0,03 моля йодистого метила и реакционную смесь вьщерживают 24 ч в тугоплавкой ампуле.при 150 С. Зате раствор упаривают до объема 10 мл и выдерживают. 24 ч. Врезультате с выходом 86% получайт. 1 ,2,6-триметил-3-зтил-4-оксо-4Н-пиридо (1,2-а)ш1рймидиний иодид. Окрашенный в желтый цвет кристаллический продукт, по лученный после перекристаллизации из этилового спирта, имеет т.пл. . 203-206°С. Рассчитано, %: С 45,37; Н 4,98. W7N;iO Найдено, /J: С 45,16/ Н 4,81. II р и м е р 20. 0.,Q2 моля 2-метил-3-этил-4-оксо-4Н-пиридо (1,2-а) пиримидина согласно примеру 6, подвергают восстановлению в присутствии ниЗкеля Ренея или палладия на активированном угле. В случае применения никеля Ренея с выходом 96% (а в случае применения палладия на активированном угле с выходом 97%) получают 2-метил-3-этил-6,7,8,9-тетрагидро-4-оксо-4Н-пиридо (1,2-а) пиримидин в форме бесцветного вязкого маслообразного вещества, которое может быть перегнано при 146-148°С. (б мм рт.ст.). После выдержки в течение короткого промежутка времени продукт закристаллизовывался. Рассчитано, %: С 68,72;Н 8,39. с,,н,, Найдено, %: С 68,67, Н 8,40. Пример 21. 0,01 моля 2,6-диметил-3-этил-4-оксо-4Н-пиридо(1,2-а) пиримидина растворяют в 20 мл ацетона. Приготовленный раствор смешивают с 0,03 моля йодистого метила и реакционную смесь выдерживают в тугоплавкой ампуле 24 ч при . Затем раствор упаривают досуха, остаток растворяют в 15 мл метилового спирта и полученный раствор смешивают с раствором содержащим 0,05 моля тетрагидробората (ill) натрия в 10 мл воды. Реакционную смесь выдерживают 4 ч, после чего производят отгонку метилового спирта и водную фракцию три раза экстрагируют хлороформом, используя каждый раз по 20 мл последнего. Экстракт сушат и упаривают. К .полученному маслообразному продукту прибавляют 10 мл насыщенного хлористым водородом этилового спирта. Продукт кристаллизуют при растирй-нии с диэтиловым эфиром. После перекристаллизации из смеси ацетона и диэтилового эфира с дом 41% получают гидрохлорид 1,2,6-триметил-3-эт1-ш- ,2,3,6,7,8,9,9а-октагидро-4-оксо-4Н-пиридо (1,2-а) пиримидина в форме белого кристаллического веществе, которое начинает сублимироваться при 206 С. Рассчитано, %; С 60,81, Н 8,24, Ci 13,8i. (.-HCI Наведено, %: С 60,64; Н 8,.12; С1 13,96. Пример 22. 10 г З-этил-2,6-диметил-4-оксо-4Н-пирвдо (1,2-а) пиримидина растворяют в 100 мл этилового спирта. К приготовленному раствору прибавляют раствор 12 г фумаровой кислоты в 100 мл этилового спирта Смесь нагревают до темпе- ; ратуры кипения, и затем .посредство 21 охлаждения кристаллизуют продукт. Кристаллическое вещество отфильтровывают, промывают небольшим количеством этилового спирта и затем су- шат. В результате получают 12.5 г (78,5%) ди-(3-этил-2,6-диметнл-А-оксо-4Н-пиридо {1,2-а) пиримидин)-фумарата, который после перекристаллизации из этилового спирта име ет т.пл. 185-186 С. Рассчитано, %: С 64,60; Н 6,20; N 10,76. . Найдено, %: С 64,35 Н 6,24; N 10,40. Пример 23. 10 г З-этил-2,6 -диметил-4-оксо-4Н-пиридо (1,2-а) пиримидина растворяют при нагревании в 100 мл этилметилкетона. К при готовленному раствору прибавляют раствор 12 г малеиновой кислоты в 100 мл этилметилкетона. Смесь нагре вают до температуры кипения и затем посредством охлаждения кристаллизую продукт. Кристаллическое вещество отфильтровывают, промывают небольши количеством метилатилкетона и затем сушат. В результате получают 14,0 г (87,9%) гидромалеината З-этил-2,6-диметил-4-оксо-4Н-пиридо (1,2-а) пиримидина, который после перекристаллизации из этилового спирта име ет т.пл. 1.37-138С. Рассчитано, %: С 60,36, Н 5,70, N 8,80. бЧуЕГ 2 5 С 60,35; Н 5,72; Нагиено, Пример 24. Юг З-этил-2,6 -диметил-4-оксо-4Н-пиридо (1,2-а) пиримидина растворяют при нагревании в 100 мл ацетона. К приготовлен ному раствору прибавляют раствор 7 салициловой кислоты в 100 мл ацетона. Смесь нагревают до температуры кипения и затем посредством охлаждения производят кристаллизацию. Кри сталлический продукт отфильтровываю промывают ацетоном и затем сушат, В результате получают 11,5 г (67,6%) салицйлата 3-зтил-2,6-димепш-4-рксо-4Н-пиридо(1,2-а) пиримидина, который после перекристаллизации из этилового спирта имеет т.пл. 126-12 Рассчитано, %: С 67,04, Н 5,92, N 8,22. QjoH-jjJjO т1айдено, %: С 67,50; Н 5,94; N 8,25. Пример 25. Юг З-этил-2,6днметил-4-оксо-4Н-пиридо (I,2-а) пиримидина растворяют при нагревании в 30 мл этилового спирта, К приготовленному раствору прибавляют 19,2 г лимонной кислоты, растворенные в 100 мл этилового спирта. Смесь нагревают до температуры кипения и затем посредством охлаждения производят кристаллизацию. Кристаллический продукт отфильтровывают, промывают этиловым спиртом и затем сушат. В результате получают 18,2 г(92,4%) гидроцитрата 3-этил-2,6-диметил-4-оксо 4Н-пиридо (1,2-а)пиримидина, который после перекристаллизации из этил:ового спирта имеет т.пл, 136-137°С. Рассчитано, %: С 54,82; Н 5,62, . Навдано, %: С 55,08; Н 5,70; N 7,01. Пример 26. 10 г З-этил-2,6-диметил-4- ОКсо-4Н- аиридо (1,2-а) пиримидина растворяют при нагревании в 100 мл ацетона. К приготовленному раствору прибавляют раствор 13,4 г яблочной кислоты в 100 мл ацетона. Смесь нагревают до температуры кипения и затем посредством охлаждения производят кристаллизацию продукта. Кристаллический продукт отфильтровывают, промывают ацетоном и затем сушат. В результате получают П,5 г (68,4%) гидро-2-оксисукцината З-этил-2,6-диметил-4-оксо-4Н-пиридо-(1,2-а) пиримидина, который после перекристаллизации из этилового спирта имеет т.пл. 141-142 С. Рассчитано, %: С 62,44; И 6,36, N Ю,40. Найдено, %: С 62,47; Н 6,76, N 10,43. Пример 27. 10,0 г 3-этил2,6-диметил-4-оксо-4Н-пиридо (1,2-а) пиримидина растворяют при нагревании в 50 МП этилового спирта. К приготовленному раствору прибавляют . 2,8 мл серной кислоты с концентрацией 96-97 вес,%. Смесь нагревают до температуры кипения и затем посредством охлаждения производят кристаллиэацию. Кристаллический продукт отфильтровывают, промывают этиловым спиртом и затем сушат. В результат получают-5 г (33%) гидросульфата 3-этил-2,6 диметил-4- Оксо-4Н пирндо (i,) пиримидина, который пос перекристаллизации из этилового сгш та дашет т.пл. 199-200 0. Рассчитано, %: С A7,99i Н 5,40; N 9,33. НаГвдено, %: С 48,31; Н 5,51; N 9,55, Пример 28, Реакцию осуществляют согласно примеру 2, однако в качестве аминокомпоиента применя ют 2 амино-4-метилпиридин, В резул тате с выходом 64% получают гидро- хлорид 3-этил 2,8 диметил-4-оксо 4М-пиридо (l,2-a) пиримидина, который после перекристаллизации из г«гш. 195этиловогчэ спирта имеет 200 с. Рассчитано, %: С 60,38/ Н 6,33/ N 1,7А; С1 14,85. .ЛАОНС 11айдено,, %: С 60,42; Н 6,38 N П.,82; Ci 14,67. П р и м ер 29. Реакцию осу1цеств.ляют согласно примеру 2, однако в качестве Шхгинокомпонента применя ют 2 амино-4,6-диметилпиридин. В резу1гьтате с выходом 71% получают гидрохлорид З-этил-2,6,8-триметил-4-оксо-4Н-пиридо (J,2-а) пиримиди на, который после перекристаллизации из этилового спирта имеет т.пл 198-205с. Рассчитано, %: С 61,78,- Н 6,78; 11,08; С1 14,03. fiN O-HCl Найдено, %: С 62,08; Н 6,81; 1 , 17; С1 13,-82. Пример 30. Реакцию осуществляют способом, /|редложенным в п мере 2, однако, с тем отличием, чт в качестве оксосоединения применяю этиловый эфнр 2-этил-3-оксока прон вой кислоты. В результате с выходом 75% получают гидрохлорвд З-этил-б-метил-2-Н прогаш-4-оксо-4Н-пиридо(1,,2-а) пиримидина, который после пйрекристаллиззции из этилового спи та имеет т.гш, С. Рассчитано, %; С 63,ОЗ; Н 7,18, N 0,50, С1 13,29. .«5НС1 Навдено, %; С 63,28/ Н 7,32; N 10.58; С1 13,15. Пример 31. Смесь, состоящую из 2,16 г 2-амино-5-метш1Ниридина; 3,16 ,г этилового эфира 2-эгилацетоуксусной кислоты; 4,6 мл хлорокиси фосфора и 1,4 г полифосфорной кислоты, неремеш1вают 45 мин при 120-130 С. Выделение газа, которое сначала было интенсивным, ослабевает и совершенно затем прекращается. Реакционную смесь разлагают 20 мл этилового спирта и прн охлаждении и царапании стенок сосуда палочкой производят кристаллизацию. Кристаллический продукт отфильтровывают. Полученные 4,6 г гидрохлорида растворяют в 20 мл вОды. рН раствора доводят до 7 посредством прибавления 20%-ного раствора углекислого натрия. Выделившийся в осадок криста.гшический продукт отфильтровывают, промывают водой и сушат. В результате получают 2 г (49%) З-этил-2,7-диметш1-4-оксо-4Н-1шридо (1,2-а) пиримидина, который после перекристаллизации из метилового спирта имеет т.пл. 154-15б С. Рассчитано, %: С 71,26; Н 6,98, N 13,85. C,2li,,N.,0 Найдено, %: С 71,42; Н 7,08/, N 13,91. Пример 32. Работают по предложенной в примере 7 методике, но в качестве исходного вещества вместо 2-амино-6-метилгшридина используют 2-амино-5-бромпир1-щнн и получают 7-бром-3-этил-2-метил-4-оксо-4Н-пиридо (l,2-a) пиримидин с выходом 69%, продукт плавится после перекристаллизации из этанола при 139-140 С. Рассчитано, %: С 49,46; Н 4,15, 10,48; Вг 29,91. На.йдено, %: С 49,62; Н 4,20; 10,62; Вг 29,67. Пример 33. Работают по предоженной в примере 7 методике, однако вместо 2-амино-6-метилпиридина используют 2-амино-5-йодпиридин и получают 3-этил-7-йод-2-метил-4-оксо-пиридо (l,2-a) пиримидин с выодом 57%, продукт плавится после ерекристаллизации из диметилформамиа при-150-152 0. С 42,06: Н 3,06/ Рассчитано, %; N 9,9; J 40,38. C,.H,,NgJ 25 Найдено, %: С 42,28, Н. 3,4i; N 8,72, J 40,44. Пример 34. Работают по предложенной в примере 7 методике, однако вместо 2-амино-6-метилпириди на используют 2-амико-3,5-дихлорпир дин и получают 3-этил-2-метил-7,9-дихлор-4-оксо-4Н-пиридо (1,2-а) пи римидин с выходом 66%, который плавится после перекристаллизации из этанола при 179-180 С. Рассчитано, %: С 51,34; Н 3,92; N 10,89; С1 27,58. q,H,c,N2. Найдено, %: С 5,42; Н 3,86, N 10,54; С1 27,42. Пример 35. Работают по пре ложенной в примере 7 методике, одна вместо 2-амино-6-метилпиридина используют 2-амино-5-этоксикарбонилпиридин и получают З-этил-7-этоксикарбонил-2-метил-4-оксо-4Н-пиридо(l,2-a) пиримидин с выходом 73%, который после перекристаллизации из этанола плавится при 94-96 С. Рассчитано, С 64,90, Н 6,20, N 10,76. С,Н Йайдено, %: С 64,76; Н 5,31; N 10,88. Пример 36. Работают по пре ложенной в примере 7 методике, но вместо 2-амино-6-метилпиридина испо зуют 2-аминопиридин-З-карбоновую ки слоту и получают 3-этил-3-карбокси-2-метил-4-оксо-4И-пиридо (I,2-а) пиримидин с выходом , который по ле перекристаллизации из диметилформамида плавится при 176-178 С. Рассчитано, %: С 62,06; Н 5,21; N 12,06. . zHfiM -ь Найдено, %: С 62,24; Н 5,27, N 12,24. Пример 37. 5 моль 3-этил-7-этоксикарбонил-2-метил-4-оксо- 4И-пиридо (1,2-а) пиримидина в 15 мл 15% вес./об. метанольного раствора аммиака оставляют стоять 3 дня при комнатной температуре. Полученные кристаллы фильтруют и перекристаллизовывают из диметия формамида. Получают 7-аминокарбонил-3-этш1-2-метил-4-оксо-4Н-пиридо(1,2-а) пиримидин с выходом 88% ко торый плавится при 289-292 С. 26 Рассчитано, %: С 62,32; Н 5,67; N 16,34. гН},} Найдено, %: С 62,15 Н 5,55, 16,78. Пример 38. Работают по приведенной в примере 37 методике, однаг ко используют 15 мл 15% вес./об. метанольного раствора метанол шина и получают 3-этил-2-метил-7-(| -метиламинокарКонйл . -4-оксо-4Н-пиридо (1,2-а)пиримидин, который после перекристаллизации из этанола плавится при 182-184 с. Выход 87«. Рассчитано, %: С 63,40; Н 6,14; N 17,06. Найдено, %: С 63,ЗЗ; Н 6,20; N 17,22. Пример 39. Работают по изложенной в примере 37 методике, но используют 15 мл 15% вес./об. метанольного раствора диметиламина и получают 3-этил-7-(Ы,Ы-диметиламинокарбонил -12-метил-/; -оксо-4Н-пиридо-О,2-а)пиримидин с выходом 81%, который по изложенной в. примере 5 методике переводят в хлоргидрат. Хлоргидрат после перекристаллизации из смеси этанол-дн:.тш1овый эфир плавится при 183-185 С. Рассчитано, %: С 56,85; Н 6,13; N 14,20; С1 11,99. Найдено, %: С 56,74, И 6,06; N 14,43; С1 11,98. Пример 40. 10 моль 3-метш1-7-аминокарбонил-2-метил-оксо-4Н-ПИРИДО (I,2-а)пиримидина кипятят с 15 мл хлорокиси фосфора 1 ч. Раствор концентрируют и нейтрализуют 20% вес./об. раствором карбоната натрия. Продукт встряхивают 3 раза по 20 мл хлороформа. Хлороформный раствор после сушки с безводным сульфатом натрия концентрируют и остаток перекристаллизовывают из этанола. Получают З-зтил-7--циано-2-метш1-4-оксо-4Н-пиридо)пиримидина с выходом 70% который плавится при 214-2 бс. Рассчитано, %: С 67,59; Н 5,20; N 19.71. ЛО Найдено, %: С 67,ЗГ, Н 5,38; М 19,66. Пример 41. 10 моль нопиридина и 13 ммоль этилового эф ра 2-этилацетоуксусной..кирлоты Кипятят 3 ч в 10-мл уксусной кислоты и реакционную смесь концентрируют. Остаток при нагревании растворяют в 2 мл этанола и к раствору добавляют 1 мл 30% вес./об. раствора хло гидрат-этанол. Еосле о-кпаждеикя выпадагавде кристаллы отфильтровывают промывают этанолом и сушат. Получают хлоргидрат 3-этил-2-метил-4- оксо-4Н-пиридо(1,2-а).пиримидина с выходом 22%, который после перекристаллизации из этанола плавится с разложением при 246-247°С. Рассчитано, %: с 58,80; Н 5,83, N 12,47; С1. 15,78. ..fgOCl Найдено, %: с 58,63; Н 5, 12,50;, С1 15,80. Пример 42. 10 моль 2-аминопиридина и 15 ммоль 2-этилацетоуксусной кислоты этилового эфира кипятят 3 ч в 10 мл пропионовой кислоты и реакционную смесь концентри руют. Остаток растворяют в 2 мл эта нола при нагревании и к полученному раствору добавляют 1 мл 30% вес./об раствора этанол - хлористый водород. .Вьшадающие кристаллы после охла вдения, промывают этанолом и сушат. Получают хлоргидрат З-этил-2-метил-4-оксо-4Н-пиридо{i,2-а)пиримидина с выходом 35%, который после перекристаллизации из этанола плавится при 246°С с разложением. Полу ченный продукт не имеет различия в температуре плавления с продуктом, полученным по примеру 41. Пример 43. 10 .-моль 2-аминопиридино и 15 моль 2-этилацетоуксусной кислоты этилового эфира в 15 мл капроновой кислоты нагревают 3 ч при 200с и реакционную смесь концентрируют. Остаток при нагревании растворяют в 2 мл этанола и к полученному раствору Добавляют 1 мл 30% вес./об. раствора хлористый водород - этанол. Вьшадакяцие после охлажде1шя кристаллы отфильтровывают, промывают этанолом и сушат. Получают хлоргидрат 3-этил-2 метил-4-оксо-4Н-пиридо-{I,2-а)пиримидина с выходом 46%. После перекристал лизации из этанола продукт плавится при 246-247 С и не имеет различия в температуре плавления с продуктом, полученным по примеру 41 или 42. Пример 44. Изготовление 75 г таблеток. 375 г -хлоргидрата 2,6-диметил-З-этил-4-оксо-4Н-пиридо(1,2-а)пиримидина, 525 г кристаллической целлюлозы и 70 г амилопектина гемогенизируют. После гранулирования с 75 г лакового раствора (Eudragit), сушки при 40 С и измельчения смесь гомогенизируют с 10 г порошкообразного талька и 10 г стеарата магния и таблетируют в таблетки по 200 мг. Пример 45. Изготовление драже пролонгированного действия массой 150 мг. 750 мг 2,6-диметил-3-этил-4-оксо-4Н-пиридо(1,2-а)пиримидина хлоргидрата, 750 г кристаллической целлюлозы и порошкообразного поливинилпирролидона смеишвают в.гомогенизаторе. Смесь гранулируют с раствором 22,5 г Eudragit в 175 см пропанола. Гранулят сушат при 50 С, измельчают, гомогенизируют с 32,5 г талька и 22,5 г порошкообразного стеарата магния и таблетируют в выпуклые с двух сторон таблетки массой 345 мг. Изготовленные таким образом таблетки (ядра драже) предусмотрены известным образом с пленочным или сахарным.покрытием. Пример 46, Изготовление капсул массой 50 мг. Порошкообразную смесь 250 мг 2,6-диметил-3-этил-4-оксо-4Н-пиридо (1,2-а)пиримидина хлоргидрата и 115 г картофельного крахмала смачивают раствором 5 г желатина, 30 г дистиллированной водой,- 3 г 2н. раствора соляной кислоты и 90% вес./об, этанола в пригодном смесителе, гранулируют через сито с размером отверстия в свету 0,3 мм и сушат при 40 С. Полученный гранулят измельчают на сите с размером отверстия в свету 0,15 мм и смешивают с порошкообразной смесью 85 г картофельного крахмала, 25 г талька и 5 г стеарина. Расфасовывают на пригодном расфасовочном аппарате в твердые желатиновые капсулы по 0,115 г. Капсулы упаковывают обычным образом.
29
90637830
Таблиц а 1
















| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения производных пиридо-(1,2-а) пиримидина или их фармацевтически приемлемых солей,или их оптически активных изомеров | 1978 |
|
SU999972A3 |
| Способ получения производных пиридо (1,2-а) пиримидина или их фармацевтически приемлемых солей или их оптически активных изомеров | 1978 |
|
SU999973A3 |
| Способ получения 2,3-полиметилен4-оксо-4н-пиридо/1,2-а/пиримидинов или их четвертичных солей | 1978 |
|
SU749365A3 |
| Способ получения производных пиридо/1,2-а/пиримидинов или их солей,или их оптически активных изомеров | 1978 |
|
SU906379A3 |
| Способ получения производных пиридо(1,2-а)-пиримидина или их солей | 1974 |
|
SU566524A3 |
| Способ получения производных пиридо /1,2-а/ пиримидина или их оптических изомеров, или их гидратов, или их солей | 1980 |
|
SU980622A3 |
| Способ получения производных пиридо (1,2-а) пиримидина | 1977 |
|
SU698532A3 |
| Способ получения производных пиридо (1,2- @ ) пиримидина или их кислотно-аддитивных солей | 1978 |
|
SU1022659A3 |
| Способ получения производных амида 4-оксо-4Н-пиридо /1,2- @ /пиримидин-3-карбоновой кислоты или их кислотно-аддитивных солей | 1989 |
|
SU1820909A3 |
| Способ получения производных пиридопиримидинов или их солей | 1978 |
|
SU791240A3 |

Гидрохлорид 2,3,6-триметил-4-оксо-4Н-пиридо{1,2-а) пиримидина
Гидрохлорид 2,6-димеТИЛ-3-ЭТШ1-4-ОКСО-4Н-пиридо(1,2-а)пиримидина
Гидрохлорид 2-метШ1-3-ЗТИЛ-4-ОКСО-4Н-ПИРИДО(1,2-а)пиримидина
Гидрохлорид 3 6-диметил-2-этил-4-оксо-4Н-пиридо(-1,2-а)пиримидииа
Гидрохлорид 2-метил-З-Н-пропил-4-оксо-4Н-пиридо(1,2-а)пиримидина
Гидрохлорид 2,6-диметил-3-Н-пропил-4-оксо-4Н-тшридо(1,2-а)пиримидина
Пробои
0,066
0,780
0,021
0,796
1,070
0,012
0,120
0,0019
0,0105
0,502
0,316 0,0025 0,607 0,069
Т .а б л и ц а 2
достигнута
То же
580
2-МеПШ.3--этил 4-оксо-4И пиркдо(15 2-а)пиримидин, гидрохлорид
2, б, 8 Триметил 3-этйл-4-оксо-4Н-пиридо(I,2-а)
пиркнидин, гидрохлорид
г
2,6--1 1иметил-3-М-пропил-4-оксо-4Н-пиридоС1,2-а) пиршшдин, гидрохлорид
2,9-Э иатил-3 этил-4-окСО-4Н-ПЙРВДО(,2-а)пиримидин, гидрохлорид
2,7ДI мeтТI-3-этил-4-oкco-4H пиpидo (1,2--а) пиримидин, гндрохлорад
2-Метил7.3-эти.я-7-хлор 4-оксо-4Н-диридо(1 ,,2-а) пиримидин, гидрохлорид
2,3,6-Триметил-4-оксо-4Н-ПИРИДО{,2-а)пиримидин, гидрохлорид
Та б л и ц/ а 3
Таблица 4
74
620 300 100 180
820 580 49 120
48
1200
310
800 500 75 150
175
98
1100
87
175
Исследуемле соединение
2-Иетил-3-(-бутил-4-ок- со-4Н-пиридо(1,2-а)пиримидин, гидрохлорйд
2,6-Диметил-З- -бутил-4-6ксо-4Н-пиридо(1,2-а) пиримидин, гидрохлорид
Метосульфат I,6-диметил-3--этоксикарбонил-4-оксо-4Н-6,7,8,9-тетрагидропиридо(1,2-а)пиримидиния(пробои)
Продолжение табл. 4
Тест с горячей пластиной, ED , мг/кг
, {на крысах) (на крысах)
р.с. i.v. S.C,
РС. I.V. S.C.
251
1100
340
НОС
50
220
1600 220
Авторы
Даты
1982-02-15—Публикация
1978-08-18—Подача