Способ заключается в том, что соединение формулы или его оптически активные изомеры где К - атом водорода или формил, подвергают взаимодействию с соедине нием общей формулы где ГЦ имеет указанные значения, при , предпочтительно при 0с последующим выделением целевого : продукт.а или омылением полученного сложного эфира, или превращением его в амид или гидразид кислоты, и целевые продукты выделяют в свобо ном виде или в виде фармацевтически приемлемых солей, или в виде оптиче ки активных из.омеров. Низший алкил или низшая алкоксигруппа - это нормальные или разветвленные алифатические насыщенные группы углеводородов с 1-6, ПреИМущественно с 1-4 атомами углерода, например метил, этил, -пропил, изо пропил, н-бутил, вторичный бутил, трет-бутил, Н-пентил, неопентил, н -гексил и т.д. Соединения общей формулы 1, соде жащие карбоксил или сульфокислоту, могут образовать с физиологически переносимыми основаниями соли, например соли щелочных металлов, таки как натриевая и -калиевая соли, а также соли, образованные с органическими аминами, такие как соли три этиламина, этаноламина и т.д. Изобретение распространяеется также на оптические и пространствен ные изомеры и туатомеры соединений общей формулы I. . В качестве соли диазония можно, например, использовать соединение общей формулы Процесс можно проводить или добавлением соединения общей формулы ; М к кислому раствору соли диазони или наоборот. Компоненты реакции берут преимущественно в эквимолярном соотношении, однако можно рабо тать также с небольшим избытком од ного или другого из компонентов. Р акцию проводят в данном случае в присутствии кислотосвязывающего вещества, например ацетата натрия. В качестве реакционной среды выбирают преимущественно обычную водную среду, используемую при реакциях с солями диазония. Соединения общей формулы можно выделять известным способом из реакционной смеси или же осаждагь из реакционной смеси в виде его солей или гидратов, которые можно отделить с помощью фильтрации или центрофугирования. Если реакцию проводят в водной среде, то конечный продукт экстрагируют из реакционной смеси подходящим органическим растворителем, например бензолом, хлороформом, простым эфиром, и выделяют, упаривая органический экстракт. Если реакцию проводят в среде органического растворителя, то соединение общей.формулы I выделяют благодаря удалении растворителя. Полученные соединения общей формулы Iможно очистить и перекристаллизацией или хроматографическим. способом. Карбоксильную группу, стояиую в качестве заместителя, можно этерифицировать известным способом до алкоксикарбонил-, арилоксикарбонил- или аралкилоксикарбонилгруппы., Этерификация может происходить, например, путем превращения с соответствующим спиртом или фенолом в присутствии кислого катализатора или обработки с диазоалканом, например диазометаном, диазоэтаном. Карбоксил соответствующего производного можно декарбоксилировать нагревая его, причем вдзникае соответствующее производное, содержащее на месте карбоксильной группы водород. Де,,карбоксилироБание целесообразно проводить в присутствии кислоты, например фосфорной. Содержащее карбоксильную группу производное можно подвергнуть взаимодействию с соответствующим амином, в замещенный в данном случае амид кислоты. Замещенные амиды кислоты получают известным способом через активный сложный эфир, например активный эфир, образованный с этиловым эфиром хлормуравьиной кислоты. Эфирную группу, содержащуюся в качестве заместителя, можно подвергнуть взаимодействию при нагревании с избытком соответствующего спирта. Сложный эфир формулы I кислотой или щелочной обработкой можно превратить в соответствующую 1 арбоновую кислоту общей формулы I. Щелочной гидролиз проводят нагреванием с гидроокисью щелочного металла в водной или спиртовой среде, из образующейся соли щелочного металла кислоту высвобож.дают благодаря подкислению. При гидролизе с минеральными кислотами получают непосредственно свободную карбоновую кислоту. .
Сложный эфир общей формулы I путе реакции с аммиаком в водно-спиртовой среде может быть превращен в соответствуютий амид кислоты Лормулы I обработкой гидразином в необходимом случае замешенным (например, гидразином, метил-,или фвнилгидразином) на соответствукяяий гидразид общей форму лы I .
Соединения общей формулы I можяо известным способом высвободить из солей, образованных ими с кислотами или щелочами,
Из основных соединений общей формулы I можно благодаря взаимодействи с неорганическими или органическими кислотами образовать соединения аддитивные. Солеобразование проводят известным способам, вводя соответствующее соединение общей формулы Iвместе с используемой в эквивалентном количестве или в избытке кислотой, в инертньй органический растворнтель.
Соединения общей формулы I, содержавще кислые группы (карбоксил или сульфокислоту), можно подвергнуть шзаимодействию с основанием (например, гидроокисью щелочного металла, гидроокисью иелочноземельного металла, органическими аминами) в соли, Образуемые с основанием.
Те соединения общей формулы I, которые содержат в качестве R отличные от водорода заместители, имеют центр ассиметрии и могут существовать в качестве оптически активных соединений или рацемата.Оптически активные соединения общей формулы I могут Ношример получать, используя оптически активные исходные вещества общей формулы 1I или разделяя рацематное соединение общей формулы { на его оптически активные антиподы. Это можно осуществлять известным способом. Соединения общей формулы (, содержащие карбоксильные группы, можно, например, разделить на оптичес- кие изомеры, подвергай взаимодействию рацемат с оптически активным основанием, например трео-1-П-нитрофенил)-2-аминопропан-1,3-диолом. Члены обр зукичейся пары диастереоизо метрических солей отделяют друг от друга на основе их разлйчаницихся. физических свойств и отделенные друг от друга оптические антиподы общей формулы I высвобождают из соли обработкой сильным основанием.
Соединения общей формулы 1 обнаруживают многие фармакологические действия; они являются противоспалительными, болеутоляющими, антиатеросклеротическими, снижают агрегацию
тромбов, регулируют кровеносную систему и функции сердца, действуют на центральную нервную систему,-обладают транквилизирующим действием, РУ-антигоничтическим, антибактериаль ным и противогрибковь1м действиями, а также противоязвенным действием. Поэтому соединения общей Формулы- I применимы в ветеринарии и медицине. Особо следует отметить их активность против аллергии и астмы.
Аллергические реакции, возникающие вследствие взаимодействия антигенов и антител, проявляются в различных органах и тканях очень, различным образом. Одной из часто встречающихся форм аллергии является астма. В качестве средства против астмы .распространен дииатрийхромогликат (1,3-бис-(2-карбоксихромон-б-ил-окси2-окси-пропан-интал R), который не применяют орально, а используют лишь в.виде ингаляций при применении сложных вспомогательных средств (SpInhaler). В настоящее время обнаружено, что.соединение общей формулы I как при оральном или внутривенном введении, так и в виде ингаляции дает положительные результаты при лечении аллергических симптомов.
Действенность соединений I доказана с помощью стандартных тестов, служащих для определения антиаллергического действия. При PGA-тесте в качестве вещества для сравнения используют динатрийхромогликолят. Тесты проводят на крысах. Результаты приведенй в табл. 1.
При PGA-тесте (050 / внутривенно) следующие сре щненйя проявляют такую; эффективность:
9-р;2-Карбоксифенил)-гидразино-2-6-метил-4-оксо-6,7, 8,9-тетрагидро-4Н-пиридо)(1,2-а)-пиримидин-3-карбоновая кислота /0,48
9-|С( 4-ЭтокСифенил)-гидрази но-3-б-метил-4-оксо-6,7, 8,9-тeтpaгидpo-4H-пиpидo(l ,2-а)-пиримидин-2-карбоновая кислота1 0
9-С(4-Хлорфен.ш)-гидразине 6-метил-4-окса-б ,7 ,8,9- тет агидро-4Н-пиридо(1,2-а)-пиримидин-3-карбоновая кислота0,53
9-(3-Пиридилгидразино-)б-метил-4-оксо-6,7,8,9тетрагидро-4Н-пиридо(1,2-а) -пиридимин-3-карбоновая кислота , . 0,54
Из приведенных данных видно, что соединения формулы ) действуют также при оральном использовании. При внутривенном введении соединения формулы I также более действенны, чем извес ные контрольные соединения. Токсичность соединений формулы I незначительна, определена на крысах и мыша и составляет при LDg. 500 мг/кг перорально. С оедйнения общей формулы I можно использовать в фармации в форме пре паратов, содержащих активное вещест во, а также твердые или жидкие, нео ганические или органические вещества - носители. Препараты изготавливают обычным при производстве лекар ственных средств способом. Препараты можно выпускать в форм пригодной для орального и парентерального введения, или в виде ингаляций, например, в виде таблеток, драже, капсул, шариков, порошкообразной смеси, в виде аэрозоли, водной суспензии или раствора, инъекционного раствора или сиропа. Препа раты могут содержать пригодный твер дый наполнитель, носитель, стерильный водный растворитель или нетоксичный органический растворитель. К предусмотренным для орального при менения препаратам можно добавлять сахарин и обычные вкусовые добавки. Орально применяемые таблетки могут содержать в качестве носителя например лактозу, цитрат натрия, карбонат кальция, а также связующие вещества, например крахмал, альгиновую кислрту, вещества, придающие скользкость, например тальк, лаурил сульфат натрия, стеарат магния. Материалом для изготовления капсул может быть лактоза и полиэтиленгликоль. Водные суспензии могут содержать эмульгирующие и суспендирующие вещества. Суспензии, приготовленные с .помощью органических растворителе могут содержать в качестве раствори теля этанол, глицерин хлороформ и т.д. Препараты, пригодные для паренте рального введения и для ингаляций, являются растворами или суспензиями активного вещества, приготовленными в пригодной среде, например арахисовом, кунжутном масле, полипропиленгликоле или воде; Инъекционные препараты можно вводить внутримышечно, внутривенно или подкожно. Инъекционные растворы готовят преимущественно с водной средой, устанавливая необходимое значение рН среда. Растворы при необходимости можно готовить в виде изотоническог солевого раствора или раствора глюкозы. Для речения астмы препараты можно также вводить в организм в виде ингаляции с помощью ингалятора или аэрозольного устройства. Содержание активного ве1чества в препарате может изменяться в широких пределах и лежит в интервале 0,005-90%. Ежедневная доза в пересчете на активное вещество может изменяться в широких -пределах и зависит от возраста, веса и состояния больного, а также от лекарственной формы препарата и активности действующего активного вещества. При оральном применении ежедневная доза составляет в общем случае 0,05-15 мг/кг, в то время как при внутривенном введении и ингаляции ежедневная доза, разделенная на несколько частичных доз, лежит в интервале 0,001-5 мг/кг. Эти даннйе носят ориентировочный характер, в отдельных случаях и в зависимости от предписаний врача они могут отклоняться в сторону увеличения или уменьшения дозы. Пример. К смеси 18,6 (0,2 моль) анилина и 100 мл 1:1 разбавленной водной соляной кислоты при р-5 С и реремеишвании медленно добавляют по каплям 13,8 г (0,2 моль) нитрита натрия в 100 мл воды. Затем к смеси медленно и при интенсивном перемешивании добавляют по каплям , раствор 47,2 (0,2 моль) этилового эфира 6-метил-4-оксо-б,7,8,9-тeтpaгидpo-4H-пиpидo-(l,2-a) ПИРШИ1-ШИН3-карбоновой кислоты в 100 мл воды. Реакционную смесь перемешивают при в течение 2-3 ч и затем оставляют в холодильном шкафу на ночь. Выпавшие кристаллы отфильтровывают и промывают 1 ейольшим количеством воды. К субстанции добавляют 500 f-ш воды и 500 МП хлороформа и устанавливают добавлением 5%-ного водного раствора карбоната натрия рН водной фазы р&йный 7. Органический слой отделяют, водный слой встряхивают дважды с 500 мл хлороформа. Очищенный органический слой сушат над прокаленным сульфатом натрия, затем при пониженном давлении отгоняют растворитель. В качестве осадка остается масло красного цвета, которое кристаллизуют из двух-, трехкратного количества этанола. Получают 48,7 г (63,0%) продукта, который плавится при 8687°С. -7 Соединение кристаллизуют с 1 моль этанола; этанол можно удалить сумкой при 90-100с в вакууме над фосфорным ангидридом. Высушенный этиловый эфир 9-(фенилгидпазоно)-б-метил-4оксо-6 ,7,8,9 тетраг« дро-4Н-пиркдо(1,2-а)пиримидин-3-карбоновой кислоты плавится при 138-139 С. Элементный анализ. Рассчитано, %: С 63,51, н 5,92; N 16,45. (;aHjc,N4.o Найдено, %: С 6.3,53; Н 6,03, N 16,60. П р и м е р 2. Работают способом описанным в примере 1, с той разницей, что вместо анилина используют П -броманилин. Полученный этиловый эфир 9-(п-бромфенилгидразоно)-б-мети 4-оксо-б,7,8,9-тетрагидро-4Н-пиридо(1,)пиримидин-3-карбоновой кислоты имеет т. пл. 188-189 С. Элементный анализ. Рассчитано, % С 51,69, Н 4,34, N 13,39, Вг 19,10. Найдено, %; С 51,84, Н 4,54, N 13,26, Вг 19.13. Пример 3. Работают способом описанным в примере 1, с тем отличи ем, что вместо анилина используют м -толуидин. Полученный этиловый эфи 6-метил-9-(м-метилфенилгидразоно)-4 оксо-6,7,8,9-тетрагилро-4Н-пиридо(1,2-а)пиримидин-3-карбоновой кисло ты имеет т. пл. 159-160 С. Элементный анализ. Рассчитано, %: С 64,39, Н 6,25, N 15,80. Найдено, %: С 64,30, Н 6,22, N 15,85. Пример 4. К смеси (0,02 мол П-хлоранилина и 10 мл 1:1 раз.бавлен ного водного раствора соляной кисло ты при перемешивании медленно по ка лям добавляют 1,4 г (0,01 моль) нит рита натрия в 10 МП воды. Затем к смеси несколькими порциями добавляю 12,0 г твердого ацетат натрия и затем при интенсивном перемешивании медленно по каплям добавляют 4,7 (0,02 моль) этилового эфира 6-метил 4-ОКСО-6,7,8,9-тетрагидро-4Н-пиридо (1,2-а)пиримидин-3-карбоновой кисло ты. Реакционную смесь при в течение 2-3 ч перемешивают и затем оставляют стоять на ночь в холодиль ном шкафу. Выпавшие кристаллы отфил тровывают и промывают небольшим кол чеством воды, ПерекристалЛизацией и этанола;получают г (56,0%) этил вого эфира 9-(д-клорфенилгидразоно) 6-метил-4-оксо-6,7,8,9-тетрагидро4Н-пиридо-(1,2-а)пиримидин-3-карбоновой кислоты, т. пл. 177-178с. Элементный анализ. Рассчитано, %: С 57,67; Н 4,30, N 14,90; С1 9,45. (;ьЧ,9М40%С1 Найдено, % С 57,35/ Н 4,40/ N 15,04, С1 9,57. ПримерЗ. К смеси 2,9 г (0,02 моль) моногидрохлорида т -толу идина и 6 мл 1:1 разбавленного водн го раствора соляной кислоты при перемешивании и медленно прикапывают раствор 1,4 г (0,02 моль) нитрита натрия в 10 мл воды. Далее; работают способом, описанным в примере 3. Получают 4,0 г (56,4%) этилового эфира 6-метил-9-(п-метилфенилгидразоно)-4-оксо-5,7,8,9-тетрагидро-4Н-пиридо4(1,2-а )пиримидин-3-карбоновой кислоты, т. пл. 147-149° С. Элементный анализ. Рассчитано, %: С 64,39, Н 6,25, N 15,80. Найдено, %: С 64,05, Н 6,34, N 15,71. В примерах 6-11 работают способом, приведенным в примере 6, однако в качестве исходного ветества выбирают другие амины. П р и м е р 6. Исходя из 2,6-дихлоранилина, получают этиловый эфир 9-(2,6-дихлорфенилгидразоно)-6-метил4-оксо-б,7,8,9-тетрагидро-4Н-пиридо(1,2-а)пипимидин-3-карбоновой кислоты, т. пл. 153-154С. Элементный анализ. Рассчитано, % С 52,82j Н 4,43, N 13,68, С1 17,32. fieH,8N404 i Найдено, %: С 52,52, Н 4,47; N 13,75j С1 17,26. Пример 7. Исходя из о -толуидина, пЬлучают. этиловый эфир 6-метил-9-( -метилфенилгидразоно)-4-оксо-б ,7,8,9-тетрагидро-4Н-пиридо(1,2-а)пиримидин-3-карб6новой кислоты, т. пл. 185°С. Элементный анализ. . Рассчитано, %: С 64,39/ Н 6,25, N 15,80. Найдейр, % С 64,45, Н 6,01, N 15,75. Примера. Исходя из 3,4-метилендиоксианилина, получают этиловый эфир 6-метил-9 ,,3,4-метилендиоксифе нилгидразоно)-4-оксо-б,7,8,9-тетра-.. гидро-4Н-пиридо-(1,2-а)пиримидин3-карбонЪвой кислоты, т. пл. 172173С.. Элементный, анализ. Рассчитано, %: С 58,02, Н 5, 38, N 14,23. 5 Найдено, %: С 58,22; Н 5,39, N 14,35. П р и м е р 9. Исходя,из, 6 -нитроанилина, получают тиловый эфир 6метил-9-.(о -нитрофенилгидразоно)-4оксо-6,7,8,9-тетрагидро-4Н-пиридо- . (1,2-а)пиримидин-3-карбоновой кислоты, т.п. 190-192 0. Элементный анализ. Рассчитано, %J С 56,10, Н 4,96/ N 18,17. ( Найдено, -%: С 56,12; Н 5,-04, N 18.12. Пример 10. Исходя из №-нитроанилина, получают этиловый эфир б-метил-9-(-нитрофенилгидразоно)4-ОКСО-6,7,8,9-тетрагидро-4Н-пирид (1,2-а)пиримидин-3-кар6оновой кисл тн, т. пл. 218-219с. Элементный анализ. Рассчитано, %: С 56,10, Н 4,,96, N 18,17, Найдено, %: С 55,98, Н 4,80, N 18,03. Пример 11. Исходя из сульф Намида, получают этиловый эфир 9fя-(амино-сульфонил)-фенилгидразон 6-метил-4-оксо-6,7,8,9-тетрагидропиридо-(1,2-а)пиримидин-3-карбонов кислоты, который в форме его моног рата имеет т. пл. 210-213°С. Элементный анализ. Рассчитано, %г С 49,42, Н 5,30; N 16,01. Cie M -WaO, . Найдено, %: С 49,01; Н 5,11; N 15,74. Пример12. К смеси 93,1 г (1,0 моль) анилина и 480 мл (1:1) разбавленного водного раствора сол ной кислоты при перемешивании и 0медленно прикапывают раствор 68,9 (1,0 моль) нитрата натрия в 500 мл ;воды.Затем реакционную смесь медленно смешивают с 65,0 г твердого ацетата натрия. К 208,2 г (1,0 моль) 6-метил4-ОКСС-6,7,8,9-тетрагидро-4Н-пиридо-(1,2-а)пиримидин-3-карбоновой кнсчоты добавляют 500 мл воды, и 10%-ным водным раствором карбоната натрия доводят рН раствора до 7. Этот раствор при интенсивном перемешивании медленно прикапчеают к предварительно приготовленному рас вору соли диазония. Реакционную смесь при перемешивают в течение 2-3 ч и оставляют стоять на ночь в холодильном шкафу. Выпавшие кристаллы отфильтровывают и промывают небольшим количеством воды. Сырой продукт растворяют в водном натровом щелоке и раствор осветляю активированным углем. Затем раство подкисляют и выпавшие кристаллы отфильтровывают. Получают 293,0 г (93,8%) 9-(фенилгидразоно)-6-метил 4-ОКСО-6,7,8,9-тетрагилро-4Н-пирид (1,2-а)пиримидин-3-карбоновой кисл ты, т. пл. 255-256°С. (После перекристаллизации из диметилформамида т. пл. 267-268 С). Элементный анализ.. Рассчитано, %: С 61,53/ Н 5,16, N 17,94. Найдено, %: С 61,62; Н 5,26, N 18,10 Пример 13. К раствору 0,6 (0,015 моль) гидроокиси натрия в 25 мл воды добавляют 3,4 г (0,01мо этилового эфира 9-(фенилгидразоно)6-метил-4-оксо-6,7,8,9-тетрагидро4Н-пиридо-(1,2-а)пиримидин-3-карбоновой кислоты. Суспензию перемешивают при 50-60с в течение 4-5 ч, причем все переходит в раствор. Разбавленной 1:1 водной соляной кислотой устанавливают рН раствора равный 2. Выпавшие кристгшлы отЛильтронывают и промывают небольшим количеством воды. Получают 2,7 г (86,4%) 9-(фенилгидразоно)-6-метил-4-оксо-6,7,8,9тетрагидро-4Н-пиридо-(1,2-а)пиримидин- 3-карбоновой кислоты, т. пл. 267-268С, который не имеет различия в температуре точки плавления с продуктом, полученным в примере 12. В примерах 14-21 работают по описанному в примере 12 способу, однако исходят из других аминов. П р и м е р 14. Исходя из п-броманилина, получают 9-(п-бромфбнилгидразоно)-6-метил-4-оксо-6,7,8,9-тетрагидро-4Н-пиридо-(1,2-а)пиримидин-3карбоновую кислоту, т. пл. 250-252 С. Элементный анализ. Рассчитано, %: С 49,12, Н 3,86; N 14,32, Вт 20,43 Найдено, %: С 48,90; Н 3,86, N 14,36-, Вг 20,66., Пример 15. Исходя из антраниловой кислоты, получают 9-(с -карбоксифенилгидразоно)6-метил-4-окоо6,7,8,9-тетрагидро-4Н-пиридо-(1,2-а) пиримидин-3-карбоновую кислоту, т. пл. 266-268 с, Элементный анализ. Рассчитано, %: С , Н 5,53, N15,72. Н бМ405. Найдено, %: С 57,87; Н 4,40; N 15,6.. П р и м е р 16 . Исходя из R: -хлоранилина, получают 9-(п-хлорфенилгидг разоно)-6-метил-4-оксо-6,7,8,9 тетрагидро-4Н-пиридо-(1,2-а)пиримидин-8карбоновую кислоту, т. пл. 262-264 Элементный анализ. Рассч итано, %: С 55,42, Н 4,36; N 16,16; С1 10,22. Найдено,, %: С 55,40; Н 4,2, N 16,02/ С) 10,21. . П р и м е р 17. Исходя из О-толуидина, получают 6-метил-9-(о-метилфенилгидразоио)-4-оксо-6,7,8,9-тетрагидро-4Н-пиридо-(1,2-а)пиримидин3-карбоновую кислоту, т. пл. 221223 С. Элементный анализ. Рассчитано, %: С 62,57; Н 5,56, N 17,17. С.4 Ц, 0 Найдено, %: С 62,83; Н 5,55, N 16,83. ri p и м p 18. Исходя из 2, метиланилина, получают 6-метил-9(2,6-диметилфонилгидразоно)г4-оксо6,7,8,9-тетрагидро-4Н-пиридо-(1,2-а пиримидин-3-карбоновую кислоту, т. пл. 192-193 с. . Элементный анализ. Рассчитано, С 63,14, Н 5,88; N 16,36, B ioNxO Найдено, %: С 63,14, Н 5,93, N 16,15. П р и м е р 19. Исходя из 2,4,5триметиланилина, получают 6-метил9-(2,4,5-тримвтилфенилгидраэоно)-4оксо-6,7,8,9-тетрагидро-4Н-пиридо(1,2-а)пиримидин-3-карбоновую кисло ту, которая плавится при 224-226 С. Элементный анализ. Рассчитано, %s С 62,78, Н 6,28, N 15,81. Найдено, %: С 62,43, Н 6,07, N 15,32. П р и м е р 20. Исходя из 2,4,6триметиланилина, получают 6-метил9-(2,4,6-триметилфенилгидразоно)-4оксо-6,7,8,9-тетрагидро-4Н-пиридо(1,2-а)пиримидин-3-карбоновую кисло ту, т. пл. 195-197 С. Элементный анализ. Рассчитано, %: С 62,78;- Н 6,26, N 15,811 С Ы405 Найдено, %: С 63,29, Н 6,17, N 15,68. Пример21. Исходя из 3-амин пиридина, получают 6-метил-9г(3-пиридингидразоно)-4-оксо-6,,9-тетр агидро-4 Н-пиридо-(1,2-а) пириютдин -3-карбоновую кислоту, т. пл. 236237°С. Элементный анализ. Рассчитано, %: С 57,50, Н 4,82; N 22,35. , Найдено, %: С 57,81; Н 4,85 N 22,27. П р м е р 22. В смеси 15 мл ледя ной уксусной кислоты и 1,1 МП концентрированной серной кислоты растворяют 1,8 г (0,01 моль) 2,4-динитр анилина. Раствор охлаждают до 10-15 и при перемешивании по частям смеши вают с 0,7 г (0,01 моль) нитрита натрия. Соль диазония выделяют эфиром, декантируют и растворяют в 1015 мл ледяной воды. Далее работают по способу примера 12, но к стен н добавляют ацетат натрия. Сырой проду перёкристаллизовывают из ацетонитри ла. Получают 0,8 г (20,0%) 6-метил9-(2,4-динитрофенилгидразоно)-4-окс 6,7,8,9-тетрагидро-4Н-пиридо-(1,2-а пиримидин-3-карбоновой кислоты, т. п 257-258с. Элементный анализ. Рассчитано, %: С 47,88; Н 3,26, N 20,94. Найдено, %: С 47,74; Н 3,39/ N 20,66. Пример23. Раствор 1,9 г (0,01 моль) сульфаниловой кислоты, 0,8 г (0,01 моль) гидрокарбоната натрия и 0,7 г (0/01 моль) нитрита натрия в 10 мл воды при и перемешивании добавляют по каплям в 5 мл 1:1 разбавленного водного раствора соляной кислоты. Далее работают по описанному в примере 12 способу. Сырой продукт перекристаллизовывают из 75%-ного водного метанола. Получают 0,3 г (7,6%) 6-метил-4-оксо-9(П-сульфофенилгидразоно)-6,7,8,9тетрагидро-4Н-пиридо-(1,2-а)пирими-. дмн-З-карбоновой кислоты, т. пл. выше 290«С. Элементный анализ. Рассчитано, %: С 48,98, Н 4,11, N 14,28, S 8,17. C,6H 6N406S Найдено, %: С 49,11; Н 4,10, N 14,21, S 8,25. Пример 24. В суспензию 34,0 г (0,14 моль) 9-гидразойо-6метил-4-оксо-6,7,8,9-тетрагидро-4Япиридо-(1,2-а )пиримидин-3-карбоновой кислоты в 700 МП безводного этанола при 10-15 С и перемешивании вводят сухой хлористый водород. После насы-. щения раствора его оставляют стоять на ночь в холодильном шкафу. На следующий день растворитель отгоняют при пониженном Давлении. Остаток растворяют в 50 мл воды, раствор нейтрализуют 5%-ным водным содовым раствором и экстрагируют 4x100 мл хлороформа. Объединенные органические фазы.сушат над прокаленным сульфатом натрия и затем упаривают в вакууме. Остаток перекристаллизовывают из метанола. Получают 18,0 г (48,6 г) этилового . эфира 9-гидразоно-6-мет.ил-4-оксо6,7,8,9-тетрагидро-4Н-пиридино-(1,2-а пиримидин-3-карбоновой кислоты, т. пл. 199-200 С. Элементный анализ. Рассчитано, %: С 54,54; Н 6,1Ь; N 21,20. Hj.NjO Найдейо,-% С 53,88; Н 6,20 N. 21,10. .Пример 25. Суспензию 2,0 г (7,57 моль) этилового эфира 9-гиДразоно-6-метил-4-оксо-6,7,8,9-тетрагидро-4Н-пиридо-(1,2-а )пиримидин-3-карбоновой .кислоты и 20 мл этанола доводят до кипения и по каплям .смешивают с 4 мл 50%-ного водного раствора гидразинридрата. После 15-минутного кипения получают раствор, из которого при охлаждении начинают -выпадать кристаллы. Сырой продукт перткристаллиэовывают из метанола. Получают 1,0 кг (52,8%) 9-гилразоно6-метил-4-оксо-б,7,8,9-тетрагидро4Н-пиридо-(1,2-а ) пиримидин-3-карбогилразина, т. пл. 219-220 0.
Элементный анализ.
Рассчитано, %: С 47,99/ Н 5,64, N 33,58.
, . Найдено, %: С 48,43, Н 5,67;
N 23,59.
Пример 26. 10,0г (0,03 мол этилового эфира 9-(фенилгидразоно )6-метил-4-оксо-б,7,8,9-тетрагидро4Н-пиридо-(1,2-а )пиримидин-3-карбоновой кислоты при нагревании растворяют в 30 мл этанола. К раствору при перемешивании прикапывают 40 мл концентрированного водного раствора аммиака. Реакционную смесь оставляют стоять, на один день, затем отфильтровывают выпавшие кристаллы. Сырой продукт перекристаллизовывают из нитрометана. Получают 5,0 г (53,5% ) 9-(фенилгидразоно )-б-метил4-ОКСО-6,7,8,9-тетрагидро-4Н-оксо6,7,8,9-тетрагидро-4Н-пиридо-(1,2-а пиримидин-З- арбоновой кислоты, т. пл. 246-247 0.
Элементный анализ.Рассчитано, %: О 61,73/ Н 5,50, М 22,49.
Найдено, %: О 61,51/ Н 5,58
N 23,17.
Пример 27. К смеси 0,9 (0,01 моль) анилина и 5 мл 1:1 разбавленного водного раствора соляной кислоты при и перемешивании медленно прикапывают раствор 0;7 г (0,01 моль) нитрита натрия в 5 мл воды. Затем в реакционную смесь по частям вводят 6,0 г твердого ацетата натрия, затем при интенсивном перемешивании медленно по каплям добавляют раствор 2,5 г (9,01 ,моль ) этилового 9-Лормил-6-метил-4-оксо1,6,7,8-тетрагидро-4Н-пиридо-(1,2-а пиримидин 3-карбоновой кислоты в 20 мл ацетона.Реакционную смесь при 0-50 перемешивают в течение 3-4 ч и затем при пониженном давлении отгоняют ацетон..Оставшийся водный раствор встряхивают с 3x10 мл хлороформа. Объединенные органические фазы основательно .встряхивают с 30 мл воды. После отделения органическую фазу сумат над прокаленным сульфатом натрия и упаривают в вакууме. Остаток перекристаллизовывают из этанола и сушат в вакуумном сушильном шкафу при ЭО-ЮО С над фосфорным ангидридом. Получают 0,7 г (20,6%) этилового эфира 9-(фенилгидразоно)-6-метил-4-оксо6,7,8,9-тетрагидро-4Н-пиридо-(1,2-а пиримидин-3-карбоновой кислоты, который плавится при 138-139 0 и не
имеет отличия в температуре точки плавления от продуктов, полученных noi примеру 1.
Пример 28. Работают по описанному в npHMeipe 12 способу, но вместо анилина используют п-фенилэтадин. Получают 7,6 г (53,3%) 9-( этоксифенйлгидразоно)-6-метил4-оксо6,7,8,9-тетрагидро-4Н-пиридо(1,2-а ) пиримидин-3-карбоновой кислоты, которая плавится при 213-219 0.
Элементный анализ.
Рассчитано, %i С 60,67, Н 5,66; N 15,72.
Crt}.4a,N404
Найдено, %tC 60,52, Н 5,73; N 15,74. .
Пример 29, Работают по описанному в примере 1 способу, однако исходят из (-)- 6-метил-4-оксо-6,7,
8,9-тетрагидро-4Н-пиридо-(1,2-а )пиримидин-3-карбоновой кислоты1; 113,7, (с 2, метанол). Выход (- )-9-фенилгидразоно-6-метил-4-оксо6,7,8,9-тетрагидро-4Н-пиридо-(1,2-а )
пиримидцн-3-карбоновой кислоты равен 91%. Кислота плавится при 258-259 0. q(J -407,5(с 2, диметилформаМИй Г,.
Элементный анализ.
Рассчитано, % О 61,53; Н 5,16; N 18,94.
C-,H..N,j03
Найдено, %: О 61,48; Н 5,04; N 17,82.
Пример 30. Работают по описанному в примере 1 способу, однако исходят из (+)-6-метил-4-оксо-6,7,8, 9-тетрагидро-4Н-пиридд- (1,2-й )пиримидин-3-карбоновой кислоты,C«fj (с 2, метанол). Выход (+)-9фенйлгидразоно-6-метил-4-оксо-6,7,8, 9-тет гагидрог4Н-пиридо-(1,2-а )пиримидин-3-карбоновой кислоты равен 92,5%. Кислота плавится при 255-256 0. +407,5(с 2, диметилформамид Г.
Элементный анализ. Рассчитано, %i О 61,53, Н 5,16; N 17,94.
Ojl
Найдено, %| О 61,72, Н 5,22, N 18,01.
П р и м. е р 31.Работают по способу примера 1, однако в качестве исходного веадества используют 7-метил-4-оксо-6,7,8,9-тетрагидро-4Нпиридо-(1,2-а )пиримидин-3-карбоновую кислоту. Получают 9-фенилгидразоно7-метил-4-оксо-6,7,8,9-тeтpaгидpo4H-пиpидo-(l,2-a)п pимидин-3-кapбoновую кислоту, т, пл. 255-256 0. Элементный анализ. Рассчитано, %: О 61,53) Н 5,16; N 17,9.
Найдено, %s С 61,27, Н 5,17; N 17,78. П р и м е р ы 32-55 (общее описание). 0,03 моль приведенного в табл. 2 производного анилина растворяют в 14,4 МП 18%-ного раствора соляной кислоты. Раствор охлаждают до и-по каплям смачивают с раствором 2,1 г нитрита натрия в 15 мл воды. К реакционной смеси добавляют 18 г ацетата натрия. К полученному таким способом раствору диазония при температуре ниже по каплям добавляют смесь 0,03 моль 6-метил-4.оксо-б,7,8,9-тетрагидро-4Н-пиридо(1,2-а )пиримидин-3-карбоновой кислоты, 30 МП воды и 7 мл 10%-ного водного раствора едкого натра. Реакцион ную смесь при- O-SP С перемешивайт в течение 3 ч. Затем отфильтровывают выпавшие кристаллы, пробивают водой и перекристаллизовывают из приведенного н табл. 2 растворителя. Пример 56. 7,8 г (0,02 моль ,Э;ТИЛового эфира 9-Ленилгидразоно-бметил-4-оксо-6,7,8,9-тетрагидро-4Нпиридо-(1j2-a)пиримидин-3-карбонрвой кислоты растворяют в 100 мл этанола Раствор рмершвают с 6,0 мл 98%-ного гидразингидратаи затем два часа ки пятят с флегмой. При охлаждении начи :нают выпадать кристаллы, которые от фильтровывают и промывают этанолом. Получают 5,4 г (82,7%) 9-фенилгйдразоно-б-метил-4-оксо-б,7,8,9-тетрагид ро-4Н-пиридо-(1,2-а )пчримидин-3-карбогидразида, т. пл. 205-207 С. Элементный анализ. Рассчитано, %: С 58,89; Н 5,5б; N 25,75. Найдено, %: С С 58,06; Н 5,47; N 25,52. Пример 57. Но способу примера 12 получают 9-фенилгидразоно6-метил-4-оксо-б,7,8,9-тетрагидро4Н-пиридо-(1,2-а )пиримидин-3-карбоновую кислоту, в реакционную смесь добавляют ацетат натрия. Выход составляет 75%. Продукт плавится при 256-251°С и не имеет отличия в тем. пературе точки плавления от продукт полученного по примеру 12. Элементный анализ. Рассчитано, % С 61,53, Н 5,1б; N 17,94, Найдено, %: С 61,48, Н 5,01, N 17,80. Пример 58. Из анилина и этилового эфира 7-метил-4-оксо-б,7, 9-тетрагидро-4Н-пиридо-(1,2-а)пиримидин-3-карбоновой.кислоты по спосо бу примера 4 получают с 60%-ным выходом этиловый эфир 7-метил-Э-фенил гидразоно- 4-оксо-б ,7,8, Э-тетреоИдро 4Н-пиридо-(1,2-а )пирймидин-3-карбоновой кислоты, т. пл. 165-167 С. Элементный анализ. Рассчитано, % С 63,51; Н 5,92, N 16,45. Найдено, %: С 63,24: Н 5,80; N 16,35. . Пример 59, Из анилина и этиового эфира 8-метил-4-оксо-6,7,8, 9-тетрагидро-4Н-пиридо-(1,2-а )пириидин-3-карбоновой кислоты по способу примера 4 получают с 61,Б%-ным выходом этиловый эфир 8-мв.тил-9-фенилгидразоно-4-оксо-б ,7,8,9-тетрагидо-4Н-пиридо-(1,2-а)пиримидин-3-карбоновой кислоты, т. пл. 108-110 С. Элементный анализ. . Рассчитано, %; С 63,51) Н 5, N 16,45. Qfe4iuN40i Найдено, %: С 63,63; Н 6,01, N 16,5.2. Пример 60. Из анилина и npiiготовленного с диметилсульфоксидом раствора 2,6-димвтил-4-оксо-6,7,8,9тетрагидро-4Н-пиридо-(1,2-а )пиримидин-3-карбоноамида по описанному в примере, 4-способу получают с 49,2%ным выходом 9-фенилгидразсно-2,6- ; диметил-4-оксо-6,7,8,9-тетрагидоо4Н-пиридо(1,2-а)пиримидин-3-кар6сН f ксамид, т. пл. 235-237 С. Элементный анализ. . . Рассчитано, %: G 62,76, Н 5,89, N 21,52. . H - NffOa. Найдено, %: С 62,84; Н 5,77; N 21,51.... П р И м е р 61. К смеси 0,45 мл (0,005 моль) анилина и 2,5 мл смес 1:1 водной соляной кислоты медленно добавляют при раствор 0,3 г (0,005 моль), нитрита натрия в 2,5 мп . воды. К реакционной смеси добавляют вначале 3,0 г твердого ацетата натрия, а затем - растврр 1,2 г (0,005 моль) этил- 1б-;метил-4-с ксо6,7,8,9-тетрагидр6-4Н-пиридо-() пиримидин-3-ил -ацетата в мп воды при медленном введении в интенсивном перемешивании. Реакционную смесь пе- ремецшвают в течение-2-3 ч при-0-5.6 после чего оставляют на ночь в холо-V дильнике. Водную фазу декантируют, а вязкий остаток желтого цвета перекристаллизовывают из метанола, получая таким способом 0,5 г (25,9%) этил f 9-(фенилгидразон )-6-метш1-4-ойсо.6jJj8,9-TeTparHflpQ-.4H-nHpHj io-(lj,2-a пиримидин-3-ил}-аие1аха. Полученный продукт содержит моль-эквивалент крясталлизованного метанола. Т. пл, 100- 102° С. Элементн1лй анализ; Рассчитано, % С 62,16; Н 56,78, N 14,50. («jHj N OsCHiOH Найдено, %1 С 62,34, Н 6,69, N 14,73.
Пример 62, Проводят те же операции и в той же последовательности, что в примере 61, за тем исклю-. чением, что в качестве исходного вещества используют |1)б-метил-4-оксо6,7,8,9-тетрагидр6-4Н-пиридо-(1,2-а ) пиpимидин-3-илJ-yкcycнyю кислоту. Полученный неочищенный продукт разбаляют десятикратным количеством воды и поддерживают рН около 8 при помощи раствора гидрата окиси натрия, после чего подкисляют образовавшийся раствор до рН 3 соляной кислотой. Таким способом получают/ 9-(фенилгидразон)-б-метил-4-оксо-б,7,8,9-тетрагидро-4Н-пиридо-(1,2-а )пиримидиН-3и ij уксусную кислоту с выходом- 59,5%, т. пл. 1бр-162 с.
Элементный анализ.
Рассчитано, %: С 62,57; Н 5,56;
N .
(0з
Найдено, %J С 63,11; Н 5,49j N 16,98.
Пример 63. Проводят те же операции д той же последовательноети, что и в примере 61, за тем исключением,- что в качестве исходного материала используют 6 метил-6,7,8,9.т6тpaгидpo-4H-пнpидo- (1 j2-a )пиримидин-4-он. Таким, способом получают 9-(фенилгидразон)-6-метил-6,7,8,9, тетрагидро-4 Я-пиридо-(1,2-а)пиримиДИН-4-ОН с выходом 52,2%, т. пл. 163165С.
Элементйый анализ.
Рассчитано, %j С 67,15, Н 6,01, N 20,.88.
Q,rlVgN403
Найдено, %: С 66,92j Н 5,98; N 21,00.
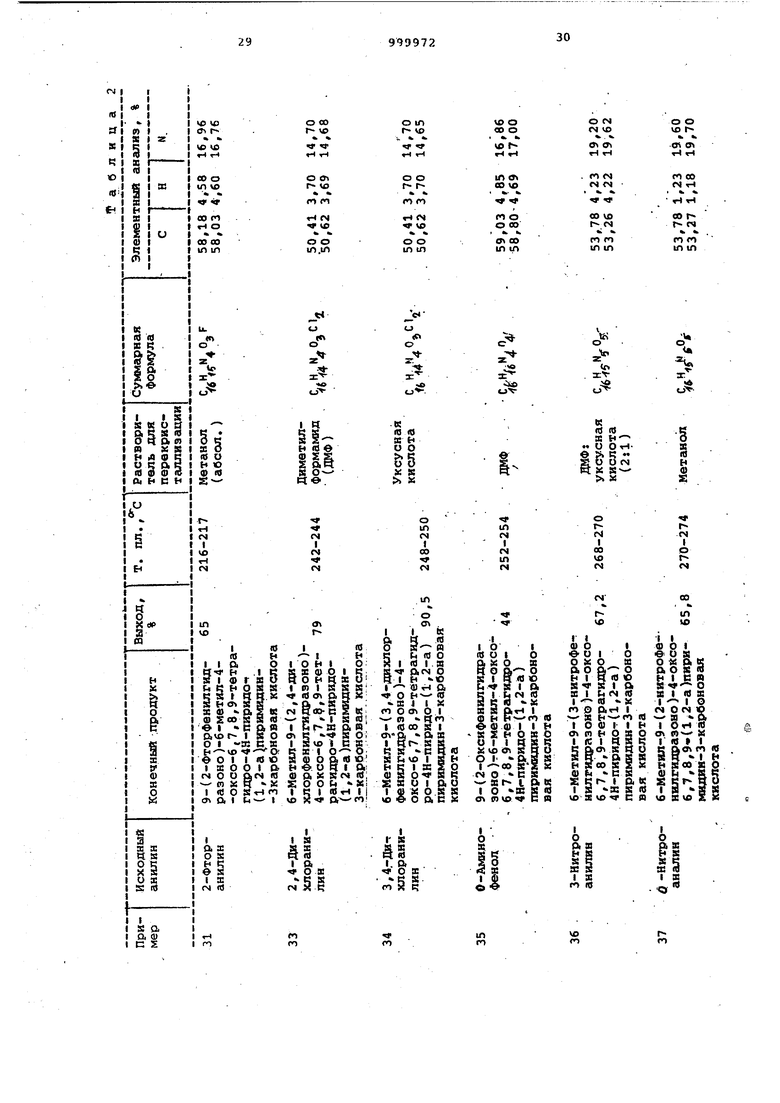
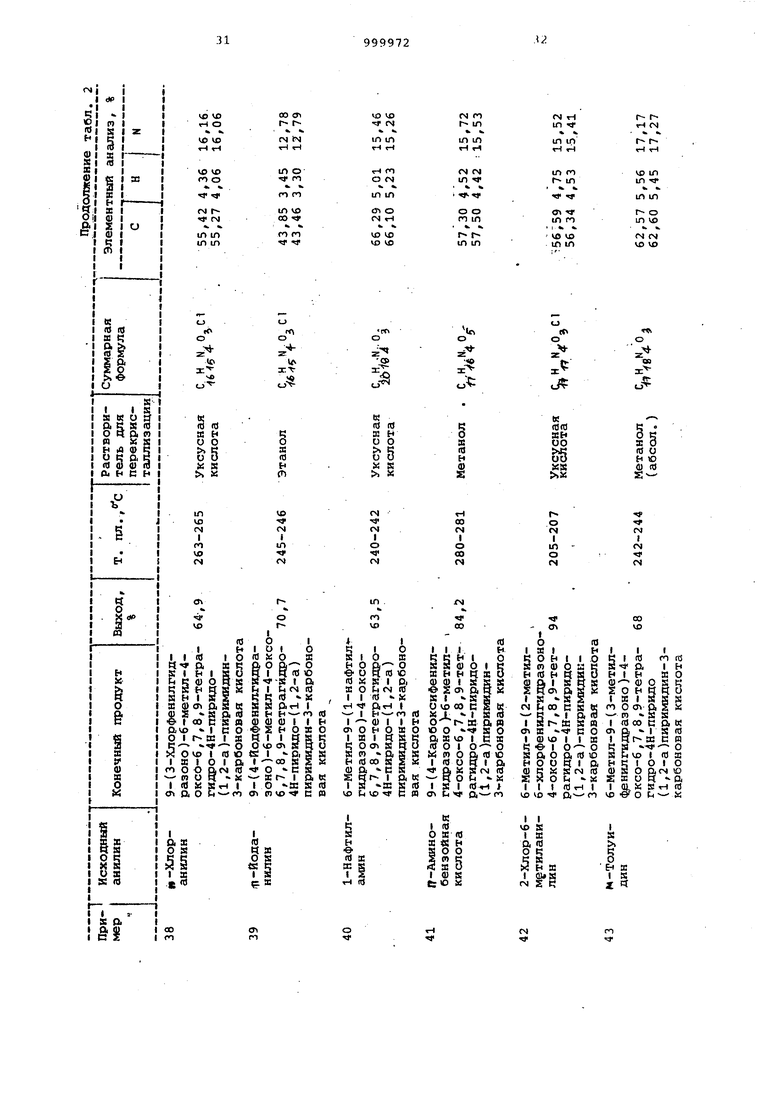
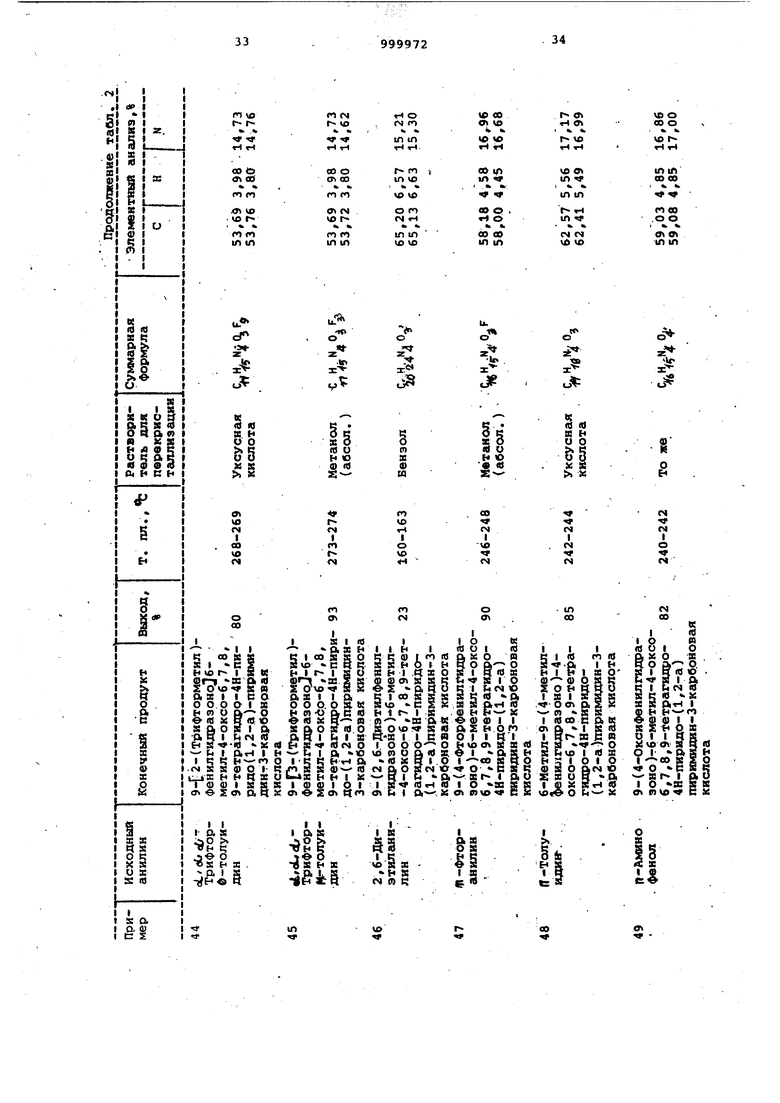
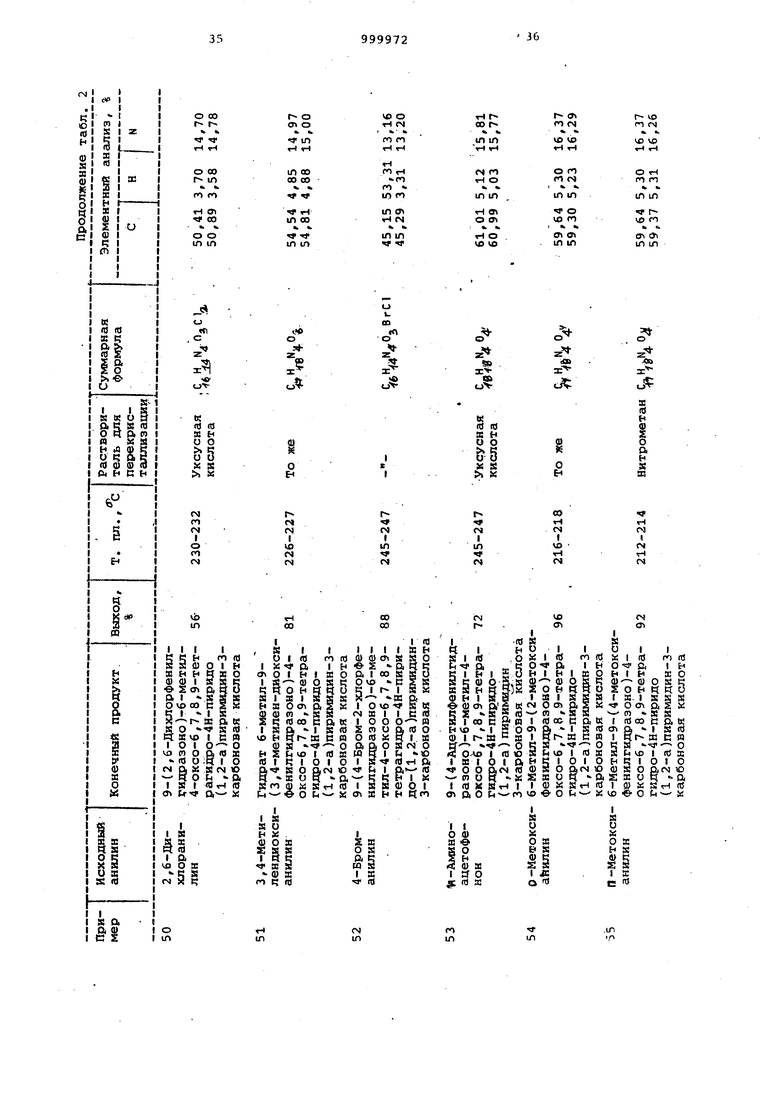
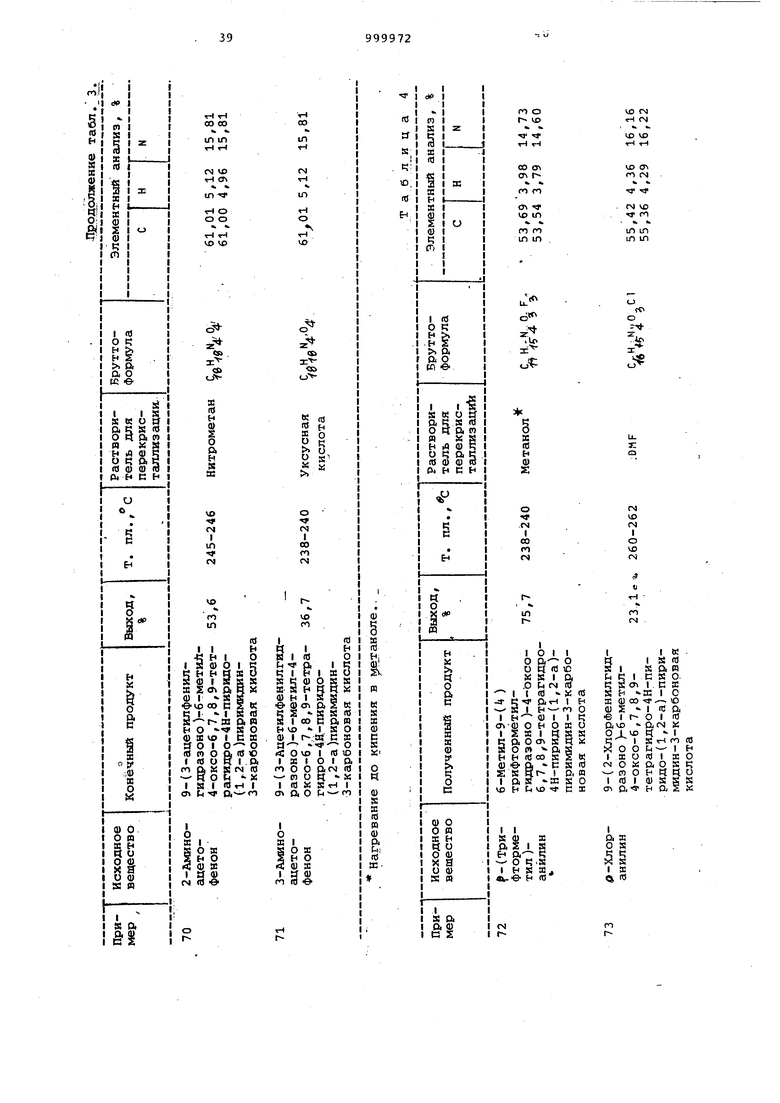
Примеры 64-71. Соединения общей формулы I, перечисленные в табл. 3, получают согласно способу, описанному в примерах 32-55.
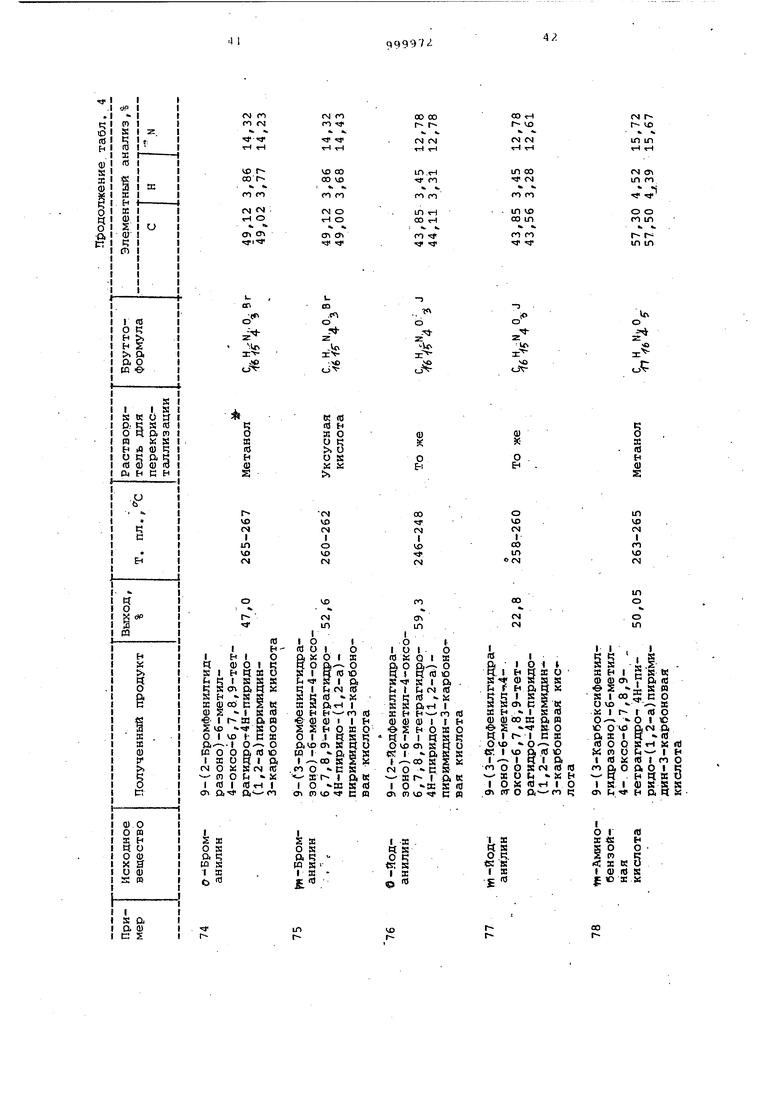
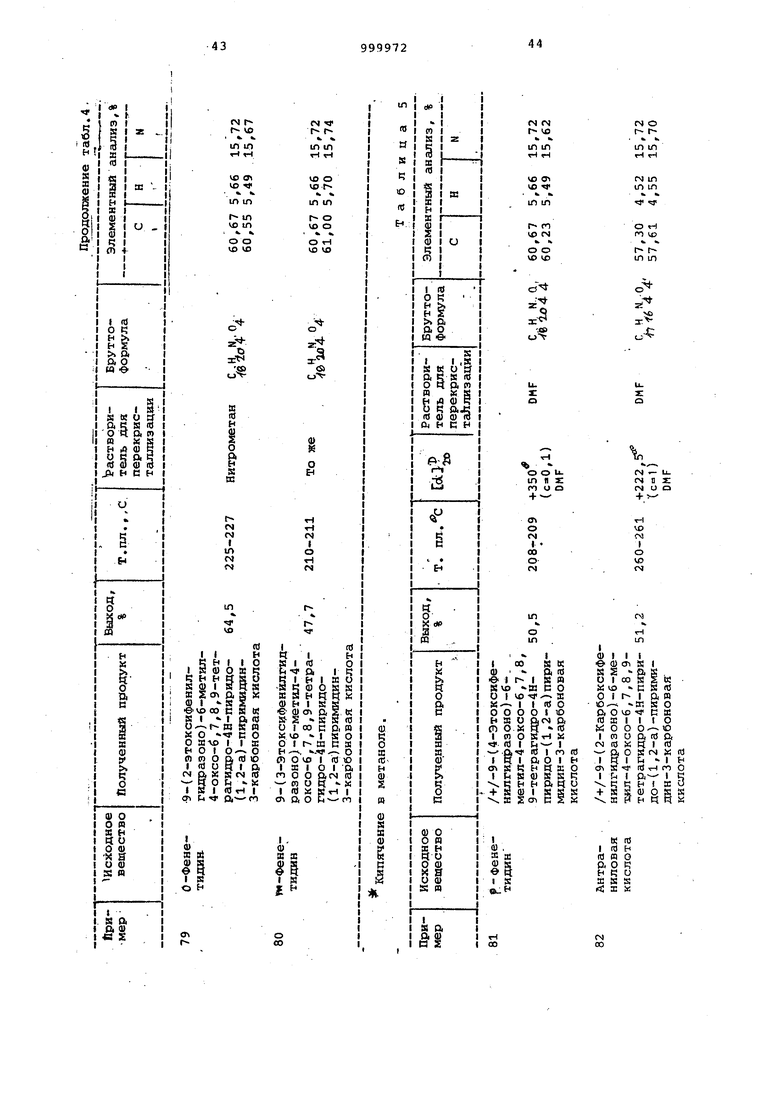
Примеры 72-84. Соединения, представленные в табл. 4 $ 5, получают как в примерах 32-35.
Пример 85. К 20 мл ацетона прибавляют 0,5 г 9-(фенилгидразино )6-метил-4-оксо-6,7,8,9-тетрагидро4Н-пиридо-(1,2-а )-пиримидин-3-карбо гидразида. Реакционную смесь кипятят в течение 3 ч при энергичном 1 перемемивании. После этого смесь охлаждают , осадившиеся кристаллы отфильтровывают ,и промывают ацетоном. Полу чают 0,35 г N -изoпpoпилидeн-9-(фeнилгидразоно )-6-метил-4-оксо-6,7,8, 9-тетрагидро-4Н-пиридо-{1,2-а )-пиримилин-8-карбогидразида, плавящегося при 293-295С после перекристаллизации из смеси хлороформа и этанола.
Элементный анализ..
Рассгитано, %: С 62,29/ Н 6,05; N 22,93.
62,29,Н 6,14,N 23,10. 65
Найдено
Пример86. К смеси, состоящей из 0,9 г (0,01 моль) анилина и 5 мл 1:1 раствора соляной кислоты в воде, прибавляют по каплям раствор 0,7 г (0,01 моль) нитрита натрия в 5 МПВОДЫ при перемешивании. После этого к реакционной смеси небольшими порциями прибавляют 6,0 г твердого ацетата натрия, ПОСЛЕ чего по каплям прибавляют раствор 2,5 г (0,01 моль) метилового эфира 9-формил-6-метил-4-оксо-1,6,7,8-тетрагидро-4Н-пиридо-(1,2-а )-пиримилин-3карбоновой кислоты.в 20 мл метанола при энергичном Т1ереме1швании. Реакционную смесь перемешивают 3-4 ч при , после чего прибавляют 20 мл воДы. Кристаллы отфильтровывают , промывают водой и сушат. При этом получают 2,5 г (76,7%) метилового эфира 9-(фенилгидраэоно)-6-меТИЛ-4-ОКСО-6,7,8,9-тетрагидрб-4Н-пиридо-(1,2-а )-пиримидин-3-карбоновой кислоты, т. пл. 122-123С после перекристаллизации из смеси этилацетата и диэтилрвого эфира.
Элементный анализ.
Рассчитано, %: С 62,57j Н 5,56/ N 17.17.
Найдено, %: С 62,75, Н 5,47,N 17,26.
..V
Пример 87. При проведении опыта по примеру 86, но с заменой метанольного раствора метилового эфи ра 9-формил-6-метил-4-оксо-1,6,7,3 тетрагидро-4Н-пиридо-(1,2-а )-пиримидин-3-карбоновой кислоты раствором 9-формил-6-метил-4-окср-1,6,7; 8ттетрагидро-4Н-пиридо-(1,2-а )-пирймидин3-карбонитрила в диметилсульфоксиде получают 3,0 г (96,0%) 9-(фенилгидразоно -6-метил-4-оксо.-6 ,7 ,8,9-тетрагидро-4Н-пиридо-(1,2-а )-пиримидин3-карбонитрила, т. пл. 223-224 0 (после перекристаллизации из ацетонитрила). Продукт не снижает своей точки плавления при смещении с продуктом примера 32.
Пример 88. При повторении опыта, описанного в примере 86, но с заменой метанольного раствора метилового эфира 9-формил-6-метил-4-оксо1,6,7,8-тетрагидро-4Н-пиридо-{1,2-а пиримидин-3-карбоновой кислоты раствором этилового эфира 1 9-формил-6метил-4-OKCO-l,6,7,8-тетрагидро-4Нпиридо- (1,2-а )-пиримидин-3-йл.З-уксусной. кислоты в ацетоне получают 3,5 г (90,5%) этилового эфира 9-(Ленилгилразоно ) 6-метил-4-о {со-6 ,7,8,9-тетрагидро-4Н-пиридо-(1,2-а )-пиримилинЗ-ил -уксусной кислоты, т. пл. (после перекристаллизации из метанола). Продукт не снижает своей точки плавления при смешении с продуктом из примера 61. Пример 89. При проведении .опыта, описанного в примере 86, но с заменой метанольного раствора метилового эфира 9-формил-6-метил-4оксо-1,6,7,8-тетрагилро-4Н-пиридо(1,2-а)гпиримидин-3-карбоновой кисл ты метанольным раствором 9-формил3,6-диметил-1,6,7,8-тетрагидро-4Нпиридо-(1,2-а)-пиримилин-4-она, получают 2,54 г (90%) 9-.(енилгидразо но)-3,6-диметил-6,7,8,9-тетрагидро4Н-пиридо-{1,2-а )-пиримидин 4она, плавящегося при после перекри таллизации из метанола. Элементный анализ. Рассчитано, С 68,06, Н 6,43; N 19,84. Найдено, %: С 67,64; Н 6, N 19,67. П р и м е р 90. При проведении опыта, описанного в примере 86, но с заменой метанольного раствора ме тилового эфира 9-формил-6-метил-4оксо-1,6,7,8-тетрагидро-4Н-пиридо(lj,2-a )-пиримидин-3-карбоновой кисл ты раствором этилового эфира (9-фор ийл-7-мётил-4-6ксо-1,6,7,8-тетраги ро-4Н-пиридо-(1,2-а )-пиримидин-3-и уксусной кислоты в смеси 1:1 ацето и метанола, получают 2,26 г (67,3% этилового эфира 9-(фенилгидразоно 7-метил-4-оксо-6,7,8,9-тетрагидро4Н-пиридо-(1,2-а)-пиримидин-3-илЗуксусной кислоты, плавящегося при после перекристаллизации из метанола. Элементный анализ,. Рассчитано, %: С 64,39f Н б,26; N 15,81. С,9 2г«40э . Найдено, %: С 63,99; Н 6,37, N 15,62. Пример 91. При повторении опыта, описанного в примере 86, но с заменой метанольного раст.вора метилового эфира 9-формил-6-метил-4оксо-1,6,7,8-тетрагидро-4Н-пиридо(1,2--а )-пиримидин-3-карбоновой кислоты раствором 3-фенил-9-формил-6метил-1,6,7,8-тетрагидро-4Н-пиридо(1,2-а )-пиримидин-4-она в диметилсульфоксиде получают 1,65 (96,0%) З-фенил-9-(фенилгидразоно )-6-метил6,7,8,9-тетрагидро-4Н-пиридо-(1 2пиримидин-4-она, т. пл. 146-148 С (после перекристаллизации из этилаи тата). Элементный анализ. Рассчитано, С 73,23; Н 5,85, N 16,27. , . Найдено, %: С 72,97/ Н 5,70; N 16,03. Пример92. При повторении та, описанного в примере. 86, но с меной eтaнoльнoгo. раствора метияо го эфира 9-формил-6-метил-4-оксо-1,6, 7-8-тетрагидро-4Н-пиридо-(1,2-а )-пиримидин-3-карбоновой кислоты раство- ром 3 ,9-диФормил-2 ,6-диметил-1 ,-6 ,7 , . 8-тетрагидро-4Н-пиридо-(1,2-а )-пиримидин-4-она в диметилсульфоксиде получают 2,67 г (86,2%) 9-(фенилгидразоно )-3- формил-2 ,6-диметил-6,7,8,9тетрагилро-4Н-пиридо-(1,2-а )-пиримидин-4-она, т. пл. 197С (после пере-, кристаллизации из ацетонитрила). Элементный анализ. Рассчитано, % С 65,79, Н 5,85, N 18,05 (,H«N40, Найдено, %« С 65,70;Н 5,90; N 18,02. Пример 93. При повторении; опыта, описанного в примере 86, но с заменой метанольного раствора метилового эфира 9-формил-6-метил-4-оксо-1,6,7,8-тетрагидро-4Н-пиридо(1,2-а )-пиримидин-3-карбоновой кислоты раствором 3,9-диЛормил-6-метил1,6,7,8-тетрагидро-4Н-пиридо-(1,2-а)пиримидин-4-она в диметилсульфоксиде получают 3,05 г (97,0% ) 9-(фенилгидразоно )-3-формил-6-метил-6 ,7,8,9тетрагидро-4Н-пиридо-(1,2-а )-пиримидин-4-она, т. пл. 166-1б7 с (после перекристаллизации из ацетонйтрида). Элементный анализ-. Рассчитано, %: С 61,15, Н. , N 17,82. (.бЧ Найдено, %: С 61,22, Н 5,53, N 17,80. Пример 94. При повторении опыта, опис анного в примере 86, но с заменой метанольного раствора метилового эфира 9-формил-6-метил-4-оксо-1,6,7,8-тетрагидро-4Н-пиридо(1,2-а )-пиримидин-3-карбоновой кислоты раствором 9-формил-6-метил-1,6,7, 8-тетрагидро-4Н-пиридо-(1,2-а)-пиримидин-4-она в метаноле получают 2,26 г (84,3%) 9-(фенилгидразоно)-б-метил-1,6,7,8-тетрагидро-4Н-пиридо-(1,2-а )-пиримидин-4-она, т. пл. 163-165 С tпосле перекристаллизации из мвтанола).Продукт не снижает точки плавления при смешении с продуктом примера 63. Пример 95. При повторении опыта, описанного в примере .86, но с заменой метанольного раствора метилового эфира 9-формил-6-метил-4оксо-1,6,7,8-тетрагидро-4Н-пиридо(1,2-а )-пиримидин-3-карбоновой кислоты метанольным раствором этилового эфира 9-формил-6-метил-4-оксо-1,6,, 7,8-гтетрагидро-4Н-пиридо- (1,2-а )-пиримидин-3-илЗ-пропионовой кислоты аолучают 2,2 г (59,8%) этилового эфира - (фенилгидразоно )-6-метил-4-оксо6,7,8,9-тетрагидро-4Н-пиридо-(1,2-а)пиримидин-З-ил -пропионовой кислоты, плавящегося при 102с после перекрис таллизации Из метанола.
Элементный анализ.
Рассчитано, %: С 65,27; Н 6,5; N 15,21.
Найдено, %: С 65,25, Н 6,70, N 14,98%.
Пример 96, При повторении опыта, описанйого в примере 86, но с заменой метанольного раствора метилового эфира 9-формил-6-метил-4оксо-1,6,7,8-тетрагилро-4Н-пиридо(1,2-а)-пиримидин-3-кар6оновой кислоты раствором 9-формил-6-метил-4-оксо1,6,7,8-тетрагидро-4Н-пиридо-(1,2-а) пиримидин-3-карбоновой кислоты в диметилсульфоксиде получают 2,86 г (91,6% ) 9-(фенилгидразоно )-б-метил4-оксо-6,.7,8,9-тетрагидро-4Н-пиридо(1,2-а )-пиримидин-3-карбоновой кислоты, т. пл. 267-268 С (после перекристаллизации из диметилформамида ). npo дукт не снижает точки плавления при смешении с продуктом примера 12.
Пример 97. К раствору 2,15 (0,036 моль) гидрата окиси калия в 50 мл воды прибавляют 4,Э г (0,012 моль) этилового эфира (9-фенилгидразоно )-6-метил-4-оксо-6,7,8, 9-тетрагидро-4Н-пиридо-(1,2-а)-пиримидин-3-илЗ-уксусной кислоты. Полу.ченную смесь перемешивают при комнат ной температуре в течение 4ч.Величину рН раствора устанавливают равную 3 при помощи 10%-ного по весу раство ра соляной кислоты. Осадившиеся кри сталлы отфильтровывают и промывают водой. Получают 2,95 г (75,6%) f9(фенилгидразоно )-6-метил-4-оксо6,7,8,9-тетрагида)о-4Н-пиридо-(1,2-а) пиримидин-3-илJ-уксусной кислоты, т. пл. 161-162 #С. Продукт не снижа ет своей точки плавления при смешеНИИ с продуктом примера 62,
Пример 98. При повторении опыта, описанного в примере 62, но ,с зё1меной 6-метил-4-оксо-6,7,8,9тетрагидро-4Н-пиридо- (1,2-а )-пирими.дин-карбоновой кислоты 8-метил-4оксо-6.7,8 у 9-тетрагидро-4Н-пиридо(1,2-а)-пиримидин-3-карбоновой кислотой получают 9-(фенилгидразоно)-8метил-4-оксо-б,7,8,9-тетрагидро-4Нпиридо-(1,2-а )-пиримидин-3-карбоновую кислоту, т, пл. 23f4-236C (после перекристаллизации из ацетонитрила). Выход составляет 52,1%.
Элементный анализ.
Рассчитано,%: С 61,53, Н 5,16, N 17,94.
С кЧгвМ40 Найдено, %: С 61,48; Н 5,1,;
N 18,03%.
Пример 99, При повторении опыта,описанного в примере 12, но с заменой анилина пара-нитроанилином пгалучают 6-метш1-9-(4-нитрофенилгидразоно )-4-оксо-6,7,8,9-твтрагидро4-Н-пиридо-(1,2-а )-пиримидин-3-карбО новую кислоту, т. пл. 242-244°С. Выход составляет 55,5%.
Элементный анализ.
Рассчитано, % С 53,78, Н 4,23. N 19,60.
C AgN OsНайденб, %j С 53-,25; Н 3,94} N 19,40.
, Пример 100. При повторении опыта, описанного в примере 12, но с заменой анилина 2-амино-4-хлорбензойной кислотой получают моногидрат 9-2-карбокси-5Хлорбензилгидразоно )6-метил-4-оксо-6;7,8,9-тетрагидро4Н-пиридо-(1,)-пиримидин-3-карбоновой кислоты. Выход составляет 61,2 Т. пл. 275-276 С.
Элементный анализ...
Рассчитано, %: С 49,85; Н 4,191 N 13,71/ С1 8,76.
С-Ч, HQ.O
Найдено, %1 С 50,65; Н 4,22, N 13,64; С1 9,03.
П р и и е р 101. При повторении опыта, о/тисанного в примере 1, но с заменой этилового эфира 6-метил4-ОКСО-6,7,8,9-тетрагидро-4Н-пиридо(1,2-а )-пиримидин-3-карбоновой кис|Лоты 6-метш1-4-оксо-6,7,8,9-тетра 21ДРО-4Н-пиридо-(1,2-а)-пиримидинЗ-(Ы-метилкарбоксамидом) с перекристаллизацией сырого продукта из ацето нитрила, получают 9-(фенилгидразоно 6-метил-4-оксо-6,7,8,9-тетрагидро4Н-пиридо- (1,2-а )-пиримидин-3- (Nметилкарбоксамид), т. пл. 153-154 с. Продукт представляет собой смесь оптических изомеров -Е. Выход составляет 53,1%.
Элементный анализ.
Рассчитано, %: С 62,76 Н 5,89, N 21,62.
Найдено,%: С 62,43, Н 5,81, N 21,23.
Пример 102. При повторении опыта, описанного в примере 6, но с заменой анилина антраниловой кислотой и с очисткой сырого продукта щелочным (кислотным) осаждением получают 2 б-метил-4-оксо-6,7,8,9-тетрагидро-4Н-пиридо-(1,2-а )-пиримидин-9илиденгидрдзоноЗ бензойную кислоту, т. пл. 170-172 С. Выход состёвляет 64,8%.
Элементный анализ.
Рассчитано, %: С 61,53, Н 5,16, N 17,94.
Найдено, %: С 64,40/ Н 5,00;
N 17,91.
Пример 103. При повторении опыта, описанного в примере 63, но с заменой анилина 3-аминобензойной кислоты и с очисткой сырого продукта щелочным (кислотным) осаждением,
получают 3- 6-метип-4-оксо-б ,7 ,8,9 )тетрагидро-4Н-пиридо-(1,2-а )-ftиpи « дин- З-илиденгидраэоно -бенэойнуюкислоту, т, пл. 260-2б2с. Внход оставляет 57,6%,
Элементный анализ.
Рассчитано, % С 61,53, Н 5,16; N 17,94.
Cji VN- 0л
Найдвно, %| С
61,,37} Н 5,11; М 17, 77.
Пример 104. 0,93 г анилина растворяют в10 мл 15%-ного (вес/объем ) раствора;соляной кислоты. Реакци оннуюсмесь охлаждают до температуры С. После этого в реакционную смесь вводят раствор 0,7 г нитрита натрия в 5 мл воды, после чего по каплям прибавляют раствор З-этил2,6-диметил-4-оксо-б,7,8,9-тетрагйдро-4Н-пиридо-{1,2-а)-пиримидина в смеси из 20 мл воды и 10 мп этанола при температуре ниже . Реакционную смесь декантируют для отделения от маслянистых-капель и фазу масла кристаллизуют из водного метанола для получения 0,8-Г (25,8%) желтого продукта. Осажденные кристаллы отфильтровывают и промзвают водой. Объединенный продукт перекристаллизовывают из этиладетата для получения 3-этил-9-фенил-2,6-димет1|л-47 оксо-6,7,8,9-тетрагидро-4Н-пиридо (1г2-а)-пиримидина, т. пл.,135-137 С Продукт представляет собой смесь геометрических изомеров.
элементный анализ.
Рассчитано, % С 69,65; Н 7,14; N 18,05.
e%vo
Найдено, % С 69,34; Н 7,06 И 17,93.
Пример 105. Работают по описанному в примере 6 способу, но вместо водного раствора этилового
эфира 6-метил-4-оксо-6,7,8,9-тетрагилро-4Н-пиридо-(1,2-а)пнримидин3-гкарбоновой кислоты используют приготовленный с ацетоном раствор б-метил-4-оксо-6,7,8,9-тетраг.идро4Н-пиридо-(1,2-а)пиримидин-3-карбонитрида. Получают гидрат 9-(фенилгидразоно)-6-метил-4-оксо-6,7,8,9тетрагидро -4Н-пиридо-(1,2-а )-пиримидин-3-карбонитрида, т. пл. 2230 .
Элементный анализ.
Рассчитано, %« С 61,73/ Н 5,50, N 22,49.
g i N-gO-Hid
5 Найдено, %: С 61,40; Н 5,32, N 22,76.
Пример 106. К раствору 2,0 г (7,57 ммоль) этилового эфира 9-гидразоно-6-метил-4«оксо-6,7,8,90 тетрагидро-4Н-пиридо-(1,2-а )пиримидин-3-карбоновой кислоты в 20 мл безводного.хлороформа добавляют 1,6 мл (11,35 ммоль) триэтиламина и 1,3 мл (11,35 ммоль) бензоХлорида.
5 Смесь К1;пятят в течение 2ч, затем охлаждают до комнатной температуры и основательно встряхивают с 20 мл воды. Органическую фазу отделяют, водную фазу экстрагируют 10 мл хлороформа. Объединенные органические фазы cytuaT над прокаленным сульфатом натрия и затем упаривают в вакууме. Остаток перекристаллизовыва1чт из метанола. Получают 1,5 г (53,8%) этияового эфира 9-(бенэбилгидразоно)-6лютия- рксо-6.,7,8,9-тетрагидро-4Нтшркпб- (i, )пиримидин-3-карбо11 свой кислоты, т. пл. 209-210 0. Элементный анализ. Рассчитано, %t С 61,96 Н 5,47/
0 N 15,20.
Найдеяо Г С 62,02, Н 5,58 N 15,61.
о
;
о















| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения производных пиридо (1,2-а) пиримидина или их фармацевтически приемлемых солей или их оптически активных изомеров | 1978 |
|
SU999973A3 |
| Способ получения производных пиридо /1,2-а/ пиримидина или их оптических изомеров, или их гидратов, или их солей | 1980 |
|
SU980622A3 |
| Способ получения геминальных дигалоидных производных конденсированных пиримидин-4-онов,рацематов или оптически активных антиподов | 1980 |
|
SU1151210A3 |
| Способ получения 9-формилпроизводных пиридо @ 1,2- @ пиримидина или их оптически активных антиподов | 1982 |
|
SU1245260A3 |
| Способ получения производных пиридо/1,2-а/пиримидинов или их солей,или их оптически активных изомеров | 1978 |
|
SU906379A3 |
| Способ получения конденсированных пиримидинов или их солей,или их оптических изомеров | 1977 |
|
SU969165A3 |
| Способ получения производных пиридо(1,2-а)-пиримидина или их солей | 1974 |
|
SU566524A3 |
| Способ получения конденсированных производных пиримидина или их солей | 1980 |
|
SU1082324A3 |
| Способ получения производных пиридо/1,2-а/пиримидина или их солей с щелочными металлами или их оптических изомеров | 1980 |
|
SU1024007A3 |
| Способ получения конденсированных производных пиримидина или их солей | 1978 |
|
SU999974A3 |

см
Г4
I
о es
N 00
r м
r-l -l
Ю о
tn r-l r 1Л
tn M
о о
fS fM
rH T-)
oo «aVO r
«t Tt (N
r О
n VO
CO rO kO
tn r
о oo
о о
ГМ тН 1Л Ю
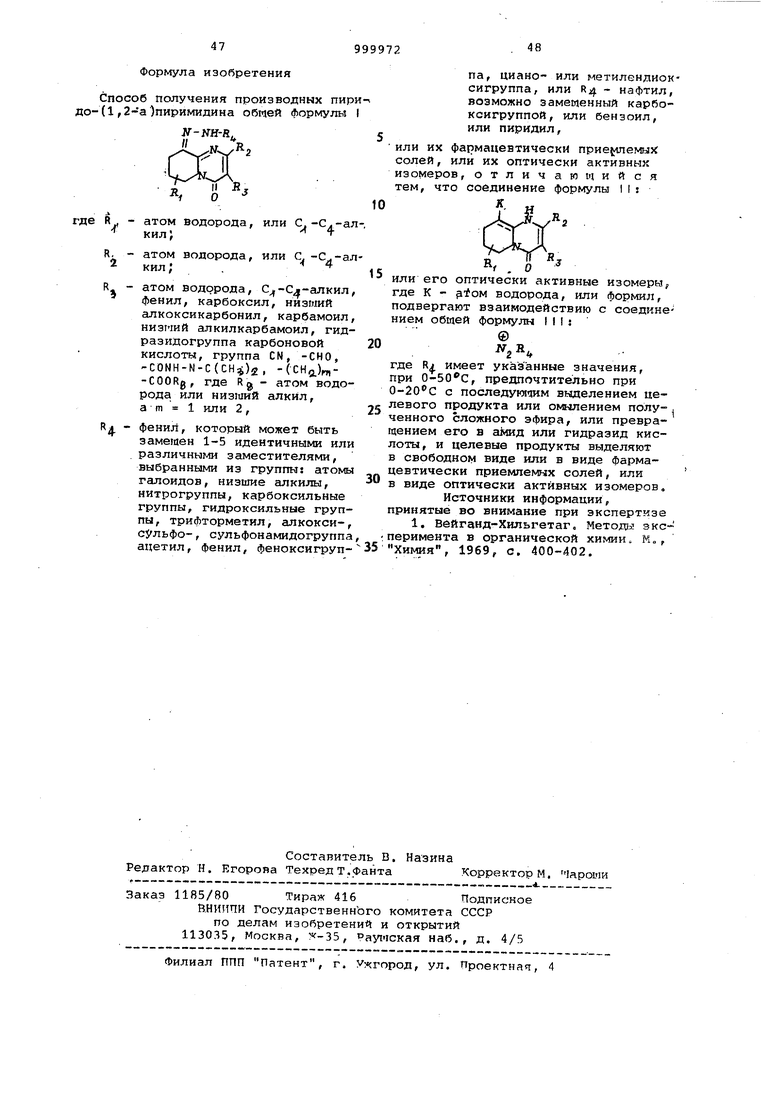
VC VO VO VO O VD Формула изобретения Способ получения производных пир до-(1,2-а )пиримидина общей формулы N-NH-R где Л - атом водорода, или С.-С.-ал кил; R. - атом водорода, или С. i кил; . R - атом водорода, С -С -алкил фенил, карбоксил, низший алкоксикарбонил, карбамоил низмий алкилкарбамоил, гидразиДогруппа карбоновой кислоты, группа CN, -СНО, -СОМН-М-С(СНч;)2, -(СНд,),-COORg, где Rg - атом водорода или низший алкил, а m 1 или 2, RA - фенил, который может быть замещен 1-5 идентичными или различными заместителями, выбранными из группы: атомы галоидов, низшие алкилы, нитрогруппы, карбоксильные группы, гидроксильные группы, трифторметил, алкоксисУльфо-, сульфонамидогруппа ацетил, фенил, феноксигруппа, циано- или метилендиоксигруппа, или R нафтил, возможно замеменный карбоксигруппой, или бензоил, или пиридил, или их фармацевтически прие{.шемых солей, или их оптически активных изомеров, отличающийся тем, что соединение формулы Ms f R, о или его оптически активные изомеры где К - -toM водорода, или формил, подвергают взаимодействию с соединением общей формулы III: где R имеет указанные значения, при , предпочтительно при О-2 О с с последукягдам выделением целевого продукта или омылением полу- . ченного сложного эфира, или превращением его в амид или гидразид кислоты, и целевые продукты выделяют в свободном виде или в виде фармацевтически приемлемых солей, или в виде оптически активных изомеров, Источники информации, принятые во внимание при экспертизе 1. Вейганд-Хильгетаго Методы зксперимента в органической химии К„, Химия, 1969, с. 400-402,
Авторы
Даты
1983-02-23—Публикация
1978-12-28—Подача