где R и R имеют указанные выше значения; L - атом галогена или гидрок сильная группа, подвергают взаимодействию с соединением общей формулJзl т 4 R и R имеют указанные значени преимущественно в присутствии связывающего кислоту средства в среде инертного органического растворителя при температуре от комнатной до температуры кипения реакционной смеси, с последующим выделением целевого продукта, или, в случае необходимости, полученное соединение формулы I, в которой пунктирная линия не означй ет валентную связь, окисляют в соеди нение формулы I, в котором пунктирная линия означает двойную связь, или подвергают декарбоксилированию для получения соединения формулы 1, 1где R - водород, или подвергают гид ролиЗУ для получения соединения формулы I, где R - карбоксильная групЦелевые продукты выделяют в виде основания или соли, или оптически ак тивных изомеров. Соединение общей формулы J с физиологически совместными неорганическими и органическими кислотами образуют соли, например гидрохлориды, гидробромиды, гидродиоды, сульфаты, нитраты, фосфаты малеинаты, сукцинаты, ацетаты, тартраты, лактаты, фумараты, цитраты и т. д. Соединения общей формулы J, - содержащие карбоксильные группы, образуют соли с физиологически совместимыми основаниями. К примеру, могли бы быть названы соли щелочных металлов, как соли натрия калия, сЬли щелочноземельных металлов например соли каль ция и магния, соли аммония, соли, образованные с органическими аминами, как трйэтиламинные и этаноламинные сопи. Изобретение распространяется такж на оптические и геометрические изоме ры и таутомеры соединений общей йюрмулы I. Структура геометрических изо 90 4 Меров становится очевидной с помощью формул 1А и 1В ) Таутомерное равновесие изображается с помощью схемы А Лг) VY о Превращение согласно предложенному способу выполняется преимущественно в присутствии связывающего кислоту средства. В качестве таких средств принимаются во внимание преимущественно карбонаты щелочных металлов (например, карбонат натрия или калия). гидрокарбонаты щелочных металлов (например, гидрокарбонат натрия или калия) , соли щелочных металлов слабых органических кислот (например, ацетат, натрия) или избыток амина общей формулы IIJ. Реакция проводится в присутствии инертного растворителя. В качестве реакционной среды применяются преимущественно ароматические углеводороды (например, бензол, толуол, ксилол), эфиры (например, этилацетат). спирты, (например, метанол, этанол), или диметияформамид. При реакции, как может предполагаться, в качестве промежуточного проДУХта получается соединение общей формулы R 4NR N.-4 у где пунктирная линия имеют луказанные значения. Это соединение можно выделить, но -можно .также перерабатывать дальше бей промежуточного выделения, т.е. окислять. Предпочтительно реакционная смесь, содержа1чая п(х межуточное соединение , подвергается воздействию
кислорода воздуха, причем наступает окисление.
Если применяются исходные вещества, где Ij является гидроксильной rpynnovi, .то реакцию можно проводить в присутствии водоотнимающего средства, нйпример дициклогексилкарбодиимида.
Соединения общей формулы I, полученные по предложенному способу, могут выделяться из реакционной смеси известным образом. Во многих случаях получают соль или гидрат соединения общей формулы 1, которое отфильтровывается или центрифугируется. Если работают в водной среде, то могут конечный продукт встряхивать с пригодным органическим растворителем и выделять путем упаривания органического экстракта. Если работают в среде органического растворителя, то соединение общей формулы I могут получать путем удаления органического растворителя. Полученный продукт можно очищать путем перекристаллизации или хроматографии.
Получать соединения общей формулы I можно путем одного или нескольких известных превращений переводить в другие соединения формулы I. Последующее превращение группы предпринимается известным образом при условиях реакции обычным для реакций этого типа.
Производное, содержащее карбоксиль ную группу, путем нагрева может декарбоксилироваться, причем возникает соответствующее соединение, содержащее вместо карбоксильной группы водород. Декарбоксилирование предпринимается преимущественно в присутствии кислоты, например фосфорной.
Эфирыобщей формулы 1 могут путем обработки кислотами или основанияг и гидролизоваться в соответствующие карбоновые кислоты общей формулы 1.
Щелочной гидролиз проводится путем нагрева со Ь4елочью в водной или спиртовой среде; из образующихся солей щелочных металлов путем подкисления могут высвобождаться кислоты. При гидролизе минеральными кислотами получается непосредственно свободная карбоновая кислота.
Полученное соединение общей формулы I известным образом момно выделить из своей образованной с кислотой ли основанием соли. Соединения обГ- Ь ей формулы 1, располагающие основ ым характером, взаимодействуя с неорганическими или органическими кислотами, могут превращаться в соли. Солеобразование следует известным образом в инертном растворителе с использованием кислоты в эквивалентном количестве или в избытке.
Соединения общей формулы I, содержащие кислотные группы (карбоксильные) , могут взаимодействовать с основаниями, например, гидроксидами щелочных метьллов, гидроксидами щелочноземельных металлов, органическими аминами, причем получают образованные с основаниями соли.
Соединения общей формулы I, содержащие в качестве R другие заместители, чем водород, располагают центром асимметрии и могут находиться в форме рацематов или оптически активных антиподов. Оптически активные антиподы этих соединений общей формулы 1 можно получать используя оптически активные исходные вещества общих формул и или имеющееся в качестве рацемата соединение общей формулы I разделяют на его оптические антиподы. Рацематное разделение можно производить известным образом, например рацемат вводят в реакцию с пригодным оптически активным основанием например, с оптически активным трео-1 -(п-нитрофенил)-2-а 1Нопропан-1,3-ДИОЛом), образующуюся диастереомерную солевую пару разделяют на основании различных физических свойств обеих солей, например кристаллизацией, и оптически активные соединения общей формулы 1 высвобождают из солей путем взаимодействия с сильными основаниями.
Исходные соединения можно получат известными способами.
Соединения общей формулы 1 имеют уменьшающее интенсивность воспаления, болеутоляющее, тормозящее агоегаиию тромбоцитов, антиатереогенное. траиквивалентное, влияющее на центральную нервную систему Рс антагонистическое, антибактериальное и антифунгальное действия, являются эффективными против и Cons и регулируют функцию сердца и кровообращения. Особенно следует подчеркнуть их действие против аллергии и астмы. На этом основании соединения общей формулы 1 могут применяться в медицине и ветерина и.
Возникающие из-за взаимодействия антигенов и антител аллергические реакции проявляются о различных органах и тканях самым различным образом. В качестве средства против астмы широко применяется динатрийхромогликат (1,(2-карбоксихромон-6-илокс)-2-гидроксипропан, Inta1 ) , который, однако, при оральном применении является недейственным и поэто му можно использовать только с помощью ингаляции при применении сложного вспомогательного прибора (Spinhaler). Было найдено, что соединения общей формулы I, применяемые как
орально, так и внутривенно или ингалятивно, отлично вылечивают аллергические симптомы.
Эффективность соединений общей формулы I доказана с помощью стандар ного теста, служащего для определения антиаллергического действия. Опыты проводились на крысах с РСА-тестом Ovary и с Churck тестом, причем в качестве сравнительного вещества применялся динатрийхромогликат. Исследования Проведенные с РСЛ-тестом дали следующие результаты, .v., мм/кг:
9 Фениламино-6-метил-4-ОКСО-6, гидроАН-пиридо(1,2-а) пиримидин- 3- карбоновая кислота1,3
(-) 9 0ениламино-6-метил-4-оксо-6,7 Дигидроин-пиридо(1,2-а) пиримидин 3-карбоновая кислота1,2
Динатрийхромогликат1,0
Как видно из- полученных данных, типичный представитель соединений согласно изобретению является эффективным также при оральном применении, в то время как динатрийхромогликат развертывает свое действие топько внутривенно. При внутривенном применении соединения общей формулы t являются более эффективными, чем сравниваемое соединение.
Токсичность соединений общей формулы 1 является небольшой: ЛД{(изучна на крысах и мышах) р.о, выше 500 мг/кг.
Процентная активность названного соединения в РСА- тесте при единственной внутривенной дозе 320 ммоль соотв. 10 ммоль при 100 соотв. 601.
Ежедневная доза активного вещества может быть очень различной и зависит от возраста, веса и состояния больного, типа препарата. При оральном применении суточная доза лежит вообще при 0,05-15 мг/кг, при внутривенном применении или ингаляции при 0,001-5 мг/кг. Это количество активного вещества может также распределяться на несколько отдельных доз в течение суток. Указанные дозы имеют чисто ориентировочный характер. Соответственно требованиям отдельного случая и врачебных предписаний он могут отклоняться от них вверх и вни
Пример 1.100,0г (0, моль) 9-бром-6-метил-А-оксо-6,7,8,9-тетрагидро- -пиридо(1,2-а) пиримидин-3-карбоновой кислоты и 100 мл анилина вносят в 800 мл метанола. Смесь при перемешивании нагрерсют до образования раствора. Раствор охлаждают до комнатной температуры и затем перемешивают в течение двух-трех дней. Высадившиеся кристаллы отфильтровывают и промывают метанолом. Получают 64,0 г (61,4) 9-фениламино-б-метил- -оксо-б,7-дигидро-, - Н-пиридо(1,Л-а) пиримидин-3-карбоновой кислоты, которая после перекристаллизации из метанола плавится при 172-173 0.
Найдено, |: С 6,22; Н 5,08; N lit,15.
Вычислено,: С 6,6А; Н 5,09;
N И,13.
Пример 2, К раствору О,А г (9,22 моль) гидроксида натрия в 10 мл воды добавляют 2,0 г (6,15 моль) этилового эфира 9 Фениламино-6-метил-4-оксо-6,7-Дигидро-4Н-пиридо(1,2-а пиримидин-3-карбоновой кислоты. Суспензию при 60-70° С перемешивают до тех пор, пока все не растворится (около 2-3 ч). Раствор нейтрализуют 10%-ной водной соляной кислотой и затем обрабатывают активированным yi- лем. После осветления раствор подкисляют 10%-ной водной соляной кислотой ДО рН 2.
Высадившиеся кристаллы отфильтровывают, и промывают водой. Получают 1,5 г (81,5) 9-Аениламино-6-метил-4-оксо-6,7 Дигидро- Н-пиридо (1,2-а) пиримидин-3-карбоновой кислоты, которая плавится при 1бО-1б2 С. После
перекристаллизации из метанола т.пл. повышается до 172-173 С,
Найдено, %: С 6i,60; Н 5,00; N и,11.
Вычислено, С 6ч,6ч; Н 5,09;
N U,13.
Пример 3. 2,,35 моль) этилового эфира Э-бром-б-метил- -оксо-6,7,8,9 тетрагидро-4Н-пиридо(1,2пиримидин-3-карбоновой кислоты растворяют в 6 мл метанола. Раствор смешивают с 1,8 мл анилина. Реакционную смесь оставляют стоять при комнатной температуре в течение двух дней и затем растворитель.отгоняют в вакууме. К остатку добавляют 5 мл бензола,высадившиеся кристаллы отфильтровывают Фильтрат упаривают в вакууме и остаток смешивают с 7,6 мл водной 1атриевой щелочи. Смесь при комнатной температуре перемешивают 3- ч. причем получают раствор. Раствор нейтрализуют водной соляной кислотой, осветляют активированным углем устанавливают рН 2. Водную фазу отделяют от высадившегося масла декантированием и масляную часть растирают с небольшим количеством метанола. Кристаллы отфильтровывают и промывают водой. Получают 0,8 г (42,1) плавящейся при 162-16 ° С 9-lфeнилaминo-6-мeтил- -oкco-6,7 Дигидpo- H-пиpидo(1 ,2-а)пиримидин-3-карбоновой кислоты. После перекристаллизации из MBтанола т.пл. 171 172°С.
Найдено, %: С 6i«,70; Н 5,12-, N Т,20.
Вычислено, %: С 6,.Н 5,09;
N 1,13.
Пример Ц. Работают по предложенному в примере 3 методу,однако вместо анилина применяют о-толуидин.Получают 0,8 CiO.I) 9 (2-метилфенил)-амино-Ь-йетил- -оксо-6,7-Дигидро-4Н-пиридо {l,2-а пиримидин-3 карбоновой кислоты, которая после перекристаллизации из метанола имеет т.пл. С.
Найдено, %: С 65,0{, Н 5,ЬО;.
N 13,39. .
С,.,Н,.
Вычислено, %: С 65,58; Н 5,50; N 13,60.
Пример 5. 0,0 г (0,127 моль этилового эфира 9-бром-6-метил- -оксо-6,7,8,9-тетрагидро-+Н-пирияо(1,2-а пиримидин 3 карбоновой кислоты растйоряют в Во мл диметилсульфоксида и
добавляют 26 мл (0,285 моль) анилина Раствор при комнатной температуре оставляется стоять J,-k дня, затем разбавляют 100 мл воды и трижды встряхивают с бензолом по 50 мл. Объединенные органические фазы сушат над сульфатом натрия и упаривают в вакууме. Остаток перекристаллизовывают из этанола, причем получают 2i,5 г (59,) этилового эфира 9 фениламино-6 метил- -оксо-6,7-Дигидро- Н-пиридо(1,2-а) пиримидин-3-карбоновой кислоты, с т.Г1Л. 119-120 °С.
Найдено, ,%: С 66,30; И 5,80; N 12,83.
,.
Вычислено, I: С 66,5; Н 5,8Э; N 12,91.
Пример 6. 0,5г(2,00 -моль этилового эфира 9-гидрокси-6-метил- -оксо-6 ,7-дигидро-ДН-пиридоО ,2-а пиримидин-3-карбоновой кислоты растворяют в 5 мл безводного этанола. Раствор смешивают с 0,3 г (3,00 моль анилина и 3 м кипятят с обратной
флегмой. Затем реакционную смесь охлаждают, высадившиеся кристаллы отфильтровывают и промывают небольшим количеством этанола. Получают 0,3 г (46,1) этилового эфира 9-фениламино-6-метил-4-оксо-6 ,7-Дигидро-4Н-пиридо (1,2-а)пиримидин-3-карбоновой кислоты, с т,пл. при 119-120 €.
Найдено, : С 65,«б; Н 5,90; N 12,82.
.
Вычислено, %: С 66,45; Н 5,89; N 12,19.
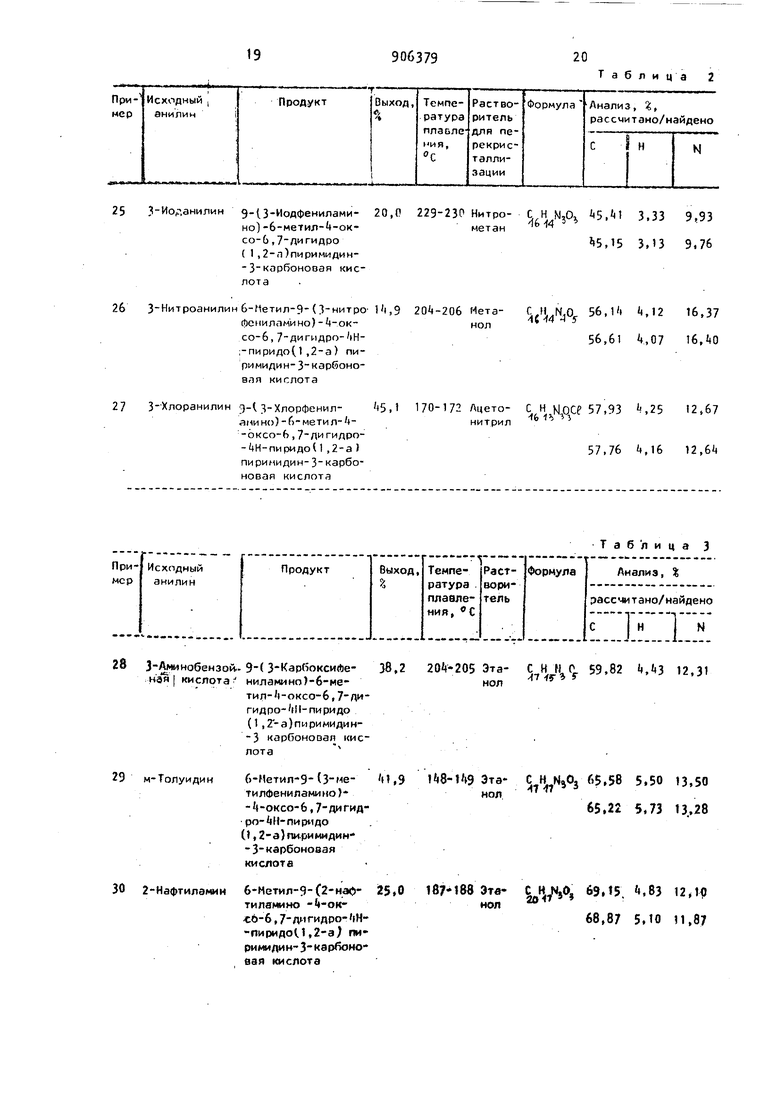
Пример 7. 10,О г (31,83 моль) этилового эфира 9-бром-6-метил-4-оксо-6,7,8,9-тетраги дро-4Н-пиридо(1 ,2-а)пиримидин 3-карбоновой кислоты растворяют в 100 мл безводного этанола. Раствор смешивают е 6,9 мл (63,66 ммоль) N-метиланилина и затем смесь кипятят 8 ч с обратной флегмой. По истечении реакции растворитель отгоняют при пониженном давлении. Остаток смешивают с 100 мл водной соляной кислоты и дважды экстрагируют хлороформом по 30 млОбъединенные органические фазы сушат над прокаленным сульфатом натрия и затем упаривают в вакууме. Остаток растворяют в 25 мл метанола и оставляют стоять в холодильнике на ночь. Высадившиеся кристаллы отфильтровывают. От фильтрата в вакууме отгоняют 15-20 мл растворителя, остаток стаn9вят в холодильник. Высадившиеся крис таллы отфильтровывают и промывают небольшим количеством метанола. По лучают 2,8 г (25,9%) плавящегося при 126-129 С этилового эфира 9-( тиланилино)-6-метил- -оксо-6,7 дигидрр-4Н пиридо(1, 2-а)пиримидин 3-ка боковой кислоты. После перекристаллизации из метанола т.пл. повышается до,131-1 33 С. . :.Шйдено, %: С 67,40; Н 6,35; м п,г, 9 УЧ ЗВычислено, %: С 67,25; И 6,23; N 12,38о П р и м е р 8. В 20 мл метанола вносят 2,0 г (6,97 :Моль) 9-бром-6 -метил-4-оксо-6,,9-тетрагидро- Н-пиридо(1,2-а)пиримидин-3-карбоноеой кислоты и 1,72 г п-броманилина Смесь при перемешивании нагревают до тех пор, пока все не растворится. Раствор охламдают до комнатной температуры и перемешивают 2-3 дня. Высадившиеся кристаллы отфильтровывают. и промывают метанолом. Получают 1,7 г (64,6% Э(-бромфенил)-амино-6-метил- -оксо-6 ,7-Дигидро- Н-пириро(1,2-а)пириглидин-3-карбоновой кис-, 1ЛОТЫ, которая после перекристаллизации из метанола имеет т.пл. 202-20 Найдено, %: С 51,15; Н 3,аО; . N 10,90; Вг 21 ,21. С,, 0. Вычислено, %: С 51,08; Н 3,75; N 11,17; В г 21, . Пример 9. Работают по предложенной в примере 1 методике, однако исходят из (-)9-бром-6-метил 4-ок со-6,7,8,9-тетрагидро- Н-пиридо(1 ,2пиримидин-3-карбоновой кислоты. С выходом получают (-)-9-фенил амино-6-метил-4-оксо-6,7-Дигидро-4Н-пиридо(1,2-а)пиримидин-3-карбоновую кислоту, которая плавится при С. Найдено, %: С 64,51; Н l,96; N 1,01. Вычислено,.%: С , Н 5,09; N Н,13. Примеры 10-13 (см. табл. 1) 2,9 г (0,01 моль) Э-бром-6-метил-4-оксо-6,7,8,9-тетрагидро-4Н-пиридо (1,2-а)пиримидин-3-кар6оновой кислот растворяют в 5 мл диметилсульфоксида К раствору добавляют 0,02 моля указанного в табл. 1 ароматического ами на. Реакционную смесь при комнатной 9 температуре оставляют стоять в открытом сосуде в течение трех дней и затем смешивают с 20 мл воды. Высадившиеся кристаллы отфильтровывают, промывают водой и затем сушат, Сырой продукт перекристаллизовывают из указанного в табл. 1 растворителя. Пример . 1+,35 г (0,05 моль) 9-бром-6 метил- -оксо-6,7 ,8,9-тетрагидро-4К-пиридо( 1 , 2-а) пиримидин-З карбоновой кислоты растворяют в 100 мл безводного хлороформа и к раствору добавляют мл (0,15 моль) н-бутиламина. Реакционную смесь при комнатной температуре оставляют стоять в течение трех дней и затем смешивают с 70 мл воды. рНзначение водной фазы при интенсивном перемешивании с 10%-ной водной кислотой HCt устанавливают на 2. Органическую фазу отделяют, водную часть встряхивают 2 раза по 50 мл с хлороформом. Объединенные органические фазы сушат над прокаленным сульфатом натрия и растворитель отгоняют при поних{енном давлении. Остаток кристаллизуется из метанола. Получают 4,3 г (31%) 9 н-бутиламино -б-метил- -оксо-6 ,7-ДИГидро-Ж-пиридо(1 ,2-а)пиримидин-3-карбоновой кислоты с т.пл. Найдено , %-. С 61, Н 7,08;. 15,06. С44. : Вычислено, %: С 60,63; Н 6,91; IN 15,15. Пример 15. 5,0г (1,64 моль) этилового эфира 6-ме- . тил-9- (Ы-метиланилино)-4-оксо-6,7,8, 9-тетрагидро-(Н-пиридо(1, 2-а) пиримидйн-З-карбоновой кислоты растворяют в 100 мл хлороформа. Раствор кипятят 9 ч с обратной флегмой с одновременным вдуванием воздуха. Затем растворитель отгоняют в вакууме, остаток выкристаллизовывают из этанола. Получают 2,9 г (58,lt%) этилового эфира 6-метил-9- (ь1-метиланилино)-4-окс,о-6,7-Дигидро-4Н-пиридо(1,2-а) пиримидин 3 1сарбоновой кислоты. Продукт плавится при ЙО-142 Сие полученным согласно примеру 7 продуктом не показывает депрессии точки плавления. Найдено, %: С 67, Н 6,36; N12,38. Вычислено, % С б7, Н 6,23; N 12,38. Пример 1б. 2,9 г (0,01 9 6ром-6-метил- -оксо-6,7,8,9 тетрагидро-ЦН-пиридо{ 1,2-а)пиримидин-3 -карбоксамида растворяют в 20 мл ацетонитрила. К раствору добавляют 0,025 моль бензиламина. Смесь кипятят 4-5 ч, затем осадйвшееся вещество отфильтровывают, промывают водой и затем сушат. С 2%-ным выходом получают 9-бензиламино-6-метил- -оксо-6,7-Дигидро-4Н-пиридо(1,2-а)пиримидин-3-карбоксамид, с т.пл. 1901924. Найдено, %: С 65,95; Н 5, N 18,10, . (.7Н, %: С 66,00; Н 5, Вычислено, N 18,11. Пример 17- Работают по пре ложенной в примере 16 методике,однако в качестве амина применяют н-б тиламин. С 50%-ным выходом получают 9- (н-бутиламино)6-метил-i(-OKCo-6 ,7 -дигидро-4Н-пиридо(1,2-а)пиримидин3-карбоксамид, с т.пл. 178-180 С. Найдено, %: С 61,00; Н 6,79; N 20,Ш. I: С 61,07; Н 6,95; Вымислено, N 20,. Пример 18.К раствору 0, гидрокарбоната натрия в 20 мл воды добавляют 1,0 г (3i3t моль) 9-анилино-6-метил-(-оксо-6,7,8,9-тетрагидро-+И-пиридоМ , 2-а-пири ми дин-3-карбоновой кислоты. Суспензию перемешивают при Во-9о С с одновременным продуванием воздуха. После того, ка все перешло в раствор, перемешивают .еще 0,5 ч и затем раствор охлаждают |до комнатной температуры. С noMoii bio соляной кислоты устанавливают значение рН. Высадившиеся кристаллы отфильтровывают, промывают Водой и затем сушат. Получают 0,5 г (65,5) 9-анилино-6-метил-4-оксо-6,7-Д гидро - i пи ри до (1,2 - а) пи римиди н- 3- карбоно вой кислоты, с т.пл. 152-15 С. Яо перекристаллизации из метанола т.пл 172-17 + С. Продукт с соединением, лученным согласно примеру 1, не пок зывает депрессии точки плавления. Найдено, % -С (12 5,22; N И,10. . . о: С 6,.Н 5,09; Вычислено, N .U. мол Пример 19. 2,Э г (0,01 моль) ( - ) 9-бром-6-метил-н-оксо-6,7,8,9-тетрагидро-4Н-пиридо( Т,2-а)пирймидин3-карбоновой кислоты ( , с 2, метанол) растворяют в 5 мл р метилсульфоксида и добавляют 3,8 г (0,022 моль) п-броманилина . Раствор оставляют стоять при комнатной температуре в открытом состоянии в течение трех дней и затем смешивают с 20 мл метанола. Высадившиеся кристаллы отфильтровывают и промывают метанолом. Получают 1,7 г («5,2%) (-)-9- (4-бpoмaнv(Линo)-6-мeтил-l-oкco-6,7,8,9-тетрагидро-ЦИ Пиридо(1,2-а) пиримидин-3-карбоновой кислоты с т.пл. 210-211 С, Найдено, : С 51,25; И 3,80; N10,90; BV 21,2. бЧ д о ВУВычислено, %: С 51,08; Н 3,75; N11,17; 8г 21,2. Пример 20. 5,0 г (0,016 моль) этилового эфира 9 бром-6-метил-4-оксо-6,7,8,9-тетрагидро-+И-пиридо( 1,2-а) пиримидин-3-карбоновой кислоты растворяют в 50 мл этанола и добавляют 3,5 мл (0,032 моль) N-метиланилина. Реакционную смесь под атмосферой азота кипятят 8-9 ч. Затем раствор смешивают с 50 мл соляной кислоты и трижды встряхивают с дихлорметаном по 25 мл. Объединенные органические фазы сушат над прокаленным сульфатом натрия и упаривают при пониженном давлении. Остается темное масло, которое кристаллизуют при добавлении небольшого количества метанола. Получают 3,0 г (55,2%) этилового эфира 6-метил-9-СН-метиланилино)-4-оксо-6,7, 8,9-тетрагидро- Н-пиридо(1,2-а)пиримидин-3 карбоновой кислоты с т.пл. 175-178 0. С 67,25Г Н 6,80; Найдено, ; W12,16. Вычислено, С 66,85; Н 6,79; Ш2,30. Пример 21. К раствору 5 г гидроксида натрия в 300 мл воды добавляют 20 г (58,56 моль) этилового эфира 6-метил-9-С метиланилино)- -оксо-6,7,8,9-тетрагидро- Н-пиридо (1,2-а)пиримидин-3-карбоновой кислоты. Суспензию перемешивают при 6070 С 15 ч. Затем отфильтровывают кристаллы и промывают водой. Сырой продукт перекристаллизовывают из эта -.15 нола. Получают 9,0 г (57,1) 6-метил 9- (-метиланилино)- |-оксо-6,7| 8,9-тетрагидро- Н-пиридо(1,2-а)пири Иудина, с т.пл, 188-18Я С. Найдено, %: С 71,б9; Н 7,30: М15,39. Вычислено, С 71,35; Н 7,11; N15,60. Пример 2.. ,7 г(0,50 мо 9-бром-6-метил-4-оксо-6,,9 тетра гидро-4Н-пиридо{1,2-а)пиримиди н-3карбоновой кислоты растворяют в 250 мл ацетоиитрияа и добавляют 100 мл анилина. Раствор при комнатной температуре перемешивают под ат мосферой азота в течение двух дней, затем смешивают с 1000 мл воды и пе ремешивают еще 30 мин. Кристаллы от фильтровывают, промывают водйй и ки пятят затем в 1400 мл метанола. Получают. 128,8 г (86,1) 9-анилино-6- мети л- 4- оксо- 6 ,7,8,9- тет ра ги д ро-4Н-пиридо{1,2-а)пиримидин-3 карбоновой кислоты, с т.пл. 198-199° С. Найдено, %: С 6(,50; Н 5,99; М13,81. (1,Н N303 Вычислено, % С 6i,20; Н 5,72; N 1,0. 23. К раствору 0,5 Пример 10 мл ВОДЬ догидроксида натрия в моль) 9 анилибавляют 1,0 г (3,3 но 6-метил- t-oKco-6,7,8,9-тетрагидро i( ридо {1,2-а) пирими ди н-3-ка рбоновой кислоты. Раствор при 70-80 перемешивают под атмосферой азота 5 ч и затем охлаждают до комнатной температуры. Высадившиеся кристаллы отфильтровывают и промывают водой. Получают 0,4 г (46,9%) 9-анилино-6-метил-6 7,8,9-тетрагидро-4Н-пиридо (1,2-а)пиримидин-4-она, с т.пл. 1бО . После перекристаллизации из ацетонитрила т.пл. ,С. Найдено, , С 70,95; Н 6.,82; Ы16,37., Вычислено, %: С 70,56,- Н 6,7Т;. N16,46. . .. Пример 24. 1,0 г (3,48 .MO 9-бром 6-метил-4-оксо-6,7,8,9 тетра гидро-4Н-пиридо(1,2-а)пиримидии-3 -карбоновой кислоты растворяют в k пиридина и раствор оставляют стоять при комнатной температуре в течение трех дней. Высадившиеся кристаллы о фильтровывают и промывают хлоройорном. Получают 0,75 г (66,9) 916 тил-4-оксо-6,7,У,9-тетрагидро-4Н-пиридо(,1 ,2-а) пиримидин-9-ил)пиримидинийбромида, с т.пл. 250-252С. После двухразовой перекристаллизации из метанола продукт плавится при 270272 С, Найдено, -;;: С 52,16; Н 4,98; Ml2,92; Вк- 25,20. Вычислено, I: С 52,19; И 5,02; 13,П4; ВГ 24,80. Примеры 25-27 {см. та&л. 2). 2,9 г (0,01 моль) 9-бром-6-метил-4-оксо-6,7,8,9-тетрагидро-4Н-пиридо(1,2-а)пиримидин-3-карбоновой кислоты растворяют в 5 мл диметилсульфоксида. К полученному раствору добавляют 0,02 моль ароматического амина (см. табл. 2) , после чего реакционную смесь оставляют стоять в открытом сосуде в течение 3 дней. Затем к ней добавляют 20 мл воды. Выпадающие кристаллы промывают водой и высушивают. Полученный сырой продукт подвергают перекристаллизации из приведенного в табл. 2 растворителя. Примеры (см. табл. 3). 0,5 г (2,25 ммоль) 9-окси-6-метил-4-ОКСО-6,7-Дигидро-4Н-пиридо (1,2-а) пиримидин-3-карбоновой кислоть растворяют в 5 мл безводного этанола. К полученному раствору добавляют 2,48 ммоль ароматического амина (см. табл. 3), после чего реакционную смесь нагревают 3 ч с обратным холодильником . затем охлаждают и отфильтровывают выпадающие кристаллы. Сырой продукт подвергают перекристаллизации из приведенного в табл. 3 растворителя . Пример 34. Процесс проводят согласно примеру 12, с той разнице З, что вместо 9 бром-6-метил-4-оксо6,,9 тетрагидро-4 1-пиридо (1,2-а) пиримидии-3 н:арбоновой кислоты используют 9 бром-4-оксо-6,7,8,9-тетрагидро 4Н-пиридо{1,2-а}пиримидин-3 карбоновую кислоту. Полученный продукт перекристаллизовываат из ацетонитрила. В результате получают 9(фениламино)-4-оксо-6,7-дигидро-4Н-пиридо(1,2-а).пиримидин-3 арбоноаую кислоту. Выход 50. Т.пл. 197-198 С. Найдено, %i С 63,45; Н 4,50; ,N1f},8b jO %i С 63,60; Н 4,69; Вычислено, M14,83. 179 Пример 39. Поступают как в. примере 22 с той разницей, что вместо 9-бром-6-метил-«-оксо-6,7,8,9-тетрагидро-4Н-пиридо(1,2-а)пиримидин-Зкарбоновой кислоты применяют 9 -бром-4-ОКСО-6,7,8,9 тетрагидро- Н-пи ридо(1,2-а)пи ри миди н-3 карбоновую кислоту. Сырой продукт кипятят в метаноле. Получают 9-анилино- -оксо-6,7,8,9-тетрагидро-4Н-пиридо(1,2-а) nиpи лидин-3 кapбoнoвyю кислоту. Выход 56,U. Т.пл. 178-180 0. Рассчитано, %: С 63,15; Н 5,30; N И,73. 0, , Найдено, %: С 63,ОА; Н 5,22; N ,. 918 П р и м е р tO. Поступают как в примере 2 с той рааницей, что применяют этиловый эфир б-метил-З-(Н-метиланилино) --оксо-б,-дигидро- Н-пиридо( 1 ,2-а)пиримидин-3-кар6оновой кислоты. Сырой продукт перекристэллизовывают из метанола. Получают 6-метил-9(М-ме- тиланилиио)-4-оксо-6,7-Дигидро- Н-пиридо(. 1,2-а)пиримидин-3-кар6оновую кислоту. Найдено, %. С 65,10; Н 5,60; V113,32. «пН{7 г 1 . Вычислено, %: С б5,55; Н 5,50; ,«9. Т а б л и ц а 1










| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения геминальных дигалоидных производных конденсированных пиримидин-4-онов,рацематов или оптически активных антиподов | 1980 |
|
SU1151210A3 |
| Способ получения производных пиридо /1,2-а/ пиримидина или их оптических изомеров, или их гидратов, или их солей | 1980 |
|
SU980622A3 |
| Способ получения производных пиридо/1,2-а/пиримидина или их солей с щелочными металлами или их оптических изомеров | 1980 |
|
SU1024007A3 |
| Способ получения производных пиридо (1,2-а) пиримидина или их фармацевтически приемлемых солей или их оптически активных изомеров | 1978 |
|
SU999973A3 |
| Способ получения конденсированных пиримидинов или их солей,или их оптических изомеров | 1977 |
|
SU969165A3 |
| Способ получения производных пиридо-(1,2-а) пиримидина или их фармацевтически приемлемых солей,или их оптически активных изомеров | 1978 |
|
SU999972A3 |
| Способ получения конденсированных производных пиримидина или их солей | 1980 |
|
SU1082324A3 |
| Способ получения 9-формилпроизводных пиридо @ 1,2- @ пиримидина или их оптически активных антиподов | 1982 |
|
SU1245260A3 |
| Способ получения производных пиридо (1,2- @ ) пиримидина или их кислотно-аддитивных солей | 1978 |
|
SU1022659A3 |
| Способ получения производных пиридо(1,2-а)-пиримидина или их солей | 1974 |
|
SU566524A3 |

п-этоксипнилин 9 ( Токсианилино)-6-метия-|-оксо-6,7 - ди гиПРО-f -пиридо (1 ,2-а)пирими№н-3 -Зкарбоновая кислота
6-Метил-9- (t-нитроп-нитроанилин
анИЛИНо) - 4-ОКСО-6 , 7 - ди ГИ ДРО- пи ОИДО
(1,2-а)пиримидин-3карбоновая кислота
9-Лнилино-6-мстил- Анилин-оксо-6,7 Д гидро- И-пиридо( ,2-а) пири 1дин- 3 карбонооая кислота
6-Метил-9-CtxnopaHH- 9б
п-хлоранилин лино)-«-оксо-6,7-ДИ, гидро- Н-пиридо(1,2-а) пиримидии-3-карбоновая кислота Суммарные формулы продуктов: пример пример
210-2П Ацето- 63,33 нитрил
li k-2kl Диметил- 56, И формамид
Метанол 6,6 6.,52
12,67
,25
57,72 10: C,,, пример 11: (;,Н, пример 13 C,bV4°-i 25 .анилин 9-(.3-Иодфенилами- 20,0 229но)-6-метил- -оксо-6,7-лигидро ( 1,2-п)пиримидин-3-корбонован кислота26 3-Нитроанилин 6-Петил-9-(3-нитро- 1|,9 20 фet илaмй но) - t-оксо-6, 7-Дигидро- Н;-пиридо(1 ,2-а) пиримидин-З-карбоновлп кислота 3-Хлоранилин 3-(3-Хлорфениллии но) - С мети л- -оксо-Ь,7-Дигидро-«Н-пиридо 1 ,2-а ) пиримидин-3-карбоновая кислота
8 ЗАминобензой,-9-( ЗКарбоксиАе- 38,2 нап| кислота ниламино)-6-ме
тил-1-оксо-6,7-Дигидро-lit-пиридо(1,-а}пиримидин-3 карОонооая кислота
6-Метип-9-О-ме- (1,9
9 м-Толуидин тилфенияамино) - -оксо-6,7 Дигидpo-iiH-пиридо(,2-а)пиримидин-З-карбоноваякислота
6-Метия-9-(2-нао- 25,0
2-Нафтилэ м тиламино Ц-окс6-6,7-Дигидро-|Н-оиридои,2-а) пиримидин-3 кар6оновая кислота
Таблица (5,1 170Таблица 3
С HKOj. 59.82 «..««З 12.31
Этанол
65,58 5.50 13,50
Этанол65,22 5.73 13,28
, 65,t5, .83 12,10
187-188 Этаноя68,87 5,to 11,87 30 Нитро- С Н NjO,, itS,) 3,33 9,93 метан «5,15 З.З 9,76 CJjL.NjO 56,1t 4,12 16.37 06 МетаЦ 4 -1 5 56,61 А,07 16,1(0 72 Лцето- С Н НОСе 57,93 ,25 12,67 нитрил 57,76 ,1б 12,б
3-Лминоацето- 9 З-Лцптилфенил- 38rt фенои мино)-6-метил-|-оксо-6,7-Дигилро-И-гмридо(1,2-a)пиpимилин-3кapбoнoвaякислота
ЗФторанилин
9-( 3-Фторфенил- «1,« -а ишо -б-метил-1-оксо-6,7 Дигидро(.1,2-а) пиримидин- 3-кар боновая кислота
1-Нафтилэмин
ь-Метил-9- -наф- 2,6 тиламино -- оксо-(,7-Диги;ро- Н-пиридо(1 ,2-а) пи римидин-3 карбоновая кислота
4-Лминобензой- 9-( -КарПокси-63,5
мая кислота (йениламино)-6-метил- -оксо-6,7-яигидро-4 -ПирИ 1ДО(1,2-а) пиримидин- 3-карбоновая кислота
5П-АНИНИЗИДИН 6-Иетил-9-( Jl-MeT-
оксифениламино)- -оксо-6,7-Дигидро- Н-пиридо(1,
62-Аминофенил 9-(2-Оксифенил- 76,6
амино -Ь-метил-(«-оксо-б, 7-дигидро-|Н-гмридоМ,2-а)пиримидин -3-карбоновая кислота
73, -Дихлорани- . 5,9 ЛИНииламино)-6-метил- -оксо-6,7
-ди гидро-tH- пиридо(1,2-d)пиримидин-3-карбоновайкислота
81 -Лминобифенил 9-(-БиЛенилами- 7,0
но)-Ь-метил- -ок: СО-6 , 7-ди ГИДрО-JlH
-пиридоО,2-а) пиримидин-3-карбоновзя кислот
73-17 Эта-
НОЛ
63,75 5.09 12,«(3
187-188 Эта- , 60,95 , «з.ЗЗ
ноп
61,(И t.SQ 13,
221-222 Эта- С НДо, 69,15 ,93 12,09
НОЛ
(кипя-69,28 ,91 12,01
чение)
230-231 Эта- 59,80 k.kO 12,31
НОЛ
59,70 .,50 12,13
195-196 Ачето-С И . 62,38 5,23 12,8 нитрил
62,7| 5,31 12,65
208-209 Эта- С,Нмоб1,3« ,83 13.«I „ «КМ
НОЛ
61,09 1.,77 13,53
218-219 Эта- CHNOo;52,28 3,58 M, МОП f.
2Г8-219 Эта- С Н . 70,76 5,13 11,25
олп -I-
НОЛ
Авторы
Даты
1982-02-15—Публикация
1978-12-28—Подача