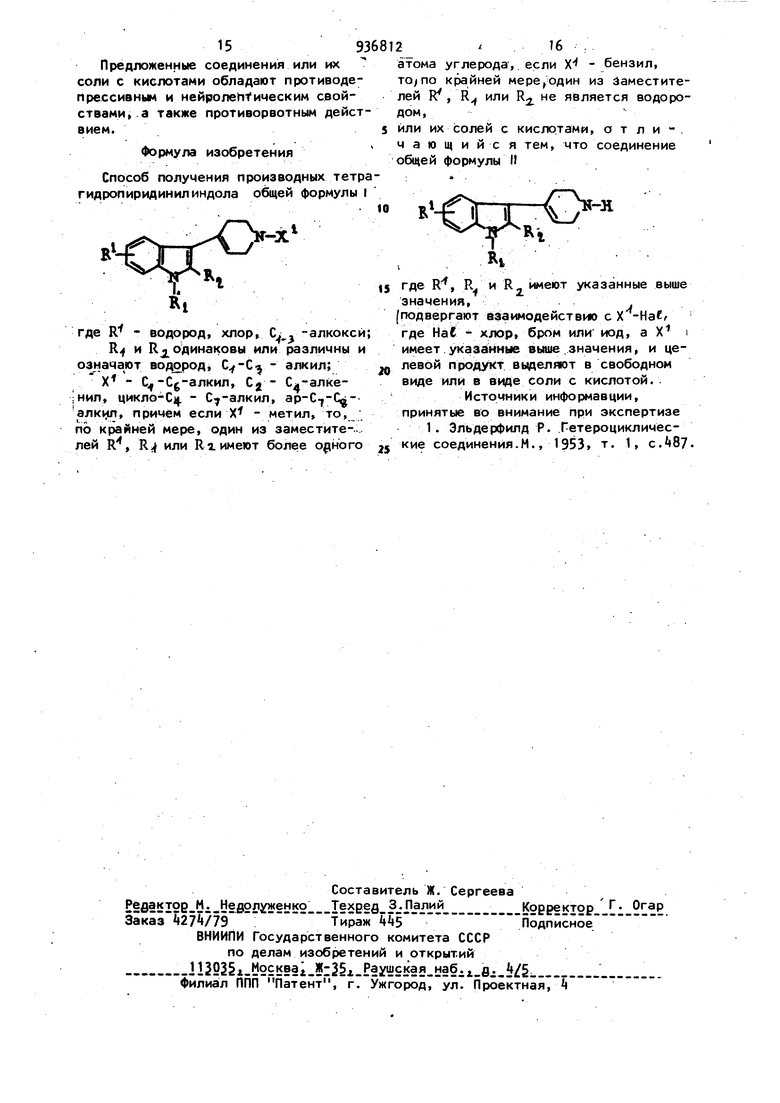
59 Стадия А: 3-(1-пропил 1,2,3,6-тет рагидропиридин-4-ил)-1Н.-индол. Растворяют А,5 г 3-(1t2,3,6-TeTpa гидропиридин-4-ил) 1Н-индола в 90 мл ацетона. К полученному раствору прибавляют г окиси серебра и 2,22 мл йодистого пропила. Нагревают в течение 3 ч при ,охлаждают,фиЛьтру ют и перегоняю, досуха в вакууме.Получе ной сырой продукт хроматографируют На двуокиси кремния, элюируя смесью хлороформ-ацетон-триэтиламин (). Отгоняют растворитель и растворяют остаток в 20О, мл этилового эфира ук-. сусной кислоты с обратным холодильником при нагревании, раствор фильтруют,и концентрируют до 150 мл., Охлаждают до ,вызывают кристаллизацию и охлаждают одну ночь. Кристаллы отсасывают, промывают этиловым эфиром уксусной кислоты и сушат. Таким путем получают 3,9 г целевого продукта, плавящегося при . Стадия Б: Хлоргидрат 3-(1-пропил-1,2,3 6-тетрагидропиридин-4-ил) 1Н -индола. 3,9 г-полученного в стадии А продукта растворяют в 250 мл изопропа- нола при нагревании с обратным холодильником и прибавляют по каплям раствор газообразной соляной кислоты в изопропаноле до получения кислого рН. Реакционную массу охлаждают в течение 2 ч, отсасывают кристаллы, промывают изопропанолом и сушат под уменьшенным давлением. Получают 4,15 г сырого продукта, которые очищают кристаллизацией. Таким путем получают г целевого продукта, плавящегося при 230-232 С. Вычислено.: С 69,42; Н 7,б5; pi 12,81; N 10,12; C H oNzHCl М.в. 276,821. Найдено,%: С б9,5; Н 7,7; Cf 12,8; N 9,9. Используемый в качестве исходного продукта 3-(1,2,3,6-тeтpaгидpoпиpидин-4-ил) 1Н-ИНДОЛ может быть получен с л 1 дующим образом. Растворяют 10 г индола в 200 мл уксусной кислоты,нагревают при 95-1ОСРС при перемешивании и в атмосфере азота. Прибавляют 50 мл 1 н.водного раст вора фосфорной кислоты и 39,3 г моногидрата хлоргидрата 4-пиперидона. Реакционную массу нагревают при в течение 1 ч, дают остынуть, выливают на лед, добавив 350 мл концецт12рированного гидрата окиси аммония и экстрагируют этиловым эфиром уксусной кислоты. Экстракты промывают водой, соленой водой, сушат над сернокислым магнием и упаривают досуха. Получают Т5,7 г сырого продукта, его сгущают в атмосфере азота и добавляют 75 мл метанола, кристаллы отфильтровывают в вакууме, промывают метанолом , и эфиром. Получают 1, г 3-(1,2,3 6-тетрагидропиридин- -иЛ) 1Н-индола. Т.пл.ТВЗ-Твб С. Упаривают маточные растворы и очищают хроматографически на двуокиси . кремния полученный сырой продукт, элюируя смесью хлороформ-триэтиламин (6-3-1). Собирают 4,55 г продукта Rf 0,15. которые растирают с эфиром. Получают 4,295 г 3-(1,2,3,6-тетрагидропиридин-4-ил) 1Н-индола,с вы. ходой 5.715 г. Полученный продукт ,очищают перекристаллизацией из изо пропанола и получают г. 3-(1,2,3,6-тетрагидр6пиридин-4-ил) 1Н-индола. Т.пл. 190-191 С. П р и м е р 3. Хлоргидрат 3-(1-пентил 1,2,3,6-тетрагидропиридин-4-ил) 1Н-индола. Стадия А: З-С -пентил-1,2,3,6-тетрагидропиридин-4-ил) 1Н-индол. Вводят 10 г 3-(1,2,3,6-тeтpaгидpoпиpидин-4-ил) 1Н-индола в 100 мл ацетона, прибавляют г окиси серебра, а затем 20 мл йодистого пентила. По истечении 4-х ч перемешивания при комнатной температуре прибавляют ещё 2Г5 мл йодистого пентила и продолжают перемешивание в течение 1 ч. Выпавший осадок отфильтровывают, промывают смесью хлористый метиленметанол С50.50 и удаляют растворители под уменьшенным давлением при . Сырой продукт очищают хроматографически на силикагеле, элюируя смесью хлороформ-метанол-триэтиламин (7-2-1). После того, как отогнали элюэнт, снова растворяет .полученный сухой экстракт в 250 мл этанола при кипении, раствор фильтруют и оставляют для кристаллизации при . Получают 7,9 г целевого продукта, плавящегося около 180 С. Стадия Б: Хлоргидрат 3-(1-пентил 1,2,3 6-тетрагцдропиридин-4-ил) 1Н-индола. Го-товят суспензию 7,9 г полученного в стадии А продукта в 100 мл абсолютного этанола,а затем при 0-5С-вводят 30мл нась енного раствора соляной кис/9лоты в этаноле. Реакционную массу остав ляют один час при перемешивании,кристаллы отфильтровывают, промывают эфи ром, а затем сушат в вакууме при . Получают 8,5 г целевого хлоргидрата в виде желтого продукта пла вящегося при , а затем при Вычислено,%: С 70,9 Н 8,3; N 9.2; С1 11,6. QeH2gf42Cl. М.в. ,866. Найдено,%: С 70,7; Н 8,3; N 9,; С1 11,6. Пример . Хлоргидрат 3-Cl-этил 112,3,6-тетрагидропиридин-4-ил 1Н- 1Ндол. Стадия-А: 1,2,3,6-тетрагидропиридин-4-ил) 1Н-индол. Подвергают взаимодействию при 30-35fC в течение 5 ч и в инертной атмосфере 9,91 г 3-(1,2,3,6-1етрагид ропиридин- -ил) 1Н-индола с 10,6 г карбоната натрия, 150 мл диметилформамида и и,5 мл этилбромида, а затем реакционную массу выливают ;в 1,5 л воды и продукт осаждается. Смесь перемешивают 1 ч, отфильтровывают, про мывают осадок водой и сушат одну ноч в сушильном шкафу при в вакууме в присутствии обезвоживающего средст ва,, . , Таким путем получают 8,95 г сырого целевого продукта, плавящегося при , которые заново растворяют в fOO мл эт1«1ового эфира уксусной кислоты при нагревании с обратным холодильником, раствор отфильтровывают в горячем виде, концентрируют до 250 W1, кристаллизуют, выдерживают 1 м, отфильтровывают кристаллы, промывают этиловым эфиром уксусной кислоты и получают 6,28 г желтыХ ;кристаллов, плавящихся при . Маточные растворы концентрируют до одной трети и получают еще 1,76г целевого продукта кристаллизацией, т.е. общий выход 8,ОА г. Стадия Б: Хлоргидрат 3(1-этил 1,2;3 6-тетрагидропиридин- -ил) 1Н-индола. 8,ОА г полученного в стадии А продукта вводят в суспензию в 80 мл этанола, охлаждают, прибавляют до кислотного рН этанольный раствор соляной кислоты и даютосадиться. По истечении 1 ч 30 мин кристаллы отфильтровывают, промываютЭтанолом, сушат при комнатной температуре в вакууме, получают 8,67 г целевого сы рого хлоргидра.та, который очищают пе 2 рекристаллизацией в два приема в этаноле и получают 6,21 г чистого целевого продукта, плавящегося при 232233°С. Вычислено,: С 69,2; Н 7,б5; С1 12,81; N 10,12. С Н CIN. М.в. 262,789. Найдено,: С 69,5; Н 7,7; С1 12,8; N 9,9. П Риме р 5. Хлоргидрат 3-(1-изопропил 1,2,3,6-тетрагидропиридин-4-ил) 1Н-индрла. Стадия А: 3-С1 метилэтил 1,2,3,6-тетрагидропиридин- -ил) Ж-индол. В инертной атмосфере перемешивают 5 г 3-(1.2,3fб-тетрагидропиридин- -ил) 1Н-индола, 50 мл диметилформамида, 5,25 г карбоната натрия и 2,7мл,прибавленные по капле,йодисто-. го изопропила, по истечении 20 ч смесь выливают в tOO мл воды, перемешивают 30 мин, кристаллизуют, кристаллы отсасывают, промывают, сушат при в вакууме и получают 5,8 ;г целевого продукта, плавящегося при 178°С. Стадия Б: Хлоргидрат 3-(1 метилэтил 1,2,3,6-тетрагидропиридин-«-ил) 1Н-индола. В 150 мл изопропана в. горячем виде растворяют полученный в стадии А продукт, прибавляют по каплям раствор газообразного НС1 в изопропаноле до кислотного рН, кристаллизуют, охлаждают одну ночь, кристаллы отсасывают, промывают изопропанол, сушат в ва-/ кууме и.получают 6 г целевого продукта, плавящегося при 260°С. Анализ (после перекристаллизации в этаноле). Вычислено,: С 69, Н 7,65; С1 12,81; N 10,12. М.в. 276,821. Найдено,: С 69,2; Н 7,9; С1 12,7; N10,1. П р и м е р 6. Хлоргидрат 6-метокси 3-С1 ПРОпил-1,2,3,6-тетрагидропиридин- -илЗ 1Н-индола. Стадия А: 6-метокси 3 1 пропил 1,2,3,6 -тетрагидропиридин- -ил) 1Н- , -индол. В инертной атмосфере перемешивают. 10 г 6-метокси 3-С1,2,3,6-тетрагидропиридин- -ил) 1Н-индола, 9,28 г карбоната натрия и 8,93 г иодида пропила в 200 мл диметилформамида, по истечении 5 м смесь выливают в 1,5 л воды, Кристаллизуют, перемешивают 1 ч, кристаллы фильтруют в вакууме, промывают водой, сушат в вакууме при 50 С в присутствии обезвоживающего средства и получают г целевого продукта, плавящегося при 219-220 С. Стадия Б: хлоргидрат 6-метокси 3(1-пропил 1,2,3,6-Летрагидропириди -i-ил) 1Н-индола. 7,3 г полученного в предыдущей стадии продукта суспендируют в 105мл этанола, охлаждают, прибавляют 7,5мл насыденного раствора газообразной со ляной кислоты в этаноле до кислотного рН, перемешивают 1 ч 30 мин при кристаллы фильтруют в вакууме промывают этанолом, сушат в вакууме при , получают 8,25 г сыррго про дукта, который после перекристаллиза ции из вЬды дает 6,2 г чистого целев го продукта, плавящегося при выше . Вычислено,%: С 66, Н 7,55; С1 11, N 9,12. М.в. 30.6,8АЗ. ClNi. Найде.но,%: С 66,2; Н 7,7; С1 N 9,0. Исходный 6-метокси 3(1,2,3,6-тeтpaгияpoпиpидин- -ил) 1Н-ИНДОЛ МО )ет быть получен следующим образом. С обратным холодильником и в ат-, мосфере азота нагревают в течение 8 ч 30,20 г 6-метокси 1Н-индоЛа с 1,75 г гидрата хлоргидрата «-пипери дона в 205 мл 2 н.метанолового раствора едкого кали, а затем смесь перемешивают одну ночь при комнатной температуре, медленно разбавляют водой до 1,2 л, кристаллизируют, перемешивают 30 мин, кристаллы фильтруют тщательно промывают водой, сушат и получают 23,05 г целевого продукта плавящегося пр 193-19 С. П р и м е р 7. Хлоргидрат 3-tl-(2-фениЛэтил)i,2,3,б-тетрагидропири дин-«-ил 1Н-индола. Стадия А: 3-р-С2-фенилэтил) t ,2,3,6-тетрагидропиридин-|-ил Ш-индол. При в течение ч перемешивают 6,9 г 3-(1,2,3,6-тeтpaгидpoпиp дин-Vил) 1Н-индола, растворенного в 105мл диметилформамида,с7,|2г карбо ната натрия и 5,95 мл фенилэтилбромида, затем смесь выливают при перемешивании в 1 л ледяной воды, кристаллизуют, перемешивают 2 ч, кристаллы отфильтровы ,рают, промывают водой, сушат одну ночь в вакууме в присутствии обезвоживающего средства, получают tO,23 г желтого продукта, плавящегося при 11,7 1210 203°С, который очищают кристаллизацией из этанола и собирают 7,33 г целевого продукта, плавящегося при 206-207 С. Стадия Б: хлоргидрат (2-фенил этил) 1 ,2,3,6-тетрагидропиридин- -ил2 1Н-индола. 8,2 г полученного в стадии А продукта суспендируют в 85 см ледяного этанола, При перемешивании прибавляют соляную кислоту в растворе в этаноле до рН кислоты, смесь.перемешивают один час,, отфильтровывают, промывают этанолом, перекристаллизуют из метанола и получают в два приема 6,99 f целевого чистого продукта, плавящегося при . Вычислено,%: С 7, Н 6, С1 8,26; N 10,. GI Н 2,,C1N-i. М.в. 333,888. Найдено,: С 7,; Н 6,9; С1 7,9; N 10,7. П р и м е р 8. Хлоргидрат -(2-пропенил)1,2,3,6-тетрагидропиридин- -ил 1Н-индола.. Стадия А: 3-11-С2-пропенил)1,2,3.6-тетрагидропиридин-А-ил 1Н-иидЬл. Перемешивают в течение 1 ч при 32°С раствор 13,86 г 3-(1,2,3,6-тетрагидропиридин-А-ил) 1Н-индола в 210 мл диметилформамида с 1t,8A г карбоната натрия и 7,3 мл дважды перегнанного в инертной атмосфере anr.i либромида, смесь выливают в 2 л воды, осаждают, фильтруют кристаллы после еще 1 ч перемешивания, промывают, сушат в вакууме в присутствии обезвоживающего средства, собирают 16,61 г светлр-желтого продукта, плавящегося при 177-179 0, который очищают перекристаллизацией в этиловом эфире уксусной кислоты, и получают в три приема 9,72 г целевого продукта, плавящегося при 177179 Стадия Б: хлоргидрат (2-nponer мил) 1,2,3,6-тетрагидропиридин- -ил I 1Н-индола. 8,79 г полученного в стадии А продукта суспендируют в 85 мл ледяного этанола, прибавляют дб кислотного рН Насыщенный раствор соляной кислоты в этаноле, смесь перемешивают 1 ч при , фильтруют, промывают этанолом, сушат в вакууме при , получают г кристаллического продукта, которьй перекристаллизованный из этанола дает 7,5 г целевого, чистого хлоргидрата, плавящегося при 177 1784 и при 217-218 0. . 1193681212 ВычисленоД: С 69,93; Н 6,96;с 10,92 г карбоната натрия и 5 мл N 10,19; С1 12,90.бромэтана, а затем медленно прибавляC H pNjCl. М.в. 27+,8,ют 350 мл дистилированной воды, выпавНайдено, С 69,7; Н 7,1; N 9,9;ший осадок, перемешивают 1 ч 30 мин, С1 13,0.5выдерживают ночь, кристаллы фильтруП р и м е .р 9- Хлоргидрат 5-хлор-ют в вакууме, промывают три раза в6-3-(1-пропил-1,2,3,6-тетрагидропири-дои и один раз с 25 мл 50%-ного воднодин- -ил) 1Н-индола.го раствора этанола, сушат в присутстСтадия А: 5 хлор-3(1 пропил-вии обезвоживающего средства, получа-1 ,2,3,6-тетрагидропиридинг -ил)юют 9, г желтого целевого продукта, 1Н-ИНДОЛ.плавящегося при 208-21О С, который При комнатной температуре в инерт-перекристаллизовывают два раза в этаной атмосфере перемешивают в течениеноле и собирают 7,87 г целевого про5ч 9,28 г растворенного в млдукта. диметилформамида 5-хлор 3-(1,2,3,6- is Стадия Б: хлоргидрат 5-хлор 3-(1-тетрагидропиридин- -ил) 1Н-индола-этил-1,2,3,6-тетрагидропиридин- -ил) с 8,8 г карбоната натрия и ,б7 мл1Н-индола. пропилибдида, смесь выливают при7,8 г полученного в стадии А проперемешивании в 1,4 л воды, кристалли-дукта Суспендируют в40 мл этанола, зуют кристаллы, фильтруют, промывают 20охлаждают до , прибавляют до рН водой, сушат в вакууме в присутствии1 этанольный раствор НСЕ . Продукт обезвоживающего средства, очищают . осаждается, его перемешивают 30 мин перекристаллизацией из этанола и по-при , оставляют при этой темпералучают 6,95 г целевого продукта, пла-туре 1 ч, фильтруют, промывают ледявящегося при 229-230С.25ным этанолом, сушат в вакууме при Стадия Б: хлоргидрат 5-хлор 3-(1-50С, собирают 7,3 г целевого про-пропил-1,2,3,6-тетрагидропиридин-дукта, плавящегося при 225°С, кото-t-ил) 1Н-индола.. рый подвергают перекристаллизации в 6,95 г Полученного в стадии А про-ледяном этаноле, и получают 5,9 г дукта суспендируют в 105 мл этанола, j чистого целевого продукта, плавящеохлаждают, прибавляют до кислотногогося при . рН насыщенный эталонный раствор НС6,Вычислено,: С 60,61; Н 6,1; перемешивают 2ч 30 мин при , крис-С1 23,85; N 9,2, таллы фильтруют, промывают этанолом C E Cl Nz- М.в. 297,239сушат в сушильном шкафу, собираютНайдено,: С 60,if; Н 6,1; С1 23,6; 7,566 г сырого продукта, который пе-N 9,3рекристаллизовывают из этанола и по-П р и м е р 11. Хлоргидрат лучают 5, г светло-желтого кристал-3- l-(циклспропилметил) 1,2,3,6-тетлов1целевого продукта, плавящегосярагидропиридин- -ил 1Н-индола. при ..Стадия А: 5-хлор 3 11-СциклопроВычислено,; С 61, Н 6,47;пилметил) 1,2, 3,6-тетрагидропиридин01 22,78; N 8,99- -it-ил 1Н-индол. CffcHjoCliN : М.в. 311,256.К раствору 12,5 г 5-хлор-ЗНайдено,: С 61,6; Н 6,5; С1 22,7;-(1 ,2,3,6-твтрагидропиридин- -ил) 1НN 8,8.-индола в 120 мл безводного диметил- ; Исходный 5-хлор 3-(1,2,3,6-тетра-формамида прибавляют 11,5 г карбонагидропиридин- -ил) 1Н-ИНДОЛ можетта натрия и 6,5 мл хлорметилциклопробыть получен по известному способу.пана, смесь перемешивают 2k ч при П р и м е р.10. Хлоргидрат 5-хлор-70 С в инертном газе, охлаждают до 3-(1-этил-1,2,3,6-тетрагидр6пиридин-30 С, прибавляют 300 мл воды (дистил- -ил) 1Н-индола. . °лированной), при перемешивании охлажСтадия А: 5-хлор 3-(1-этил-,дая при помощи бани с ледяной, водой. -1,2,3,6-твтерагидропиридин-4-ил)Выпавший осадок перемешивают 5 мин, 1Н-ИНДОЛ.вьиерживают 15 мин, кристаллы фильтПри комнатной температуре в инерт-руют в вакууме, промывают раза ной атяосфере перемешивают в течение дисталлированной водой, 20 мл 50%-ного 6ч 30 мин 12 г 5-хлор-3-(1,2,3,6-тет-водного раствора этанола, сушат в варагидропиридин- -ил) 1Н-индола вкууме при 50°С в присутствии обезво120 мл безводного диметилформамидаживающего средства, собирают 13,5 г 13 сырого продукта, который заново раст воряют, нагревая с обратным холодиль ником в 350 мл этанола, фильтруют, концентрируют до 300 мл, кристаллизируют при комнатной температуре, за тем оставляют 1 ч 30 мин в холодильном шкафу, фильтруют под вакуумом, промывают этанолом, сушат в вакууме и получают г целевого продукта, плавящегося при . Стадия Б: Хлоргидрат 5-хлор -(циклопропилметил)-1,2,3,6-тетрагид ропиридин7 -илЗ 1Н-индола. К суспензии г полученного в предыдущей стадии продукта в 80 мл охлажденного на бане с ледяной водой этанола, прибавляют этанольный растт вор нее до рН 1, перемешивают 1 ч, полученный осадок отстаивают 15 мин, кристаллы фильтруют в вакууме, промывают этанолом, сушат под уменьшенным давлением,перекристаллизуют из этанола и получают 6,9 г чистого целевого хлоргидрата, плавящегося при 2Ц2-2ЦЦ С.. Вычислено,: С 63,.16; Н 6,23; С1 21,93;, N 8,66. 323,268, Найдено,: С 63,3; Н 6,2; С1 22,2 N 8,6. П р и м 6 р 12. Хлоргидрат 6-метокси 2-метил-З-И-пропил 1,2,3,6-тетрагидропиридин-А-ил) 1Н-индола. Стадия А: 6-метокси 2-метил-З-(1-пропил 1,2,3,6-тeтpaгидpюпиpидин- -ил) 1Н-ИНДОЛ. В атмосфере азота при смешит вают 10,3 г хлоргидрита 6-метокси 2-метил-З-(1,2,3,6-тетрагидропиридин-t-ил) 1 Н-индала с 11, г карбоната натрия, 103 мл диметилформамида и t,82 мл 1 пропилиодида, по истечении k ч 30 мин реакционную смесь вылива- ют при перемешивании в воду, экстрагируют полученную смолу этиловым эфиром уксусной кислоты, промывают водой, а затем соленой водой, сушат, упаривают досуха, 10,1 т полученной смолы разбавляют 50 мл этанола, кристаллизуют таким образом продукт, перемешивают 5 мин при комнатной темпе ратуре, охлаждают 30 мин при перемешивании, оставляют в покое 30 мин. кристаллы отсасывают, промывают этач НОЛОМ и эфиром и получают 7,8 г основанир целевого продукта, плавящегося при 90-95 С. 12It Стадия Б: хлоргидрат Зметокси-2-метил-3-(1-пропил-1,2,3,6-тетрагцдропиридин- -игО 1Н-индола. 9J г основания, полученного в предыдущей стадии, растворяют в 70мл изопропанола, раствор фильтруют, охлаждают, прибавляют насыценный сухим НС& изопропанол, выпавшие кристаллы перемешивают 30 мин, дают отстояться 30 мин, отсасывают в вакууме при комнатной температуре, промывают изопропаНОЛОМ, собирают 8,73 г целевого хлоргидрата, плавящегося выше 260 d очищают перекристаллизацией в мета ноле и получают Ц,Ц г целевого чистого продукта, плавящегося при 275С. Вычислено,: С 67,37; Н 7,85; С1 11,00; N 8,73. QgH g ClNjO. М.в. 320,87. Найдено,; С 67,2; Н 8,00; С1 11,00; N 8,6. Хлоргидрат 6-метокси-2-метил-3 (1,2,3,6 тетрагидропирцдиц- -ил) 1Н-индола может быть получен следующим образом. При в инертной атмосфере перемешивают 2 г 6-мeтoкcи-2-мeтил-1H-индола с г гидрата хлоргидрата 4-пиг еридона в40мл укЬусной кислоты.По истет) чении 1 ч ЗОмин смесь охлаждают,выливают на 150 г льда и 80 мл чистого гидрата окиси аммония в 22 Бе, экстрагируют этиловым эфиром уксусной кислоты, промывают водой, сушат над сернокислым магнием, перегоняют досуха в вакууме, полученный остаток помещают в этиловый эфир уксусной кислоты, нагревают до кипения, охлаждают, И.выпавшие кристаллы промывают этиловым эфиром уксусной кислоты, сушат в вакууме .и получают 2,5 г сырого продукта. Получение хлоргидрата. Полученный продукт растворяют в 50 мл горячего изопропанола, охлаждают, прибавляют по каплям раствор ra-i зообразного НИ в изопропаноле до кислотного рН, бросают затравку для кристаллизации. По истечении одной ночи кристаллы промывают изопропанолом, сушат в вакууме и получают 2,25 г целевого продукта, плавящегося при . Вычислено,%: С 6k,S2; Н 6,87; 01 12,72; N 10,05. Найдено,: О 6,5; Н 7,0; С1 13,0; N 9,. Предхюженные соединени:я или их соли с кислотами обладают противодепрессивным и нейролеИТическим свойствани а также противорвотным действием. Формула изобретения 9368 , атома углерода, если Х - бензил, то/по крайней из Заместителей R, R или R не является водородом, или их солей с кислотами, о т л и - . чающийся тем, что соединение общей формулы t








Авторы
Даты
1982-06-15—Публикация
1979-01-15—Подача