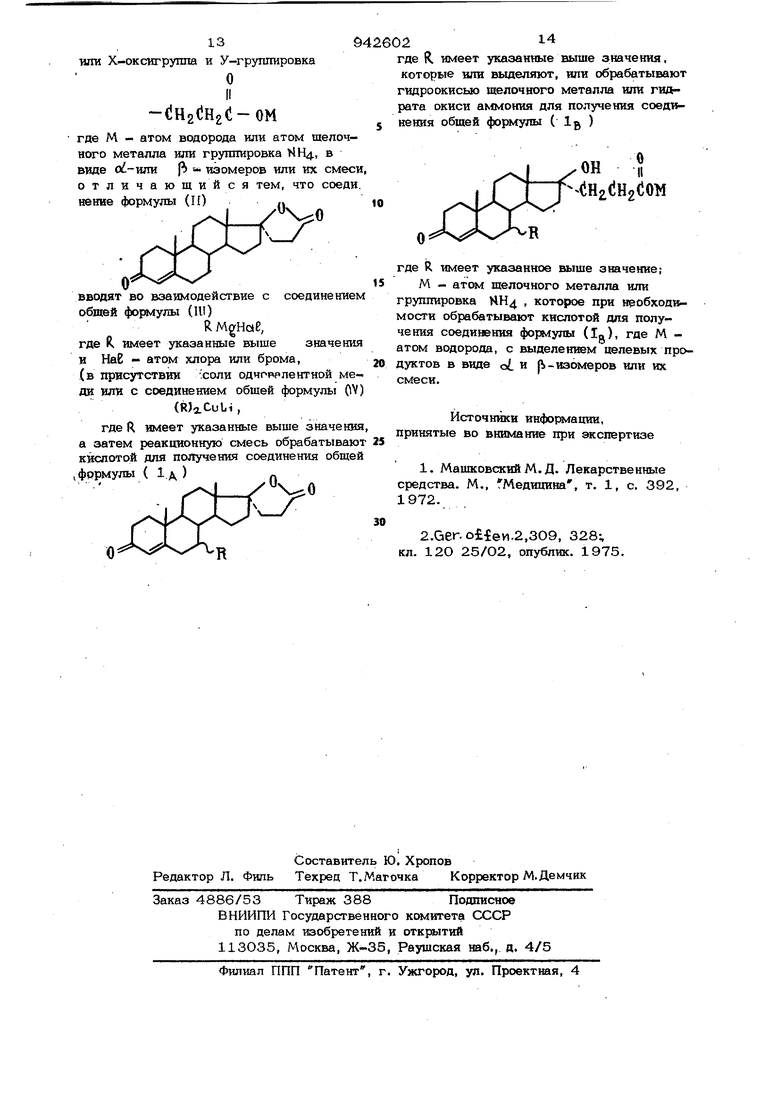
шат и упаривают досуха. Полученный кристаллический остаток хроматографируют на двуокиси кремния, используя смесь цикпогексан/этиповый эфар уксуоной кислоты (3:2). Вьщел1аот последоватепьно:6,3 г d -изомера целевого продукта, плавящегося при , точка плавления не изменяется после перекристаллизации продукта в метаноле, +67+1, хлороформ),3.2г и-изомера целевого продукта, плавящегося при 150 С, а затем при .170°С. Аналитический образец полу;чают перекристаллизацией из метанола. Т. пл. 155°С, а затем 172С после отвердеваИИЯ.,5+1,5 ° (1%, хлороформ). Пример 2. Г-/ актон-7ск -пропил-17 )-окси-3-оксо-17о6-прегв-4-ен21-карбоновой кислоты. К полученному при перемешивании при комнатной температуре комплексу из 382 мг моноиодида меди и 0,7см суль фида и-бутила прибавляют раствор 5,1 .канренона (или 3:--лактони-17(%-окси3-оксо-17о.-прегна-4,6 ,-диен-21-карбоновой кислоты) в 75 см безводного тет рагидрофурава и 5О см безводного этило вого эфира. Охлаждают смесь до - и при интенсивном перемешивании приба& ляют в течение 35 мин 1,2 М эфирный раствор прошшмагнийбромида. По истечении добавочных 1О мин перемешивания. , при - реакционную смесь подкисяя- ют, добавляя 5О см 5 н. раствора соля йой КИСЛОТЫ, Перемешивают ЗО мин при комнатной температуре, а затем экстрагируют этиловым эфиром уксусной киспо ты. Органический слой прс « 1вают &одой, 0,2 н. раствором тиосульфата натрия и в Дои, высушивают сульфатом натрия и упаривают досуха. Остаток хроматографируют на двуокиси кремния, используя смесь бешол - этиловый эфир (№:4). Выдел5аот последовательно: 3.3г кристаллического сС -изомера иелевого продукта, 1.4г аморфного ft -изомера целев го продукта. Аналитический образец целевого продукта (7с -пропипьное производное) ш лучают перекристаллизацией из метанола, т. пп. 20SPcC rf3i5M-70+l,5° (1%, хпоро..форм).3 Примерз. Калиевая соль пвл-17 окс -3-оксо-17oL-пpeгн-4-eн21-кapбoнoвoй кислоты, 1,.5 Г полученвого в примере 2 соединения, 5,4 см 0,53 н. раствора едкого кали в этаноле и 5,4 см воды нагре fe вают до кипеюш с обратным холодильйиком в течение 15 мин, а затем уларИ . вают до малого объема при пониженном давлении до получения густого желтого сиропа. После прибавления 5О см ацетона отфильтровывают кристаллический оса док, прсичывают его ацетоном и сушат . при , после чего перекристаллизовь вают из 1,3 см воды .с добавлением 19,5 см ацетона. Получают 1 г целево- . го продукта в виде моногидрата. Т. пл. около 29CPC,WJ3,+48±1,5 (1%, вода). Пример 4. Т-лактон 7af.-6yтил 17р-окси-3-оксо-17 -прег -4-е 21-карбоновоЙ кислоты. К 191 мг моноиодида меди приливают при перемешивании О,35 см сульфида ц -бутила, полученный комплекс растворяют в 35 см безводного тетрагидрофурана и прибавляют 1,7 г канренона (или J -лактона 17 -окси-3-оксо- . 17oL -прегна-4,6-диен-21 -карбоновой кислоты). Полученный раствор перемешивают на ледяной бане и к нему прибавляют в течение ЗО мин. 7,5 см1,2 М раствора бутилмагнийбромида в этиловом эфире. .Через ЗО мин реакционную смесь подкисляют, используя большой избыток 5 н. раствора соляной кислоты и обрабатывают в соответствии с примером 2. Хроматографией на двуокиси кремния, используя смесь Ш1клогексан/этиловый эфир уксусной кислоты (3:2), выделяют последовательно: кристаллический Q/,-изомер, который растирают в изопротшовом э(|я1ре, отфильтровывают в шдсушивают на воздухе, получают 1,12 г щродукта, т. пп. 147°С. Аналитический образец после перекриста1 лизации из метанола плавится при 149С., + l (1%, хлороформ), 0,65 г аморфного . П р н М е р 5. Калвевая соль 7 тил-17 ft -окс1ь Зчюксо-17 о6.-«регн-4-е№21-карбовсшо& кяспоты. В течешю 15 мвв нагревают до кипения с обратвым холодвпьниксм 1,19 г полученного в щшмере 4 соединения, 5,4 см О,53 в. створа едкого в этаноле и 5,4 см врды, а затем реакционную смесь ковиевтрируют в вакууме до получения светло-желтого густого сирота. После добавпевия 5О см ацетона калиев ш сол кристаллизуется в виде тонких игол. Кристаллы отфильтровывают. 794 промывают ацетоном, сушат при 50°С и затем перекристалУшзовываюг, растворяя в 3 см ацетона, содержащего 5О% Ьбды, и добавляя 28,5 см ацетона. Получают 1,13 г целевого продукта в рнде дигидрата. Т. пл. около 36,5 + 1, (1%, вода). П р и м 8 р б. Зг -лактон 7а/-(2-метилпропил)- / -окси-3-оксо-17а -прегн4-ен 21-карбоновой кислоты, Комплекс, полученный из 135 мг моноиодидо меди и 0,25 см сульфида И -бутила, растворяют в 15 см безводног о тетрагидрофурана и прибавляют 680 мг KBHpeHotia (или -ла кто на i7p окси--3-.Ьксо-17ос-прегна-4,6-диен-21карбонрвой кислоты). Раствор охлаждают до - , при интенсивном перемешивании к нему прибавляют по каплям в течение 2О мин 4,3 ,7 М раствора изобутилмагнийбромида в этиловом эфире. После окончания добавления реакционную смесь леремешивают 15 мин лри -30 С, Затем образовавшуюся суспензию подкисляют большим избытком 2 н. раствора соляной кислоты, перемешивают в течение ЗО мин при комнатной температуре, а затем экстрагируют этиловым эфиром yкcycнoй кислоты. Экстракты промывают водой, высушивают и упаривают досуха, Остаток хроматографируют на двуокиси кремния, используя смесь бензол-этиловыГ эфир (1:9), Выделяют последовательно: 450 мг об-изомера, который перекристаллизовывают из 1 см.метанола, получают 320 мг сольватированных с . 0,5 моль метанола кристаллов целевого продукта, плавящегося при , после десольватации т. пл, около 10O°C;{piJ +63+1,5°(1%, хлороформ). 310 мг 5-изомера, продукт перекристаллизовывают из смеси хлористого метилена и изопропиловрго эфира и получают 230 мг продукта, т, пл, 218°C-,o6j 4-79 +1,5 (1%, хлороформ),, , П р и М е,р 7.-лактон 7 -этенил-1 -17 окси-3-оксо/17с /-4-прегнен-21-карбоновой кислоты,. , . При комнатной температуре перемешиваюг 2,1 г моноиодида меди и 5,6 см сульфида и бутила, а затем образовавшийся комплекс добавляют к раствору 10 г канренона(или -лактона-17/ -окси 3-оксс.17о -прегна-4,6-дие -21-карбоновой кислоты) в 200 см безводного те рагвдрофу1эа ш. Полученный раствор охлаждают до - 20 С и к нему прибавляют по 2 .8 каплям в течение 80 мин при ичтенсивном перемешивании 44 смн. раствора винилмагнийхлорида в тетрагидрофуране. После окЬнчания прибавления перемешивание продолжают при - еще 60 мин, а затем реакционную смесь подкисляют с помощью 45 см н. раствора соляной кислоты. Перемешивают 90 мин . при комнатной температуре и экстрагируют этиловым эфиром уксусной кислоты, Органический слой промывают водой, 0,2 М раствором тиосульфата натрия, высушивают , упаривают досуха. Оставшееся масло хромат ографируют на двуокиси кремния, используя смесь циклогексан/этиловый эфир уксусной кислоты (1:1). Выделяют последовательно: 2,9 г целевого изомера, плавящегося при 199 С после перекристаллизации изо- бутилового эфира уксусной кислоты, а затем из этанола при 75°С;1о1 +17,5 + +1,5°(1%, хлороформ), 3,5 г Р -изомера, обладающего трои ной точкой плавления: около 100, затем 142 и 161°С после перекристаллизации из смеси хлористый метилен/изопропиловый эфир, П ри Ы е р 8, J -лактон 7а,-(2пропенил)-17 |Ь-oкcи-3-oкco-17o6-пpeгнf4-ен-21-карбоновой кислоты, а) Получение растворимого комплекса бис-(сульфид Н -бутила)-моноиодид меди, При комнатной.температуре перемешивают 475 мг моноиодида меди с 0,875 см сульфида н -бутила. Слегка экзотермическое растворение одновалент-. ной меди заканчивается через 10 мин, Полученный комплекс {желто-ошнжевая жидкость) растворяют в 10 см- безводного этилового эфира, б) Получение ди-аллилкупрата лмтия, К раствору 1,95 г Трифенилаллилолоза в 15 см безводного этилового эфира при перемешивании прибавляют 2,85 см 1,75 М раствора фенил лития в смеси . бензол этиловый эфир (7:3). Немедленно образуется обильный белый осадок тетрафенилолова. Реакционную смесь перемешивают затем охлаждают до о прибавляют к ней в течение 10 мин полученного выше комплекса и продолжают перемешива „ Получают раствор диаллилкупрата лития, содержащий тетрафеJ OBO в виде суспензии, реакция со стероидом, К полученной выше смеси прибавляют раствор 680 мг канренона (или - -лактона i 7 i -.окси-З-оксо-l 7д -прегна-4,6 диен-21-карбоновой кислоты) в 25 ол безводного тетрагидрофурана. После пере мешивания в течение 90 мин. при реакционную смесь подкисляют прибавлением 15 см 2 н. раствора соляной кислоты и продолжают перемешивание при комнатной температуре в течение 2 Тетрафешшолово отделяют фильтрованием, орга1гаческий слой отделяют, промывают водой, высушивают и упаривают досуха. Остаток хроматографируют на . двуок 1си кремния, используя смесь хлороформ/этиловый эфир уксусной кислоты (95:5). Выделяют 408 мг целевого соединения, плавяшегося при , а затем при 194С после повторного отвердевания. Аналитический образец получают после перекристаллизации из . метанола, т. пл. 196°С,с +113+3° (О,7%, хлороформ). П р и м е р 9. З-лактон 7й« -циклопропилметил-17 р -окси-З-оксо-17aL -пре 4-ен-21-карбоновой кислоты. К 3 г магниевых стружек приливают 25 см эфира, а затем при перемеш шашга добавляют около 10 см раствора 9,05 г хлорметилдиклопропана в 75 см эфира. После начала реакции при кипении с обратным холодильником добавляют оотаток указанного выше раствора в течение 4О мин. Кипячение с обратным холодильником . лродолжают при перемешива нии в течение 30 мин, а затем остав ляют при комнатной температуре. Получают комплексиз 135 мг монохлорвда меди .i 85 мг хлорида лития в. 35 см тетрагидрофурана. К раствору данного комплекса прибавляют 1,7 г канренона, а затем охлаждают после растворения стероида до , в течение 30 мин при перемеишва нии добавляют 14,2 см вышеполуче ного магнийорганического раствора, продолжают перемешивание в течение 15 ми при - , а затем реакционную смесь 15 см 5 н, раствора соляной кислоты. Дают температуре смеси подняться до К(Ж1натной и экстрагируют ее этиловым эфиром уксусной кислоты. Органический слой промывают водой, насыщенным водным раствором хлорида натрия, высушивают и упаривают досуха. Остаток хроматографируют на двуокиси кремния, элю руя смесью эфир/бензол (75:25). Выдал яют: 1,25 г целевого oi-изомера, которы перекристаллизовывают из изопропанола или этилового эфира .уксусной кислоты, т. пл. 180°C,CotJjj H-5e+l,5(l%, хлороформ). Вычислено %: С 78,74;Н 9,15 (396,57) Найдено, %: С 78,9, Н 9,0 0,5 г р-изомера, который перекристалпизовывают из изопропанола,. т. пл. 132С. +64+1,5(1%, хлороформ). Вычислено, %: С 78,74, Н 9,15 С (396,57) Найдено, %: С 78,5, Н 9,0.., Приме р 1О. Калиевая соль 7cf-циклопрошшметил- 7р-окси-З-оксо-17ai прегн-4-ен-21карбоновой кислоты. К 2 г полученного в примере 9 7« изомера прибавляют 7 см воды и 3,5 см 1,38 н. этанолового раствора едкого кали. На гревают с обратным холодильником в течение ЗО мин, а затем упаривают досуха. К остатку прибавляют ацетон, отсасывают, промывают ацетоном и сушат полученный продукт. Получают 2,2 г целевого POflyKTa,Co(.J j) +39-l°(l%, вода) Вычислено. %: С 65,72, Н 8,38 .)K.i,25 нр Найдено,%: С 65,7, Н 8,3 ено, %: С 65,7, Н 8 П р и м е р 11. gf-лактон 7с -фенилметил-17/ -окси-3-оксо-1 7о1-прегн-4ен-21-карбоновой кислоты. 135 мл дихлорвда меди и 84 мг хлорида лития перемешивают в 5 см тетрагидрофурана, прибавляют раствор 1,7 г канренона в 30 см тетрагидрофурана, реакционную смесь охлаждают до О°С и к ней прибавляют в течение 40 мин 14,3 см0,7 М раствора бензилмагнийбромида в Э(|яфе , Затем реакционную смесь подкисляют 1О см 5 н. раствора соляной кислоты, перемешивают в течение 1 ч при комнатной температуре, разбавляют водой и экстрагируют этиловым эфиром уксусной кислоты. Органический слой промывают водой и насыщенным водным раствором хлорида натрия, высушивают и упаривают досуха. Остаток хроматографируют на двуокиси кремния, элюируя смесью бензол/этиловый эфир уксусной кислоты (7О:ЗО), и получают; 1,2 г целевого at -изомера, который перекристаллизовывают из метилэтилке тона, т. пп. 258°С,И +2,5±1(1%, хлороформ). од 5 г i -изомера, который перекристалпизовывают из этанола, т. пл. 220°С. Проводят фармакологическое исследова ние лактона аТ/ -окси-З-оксс -Тсб-пропил- 7oil-nperH-4-енн21--карбоновой ки лоты (продукт А), калиевой соли 17/5 OKC f -oKco-7ot-npomoi-17oL-nperH-4ен-21-карбоновой кислоты (продукт Б) и их известного гомолога --лактона 1 7 р -окси-3 оксо-7 oi-метил-17 зС-прег№ 4-е -21-«арбоновой кислоты (продукт С Для изучения антиальдостероновой активности у крыс самцов удаляют надпочечники за семь дней до диуреза, и животных оставляпют натощак ш 17 ч до диуреза. Исследуемые продукты вводят перорально за один час до диуреза. В момент диуреза животным вводят внутрибрюшинно физиологический .вод . ный раствор хлористого натрия в количес ве 5 мл (ва 1 крысу) и подкожно 1 мкг/кг 2,5%-ного спиртового раствора моноапетата альдостерона. Через 4 ч после принудительного диуреза устанавливают содержание в моче натрия и калия на плазменном, фотометре автоматического анализатора. Полученные результаты, выраженные процентах торможения антиальдостероново активности 1 мкг моноацетата альдостер на, введенного под кожу на кг веса (на логарифм отношения: концентрация натрия концентрошя калия) даны в таблице. Как вшно из таблицы, при дозе в 2 мг/кг, введанной перорально, продукт А оказывается более активен, чем продукт С, продукт В при дозе в О,4 мг/кг дает 58% торможения антиальдостероново активности,- значительно превышая тем са мым аналогичный показатель соединения С. Для изучения андрогенной активности -простату, взятую из кастрированных на 24 ч раньлпе крыс самцов, гомогениз1&руют в буферном -растворе следующего состава: триметамин 1О мл моль, сахароза 0,25 М, НСерН 7,4, после чего центрифугируют при 105 000 в течение одного часа. Суперкатант в определенной кондеитра шш,содержащий третий Т, 17р-окси17о6- етилэстра.-4,9,11-триен 3-он (называемый далее R) с третием Т, подвергают инкубашш при течение 2 ч в присутствии или в отсутствии увеличивающейся концентрации R, не соде{ жашего третий Т, тестостерона или изучаемого продукта. По истечении двух часов определяют радиоактивность,содержащего радиоактиьНомеченный третий Т, связанный с акцептором . Относительное средство изучаемого продукта или ARL определяют по формуле IARl.lOO)fCTJCX, U), где СТ - концентрация холодного тестостерона (без третия Т), которая тормозит на 50% связывание R с третием Т; СХ - концентрация изучаемого продук та, которая тормозит на 5О% связывание R с третием Т. 1 Получены следующие результаты: ПродуктА RL Тестостерон100 Продукт АО,4Продукт В.0,2 Продукт С28 Продукт А практически лишен сродства по отношению к простатическому акцептору тестостерона, тогда как продукт С обла,, дает по отношению к нему довольно значительным сродством . Продукт В дает значение А R Ц, равное 0,2, т. е. проявляет еще более низкое сродство по отношению к простатическому акцептору тестостерона. Формула изобретения Способ получения 7с -алкилпроизводных стероидов обшей формулы (1) где R - в положении с или .р алкил или алкенил с 2-8 атомами углерода, цкклоалкилалкил с 4-8 атомами углерода или арилалклл с 7-12 атсмамп углерода и/или X и У группировка .0. wra Х-оксигруппа и У-гругагаровка (1Н2(Н2(1-ОМ где М - атом водорода или атом щелочного металла или грушгировка 1Н4.. в виде ( - изомеров или их смеси, отличающийся тем, что соеди. некие формулы (И) Q - ВВОДЯТ во взаимодействие с соединением обшей формулы (III) RMgHae, где R. имеет указанные выше значения и Наб - атом хлора или брома, (в присутствии холи одчрррлентной меди или с соединением обшей формулы 0) (WiCuLi , где R имеет указанные выше значения а затем реакционную смесь обрабатывают кислотой для получения соединения общей формулы ( 1 А. ) 94 2 где R. имеет указанные выше значения, которые или вьвделяют, или обрабатывают гидроокисью щелочного металла или гидрата окиси аммония для получения соединения общей формулы ( Ig ) 1 xQH « . Г T- iiH dHoCoM /ii 0# 4sAsX R где R имеет указанное выще значение; М - атом щелочного металла или группировка ЫН4. , которое при необходимости обрабатывают кислотой для получения соединения формулы (Ig), где М атом водорода, с выделением целевых продуктов в виде oi и PI-изомеров или их смеси. Источники информации, принятые во внимание при экспертизе 1. МашковскийМ.Д. Лекарственные средства. М., Медицина , т. 1, с. 392, 1972. 2.Ger. еи.2,ЗО9, 328; кл. 12О 25/О2, опублик. 1975.







Авторы
Даты
1982-07-07—Публикация
1980-02-29—Подача