1130131
Изобретение относится к способу получения новых производных стероидов 3-кето-Л -стероидов, замещенных в положении 7, общей формулы
(1)
О- - - RI
R, - С,-С4-алкил;
X и Y вместе группа (
а
О
X - радикал гидроксил;
Y - радикал ,
где Me - атом водорода или атом щелочного металла, причем заместитель R, находится в oi-положении, обладающих антиальдостероновой и антиандрогенной активностью.
Цель изобретения - получение Новых стероидных соединений, обладающих преимуществами в фармакологическом отношении перед известными структурными аналогами.
Пример I.у -Лактон 17 -гид рокси 7 ci-пропил-3-оксо 17oi -прегна- -1,4-диен 21-карбоновой кислоты.
Растворяют в инертной атмосфере 2 г у -лактона 1 7 а,-гидрокси 7ui -про- пил-З.-оксо I 7о(: -прегн-4-ен 21-карбоновой кислоты и 1,44 г 2,3-дихлор- -5,6-дициано 1,4-бензохинона в IО см диоксана. Перемешивают с обратным хо лодильником в течение 1 ч 45 мин. Охлаждают льдом Ю мин, отсасывают осадок, прополаскивают его диоксаном
Органический слой промьшают 10%- ным водным раствором тиосульфата натрия, а затем 1 н. раствором гидрата окиси аммония. Промьшные воды зано- во экстрагируют,этиловым эфиром уксусной кислоты, сушат соединенные органические слои и отгоняют досуха под уменьшенным давлением. Получают 2,8 г сырого продукта, который хрома тографируют на двуокиси кремния, элю ируя смесью бензол - этиловый эфир уксусной кислоты.
Собирают 1,4 г продукта, который кристаллизуют в 5 см этилового эфи- ра и отсасывают.
Получают 1,3 г продукта, который можно перекристаллизовать в изопро- паноле. Т.пл. 202 С.
0131
10
t5
20
35
25-
т
45 -50 -
55
40
7 .2
Вычислено, %: С 78,49; Н 8,96.
382,52.
Найдено, %: С 78,6; Н 9,1.
Вращательная способность +312 (k 0,8% в хлороформе).
Пример 2.У -Лактон -(3- -хлорпропил) 17 rt-гидрокси 3-оксо I 7 об -прегна-1 ,4-диен 21 -карбоновой кислоты.
Растворяют в инертной атмосфере 3,5 г у -лактона 7( -(3-хлорпропил) 1 7 В-гидрокси 3-оксо 1 7с(,-прегн-4-ен 21-карбоновой кислоты и 2,3 г 2,3-ди- хлор-5,6-дициано 1,4-бензрхинона в 17,5 см диоксана .
Перемешивают с обратным холодильником в течение 3 ч, затем охлаждают льдом в течение 10 мин, отсасывают осадок, прополаскивают диоксаном и разбавляют фильтрат 30 см эти- лового эфира уксусной кислоты.
Промывают органический слой 10%- ным водным раствором тиосульфата нат рия, а затем 0,5 н. раствором гидрата окиси аммония. Заново экстрагируют этиловым эфиром уксусной кислоты, сушат, отфильтровывают и отгоняют досуха под уменьшенным давлением.
Получают 4,7 г продукта, которьй хроматографируют на двуокиси кремния, элюируя смесью бензол - этиловый эфир уксусной кислоты (8:2).,Собирают 2,4 г масла, которое кристаллизуют в 5 см этилового эфира.
Получают 2,3 г продукта (т.пл. 196 с), который можно перекристаллизовать в изопропаноле для получения 1,9 г чистого продукта. Т.пл. 196°С.
Вычислено, %: С 72,01; Н 7,98; С1 8,50.
С.5Н„С10з 416,97.
Найдено, %: С 72,0; Н 8,1; С1 8,7.
Вращательная способность +4 t 1,5 ° (k 0,8% в CHClj).
Пример З.у -Лактон 7oi -(бут- -3-енил) 17 Ь-гидрокси 3-оксо 1 7с6 - -прегна-1,4-диен 21-карбоновой кислоты.
Растворяют в инертной атмосфере 4,7 г -лактона (бут-3-енил) 17 -гидрокси 3-оксо 17об-прегн-4-ен 21-карбоновой кислоты и 3,5 г 2,3-ди- хлор-5,6-дициано 1,4-бензохинона в 23,5 см диоксана. Перемешивают с обратным холодильником в течение
3130
2 ч 30 мин, охлаждают льдом, отсасывают осадок, прополаскивают его диок- саном.
Разбавляют фильтрат 30 см этилового эфира уксусной кислоты, промыва- ют 10%-ным водным раствором тиосульфата натрия, затем 0,5 и. раствором, гидрата окиси аммония, а затем водой Экстрагируют этиловым эфиром уксусной кислоты, сушат, фильтруют и пе- регоняют под уменьшенным давлением. Получают 5,2 г масла, которое хрома- тографируют на двуокиси кремния, элю- ируя смесью бензол - этиловый эфир уксусной-кислоты (8:2). Собирают 1,8 г продукта, который кристаллизуют в эфире.
Получают 1,7 г целевого продукта. Т.пл. 197°С.
Вычислено, %: С 79,15; Н 8,69. С,бН,Оз 394,53 Найдено, %: С 79,3; Н 8,8. Вращательная способность сб Зр -7 ± l (k 0,9% в CHCl ).
Пример 4. Соль калия 17 ft - -гидрокси 3-оксо 7 об-пропил прегна-1,4-диен 21-карбоновой кислоты.
2 г полученного в примере 1 у -лак тона -гидрокси 7oi-пропил 3-оксо 17сб-прегна-1,4-диен 21-карбоновой кислоты вводят в суспензию в 11,2 см 0,45 и. этанолового раствора едкого кали и 11,2 см воды. Нагревают с обратным холодильником 15 мин, пе- регоняют досуха под уменьшенным давлением и прибавляют 50 см ацетона. Охлаждают льдом и отсасывают целевой продукт.
о
Получают 2 г продукта. . 280 С
Этот продукт растворяется в теплой смеси вода - ацетон (1:1). Фильтруют, прибавляют 70 см ацетона, леденят и отсасывают.
Получают 1,7 г целевой соли калия в виде моногидрата. Т.пл. 280 С. Вычислено, %: С 68,45; Н 8,04.
С 5К„К04 438,63 (продукт, высушенный при 100 С).
Найдено, %: С 68,2; Н 8,0.
Вычислено, С 65,75; Н 8,17.
,дК04 iHjC (невысугаенный).
Найдено, %: С 65,5; Н 8,2.
Вращательная способность cijjj -20 ± 1° (k 1% в воде).
Пример 5. Соль калия 7об - (3 -хлорпропил) 1 7/3 -гидрокси 3-оксо
74
1 7 oi -прегна-1 ,4-диен 21-карбоновой кислоты.
Действуя, как указано в примере но исходя из 0,84 г полученного в пмере 2 продукта, получают 0,62 г целевого продукта. Т.пл. 230 С.
Вычислено, %: С 60,29; Н 7,43; С1 7,12.
473,094 (сольват в 5% воды)
Найдено, %: С 60,4; Н 7,0; С1 7,2.
К.Фишер: 4,7-5,2% воды.
Вращательная способность -22,5± 1,5° (k 1,1% в воде).
Пример 6. Соль калия 7oi:, - - (бут-3-энил)I7 -гидрокси 3-оксо 17oi -прегна-1 ,4-диен 21-карбоновой кислоты.
Действуя, как указано в примере но исходя из 1,16 г полученного в примере 3 продукта, получают 0.634 г целевого продукта. Т.пл. 2г 270 С.
Вычислено, %: С 67,93; Н 7,89.
С2бН,5К04 1/2 459,65
Найдено, %: С 67,6; Н 7,8.
К.Фишер: 1,9-2,1% воды.
Вращательная способность ctl -32il ° (k 1% в воде).
Пример 7,у-Лактон 17 А-гидокси 7 oi-пропил 3-оксо 17 of. -прегна- -1,4-диен 21-карбоновой кислоты.
1€ ,г у-лактона 17 ft-гидрокси-7- -ci-пропил 3-оксо 1 7( -прегн-4-ен 21-карбоновой кислоты вводят в суспензию в инертной атмосфере в 60,5 метанолового раствора едкого калия и 60,5 см воды. Нагревают с обратным холодильником в течение 15 мин и получают раствор соли калия (раствор А). Отдельно готовят буферный раствор, содержащий 13,6 г первичного фосфата натрия в 1,9л воды. Прибавляют 60 см 1 н. раствора едкого натра и доводят рН до 7,2 прибавкой 6,1 см 1 н. раствора едкого натра (раствор В).
Смешивают 1,5 л раствора В с расвором А, а затем прибавляют 50 мг 2-метил-1,4-нафтохинона, 100 см ферментативной мази Arthrobacter simplex и 10 г гифлосуперцела.
Суспензию перемешивгиот под барбо тированием воздуха в течение 24 ч при 33 4 1°С.
Затем подкисляют при помощи . 100 см 5 н. соляной кислоты и перемешивают 30 мин при комнатной тем513
пературе. Прибавляют 400 см этилового эфира уксусной кислоты, перемешивают 15 мин, фильтруют на гифлосу перцеле и прополаскивают этиловым эфиром уксусной кислоты.
Декантируют фильтрат, промывают I0%-ным водным раствором тиосульфата натрия, затем водным раствором бикарбоната натрия, а затем водой. Заново экстрагируют этиловым эфиром уксусной кислоты, сушат, фильтруют и отгоняют досуха под уменьшенным давлением. Получают 9,5 г целевого продукта.
Осадок гифлосуперцела вводится з
л
НОВО в суспензию в 150 см метанола в течение 30 мин при перемешивании. Отфильтровывают, концентрируют фильтрат под уменьшенным давлением, разбавляют водой и экстрагируют эти ловым эфиром уксусной кислоты. Сушат, фильтруют и получают 0,6 г целевого продукта. Кован экстракция гифлосуперцела смесью хлористый метилен - метанол (1:1) позволяет ре- куперировать 140 мг продукта.
Соединяют три партии {т.,е. 10,2 г растворяют их в 300 см этилового эфира уксусной кислоты при 50 С и прибавляют 41,5 г активированного угля. Перемешивают 5 мин и отфильтровывают на гифлосуперцеле. Отгоняю фильтрат досуха под уменьшенным давлением.
3
Забирают кристаллы в 25 см изопропилового эфира, отсасывают и собирают 9,6 г чистого продукта. Т.пл 202°С.
Продукт идентичен продукту при- мера 1.
Пример 8. у-Лактон 17р-гид окси 7об-пропил 3-оксо 17od -прегна- -1,4-диен 21-карбоновой кислоты.
1 г -лактона 1 7 /3 -гидрокси 7 - -пропил 3-оксо 17-о(,-прегн-4-ен 21- -карбоновой кислоты в 10 см безводного толуола и 1,1 селенового ангидрида в бензоле нагревают при 100 С в инертной атмосфере. После 1 ч пер мешивания полученный раствор разбавляют 30 см этилового эфира уксусной кислоты, промывают водой и водным раствором бикарбоната натрия. Заново экстрагируют водные слои этиловым эфиром уксусной кислоты, сушат, фильтруют и перегоняют досуха под уменьшенным давлением. Получают 1,25 г масла которое хро
матографируют на двуокиси кремния,, элюируя смесью бензол - этиловый эфир уксусной кислоты (8:2). Получают 850 мг целевого продукта. Т.пл. 202°С.
Продукт идентичен продукту примера 1 .
Пример 9.у -Лактон 7а:, -бутил 1 7 А-гидрокси 3-оксо 17 об -прегна- 1,4-диен 21-карбоновой кислоты.
Действуя, как указано в примере 7, но исходя из 2 г у-лактона 7с -бутил 1 7/ -гидрокси 3-оксо-1 7а;-прегн- 4-ен 2i-карбоновой кислоты получают 1,6 г целевого продукта (чистого) Т.пл. 183°С.
Вычислено, %: С 78,74; Н 9,15.
396,5
Найдено, %: С 79,0; Н 9,3.
Вращательная способность l. - -9,5t2° (k 0,7% в СНСЦ).
Пример 10. у -Лактон 7с6-(2- метилпропил) I 7 (Ь-гидрокси 3-оксо- 17Qi -прегна-1,4-диен 21-карбоновой кислоты.
Действуют, как указано в примере 7, но исходя из 1 г у-лактона 7ft;-(2- метилпропил) 17 -гидрокси 3-оксо 1 7-ot-nperH-4-eH 21-карбоновой кислоты, получают 0,9 г целевого продукта (первая партия).
Собирают осадок гифлосуперцела хлористым метиленом, фильтруют, промывают фильтрат при помощи водного раствора бикарбоната натрия, сушат, фильтруют и упаривают досуха, получают 0,2 г продукта (вторая партия).
Обе партии соединяют,очищают хро- матографически на двуокиси к ремния, элюируя смесью бензол - этипов.ый эфир уксусной кислоты (8:2). Собирают 0,925 г продукта, которьй можно перекристаллизовать в изопропаноле. .Т.пл. 245°С.
Вычислено, %: С 78,74; Н 9,15.
, 396,5
Найдено, %: С 78,9; Н 9,4.
Ир -1-6,5+2° (k 0,5%вСНС1э)
Пример 11. 17/i -Окси-7об-про пил-З-оксо-1 7об-прегна- , 4-диен-21 -. карбоновая кислота.
Растворяют 500 мг 17 -окси-7а, - -пропил-3-оксо-1 706-прегна-1,4-диен-2 карбоксилата калия в 15 мл воды, раствор охлаждают приблизительно до +5 С, добавляют при перемешивании 12 мл 0,1 Н. соляной кислоты и продолжают перемешивание еще в течение
И, О
15 мин. Затем остаток обезвоживают, промывают водой и сушат до постоянного . Получают 420 мг целевого продукта, Rf 0,2 (метилен- хлорид/этанол 8:2), т.пл. - 205°С (разл.).
Вычислено, %: С 74,13; Н 9,08j
1,1.
Найдено, %: С 74,1; Н 9,0; 0,9.
Изучение антиальдостероновой активности.
Изучение проводилось с помощью теста, разработанного Кагава и Маркусом по следующей методике.
Самцы крыс Spraguea Dawley SPFZFFACREPO весом 180 г были подвергнуты адреналэктомии за семь дней до диуреза, анестезированы имальгеном (кетамином) интраперито- неально дозой 100 мг/кг, с момента операции и до начала эксперимента получали в качестве питьевой воды физиологический раствор.
За 17 ч до диуреза животным не давали пищи, физиологический раствор заменили на воду с 5% глюкозы.
Продукты вводили орально за 1 ч перед посадкой в клетку.
Продукт Ингибирующее действие, %, при введении
продукта в дозе, мг/кг
Известный
22
По примерам 5, 10, .
Изучение антиандрогенной активности.
Группы из 5 кастрированных самцов крыс в возрасте примерно 4 недель 55 (вес примерно 100 г) получали од- повременно (за две отдельные инъекции) и ежедневно в течение 8 дней подкожно испытуемый продукт и 50 мг
013178
В момент проведения диуреза животные получали водно-солевую перегрузку интраперитонеальным путем в количестве 5 мл 9%-ного физиоло- 5 гического раствора (на одно животное) и 1 мг/кг моноацетата альдостерона в виде 2,5%-ного спиртового раствора подкожно.
Затем крыс поместили по две в О клетку для диуреза без еды и питья на 4 ч.
Но истечении этого времени проводили усиленное мочеиспускание под давлением на мочевой пузырь и изме- 5 ряли объем собранной мочи.
После тщательной промывки клеток и стеклянной посуды объем мочи составил 50 см. В этом растворе проводили определение натрия и калия мочевого происхождения фотометрией пламени на автоанализаторе.
Полученные результаты, выраженные в процентах ингибирования активнос- ти I мг/кг моноацетата альдостерона, введенного подкожно, на логарифм от- нощения концентрации натрия к концентрации калия (метод Кагава) приведены в табл.1. ., Таблица 1
69
58
81
пропионата тестостерона (продукты суспендированы в карбоксиметилцел- люлозе, содержащей 0,2% твина, их вводят в объем 0,5 см).
Животных умертвили через 24 ч после последней обработки, изъяли простату и зафиксировали на 24 ч в 10%- ном растворе формальдегида (на физи9130131
ологическом растворе), потом рассекли и взвесили.:
Ингибирование увеличения веса . простаты, вызванного пропионатом тестостерона, рассматривается как анти- г андрогенная активность продуктов.
Полученные результаты приведены в табп.2.
Т а б л и ц а 2
п
.0
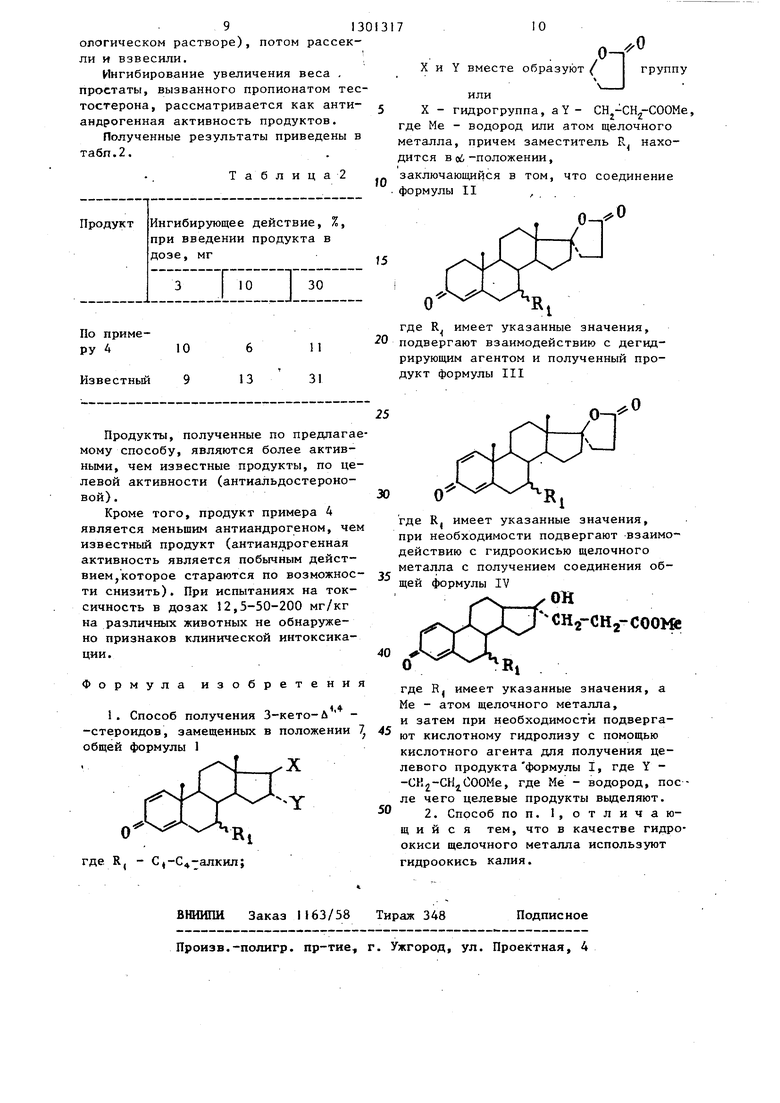
X и Y вместе образуют { I группу
О
или
X - гидрогруппа, аУ- СН -СН -СООМе, где Me - водород или атом щелочного металла, причем заместитель Гч. находится в с -положении,
заключающийся в том, что соединение формулы II
Продукт
Ингибирующее действие, %, при введении продукта в дозе, мг
I:E::I
30
По приме
где R имеет указанные значения, подвергают взаимодействию с дегидрирующим агентом и полученный продукт формулы III
Продукты, полученные по предлагаемому способу, являются более активными, чем известные продукты, по целевой активности (антиальдостероно- вой).
Кроме того, продукт примера 4 является меньшим антиандрогеном, чем известный продукт (антиандрогенная активность является побычным действием, которое стараются по возможности снизить). При испытаниях на токсичность в дозах 12,5-50-200 мг/кг на различных животных не обнаружено признаков клинической интоксикации .
Формула изобретения
1. Способ получения 3-кето-Л - -стероидов, замещенных в положении 7 общей формулы 1
X
где R, - С -С алкил;
25
.0
35
где RJ имеет указанные значения, при необходимости подвергают -взаимодействию с гидроокисью щелочного металла с получением соединения общей формулы IV
ОН СН2-СН2-СОО й
45
50
где R имеет указанные значения, а Me - атом щелочного металла, и затем при необходимости подвергают кислотному гидролизу с помощью кислотного агента для получения целевого продукта формулы 1, где Y - -CH -CHjCOOMe, где Me - водород, пос ле чего целевые продукты вьщеляют.
2. Способ по п. 1, отличающийся тем, что в качестве гидроокиси щелочного металла используют гидроокись калия.



| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения производных @ @ 19-норстероидов | 1983 |
|
SU1340593A3 |
| Способ получения сложных эфиров циклопропанкарбоновых кислот | 1981 |
|
SU1473707A3 |
| Способ получения 7 @ -алкилпроизводных стероидов в виде @ -или @ -изомеров или их смеси | 1980 |
|
SU942602A3 |
| Способ получения производных циклопропанкарбоновой кислоты в виде их рацематов или оптически активных антиподов | 1981 |
|
SU1342408A3 |
| Способ получения производных стероидов | 1988 |
|
SU1665877A3 |
| Способ получения производных прегн-4-ена | 1978 |
|
SU826958A3 |
| Способ получения стероидных производных с замещенной 3-аминогруппой или их кислото-аддитивных солей | 1981 |
|
SU1327789A3 |
| Способ получения эфиров-производных циклопропанкарбоновой кислоты | 1981 |
|
SU1428189A3 |
| Способ получения производных стероидов | 1982 |
|
SU1447289A3 |
| Способ получения производных 4-оксихинолинкарбоновой кислоты | 1986 |
|
SU1584749A3 |
Изобретение относится к замещенным стероидам, в частности к 3-кето лы I стероидам общей формух СИ -СН.-СНСх I I Y С СН-СН-СН -он -он -CHjj -CHj -CHj-C R. где R, С,-С4 - алкил; X + Y образуют группу С-СН2-СН -С(0)-0 или , а Y -(CH2),j-C(0)-OMe, при Me Н или щелочной металл, причем R, находится в а;,-положении, которые проявляют антиальдостероновую активность . Дпя выявления активности среди замещенных стероидов были получены новые I. Их синтез ведут дегидрированием соединения 1, где X-bY - указанная группа, с помощью, например, 2,З-дихлор-5,6-дициано-1,4- бензохинона в среде диоксана в инерт- Hoii атмосфере. Полученный продукт при необходимости обрабатывают щелочью, например КОН (происходит размыкание цикла с получением и ,-CH2-C(0)-OMe). Далее также при необходимости образовавшийся продукт гидролизуют в присутствии кислоты и вьщеляют целевой 1. Испытания 1 показьшают, что они малотоксичны и проявляют лучшую активность, чем известный продукт. 2 табл. О) :с :о 
ВНИИПИ Заказ 1163/58 Тираж 348 Подписное Пройзв.-полигр. пр-тие, г. Ужгород, ул. Проектная, 4
| Патент США № 4258039, кл | |||
| 4241241, опублик | |||
| Пишущая машина для тюркско-арабского шрифта | 1922 |
|
SU24A1 |
Авторы
Даты
1987-03-30—Публикация
1981-12-17—Подача