1
Изобретение относится к области . химии фосфорорганических соединений, а.именно к новым фосфорилироваНнЫм триметилизотиомочевинам общей форму лы
.. $СНз
((Нз)2 iJy
где R
метил, этил, клорметил или этоксигруппа;
этокси, Фенокси-, хлорфенокси-, 2,-дихлорфенокси-, 2 ,,5 трихлорфенокси- или пентахлорЛенокси гр уппа; X кислород или сера, обладающим инсектоакарииидной активностью, которые могут найти применение е сельском хозяйстве..
Известно использование в качестве инсектицидов и акарицидов хлорофоса L1j и клрбофосп Г 2.
Ближайшими известными структурными аналогами описываемых соединений являются фосфорилированные метиЛизотиомочевины общей формулы
О Hi ()2P-N C-1NH2
где R - низший алкил З.
Однако данные об их биологической активности в литературе отсутствуют.
Целью изобретения являетсп расширение арсенала средств воздействия на живой организм.
- j Поставленная цель достигается описываемыми фосфорилированными триметилизотиомочевинами формулы ( 1, обладающими инсектоакарицидной активностью.
Фосфорилированные триметилизотиомоче.вины формулы (1) получают путем взалмодействия хлорангидридов соотл лг. Va-aa™, . 1.. letcfByibuiHX кислот фосфора общей фо мулы.. , , . ;, . : ..где R, R и X имеют вышеуказанные значения, ;.: .V с сблямй триметилизотиомочевины фор мулы , . н HY-HN ci r- : (1Нз)г где J - хлор, бром, или йод, в присутствии двух эквивалёйтов органического основания, в качестве которого могут быть использованы тр тичные ароматические или алифатичес кйёайййы, например пиридин или три метиламин, при 0-50 С в среде инерт ного органического растворителя. П р и мер 1. Получение Н,М-ди метил-5-метил-М-диэтоксифосфинилизртиомОчевияы. г (0,022 моль) йодистоводоро ной сОли триметилизотиомочевины рас воряют в 200 мл хлороформа. К полученному раствору прибавляют по капJ K-w. мн ис1штлл ПО кап- А П Х - - - - лям 3,8 г (0,022 моль) хлорангидрид диэтилфосфорной кислоты, затем медленно вносят ,S г (0,4f моль) три этиламина при температуре от О до в течение 15 мин. Реакционную массу перемешивают 3 ч при комнатно температуре и оставляют на ночь. 3 i Те и ёШ еь frp6 мы в aioT т риж ды водой (по 20 мл), сушат над безводным сул фётом натрия, Упарйваюо в вакууме и получают Ц,8 г масла, которое экстра гируют низкокипящим петролейным эфиром. Остаток выде1рй иво1ЮТ в вакууме мм рт.ст. и выделяют 3,9 г Ы,Н-диметил-5-метил-1 1-диэтоксйфосфинилизртиомочевины, п ° 1,5000, df M590VMRv,,5ь MR,,, 6А,11. .; ,,. , - . Найдено, %: С 38,1; Н 6,9б; Р 12,08. - : .. e.5 JiVSВычислено, %: С 38,7б; Н Р,12,18, :::2,:Г-:...--..--/:.--...--.:-..-.--.- . П р и м ё р 2. Получение М,М-диметил-З-метил-Нгфеноксиметилфосфинили зотмомочёвины. -, ., ; ГК pacTVopy ,9 г (0,02 моль) йодистоводородной «win Tj:lй ftШизoтйo32мочевины в 200 нп хлороформа прибав-. ляют 2,80 г (0,02 моль) хлорангидри-1 да 0-фенилмётилфосфоновой кислоты, затем при температуре от О до +10 С прибавляют по каплям в течение 15 мин ,0 г (0, моль) триэтилами на. РеакциЬнную массу перемешивают 7 ч при комнатной температуре, промывают три раза водой, сушат над прокаленным сульфатом магния и упаривают в вакУУме Получают 3,8 г технической N,N-димeтил-S-мeтил-N -фeнoксиметилфосфинилизотиомочевины. После очистки на пластинках с незакрепленным сло:ем силикагеля получают аналитически чистый препарат п 1,, df 1.2690, MR. 70,85, riR-,,, 6о,9ч« Найдено, %: С 49,01; ff 6,22; N 10,10; Р 12,10. Вычислено, %: С 48,51; Н 6,29; N 10,28; Р 11,37. П р и м е р 3. Получение N,N-диметил-5-метил-М-ДИэтокситиофосфинилизoти0 dчeвины и М,Ы-диметил-5-метил-N-этоксиэтилтиофосфинилизотиомочевины. К раствору 4,9 г (0,0-2 моль) vK-v.c. т.ч i (.и,и- моль; йодистоводородной соли триметилизо тиoмOчeвины в 200 мл хлороформа внотиомоирр1ими п 9пп ..г, сят 3,76 г (0,02 моль) хлорангиприда О,О-дйэтилтиофосфорной кислоты, затем прибавляют по каплям при температуре от О до +10 С 4,04 г (0,02 моль) триэтиламина. Реакционйуй йёссу перемешивают при комнатной температуре 2 ч, затем кипятят при перемешивании 4 ч и оставляют на ночь. Хлороформ отгоняют в вакууме, к остатку прибавляют бензол и фильтруют, Осадок на фильтре промывают безводным/бензолом. Фильтрат упаривают и экстрагируют сначала 30 мл холодного гексайа затем 100 мл горячего. кстракты объединяют и упаривают, поу ют 4,5 масла, представляющего обой смесь М,Н-диметил-8-метил-М диЭтОксйтиофосфйнилизотиомочевииыЫ,М-диметил-8-метил-М-этокси (этилтио) фЬсфинилизртиомочевины в оотношений 5:1 Хроматографией на ластинках с незакреплекным слоем иликагеля. выделены два аналитичеси чистые препараты. «, . Первый. - М,Ы-диметил-8-метил-Ндиэтокситиофосфинилизотиомочевины.
Найдено, %: С 35,04;.Н 7,09; N 9.52; Р 10,37.
C,.H,,
Вычислено, %: С 35,53; Н 7,08; N 10,36; Р .
Второй - Ы,Ы-диметил-5-мети,л-Н-этокси (этилтио)фосфинйлизотиомомевины. .
Найдено, %: С 33,90; Н 6,89; N 9,56; Р 11,2it.
Вычислено, %: С 35,53; Н 7,08; N 10,36; р.11.5.
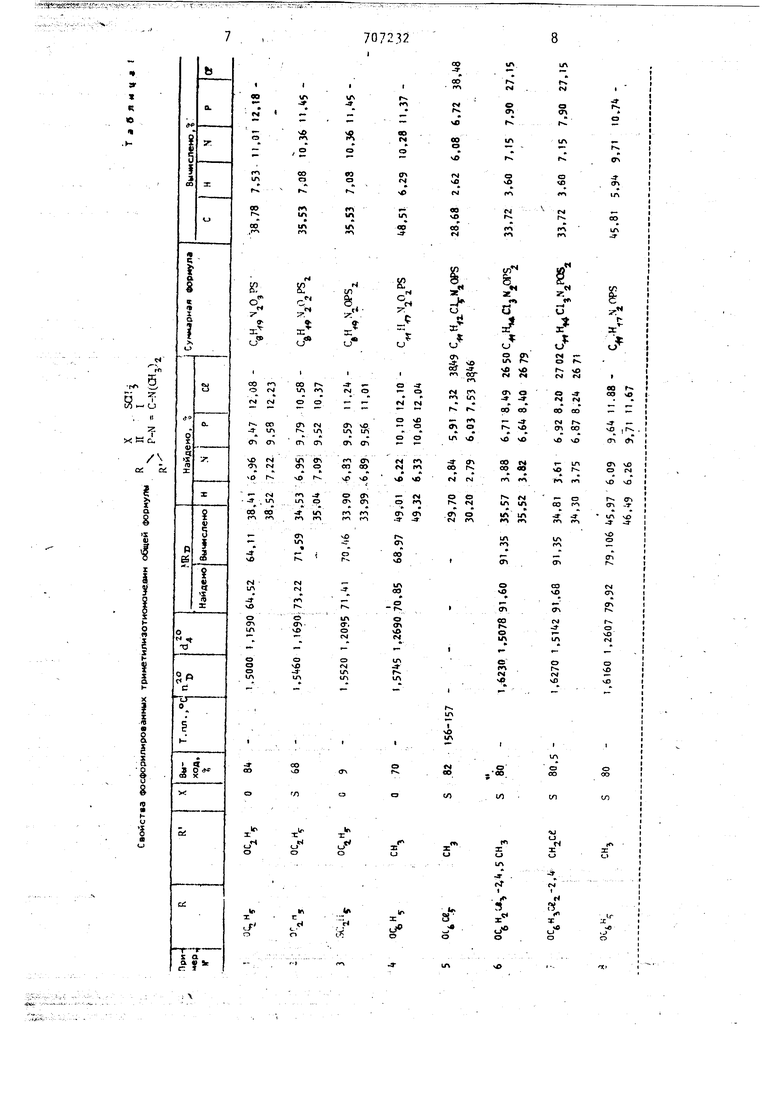
Свойства других полученных соеди нений приведены в табл. 1 ,
Строение всех полученных сбедине НИИ подтверждено данными элементного анализа ИК- ПМР- и ЛИР С-спектрами. .
ИК-спектры всех соединений содержат интенсивную полосу поглбщения в области 1бОО см (сопряженная ), тиофосфинилпрОизводные имеют по,юсу поглощения в области 620-бАО, (Р S), фрсфинилпроиз водные поглощают в. области 1220-12 40 () .
В спектрах ПНР фосфинил(тиофосфинил)триметилизотиомочевин наблюдают.ся синглетные сигналы протонов СН группы при 2,.32-2,53 м.д и ( группы при 3,11-3,32 м.д. (спектры измерены при , растворители - дейтероацетон и дейтерохлороформ.
- f
В спектрах ЯМР С имеется сигнал трИгоИального атома углерода при 166169 м.д.
Полученные фосфорилированные; триметйлизотиомочевины обладают высокой инсектоакарицидной активностью. Они эффективны против комнатных мух (Musса domestica Z.I жуков рисового долгоносика .(Caiandra Z.), обыкно венного паутинного клеща (Tctranvchus urticae Koch..l, гусениц непарного шелкопряда (Р. -dispar) и личинок кома ров. .
I ., . Для практического использования в
качестве инсектицидов и акарицидов предлагаемые соединения обь1чно используются в виде активных компонентов композиций, включающий инертные наполнители, нс5сители, растворители, диспергаторы, эмульгаторы. Инсектицидные и акарицидные композиции могут использоваться в виде твердых, жидких или патообразных препаративных форм. Твёрдые препаративные формы могут приготавляться в виде дустов, гранулсмачивающихся пороиков. .);(идкие - в
707232
виде растворов аэрозолей -.ли эмульсионных концентратов,
Все предлы аемые вещества проявляют высокую инсектоакарицидную активность. При этом некоторые из них зн;-;ительно в 2,5-20 раз превосходят эт::лоны. Так по токсичности для комнатных мух соединения 7 и 8 (см. табл. 2) равны хлорофосу, широко при0меняемому для борьбы с комнатными мухами и к которому во многих городах образовались резистентные популяции. Для рисовых долгоносиков соединение 8 более, чем в 3 раза активнее хло5рофоса. В отношении гусениц шелкопряда соединения 5,7 и 8 также более активны, чем карбофос. Особенно высокая активность отмечена у соединений 7 и 8 для личинок комаров. Ларвицйд0ная активность их превосходит активность карбофоса в 2,5и 20 раз.,
Для паутинных клещей соединения 2 и Ц в 2 раза активнее карбофоса.
Прим е Р k. Определение инсектоакарицидной активности фосфорилиро5ванных триметилизотиомочевин.
Инсектицидные свойства изучены для комнатных мух, рисовых долгоносиков, гусениц непарного шелкопряда и личинок коиаров-кулексов. Комнатных
0 мух и жуков опрыскивают 0,15 -ными водноацетоновыми растворами соединений в чашках для опрыскивания. Учет гибели проводят через и 7 ч, соотвественно.
5
Гусениц непарного шелкопряда подсаживают в стаканчики, опрыснутые О,01%-ной концентрацией испытуемых соединений. Учет гибели проводят через 2k ч.
Личинки комаров помещают .в стаканчики, заполненные ацетонововодными растворами в концентрации 1-10 . Учет ведут через 2 ч. Результаты представлены в табл. 2.
Пример 5. Определение акарицидной активности фосфорилированных
0 триметилизотиомочевин.
Лкарицидные свойства определяют путем опрыскивания водноацетоновыми растворами испытуемых соединений кон5центрации 0,06 высечек из листьев, зараженных паутинными .клещами. Учет гибели проводят через 8 ч. Результаты представлены в табл. 3.
Тяблица 2




| название | год | авторы | номер документа |
|---|---|---|---|
| Фосфорилированные триметилизомочевины, обладающие инсектоакарицидной активностью | 1978 |
|
SU707233A1 |
| @ -Этинильные эфиры дитиофосфорной кислоты,обладающие инсектоакарицидной активностью | 1980 |
|
SU948107A1 |
| ФОСФОРИЛИРОВАННЫЕ N-АЛКИЛБЕНЗАМИДОКСИМЫ, ОБЛАДАЮЩИЕ ИНСЕКТИЦИДНОЙ И ИНСЕКТОАКАРИЦИДНОЙ АКТИВНОСТЬЮ | 1983 |
|
SU1189067A1 |
| 4,5-ДИГИДРО-4-(О,О-ДИЭТИЛТИОФОСФОРИЛ)-5-МЕТИЛ-1,2,4-ТРИАЗИН-6-ОН, ОБЛАДАЮЩИЙ ИНСЕКТИЦИДНОЙ И АКАРИЦИДНОЙ АКТИВНОСТЬЮ | 1988 |
|
SU1527872A1 |
| Фосфоросодерщажие симм-триазины,обладающиеиНСЕКТОАКАРицидНОй АКТиВНОСТью | 1978 |
|
SU689197A1 |
| Фосфоросодержашие симм-триазины,обладающиеиНСЕКТОАКАРицидНОй АКТиВНОСТью | 1978 |
|
SU694043A1 |
| ФОСФОРИЛИРОВАННЫЕ 2-АЛКИЛАМИНОДИГИДРО-1,3-ТИАЗИНЫ, ОБЛАДАЮЩИЕ ИНСЕКТИЦИДНОЙ АКТИВНОСТЬЮ | 1983 |
|
SU1157831A1 |
| 1-( ДИЭТИЛТИОФОСФОРИЛТИО )МЕТИЛ -5- МЕТИЛ - 4,5 - ДИГИДРО -6- ОКСО - 1,2,4 - ТРИАЗИНЫ, ОБЛАДАЮЩИЕ ИНСЕКТИЦИДНОЙ И АКАРИЦИДНОЙ АКТИВНОСТЬЮ | 1989 |
|
SU1621453A1 |
| 0-ЭТИЛ-S-[(N-КАРБАЛКОКСИ-N-КАРБАЛКОКСИАЛКИЛ)АМИНОМЕТИЛ] МЕТИЛТИО- ИЛИ ДИТИОФОСФОНАТЫ, ОБЛАДАЮЩИЕ АКАРИЦИДНОЙ И ИНСЕКТОАКАРИЦИДНОЙ АКТИВНОСТЬЮ | 1982 |
|
SU1100896A1 |
| ТИОФОСФОРИЛИРОВАННЫЕ ОКСИМЫ ЛАКТАМОВ, ОБЛАДАЮЩИЕ ИНСЕКТОАКАРИЦИДНОЙ АКТИВНОСТЬЮ | 1990 |
|
SU1732666A1 |

Акадицидные свойства соединений для
Tetranychus urticae Koch.
u:i fcKA i.V;;.i;:i,;: KjiiefeKawr% i;:iJ5i,iU-.Таблица 3 11 Формула изобретения ФЬсфо|эилированные триметилизотио мочевины общей формулы S X ЙЙНз p-K-d-K(dH,), где R - метил этил, хлорметил или этоксигруппа; R - этоксит, фенокси-, хлорфеНОКСИ-, 2, 7Дихлорфенокси2,,5 трихлорфенокси- или 2 пентахлорфеноксигруппа; X - кислород или сера, обладающие инсектоакарицидной активностью. Источники информации, принятые во внимание при экспертизе 1.Мельников Н. Н. Химия и технология пестицидов. Химия, М., 1975, с. 598. 2.Шрадер Г. Новые фосфорорганические инсектициды. Мир, М., 1965, с. 160. 3.Алимов П. И., Левкова Л. Н, Изв, АН СССР, сер. Хим., 196, с. 1889
Авторы
Даты
1982-05-30—Публикация
1978-08-14—Подача