{СН2)-СН-С-Ш ifff к-3,4; Bl-H-.-CHg; -снэ; Синтез указанных веществ проводят путем конденсации хлорангидридов аминокислот с о-аминобензальдегидом (б-Оба) или же с о-аминоацето феноном. Конденсацию осуществляют при в двухфазной системе, причем к о-аминобензкарбонильному соединению, находящемуся .в нижнем слое, медленно добавляют рас вор хлорангидрида N-бензилпропила с такой скоростью, чтобы рН верхнего слоя при слабом перемешивании (без заметного смешения фаз) состав ляло 6-8 и выделяющийся в нижнем слое НС1 успевал нейтрализоваться постепенно добавляемой в водный сло щелочью. По завершении добавления раствора хлорангидрида органический слой промывают до нейтрального рН, хлороформ упаривают, а продукты ре.акции очищают с помощью xpoMafoграфии на силикагеле. Идентификацию полученных соединений проводят обычными методами: элементным анализом, тонкослойной х матографией, методом ПМР, характери зуют удельным вращением, ИК- и элек тронными спектрами.; Полученные производные S- и R-2-аминокарбонил-2 -аминобензальдегида образуют комплексы с ci-аминокислотами в присутствии ионов переход ных металлов. Однако, наряду с этим данный ряд соединений приобрел и совершенно новые свойства - стереоспецифичность и стерес селективность как при образовании комплексов, так и при некоторых их превращениях. Стереоселективность полученных производных проявляется при образов нии комплекса с рацематами Ы-аминокислот, причем в образовании комплекса принимает участие аминокисло преимущественно одной конфигура-; ции, а в растворе остается ее анти под. После выделения и разложения комплекса получается исходное произ водное и оптически активная ot-аминокислота, содержащая преимуществен-; но один изомер. Проявлением стереоспецифичиости нового ряда является процесс ретро- рацемизации (-аминокислот в этих комплексах при обработке их основаниями, т.е. превращение рацемата аминокислоты в комплексе преимущественно в один изомер, а оптического изомера аминокислоты в сооэ ветствующий антипод. Изомеры ot-аминокислот можно выделить разложив комплекс, причем использованное производное 2-аминоалкилкарбонил 2-аминобензальдегида сохраняется в неизменном виде. Кроме того, используя стереоспецифичность описываемых соединений можно приводить с их помощью синтез оптически активного треонина (например .(1гтреонина) с высокой степенью чистоты и большим выходом без изменения применяемого производного. Таким образом, за счет новых , свойств: стереоспецифичности и стереоселективности производных S- и R-2-аминоалкилкарбонил-2-аминобёнзальдегида эти производныеможно применять как реагенты при получении оптически активных аминокислот. Описываемые хиральные реагенты можно ковалентно закрепить на полимерной матрице путем алкилирования 2-ами но- N- пи рроли дин карбонил-2 -аминобензальдегида хлорметилированным сополимером стирола с дивинилбензолом.,. Алкилирование проводят в смеси метанол - диоксан (1:1) при SO-SS C в те.чение 30 ч. Пример 1. В стакан помещают 3 ммоль о-аминобензальдегида в 25 мл хлористого метилена и 50 мл воды. В верхний водный слой опускают стеклянный электрод и электрод сравнения рН-метра. При раздельном перемешивании органического и водного слоев в органический слой по каплям в течение 15 мн при комнатной температуре добавляют 3 ммоль хлоргидрата хлорангидрида М-бензил-5-пролина в 2 мл сухого хлористого метилена. Одновременно в водный слой добавляют 2н. раствор КОН таким образом, чтобы рН водного слоя поддерживалось 7-8. Затем смесь перемешивают еще 35-, kO мин. Органический слой отделяют, водный слой промывают 3 раза по 13 мл хлористым метиленом, органические
5, 9601
вытяжки объединяют с органическим слоем, растворитель отгоняют под ваку умом при 30-40 С, а остаток хроматографируют на силикагеле Л 40/100/4 в колонке 2, см в системе хлоро- s форм-бензол-диэтиловый эфир-уксусная кислота-этанол (Ю: 1Q: 10:2,5:2,5), причем собирают 2-ю фракцию, содержащую продукт..реакции (контроль осуществляют с помощью тонкослойнойto хроматографии на силикагеле). Затем растворитель отгоняют, к остатку до26,
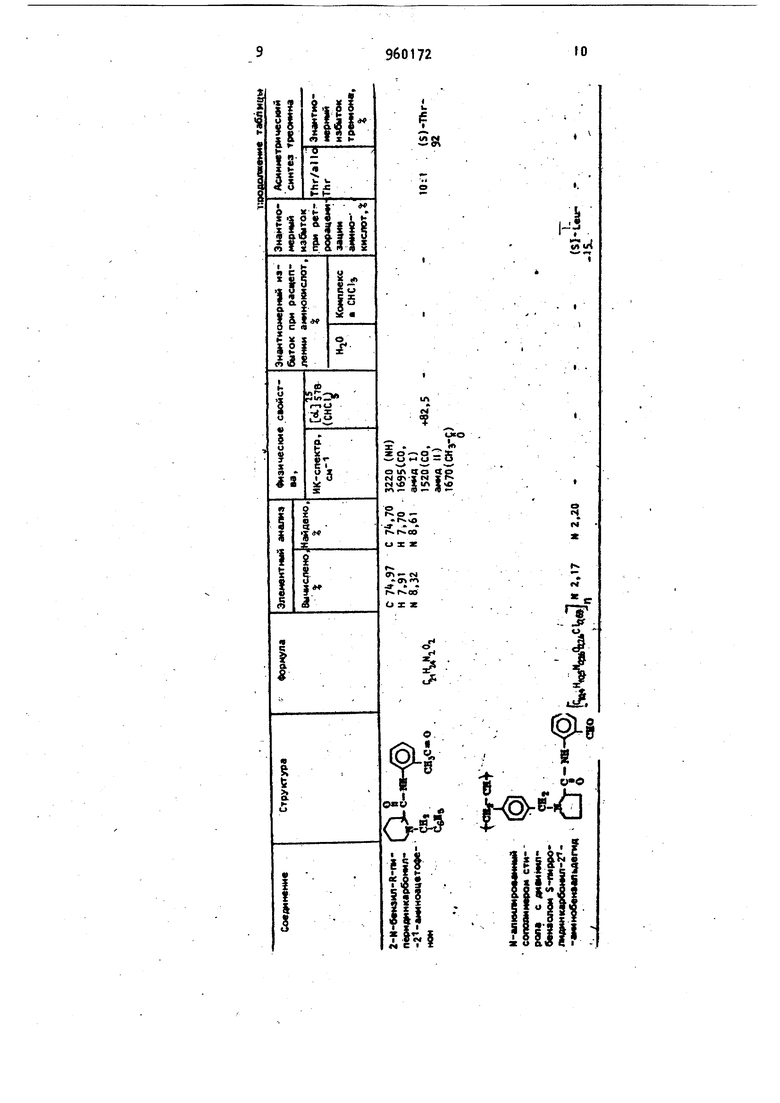
бавляют 25 мл Н,0 и безводного карбоната натрия до pHi9 и выделившийся продукт экстрагируют хлороформом 3 раза по 3,0 мл, отгоняют хлороформ и получают 2М-бензил-5-пир|5Оли/ 1ин-1 карбонил-2 -аминобензальдегид в виде масла (0,8 мйоль, выход л; 27%). , После перекристаллизации из петролейного эфира (40-70 с) получают кристаллы с 1рд9б-98С. Данные по характеристике структуры полученных соединений сведены в таблицу.
I-)
ИЧ| J
«л 1Л






| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения оптически-активных изомеров @ -аминокислот из их рацематов | 1981 |
|
SU1087513A1 |
| Способ получения оптически активного треонина | 1981 |
|
SU952839A1 |
| Хиральные производные ( @ )-или ( @ )-2- @ -( @ -бензилалкил)аминобензофенона как реагенты для получения оптических изомеров @ -аминокислот | 1984 |
|
SU1189859A1 |
| Способ получения энантиомеров @ -аминокислот | 1984 |
|
SU1198063A1 |
| Способ получения серина | 1983 |
|
SU1105490A1 |
| Хиральные производные (S)-2-N-(NЪ-бензилпропил)- или (R)-2-N-(NЪ-бензилпипеколил)-2Ъ-замещенного аминобензофенона в качестве реагентов для получения оптических изомеров аминокислот | 1987 |
|
SU1498763A1 |
| СПОСОБ ПОЛУЧЕНИЯ НИКЕЛЬ (II) - КОМПЛЕКСОВ ОСНОВАНИЯ ШИФФА ГЛИЦИНА ИЛИ МЕЧЕННОГО 1-CC ИЛИ 2-C ГЛИЦИНА С ХИРАЛЬНЫМИ ПРОИЗВОДНЫМИ (S) ИЛИ (R)-2-N-(N'-БЕНЗИЛПРОПИЛ) АМИНОБЕНЗОФЕНОНА | 1992 |
|
RU2027720C1 |
| Способ получения оптически активных S-фенил-L-цистеина или S-бензил-L-цистеина | 1986 |
|
SU1337385A1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ АМИДИНОПЕНИЦИЛЛАНОВОЙ КИСЛОТЫ | 1973 |
|
SU406362A1 |
| Способ получения производных хинолина,их солей или их изомеров | 1974 |
|
SU535034A3 |

119 П р и м е р 2. Поступают аналогич но примеру 1, но вместо о-ад 1нобензальдегида берут о-аминоацетофенои и получают ;1 Н-бвнзил-$-пирролидинкарбония-2-аминоацетофенон (1, еыход Ц0%) с tf,д10 -106°C. Примерз. Поступают аналогич но примеру 1, но вместо,хлоргидрата хлорангидрида М-бензил-5-пролина берут хлоргидрат N-бензил-S-пипеколиновой кислоты и получают 2N-бeнзил-5-пиперидинкарбонил-2 -аминобензальдегид (0,6 ммоль, выход 20) с t П2°С. Пример , Поступают аналогично примеру 3 но вместо о-аминобензальдегида берут о-аминоацетофенон и получают 2М-бензил-Л-пиперидин ) -I r карбонил-2 -аминоацетофенон 0,7ммол выход 23) с tnAl17°C. У , П р и м е р 5. Поступают аналогич но примеру 1, но вместо хгэргидрата хлорангидрида М-бензил-5-пролина бе рут хлорангидрид N-фopмил-S-пpoлинa и получают 2М-формил- S-пирррлидинкарбонил-2 -аминобензальдегид (0,75 ммоль, выход 25). Весь полученный продукт рАстворя ют в 10 мл 1 н. НС1 в абсолютном эт ноле, растворитель отгоняют под вакуумом досуха при O-SO-C и получают хлоргидрат 2-амино-5-пирролидинкарбонил-2 -аминобензальдегид (0,75 ммо выход, считая на формильное производное, 100%), который затем алкилируют хлорметилированным сополимером стирола и дивинилбензола следующим образом: растворяют 1 ммоль поли мерного хлоргидрата в 5 мл метанола и 5 мл диоксана, содержащих 0,2 г йодистого натрия и 2 г углекислого натрия. В полученную смесь вводят 1 г хлорметилированного сополимера стирола с дивинилбе,нзолом, содержащего 20 хлора. Смесь перемешивают 10 мин и греют при 50-55°С в течение 30 ч. Затем фильтруют, про мывают ацетоном 3 раза по 50 мл, водой 2 раза по 100 мл и сушат при 0°С до постоянного веса. Получают 1 г N-алкилированного сополимером стирола с дивинилбензолом -У . .. . (Bi -CH2- O/ CJl- H2)-S-пирролид - карбонил-2-аминобеизальдегида 2 12 CHg-CHJ-jti /NX NH- О - СН СНг II сНа- CHg Полученный продукт нерастворим в растворителях, но набухает в спиртово-водной смеси (60:АО) на 95 вес.% Найдено, %: N 2,20, О 2,22. Вычислено, %: N 2,17; О 2,17. Молярное соотношение . Содержание активного лиганда 0,9 ммоль/г. Кроме того, полученный продукт характеризуется по поглощению глицина и ионов меди (см. пример 13). П р и м е р 6. Селективный выбор аминокислот. 6-1, Получение комплексов, В колбу помещают 0,6 ммоль К,5-валинз в 0,6 мл 1 н, раствора метилата натрия в метаноле, 3 мл абсолютного метанола, 0,3 ммоль 2Ы-бензил-5-пирролидинкарбонил-2 -аминобензальдегида и 150 мг молекулярного сита Wplfen Zeosorb . Реакционную смесь перемешивают с помощью магнитной мешалки при комнатной температуре в течение 1 ч, затем удаляют молекулярные сита и . к смеси реагентов добавляют раствор 0,3 ммоль тонко измельченной уксусной меди, реакционную смесь перемешивают ч 5 мин и добавляют 0,3 мл 1н. раствора метилата натрия в метаноле и 30 мл смеси вода-хлороформ (1:1), Образовавшийся комплекс экстрагируют хлороформом 3 раза по 15 мл, вытяжки объединяют и хлороформ отгоняют (полученный комплекс очищают на силикагеле Л 0/100 ,и в колонке ( см) в этаноле , Оставшийся после экстракции хлороформом раствор подкисляют 1н, соляной кислотой до рН 1-2, пропус сероводоррд для осаждения оставшихся ионов меди, фильтруют, упаривают, растворяют в 10 мл воды и к раствору добавляют 2,0 г смолы КУ-2 в Н -форме, СмесЬперемешивают 15 мин, смолу отфильтровывают, промывают 50 мл воды и затем сорбированную аминокислоту со смолы 2 раза Ю-ю миллилитрами элюируют S% водного миллилитоами аммиака, выдержи.вая каждый раз смо13960172, U
лу в растворе 15-20 мин, элюаты объ- отгоняют ацетальдегид. Далее постуединяют, упаривают. Получают 0,2S ммоль пают, как описано в примере 6-2. преимущественно R-валина, содержание изомеров определяют энантиомерным анализом. Данные анализа приведены в таблице. 6-2. Полученный комплекс разлагают следующим образом. 0,2 ммоль комплекса растворяют в 2 МП метанола. добавляют 5 мл 1н. раствора HCI (рН выдерживают 10 мин при комнатной температуре, добавляют 15 мл воды, пропускают сероводород, осадок отфильтровывают, к фильтрату добавляют концейтрированный аммиак до рН 9-10 и выделившийся N-бeнзил-S-пиppoлидин-карбонил-2 -аминобензальдегид экстрагируют хлороформом 3 раза по 20 мл и после упаривания хлороформа получают 0,15 ммоль (выход 75% за , счет потерь на осадке сульфида меди) Водный раствор упарив.ают и освобождают -ОТ солей на смоле КУ-2 указанным образом. Полумают 0,18 ммоль валина, содер жащего преимущественно S-валин (по энантиомерному анализу). П р и мер 7. Поступают аналоги ч но. примеру 6, но вместо К,5-валина берут К,5-лейцин. Получают 2 фракции леициуа, содержащие, преимущественно разные антиподы. П р и м е р 8, Ретрорацемизация. Поступают .аналогично примеру 6, но вместо R,S-вaлинa используют К,5-лейцин в количестве 0,3 ммоль и получают 0,25 ммоль комплекса. Затем 0,2 ммоль полученного комплекса растворяют в 2 мл 0,1н. раствора метилата натрия в метаноле, выдерживаю при комнатной температуре в течение 2 ч И далее разлагают комплекс, добавляя 5 мл 1н. раствора НС1, как описано в примере 6-2. Получают лейцин, содержащий преимущественно Sпейцин. П р и м е- р 9- Синтез треонина. Поступают аналогично примеру 6, н вместо 0,6 ммоль В,$-валина берут О, ммоль глицина. Полученный ком-, плёкс глицина берут в количестве 0,2 ммоль, растворяют в2 мл 0,1н, раствора метилата натрия в метаноле и добавляют 20 ммоль ацетальдегида. Смесь выдерживают 1 ч при комнатной температуре, затем к смеси добавляют 5 мл 1н, раствора HCI для разложения комплекса и после выдержки 15 ми Получают треонин и аллотреонин (энантиомерный состав приведен в таблице). П р и м е р 10. Поступают-аналогично примеру 9, но вместо 2М-бензил-5-пирролидинкарбонил-2 -аминобензальдегида берут 2К-бензил-5-пирролидинкарбонил-2 -аминоацетофенон. Получают R-треонйн с выходом 97 по энантиомерному анализу. П р и f е р 11. Поступают аналогично примеру 8, но вместо 2М-бензил-5-пирролидинкарбонил-2-аминобензальдегида берут 2Н-бензил-5-пирролидинкарбонил-2 -аминоацетофенон, а вместо Н,5-лейцина берут К,5-аланин, кроме того, раствор 0,2 ммоль комплекса в 2 мл О,1н. раствора мети лата натрия выдерживают не при комнатной температуре 2 ч, а при 35°С 14. Выделяют аланин с преобладанием изомера S-конфигурации. П р и м е р 12, Поступают аналогично примеру 9, но вместо 2М-бензил-5-пирролидинкарбонил-2-аминобензальдегида берут 2-амино-5-п11рРолидиикарбонил-2 -аминобензальдеПолучают треонин. При мер 13. Поступают аналогично примеру 8, но вместо N-бензил-5-пирролидинкарбонил-2 -аминобензальдегида используют 0,33 г (0,3 ммоль) N-алкилированного сополимером стирола с дивинилбензолом 2-амино-5-пирролидинкарбонил-2-аминобензальдегида, полученного в примере 5 . В реакционную смесь не добавляют молекулярное сито, а перемешивают ее 10 ч, после чего к смеси добавляют 0,3 ммоль тонкоизмельченной уксусно ислрй меди. Смесь перемешивают в течение часа, добавляют 0,3 мл 1н, метилата натрия в меГаноле и перемешивают 1ч. Смолу отфильтровывают, промывают 50 мл воды. на фильтре Шотта в течение 30 мин и высушивают под вакуумом при 3040°С, В объединенной промывной воде с фильтратом определяют содержание аминокислоты. Полученную смолу, содержащую комплекс, используют для проведения процесса ретрорацемизации, для чего заливают ее 5-ю- ммоль О,01н. раствора метилата натрия в метаноле и выдерживают, изредка перемешивая, .
в течение 4 ч. Затем в раствор добавляют 5 нп |1н. раствора соляной кис10 0 2
лоты, выдерживают при
смот
лу-реагент отфильтровывают, осажда-v ют ионы хеди, пропуская в фильтрат еероводород, осадок отфильтровывают, фильтрат выпаривают и выделяют аминокислоту,, очищая ее от солей с помощью смолы КУ-2, как указано в примере 6. Получают 0,28 ммоль лейцина, содержащего, преид щественно S-форму. Кроме того, в отфильтрованном осадке сульфида меди определяют содержание меди. Таким образом, находят, что реагент поглощает из раствора 0,29 ммоль меди и 0,292 ммоль аминокислоты.
П р и м е р 14, .Поступают аналогично примеру 8, но вместо 2М-бензил-5-пирролидинкарбонил-2-амйнобензальдегида берут 2Ы-бензил-3-пиперидинкарбонил-2 -аминобензальдегид. Получают S-лейцин.
П р и м е р 15. Поступают аналогично примеру 9| но вместо N-бензил-5-пирролидинкарбонил-2-аминобензальдегида берут 2Nбeнзил R-пипeридинкарбонил-2 -аминоацетофенон. Получают треонин.
Таким образом, предлагаемые соединения могут образовывать хи льные комплексы с различными о -аминокислотами, а если образование комплекса проводить из избытка рацемета аминокислот, то можно разделить рацемат на антиподы. Комплексы могут быть активированы в щелочной среде, что приводит к превращению рацеметов аминокислот в оптически активные аминокислоты, а комплексы глицина становятся способными присоединить ацет альдегид с образованием оптически активного треонина. Причем все превращения в комплексах происходят ко; личественно, а исходные производные можно количественно извлекать.
Таким образом, новые соединения ряда 2-аминоалкилкарбонил-2-аминобензальдегида открывают возможность широко использовать их в качестве регенерируемых реагентов для получения оптически активных аминокислот при разработке промышленной технологии.
Формула изобретения
Производные R- и S-2гаминоалкилкарбонил-2-аминобензальдегида с1бщей формулы
(CH2)«N
N I
RI
г-Эеп 3,4
,R2--Hi-CH5,
в качестве реагента для получения оптически активных аминокислот. Источники информации, принятые во внимание при экспертизе 1. Белоконь Ю.Н. и др. Аминокислоты как С-Н-кислоты. Изд-во АН СССР, сер. хим., 1978, № 10, с. 2276-2282.
Авторы
Даты
1982-09-23—Публикация
1981-01-09—Подача