3 96 sutus (Fr., Quel., Corlolus pargamenus (Fr.) Pat., с помощью воды или 0,01-0,5 н. водного щелочного раствора при 95 100с, отделение экстракта, его концентрирование, фракционированное осаждение целевого продукта сульфатом аммония, диализ и хроматографическую очистку диализата, из вида Coriolus verslcolor (Fr.) Quel используют штаммы FERM-P N 24l2-2 26, из вида Coriolus hirsutus (Fr.) Quel штамм FERM-P № 2711, из вида CorloIus pargamenus (Fr.) Pat. - штамм FERM-P № 2712, из сконцентрированного экстракта удаляют низкомолекулярные вещества путем добавления сульфата Ьммония в количестве, соответствую- ; щем 100% степени насыщения, с последу ющим перерастворением полученного осадка в воде и диализом., фракционированное осаждение сульфатом аммония осуществляют сначала в количестве от насыщения с удалением полученного осадка, затем в количестве 0 от насыщения с последующим диализом, а хроматографическую очистку диализата осуществляют на диэтиламинЬэтилцеллюлозе с элюацией 1 н. раствором NaCI, после чего целевой продукт выделяют осаждением сульфатом аммония в количестве kQ% от насыщения с последующим диализом и сушкой распылением. Используемые штаммы депонированы в Научно-исследовательском институте ферментации (Агентство промьгашенных исследований и технологии) в Японии. На фиг. 1 графически изображен инфракрасный спектр поглощения предлага емых веществ - полисахаридов, связанных с белками; на фиг, 2-6 - спектры протонного магнитного резонанса предлагаемых веществ. Мукополисахариды, полученные предлагаемым способом, более эффективны при подавлении образований из пересаженных опухолевых клеток на подопытных животных по сравнению с продуктом полученным в соответствии с известным способом, при стоматическом при.менении. Результаты сравнения противоопухолевых активностей приведены в табл.1 8 качестве исходного материала можно применять как Corlolus versicolor (Fr.) Quel - штамм FEPM-P N 2H22 26, так и Coriolus hfrsutus (Fr.) Quel - штамм FEPM-P Vf 2711, и Corlolus pargamenus (Fr.) Pat. - штамм FEPM-P № 2712. Однако для промышленного производЬтва наиболее вЬ1годно использовать Coriolus versicolor (Fr.) Quel штамм FF.PM-P № , так как он может обеспечить самый высокий выход предлагаемого вещества. Способ осуществляют следующим образом. Грибы-продуценты предварительно выращивают и мицелиальную пленку, выросшую на поверхности питательной среды, гомогенизируют физиологическим раствором, чтобы получить посевной материал для производства культу ры. Посевной материал подвергают cтa ционарному выращиванию или выращиванию погружением для развития, грибницы, которую экстрагируют, применяя водный растворитель - горячую воду или. разбавленный щелочной раствор. Полученный экстракт после, удаления из него остатка от экстракции концентрируют и затем подвергают высаливанию сульфатом аммония или ультрафильтрации для удаления низкомолекулярных веществ. Очищенный таким образом экстракт концентрируют до 5-10 по весу. В этот концентрированный раствор затем добавляют сульфат аммония в количестве,, соответствующем 2S% от величины наГсыщения, с целью . проведения фракционированного осаждения, и удаляют образовавшийся осадок. В полученный раствор снова добавляют сульфат аммония в количестве, соответствующем 0% величины насыщения, и полученный .осадок собирают. Собранный осадок растворяют в воде и обессоливают с помощью диализа. Образовавшийся раствор пропускают через кколонку с ДЭАЭ-целлюлозой и вещество, адсорбированное на колонке, промывают водой и затем вымывают 1 н. солевым раствором. В полученный элюат снова добавляют сульфат аммония в количестве, соответствующем 40 величи,ны насыщения, для получения осадка. Полученный осадок снова растворяют в воде и затем обессоливают с помощью диализа. Полученный очищенный npcjдукт высушивают. Характерные свойства предлагаемого вещества. Цветные реакции. Испытания на цветные реакции проводят с водными растворами предлагаемого вещества и получают результата :представленные в табл. 2, Из приведенных результатов испытаний на цвет ные реакции очевидно, что предлагаемое вещество содержит сахариды и белок Растворимость. Полумаемые вещества растворяются .,в ВОде и почти не растворяются в ме{ганоле, пиридине, хлороформе, бензоле и гексане. Гигроскопичность. Для определения гигроскопичности предлагаемого вещества несколько образцов помещают а эксикаторы, в каждом из которых поддерживается заданная относительная влажность (табл.з) с помощью насыщенных растворов солей и содержание влаги в каждом образце определяют, измеряя изменение веса со временем. Изменение поглощения влаги со временем при каждой относительной влажности представлено в табл 3. Применяемым насыщенным раствором для 32 относительной влажности служит насыщенный раствор хлористого на рия и азотнокислого калия; для 52 ;относительной влажности - насыщенный ,раствор двухромовокислого натрия; дл 73% относительной влажности - насыще ный раствор хлористого аммония; для ЭВ% относительной влажности - насыще ный раствор азотнокислого свинца. Как видно из табл. 3 каждый обра зец предлагаемого вещества претерпевает незначительное изменение внешнего вида и расплывания, вызываемого поглощением влаги, не наблюдается. Величина рН. рН предлагаемого вещества измеряется при растворении образца весом 1 г в 100 мл воды. Найдено, что оно имеет рН 6,6-7,2. Это указывает на ТО, что предлагаемое вещество, по cyществу, нейтрально. Оптическое вращение. Оптическое вращение предлагаемого вещества измеряют, применяя 0, водный раствор образца, чтобы определить удельное вращение Со(. Оно находится в области от О до 30 и предполагается, что предлагаемое вещество состоит преимущественно из |Ь-глюкана, удельное вращение которого порядка 0. ИК-спектр поглощения. ИК-спектр поглощения предлагаемого вещества, измеренный методом табле ток в бромистом калии, показан на фиг. 1. Широкую полосу поглощения при 3600/3200 скГ относят к l) ОНгрупп, которые в различной степени вступают в водородную связь. Это мож- но объяснить тем, что широкая полоса поглощения ослабляется или исчезает, когда гидроксильные группы в полисахаридной части образца метоксилиЬуют. Поглощения при 1бОО и 1530 см при- писывают деформационным колебаниям п соответственно. Предполо-т и жительно такое явление возникает от белковой части образца. С другой стороны, широкие полосы поглощения при ; 1200-1000 см рассматривают, как вызванные несимметричным валентным-колебанием связи С-О-С в пиранозных кольцах в полисахаридной части. Кро-. ме того, при 890 смг наблюдают характерный тип поглс цения, возникающий от fb-связи глюкозы в полисахаридной части, но характеристическое поглощение при BlO см, возникающее от(-свяг зи, различают с трудом. Структура полисахаридной части. Для определения структурных характеристик полисахаридной .части предла-; гаемого вещества к образцу весом О добавляют раствор соля ° кислоты в метаноле, чтобы выпол ить метанолиз при в течение 16 ч, и затем, после введения триметилсилильных групп обычным способом. подвергают газохроматографическому анализу. Результаты показывают, что глюкоза составляет более 99% общего количества сахаридов, а другие сахаридные компоненты, такие .как анноза, галактоза, ксилоза и фруктоза, ..-представлены очень скудно. Для того, чтобы установить тип глюкозы (D- или L-тип), кристаллы глюкозы отделяют от продуктов гидролиза предлагаемого вещества. Найдено, что точка плавления отделенной глюкозы находится в области от до , и когда кристаллы глюкозы смешивают со стандартной I)-глюкозой, не наблюдается снижения точки плавления. Поэтому глюкозу, .составляющую полисахаридную часть предлагаемого вещества, идентифицируют как D-глюкозу. Характеристики вида связи сахаридов, составляющих полисахаридную часть. Положение глюксзидной связи определяют следующим образом. Типы связи G означает структуоный скелет глюкозы ; -..G-- и «- - подтверждают из анализа моносахаридов, полученных по методу окис ления .периодатом или разложением по способу Смита, и их соотношение в со )ставе определяют в опытах по метилигрованию по способу Хеуорса. В процес се идентификации сахариды, полученные при гидролизе метилированных соединений, идентифицируют с помощью газовой хроматографии как альдитолацетат и метилглюкозид. Индивидуальные продукты, гидролиза выделяют жидкосгной хромагогрёфйей не колонке и затем кристаллизуют или переводит в их кристаллические производные.для подтверждения. Молярные соотношения каждой связи в предлагаемом веществе даны в табл. «, причем молярное содержание G-г -связи принято за 1 Молярные соотношения, приведенные .в табл. k, определяют по площадям пи ков на газовой хроматограмме альдитолацетата. . видно из табл. k, считается что полисахаридная часть предлагаемо го вещества состоит, главным образом из fi 1,4-связей, МО в этой полиса харидной части существуют также и |4-Т,3-связи и многие ответвления. На основании этого можно сказать, что полисахаридная часть предлагаемого вещества представляет ёобой структуру, в которой боковые цепи связаны с главными цепями целлюлозы и сущест |Вуют отдельные р-1,3-свяэи. Характеристики белковой части. Белковую часть предлагаемого вещества гидролизуют обычным способом и аминокислоты, составляющие продукты гидролиза, анализируют с помощью анализатора аминокислот. Содержание аминокислот, составляющих белковую часть, вес.: 4.впарагиновая кивуАн та13-19 Треонин 6-10 Серин6-11 Глутаминовая кислота12-18 ПролинСледы - 8 Глицин6-9 Аланин6-13 ЦистеинСледы Валин5-11 Метионин1-4 Изолейцин3-5 Лейцин Тирозин Фенилаланин Триптофан Гистидин Аргинин Аммиак Следовательно, белковая часть предагаемого вещества содержит 18 видов минокислот, среди которых преобладат кислые и нейтральные аминокислоты, количество основных аминокислот чень ограничено. Для предлагаемого ещества также характерно, что аспараиновая кислота, треонин, серин, глуаминовая кислота, глицин, аланин, алин и лейцинвместе составляют боее 70 всех аминокислот, найденных белковой части. , Хотя присутствие глюкозамина таке подтверждается при аминокислотном нализе, количество этого вещества оставляет Менее 1% по весу от общего оличества белка. Что касается связи этих аминокислот полисахаридной частью, предполагаетя, что аминокислоты прочно связаны полисахаридной частью в виде олигоептида или пептида. Это предложение можно вести из реультатов различного рода испытаний. При испытанияхПО методу Севага, который часто применяют для удаления из образца 1римеси белка, образцы предлагаемого вещества осадка не образуют. Для практического осущебтвлеН1ия этого метода добавляют 1/5 объема хлороформа и 1/25 объема Н-бутанола к водному раствору каждого образца (желательно поддерживать величину рН раствора от 4 до 5) и затем энергично встряхивают смесь. Раствор внимательно рассматривают, чтобы определить, образуется ли какой-нибудь гелеобразн)й ocafjOK или нет. Если полисахарид. часть « белок существуют в образце в виде простой смеси, белок денатурируется, образует гель и оседает между слоем воды и слоем хлороформа, но такого осаждения не происходит в том случае, когда полисахарид и белок связаны. Еще в одном опыте по осаждению, который проводится подобным образом С пр1именением трифтортрихлорэтана, снова не наблюдается образования осадков из образцов предлагаемого вещества. Кроме того, образцы предлагаемого вещества не показывают изменения содержания белка в опыте, в котором на образцы предлагаемого вещества воздействуют протеазой - протолитическим энзимом. На основании результатов предыду- щих испытаний предполагается, что в предлагаемом веществе полисахаридная и белковая части не просто смеша ны одна с другой, а химически связаны друг с другом. Что касается типа связи полисахаридной и белковой частей в предлагаемом веществе, то известны следующие типы свяэк сахара и белка: М-ацилгликозиламинный, 0-глюкозидный и глюкозидэфирный, но в Случае предлагаемого вещества, в свете тех фактов, что связи могут с трудом разрушаться слабой щелочью и что после гидролиза предлагаемого вещества при анализе аминокислот отмечают присутствие глюкозамина, считается, что в предлагаемом веществе преобладает N-ацилглюкозиламинный тип связи. Протонные спектры ядерного магнитного резонанса ,ЯМР . ЯМР (100 МГц ) предл.агаемого вещест ва измеряют, применяя в качестве раст ворителя тяжелую воду и выбирая в качестве стандарта 2,2-диметил-2-силано пентан-5-сульфонат натрия (ДСС). Ре зультаты приведены на фиг. 2-6. Если предполагается, что поглощение от 0,5 до 2,3 миллионных долей (м.д.) по ДСС связано с протонами боковых цепей белковой части, а поглощение от 2,5 до 6,0 м.д - с протонами поли: сахаридной части, и если свойства предлагаемого вещества, в соответстви с приведенными определениями, выражаются посредством соотношения интексивности сигналов протонов Двух частей, то такое соотношение находится в области от 95/5 до 55А5. При упомянутых измерениях ЯНР для устранения влияния .остаточной легкой воды в тяжелой воде пользуются величинами после коррекции в соответствии с допущением кривой Лоренца. Относительно поглощения полйсахаридной части пик поглощения при 2,5-,1 м.д. возникает благодаря протонам метиленовой группы в 2- и 6-пог ложениях в пиранозных кольцах цепи сахара. Для сравнения может быть пред ложен продукт, полученный из экстракта гриба, принадлежащего к Cortolus versicolor (Fr.) Quel, после фильтрации экстракта под давлением, горя- чей стерилизации и высушивания распылением (такой продукт обозначается как Р5-К). Наибольшим различием между PS-K - предлагаемым веществом, как из фиг. 2-6, является то, что в случае предлагаемого вещества абсолютно не наблюдается поглощения в области 4,9-6,0 м.д., возникающего из-за ; с(-связей. Этот факт подтверждает, что полисахаридная масть предлагаемого вещества состоит из одного в -D-глюкана. Поглощение при Ц,5 м.д. (фиг. 2Уотносится кр-:() И -(1 6) в протонах метина в 1-ом положении, в то время, как поглощение при Л,7 м.Д. связывается с (i-(1- 3 , и ( 1 - 2) в протонах метина в 1-ом положении. Поэтому можно опреде- лить соотношение р (1 - ) и Ji-(l )/ -(1 - 3) и ()/ - (1 -ч 2) t но так как включается также разветвленное строение, упомянутый метод метилирования должен быть использован для разъяснения тонкой структуры Что Касается белковой части,едва ЛИ можно считать доказанным строение такой белковой части только на основании измерений спектров ядерного магнитного резонанса. Однако, так как предлагаемое вещество показывает по-; глощение в некоторых, упомянутых ниже, заданных областях, этот метод считается очень подходящим Для идентифика-. ции предлагаемого вещества. Предлагаемое вещество показывает поглощение при 0,9-0,1; 1,21.0,1; 2,0±i),1; ,,1 и ,,1 м.д., не поглощает в области ,0 м.д. и дает широкую полосу поглощения в области 3,, М.Д. Молекулярный вес. Молекулярный вес предлагаемого вещества, измеренный методом ультра-; центрифугирования, находится в облает ти 5000-300000 и средний молекулярный вес находится в области ШООО100000. Величины, полученные при других способах определения, таких как фракционирование с помощью ультрафильтрации, также попадают в область lOOOO-lOOOGQ. Поэтому можно предположить, что средний молекулярный вес предлагаемого вещества лежит в области 10000-100000. Таким образом, предлагаемое вещест во является нЬвым веществом, полученным из полисахаридов, связанных с белками (Р S-k), происходящих из гриба, принадлежащего к Cor id us, и не содержащим сб-глюкан, согласно измерениям ЯМР, поэтому предлагаемое вещест во должно отличаться от Р S-K. Вещест во легко идентифицировать посредство точного определения области поглощения при измерениях ЯМР, поэтому техника идентификации, относящаяся к предлагаемому веществу явпкется ценным ориентиром при изучении сложных высокомолекулярных веществ, извлеченных из природных материалов. Противоопухолевая активность. Испытания острой токсичности на мышах и крысах При этих испытаниях используют мы 1№ей ICR-ICL S-rain 4-5-недельного воз раста, весящих 21-2 г, и крыс расы Оапгип Ц-5-недельного возраста, весящих 100-150 г. Предлагаемое вещест во вводят следующими четырьмя спосо бами: внутривенно, подкожно, внутрибрюшинно и стоматически. Через 7 дне после введения вещества проводят наблюдения общих симптомов, гибели и веса тела и после завершения наблюде НИИ животных умерщвляют и вскрывают. Результаты испытаний острой .токсично ти на мышах и крысах представлены в табл. 5. Даже введение максимальной ДОЗЫ не вызывает гибели животных ни крыс, ни мышей, и практически невозможно вычислить вели чины od . Испытания противоопухолевой актив ности. Противоопухолевая активность in vitro. Подавляющая активность In vitro против роста клеток асцитической гепатомы АН-13. Исследуют концентрацию LCcp подавляющую рост на 50%. Предлагаемое вещество, последовательно разбавленное, добавляют к суспензии клеток асцитической гёпатомы АН-13 и после i 8-4acoBoro Еыращивания подсчитывают живые клетки методом окрашивания, чтобы определить подавление роста. Результат показывает, что LCjo предлагаемого вещества составля ет 100 мг/мл. .Активность in vitro против роста клеток асцита Эрлиха мышей. Исследую влияние предлагаемого вещества на по глощение Н-уридина и Н-тимидина клетками асцита Эрлиха мышей (ЕС-клетки) , ЕС-клетки () выращивают в питательной среде Eagle MEM, содержащей 500, 1000 и 2000/J г/мл предлагаемогр веществами 0,5 С/мл Н-уриди - 1 --.,, на или Н-тимидина, при в течение 120,мин. Для контроля вместо предлагаемого вещества добавляют стерильный физиологический раствор. Предлагаемое вещество может уменьшить поглощение Н-уридина РНК ЕС-клеток до 70% от контрольного при содержании предлагаемого вещества , через 120 мин, до 6S% от контрольного при 1000;Мг/мл и до 60 от контрольного при 2000/1Г/МЛ. Предлагаемое вещество может также уменьшить поглощение Н-тимидина ДНК ЕС-клеток до при 500у«г/мл, до 60% при OQO г/мл и до 2000 г/мл, через .120 минут, соответственно. Испытание противоопухолевой активности in vivo и in vitro. (Подавляющая активность предлагаемого вещества против роста клеток асцита Эрлиха). Исследуется против роста клеток асцита Эрлиха мышей. ЕС-клетки (5x10 клеTOK/rvi) инкубируют в растворе Ханка, содержащем 5000 г/мл предлагаемого вещества, при в течение 3 ч. После инкубации ЕС-клетки пересаживают в брюшные полости ICR-iCL мышей- самок (10 мышей в каждой группе количестве 10 клеток на мышь и в регистрируют случаи гибели животных в течение 2( дней. Не наблюдается гибели животных в течение 20 дней после пересадки мышам ЕС-клеток, обработанных предлагаемым веществом. Имеется несколько мышей, у которых отсутствует накопление асцита. С другой стороны, все мыши контрольной группы, которым привиты ЕС-клетки, погибают от опухоли в течение 20 дней после пересадки. Испытания противоопухолевой активности in vivo. Результаты испытаний противоопухолевой активности in vivo на мышах и крысах приведены в табл. 6. Предлагаемое вещество показывает высокую противоопухолевую активность вкаждом случае, Итак, получаемое вещество - полисахарид, связанный с белками, показывает очень эффективное действие при ррименении в качестве противоопухоле вого вещества, вводимого стоматически. Предлагаемое вещество, кроме то1396го, придает способность к иммунитету через хозяина и является эффективным для предотвращения ухудшения или рез кого Падения иммунитета или физической силы Больных, которые прошли раз личные курсы лечения, такие как хими терапия, радиотерапия, хирургическая операция или переливание крови, неза висимо от того, были ли они поражены раком или нет. Более того, предлагаемое вещество эффективно также для защиты больных от инфекционных болез ней, таких как гепатит или пневмония, которые могут быть вызваны зара жением вирусами или бактериями в результате ослабления или упадка иммунитета или физической силы. Кроме того, предлагаемое вещество при стоматическом введении больному не только способствует улучшению общего физического состояния, но так же действует как облегчающее работу кишечника и улучшающее аппетит больного. Предлагаемое вещество оказывается также очень полезным-для улучше ,.ния функции кишечника больного, который длительное время лежит в постеш Примеры 1-. Продуценты каждая линия СМ-101 (FEPM-P Jf 2kn , СМ-102 (FEPM-P tf 2lt13 и СМ-103 (FEPM-P If 2 , принадлежащих к CoriolusversTcolor (Fr.) Quel, засевается в 200-миллилитровую коническую колбу, содержащую 30 мл питательной среды, имеодей следующий состав, %: глюкоза 5, пептон 0,2, дрожжевой экстракт 0,3, КН, 0,1 и 0,1. Культивирование стационарно при 25-27 0 в тече ние 10 дней и мицелиальную пленку, выросшую на поверхности питательной среды, гомогенизируют физиологически раствором для получения посевного ма териала. Посевной материал затем высевают в каждую из однолитровых колб для выращивания, содержащих 200 мл той we самой питательной среды, и ин кубнруют при 25-27С в течение 25 , дней, чтобы посредством этого получить грибницу. Мицелиальный выход составляет г. на колбу для СМ-101 2,0-2,5 г для СМ-102 и 2,7-3,2 г для СМ-103.Затем к каждой полученной грибниj e (JOO г) добавляют 3 л дистиллированной воды и каждую из грибниц экстрагируют при перемешивании при 98 в течение 3ч. После завершения экстракции каждый раствор разделяют на экстракт и остаток от экстракции, 1 остаток от экстракции подвергают такой же обработке посредством экст;акции,как упомянуто,используя каждый из водных растворителей, указанных в табл. 7. Каждый из экстрактов собирают и затем концентрируют. Концентрированный раствор экстракта насыщают сульфатом аммония и получают осадок. Полученный осадок снова растворяют в воде и подвергают обессоливанию посредством диализа, используя целлюлозную мембрану. Полученный таким образом раствор концентрируют до S% по ресу, затем добавляют сульфат аммония в количестве, соответствующем 25 от величины насыщений. После удаления осадка, образовавшегося при упомянутой обработке, к раствору снова добавляют сульфат аммония в количестве, соответствующем kQ% от величины насыщения. Полученный осадок растворяют в воде и подвергают такому же обессоливанию, как- упоминалось, затем пропускают через колонку с ДЭАЭ-целлюлозой. Адсорбированное на колонке вещество промывают водой, затем вымывают одномолярным солевым раствором. В элюат снова добавляют сульфат аммония в количестве 0 от , величины насыщения и образовавшийся в результате осадок собирают и снова растворяют в воде. Полученный раствор обессоливают посредством диализа и концентрируют, затем высушивают распыливанием и получают посредством этого искомое вещество. Свойства полу- . ченного вещества и результаты его испытаний на животныхприведены в табл.7. Метод щелочного экстрагирования с . .применением в качестве растворителя щелочи осуществляется так же, как описанный способ, за исключением того, что вместо воды в повторной экстракции осадка применяют 1/10 н. раствор едкого натра и после завершения экстракции доводят величину рН до нейтральной с помощью 1/10 н. соляной кислоты..В табл. 7 приводится инфракрасный спектр поглощения, измеренный по способу таблеток в бромистом калии, который графически изображен на . 1 на котором видно поглощение 1/ ОН при 2600-3200 деформационные колебания - -т при 1600 и 1530 см1 соответственно, широкое поглощение при 1200-1000 см - антисимметричные валентные колебания С-0-С-связи пиранозных колец о полисахаридной части и специфичное поглощение при 890 см, вызванное/ -связью глюкозы, но поглощение при (с/-связь) едва заметно. Так как большого различия в инфрарасных спектрах поглощения отдельных образцов«не отмечается, в качестве ти пичного представителя даны результаты одного примера 1. Измерения ЯМР проводят, выбирая в качестве внутреннего эталона ДСС и 1Применяя в качестве растворителя тяжелую воду. Данные, приведенные в -1-1 Габл. 7, представляют собой величины Лосле коррекции в соответствии с допущением кривой Лоренца для устранения влияния остаточной легкой воды ё тяжелой воде. Молекулярный вес предлагаемого вещества измеряют, применяя метод ультрацентрифугирования. Он равен 5000300000 для всех образцов. Для измерения используют седиментационное равновесие и искусственную граничную модель, применяя интерференционную оптическую систему. Условия эксперимента следующие: концентрация образца 0, растворитель 1/10 н. КС1; температура 25°С; длина столбика раст.вора 1,7 мм; скорость 22000 об/мин; ёремя измерения 5ч. Аминокислотный анализ выполняют 6 cooтвeтctвии с обычным методом путем добавления 4 мл 6о н. соляной кис лоты к 10 мг каждого образца, замораживая его в смеси сухого льда и аце :гона, запаивания образца в трубке под уменьшенным давлением, гидролизуя его течение 24 ч, при высушивая и затем растворяя в мл лимонноКислого буферного раствора с величиной рН 2,20. При определении удельного вращения сначала измеряют оптическое вращение bJJ-линией натрия ( 589 мм), используя 0, водный раствор каждого образца и 5-сантиметровые ячейки, и вы14ИСЛЯЮТ удельное вращение о J из из меренного оптическоговращения Измерение моносахаридного состава предлагаемого вещества проводят еле- дующим образом. 3 мг каждого образца помещают в 5-миллиметровую стеклянную ампулу, в которую добавляют 10 мл 3 -ного раствора хлористого водорода в метаноле, и проводят метанолиз при в течение 16 ч. Образовавшийся Продукт нейтрализуют углекислым серебром и отфильтровывают при комнатной температуре. Фильтрат упаривают досуха и затем растворяют в 0,5 мл сухого пиридина. В полученный раствор добавляют 0,2 мл гексаметилдисилазана и 0,3 Мл триметилхлорсилана и смесь оставляют стоять в течение 30 мин при комнатной температуре, чтобы осуществить введение триметилсилильных групп. По завершении этого процесса смесь раст(воряют в хлороформе и, после удале ния избытка реагента промыванием во- дои, полученный раствор упаривают , милунсппмп pauiDUp у i ictyn uonj I ди суха. Обработанное таким образом вещество (триметилсилат ; растворяют в четыреххлористом углероде и оценивают посредством газовой хроматографии. i Тип связи сахаридов определяют в соотёетствии со способом Хеуорса. Т.е. 2 г каждого образца растворяют в 10 мл 1 н. раствора ЫаОН и, поддерживая тем-г пературу смеси tO-5flC в токе азота, при интенсивном перемешивании добавляют по каплям 20 мл диметилсерной кислоты и 0 мл 30 -ного раствора гидроокиси натрия в течение нескольких часов. После отстаивания смеси в течеиие ночи ее подвергают такой же обработке тем же самым количеством метилирующего реагента. После нейтрали- . зации реакционный раствор диализуют в протекающей воДе, диализат концентрируют при уменьшенном давлении и подвергают трехкратному метилированию. После дополнительной нейтрализации и диализа смесь упаривают досуха при . уменьшенном давлении. Оставшееся вещество растворяют в 20 мл смеси хлороформа с метанолом (10:0 и к раствору добавляют смесь петролейного эфира и эфира (1:1) для осаждения метилированного вещества. Затем 20 мг этого метилированного вещества подвергают гидролизу с 1 н. серной кислотой при в течение 16 ч и продукт гидролиза обычным способом переводят в альдитолацетат, молярное соотношение определяют по площадям пиков на газовой хроматограмме. Для того, чтобы различить 2,3,6-три-0-Ме-О и 2,3, --три-0-Ме-6-, 20 мг метилированного вещества подвергают метанолизу при в течение 16 ч в запаянной трубке, применяя раствор хлористого водорода в метаноле. При5 сутствие 2,3,-три-О-Ме-О- в продукYe метанолиза не подтверждается газо роматографическим анализом. Каждый из упомянутых продуктов разложения идентифицируют по газовой хроматогра мме, используя эталон. Кроме того, каждый из упомянутых продуктов разложения выделяют, применяя жидкостну хроматографию на колонке и/или кристаллизуют или переводят в кристаллическое производное. Свойства, структурные характеристики и противропухолевartrактивность полученных таким образе веществ полисахаридов, связанных с белками, показаны в табл. 7 При меры 5и6. Проводят аналогично примерам 1- с использова нйем штамма грибков FEPM-P Н 2711 Corlolus hirsutus (Fr.) duel. При этомлолучают практически те же самые результатыI что и в ходе проведения эксперимента примера 1, когда исполь зуют грибки Corlglus verslcolor (Fr) duel (штамма FEPM-P ff .). Другие эксперименты проводят аналогично варианту способа, описанному в примере 1, с использованием штамма FEPM-P ff 2712 грибков Coriolus pargamenus (Fr.) Pat. При этом также достигают лрэктически те же результаты, что и ;в ходе проведения эксперимента примера1. Свойства получаемых веществ приведены в табл.8. Получаемые вещества имеют структурру, в которой белок связан с полисахаридной частью. Предлагаемое вещество не имеет запаха, безвкусно и растворимо в воде, имеет светло-коричневую или коричневую окраску. Кроме , предлагаемое вещество не имеет определенной точки плавления и постепенно чернеет и разлагается при температуре выше . а б, л и ц а 1 .



















| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения полисахаридов, обладающих противоопухолевым действием | 1977 |
|
SU704431A3 |
| Способ получения полисахарида, обладающего противоопухолевым действием | 1977 |
|
SU740156A3 |
| Способ получения азотсодержащего полисахарида, промотирующего чувствительность к лекарствам у бактерий, устойчивых к антибиотикам | 1978 |
|
SU793408A3 |
| КОНЬЮГАТ ДЛЯ ИММУНОФЕРМЕНТНОГО АНАЛИЗА И СПОСОБ ИММУНОФЕРМЕНТНОГО АНАЛИЗА | 1992 |
|
RU2014610C1 |
| Способ получения полисахаридов, обладающих противоопухолевым действием | 1976 |
|
SU786855A3 |
| Способ получения полисахаридов | 1978 |
|
SU1403990A3 |
| Способ получения азотсодержащих полисахаридов, обладающих противоопухолевым действием | 1977 |
|
SU730277A3 |
| ПИТАТЕЛЬНАЯ СРЕДА ДЛЯ КУЛЬТИВИРОВАНИЯ БАЗИДИАЛЬНЫХ ГРИБОВ-ПРОДУЦЕНТОВ КОМПЛЕКСА ФЕРМЕНТОВ | 1992 |
|
RU2096449C1 |
| СПОСОБ ПОЛУЧЕНИЯ ФЕРМЕНТНОГО ПРЕПАРАТА ЛАККАЗЫ | 2005 |
|
RU2349644C2 |
| Способ получения гипотриглицеридально-активных полисахаридов | 1984 |
|
SU1732815A3 |

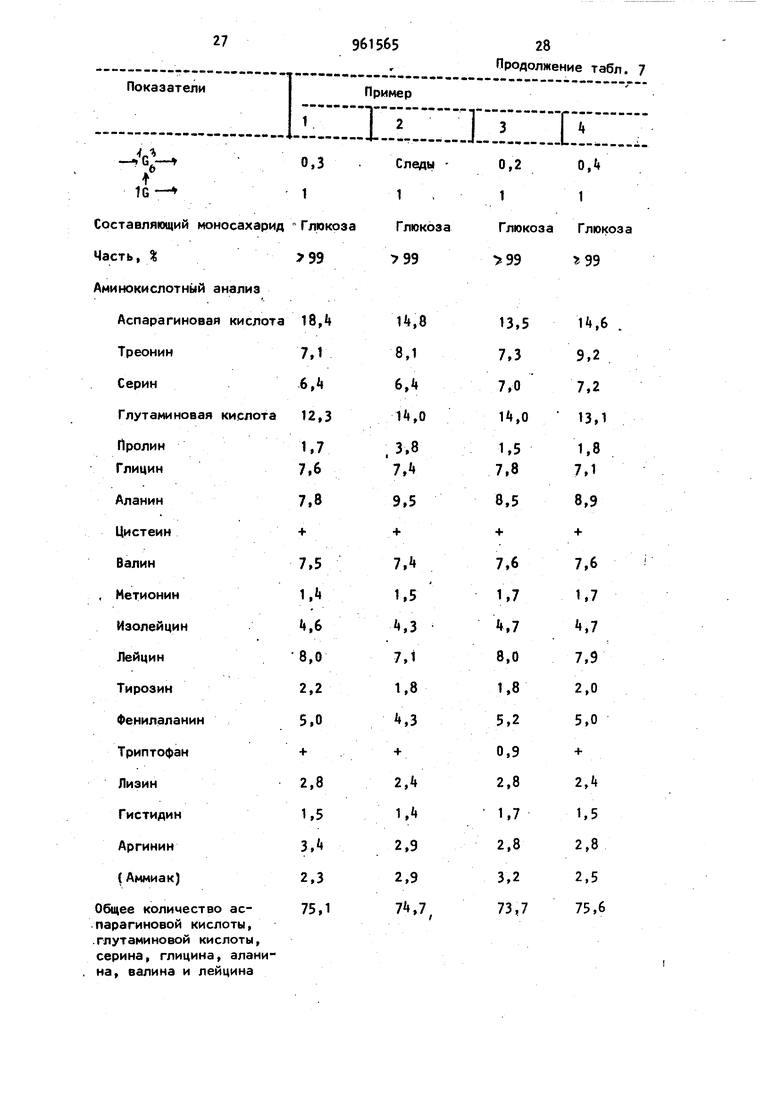
Раковое 1000x10 .новообразование 500x10 Эрлиха .
Саркома-180 1000x10
дозировка,мг/кг в день, умноженная на число назначенийё
..-. -- -- Цветная реакция Ц Цвет/J
« «,Mi«««« J«B MM 4 М м« ««
Реакция с о6-нафтолом и серной кислотой
Реакция с индолом и серной кислотой
Реакция с антроном и серной кислотой
Реакция с фенолом и серной кислотой
65 50
95 85
85-90 60-65 83-89 50-55 500x10
Таблица 2 Результаты
Пурпурный Сахариды
КоричневыйЗеленовато- - голубой
Коричневый
Д996156520
, Продолжение табл. 2
Цветная реакция Цвет Г Резу|1ьтаты
Реакция с триптофаном Пурпурно- . - и серной кислотой коричневый
Способ Лоури-Фолина Голубой Пептидные
.ЗИН j триптоРеакция с нингидридомФиолетово- ct-Аминокислоты
после гидролиза соля-голубой ной кислотой (6 н. НС1,
, 20 ч.
««-«м м« шм « ««««.««цм. ..м
. -. г
- --- - --.- -г---- ------------ - ----
УсловияСодержание влаги, %, через ч
1 I 3 7 2i I 72 96 jlt
Относительная влажность 98% Температура20 С 10,0 12,5 16,0 22,5 25,5 27,027,027,0
Относительная влажность 79
Температура25°С 9,0 9,5 11,7 15,0 15,5 16,016,617,0
Относительная влажность 52%
Температура20 С 9,0 9,5 11,7 15,0 15,3 15,515,716,0
Относительная влажность 32%
Температура16, 8,0 8,5 9,0 10,0 12,5 12,512,512,5
Продукты гидролиза Связь Молярное метили рованных- соотношесахаридовние
2;3,,6-Тетра-0-ме-.
тил-СG . 1
2,3,6гТри-0-ме- .
тил-С-- G - 3-12
2,3-Ди-О-метил-С- G ,5-3
2,6-Ди-О-метил-С.,1-2,5
2 ,1 -Ди-0-метил-С- Q или менее
2,,6-Три-0-метмл-С - G или менее
связи, тирофан, цистеин
т а б л и ц а 3
Т а б л и ц а Д
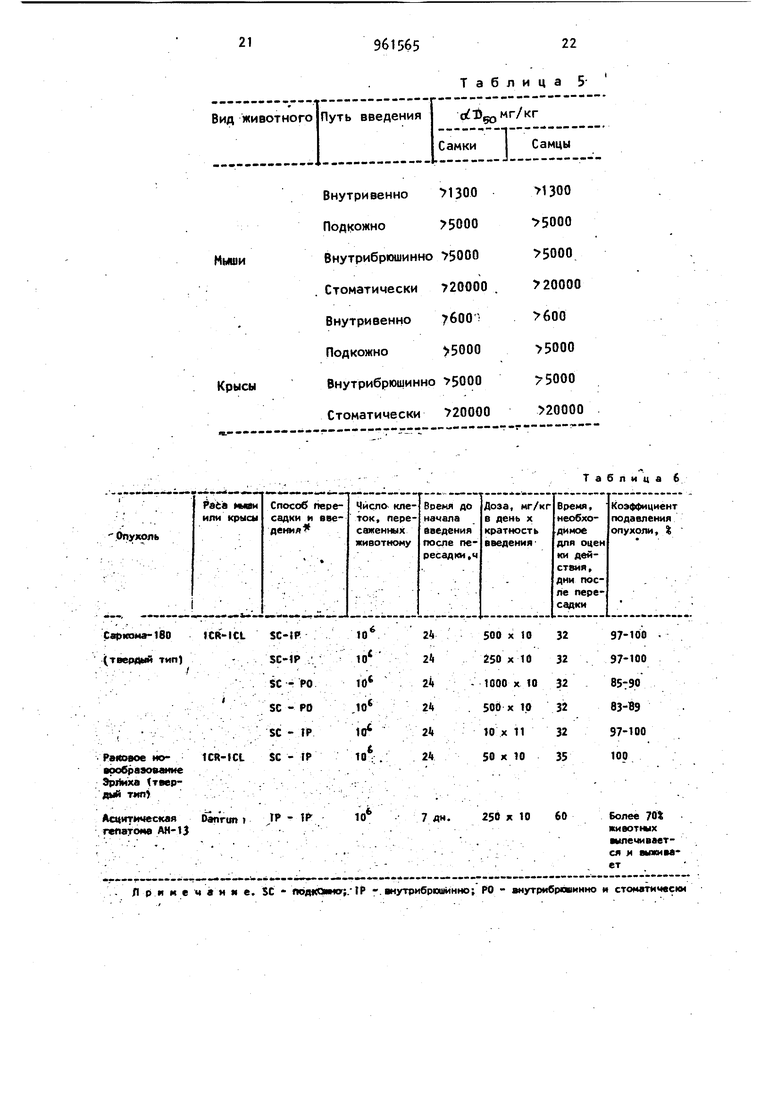
Внутривенно 1300 1300
Подкожно 5000 5000
Внутрибрюшинио 5000 5000 Стоматически 720000 . 20000
Внутривенно 7бОО 600
Подкожно 5000 5000
Внутрибрюшинно 50005 5000 Стоматически 20000 20000 Л р и и е ч и я е. SC
Таблица 5
Таблица 6 Лбдксммог;.-1Р . виутрибрюшйнно; - вмутриброиинно и стоматически вес( X Цветная реакция (сахарид Реакция с о -иафтолом Пурпурный и серной кислотой Коричневый Реакция с индолом и серной кислотой Реакция с антроном Зеленовато голубой и серной кислотой Коричневый Реакция с фенолом и серной кислотой Реакция с триптофаном Пурпурнои серной кислотой .коричневый Цветная реакция (белок) Способ Лоури-Фолина - Голубой Реакция с нингидринон Фиолетово после гидролиза с со- гойубой ляной кислотой (6 н. НС1, 20 ч )
г
Удельное вращение в J
л
ИК-спектры поглощения,см 3600-3200
1600
+2
4-1
Присутст- Присутствует вует Пурпурный Пурпурный Пурпурный КоричнеКоричневыйКоричневый вый ЗеленоватоЗеленоваЗеленоватоголубойголубой .то-голубойКоричнеКоричневыйКоричневый вый ПурпурноПурпуриоПурпурнокоричневыйкоричневый коричневыйГолубой Голубой Голубой Фиолетово-ФиолетовоФиолетовоголубой голубой голубой
парагиновой кислоты, .глутаминовой кислоты, серима, глицина, алани на, валика и лейцина
31
Противоопухолевая активность In vftro на ингибирование роста клеток асцитйческой гепатомы АН-13, умг/мл
105
Ингибирующее действие In vitro на рост клеток асцита Эрлита (ЕС-клеток) мышей
Поглощение Н-уридина РНК ЕС-клеток через 120 мин (контрольное принято за 100),г/мл
71 6k
500
1000
59
2000
Поглощение Н-тимидина ДНК ЕС-клеток через 120 мий (контрольное принято за 100,11г/мл
500 1000
2000
одавление роста клеток сцмта Эрлиха, г/мл Все выжи- Все вают Противоопухолевая активность In vivo (ингибирование роста) Саркома-180 мышей, мг/кг 10
1 1
250 500 500
РО 1000
32
961565 Продолжение табл. 7
98
97
100 выживают Все выжи- Все выживают вают Показатели Раковое новообразование Эрлиха мышей, мг/кг р 50 АН-13 крыс (выжившие)/ УЧИСЛО использованных крыс, через 60 дней , мг/кг if 2507/10 . - - - - - - -Штамм FEPM-P, W
Метод экстракционной обработки
Выход продукта на 100 г сухих грибко г
Молекулярный вес
Средний молекулярный вес
Цветные реакции сахарида
Реакция с о -нафтолсуяьфокислотой Реакция с индолсульфокислотой Реакция с антронсульфокислотой
Реакция с фенолсульфокислотой Реакция с триптофансульфокислотой
Цветные реакции белка
По методике Лоури-Фолина
Реакция с нингидрином после гидролиза 6 н. соляной кислотой в течение 20ч 2711
2712
Горячей водой
0.4
0,6 - 30 X Ю
8,3 X Ю
о
Пурпурная Коричневая
Зеленоватоголубая
Коричневая
чПурпурно-коричневая
Голубая Голубая Пурпурно-голубая Пурпурно-голубая Продолжение табл. 7 , (Ш. IKflB Пример j;i;r j;;;i:;i::i: 100 100 100 . 8/10 8/10 В/10 - - - - - I Т а б Л И Ц а . 8 .... Corlolus pargamenus (Fr.) Pat
35
Удельное вращение Сс 3
Спектрограмма поглощен лучей, см Г
3600 - 3200
1600
1530
1200-1000
890
ЯМР-спектрограмма Зона поглощения, ррт
0,,1 l,2tO,1 ,1 1,,1
,7tO,1
5,OtO,1
5,,n 3.0tl,A
Коэффициент интенсивно для полисахарида для белка
Гликозидный анализ т связи)
.
G/1-4
36
961565 Продолжение табл. 8
+
ч- 6
ется полоса
Имеется полоса III
м ll
. II -,
н и
и .
Отсутствие-полос Отсутствие полос
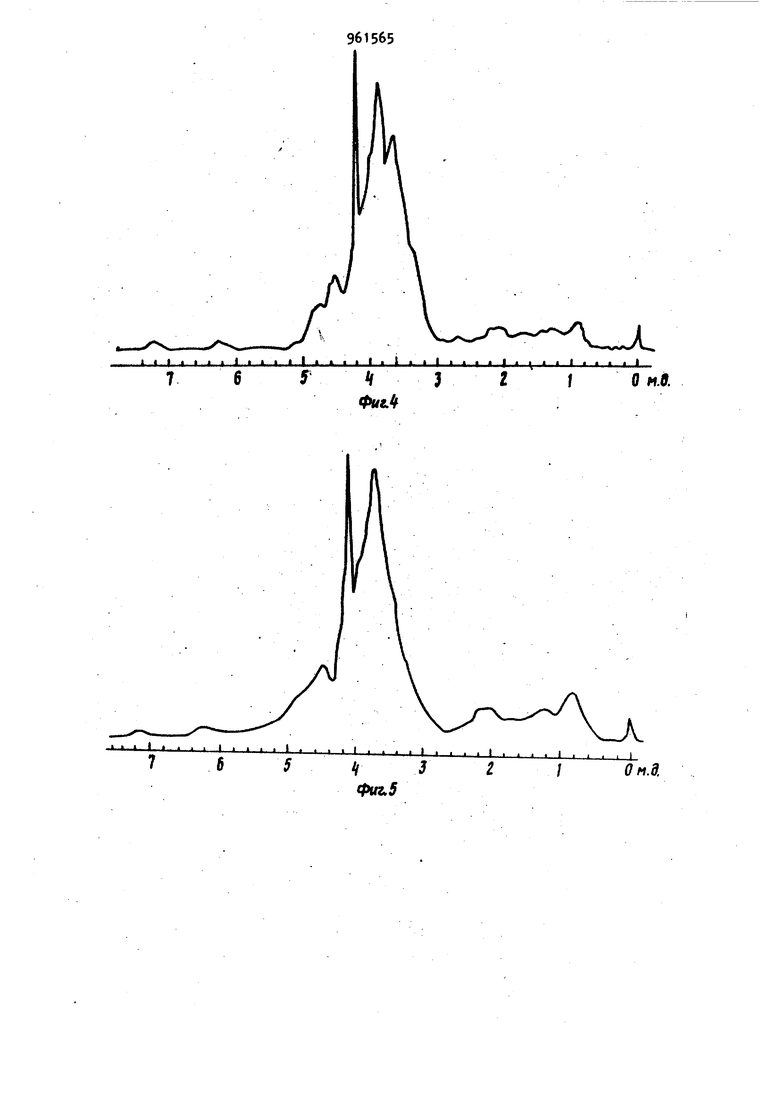
Фиг. 6
Фиг. 5
Отсутствует
вует
II
Имеется
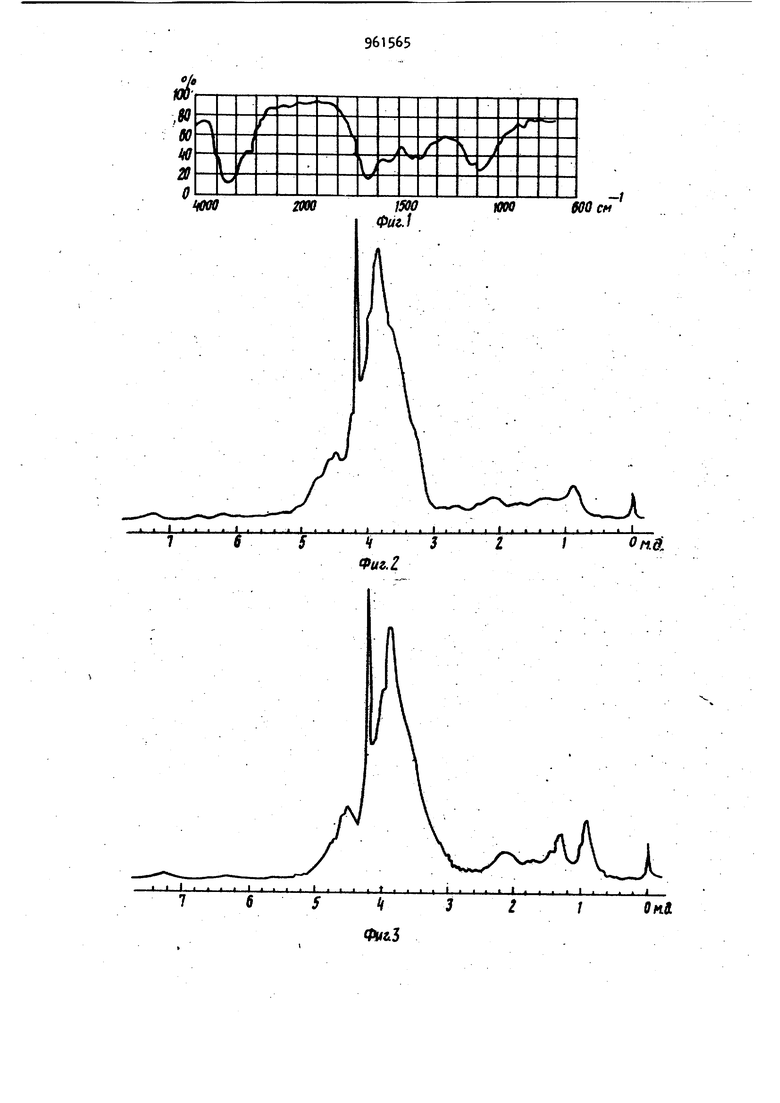
82,5 17.5
.З. 1.7 0.9 0,6
37
Вид ,
,8
i
Состав моносахарида
Содержание, % Peзyлbtaты аминокислотного
асларагиновая кислота
треонин
серин
глутаминовая кислота
пролин
глицин
аланин
цистеин
валин
метионин
изолейцин
лейцин
тирозин
фенилаланин
триптофанлизин
гистидин
аргинин
, {аммиак )
Общее содержание аспаргинолоты, глутаминовой кислоты
аланина, валина и лейцина
961565
38 Продолжение табл. 8
Coriolus hirsutus
Corfolus pargamenus (Fr.) auel (Fr.) Pat.
0,8 1
Глюко 99
17,8
7,2
10,1
1,5
0,7
8,6
8,1
Следы
6,5
1,3
3,
7,9 0,3
,1 Следы
3,2
0,8 3,0 2,5
73,5
961565
39 Т--
страя токсичностьс/1) мышей, мг/кг
при внутривенном введении самцы самки
При подкожном введении самцы самки
При внутрибрюшинном введении самцы самки
При введении через рот самцы
Сёмки.
Острая токсичность для крысi мг/кг При внутривенном введении: самцы самки
При подкожном введении самцы
. самки
При внутрибрюшинном введении:
самцы
самки X. При введении через рот
самцы самки П(отивоопухолевая активность.
40 Продолжение табл. 8 iCorlolus hirsutus I (Fr.) Quel
13оо
1300
5000 5000
5000 5000
20000 20000
600 600
5000 5000
5000 5000
20000 20000 р---Г iCortotus pargamenus I (Fr.) Pat, Подавление роста асцитной гепатомы в лабораторных условиях, клетки АН-13, Хс омкг/млtoo Способность подавлять рост асЦитных клеток Эрлиха (клетки ЕС ) в организме мышей в лабораторных условиях: По истечениии 120-мииутного поглощения Н-уридина РНК клеток ЕС (за контрольный результат взято 100) МКГ/ЙЙ 50070 100063 200059 . По истечении 120-минутнрго поглощения Н-тимидина ДНК клеток ЕС (за контрольный результат взято 100 , икг/мп 500 .61 100060 200050 Подавление роста асцитны; клеток Эрхтха 3000 мкг/мл
Противоопухолевая активность бораторных условиях (подавлен
Мышиная саркома-180 .
I.
Внутрибрюшинное введение, мг/кг
10
250
500
Введение через рот, мг/кг
500
1000 Пол мос
98
100
100
85 Вид
Мышиная болезнь Эрлиха
Внутрйбрюшинное введение, мг/кг
Крыса АН-13 (выживаемость: число использованных для опыта животных по истечении 60 дней)
Внутрйбрюшинное введение, мг/кг
29Р ,
;. Формула изобретения
Способ получения мукопрлисахаридоо, Предусматривающийэкстракцию их из . мицелия и/или плодовых тел грибов зидиомицетов, выбранных из группы/ включающей Corlolus versfcolor (Fr.) Qdel,, Corlolus hirsutus (Fr.) Quel., Corlolus pargamenus (Fr.) Pat., с помощью воды или 0,01-0,5 н. водного 30 щелочного раствора при 95-10tf C, отделение экстракта, его концентрирование, фракционированное осаждение целевого продукта сульфатом аммония, диализ и хроматографйческую очистку диа|5 лизата, о т л и ч а ю щ и и с я теЦ,1 что, с целью улучшения свойств полу чаемого продукта, из вида Corlolus Verslcplpr (Fr.) Quel используют штаммы FF.RM-P № ,,из вида Cor Т- 40 olus htrsutus,jFr.) Quel - штамм FERM-P (Г 2711, из вида Corlolus раг.gamenus (Fr.) Pat. - штамм FERM-P IP 2712, из сконцентрированного экст939 жение табл 8
П
у
Corlplus hlrsutus
Corlolus pargamenus (Fr.) Quel (Fr.) Pat.
100
8/10
ракта удаляют низкомолекулярные ве-гщества путем добавления сульфата аммония в количестве, соответствующем 100% степени насыщения, с последующим перерастворением полученного осадка в воде и диализом, фракционированное осаждение сульфатом аммония осуществляют сначала в количестве от насыщения с удалением полу енного осадка, затем в количестве 0% от насыщения с последующим диализом, а хроматографическую очистку
диализата осуществляют на диэтиламиноэтилцеллюлозе с элюцией 1 н. раствором NaCt, после чего целевой продукт выдёляют осаждением сульфатом аммония в количестве kQ% от насыщения с последующим диализом и сушкой распылением.
Источники информации, принятые во внимание при экспертизе
Ь Патент Великобритании Н 133151, опублик. 1973.
goo см
«
ОпЛ
ОмА
Ч3
Фиг.5
Авторы
Даты
1982-09-23—Публикация
1977-01-20—Подача