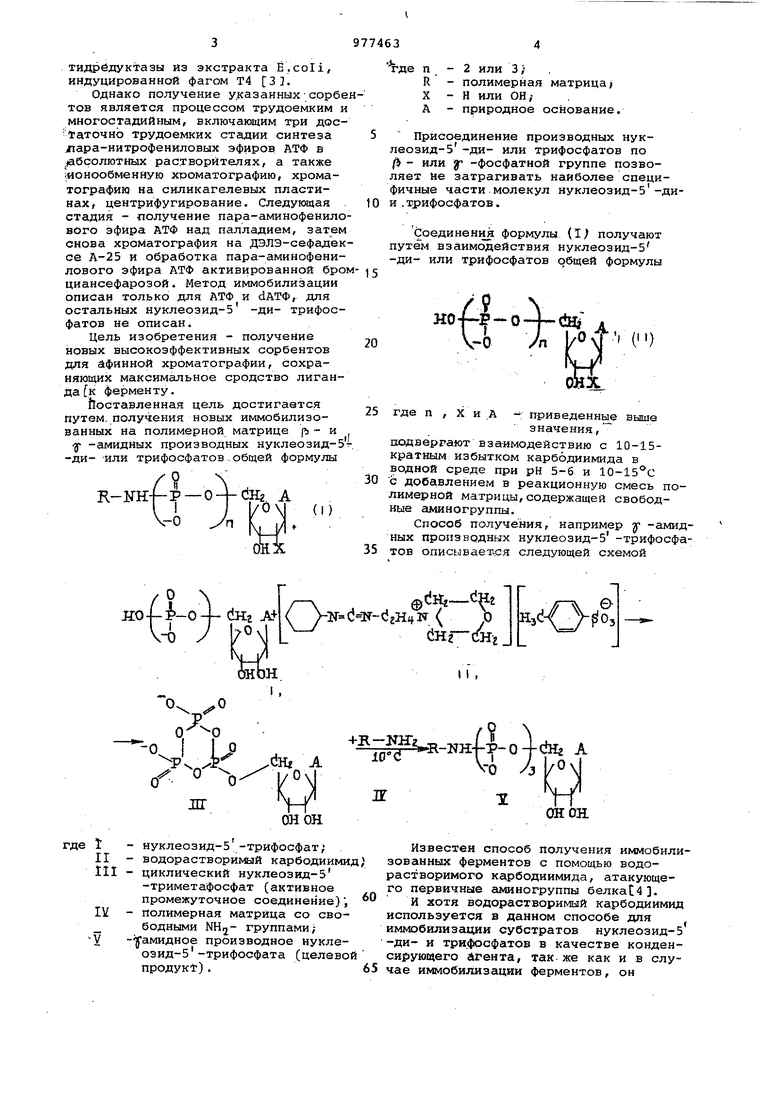
тиДрёдуктазы из экстракта E.coli, индуцированной фагом Т4 31. Однако получение указанных-сорб тов является процессом трудоемким многостадийным, включающим три дос таточно трудоемких стадии синтеза лара-нитрофениловых эфироэ АТФ в .абсолютных растворителях, а также ионообменную хроматографию, хроматографию на силикагелевых пластинах, центрифугирование. Следующая стадия - получение пара-аминофенило вого эфира АТФ над палладием, затем снова хроматография на ДЭЛЭ-сефаде се А-25 и обработка пара-аминофенилового эфира АТФ активированной бро циансефарозой. Метод иммобилизации описан только для АТФ и dATФ, для остальных нуклеозид-5 -ди- трифос фатов не описан. Цель изобретения - получение новых высокоэффективных сорбентов для афинной хроматографии, сохраняющих максимальное сродство лиганда к ферменту. Доставленная цель достигается путем, получения новых иммобилизованных на полимерной матрице ъ - и у -амидннх производных нуклеозид-ди- -или трифосфатов.общей формулы / Ч .-KHf-P-0 + ЙНг. А 1 У rN -° - kj/t -2 или 3; де п R X А -полимерная матрица/ -Н или ОН; -природное основание. Присоединение производных нуклеозид-5 -ди- или трифосфатов по (Ь - или у -фосфатной группе позволяет не затрагивать наиболее специфичные части молекул нуклеозид-5-дии . трифосфатов. соединения формулы (i; получают путем взаимодействия нуклеозид-5 -ди- или трифосфатов общей формулы где п , X и А - приведенные выше значения, шэдверрают взаимодействию с 10-15кратным избытком карбодиимида в водной среде при рН 5-6 и 10-15 с с добавлением в реакционную смесь полимерной матрицы,содержащей свободные аминогруппы. Способ получения, например Г -амидных производных нуклеозид 5 -трифосфатов описываетчся следующей схемой
/О
/-ч@ f Z
:о4--1 -о4- toz ( VlT CjK-cJzH N (о
U
Lс}нг сГНг
Ч-г
шЬн
енг-%
11,
(
4.f vi ли
он он нуклеозид-5 -трифосфат; водорастворимый карбодиимид , циклический нуклеозид-5 -триметафосфат (активное промежуточное соединение); полимерная матрица со свободными NHij- группами; -уамидное производное нуклеозид-5-трифосфата (целевой продук).6
g
окон Известен способ получения иммобилизованных ферментов с помощью водорастворимого карбодиимида, атакующего первичные аминогруппы белкаС4. И хотя водорастворимый карбодиимид используется в данном способе для иммобилизсщии субстратов нуклеозид-5 -ди- и трифосфатов в качестве конденсирующего йгента, так же как и в случае иммобилизации ферментов, он
осуществляет другую реакцию. Реакция идет через активацию фосфорильных групп субстратов - циклический нуклеозйд-5 -триметафосфат (активное промежуточное соединение) и конечным (целевым) продуктом реакции является иммобилизованный нуклеозид-5 -трифосфат, который являясь афинным аналогом субстрата, легко узнается соответствующим ферментом. А это позволяет в свою очередь использовать афинные аналоги субстратов (афинные сорбенты) для получения высокоочищенных ферментов.
Осуществление процесса в определенных параметрах позволяет осуществить процесс без затрачивания наиболее специфичных частей нукле.озид-5 -ди- или трифосфатов.
Способ осуществляется следующим образом4
Взаимодействие нуклеозид-5 -диили трифосфатов с карбодиимидом идет через образование активного проме.жуточного соединения, которое обладает способностью вступать во взаимодействие с нуклеофилами-, представляюJBIHMH собой полимерную матрицу со свободными с1миногруппами. За реакцией образования активного промежуточного соединения следят по расходу кислоты, : необходимой Для поддержания пб стояйнога значения. рН реакционной сйеси, равного 5-6. Процесс ведут при 1015 с. После достижения максимальной концентрации активного промежуточного соединения в реакционную добавляют соответствующую нерастворимую полимерную матрицу.
Выход целевого продукта составляет по исходному нуклеозид-ди- или трифосфату. Полученный продукт анализироваши путем проведения
кислотного гидролиза, хроматографии на бумаге, снятия УФ-спектров. Определение емкости сорбента проводили по количеству иммобилизованных нуклеозид-5 гди- или трифосфатных
остатков на 1 г сорбента.
На основании предлагаемого способа синтезированы сорбенты, для получения которых использовсшись следующие нуклеозид-5 -ди- или трифосфатй:
аденозин-5-дифосфат и -трифосфат/ дезоксиаденозин-5 -трифосфат t гуанозин-5-дифосфат и -трифосфат уридин-з-трифосфат; цитизин-5-три фосфат.
; В качестве полимерных матриц даспользованы:
Аминоэтилцеллюлоза (АЕ-целлюлоза)
1|-с Нг-с Нг-ЗШг .
Гидразид карбоксиметилцеллюлозы
(КМа-гидразидОQ
g-ciHz-ci
3NH- КНг
Аминоэтилированное производное полиакриламида (АЕ-биогель)
Х
Я
NH-CtiHzl JfHiz
Гексаметилендиаминсефароза (АНсефароза 4В)
-Лн((}Нг)
35
Данные по синтезированным иммобилизованным на полимерных матрицах
нуклеji - и 1 -амидным.производным озид- 5 -ди- и трифосфатам -т. представлены в табл.1.
о о t-i I о
00
о о
О
00
I о
N
1Л



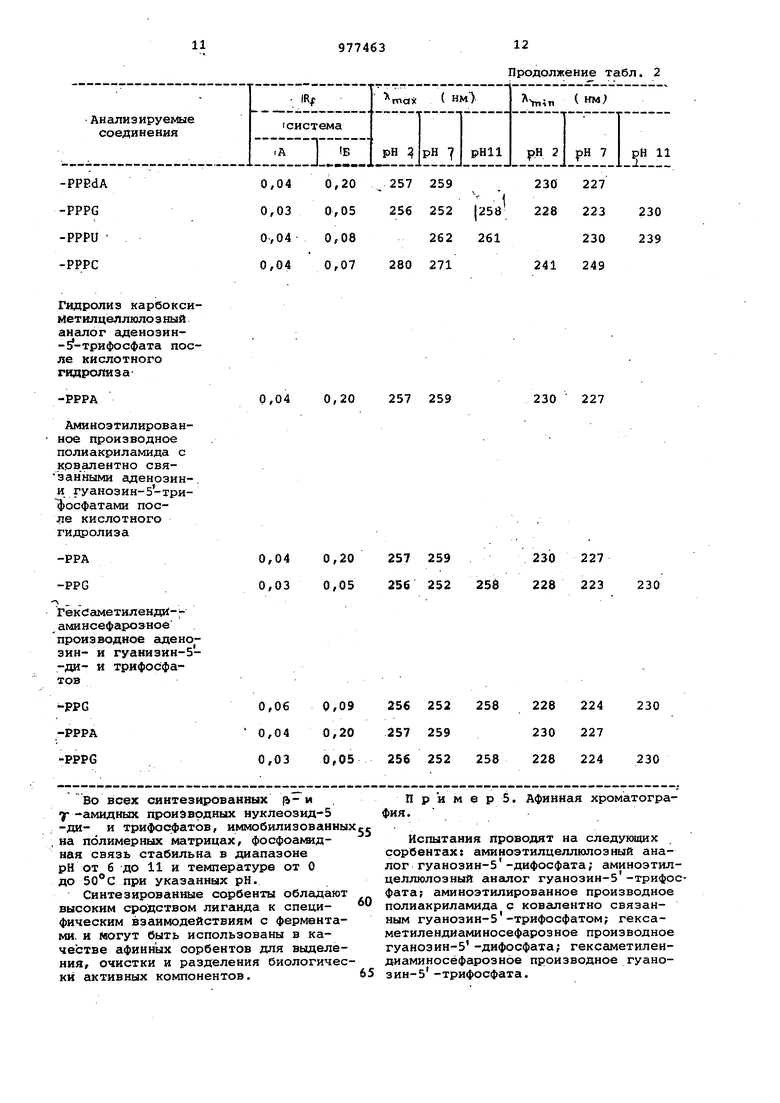



| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения -мидов-нуклеозид-5-трифосфатов | 1974 |
|
SU616265A1 |
| Спин-меченые производные олигорибонуклеотидов как спиновые зонды для исследования механизма действия ферментов и способ их получения | 1977 |
|
SU659573A1 |
| Способ получения биоспецифического сорбента | 1982 |
|
SU1057514A1 |
| СПОСОБ СИНТЕЗА НУКЛЕОЗИД-5'-ТРИФОСФАТОВ, МЕЧЕННЫХ РАДИОАКТИВНЫМИ ИЗОТОПАМИ ФОСФОРА В АЛЬФА-ПОЛОЖЕНИИ | 2007 |
|
RU2355768C2 |
| СПОСОБ ПОЛУЧЕНИЯ АФИННОГО СОРБЕНТА ДЛЯ ОЧИСТКИ ФЕРМЕНТНЫХ ПРЕПАРАТОВ | 2003 |
|
RU2230072C1 |
| Способ получения рибо- и дезоксирибонуклеозид-5 @ -трифосфатов | 1987 |
|
SU1493644A1 |
| СПОСОБ ПОЛУЧЕНИЯ РИБОНУКЛЕОЗИД-5'-ФОСФАТОВ | 1994 |
|
RU2091387C1 |
| СПОСОБ ПОЛУЧЕНИЯ 1-β-D-РИБОФУРАНОЗИЛ-1,2,4-ТРИАЗОЛ-3-КАРБОКСИАМИДА (РИБАВИРИНА) | 2002 |
|
RU2230118C2 |
| Способ получения рибо- и дезоксирибонуклеозид-5 @ -трифосфатов, меченных изотопами @ С и @ Н | 1984 |
|
SU1251509A1 |
| Способ получения амидов нуклеозид 5-моно-или полифосфатов по концевой фосфатной группе | 1977 |
|
SU721453A1 |

о 1Л т-( о СЧ го ГГ N гН тН
} «Ь
1 РМ А &1 f
ft Л П. п. к RI Pi
г г JT Jfc Л
1 Т f Т
ллл-х
§
СО О
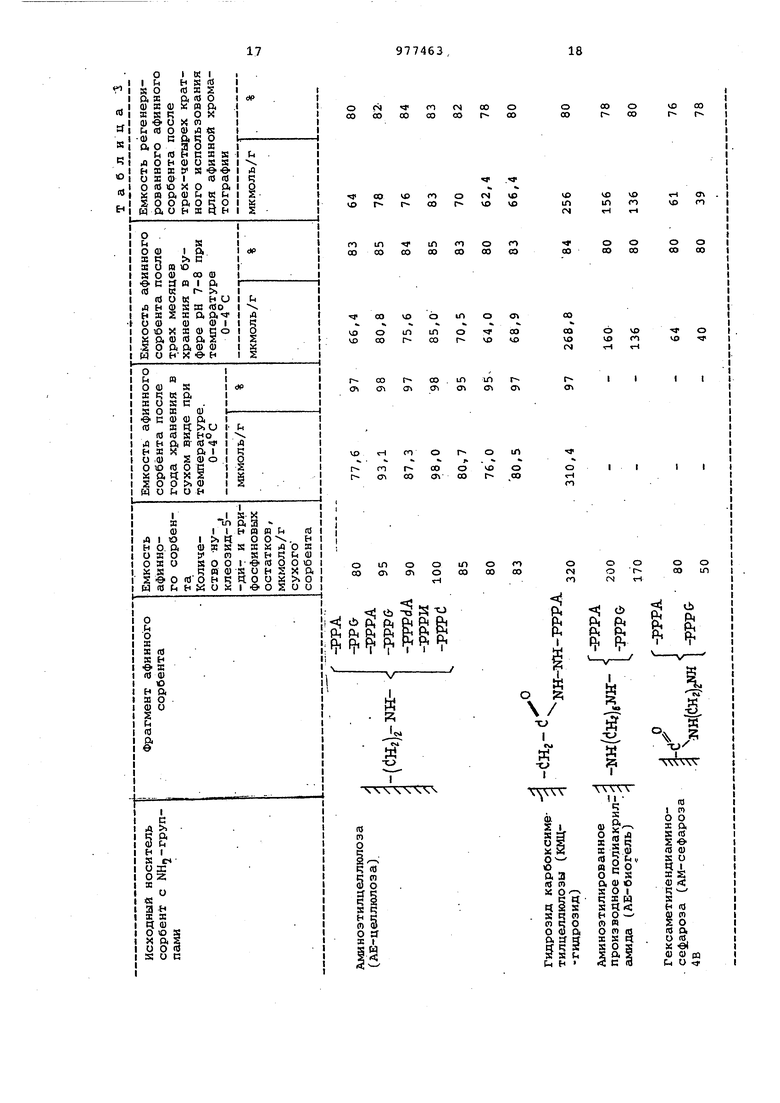
О Г N -1 Пример. Синтез аминоэтилцеллкшозных аналогов нуклеозид-З -ди- и трифосфатов проводят в термостатированной кювете при 10-15°С. 45 мкмоль нуклеозид-5 -ди- или трифосфата (аденоэин-5-ди- или трифосфата; гуанозин-5-ди- или трифо фата,- цитидин-5 -ди- или трифосфата/ уридин-5-трифосфата) растворяют в 15 мл воды рН доводят до 5,6. При непрерывном перемешивании добавляют 380 мг водорастворимого карбодиимида. Постоянное значение рН поддерживают при непрерывном под титровывании 0,5 N соляной кислотой контролируя рН с помощью потенциометра ЛПУ-.01. Через 30 мин добавляют 1 аминоэтил-целлюлозы. Реакционную смесь наносят на с1еклянный фильтр, промывают М,КС1.до исчезновения оптической плотности, затем - водой. Синтезированный продукт анализируют проведением кислот ного гидролиза. Хроматографией на бумаге и снятием УФ-спектра. Пример 2. Синтез гидразид карбоксиметилцеллюлозного аналога ещенозин-Б -трифосфата (АТФ) шроводят при сохранении всех параметров и условий, указанных в примере 1. Полимерную матрицу - гидразид карбоксиметилцеллюлозу добавляют в количестве 0,5г. Пример 3. Синтез аминоэтили рованного производного полиакриламида с ковалентно свйзанным аденоэин- и гуанозингЗ -трифосфатами про водят при сохранении всех параметро и условий процесса, указанных в при мере 1. Полимерную матрицу - аминоэтилированное производное полиакрил амида добавляют в реакционную смесь в количестве 0,5г. П р и м ё р 4. Синтез гексаметил диаминсефарозного производного аден зин- и гуанозин-5 -ди- и трифосфато проводят при сохранении всех параме ров и .условий процесса, указанных в
Аминоэтилцеллюло3ный аналог нуклеозид 5 -диили трифосфата после кислотного гидролиза
-РРА
-PPG -РРРА
227
230
259
230 228 224
258
252 227 230
259 примере 1. Полимерную матрицу - гекСс1метилендиаминсефарозу добавляют в реакционную смесь в количестве 1 г. При проведении повторных реакций с синтезированным сорбентом можно достичь дополнительной иммобилизации производных нуклеозид-З -ди- или трифосфатов, что позволяет получать сорбенты заданной емкости. Кислотный гидролиз синтезированных продуктов для количественного определения амина и нуклеотиднрго материала проводят в 1 hJHCI в течение 2-х ч при 40°С. Затем гидролизат нейтрализуют, наносят на стеклянный фильтр. Нуклеотидный материал заме ряют на спектрофотометре. В результате кислотного гидролиза происходит разрыв фосфоамидной связи -N-P и в реакционной смеси получают исходный соответствующий нуклеОзид-5 -ди- или трифосфат и полимерную матрицу, несущую свободную аглнногруппу. Нуклеозид-5 -ди- или трифосфат, предварительно отделенный от полимерной матрицы (на стеклянном фильтре, анализируют методом бумажной хроматографии для определения R и доказательства индивидуальности продукта в системах растворителей; (А )этанол : 1 М ацетат аммония, 7 s 3 по объему, рН 7,5,- (В) 1Изомасляная кислота : конц. аммиак : вода, 6б51:33, рН 3,7. УФ-спектры снимают на автоматическом регистрирующем спектрофотометре при р11 1,2,7,11 и концентрации 0,75 по нуклеотидному материалу. Таким образом, анализ синтезированных новых химических соединений, иммобилизованных на полимерной матрице производн лх fj-H у-амидов нуклеозид-Б -дн- и трифосфатов показал, что соединения химически чисты, строение их доказано и данные анализа приведены в табл.2. Таблица 2
Гидролиз карбоксиметилцеллюло з ный аналог аденозин- -трифосфата после кисшотного гидролиза
-РРРА
0,20
0,04
Аминоэтилированное производное полиакриламида с крвалентно свяванными аденозини гуанозин-5-триосфатами посе кислотного гидролиза
0,20
0,04
-РРА 0,03
-PPG 0,05
-. Гексаметилендй-аминсефароэноепроизводное аденозин- и гуанизин-5-ди- и трифосфатов
-PPG
0,06 0,09 0,04 0,20
-РРРА
-PPPG 0,03 0,05 Во всех синтезированных . 7 амидных производных нуклеозид-5 -ди- и трифосфатов, иммобилизованны на полимерных матрицах, фосфоаьшдная связь стабильна в диапазоне рН от б до 11 и температура от О до 50®С при указанных рН, Синтезированные сорбенты обладают высоким сродством лиганда к специфическим взаимодействиям с ферментами, и могут быть использованы в качестве афинных сорбентов для выделения, очистки и разделения биологичес ки активных компонентов.
Продолжение табл. 2
257 259
230 227
259
230
227
258 252 228 223
230
252
258
228
224
230
259 230 227 252 228
258 224
230 П р и м е р 5. Афинная хроматография. Испытания проводят на следующих сорбентах: аминоэтилцеллкшозный аналог гуанозин-5 -дифосфата; аминоэтилцеллюлоэный аналог гуанозин-5-трифосфата; аминоэтилированное производное полиакриламида с ковалентно связанным гуанозин-5-трифосфатом; гексаметилендиаминосефарозное производное гуанозин-5 -дифосфата; гексаметилендиаминосёфарозное производное гуанозин-5 -трифосфата. Клетки E.coli MRE 600 разрушают помощью звукового генератора УЗДН iy4,2,(22 кГц, 3 0,5-0,6 ампер). Белковый осадок, полученный из 10500.0 xg супернатанта насьпдением сульфата аммония между 37% и 67%, растворяют в буфере 1, содержащем 2тМ трис-НС1, ,0, 10 тМ ацетата магния, 2mMDTT, 0,35 М НС1, 5тМ ЭДТА,-и проводят диализ против этого же буфера. 1 г влажного аминоэтилированного производного полиакриламида с ковалентно связанным гуанозин-5-трифосфатом (ГТФ-АЕ-биогель) перемешивают с белком (20 о.е. Л 280 нм) в течение 3-4 ч при 4°С. Смесь вносят в колонку и элюируют сначала бу ром 1 до исчезновения оптической плотности белка ( Л 280 нм ), затем буфером II, содержащем дополнительно к составу буфера I 100уи.МГТФ. фракции белка, содержащие EF-Tu активность, концентрируют и проводят дисшиз против 10 тМ натрий фосфатного буфера (,0),содержащего 0,1% SDS и 0,1% fb-меркаптоэтанола. Электрофорез белков проводят в полиакриламидном геле с SDS, Бело элюированный с афинной колонки, по данным электрофоретического анализа получен в индивидуальном состояНИИ с молекулярным весом 4200044€00. Сходные результаты были полу чены и с другими сорбентами. В результате испытания установлено, что синтезированные соединения могут быть использованы в каче ве эффективных сорбентов для афинной хроматографии биологически активных компонентов, имеющих сродст (афинность) к нуклеозид-З -ди- и трифосфатом, таких как белковые фа торы элонгации и другие. Способ получения сорбентов экспериментально прост, а их использо вание для выделения и очистки ферм тов дает возможность сократить это многостадийный процесс практически до одной стадии. Сорбент легко рег нерируется и может быть использова многократно. Примере. Афинная хроматог фия. Испытания проводят на следуквдих сорбентах: аминоэтилцеллюлозный аналог аденозин-5 -дифосфата; амин этилцеллюлозный аналог аденозин-З -трифосфата; аминоэтилированное про водное полиакриламида с ковалентно связанным аденозин-5 -трифосфатом; гидразидкарбоксиметилцеллюлозный ан лог аденозин-5 -трифосфата; гексаме тилендиаминсефарозное производное аденозин-5-трифосфата; аминоэтилцеллюлоэный аналог цитидин-Б -трифо ,фата; аминоэтилцеллюлозный аналог ури-. дин-5-трифосфата. Все четыре субстрата (АТР, ГТР, УТР, ЦТР), иммобилизованные на нерастворимых матрицах, способны образовывать специфический комплекс с ферментами:1)Креатинкиназу КФ 2.7.32.АТР: креатинфосфотрансфераза из мышц кролика вьщеляют по методу Кьюби. В случае применения афинных сорбентов ткань мышц кролика разрушают., экстрагируют 0,3 М КС1 в буфере, содержащем 10 мМ трис-НС1 рН 85, 5 мМ уксуснокислый магний, 100 мМ уксуснокислый натрий, 1 мМ (-меркаптоэтанол, 10 мМ ЭДТА и проводят диализ против того же буфера А. 1 г влажного аминоэтилцеллюлоэного производного аденозин-5-трифосфата перемешивают с белком 50ос. 280 нм ) в течение 4-5 ч при 4°С. . Смесь вносят в колонку и элюируют буфером А до исчезновения оптической плотности белка{А 280 нм ). Затем буфером Б (к буферу А добавляют АТР в конечной концентрации 100 мкМ) , элюировали белок, который образовывает специфичный комплекс с сорбентом. До 70% исходной активности креатинкиназы определяютво фракции, полученной при элюировании афинной колонки буфером Б (активность креатинкиназы измеряют потенциометрически,используя рН-метр марки рН-340). Эти данные свидетельствуют о том, что креатинкиназа образует достаточно прочный комплекс с афинным сорбентом, что хорошо согласуется с константой ингибирования Ki, равной 4, ПО отношению к АГР для афинного реагента креатйнкиназы JT -амидного прЬизводного АТР. 2)Пиру ватки назу (КФ 2.7.1.40, АТР; фосфотрансфераза) выделяют из бактериальной массы E.coli iMRIi-600. Клетки E.coli обрабатывают, как указано в примере 5. Белковой осадок, содержащий большую часть ферментов клетки, полученный из 105000 хд супернатанта фракционированием сульфатом аммония, растворяют в буфере I, содержаи ем 10 мМ трис-НС1, рН 7.2, 10 мМ магний ацетат, 1 мМ (ъ-меркаптоэтанол, 5 мМ ЭДТА. После каждого фракционирования сульфатом аммония осадки белка диализуют против того же буфера. Поскольку для пируваткиназы донором кроме аденозин-5 -трифосфата (АТР) могут служить уридин-5 -трифосфат (УТР), цетозин-5-три фосфат (ЦТР) и деэоксиаденозин-5-трифосфат (ДАТР), то в качестве афинного сорбента используют амнноэтилцеллюлозное производное АТР или УТР, или ЦТР по 0,5 г каждого влажно
го сорбента смешивалось с 10 iA а 280 им белка.
И второй вариант, когда три сорбента (аминрэтилцеллкшоэное производное АТР, УТР и ЦТР) смешивают, в эквивалентных количествах, паремешивают в течение 3-4 ч при С с 30 А 280 белка и затем смесь вносят в колонку. Как в первом варианте так и во втором, афинная колонка элюировалась буфером I для удаления всех балластных белков (до исчезновения оптической плотности белка А 280), Буфером 11(буфер 1 с до авлениём соответству1а1цего субстрата до 100 мкм концентрации eroj элюировали белок, образующий специфический комплекс с афинным.сорбентом. Об образовании комплекса в каждом случае судят по количеству белка, вы1иываемого с афииной колонки бУФвром I и буфером II с определением в каждой фракции пируваткинаэной активности.
В результате испытания установлено, что ируваткиназа образует комплеке с афинными сорбентами, причем
более прочный комплекс (почти в 2 раза) образуется и случае испытания трех сорбентов одновременно.
Таким образом, данные .сорбенты обладают высоким сродством лиганда к специфическому взгшмодействию фермента, которое позволяет многостадийные трудоемкие процессы выделения и очистки ферментов сократить практически .до одной стадии, получая индивидуальньй) белок; сорбенты стойки, стабильны в диапазоне рН от 6 до 11 при температуре от О до , гидрофильны, имеют большую удельную поверхность, механически прочны, имеют однородную форму. Ввиду легкой регенергщии-и возможности длительного хранения синтезированные сорбенты могут быть многократйо использованы для выделения и очистки индивидуальных белков.
Данные по использованию получен-. ных новых соединений в качестве афинных сорбентов для афинной хроматографии, а также данные-ПОрегенерированию и хранению афинных сорбентов представлены .3.
Формула изобретения
Ьбщей формулы
/9 Л
R-NH-f-F-O-bdHz А
-° iCJ
онх
где п - 2 или 3;
R - полимерная матрица;
X - Н или ОН;
А - природное основание, в качестве сорбентов для афинной хроматографии.
У -амидных производных нуклеозид-з -ди- или трифосфатов общей формулы
Ч
i«.
Л
Jn
Q
ОНХ
2 или 3)
полимерная Матрица;
Н или ОН;
природное основание,
35
чающийс
тем, что
нуклеозид-5 -ди- или трифосфат общей формулыg,
of-P-o4-ciH, Л U Jn Ч
Чт
онх
где п, X и А - приведенные выше значени, подвергают
взаимодействию с 10-15-кратным избытком карбодиимида в водной среде при рН 5-6 и 10-15 С с добавлением в реакционную смесь полимерной матрицы, содержащей свободные аминогруппы.
Источники информации, принятые во внимание при экспертизе
. Kapnjayer H. , Lappi D.A., Kaplan N.O. The synthesis of 8-(6-aminoliexy)-amino-GTF and GDP and their application as Ligands in affinity chroraatography. - Analytical Biochem 1979, 99, 189-199.
.Rabbit Liver Microsomal Fraction. Biochemical Journal, 1972, 28.45f-498
Под ред. И.В.Березина, т.1, М., 1976 с. 170-171.
Авторы
Даты
1982-11-30—Публикация
1980-01-10—Подача