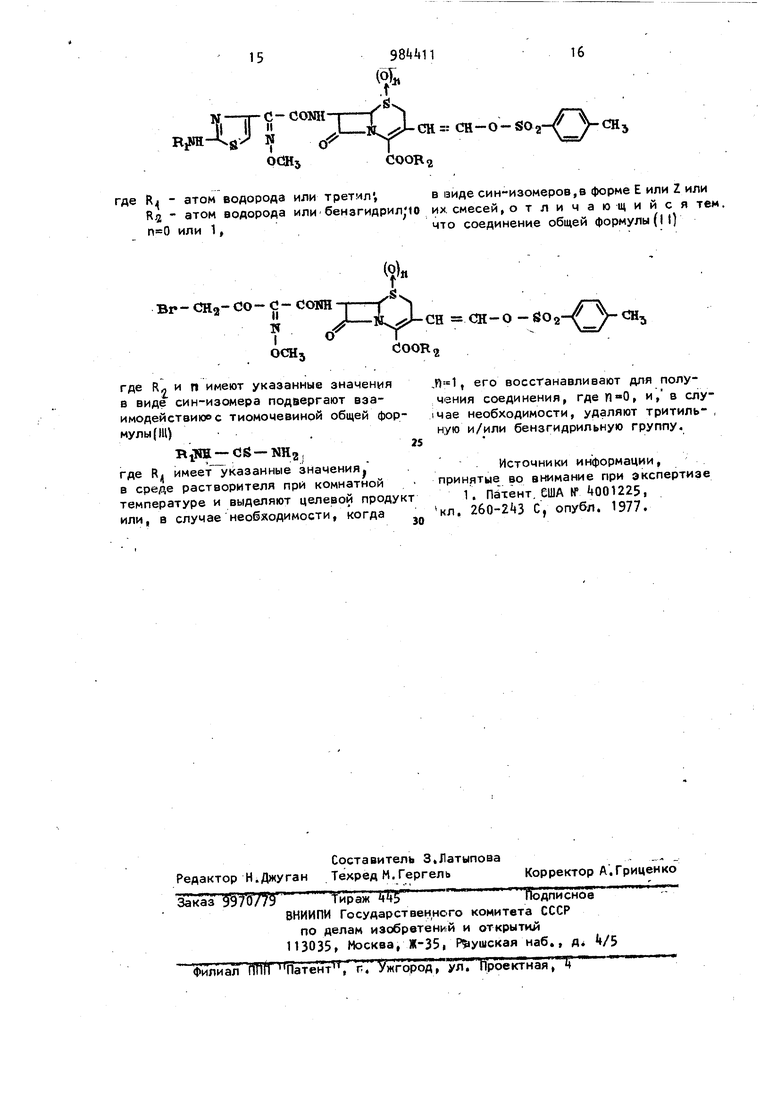
Br СТ2 СО - J - ССГШ-p-Y где Rj и п имеют указанные значения/ в виде сии-изомера подвергают взаимодействию с тоимочевиной уэрму/ы , RiTSH-C6-NH2 С) где Rf имеет указанные значени)р, в среде растворителя при комнатной температуре и выделяют целевой прот дукт или, в случае необходимости, когда , его восстанавливают для получения соединения, где , и, в случае необходимости, удаляют тритил ную и/или бензгидрильную группу. Обычно процесс ведут в водной, органической или водноорганической ,вреде в таких растворителях или смесях растворителей, как спиртах (метаНоле, этаноле), кетонах (ацетоне), хлорированных растворителях (хлороформе, этиленхлориде), нитрилах (ацетонитриле), амидах (диметилформамиде диметилацетамиде), .простых эфирах (тетрагидрофуране, диоксане, сложных эфирах( этилацетате) или в кисло тах (уксусной, муравьиной) в присутствии или в отсутствии основания, например, едкого натра, едкого кали, карбонатов или гидрокарбонатов щелочных металлов, солей карбоновых.кислот и щелочных металлов (формиата натрия ацетата натрия) или третичных аминов (триэтиламина, триметиламина или пиридина) . Преимущественно реакцию осуществля ют в водноорганической среде, например вода - простой эфир (тётрагидрофуран, диоксан), вода - кетон (ацетон) или вода - хлорированный растворитель (хлороформ, метиЛенхлорид), .в присутствии щелочного агента конденсации как бикарбоната щелочного металла (например, бикарбоната натрия) , П р и м е р 1, 52,5 мг 2-бензогидрилоксикарбонил-7 третгбутоксикарбониламино-З-оксо-3-(2-оксоэтил)-5 -оксид-5-тиа-1 -аза-дицикло (, 2,0) -2-октена растворяют в 2 см пиридина, раствор охлаждают до , затем добавляют 21 мг.ц-тоЛуолсульфонилхло9 ( r. 1 CH-O-SOgCHR2 рида. Перемешивают в течение 15 мин при затем 1 ч в интервале температур -15 - , Реакционную смесь выливают в 50 см дистиллированной воды. Экстрагируют 50 см этилацетата и промывают органическую фазу два раза 50 см- 0,1 н, соляной кислоты, noтом два раза 50 см дистиллированной воды. Сушат над сульфатом натрия, фильтруют и выпаривают растворитель при пониженном давлении (20 мм рт,ст.) при 30°С. Получают 66 мг смеси форм Z и Е 2-бензогидрилоксикарбонил-7-трет.-бутоксикарбониламино-8-оксо-5-оксид-3-(2-тозилоксивинил)-5-тиа-1-аза-дицикло(.2.0)-.2-октена в виде массы безе оранжевого цвета. МетоД0М хроматографии на пластинке с си-, лика гелем, растворит-ель циклогексанэтилацетата 50-50 (по объему),разделяют на две формы: форма Z, 10 мг, ИК-спектр (СНВг)): , 1800, 1720, 1505, 1330, 1370, 1195, ПВО, 1050, 1010 и 730 см. ЯМР-спектр протона (350 МГц, СДСЕ, S , М.Д., j в Гц): 1,49 (S, :. 9Н, -с(снз)з); 2,4 (S, зн, -СНз); 3,36 и ,0 (2 d, & 19, 2Н, -SCH2); ,t (d, ,5; 1Н, н в 6); 5,73 (d, , 1Н, -CONH-); 5г81 (dd,6,5 и 9, 1Н, Н в 7); 6,2 (d, ё 7, 1Н, -СН :Н-0502-); 6,46 (d, , 1Н, ); 6,89 (S, 1Н, -СООСН); 7,77 (d, , 2Н, Н в ортоположении тозила). Форма Е 40 мг, ИК-спектр (СНВгз); 3420, 1800, .1720, 1505, 1380, 1370, 1195, 180, 1075, 935 и 745 смЧ Я11Р-спектрпротона (350 МГц,СДС, бм,А,, S в Гц); 1,48 (5, 9Н, (CH-jLC-j: 2,46 (S, ЗН, -СНа); 3,16 и 3,81 (2 d, , 2Н, -SCH-); 4,46 (d, S-4,5, 1Н, Н в 6); 5,73 (d, В -9, 1Н -CONHr); 5,8 (d, d S-9, и 4,5, 1Н, Н в 7); 6,83 (d, S-13, 1Н, -CH CH-OS02); 6,83 (S, 1Н,2СООСН) 7,08 (d,. lH, CH-OS02-); 7,73 (d, 5-9, 2H, H 0 ортоположении тозила). s , . 2-6внзогидрилоксикар6онил-7-трет, -бутоксикарбониламина-8-оксо-3-(2-ок соэтил)-5-оксид-5-тиа-1-аза-дицикло (.2.0)-2-октен может быть приготовлен следующим образом. 2,7 г 2-бензогидрилоксикарбонил- 7 - т рет.-бу токсккарб е}ни лами но-3-(2-диметиламиновиний)-в-оксо-Б-тиа-t азадицикло-(,2.0)-2-октеиа (форма Е) растворяют в 5 си тетрагид% рофурана. Добавляют поеледовательно 27 см дистиплироваиной воды и 2,7 см чистойМуравьиной кислоты и перемеимваот реакционную смесь в течение ЛО мин при . После частичного упаривания реакционной Смеси при пониженном давлении(20 мм.рт, ст.) при 30°С и добавления 200 см этилацетата органическую фазу отделяют и /|ромывают два раза 100 см насыщенного водного раствора :хлорида 14атрия. Органическую фазу высушивают над сульфатом магния в присутствии растительной сажи , фильтруют и упаривают досуха при пониженном давлении (20 мм рт. ст.) при . Получают 2,3 г продукт в виде массы безе оранжевого цвета, который используют без дополнительной очи-/ стки. Раствор 1,02 г полученного продук та В VOO См мвтиленхлорида охлаждают до температуры от (-5) до () Добавляют по каплям в течение 20 раствор 0,35 г 85% метахлорнадбензой ной кислоты в kO см метиленхлорида. По окончании добавления реакционную сМесь перемешивают в течёкме 10 мин при температуре от -5 до , затем промывают 50 см полунасыщенного водного раствора бикарбоната натрия. ПОТОМ три раза :50 см дистиллированной воды. После сушки над сульфатом натрия и фильтрования растворитель выпаривают досуха при пониженном давлении (20 мм РТ. ст.) при . Остаток снова растворяют в 25 см ме- . тиленхлорида. Добавляют 5 г двуокиси кремния (0,56-0,2 мм). Упаривают досуха при давлении fOO мм рт. ст. при и. помещают полученный пороиюк в колонку с 25 г силикагеля (0,560,2 мм), приготовленную со смесью циклогексан - этйлацетат 80-20 (по объему), высота колонки 21 см, диаметр 2 см. Элюируют смесями циклогексан - этйлацетат в последовательных следующих соотношениях (по o h лированной воды. Водную фазу декантируют и экстрагируют 100 см этилацетата. Собранные органические растворы промы11ают два раза 100 см дистиллированной воды, потом сушат над сульфатом магния и фильтруют. После выпаривания растворителя при пониженном-давлении (20 м, рт. ст.) при получают 2,7 г похожей на безе массы каштанового -цвета.
Анализ методами хроматографии в тонком слое на силикагель с элюентом циклогексан - этйлацетат (по объему),и ИК-спектр зывают, что получен в основном , 2-Бензогидрилоксикарбонил-7-трвт.r-. t .; ------. ему): 80-20 (100 см); 70-30 (200 см), CiOO см ). 50-50 CtOO см) и 1( см), отбирая фракции по 60 см. фракции 10-2t упаривают досуха при пониженном давлении (20 ммрт. ст.) и . Получают 0,2 Г 2-бензогидоилоксикарбонил-7-трет,-бутоксикарбониламино-8-оксо-З-(2-оксоэтил)г -5-оксид-5-тиа-1-аза-Дицикло (1 ,2.0) i -2-октена в виде массы безе оранжевоjro цвета. ,32jхроматография на силикагеле с элюентом циклогексан - этйлацетат 20-80 (по об-ьему). ИК-спектр (СНВг-): 2720, t80b, 1720 и 1050 смЧ ЯНР-спектр протона (350 МГц, СДсК, §м.д.): 1, (S, 9Н, (CH3)iCO-)i 3,37 и 3,57 (2 d, АВ, j.19 Гц, 2Н. -СНСНО); 3,60 иЧ,20 (2 d, АВ, J-18 Гц, 2Н: -SO-CH-); ,5б (d,S- Гц. 1Н, Н .в 6); 5,2 (d, S-10 Ti,. IH: -СОНН); 5,82 (d, dS-lO и Гц, 1Н: Н в 7); i(V, 1Н: - СН ((t ; 7, (У41иренный, 10Н: аром{е1ТИ1.4еские); (dr,-t Гц, 1Н: -СНО). 2-Бензогидрилоксикарбонил-7 трет.-буTQксикарбониламино-3-(2-диметиламиновинил) 8-оксо-1 -тиа-1-аза-дицикло(,2.0)-2-октен (форма, Е) получают следующим образом, К раствору 2,« г 2-бензогидрилоксикарбонил-7-трет,-бутоксикарбонил-амино-3-метил-8-оксо-5-тиа-1-аза-дицикЛо(.2,0)-2-гоктена в 12 см безводного N, N-диметилформамида в атмосфере сухого азота добавляют при раствор диметоксидиметнламинометана в 12 см безводного N, N-диметилформамида, Реакционную смесь подогревают до в течение 3. ч 20 мин, затем выливают в смесь 150 см этилацетата и-150 см дистил-бутоксикарбониламино-3-(2-диметиламиновинил)-8-оксо-5-тиа-1-аза-д цикло(«,2,0)г2-октен (форма Е), Ri«Q,29 хроматография на сили-г кагеле с элоентом циклогексан этилацетат (по объему). 2-БеНзогидрилоксикарбонил-7 -трет,-бутЬксикарбониламино-З-метил 8-оксо-5-тиа-1-аза-дицикло(k,2, -октвн полумают следующим образом К раствору 188,6 г 7-трет.-бу.ток сикарбониламино-3 метил-8-оксо-5-тиа-1-аза-дицикло С .2.а)-2-октена в 2100 см ацетонитрила добавляют по каплям в течение t мин при 2530 С раствор 116,5 г дифенилдиазотмета нав 800 смацетонитрила, Реакционную смесь перемешивают в течение 16 ч 1ри 22С, затем упаривают досуха при пониженном давлении (20 ММ pT.cT при . Остаток растворяют в 2 л этилацетата и раствор промывают 700 ct 2 н. соляной кислоты, потом 700 см насыщенного водного раствора бикарбоната натрия и 700 с насыщенного водного раствора хлорида натрия. Раствор сушат над сульфа том натрия, обрабатывают растительной сажей и фильтруют, затем упари.вают досуха при пониженном давлении (20 мм рт. ст.) при . Остаток растворяют в бОО см этила1$етата пр температуре кипения. Добавляют 1 л циклогексана, нагревают с рефлюксом затем оставляют охлажда;1;ься.Образу ющиеся кристаллы отделяют фильтрованием, промывают три раза 250 см диэтилового эфира, потом сушат. Получают 191 г 2-бензогидрилоксцкарбо нил-7-трет.-бутоксикарбониламино-3-метил-8-оксо-5 тиа-1-аза-дицикло(А.2,0)-октена в виде белмх кристал лов (т.пл. ), При упаривании маточного раствора до 500 см получают вторую фракцию продукта (32,6 -ал f Л - Т.ПЛ. 178С). 7-трет.-Бутоксикарбониламино-2-карбокси-3-метил-8-оксо-5 тиа-1-аз-дицикло(4.2.0)-2-октен получают следующим образом. 371 г 7-амино-2-карбокси-3-метил -8-оксо-5-тиа-1-аза-дицикло(А.2.0)-2-октена растворяют в растворе 307 бикарбоната натрия в смеси 2 л дистиллированной воды и 2 л диоксана. Добавляют в течение 10 мин раствор 421 г карбоната ди-трет.-бутила в 2 л диоксана. Реакционную смесь пер 8 мешивают в течение ч при 25С. Полученную суспензию упаривают при пониженном давлении (20 мм рт, ст.) при до остаточного объема (приблизительно 2 л), затем разбавляют 1 л этилацетата и 2 л дистиллированной воды. Водную фазу декантируют, промывают 500 см этилацетата и подкисляют до рН 2,6 1 н, соляной кислотой в присутствии 1500 см этилацетата. Водную фазу экстрагируют два раза 1 л этилацетата. Соединенные органические фазы промывают два раза 250 см насыщенного раствора хлорида натрия и сушат над сульфатом натрив. После фильтрования отгоняют растворитель при пониженном давлении (20 мм рт. ст,) при . Получают г .-бутоксикарбониламино-2-карбокси-3-метил-8-оксо-5-тиа-1 -аза-дицикло (i. 2,0 )-2-октена в виде желтых кристаллов (т.пл. . разлагается). К раствору 6,1 г 2-бензогидрилоксикарбонил-7-трет.-бутоксикарбониламино-8-оксо-З-(2-тозилоксивинил)-5-тис1-1-аза-дицикло С. 2,0)-2-октена (форма Е) в 75 см ацетонитрила добавляют по каплям а течение 25 мин при , 3,9 г гидрата П-толуолсульфокислоты в 25 см ацетонитрила. Перемешивают 45 мин при 35.С и выливают смесь в 500 см насыщенного раствора бикарбоната натрия. После контактирования в Течение 30 мин при перем уцивании экстрагируют 500 см этилацетата, промывают органическую фазу 100 см воды, высушивают над сульфатом натрия, фильтруют и выпаривают досуха при и давлении 20 мм рт.ст. Получают 4,7 г 7 амино-2-бензогидрилоксикарбонил-8-оксо-3 (2--тозилоксивинил) -5-тиа- 1-аза-дицикло(4.2.0)-октена (форма Е) в виде массы безе- коричневого цвета. ,18 хроматография на силикаD.. Л «Ч геле с элюентом циклогексан - этилацетат 50-50 (по объему), К охлажденному до -10°С раствору 4,7 г 7 амино-2-бензогидрилоксикарбонил 8-оксо-3-(2-тозилоксивинил)-5-тиа-1-аза-дицикло(4,2,0)-2-окте-на (форма Е) в 50 см ацетона, 5 см воды и 2,8 г бикарбоната натрия добавляют в течение 7 мин раствор 2 г 4-б1ром-2-метоксиимино-3 оксобутирипхлорида (форма син)в 10 см ацетона, Перем12шивают в течение 1 ч при и выпаривают досуха «ПРИ 20 С и давле нии 2б мм рт. ст. (2f7 кПа). Получают П г неочищенного 2-бензогидрил о«сикар6онил-7- (бpoм-2-мeтoкcииминo-3-oкcoбyтиpипaминo)-8-oкco-3-(2-тoзилoкcйвинил) -5-тйа- 1-аза-дицикло(1.2«0)-2-октена (изомер сии, форма Е). Раствор 5 г неочищенного полученного продукта в 25 см тетрагидрофу рана-.,эыливают в течение 5 мин при 20 в pacTBOpOtS гтиомочевины, 50см . воды и 25 см этанола. Переме иивают 30 мин при и выпаривают досуха при ,20 С и давлении 20 ни рт. ст, (2,7 кПа). Растворяют остаток в 150с этилацетата и 50 см насыщенного ра.створа хлорида натрия, декантируют, промывают органическую фазу два раза 100 см воды и 100 см насыщенного раствора хлорида натрия, высушивают над сульфатом натрия, фильтруют и вы паривают досуха при и давлении 20 мм рт. ст.,(2,7 кПа).Полученный продукт хроматографируют на колонке с 120 г силикагеля Merck (0,,0б диаметр колонки см, высота 20 см. Элюируют 2 л смеси циклогексан - д эгила«атат (по объему) при дав лении sO кПа и собирают фракции 50 см Зыпаривсют досуха фракции 16-38 при 20 и давлении 20 мм рт. ст. (2,7кП и получают 0,75 г 7-(2-амино- -тиа1золил)-2-метоксимминоацетамидо1-2-бензогидрилоксикарбонил-8-оксо-З-(2-тозилоксивинил -5-тиа-1-аза-дицикло(1,2.0)-2 октена (изомер син, форма Е) в виде твердого вещества кремового цвета. -Бром-2-метоксиимино-З-оксобутирилхлорид (изомер син) получают следующим образом. . К раствору k,09 г 2-метоксиимино-3-оксомасляной кислоты (изомер син) в 50 см диэтилового эфира добавляют при две капли диметилформами да, затем по каплям,в течение 15 мин 2см оксздилклорид, растворенного в 5 см дизтилового эфира. Переме шивают в течение 1 ч при 20 С, добавпяют еще одну каплю димет;илформам да и продолжают реакцию еще 15 мин. Выпаривают досуха при 20 С и.-давлении 20 fM рт. ст..(2,7 кПа), растворяют дза раза в 30 см петролейного эфира, выпаривая кажды раз растворитель при и давлении 20 мм рт. ст (2,7 кПа). 2-Метоксиимино-З-оксобутаноилхлорид (изомер син), получен1ный таким образом, растворяют в 50 см метиленхлорида, добавляют к этому раствору при 20С, 0,2 см 5, эфирного раствора соляной кислоты и I, см брома Перемешивают в течение 20 ч при , выпаривают досуха при 20 Си давлении 20.мм,рт,ст. (2,7 кПа) и получают г кор,ичне- . вого масла, состоящего в основном из -бром2-метоксиимино-З-оксобутирияхлорида (изомер син). ЯМР-спектр протона (бО МГц,СДСРв, БМ.Д. 8 Гц); 1,25 (S; ЗН, -ОСН-); . ,3 (S, 2Н, ).2-Метоксиимино-З-оксо-маслянуюкислоту (изомер син)получают следующим образом. Нагревают с рефлюкоом в течение 15 ч смесь 52 г этил-2-метоксиимин6-3-оксобутирата (изомер син), 300 см этанола и 330 см Т н. едкого натра Отгоняют этанол при и давлении 20 мм рт. ст. (2,7 кПа) и экстрагируют 150 см метиленхлорида. Водную фазу обрабатывают 1 г животного угля, фильтруют, насыщают хлоридом натрия, охлаждают до и подкисляют до рН 2,2 1 н. соляной кислотой в присутствии 200 см метилеиСнова экстрагируют водную хлорида фазу два раза 100 см того же растворителя, затем шесть раз 200 см этилацетата. Органические фазы высушивают над сульфатом натрия и выпаривают досуха раздельно при и давлении 20 мм рт. ст. (2,7 кПа). Остатки соединяют и обрабатывают при энергичном перемешивании 80 см диизопропилоксида в, течение ч. Полученные кристаллы обезвоживают и высушивают, получают 8,9 г 2-метоксиимино-3-оксомасляной кислоты (изомер син)... ИК-спектр (СНСН5), 2830,2300, 1730,,1695, 1370 и 1035 см. ЯМР-спектр протона (60 МГц, СДСР, S М.Д., 5 Гц); 2, (S,3H, CHjCO-); ,18 (S, ЗН, -OCH); 1Г,2 (S, IK, -СООН). Этил-2-метоксиимино-3 ОКСобутират (изомер син) получают по способу, описанному R. Bucourt и сотр.. Tetrahedron Letters 3, 2233 (1978).Работая аналогичным образом, можно noj|j(;чить следующие соединения: А. 2-Бензогидрилоксикарбонил-7 -Г2-метоксиимино-(2-тритиламино-|-тиазолил)ацетамидо -8-оксо-3-(2-тозилоксивинил)-5-тиа-1-аза-дицикло11-(.2.0)2-октена (изомер син, форма (Е). ЯМР-спектр (350 МГц. СДСР., «5 м,д 3.37 и;3, (АВ, Гц,2Н, -S-CH -цефем); 5,07 (d,S.i, Н в 6); 5,92 (dd, S и 9, Н в 7);, Б, 2-Бензогидрилоксикарбонил-7- 2-метоксииминб(2-тритиламино- -тиазолил)ацетамидо -8-оксо-3-{2-тозилоксивинил)-5-тиа-1-аза-дицикло (,2.0)-3-октена (изомер син, форма Е) , ЯМР-спектр (350 МГц, СДС,, м,д 5.07 (S, 1Н, Н в 2); 5,32 (d, 5, Н в 6);- 5,68 (dd, S и 9, Н в 7); 6,19 (S, Ш, Н В, 2-Бензогидрилоксикарбонил-7- 2-метоксиимин-2-(2-тритиламин- -тиазолил)-ацетоамид -8-оксо- Б оксид -3 (2-окситозилвинил}-5-тиа-.1-азабицикло(.2,0)-2-октена (изомер син) . Изомер Z, ИК-спек-( (СНВгз): 3380, 1800, 1720, 1680, 1510, 1375, 1180, 1175, , 1000 и 735 cMl ЯМР-спектр протона (350 МГЦ, СДСЕ Вм.д., j Гц): 2,03 (S, ЗН, .-СН 3,36 и ,07 (2 d, , 2Н, -SCH2-) +,09 (S, ЗНр -ОСНз).; «+,52 (d, , 1Н, Н в 6); 6,Vf (d,d, и 9,1Н, Н в 7); 6, (АВ, , 2Н, ); 6,86 (S, 1Н, .СООСН-); 6,1 (d, |, 1Н, Н вбтиазола.; 7,75 (d, j 9, 2Н, Н в ортоположении тузила). Изомер Е, ИК-спектр (еНВга): 3380, 1800, 1725, 1685, 1515, 1380, 1190, 1180, 1070, 1050, 755 и 735 смЧ ЯМР-спектр протона (350 МГц,,СДСНз §м,д., j Гц): 2,(S, ЗН, -С.Н.СН 3,19 и 3.77 (2 d,, 2Н, ) «+,08 (S, ЗН, -OCHj); 4,6 (d, j 4, Н в 6); 6,18 (d, dj it и 9 Н в 7h. 6,72 (S, 1Н, Н в 5 т.иазола); 6,93 (dd, , 1Н, -CH CH-OS02-); 7,11 (d, , 1Н, OSOj-); 6,90 (S, 1Н, -СООСН), 7,73 (d,S 9, 2Н, Н в ортоположении тозила), Пример2.3г 2-бензогидрил оксикарбонил-7 2-метоксиимино-2- 2-тритиламино- -тиазолил ацетамиAoJ-8-оксо-5-оксиА-3-(2-тозилоксиви нил) -5-тиа-1-аза-дицикло(.2.0)-2-октена (изомер син, форма Е) раств ряют в 30 смЗ метиленхлорида, добав ляют 1,2 см Н,М-диметилацетамида. , Раствор помещают в атмосфере азота, охлаждают до и обрабатывают 0,9 г трихлорида фосфора. Реакцион ную смесь перемешивают 90 мин при температуре от -10Ч AO-SC, затем разбавляют 250 см этилацетата и промывают 150 см насыщенного водного раствора бикарбоната натрия и два . раза 100 см насыщенного раствора хлорида натрия. После сушки над.сульфатом натрия и фильтрованием орга- нический раствор выпаривают досуха яри пониженном давлении 20, мм рт.ст) при , остаток растворяют в 20 см метиленхлорида и раствор хроматографируют на колонке (высота 25 см, диаметр 5 см), содержащей 2MQ г силикагеля (0,,ОбЗ мм). Элюируют 2 л смеси циклогексан - этилацетат бОГ+О (по объему) и отбирают фракции 100 см, фракции 8-13 выпаривают досуха при пониженном давлении (20 Мм рт, ст.) и . Получают 1,7 г 2-бензогидрйлоксикарбонил-7 - 2-м«токсиимино-2- (2-тритиламино- -ти 13олил)ацетамид9 -3 (2-тозилоксивинил)-8-оксо-5-аза-1-аза-дицикло(.2,0)-2-октена (изомер син, фор|ма Е). ,52, хроматография на силикагеле с элюентом циклогексан - этилацетат 50; 50 (по объему). ИК-спектр (CHBrj): , 1790, 1725, 1685, 1520, 1375, 1190, 1180, 1075, 1050, 755 и смЯМР-спектр протона (350 МГц.СДС, 6 и.д., j Гц): 2,42, (S, ЗН; -СН. тозил); 3,33 и 3,2 (ЛВ, , 2Н, 5СН2-); ,07 (S, ЗН, -ОСИ); 5,03 (d, , IH, Н в 6); 5,87 (dd, j i и 9, IH, Н в 7);; 6,71 (S, IH, Н в 5 тиазола); 6,87 (S, IH, ) 6,87 (d, , IH, -ен СН-0$02-); 7,0 (S уширенный, IH, N-Н-тиазол); 7,78 (d , , -СОН-).Примерз. 1,5 г 2-бензогидрилоксикарбонил-.7-р-метоксиимино-2-(2-тритиламино-Ц-тиазолил)ацетами-до)-8-оксо-3-(2-тозилоксивинил)-5-тиа-1-аза-дицикло(.2.0)2гоктена (изомер син, форма Е) растворяют в смеси 30 см муравьиной кислоты и 1,0 см дистиллированной воды. Раствор нагревают до 50°С 30 мин. После охлаждения отфильтровывают осадок и выпаривают фильтрат досуха при.по,,„- . иженном давлении (10 мм рт. ст.) при . Остаток растирают с 50 см диэтилового эфира. Твердый продукт Отделяют фильтрованием, промывают два раза 25 см диэтилового эфира. затем сушат при пониженном давлении (5 мм рт. ст.)при . Получают 0,75 г (2-амино- -тиазолил)2-метоксииминоацетамидо1 -2-карбокси-8-оксо-3-(2-тозилоксивинил)-5 -тиа-1-аза-дициклоС .2.о)-2-октена (изомер син, форма Е) в виде сольвата с муравьиной кислотой. ,57, хроматография на силикагела элюентом: смесь этилацетат ацетон - вода - уксусная.кислота 50:20J0 10 (по объему)С ИК-спектр (КВг): , ЗЗАО, . ЗОрО, 2820, 2200, 1775, 1720, 1670, 1630, 1370, 1190, 1165 и 1070 скг. ЯМР-спекто протона (350 МГц, ДМСО d,,5M.A.,( Гц): 2.1«2 (S, ЗН. -CHj тозил); 3,55 и 3,78 (АВ, S 19, 2Н, -SCH,-); 3,83 (S, ЗН, -OCHj); 5,1« (d, , 1Н, Н в 6); 5,75 (dd, S и 9, 1Н, Н в 7); 6,65 (d, , 1Н, 02-); 6,73 (S, 1Н,И в 5 тиазола); 7,18 (S мультиплет, -NH-); 9,53 (d, , Ш, -CONH-). П р и и а р 4« Перемешивают при в течение 30 мин смесь 0,35 г (2-амино- -тиазопил)-2-метоксииминоацетамидо -2-бензогидрилоксикарбонил-8-оксо-З-(2-тозилоксивинил) -5-тиа-1-аза-дицикло(«в2.0)2-октена (изомер син, форма Е), 10 см муравьиной кислоты и 3 см воды. Затем добавляют 8 см воды, фильтруют и выпаривают при и давлении 0,05 мм рт. ст. (0,007 кПа).Растворяют два раза в 20 см этанола, выпаривая каждыйраз досуха при и давлении 20 мм рт. ст. (2,7 кПа). Полученное твердое вещество растирают с 20 см диэтилового эфира. Пос ле фильтрования и сушки получают 0,12 г ((2-амино- -тиазолил)-2-метоксииминоацетамидо -2-карбокси-8-оксо-3-)2-тозилоксивинил)-5-тиа -1-аза-дицикло(4,2.0)-2-октена (изомер син, форма Е) в виде желтого порошка. ИК-спектр (КВг): 3360, 3200, ЗЮО 2000, 1770, 1670, 1630, 1530, 1370, 1190, 1175, 1070, 1045, 925, 810 см7 ЯМР-спектр протона 350 МГц, ДМСО : $. м.д.,, j Гц); 2,t5 (S, ЗН, -СНз 3,58 и 3,80 (2, d, 5 18, 2Н, -SCH2i 88 (S, ЗН, -qcH,); 5,i8.1d,S «. .1Н, Н в 6); 5,78 (d,d, S и.9, ,ГН, Н в 7):; 6,68 и 7,20(2 d, , 2Н, ); 6,7А (S, 1Н, Н тиазола 7Г20 (S, 2Н, -NH); 7,51 и 7,В8 (2 d , АН, группа тозила); 9,58 (d, J9, 1Н, -CONH-). П р и м е р 5. Нагревают с рефлюксом в течение 20 ч смесь 0,9 г 2-бензогидрилкарбонил-7- 2-метоксиимино-2-(2-тритиламино- -тиазолил)ацетамидо -8-оксо-З-(2-тозилоксивинил)5 -тиа-1-аза-дицикло(.2.0)г2-октена (изомер син, форма Е), 20 см ацетона и 10 мг гидрата п-толуолсульфокислоы. Выпаривают досуха при давлении 20 мм рт. ст. и , растворяют в 30 см этилацетата и 20 см 5%-ного . раствора бикарбоната натрия, деканируют, сушат органическую фазу над сульфатом натрия, филвтруют и выпаривают досуха при давлении 20 мм рт.ст. и . Остаток хроматографируют на .. колонке с 50 г силикагеля Merck ... (0,06-0,2), диаметр колонки 3 см, высота 2-7 см. Элюируют 0,4 л этилацетата, собирая фракции 20 см , J4PaKr ции 8-10 представляют собой смесь исходного вещества и требуемого продукта, фракции 11-17 выпаривают при давлении 20 мм рт. ст. и . Получают 0,15 г (2-aминo4-тиaзoлил)-2-мeтoкcииминoaцeтaмидo |-2-бeнзoгидpилoкcикapбoиил 8-okсо-Зт(2-тознлоксивинил)-5-тиа-1-аза-дицикло(4.2,0)-2-октена (изомер син, форма Е) , в виде твердого вещества кремового цвета. ИК-спектр (CHBr): 3480. 3390, 3340, 3210, 1780, 1725, 1680, 1620, 1600, 1530, 1495, 1455, 1445, 1360, 1190, 1180, 1075, 1050, 925, 810 ч 760 cMl ЯМР-спектр протона (350 МГц, ДМСО dj., §м,д. / Гц):.2,43 (S, ЗН, -СНа)) 3,61 и 3.85 (2 d, , 2Н, -SCH,-); 3,86 (S, ЗН, -ОСН,);.5,22 (d, , 1Н, 6); 5,85 (dd, и 9, tH, Ив 7); 6,54 и 7,38 (2 d, f-12, 2Н, ); 6,75 (S, 1Н, Н тиазола); 6,88 (S, 1Н, -COOCH-i); 7,20 (S, 2Н, -NH); 7,50 и 7,84 (2 d, S 8, 4Н группа тозила); 9,62 (d, , 1Н, -CONH-). Формула изобретенияСпособ получения производных 3-оксивииилцефалоспорина общей формулы (I)
C-COMl
odHs где R - атом водорода или третил; RjZ атом водорода или-бензгидрилмо или 1,
16
CH-0-S02
г
СооВг в виде син-изомеров,в форме Е или Z или их. смесей, отличающийся тем, что соединение общей формулы (И)
CHg-СО С - СОШ
оОСН5
()«
I
СН СН-0 COOR
где Но и п имеют указанные значения в виде син-изомера подвергают взаимодействиювс тиомочевиной общей формулы (Щ)
ИгШ -Og - NH,
где Rjj имеет указанные значения| в среде растворителя при комнатной температуре и выделяют целевой продукт или, в случае необходимости, когда .
,, его восстанавливают для получения соединения, где , и/ в слу1чае необходимости, удаляют тритильную и/или бензгидрильную группу.
Источники информации, принятые во внимание при экспертизе
1. Патент, США № i+OOIZZS, кл. 2( С, опубл. 1977.






| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения производных 3-оксивинилцефалоспорина | 1981 |
|
SU988193A3 |
| Способ получения 3-тиовинилцефалоспоринов или их солей с щелочными металлами или их аддитивных солей с азотсодержащими органическими основаниями | 1980 |
|
SU1130167A3 |
| Способ получения 3-тиовинилцефалоспоринов или их солей | 1980 |
|
SU1098522A3 |
| Способ получения производных 3-оксивинилцефалоспорина | 1980 |
|
SU965358A3 |
| Способ получения 3-тиовинилцефалоспоринов или их солей | 1980 |
|
SU1114339A3 |
| Способ получения производных цефалоспорина | 1980 |
|
SU927118A3 |
| Способ получения 3-тиовинилцефалоспоринов | 1980 |
|
SU1037842A3 |
| Способ получения производных 3-аминовинилцефалоспорина | 1980 |
|
SU1031409A3 |
| Способ получения 3-тиовинилцефалоспоринов | 1981 |
|
SU1160936A3 |
| ТИАЗОЛБЕНЗОГЕТЕРОЦИКЛЫ, СПОСОБЫ ИХ ПОЛУЧЕНИЯ, ЛЕКАРСТВЕННОЕ СРЕДСТВО, ПРОМЕЖУТОЧНЫЕ ПРОДУКТЫ ДЛЯ ПОЛУЧЕНИЯ ТИАЗОЛБЕНЗОГЕТЕРОЦИКЛОВ | 1998 |
|
RU2198889C2 |


Авторы
Даты
1982-12-23—Публикация
1981-01-19—Подача