в виде син-изомера,
где Rg - защитная группа, такая как тритил;
R;H R;
имеют указанные для R и Rj значения, при условии, что в случае наличия в заместите СН СН-0-502-СбН1Г СНз
COOR.
где Rj - сложноэфирная. защитная группа, такая как бензгидрил, при нагревании в среде инертного органического растворителя, полученный сульфоксид восстанавливают треххлористым фосфором при охлаждении в среде инертного органического растворилях Своб(1диых амино-, оксиили форМИЛЬНЫХ групп
защищены и К не может означать атом водорода, подвергают взаимодействик с соединением формулы
теля, в полученном продукте удаляют группы, защищающие амино-, окси или формильные группы, и выделяют целевой продукт в виде свободной кислоты или ее сложного эфира, такого как бензгидриловый, или в виде соли.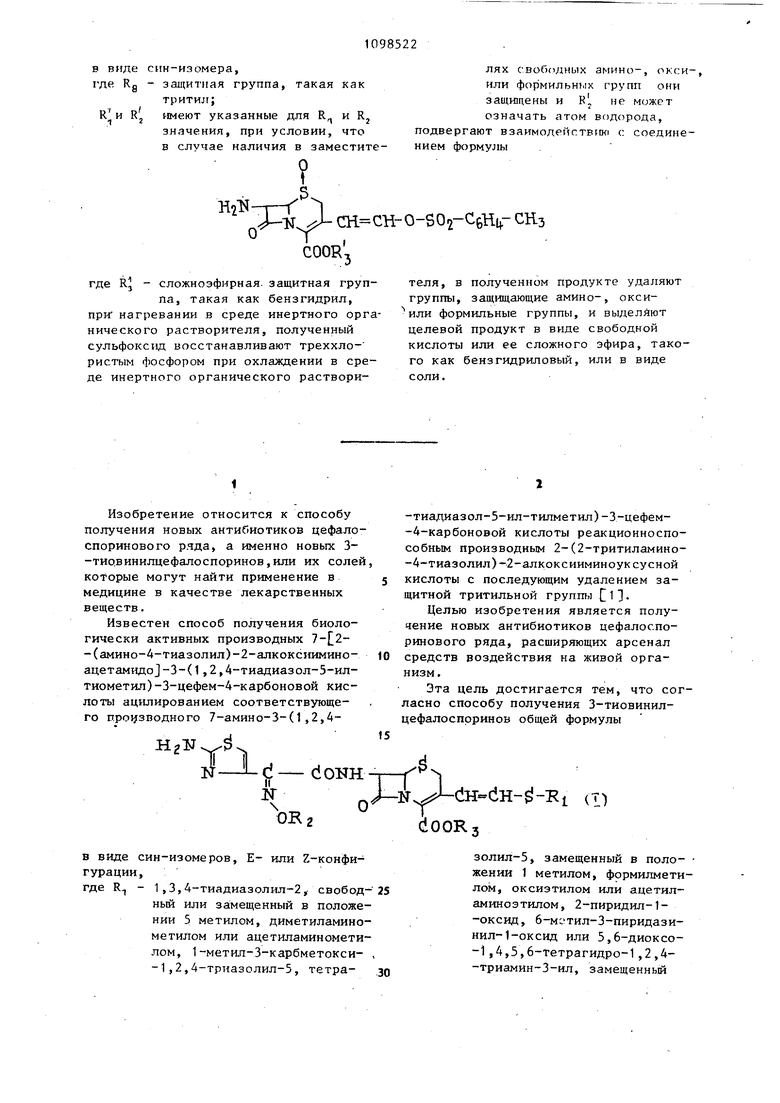














| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения 3-тиовинилцефалоспоринов или их солей с щелочными металлами или их аддитивных солей с азотсодержащими органическими основаниями | 1980 |
|
SU1130167A3 |
| Способ получения 3-тиовинилцефалоспоринов | 1981 |
|
SU1160936A3 |
| Способ получения 3-тиовинилцефалоспоринов или их солей | 1980 |
|
SU1114339A3 |
| Способ получения 3-тиовинилцефалоспоринов | 1980 |
|
SU1037842A3 |
| Способ получения производных 3-аминовинилцефалоспорина | 1980 |
|
SU1031409A3 |
| Способ получения производных 3-оксивинилцефалоспорина | 1980 |
|
SU965358A3 |
| Способ получения производных 3-оксивинилцефалоспорина | 1981 |
|
SU988193A3 |
| Способ получения производных 3-оксивинилцефалоспорина | 1981 |
|
SU984411A3 |
| Способ получения производных цефалоспорина | 1980 |
|
SU927118A3 |
| Способ получения производных 2,3,6,7-тетрагидротиазоло /3,2- @ / пиримидин-5-она | 1982 |
|
SU1145932A3 |
Способ получения 3-тиовинилцефалоспоринов общей формулы I ilL - - ЙОНН-р-Г 1 .:(lH.eH-e-Si к О OR г dOOKj в виде син-изомеров Ё- или Z конфигурации, где R - 1,3,4-тиадиазолил-2, свободньй или замещенный в положений 5 метилом, диметиламинометилом или ацетиламино метилом, 1-метил-3-карбме- токси-1,2,4-триазолил-5, тетразолил-5, замещенный в положении 1 метилом, формилметилом, оксиэтилом или ацетиламиноэтилом, 2-пиридил-1-оксид, 6-метил-З-пиридазинил-1-оксид или 5,6-диоксо-1,4,5,6-тетрагидро -1,2,4-триазин-З-ил, замеценный в положении 4 2-оксопропилом, группой формулы -СН, -сн. R 2 2 4 где R. - ОКСИ-, амино-, формил, меТОКСИ-, метилтио-, ацетамиДО-, формилокси-, ацетилокСИ-, карбамоилокси-, карбметоксиамино-, глицилокси-, метансульфонамидо-, аминоацетамидо- или метилуреидо-радикал, или группой формулы -СН. - СН - R.. i Re где Rg - оксигруппа и R g - формил СП или оксиметил или Rg и Re вместе с атомом углерода,с которым они связаны, образуют тиазолидинил,или группой формулы -СН, - СН R где R - кислород, метилен или оксиимино- или метоксиимино-радикал в виде смеси син- и анти-изомеров; R - водород, метил, винил или цианометил; Rj - водород или сдожноэфирная защитная группа, такая как бензгидрил, или их солей, отличающийс я тем, что соединение формулы II V R&N: C-CO-S-K, Nи -№ , ORO

Изобретение относится к способу получения новых антибиотиков цефалоспоринового ряда, а именно новых 3-тио.винилцефалоспоринов,или их солей которые могут найти применение в медицине в качестве лекарственных веществ.
Известен способ получения биологически активных производных (амино-4-тиазолил)-2-алкоксииминоацетамидо -3-(1,2,4-тиадиазол-5-илтиометил)-З-цефем-4-карбоновой кислоты ацилированием соответствующего производного 7-амино-3-(1,2,4-тиадиазол-5-ил-тилметил)-3-цефем-4-карбоновой кислоты реакционноспособным производным 2-(2-тритиламино-4-тиазолил)-2-алкоксииминоуксусной кислоты с последующим удалением защитной тритильной групш, СОЦелью изобретения является получение новых антибиотиков цефалоспоринового ряда, расширяющих арсенал средств воздействия на живой организм.
Эта цель достигается тем, что согласно способу получения 3-тиовинилцефалоспрринов общей формулы
2Uv
;а
doNHК
OR
в виде син-изомеров. Е- или Z-конфигурации,
где R - 1 ,3,4-тиадиазолил-2, свобод-25 ный или замещенный в положении 5 метилом, диметиламинометшюм или ацетиламинометилом, 1-метил-3-карбметокси- , -1,2,4-триазолил-5, тетра- зо
золил-5, замещенный в положении 1 метилом, фррмилметилом, оксиэтилом или ацетиламиноэтилом, 2-пиридил-1-оксид, 6-мс тил-3-пиридазиНИЛ-1-ОКСИД или 5,6-диоксо-1 ,4,5,6-тетрагидро-1,2,4-триамин-3-ил, замещенный 3109 в положении 4 группой 2-оксопропилом, формулы -СН - CHj - R где R - ОКСИ-, амине-, формил, метоксц-, метилтио, ацетамидо-, формилокси-, ацетилокси-, карбамоилокси-, карбметоксиамино-, ГЛИЦИЛОКСИ-, метансульфонамидо-, аминоацетамидо, или метилуреидо-радикал, или группой формулы -CHj - СН - Rg где Rr - оксигруппа и R - формил или оксиметил илиRgИ R вместе с атомом углерода, с которым они связаны, образуют тиазолидинил, или группой формулы -CHj -СН R где R - кислород, метилен или оксиимино, или метоксиимино-раNY CH CH-OСООКагде R - сложноэфирная защитная группа, такая как бензгидрил, при нагревании в среде инертного органического растворителя, полученный сульфоксид восстанавливают треххлористым фосфором при охлаждении в среде инертного органического растворителя, в полученном продукте удаляют группы, защищающие амине-, окси- или формйльные группы, и вьщеляют целевой продукт в виде свободной кислоты или ее сложного эфира,такого как бенз гидриловый, или в виде соли. Новые соединения формулы 1 могут быть подвергнуты очистке физическими способами, такими как -кристаллизация или хроматография. Новые производные цефалоспорива, а также их фармацевтически пригодные соли обладают антибактериальными свойствами. Они обладают значительным, действием как in vivo, так и in vitro на грамположительные и грамотри цательные бактерии. в гд по ни дикал в виде смеси сии- и анти-изомеров; Rj - водород, метил, винил или цианометил; RJ - водород или сложноэфирная защитная группа, такая как бензгидрил, их солей, соединение формулы Наш S C-CO-S-R виде син-изомера, е Rg - защитная группа, такая как тритил; R и Rj имеют указанные для R., и Rj значения, при условии, что Fслучае наличия в заместите лях свободньге амино-, оксиили формильных групп они защищены, и RJ не может означать атом водорода, двергают взаимодействию с соединеем формулы OJ- В условиях in vitro продукты формулы I проявляютактивное действие при концентрации 0,5-15 мгк/см на штаммы стафилококков, чувствительных к пенициллину (Staphylococcus aureus Smith), при концентрации 1-30 мкг/см на штаммы стафилококков, стойких к пенициллину (Staphylicoccus aureus Ш9), при концентрации 0,001 1 мкг/см на кишечную палерчку (Escherichia coli, щтамм Monod) и при концентрации 0,06-30 мкг/см на возбудитель пневмонии (Klebsiella pneumoniae). Кроме того, некоторые c.oep,ij нения проявляют активное действие при концентрации 0,01-30 1кг/см на Proteus morgani и приО, 1-30 мкг/см на Enteribacter aerogenes. В условиях in vivo продукты формулы I оказывают активное действие, как вьшвлено при иcпытa ияx на мышах, на Staphylococcus aureus Smith, чувствительный к пенициллину G, при дозе 0,2-15 мг/кг в день (подкожная инъекция) и на кишечную палочку (Escherichia coli, штамм Monod) при подкожном введенииО,001-10 мг/кг в день. Доза LDgpпродуктов формулы I находится в пределах от 1,5 г/кг до значения, превышающего 2,5 г/кг, при вводе этих продуктов в организм мышей путем подкожной инъекции. Пример 1. Смесь 1,16 г 6-амино-2-бензгидрилоксикарбоннл-8-оксо-т5-оксид-3-(2-тозилоксивинил)-5-тиа-1-азабицикло-(4,2,0)-октена-2 кбнфигурации Е, 35 см диметнлфьрмамида, 1,67 г 5-С2-метоксиимино-2-(2-тритйламино-4-тиазолш1)-ацетилтиЬЗ-2-метил-1,3,4-тиадиазола, синизомер, и 0,35 см Н,М-диизопропилэтиламина перемешивают в течение 1 ч при в атмосфере азота.Смесь разбавляют 140 см этилацетата, раствор промывают трехкратно 70 см воды. высушивают над сульфатом натрия, фил руют и выпаривают досуха при 20 С и 20 мм рт.ст. (2,7 кПа). Остаток раст воряют в 25 см метиленхлорида доба ляют 5 силикагеля Merck (0,06-0,2 мм выпаривают досуха при и 20 NW рт.с. (2,7 кПа) и этот порошок вводя в хроматографическую колонку диаметром 2 см, заполненнук 35 г силикагеля Merck (0,06-0,2 мм). Элюирование осуществляют последовательно 100 см смеси циклогексан - этилацетат в объемном соотношении 80:20:250 см (60:40), 500 см (40:60); 500 см (20:80) и 500 см чистого этилацетат при этом собирают фракции объемом 60 см. Фракции 17-26 выпаривают досуха при 20 С и 20 мм рт.ст. (2,7 кП и в результате получают 0,56 г 2-бен гидрилоксикарбонил-7-С 2-метоксиимино -2-(2-тритиламино-4-тиазоли)-ацетамидо -3- 2-(2- метил-1,3,4-тиaдиaзo -5-ил-тиo)-винил-C8-oкco-5-oкcид-5-тиа-1-азабицикло-(4,)октена-2, син-изомер конфигурации Е, в виде безе розоватого цвета. ИК-спектр (СНВз), 3380, 1800 1725, 1680, 1515, 1490, 1445, 1045, 935, 750. ЯМР-спектр (350 МГц, СВС1з) , ч./млн. (I, Гц): 2,72 (синглет, ЗН, -CHj); 3,28 и 4,08 .(2 дублета, 1 18, 2Н, -SCHj-); 4,07 (синглет, ЗН, -ОСИ,); 4,60 (дублет, , 1Н, Н в 6); 6,16 (дублет дублет, и 9, 1Н, Н в 7); 6,71 (синглет, 1Н, Н тиазола); 6,95 (синглет, 1Н, -СООСН-); 7,07 (синглет, 1Н, , -NHCCC Hj),); 7,23 и 7,33 (2 дублета, I 16, ); К раствору 5,11 г 2-бензгидрклоксикарбонил-7-С2-метоксиимйно-2-(2-тритиламино-4-тйазолил)-ацетамидо}- 3-С2-(2-метил-1 ,3,4-тиадиазолил-5)-тиовинил1-8-оксо-5-оксид-5-тиа-1-азабицикло(4,2,0)октена-2, син-изомер конфигурации Е, и 2,1 см диметилацетамида в 50 см.метиленхлорида добавляют при -8°С и при одновременном перемешивании 0,93 см трихлорида фосфора. Смесь перемешивают в течение 1 ч при -8 С и разбавляют ее 1 л этилацетата, промьшают двукратно 250 см- полунасыщенного раствора бикарбоната натрия и двукратно 250 см полунасьш4енного раствора хлорида натрия, высушивают над сульфатом натрия и выпаривают досуха при 20°С и 20 мм рт.ст. (2,7 кПа). Продукт выпаривания растворяют в 50 см- смеси циклогексан этилацетат (объемное соотношение 40:60) и вводят в хроматографическую колонку. Диаметром 5 см, наполненную 150 г силикагеля Merck (0,04-0,06 мм) . Элюирование осуш;ествляют 3 л указанной ранее смеси под давлением 4 кПа, и собирают фракции объемом 125 см. Jl. Фракции 10-20 выпаривают досуха при и 20 мм рт.ст, (2,7 кПа), В результате получают 2,69 г 2-бензгидрилоксикарбонил-7- 2-метоксиимино-2-(2-тритиламино-4-тиазолил)-ацетамидо}-3-j 2- (2-метш1-1 ,3,4-тиадиазолил-5) .тиовинил -3-оксо-5-тиа-азабицикло(4,2,0)ой:тена-2, син-изомер конфигурации Е, в виде безе желтого цвета. ИК-спектр (СНВз), 3390, 1785, Т720, 1685, 1515, 149, 1445, 1045, 94, 755. ЯМР-спектр (350МГц, СВС1з)с, ч./млн. (I, Гц): 2,75 (синглет, ЗН, -СНз); 3,60 и 3,69 (2 дублета, , 2Н, -SCHj-); 1,09 (синглет, ЗН, -ОСНз); 5,09 (дублет, , 1Н, Н в 6); 5,93 (дублет, дублет, и 9, 1Н в 7)J 6,75 (синглет, 1Н, Н тиазола); 6,98 (синглет, 1Н, -СООСН-); 7,0 (синглет, 1Н, -НН-С(СбН5)з); 7,22 (дублет, 1 14, 1Н, ), Смесь 2,37 г 2-бензгидрилоксикарбонил-7- 2-метоксиимино-(2-тритш1амино-4-тиазолил)-ацетамидоЗ-3- 2-(2-метил-1,3,4-тиа:диазолил-5)тиовинил -8-оксо-5-тиа-1-аза-бицикло(4,2,0)-октена-2, син-изомер конфигурации Е, и 30 см муравьиной кислоты с добавкой 14 см воды перемешивают при в течение 15 мин. Смесь охлаждают, разбавляют 16 см воды и фильтруют. Фильтрат выпаривают досуха при 30°С и 0,05 мм рт.ст. (0,007 кПа), и остаток растворяют трехкратно в 50 см этанола, выпаривая досуха после каждого растворения Полученный твердый продукт перемешивают при в 35 см этанола в течение 25 мин, фильтруют, промывают двукратно 20 см этилового эфира и выпаривают. В результате получают 1,18 г 7-С2-(2-аминотиазолил-4)-2-метоксииминоацетамидо -2-карбокси-З (2-метил-1,3,4-тиадиазолил-5)тиовинил -8-оксо-5-тиа-1-аэабицикло(4,2,0)-октена-2, син-изомер конфигу рации Е, в виде порошкообразного про дукта желтого цвета. ИК-спектр (КВг), 3400, 3200, 3100, 2200, 1775, 1675, 1530, 1045, ЯМР-спектр (350 МГц, DMSod ) с , ч./млн. (I, Гц): 2,74 (.синглет, ЗИ, -CHj); 3,67 и 3,94 (2 дублета, I 18, 2Н, -SCHj-); 3,86 (синглет, ЗН, -ОСН)з); 5,21 (дублет, , 1Н, Н в 6); 5,80 (2 дублета, I 4 и 9, Ш, Н в 7); 6,75 (синглет, 1Н, Н тиа зола); 7,12 и 7,17 (2 дублета, , 2Н, ); 7,20 (синглет, 2Н-ЫН.г) 9,63 (дублет, , 1Н, -CONtf-). 7-Амино-2-бензгидрилоксикарбонил-8-оксо-5-оксид-3-(2-тозш1оксивинил) -5-тна-1-аэ абицикло(4,2,0)-октен-2 может быть получен следующим образом Раствор 54,3 г 2-бензгидрилоксикарбонш1-7-трет-бутоксикарбониламино-8-оксо-5-оксид-3-(2-тозилоксивинил) -5-тиа-1-азабицикло(4,2,0)-октен-2 конфигурации Е и 30,4 г гидратирован ной п-толуолсульфокислоты в 1,4л ацетонитрнпа перемешивают при 35С в течение 2 ч. Раствор выпаривают досуха при 30°С и 20 мм рт.ст. (2,7 кПа), продукт выпаривания раств ряют в 1 л этилацетата, промывают двукратно 500 см полунасьшченного раствора бикарбоната натрия в двукратно 500 см полунасьш;енного раствора хлорида натрия, высушивают над сульфатом натрия и выпаривают досуха при 20°С 20 мм рт.ст. (2,7 кПа). Оста ток растирают, смешивая с 200 см простого эфира. В результате получают 28,13 г 7-амино-2-бензгидрилоксиарбонил-8-оксо-5-оксид-3-(2-тозилокивинил)-5-тиа-1-азабицикло(4,2,0)октена-2 конфигурации Е в виде поошкообразного продукта светло-коричевого цвета. Rf 0,32 (хроматография на силикагеле, элюент - смесь метиленхлоридметанол в объемном соотношении 85:15). 5- 2-Метоксиимино-2-(2-тритиламино-4-тиазолил-ацетилтиоД-2-метил-1,3,4-тиадиазол, син-изомер, может быть получен следующим образом. К охлажденной до 4°С суспензии 8,88 г 2-метоксиимино-2-(2-тритиламино-4-тиазолил-) -уксусной кислоты, син-изомер, и 2,64 г 5-меркапто-2-метил-1,3,4-тиадиазола в 200 см этилацетата добавляют при одновременном перемешивании однократно 4,96 г Ы,Н-дициклогексилкарбодиимида. Смесь перемешивают в течение 4 ч при 4°С, фильтруют суспензию, промывают двукратно 200 см воды, . двукратно 100 см полунасьш:(енного раствора бикарбоната натрия и 100см насьпценного раствора хлорида натрия, высушивают над сульфатом натрия, фильтруют, выпаривают при 20 С и 20 мм рт.ст. (2,7 кПа) до остаточного объема 20 см и фильтруют,фильтрат разбавляют 200 см петролейного эфира, фильтруют и в результате получают 6,2 г сырого целевого продукта желтого цвета. Очистку осуществляют следующим образом. Полученный продукт подвергают обработке циклогексаном (220 см) при кипячении с обратным холодильником, фильтруют в горячем состоянии, фильтрат выпаривают до получения остаточного объема 30 см при 20С и 20 мм рт.ст. (2,7 кПа), фильтруют ив результате получают 4,5 г 5- 2-метоксиимино-2-(2-тритиламино-4-тиазолил)-ацетилтио -2-метил-1,3,4-тиадиазола, син-изомер. ЯМР-спектр (80 МГц, CDCl3)d, ч./млн. (I, Гц): 2,85 (синглет, ЗН, -CHj); 4,08 (синглет, ЗН,ЫОСНз); 6,60 (синглет, Ш, Н тиазола) . ИК-спектр (СНВГз), 695, 1605, 1580, 1530, 1490, 1450, 1050, 900. Пример 2. Смесь 0,23 г 7амино-2-бензгидрилоксикарбонил-8оксо-5-оксид-3-(2-тозилоксивинил)5-тиа-1 -азабицикло (4,2,0) -9ктена-2 91098 конфигурации Е, 15 см диметилформамида, 0,40 г 4-(2,2-диметоксиэтил)-5,6-диоксо-3-С2-метоксиимино-2-(2-тритиламино-4-тиазолил)-2-ацетилтио -1,4,5,6-тетрагидро-1,2,4-триазина, син-изомер, и 0,07 см К,Ы-диизопропилэтиламина перемешивают .в течение 5 ч при 60°С в атмосфере азота.Смесь разбавляют 60 см э.тилацетата, промьшают раствор трехкратно 30 см воды, затем двукратно 30 см полунасыщенного раствора хлорида натрия, выс шивают над сульфатом натрия, фильтру ют и выпаривают досуха при и 20 мм рт.ст. (2,7 кПа). Остаток растворяют в 10 см метиленхлорида, добавляют 2 силикагеля Merck (0,060,2 мм) и выпаривают досуха при 20°С и 20 мм рт.ст. (2,7 кПа). Полученный порошкообразный продукт вводят в колонку диаметром 1,2 см, за11олненн5то 8 г силикагеля Merck (0,06-0,2 мм). Элюирование осуществляют последовательно 50 см смеси циклогексан этилацетат в объемном соотношении 80:20; .100 см (60:40); 200 см 20:80 и 200 см чистого этилацетата, при этом собирают фракции объемом 25 см. Фракции 12-19 выпаривают досуха при 20°G и 20 NW рт.ст. (2,7 кПа и в результате получают 0,19 г 2-бензгидрилоксикарбонил-3- 2- 4-(2,2 -диметоксиэтш1)-5,6-диоксо-1,4,5,6-тетрагидро-1,2,4-триазинил-3- -тиовиншIЗ-7-t2-мeтoкcииминo-2-(2-тpитил амино-4-тиазолкл)-ацетамидо -8-оксо-5-оксид-5-тиа-1-азабицикло(4,2,0)-октена-2, син-изомер конфигурации Е, в виде безе беж-еього цвета. ИК-спектр (КВг), см: 3380;3250, 1795, 1720, 1685, 1520, 1490, 1445, 1040, 940, 760, 700. ЯМР-спектр (350МГц, CDCl)rf , ч./млн., (I, Гц): 3,34 и 4,12 (2 дуб лета, I 18, 2Н, ); 3,40 (син глет, 6Н, -OCH.j); 3,94 - 4,06 (мультиплет, 5Н, -ОСНз и ); 4,60-4,68 (мультиплет, 2Н, Н в 6 и -СН(ОСН )j); 6,07 (дублет-дублет, I 4 , 1Н, Н в 7); 6,70 (синглет .1Н, Н тиазола); 6,82 (дублет, , 1Н, ); 6,96 (синглет, 1Н, -сосен-). Раствор 8,5 г 2-бензгидрилоксикарбонип-3-{2- С4-(2,2-диметоксиэтил) -5,6-диоксо-1,4,5,6-тетрагидро-1,2,4 -триазинил-ЗЗтиовинил -7- 2-метоксиимино-2-(2-тритиламиио-4-тназолил)-ацетамидо --8-оксо-5-оксид-5-тиа-1-азабицикло(4,2,0)-октена-2, синизомер конфигурации Е, и 3 см диметилацетамида в 100 см метиленхлорида подвергают обработке 1,40 см трихлорида фосфора при -10 С и, одновременном перемешивании. Через 1,5 4s а затем 2 ч каждый раз добавляют 0,7 см трихлорида фосфора. Смесь разбавляют 600 см этилацетата, промывают двукратно 150 см 2%-ного раствора бикарбоната натрия и двукратно 150 см полунасыщенного раствора хлорида натрия, высушивают над сульфатом натрия, фильтруют и выпаривают досуха при 20°С в вакууме (20 мм рт.ст., или 2,7 кПа). Остаток растворяют в 50 см этилацетата и раствор подвергают хроматографическому разделению в колонке (диаметром 3 см, высота 25 см), наполненной 100 г силикагеля Merck с размером частиц 0,05-0,2 мм. Элюирование осуществляют 1 л этилацетата, собирают фракции объемом 200 см. Фракции 3,4 и 5 выпаривают досуха (20 мм рт.ст., или 2,7 кПа) при 20 С. В результате получают 7,5 г 2-бензгидрилоксикарбонил-3-{2- 4-(2,2-диметоксиэтил) -5,6-диоксо-1,4,5,6-тетрагидро-1 2,4-триазинил-З -тиовинил -7- 2-мeтoкcиминc-2-(2-титилaминoтиaзoлил-4)-aцeтaмидo -8-oкco-5-тиa- 1-азабицикло(4,2,0)-октена-2, синизомер конфигурации Е, в виде безе оранжевого цвета. ИК-спектр (СНВг,), 3380, 1780, 1720, 1680, 1515, 1490, 1445, 755, 740. ЯМР-спектр (350 МГц, СНВГз)с, ч/млн. (I, Гц): 3,40 (синглет, СН, -СН(ОСНз)2); 3,54 и 3,66 (2 дублета, I 18, 2Н, SCH,,-); 3,98 (дублет, 1 5, 2H,NCH2-); 4,02 (синглет, ЗН, NOCHj); 4,65 (триплет, , 1Н, -СН(ОСНз)2); 5,08 (дубет, I 4, 1Н, Н в 6-); 5,92 (дубет-дублет, 1 4 и 9, 1Н, Н в 7); ,73 (синглет, 1Н, Н тиазола); 6,83 . (дублет, I 16, Ш, ) 6,95 (синглет, -СООСН-). Раствор 1,05 г 2-бензгидрилоксиарбонил-3- 2- 4-(2,2-диметоксиэтил)5,6-диоксо-1,4,5,6-тетрагидро-1,2,4триазинил-ЗЗ-тиовинил -7- 2-метоксимино-2-(2-тритиламинотиазолил-4)ацетамидоЗ-8-оксо-5-тиа-1-азабицико(4,2,0)-октена-2, син-изомер конфигурации E, в 20 см 98%-ной муравь иной кислоты подвергают обработке дри 50 С в течение 30 мин. Смесь выпаривают досуха при 50°С в вакууме (0,05 мм рт.ст., или 0,007 кПа), растворяют в 50 см ацетона, выпари вают досуха при 30°С в вакууме (20 мм рт.ст., или 2,7 кПа). Эту операцию повторяют дважды. Твердьш остаток подвергают обработ ке 50 см ацетона при 60°С в течение 10 мин при одновременном переме шивании, суспензию охлаждают и филь руют, высушивают твердьй остаток и результате получают 0,51 г 7-L2-(2-аминотиазолш1-4)-2-метоксииминоаце амидо -2-карбокси-3- 2-(5,6-диоксо-4-формилметнл-1,4,5,6-тетрагидро-1,2,4-триазинил-3)-тиовинил -8-окс -5-тиа-1-азабицикло(4,2,0)-октена-2 син-изомер конфигурации Е. ИК-спектр (КВг), 3500, 2300 1770, 1715, 1690, 1540, 1050, 950. ЯМР-спектр (350 МГц, СРзСООВ)сЛ, ч./млн. (I, Гц): 3,87 (АВ предел, 2Н, -SCHj-); 4,30 (синглет, ЗН-ОСН 5,20 (синглет широкий, 2H,NCH-); 5,38 (дублет, I 4, 1Н в 6); 6,08 (дублет, , 1Н, Н в 7); 7,22 (дублет, I 16, Н, ); 7,50 (синглет, 1Н, Н тиазола); 7,72 (дуб лет, I 16, 1Н, CHS-); 9,73 (синглет широкий, 1Н, -СНО). ЯМР-спектр (350 МГц, ч./млн., (I, Гц); 3,82 (АВ предел, 2Н, -SCHj-); 4,26 (синглет, ЗН, -OCHj); 5,10 (синглет широкий, 2Н, NCHj-); 5,32 (дублет, 1 4, 1Н, Н в 6); 5,96 (дублет, I 4, 1Н, Н в 7); 7,06 (дублет, I 16, 1Н, ); 7,43 (синглет, 1Н, Н тиа зола); 7,56 (дублет, I 16, 14, СН-); 9,67 (синглет широкий, 1Н, -СНО). 4-(2,2-Диметоксиэтил)-5,6-диоксо -3- 2-метоксиимино-2-(2-тритиламино триазолил-4)-адетилтио ,4 5,6-тет рагидро-1,2,4-триазин, син-изомер, может быть получен следующим образо К охлажденному до 4С раствору 0,89 г 2-метоксиимино-2-(2-тритипаминотиазолил-4)-уксусной кислоты, син-изомер, и 0,47 г (2,2-диметокси этил)-5,6-ДИОКСО-3-ТИОКСО-1,2,4-пер гидротриазина в 20 см диметилформамида добавляют однократно 0,50 г Ы,Н-дициклогексилкарбодинмида, смес перемешивают в течение 1 ч при 4с, а затем в течение 3 -t при 20°С. Затем суспензию фильтруют., разбавляют фильтрат 100 см этилацетата, промывают двукратно 50 см воды, двукратно 50 см 1%-ного раствора бикарбоната натрия и двукратно 50 см полунасыщенного раствора хлорида натрия, высушивают над сульфатом натрия, фильтруют и выпаривают досуха при и 20 мм рт.ст. (2,7 кПа). Остаток смешивают с 10 см изопропило ого зфира и после фильтрации и сушей получают 0,91 г 3-(2,2-диметоксиэтил)-5,6-диоксо-3-{2-метоксиимино--2-(2-тритиламинотиазолил-4)-ацетилтиоЗ-1,4,5,6-тетрагидро-1,2,4-триазина, син-изомер, в виде порошкообразного продукта желтого цвета. ЯМР-спектр (80 МГц, СОС,), ч./млн. (I, Гц): 3,30 (синглет, 6Н, -OCHj); 4,05 (синглет, ЗН, НОСНз); 4,28 (дублет, , 2Н, NCH.-); 4,66 (триплет, 1 5, 1Н, -СН); 6,68 (синглет, 1Н, Н тиазола). ИК-спектр (СНВГз), 3380, 1720, 1585, 1525, 1490, 1450, 1040, 900, 750, 730. Пример 3. Смесь 0,614 г 7-амино-2-бензгидрилоксикарбонил-8-оксо-5-оксид-3-(2-тозилоксивинил)-5-тиа-1-азабицикло(4,2,0)-октена, конфигурация Е, 50 см диметилформамида и 0,70 г 4-(2-трет-бутоксикарбонштаминоэтил)-5,6-диоксо-3- 2-метоксиимино-2-(2-тритиламинотиазолил-4)-ацетилтио -1,4,5,6-тетрагидро-1,2,4-триазина, син-изомер, нагревают при 60°С в течение 6 ч в атмосфере азота. Смесь разбавляют 150 см этилацетата, промывают двукратно 120 см воды,двукратно 100 см 1 Н. соляной кислоты, 100 см воды и 100 см насыщенного водного раствора хлорида натрия, высушивают над сульфатом натрия. Фильтруют и выпаривают досуха при ° С и 20 мм рт.ст. (2,7 кПа). Остаток подвергают хроматогра(|«ческому разделению в колонке диаметром 2,5 высотой 25 см, заполненной 40 г си кагеля Merck (0,06-0,2 мм). Элюирование осуществляют 1 л этилацетата и собирают фракции объемом 60 см.Фракции 3-6 выпаривают досуха при 20С и 20 мм рт.ст. (2,7 кПа). .В результате получают 0,21 г 2-бензгидрилоксикарбонил-3-{2- 4-(2-1рет.-бутоксикарбониламинозтш1)-3,6-диоксо-1,4,5,6-тетрагидро-1,2,4-триазинил-З тиовинил}-7- 2-метоксиимино-2-(2-тритил,3109 аминотиазолил-А)-ацетамидоЗ-8-оксо-5-ОКСИД-5-тиа-1-азабицикло(4,2,0)-октена-2, син-изомер конфигурации Е в виде безе коричневого цвета. Раствор 3,36 г 2-6ензгидрилоксикарбонил-3- 2- А-(2-трет.-бутокси1-карбониламиноэт11л) -5,6-диоксо-1,4,5 , 6-тетрагидро-1,2,4-триазинил -3 тиоПбинил -7-C2-мeтoкcииминo-2-(2-тpитилaминoтиaзoлил-4 )-ацетамидо -8-оксо-5-оксид-5-тиа-1-азабицикло(4,2,0)-октена-2, син-изомер конфигурации Е, в 30 см метиленхлорида и 1,2 см диметилацетамида подвергают обработке при -10°С в течение 1,5 ч 1,04см трихлорида фосфора. Раствор разбавляют 150 см этилацетата, промывают 150 см 2%-ного раствора бикарбоната натрия и двукратно 100 см полунасы щенного водного раствора хлорида на |рия, высушивают над сульфатом натри фильтруют и выпаривают досуха при 20С и 20 мм рт.ст. (2,7 кПа) . Продукт осаждают на 5 г силикагеля Merck (размер частиц 0,06-0,2 мм) и подвергают хроматографическому разделению в колонке (диаметром 3 см высота 15 см), заполненной 50 г силикагеля Merck (0,06-0,2 мм). Элюирование осуществляют 6 л этилацетат и собирают фракции объемом 600 см. Фракции 2-7 выпаривают досуха при 20°С и 20 мм рт.ст. (2,7 кПа) и в результате получают 1,97 г 2-бензгид рилоксикарбоншт-3-{2-| 4-(2-трет.бутоксикарбониламиноэтил)-5,6-диоксо-1,4,5,6-тетрагидро-1,2,4-триазинил -3 -тиовинилj-7-f2-мeтoкcииминo-2-(2-тpитш aминoтиaзoлилг4)-aцeтaмидo -8-ок со-5-тиа-1-аз абицикло(4,2,0)-октена-2, син-изомер конфигурации Е в виде безе желтого цвета. ПК-спектр (КВг), 3400, 3280 1790, 1715, 1695, 1590, 1520, 1495, 1450, 1040, 945, 755, 700. ЯМР-спектр (350 МГц ОМСО){Г,ч./млн (I, Гц): 1,33 (сйнглет, 9Н, -С(СНз) 3,20. (мультиплет, 2Н, -CH CHNO; 3,64 и 3,86 (2 дублета, I 18, 2Н, -SCHj-); 3,83 (триплет, I 6, 2Н, ); 3,84 (сйнглет, ЗН, NOCHj); 6.,25 (дублет, 1 4, 1Н, Н 5,77 (дублет-дублет, I 4 и 9, 1Н, Н); 6,72 (сйнглет, 1Н, Н тиазола); 6,92 (сйнглет, 1F1, -СООСНС); 9,93 и 7,02 (2 дублета, 1 12, 2Н, -CH CIi-S-); 8,82 (сйнглет, 1Н, N-H-) 9,53 (дублет, , 1Z, -NHCO-): 12,55 (сйнглет, 1Н, -NH-триазин). Смесь 1,88 г 2-бензгидрилоксикарбонил-3-f2- 4-(2-трет.-бутоксикарбониламиноэтил)-5,6-диоксо-1,4,5,6-тетрагидро-1,2,4-триазинил-3 -тиовинил|-7- 2-метоксиимино-2-(2-тритиламинотиазолил-4)-ацетамидо -8-оксо-5-тиа-1-азабицикло(4,2,0)-октеиа-2, синизомер конфигурации Е, 35 см мурапьиной кислоты и воды нагревают при 50 с в течение мин. Затем добавляют 20 см воды, смесь охлаждают до 20 С, фильтруют и выпаривают досуха при 50°С и 0,05 мм рт.ст. (0,007 кПа). Остаток двукратно растворяют в 100 см этанола и после каждого растворения выпаривают досуха при и 20 мм рт.ст. (2,7 кПа). Остаток обрабатывают 50 см этанола при 45 С в течение 15 мин, фильтруют, промывают твердый остаток двукратно 20 см эфира и высушивают. В результате получают 1,08 г (2-аминотиазолил-4)-2-ме ток сиимин раце тамидо J-3-{2- 4-(2-аминоэтил)-5,6-диоксо-1,4,5,6-тетрагидро-1,2,4-триазинил-3 -тиовинил -2-карбокси-8-оксо-5-тиа-1-азабицикло(4,2,0)-октена-2, син-изомер конфигурации Е, в виде формиата, представляющего собой порошкообразный продукт желтого цвета. ИК-спектр (КВг). смЧ- 3500, 2200, 1770. 1710, 1680, 1630, 1530, 1380, 040, 930. ЯМР-спектр (350 МГц, ОМЗО)сЛ , ч./млн. (I, Гц): 3,12 (мультиплет, 2Н, -CHj-CHj-NH); 3,51 и 3,60 (2 дублета, I 18, 2Н, ); 3,85 (сйнглет, ЗН, CHON); 4,12 (тришгет, , 2Н, NCHj-CHj-NH); 5,12 (дублет, , 1Н, Н ); 5,67 (дублет, дублет, I 4 и 9, 1Н, Н ); 6,44 (дублет, I 8, 1Н, ).; 6,73 (сйнглет, 1Н, Н тиазола); 7,2 (сйнглет широкий, 2Н, -NHj); 8,18 (сйнглет, JH, Н формиата), 9,55 (дублет, I 9, 1Н, -NHCO-), Эфир тиоловой кислоты, являющийся исходным продуктом, может быть получен следующим образом, К охлажденной до суспензии 2,17 г 2-метоксиимино-2-(2-тритиламинотиазолил-4)-уксусной кислоты, синизомер, и 1,05 г 4-(2-трет.-бутоксикарбониламиноэтил)-5,6-диоксо-З-тиоксо-1,2,4-пергидротиазина в 50 см этилацетата добавляют 1,11 г N,N-дициклогексилкарбодиимида. Смесь перемешивают в течение 4 ч при 20 С, фильтруют и выпаривают досуха при
20 С и 20 мм рт.ст. (2,7 кПа). Остаток растворяют в 20 см метиленхлорида и раствор вливают в 250 см диизопропилового эфира. После фильтрации-и сушки получают 0,73 г 4-(2-трет.-бу- 5 токсикарбониламииоэтил)-5,6-диоксо-3- 2-метоксиимино-2-(2-тритиламинотиазолил-4)-ацетилтио 3-1,4,5,6-тетрагидро-1,2,4-триазина, син-иэомер,
в виде порошкообразного продукта желтого цвета.
ИК-спектр (CHBrj), 3440, 3390, 2820, 1710, 1585, 1530, 1450, 1390, 1370, 1050, 955,900, 755.
Аналогично, используя соответствующие исходные получают соединения формулы 1, представленные в таблице.
vO О
ivo т
я счра
aj о
«г н я
вй о aj - U и
s
о t
тON
о
У|
г
« ss-Й .
CSI |-
S
« vO «
S - ia а « - - о и х о, vo I
- S -) vO
сч аI
vO со
« гП
1Л И d O и
«Ч Я
fO
И f О /-.
I щ со fli S
y-N
5 S
I MVO «OS
ta 1 ст
о rt я
«,« S S о
CO
33 г t. т о сч и
is; в ON г4 Н
/ SS 3
ш о г I f4 I
2J ««чл
СМ ас -v «33
00 cd BJ « Ч см
f О
см оч m я «
S
Х SX
ITI
НО «М
и ft чО тЭ
33S
CNJ
-э и а см
Sч-
) к ю
ev|
N.X 00
СМ
- ТЗ О
«n
ТЗ со Ю и in .х I
S
Щ
со in А
CN
- г г I м vO
. «. CJ
S tn о г I CO
A Ф
О «
I Ы
о
о с
А|
ci
-S
p
0)
§
n
s
I W
о §
f-YI
;ziYf2i-S
о
IN
-- CN
ю
.S
о
о о
°оё.
tri
ИИ с
l о о.
Тт й-CM
-5
Y
CSJ
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Способ получения производных - -( -АМиНО- -ТиАзОлил)- - АлКОКСииМиНОАцЕТАМидО - -( - ТиАдиАзОл- -илТиОМЕТил)цЕф- -EM-- КАРбОНОВОй КиСлОТы или иХ СОлЕйС щЕлОчНыМи МЕТАллАМи, B ВидЕ СиН-изО-MEPOB | 1978 |
|
SU841590A3 |
Авторы
Даты
1984-06-15—Публикация
1980-10-15—Подача