Изобретение относится к способам получения 3 α, 5-цикло-24 метил-5 α -холеста-7,22-диен-6 β -ола формулы (I), который является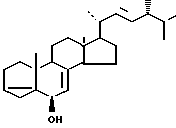 промежуточным продуктом в синтезе природного фитогормона эпибрассинолида, обладающего высокой ростостимулирующей активностью (1-3).
промежуточным продуктом в синтезе природного фитогормона эпибрассинолида, обладающего высокой ростостимулирующей активностью (1-3).
Известен (4) единственный метод получения 3 α -5-цикло-24R-метил- 5 α -холеста, 7,22-диен-6 β -ола (I) (прототип), который заключается в том, что природный стерин эргостерин (II) превращают в тозилат (III) действием п-толуолсульфохлорида в пиридине при комнатной температуре в течение суток. Затем тозилат эргостерина (III) подвергают i-стероидной перегруппировке в 3 α -5-цикло-24R-метил-5 α-холеста-7,22-диен-6 β -ол (I) кипячением в водном ацетоне в присутствии бикарбоната калия в течение 5 мин. Общий выход циклоспирта (I) составляет 49%. Недостатком этого метода является сравнительно невысокий выход целевого продукта (I) из эргостерина (II), необходимость очистки на обеих стадиях от примеси соединения (IV), а также длительность процесса.
Цель изобретения - увеличение выхода 3 α, 5-цикло-24R-метил-5 α -холеста-7,22-диен-6 β -ола (I) из эргостерина (II) и сокращение длительности процесса.
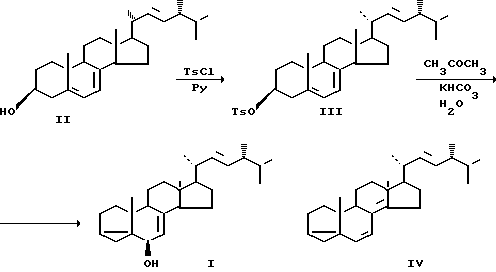
Поставленная цель достигается описываемым способом, который заключается в том, что эргостерин (II) обработкой метансульфохлоридом в пиридине превращают в мезилат (V), который при кипячении в водном ацетоне в присутствии бикарбоната калия перегруппировывается в 3 α -5-цикло-24R-метил-5 α -холеста-7,22-диен-6 β-ол (I).
Способ отличается от ближайшего известного тем, что в i-стероидной перегруппировке вместо тозилата эргостерина (III) используется его мезилат (V).
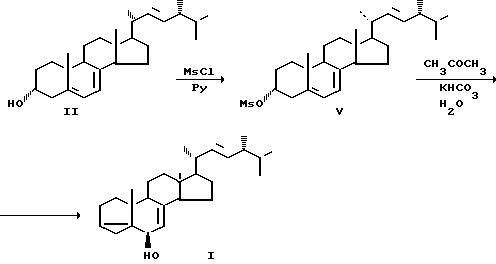
Известно использование для проведения i-стероидной перегруппировки мезилата 22-дегидрохолестерина (VI), содержащего в цикле. В только одну двойную связь [5]. Выход кетона (IX) в данном случае составил 79%.
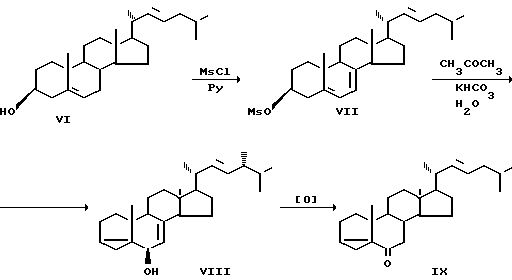
Применение мезилата вместо тозилата не дает в данном случае каких-либо преимуществ. Так, соединение (XIII) получено по аналогичной схеме через стадию тозилата (XI) с выходом 80% (6). Применение мезилатов стеринов, содержащих диеновую систему в цикле В, для проведения i-стероидной перегруппировки неизвестно.

Для лучшего понимания сущности изобретения приводится пример.
П р и м е р 1. Эргостерин (5 г, 1,2˙10-2 моль) растворяют в 40 мл пиридина и при непрерывном перемешивании прибавляют 2,03 г (1,77˙10-2 моль) метансульфохлорида. Реакционную смесь выдерживают в течение 15-20 мин, затем разбавляют водой и экстрагируют эфиром. Экстракт промывают 20%-ной уксусной кислотой, затем водой и насыщенным раствором бикарбоната натрия. Сушат над сульфатом натрия, упаривают. Выделено 5,88 г соединения IV. Выход 98,2% Т.пл. 95-96оС. ИК-спектр, см-1; 1180, 1325 (O=S=D).
Спектр ПМР (200 МГц, δ, м.д.) 0,62 с (3Н, 18-Ме), 0,82 д (3Н, I 7Гц, 26/27 Ме), 0,84 д (3Н, I 7Гц, 26/27-Ме), 0,92 (3Н, I 7Гц, 24-Ме), 0,96 с.
К раствору 5,2 г мезилата IV в 700 мл ацетона прибавляют раствор 12 г бикарбоната калия в 100 мл воды. Реакционную смесь кипятят с обратным холодильником в течение 1-1,5 ч. Затем упаривают 1/3 об. разбавляют 300 мл воды и экстрагируют эфиром. Экстракт сушат над сульфатом натрия, упаривают. Выделено 4,18 г циклоспирта I. Выход 96,2%. Т.пл. 131-133оС.
ИК-спектр, см-1: 3400 (ОН).
Спектр ПМР (200 МГц, δ, м.д.); 0,64 с (3Н, 18-Ме) 0,826 д 3Н, I 7Гц, 26/27 Ме), 0,846 д (3Н, I 7Гц, 26/27 Ме), 0,92 д (3Н, 7,2 Гц, 24-Ме), 1,03 д (3Н, 7Гц, 21-Ме), 1,08 с (3Н, 19-Ме) 3,42 дд (1Н, I1 4,5 Гц, I2 1,2 Гц, С6-Н, 5,2 м (2Н, С22-Н и С23-Н); 5,47 м (1Н, С7-Н-. Масс-спектр (m/z) 396 (М+), 378 (М+-Н2О).
Применение описываемого способа позволяет повысить выход целевого соединения с 49 до 94%, уменьшить длительность процесса, а также исключает необходимость очистки целевого продукта.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения 3 @ -окси-24R-метилхолест-5-ена | 1988 |
|
SU1594181A1 |
| СПОСОБ ПОЛУЧЕНИЯ 24-ЭПИБРАССИНОЛИДА | 2004 |
|
RU2272044C1 |
| Способ получения 3 @ ,5-цикло-24 @ -этил-5 @ -холест-22-ен-6-она | 1984 |
|
SU1162816A1 |
| Способ получения 24-эпибрассинолида | 2023 |
|
RU2839811C2 |
| (22ζ)-6b-МЕТОКСИ-3a,5-ЦИКЛО-5a-ХОЛЕСТАН-24-ОН-22-ОЛ В КАЧЕСТВЕ ПОЛУПРОДУКТА В СИНТЕЗЕ (22R,23R)-3b-АЦЕТОКСИ-22,23-ИЗОПРОПИЛИДЕНДИОКСИ-24-МЕТИЛХОЛЕСТ-5-ЕНА | 1991 |
|
RU2024540C1 |
| (22 @ ,23 @ ,24 @ )-22,23-Эпокси-24-этил-5 @ -холест-2-ен-6-он в качестве полупродукта в синтезе (24 @ )-24-этилбрассинона | 1985 |
|
SU1270155A1 |
| (22R, 23R, 24S)-22,23-Диокси-24-этил- @ -холест-2-ен-6-он в качестве промежуточного продукта в синтезе (24S)-24-этилбрассинона и способ его получения | 1985 |
|
SU1363830A1 |
| АРОМАТИЧЕСКИЕ СОЕДИНЕНИЯ И СОДЕРЖАЩИЕ ИХ ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ | 1996 |
|
RU2182574C2 |
| СТЕРОИДНЫЕ СОЕДИНЕНИЯ, СПОСОБЫ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СПОСОБЫ РЕГУЛЯЦИИ И СОВЕРШЕНСТВОВАНИЯ ВОСПРОИЗВЕДЕНИЯ, ПРОМЕЖУТОЧНЫЕ СОЕДИНЕНИЯ | 2002 |
|
RU2289587C2 |
| @ (11 @ ,17 @ )-11,17-Дигидрокси-3,20-диоксопрегн-4-ен-21-ил @ тио @ уксусная кислота как промежуточный продукт в синтезе биоспецифического сорбента и способ ее получения (его варианты) | 1983 |
|
SU1161512A1 |
Использование: как промежуточный продукт в синтезе фитогормона эпибрассинолида. Сущность: продукт 3,5-цикло-24-метил-5-холест-7,22-диен-6-ол. Выход 94% т. пл. 95-96°С. Способ ускоряет процесс, исключает необходимость очистки целевого продукта. Реагент: 1: эргостерин. Реагент 2: метансульфохлорид. Условия реакции: в среде пиридина, с последующей обработкой бикарбонатом натрия в водном ацетоне.
СПОСОБ ПОЛУЧЕНИЯ 3α, 5-ЦИКЛО-24R-МЕТИЛ- 5α -ХОЛЕСТ-7,22-ДИЕН- 6β -ОЛА, включающий взаимодействие эргостерина с сульфонилгалогенидом в пиридине и кипячение полученного сульфопроизводного в водном ацетоне в присутствии бикарбоната калия, отличающийся тем, что, с целью сокращения длительности процесса и повышения выхода целевого продукта, в качестве сульфонилгалогенида используют метансульфохлорид.
| Авт.св | |||
| Способ получения 3 @ ,5-цикло-24 @ -этил-5 @ -холест-22-ен-6-она | 1984 |
|
SU1162816A1 |
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
Авторы
Даты
1994-12-15—Публикация
1991-06-26—Подача