Изобретение относится к органическому синтезу и касается способа получения производного бензопирана, представляющего собой (±) -6-циано-3,4-дигидро-2,2-диметил-транс-4-(2-оксо-пирролидинил)-2Н- 1-бензопиран-3-ол формулы VI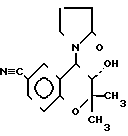 известного как Кромакалим (DRL-34 915).
известного как Кромакалим (DRL-34 915).
Кромакалим является анти-гипертензивной композицией нового действующего механизма. Он принадлежит к периферической группе анти-гипертензивных веществ, он действует путем раскрытия каналов калия в клетках гладкой мышцы, и он тем самым предотвращает аккумуляцию электрического потенциала через мембраны. Таким образом, он принадлежит к активаторам каналов калия [Drugs of the Future, 11, 175 (186), 12, 284 (1987), 13, 269 (1088), 14, 276 (1989)]
Согласно ЕР 076 075 [1] описывающему возможности получения Кромакалима, 4-циано-фенол формулы I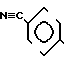
 реагирует с 3-хлор-3-метил-бутином, что приводит к пропаргиловому эфиру формулы IX
реагирует с 3-хлор-3-метил-бутином, что приводит к пропаргиловому эфиру формулы IX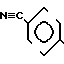
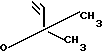 который затем подвергается замыканию цикла с получением 6-циано-2,2-диметил-2Н-1-бензопирана формулы III
который затем подвергается замыканию цикла с получением 6-циано-2,2-диметил-2Н-1-бензопирана формулы III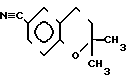
Соединение формулы III превращается затем через 6-циано-транс-3- бром-3,4-дигидро-2,2-диметил-2Н-1-бензопиран-4-ол в 6-циано-3,3-дигидро-3,4-эпокси-2,3-димет- ил-2Н-1-бензопиран формулы V
Из соединения формулы V может быть получен по трем независимым путям конечный продукт реакции формулы VI.
1) Соединение формулы V подвергается реакции с аммиаком с получением 6-циано-3,4-дигидро-2,2-диметил-транс-4-амино- 2Н- 1-бензопиран-3-ола формулы VII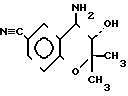 который затем подвергается реакции с хлорангидридом 4-хлормасляной кислоты с получением соединения формулы VIII
который затем подвергается реакции с хлорангидридом 4-хлормасляной кислоты с получением соединения формулы VIII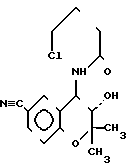 и это соединение затем подвергается замыканию цикла в системе гидрид натрия-тетрагидpофурен.
и это соединение затем подвергается замыканию цикла в системе гидрид натрия-тетрагидpофурен.
2) Соединение формулы V подвергается реакции с 4-аминомасляной кислотой в системе бикарбонат натрия-этанол, и замыкание цикла приводит к конечному продукту реакции формулы VI.
3) Соединение формулы V подвергается реакции с 2-пирролидоном в присутствии гидрида натрия и диметилсульфоксида и получается конечный продукт реакции формулы VI.
При воспроизведении разработанных примеров из ЕР 076 075 авторы изобретения обнаружили следующие обстоятельства:
4-циано-фенол реагирует с 3-хлор-3-метил-бутином в присутствии гидроокиси натрия бензил-триметил-аммоний-гидроокиси-воды и дихлорбутана при комнатной температуре в течение 5-6 дней; согласно описанию изобретения к патенту пропаргиловый эфир формулы IX может быть получен с выходом 69% Реакция была повторена несколько раз, однако может быть достигнут только 46-50%-ный выход. Реакция была проведена в ацетоне, диметилсульфоксиде, N,N-диметилформамиде в качестве растворителя в присутствии карбоната и йодистого калия при 50-150оС, и после 30-40 ч реакции может быть достигнут только 40-55%-ный выход. Дополнительной проблемой является то, что только 3-окси-3-метил-бутил является коммерчески доступным и согласно опытам 3-хлор-3-метил-бутин может быть получен из этого соединения только с выходом 55-60% в ходе затрудненной реакции. 3-Хлор-3-метил-бутин является мало стабильным соединением, он разлагается при стоянии, и то же время он полимеризуется во время реакции алкилирования, или он разлагается при более высокой температуре. Реакция 4-циано-фенола формулы I и 3-хлор-3-метил-бутина приводит к пропаргиловому эфиру формулы IX с выходом только 45-55% и этот эфир затем подвергается замыканию цикла в орто-дихлорбензоле до 6-циано-2,2-диметил-2Н- 1-бензопирена формулы III с выходом 80% согласно ЕРО 0 076 075. Согласно собственным экспериментальным опытам реакция может быть проведена с выходом в лучшем случае 70% очистка продукта реакции формулы III является сложной процедурой и может быть осуществлена вакуумной перегонкой или колоночной хроматографией. По этой реакции могут быть получены производные хромена формулы III с выходом 35% относительно 4-циано-фенола формулы l и с выходом 23% относительно 3-хлор-3-метил-бутина.
3-Бром-4-окси-производные формулы IV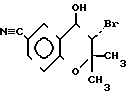 могут быть получены из хромена формулы III в системе диметилсульфоксида и воды с выходом 90% согласно ЕРО 076 075. Подобным же образом эпоксид формулы V может быть получен с выходом 90% путем реакции взаимодействия 3-бром-4-оксипроизводного формулы IV с гидроокисью натрия в присутствии смеси растворителей диоксана и воды, т.е. может быть осуществлено превращение
могут быть получены из хромена формулы III в системе диметилсульфоксида и воды с выходом 90% согласно ЕРО 076 075. Подобным же образом эпоксид формулы V может быть получен с выходом 90% путем реакции взаимодействия 3-бром-4-оксипроизводного формулы IV с гидроокисью натрия в присутствии смеси растворителей диоксана и воды, т.е. может быть осуществлено превращение
III_→IV__→V
Получение конечного продукта реакции формулы VI было осуществлено простым методом, при котором эпоксид формулы V был подвергнут реакции с 3-пирролидоном в присутствии гидрида натрия и диметилсульфоксида. Неожиданно была получена довольно сложная реакционная смесь, и по тонкослойной хроматографии можно было определить 6-8 компонентов, количество которых было соизмеримым Реакция была повторена несколько раз и конечный продукт реакции формулы IV мог быть получен с выходом 20-25% только с помощью усложненной колоночной хроматографии в противоположность выходу 60% согласно изобретению.
Согласно методике, раскрытой в ЕР 076 075 [1] конечный продукт реакции формулы VI может быть получен только с выходом 22-26% относительно 4-циано-фенола формулы I, а методика, когда воспроизводится по собственным экспериментам, может быть осуществлена с выходом только 6-8%
Таким образом, методики, раскрытые в ЕР 076 075 [1] являются неподходящими для промышленного получения Кромакалима формулы VI.
Целью изобретения было тщательно разработать новый экономичный и промышленно доступный способ получения Кромакалима формулы VI. Изобретение относится к новому способу получения (±) -6-циано-3,4-дигидро-2,2-диметил-транс-4-(2-оксо-1-пирролидинил)- 2Н-1-бензопиран-2-ола формулы VI исходя из 4-циано-фенола формулы I, включающему реакцию 4-циано-фенола формулы I с непредельным углеводородом. Способ по изобретению отличается тем, что 4 -циано-фенол формулы I вводят во взаимодействие с изопреном с получением 6-циано-2,2-диметил-3,4-дигидро-2Н-1-бензопирана формулы II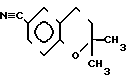 который затем превращают в 6-циано-2,2-диметил-2Н-1-бензопиран в присутствии катализатора и/или окислителя или путем бромирования в бензильной части молекулы и дегидробромирования полученного соединения формулы Х
который затем превращают в 6-циано-2,2-диметил-2Н-1-бензопиран в присутствии катализатора и/или окислителя или путем бромирования в бензильной части молекулы и дегидробромирования полученного соединения формулы Х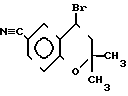 с получением в одну стадию 6-циано-3,4- дигидро-2,2-диметил-3,4-эпокси-2Н-1-бен-зопирана с помощью надкислот и последующим взаимодействием этого соединения с 2-пирролидоном с получением конечного продукта реакции.
с получением в одну стадию 6-циано-3,4- дигидро-2,2-диметил-3,4-эпокси-2Н-1-бен-зопирана с помощью надкислот и последующим взаимодействием этого соединения с 2-пирролидоном с получением конечного продукта реакции.
Взаимодействие 2-циано-фенола формулы I с изопреном осуществляют при 30-120оС в среде растворителя и в присутствии щелочных металлов и/или катализаторов. В качестве щелочного металла предпочтительно применяют калий. Реакцию осуществляют в присутствии в качестве катализатора кислот Льюисовского типа, предпочтительно треххлористого алюминия; при этом молярное соотношение 4-циано-фенола формулы I:изопрен:калий: треххлористый алюминий составляет (0,8-1,2):(0,9-2,0):(01-0,7):(0,9-3,0), предпочтительно 1:1:0,5: 1.
В качестве растворителя применяют ароматические растворители, предпочтительно бензол.
Продолжительность реакции 2-10 ч, предпочтительно 5-8 ч.
Реакцию 4-циано-фенола формулы I с изопреном осуществляют также путем катализа кислотами в несмешивающемся с водой растворителе с использованием в качестве кислотного катализатора хлористоводородной кислоты, серной кислоты, ортофосфорной кислоты, хлорной кислоты, метансульфоновой кислоты, паратолуолсульфоновой кислоты, предпочтительно серной кислоты и с использованием в качестве растворителя алифатических и ароматических углеводородов, галоидалканов, предпочтительно хлороформа, и осуществляют реакцию при 60-80оС, предпочтительно в течение 4-6 ч. При этом молярное соотношение 4-циано-фенола формулы I:изопрена составляет 0,5:10, предпочтительно 1:4.
При упомянутых условиях реакции 6-циано-3,4-дигидро-2,2- диметил-2Н-1-бензопиран формулы (II) был получен с выходом 90-95% он является новым соединением. Превращение соединения формулы (II) в 6-циано-2,2-диметил-2Н-1-бензопиран формулы III может быть осуществлено по нескольким независимым путям:
1) Соединение формулы II бромируется в бензильной части молекулы с помощью N-бром-сукцинимида в присутствии следов перекиси и при этом почти с количественным выходом образуется 6-циано-3,4-дигидро-2,2-диметил-2-бром-2Н-1-бензопир-ан формулы Х.
Это соединение подобным образом может быть почти с количественным выходом дегидробромировано с помощью алкоголятов щелочных металлов с получением 6-циано-2,2-диметил-2Н-1-бензопирана формулы III.
2) Новое соединение формулы II может быть окислено в одну стадию с почти количественным выходом, используя тетраацетат свинца в ледяной уксусной кислоте или с помощью 2,3-дихлор-5,6-дициано-бензохинона в непорядном растворителе.
Кроме того, можно эпоксидировать соединение формулы III в одну стадию до производного формулы V путем использования надкислот в присутствии растворителя галоидалканового типа.
При осуществлении вышеописанным образом получения соединения формулы III путем бромирования в бензильной части молекулы соединения формулы II и дегидробромирования полученного соединения формулы X, осуществляют формирование в бензильной части молекулы соединения формулы II с помощью 0,9-1,5 молярного эквивалента, предпочтительно 1-1,1 молярного эквивалента N-бромсукцинимида в присутствии перекиси бензоила в галоидалкане, предпочтительно четыреххлористого углерода при 40-100оС, предпочтительно 70-80оС в течение 3-15 ч, предпочтительно 4-6 ч, и осуществляют дегидробромирование соединения формулы Х в присутствии 0,7-1,5 молярного эквивалента, предпочтительно 1-1,1 молярного эквивалента алкоголята щелочного металла, предпочтительно этилата натрия или трет-бутилата калия, в ароматических растворителях, предпочтительно бензола, при 75-85оС в течение 2-10 ч, предпочтительно 4-7 ч.
Если осуществляют реакцию получения соединения формулы III путем дегидрирования соединения формулы II, то осуществляют дегидрирование с помощью 0,5-10 молярного эквивалента, предпочтительно 1 -3 молярного эквивалента 2,3-дихлор-5,6-дицианобензохинона в ароматических растворителях, предпочтительно бензоле, предпочтительно при 75-80оС в течение 20-60 ч, предпочтительно в течение 35-40 ч.
Или осуществляют дегидрирование с помощью 0,5-10 молярного эквивалента, предпочтительно 1-3 молярного эквивалента тетраацетата свинца в алифатической карбоновой кислоте, предпочтительно ледяной уксусной кислоте, при 90-100оС в течение 0,5 ч, предпочтительно 1-2 ч.
Согласно изобретению соединение формулы V получают путем окисления соединения формулы III с помощью надкислот, предпочтительно с помощью 1-1,2 моляр- ного эквивалента мета-хлор надбензойной кислоты, и осуществляют реакцию в галоидированных углеводородах, предпочтительно хлороформе, в присутствии водного раствора бикарбоната щелочных металлов, предпочтительно бикарбоната натрия при 0-5оС в течение 3-40 ч, предпочтительно 18-23 ч.
Конечный продукт реакции формулы Vl получают путем взаимодействия соединения формулы (V) с 2-пирролидином и осуществляют реакцию в присутствии 1-1,2 мольного эквивалента щелочного металла, предпочтительно натрия или алкоголятов щелочных металлов, предпочтительно метилата натрия или третбутилата калия, при 20-30оС в течение 2-8 ч, предпочтительно 3-5 ч.
Изобретение имеет следующие преимущества:
4-циано-фенол формулы (l) реагирует с изопреном с почти количественным выходом, изопрен является недорогим, легко доступным промышленным промежуточным продуктом, хромен формулы lll может быть получен с помощью селективных реакций с хорошим выходом и поэтому очищен только кристаллизацией (в противоположность вакуумной перегонке, предлагаемой в ЕР 0 076 075) [1]
эпоксид формулы V может быть получен по изобретению с высокой чистотой в кристаллической форме;
конечный продукт реакции формулы (Vl) может быть получен при мягких условиях реакции ( нет необходимости использовать дорогостоящие гидрид натрия и диметилсульфоксид, которые являются опасными для окружающей среды и создают трудности при переработке;
очистка продукта реакции и обработка реакционной смеси являются простыми;
использованные растворители могут быть регенерированы перегонкой и могут быть возвращены в повторный цикл;
реакция может легко управляться, и объем реакционной смеси может быть увеличен;
промышленное производство не требует специального оборудования, и реакции могут быть приведены на обычных промышленных установках.
Согласно новому способу Кромакалин может быть получен с выходом 55-65% относительно 4-циано-фенола формулы l, в противоположность максимально 6-8% -ным выходам, раскрытым в ЕР 0 076 075 [1] и воспроизведенным экспериментами авторов данного изобретения.
П р и м е р 1. Получение 6-циано-2,2-диметил-2Н-1-бензопирана.
11,9 г (0,1 моля) 4-циан-фенола растворяют в 200 мл безводного бензола и затем добавляют малыми порциями 1,95 г (0,05 моля) металлического калия в атмосфере азота. Реакционную смесь перемешивают до прекращения выделения водорода. После этого добавляют при перемешивании 13,3 г (0,1 моля) треххлористого алюминия. При интенсивном перемешивании по каплям добавляют 10 мл (0,1 моля) изопрена и 50 мл абсолютного бензола. Реакционную смесь кипятят в течение 6 ч. Реакционную смесь охлаждают и добавляют раствор 250 мл насыщенного хлористого аммония. Слои разделяются, органический слой промывают до нейтральной реакции, высушивают над сульфатом натрия, и растворитель удаляют под вакуумом. Получают 17,29 г (92%) бесцветного масла.
nД24 1,5475.
Вычислено, C 76,98; H 6,99; N 7,48.
Найдено, C 76,80; H 7,07; N 7,40.
ПМР (СDCl3): 1,35 (6Н, синглет, 2 СН3), 1,93 (2Н, триплет, J 7 Гц, 3-СН2), 2,80 (2Н, триплет, J 7 Гц, 4-СН2), 6,80 (1Н, двойной дублет, J1 8 Гц, J2 1 Гц, 7-Н), 7,34 (2Н, мультиплет, 5Н и 8Н).
Масс-спектр (отн, инт.): 187 (60% М+), 172 (79%), 158 (32%), 144 (12%), 132 (100%), 116 (15%).
П р и м е р 2. Получение 4-бром-6-циано-3,4-дигидро-2,2-диметил-2Н-1-бензопирана.
В 200 мл четыреххлористого углерода растворяют 19,7 г (0,1 моля) 6-циано-3,4-дигидро-2,2-диметил-2Н-1-бензопирана и добавляют 18,7 г (0,105 моля) N-бром-сукцинимида и 1 г перекиси дибензола.
Реакционную смесь кипятят в течение 5 ч. Ее охлаждают, и выпадающий в осадок сукцинимид фильтруют, промывают четыреххлористым углеродом 2 х 200 мл и объединенный органический слой промывают до нейтральной реакции и высушивают над сульфатом натрия, растворитель удаляют. Получают 25 г (94%) кристаллического вещества.
Т,пл. 78-79оС.
Вычислено, C 56.16; H 4.54; Br 30,02; N 5,26
Найдено, C 56,00; H 4.60; Br 30,10; N 5,20.
ПМР (ДМСО-d6): 1,29 (3Н, синглет, СH3), 1,47 (3Н, синглет, СH3), 2,26-2,69 (2Н, мультиплет, 3-СН2), 5,76 (1Н, мультиплет, Br-CH), 6,93 (1Н, дублет, J 10 Гц, 8-Н), 7,64 (1Н, двойной дублет, J1 10 Гц, J2 2 Гц, 7-Н), 7,90 (1Н, дублет, J 2 Гц, 5-Н).
П р и м ер 3. Получение 6-циано-2,2-диметил-2Н-1-бензопирана.
26,6 г (0,1 моля) 4-бром-6-циано-3,4-дигидро-2,2-диметил-2Н- 1-бензопирана растворяют в 300 мл бензола и добавляют 11,2 г (0,1 моля) трет-бутилата калия. Реакционную смесь кипятят в течение 4 ч. Ее охлаждают и промывают водой 3 х 200 мл и высушивают над сульфатом натрия. После выпаривания получают 17,05 г (95%) кристаллического вещества.
Т.пл. 45-47оС.
МИК (KBr): 2230 см-1 (литературные данные по т.пл. 36-37оС).
П р и м е р 4. Получение 6-циан-2,2-диметил-2Н-1-бензопирана.
В 250 мл бензола растворяют 26,6 г (0,1 моля) 4-бром-6-циан-3,3- дигидро-2,2-диметил-2Н-1-бензопирана и добавляют 75,5 г (0,1 моля) 90%-ного этилата натрия и реакционную смесь кипятят в течение 6 ч. Следующая методика подобна методике примера 3. Получают 17 г (92%) твердого вещества, плавящегося при 45-46оС.
П р и м е р 5. Получение 6-циано-3,4-дигидро-2,2-диметил-2Н- 1-бензопирана.
К перемешиваемой смеси 220 г 48%-ной серной кислоты и 200 г хлороформа добавляют 11,9 г (0,1 моля) 4-циано-фенола. Добавляют при комнатной температуре 14 г (0,2 моля) изопрена и реакционную смесь энергично перемешивают при 60оС в течение 5 ч. Смесь охлаждают, слои разделяют, и органический слой промывают водой 2 х 100 мл, 5%-ным раствором бикарбоната натрия 2 х 150 мл и водой 2 х 100 мл, и смесь затем высушивают над сульфатом натрия. Растворитель удаляют под вакуумом. Получают 17,7 г (95%) бесцветного масла, физические константы и спектральные данные которого идентичны с данными, раскрытыми в примере 1.
П р и м е р 6. Получение 6-циано-3,4-дигидро-2,2-диметил-2Н-1-бензопирана.
К перемешиваемой смеси 25 г (85%-ного раствора ортофосфорной кислоты и 250 г хлороформа добавляют 11,9 г (0,1 моля) 4-циано-фенола. При комнатной температуре добавляют 10,5 г (0,15 моля) изопрена, и смесь энергично перемешивают при 60оС в течение 4 ч. Смесь можно далее обрабатывать так, как описано в примере 5. Получают 17,5 г (93%) бесцветного масла.
П р и м е р 7. Получение 6-циано-3,4-дигидро-2,2-диметил-2Н-1-бензопирана.
К перемешиваемой смеси 40 г 30%-ного раствора соляной кислоты и 200 г хлороформа добавляют 11,9 г (0,1 моля) 4-циано-фенола. При комнатной температуре добавляют 21 г (0,3 моля) изопрена, и смесь энергично перемешивают при 60оС в течение 5 ч. Смесь можно далее обрабатывать так, как описано в примере 5. Получают 16,8 г (90%) бесцветного масла.
П р и м е р 8. Получение 6-циано-2,2-диметил-2Н-1-бензопирана.
В 300 мл абсолютного бензола кипятят в течение 33 часов 18,7 г (0,1 моля) 6-циано-3,4-дигидро-2,2-диметил-2Н-1-бензопира- на и 22,7 г (0,1 моля) 2,3-дихлор-5,6-дициано-1,4-бензохинона. Раствор охлаждают, фильтруют, и маточный щелок промывают 5%-ным раствором бикарбоната натрия 3 х 100 мл, водой 3 х 100 мл, а затем высушивают над сульфатом натрия, и растворитель удаляют. Получают 17 г (92%) кристаллического вещества, плавящегося при 45-47оС.
П р и м е р 9. Получение 6-циано-2,2-диметил-2Н-1-бензопирана.
В 150 мл ледяной уксусной кислоты в присутствии 41,5 г тетраацетата свинца кипятят в течение 2 ч 18,7 г (0,01 моля) (6-циано-3,4-гидро-2,2-диметил-2Н-1-бензопира- на). Смесь охлаждают и выливают на 200 г раздробленного льда, экстрагируют трижды по 100 мл хлороформом, и органический слой промывают 5%-ным раствором бикарбоната натрия 3 х 100 мл и водой 3 х 100 мл. Смесь высушивают над сульфатом натрия, и после удаления растворителя получают 17,4 г (94%) твердого вещества, плавящегося при 46-47оС.
П р и м е р 10. Получение (±)-6-циано-3,4-дигидро-2,2-диметил-3,4-эпокси-2Н-1-бензопирана.
В 300 мл хлороформа при комнатной температуре растворяют 18,5 г (0,1 моля) 6-циано-2,2-диметил-2Н-1-бензопирана, после чего смесь охлаждают льдом до 0-5оС и добавляют 37,74 г (0,011 моля) 50%-ной мета-хлор-надбензойной кислоты. Смесь далее перемешивают в течение 3 ч, и после прекращения охлаждения реакция продолжается в течение 20 ч. Хлороформный слой промывают затем с помощью 5% -ного раствора гидроокиси натрия и водой. Органический слой высушивают над безводным сульфатом натрия и выпаривают. При охлаждении получают медленно кристаллизующееся желтое масло.
Выход: 19,10 г (95%).
Т.п. 104-105оС.
П р и м е р 11. Получение (±)-6-циано-3,4-дигидро-2,2-диметил- 3,4-эпокси-2Н-1-бензопирана.
В 200 мл воды растворяют 12,50 г (0,15 моля) бикарбоната натрия и раствор затем энергично перемешивают вместе с раствором 18,52 г (0,1 моля) 6-циано-2,2-диметил-2Н-1-бензопирана в 300 мл хлороформа. Реакционную смесь охлаждают до 0-5оС и добавляют 37,74 г (0,11 моля) 50%-ной мета-хлорнадбензойной кислоты. Смесь далее перемешивают в течение 3 ч, а затем после прекращения охлаждения реакцию продолжают в течение 20 ч. Слои разделяют, хлороформный слой промывают 5%-ным раствором гидроокиси натрия и водой. Органический слой высушивают над сульфатом натрия и выпаривают. При стоянии получают медленно кристаллизующееся бледно-желтое вещество.
Выход: 18,50 г (92%).
Т.пл. 103-104оС.
П р и м е р 12. Получение (±) -6-циано-3,4-дигидро-2,2-диметил- транс-4-(2-оксо-1-пирролидинил)-2Н-1-бензопиран-3-ола.
60 мл 2-пирролидона нагревают до 70оС, и под инертной атмосферной добавляют 2,53 г (0,11 г-атом) металлического натрия. После завершения добавления раствор охлаждают до комнатной температуры, добавляют 20,12 г (0,1 моля (±) -6-циано-3,4-дигидро-2,2-диметил-3,4-эпокси-2Н-1-бензопирана, и реакцию продолжают в течение 4 ч. Затем реакционную смесь выливают на 200 г льда и энергично перемешивают. Получают серовато-белый осадок, который фильтруют, промывают ледяной водой и высушивают. Сырой необработанный продукт реакции перекристаллизовывают из 3:2 смеси хлороформа и четыреххлористого углерода.
Получают белое кристаллическое вещество в виде маленьких игл.
Выход 25,7 г (90%).
Т.пл. 229-230оС.
П р и м е р 1 3. Получение (±) -6-циано-3,4-дигидро-2,2-диметил-транс-4-(2-оксо-1-пирролидинил)-2Н-1-бензоп иран-3-ола.
60 мл пирролидона нагревают до 40оС, и в инертной атмосфере добавляют 4,30 г (0,11 г-атом) металлического калия. После завершения добавления раствор охлаждают до комнатной температуры, добавляют 20,12 г (0,1 моля) (±)-6-циано-3,4-дигидро-2,2-диметил-3,4-эпoкси-2Н-1-бензопирана, и смесь перемешивают в течение 4 ч. Затем реакционную смесь выливают на 200 г льда и энергично перемешивают. Получают серовато-белый осадок. Он может быть дополнительно обработан, как это представлено в примере 12, и Выход 27,2 г (95%). Т.пл. 229-230оС.
П р и м е р 14. Получение (±) -6-циано-3,4-дигидро-2,2-диметил-транс-4-(2-оксо-1-пирролидинил)-2Н-1-бензоп иран-3-ола.
60 мл 2-пирролидона растворяют при комнатной температуре 20,12 г (0,1 моля) (±) -6-циано-3,4-дигидро-2,2-диметил-3,4-эпокси-2Н-1- бензопирана и добавляют 12,35 г (0,11 моля) трет-бутилата калия. Реакционную смесь поддерживают при комнатной температуре в течение 1,5 ч, после чего ее выливают на 200 г льда. После этого получают бледно-желтый осадок. Он может обрабатываться далее так, как это представлено в примере 12. Получают белое кристаллическое вещество в форме маленьких игл. Выход 25,5 г (85%).
Т.пл. 230-231оС.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ (±) 6-ЦИАНО -3,4-ДИГИДРО -2,2- ДИМЕТИЛ -ТРАНС -4- (2- ОКСИ -1- ПИРРОЛИДИНИЛ) -2H-1- БЕНЗОПИРАН -3-ОЛА | 1990 |
|
RU2036196C1 |
| ПРОИЗВОДНЫЕ ХИНОЛИНА И СПОСОБ ИХ ПОЛУЧЕНИЯ | 1991 |
|
RU2034842C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ ХЛОРМЕТИЛХИНОЛИНА | 1987 |
|
RU2012560C1 |
| ПРОИЗВОДНЫЕ БЕНЗОПИРАНА ИЛИ ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 1991 |
|
RU2038354C1 |
| Способ получения производных N-деметил-морфинов | 1985 |
|
SU1398776A3 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ ПИРАНИЛ-ЦИАНОГУАНИДИНА | 1990 |
|
RU2057129C1 |
| СПОСОБ ПОЛУЧЕНИЯ β- ЗАМЕЩЕННОГО 4-АЗААНДРОСТАНА | 1993 |
|
RU2109746C1 |
| 2-2-ДИАЛКИЛ- ИЛИ ТРАНС-2,2-ДИАЛКИЛ-3,4-ДИГИДРО-3-ГИДРОКСИ-6-(ПИРИДИН-4-ИЛ)-2Н-1-БЕНЗОПИРАН | 1992 |
|
RU2104277C1 |
| ПРОИЗВОДНЫЕ ИНДОЛА | 1992 |
|
RU2061694C1 |
| Способ получения производных бензопирана или их фармацевтически приемлемых аддитивных солей | 1988 |
|
SU1757466A3 |
Использование: в медицине в качестве анти-гипертензивного средства (кромакалима). Сущность изобретения: продукт (+)-6 циано-3,4-дигидро-2,2- диметил-транс-4-(2-оксо-1-пирролидинил) -2Н-1 -бен зопиран-3-ол:кромакалим. Б.Ф. C16H18N2O2 т.пл. 229-230°С. Выход 90 Реагент 1: 4-циано-фенол. Реагент: изопрен. Условия процесса: при 30-120°С в среде растворителя в присутствии щелочного металла и/или катализатора. Реагент 3:6-циано-3,4-дигидро-2,2-диметил-2Н-1-бензопиран, который превращают в 6-циано-2,2-диметил-2Н-1-бензопиран при 40-150°С в среде растворителя в присутствии катализатора и/или оксилителя или путем бромирования в бензильную часть молекулы и дегидробромированием полученного 6-циано-3,4-дигидро-2,2-диметил-4-бром-2Н-1-бензопирана. Из 6-циано-2,2-диметил-2Н-1-бензопирана получают в одну стадию 6-циано-3,4-дигидро-2,2-диметил-3,4-эпокси-2Н-1-бензопирана действием надкислоты в среде растворителя с последующим взаимодействием этого соединения с 2-пирролидоном в присутствии щелочного металла при 20-100°С и выделением целевого продукта. Способ позволяет повысить выход кромакалима с 26 до 55-65% по отношению к 4-цианофенолу. 11 з.п. ф-лы.
| Аппарат для вытяжения при переломах костей предплечья | 1947 |
|
SU76075A1 |
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
| Гребенчатая передача | 1916 |
|
SU1983A1 |
Авторы
Даты
1995-08-09—Публикация
1992-02-19—Подача