Изобретение относится к области органического синтеза и касается новых органических соединений, способа их получения по нескольким вариантам и фармацевтической композиции, содержащей эти соединения.
Конкретно объектом изобретения являются:
Производные бензофурана, бензотиофена, индола или индолизина общей формулы (I):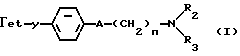
в которой Гет обозначает одну из групп: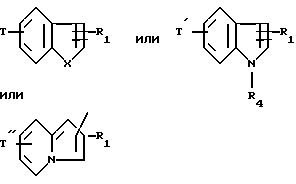
в которых T обозначает группу:
в которой R и Ra одинаковые или разные, обозначают:
водород;
радикал SO2R', в котором R' обозначает линейный или разветвленный алкильный радикал C1-C6; трифторметильный радикал; фенильный радикал, в известных случаях замещенный алкильным радикалом C1-C4:
причем Rа и Ra с атомом азота могут образовывать сульфонамидную группу, 1,1-диокси-изотиазолин-1,2-ильный цикл;
T' означает:
водород,
нитрогруппу
группу: 
в которой R и Ra одинаковые или разные, означают
водород,
радикал -SO2R', в котором R' означает алкил
C1-C6 линейный или разветвленный,
Т'' означает:
группу бензилоксикарбониламино,
группу формулы: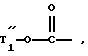
в которой T
группу формулы: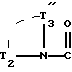
в которой T
водород или C1-C4-алкил, или T
группу 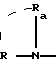
в которой R и Ra одинаковые или разные, означают:
водород
радикал SO2R' где R' означает алкил C1-C6, линейный или разветвленный, или фенил, возможно замещенный алкилом C1-C4,
X означает -O- или -S-
Y означает радикал 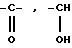 или -CH2-
или -CH2-
R1 означает алкил C1-C6 или фенил,
R2 означает:
водород,
алкил C1-C6, линейный или разветвленный,
R3 означает:
линейный или разветвленный C1-C6 алкильный радикал,
радикал формулы: Алк R6, в которой "Алк" обозначает линейный или разветвленный алкиленовый радикал C1-C6 и обозначает фенил, замещенный одним или несколькими алкоксильными группами C1-C4;
R4 обозначает:
водород,
алкильный радикал C1-C4,
радикал -SO2R
радикал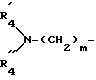
в котором R
A обозначает -O- или 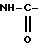
"n" обозначает число 2-5, при условии, что, когда R4 обозначает радикал -SO2R
T' обозначает водород, нитро-группу, так же, как их фармацевтически совместимые соли.
Предпочтительными согласно изобретению являются производные бензофурана, бензотиофена, индола или индолизина общей формулы I, в которой R обозначает группу -SO2R′ и Ra означает атом водорода;
предпочтительны также производные формулы I, в которой Y означает группу 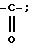 ;
;
также предпочтительными являются производные формулы I, в которой A означает атом O.
Далее, предпочтительными по изобретению являются: производные формулы I, в которой:
R1, R2 и R3 обозначают H-бутильный радикал и "n" равно 3;
Производные формулы I, в которой X обозначает -О-;
Производные формулы I, в которой цепь 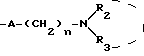 находится в положении 4.
находится в положении 4.
Предпочтительными также являются производные формулы I, выбираемые из группы, включающей: 2-н.бутил-3-[4-(N-метил-N-)-3,4-диметокси-β-фенилэтил] -3-аминопропокси] -бензоил-5-метилсульфонамино-бензофуран, 2-н.бутил-З-[4-(3-ди-н.бутиламино-пропокси)-бензоил]-5-метилсульфонаминобензофуран.
Изобретение также касается фармацевтически приемлемых солей соединений формулы I, полученных с органической или неорганической кислотой.
В качестве примера органических солей этого типа можно назвать оксалаты, малеаты, фумараты, метансульфонаты, бензоаты, аскорбаты, памоаты, сукцинаты, гексаматы, бисметиленсалицаты, этандисульфонаты, ацетаты, пропионаты, тартраты, салицилаты, цитраты, глюконаты, лактаты, малаты, циннаматы, манделаты, цитраконаты, аспартаты, пальмиаты, стеараты, итаконаты, гликолаты, p-аминобензоаты, глутаматы, бензолсульфонаты, p-толуолсульфонаты и теофиллин ацетат, а также соли, образованные из аминокислот, таких, как лизин или гистидин.
В качестве неорганических солей этого типа можно назвать хлоргидраты, бромгидраты, сульфаты, сульфаматы, фосфаты и нитраты. Предпочтительно по изобретению фармацевтически совместимой солью является оксалат, фумарат, хлоргидрат или п-толуолсульфонат.
Было обнаружено, что вещества изобретения обладают замечательными фармакологическими свойствами, так как они обнаружили способность одинаково удлинять потенциал действия и рефракторный период миокардиоцитов. Более того, большая часть новых веществ обнаружила также свойства брадикардические, антигипертензивные и антиадренэргические.
Эти свойства способны сделать рассматриваемые вещества весьма полезными в лечении некоторых патологических синдромов сердечно-сосудистой системы, в частности в лечении грудной жабы, гипертонии, аритмии, недостаточности мозгового кровообращения.
В противоопухолевой области новые вещества могут быть использованы в качестве потенциирующих антираковых агентов.
Следовательно, изобретение касается также фармацевтической композиции, содержащей в качестве активного ингредиента по крайней мере одно соединение в сочетании с фармацевтическим носителем или инертным веществом.
В зависимости от способа введения дневная дозировка для человека весом 60 кг находится в пределах 2 500 мг активного начала.
Соединения формулы I могут быть подучены по следующим методикам:
I Соединения формулы I, в которых Y означает группу 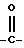 , а T, T' или T'' является группой R'-SO2-NH, в которой R' имеет те же значения, что указаны выше, получают тем, что вводят в реакцию соединение формулы I, в котором R и Ra каждый является водородом, с одним или двумя эквивалентами галогенида общей формулы:
, а T, T' или T'' является группой R'-SO2-NH, в которой R' имеет те же значения, что указаны выше, получают тем, что вводят в реакцию соединение формулы I, в котором R и Ra каждый является водородом, с одним или двумя эквивалентами галогенида общей формулы:
Гал SO2 R' (II)
или с ангидридом общей формулы:
(R'SO2)2O (III)
в которой R' имеет значение, указанное выше, а Гал является атомом галогена, реакцию проводят в присутствии акцептора кислоты и в среде подходящего органического растворителя, при этом получают в виде свободного основания целевые соединения, которые при желании вводят в реакцию с органической или неорганической кислотой получения фармацевтически приемлемой соли этих производных.
Для получения производных, у которых Y является группой 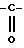 , T, T' или T'' является группой
, T, T' или T'' является группой 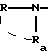 в которой R имеет указанные значения и Ra является алкилом, проводят реакцию в щелочной среде соединения формулы I, у которого R имеет указанное значение и Ra является водородом, с одним или двумя эквивалентами галогенида общей формулы:
в которой R имеет указанные значения и Ra является алкилом, проводят реакцию в щелочной среде соединения формулы I, у которого R имеет указанное значение и Ra является водородом, с одним или двумя эквивалентами галогенида общей формулы:
R'a Гал,
в которой Гал является атомом галогена, а R'a является алкилом C1-C4, при этом получают в виде свободного основания целевые соединения, которые при желании вводят в реакцию с органической или неорганической кислотой для получения фармацевтически приемлемой соли этих производных.
Способ получения производного, в котором T является циклизованной группой 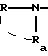 , Y является группой
, Y является группой 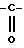 и A является -O-, заключается в том, что конденсируют при температуре 90-110oC в среде подходящего растворителя кетон общей формулы:
и A является -O-, заключается в том, что конденсируют при температуре 90-110oC в среде подходящего растворителя кетон общей формулы: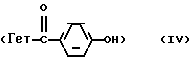
где Гет означает группу формулы: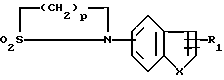
в которой R1, X и p имеют те же значения, что и указанные выше, с соединением общей формулы: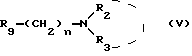
в которой R2, R3 и n имеют те же значения, что указанные выше, и R9 является атомом галогена, C1-C4 алкилсульфонилокси или C6-C10-арилсульфонилокси, при этом получают целевые соединения в виде свободных оснований, которые при желании вводят в реакцию с органической или неорганической кислотой для получения фармацевтически приемлемой соли.
Для получения производных, в которых T, T' или T'' является группой -NHSO2R', обрабатывают в подходящем растворителе соединение общей формулы: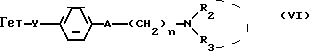
в которой R2, R3, Y, A и n имеют значения, указанные выше, и Гет является группой общей формулы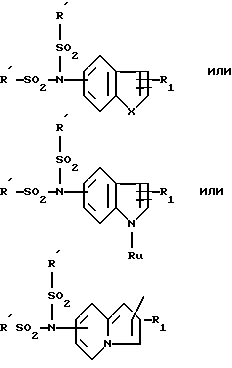
в которой R', R1, R4 и X имеют те же значения, что указаны выше, гидроксидом щелочного металла, при этом получают целевые соединения, которые при желании вводят в реакцию с органической или неорганической кислотой, чтобы получить фармацевтически приемлемую соль.
Способ получения производных, у которых T или T' является группой 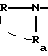 , в которой R и Ra имеют указанные значения и каждый является группой -SO2R', Y является группой
, в которой R и Ra имеют указанные значения и каждый является группой -SO2R', Y является группой  а A является группой -O-, заключается в том, что проводят реакцию в присутствии основного агента при температуре кипения с обратным холодильником реакционной среды соединения общей формулы:
а A является группой -O-, заключается в том, что проводят реакцию в присутствии основного агента при температуре кипения с обратным холодильником реакционной среды соединения общей формулы: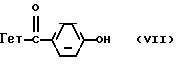
в которой Гет означает группу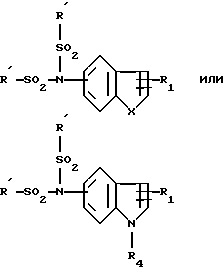
в которой R', R1, R4 и X имеют те же значения, что указаны выше с соединением общей формулы
в которой R2, R3 и n имеют указанные выше значения, a R9 является атомом галогена, C1-C4-алкилсульфонилокси или C6-C10-арилсульфонилокси, при этом получают целевые соединения в виде свободного основания, которое при желании вводят в реакцию с органической или неорганической кислотой для получения фармацевтически приемлемой соли.
В настоящее время несомненный интерес вызывает использование в качестве средств, предупреждающих сердечные аритмии, стимуляторов, которые обладают отсроченной проводимостью электрического импульса на уровне сердечной клетки или удлинением рефракторного периода.
Несмотря на то что многочисленные физиопатологические состояния пролонгируют реполяризацию клеток сердца и связаны с влиянием, уменьшающим перебои в сердечной деятельности, концепция фармакологического контроля за нарушением ритма путем увеличения потенциала действия относительно нова.
Характеризуя потенциал действия, определяют проводимость и рефракторные периоды. Кроме того, всякое укорочение реполяризации аритмогенно вследствие соответственного укорочения рефракторного периода. Наоборот, любые вмешательства, одинаково удлиняющие потенциал действия, удлиняют абсолютный рефракторный период, что сводит к минимуму аритмогенез.
Другими словами, при отсрочивании достижения порогового уровня мембранного потенциала, необходимого для генерирования следующего потенциала действия, в ответ на стимул, воздействуя на процессы, которые управляют скоростью реполяризации, рефракторные периоды (абсолютный и относительный) сердечной мышцы должны удлиняться соответствующим образом, что и порождает антиаритмический механизм.
Амиодарон или н-2-бутил-3-[4-(2-диэтидаминоэтокси)-3,5-дииодбензоил]-бензофуран является в настоящее время одним из редких антиаритмических препаратов, выпускаемых промышленностью, который обладает свойствами, изложенными выше.
Это соединение пролонгирует уровень реполяризации, не изменяя скорости быстрой деполяризации. Его антиаритмический эффект вызван одинаковым удлинением потенциалов действия и рефракторных периодов миокардиоцитов.
Кроме того, амиодарон обладает антиаденэргическими свойствами типа неполных α и β. Следовательно, это соединение должно рассматриваться не как b-блокирующее, но как адренотормозящее средство, то есть как частичный антагонист a и β адренэргических реакций. Эти свойства несомненно полезны, т. к. кажется весьма желательным не изыскивать свойства полного антагонизма a и β, т.к. они могут вызвать различные побочные эффекты при применении препарата в клинике ("Bruxelles Medical", N 9, September 1969, стр. 543-560).
Известны также производные бензофурана, бензотиофена, индола или индолизина, аналогичные по своей химической структуре амиодарону, то есть содержащие в положении 3 диалкиламино- или моноалкиламино-алкокси-бензоильную цепочку: эти соединения показали в разной степени способность активно воздействовать на сердечно-сосудистую систему.
По этому поводу можно процитировать, например, патенты US N 3.920.707 и 3.947.470, заявки на изобретения EP N 338.746 и 360.784, заявки PCT N WO 89/02888, 89/02893, а также Eur.J.Med.Chem. Chimika Therapeutica 12, N 5 стр. 483-487 (1977).
До настоящего времени не существует ни одного производного бензофурана, бензотиофена или индола, содержащего диалкиламино или моноалкиламино-алкоксибензоильную цепочку и замещенный на гомоцикле замещенной или незамещенной аминогруппой.
Хотя патент США N 3.947.470 и содержит сведения об азотированных производных на гомоцикле, то есть о производных, содержащих нитрогруппу, ни один из продуктов этого типа не был реально получен и тем более исследован на фармакологическую активность.
В рамках изобретения было открыто, что производные бензофурана, бензотиофена, индола или индолизина, содержащие моноалкиламино или диалкиламино-алкокси-бензоильную цепочку, а также другие группы, расположенные на гетероцикле, в частности на гомоцикле бензофурана, бензотиофена или индола или на пиридиновом остатке индолизина, обладают замечательными фармакологическими свойствами, выражающимися, в частности, в увеличении продолжительности потенциала действия и рефракторных периодов сердечной клетки.
Эти свойства в значительной мере превосходят свойства уже известных производных или аналогичных производных, содержащих нитрозаместитель на гомоцикле.
Кроме того, было выявлено, что новые соединения обладают меньшими возможностями проявить побочное действие, чем уже известные аналоги.
В частности, известно, что амиодарон вызывает фосфолипидоз в легких, с последующей деструкцией макрофагов в альвеолах. Эта деструкция проявляется у пациента, подвергшегося воздействию амиодарона, в появлении легочных осложнений, таких, как дыхательная недостаточность, что требует прерывания лечения.
Другие известные соединения, такие, как н2-бутил-3-[4(ди-n-3-бутиламинопропокси-)-бензоил] -бензофуран, также обладают этим побочным действием. Например, было замечено, что это соединение в дозе 139 мг/кг при оральном применении в течение 14 дней вызывает у крысы увеличение легочных фосфолипидов на 11,6% В тех же условиях, при дозировке 100 мг/кг, амиодарон вызывает увеличение уровня фосфолипидов в легких на 26,7%
Например, следующие соединения по изобретению:
н-2-бутил-3-[4-(ди-n-3-бутиламино-пропокси)-бензоил] -5-метилсульфонамидо-бензофуран (пр.2)
-5-амино-3-[4-(ди-n-3-(бутиламино-пропокси)-бензоил]-n-2-бутилбензофуран (пр.3), не изменяют уровня легочных фосфолипидов при дозах 116 и 135 мг/кг.
Учитывая отсутствие легочного липидоза, а также осуществленные фармакологические исследования соединения, согласно изобретению, наилучшим антиадренэргическим и антиаритмическим агентом является н-2-бутил-3-[4-(ди-н.-3-бутиламино-пропокси)-бензоил] -5-метилсульфонамидо -бензофуран и его фармацевтически приемлемые соли.
Результаты фармакологических тестов, осуществленных с исследуемыми соединениями на сердечно-сосудистую систему, представлены ниже.
I. Воздействие на продолжительность потенциала действия
Воздействие исследуемых соединений на продолжительность потенциала действия было продемонстрировано с помощью измерения эффекта у крыс "in vivo" при внутривенном введении.
Были использована следующая методика:
Самцов-крыс породы Spraque-Dawley весом 250-450 г анестезируют и фиксируют на спине к подставке. После наложения биполярных электродов на 4 конечности для регистрации ЭКГ крыс переводят на искусственное дыхание. После торакотомии и рассечения перикарда присасывающийся электрод помещают на сердце, избегая коронарных артерий. Электрод постоянно присасывается за счет аспирационной силы вакуумной трубки, с которой он соединен.
Таким образом, одновременно регистрируют потенциал действия, а также ЭКГ на скорости 200 мм/с до введения тестируемого соединения, а также в различные промежутки времени (1, 3, 5 и 10 мин) после введения за 30 с дозы тестируемого соединения.
Полученные результаты выражаются в увеличении продолжительности потенциала действия (Д.Р.А) по отношению к продолжительности, зарегистрированной до введения изучаемого препарата. Эта продолжительность была измерена при 90% амплитуды потенциала действия.
В качестве примера были получены следующие результаты (см. табл. 1-4), соединения формулы 1 находились в виде основания или соли.
В качестве сравнения были получены результаты для известного соединения, представленные в табл.5.
Эти результаты показывают абсолютное превосходство соединений согласно изобретению над известными в качестве агентов, способных увеличивать продолжительность потенциала действия миокардиоцита.
II Антиадренэргические свойства
Целью этого теста являлось определение способности исследуемых соединений уменьшать повышение кровяного давления, вызванного эпинефрином (антиaэффект) и нарастание частоты сердечных сокращений, вызванных изопреналином (антиbэффект) у собаки, которой предварительно ввели атропин и анестезировали пентобарбиталом.
Вначале для каждой собаки определяли дозу эпинефрина (3 10 мг/кг), которая вызывала воспроизводимое увеличение артериального давления около 133•102 Па, а также дозу изопреналина (1-2 мг/кг), которая вызывает воспроизводимое увеличение частоты сердечных сокращений, примерно 70 уд/мин. Попеременно каждые 10 мин вводят определенную таким образом дозу эпинефрина и изопреналина и после получения двух последовательных ответов вводят внутривенно некоторое количество изучаемого вещества.
Антиaэффект
Регистрируют процент сокращения гипертензии, вызванного изучаемым веществом, по сравнению с гипертензией, полученной ранее (примерно 100 мм рт.ст. ).
Антиbэффект
Регистрируют процент сокращения увеличения частоты сердечных сокращений, вызванного изучаемым веществом, по сравнению с тахикардией, измеренной ранее (примерно 70 уд.).
В этих двух случаях результаты уменьшения артериального давления или частоты сердечных сокращений выражали следующим образом:
+ для сокращения <50%
++ для сокращения ≥50%
+++ для субтотального (почти полного) сокращения
Результаты см. в табл. 6.
Для сравнения см. результаты, полученные при тестировании известных соединений, в табл. 7.
Токсичность соединений оказалась совместимой с их использованием в терапевтической клинике.
Согласно изобретению, соединения могут выпускаться в любой фармацевтической форме, в зависимости от способа введения. Что касается единичной дозы, то она может быть представлена в виде таблетки, драже, капсулы, порошка, суспензии или сиропа для орального применения, свечи для ректального применения, а также раствора или суспензии для парэнтерального применения.
Вводимая единичная дозировка может содержать, например, 50 500 мг веса активного ингредиента для орального введения, 50 200 мг активного ингредиента для ректального введения и 50 150 мг активного ингредиента для парэнтерального введения.
В зависимости от типа введения соединения по изобретению, предназначенные для применения в терапии или ветеринарии, могут дополнительно содержать инертное вещество, которое может состоять по крайней мере из одного из ингредиентов, выбранных из следующих веществ: лактоза, крахмал, тальк, стеарат магния, поливинилпирролидон, альгиновая кислота, коллоидальный кремнезем, дистиллированная вода, бензиловый спирт или подслащивающие агенты.
Далее представлены примеры, иллюстрирующие получение соединений и составов на их основе.
Пример 1. Получение 5-амино-3-[4-(ди-n-3-бутиламино-пропокси)-бензоил] -m-2-бутил-бензофурана (SR 33580)
а) Бромид-2-гидрокси-5 нитро-бензилтрифенилфосфония
Нагревают с обратным холодильником в течение 5 ч 100 г (0,43 моль) 2-гидрокси-5-нитро-бромбензила и 113 г (0,43 моль) трифенилфосфина и 1600 мл хлороформа. Охлаждают и обезвоживают образовавшийся осадок белого цвета. Фильтрат выпаривают досуха под вакуумом и выделяют при помощи 500 мл толуола. Обезвоживают, промывают толуолом, объединяют образовавшиеся твердые вещества и высушивают под вакуумом при 50oC.
Таким образом получают 210,5 г бромид-2-гидрокси-5 нитро-бензилтрифенилфосфония.
Выход: 99,01%
b) n-2-Бутил-5 нитро-бензофуран
Медленно, при помешивании, добавляют 113,5 г (0,94 моль) хлорида пентаноила к смеси из 370 г (0,75 моль) бромида 2-гидрокси-5-нитро-бензилтрифенилфосфония и 120,2 г (1,52 моль) пиридина в 700 мл хлороформа. Нагревают при обратном холодильнике в течение 2 ч. Прибавляют 2800 мл толуола и отгоняют 1400 мл растворителя. Затем прибавляют 228 г (2,28 моль) триэтиламина и нагревают 3 ч при обратном холодильнике. Охлаждают, обезвоживают сформировавшийся трифенилфосфин-оксид, промывают этилацетатом и концентрируют фильтрат в вакууме. Растворяют в ацетонитриле полученный вязкий продукт и экстрагируют в экстракционном аппарате жидкость-жидкость, с пентаном. Высушивают на сульфате натрия, фильтруют и выпаривают досуха.
Таким образом получают н-2-бутил-5-нитро-бензофуран в сыром виде.
Чистота (жидкая хроматография высокого давления (ЖХВД)): 97,9% T.кип. 120-123oC (0,02 мм рт.ст. или 2,66 Па).
Тем же способом, что описан выше, получают следующие соединения:
2-Метил-5-нитро-бензофуран. Т. пл. 96oC (изопропиловый эфир). Чистота (ЖХВД): 100%
2-Этил-5-нитро-бензофуран. Т. пл. 86oC (изопропанол). Чистота (ЖХВД): 99,8%
n-2-пропил-5-нитро-бензофуран. Т.пл. 38oC (изопропанол). Чистота (ЖХВД): 99%
2-Изопропил-5-нитро-бензофуран. Т.пл. 73oC (изопропиловый эфир). Чистота (ЖХВД): 99,45%
2-фенил-5-нитро-бензофуран. Т. пл. 159oC (изопропиловый эфир). Чистота (ЖХВД): 99,5%
c) n-2-бутил-3(4-метокси-бензоил)-5-нитро-бензофуран
К раствору из 44,5 г (0,2 моль) н-2-бутил-5-нитро-бензофурана и 44,3 г (0,26 моль) анизоилхлорида в 308 мл дихлорэтана понемногу прибавляют 59,8 мл (0,50 моль) тетрахлорида олова. Поддерживают температуру 23oC и продолжают перемешивание в течение 24 ч. Выливают на 770 мл ледяной воды и экстрагируют с 3 порциями 150 мл дихлорэтана. Промывают водой с раствором гидрогенкарбоната натрия 5% и снова водой. Выпаривают досуха и получают таким образом быстро кристаллизующийся продукт.
Чистота (ЖХВД): 91,69%
Кристаллизуют в 250 мл изопропанола и получают 59 г n-2-бутил-3-(4-метоксибензоил)-5нитро-бензофурана.
Выход: 83,5%
Чистота (ЖХВД): 96,39%
Т.пл. 95oC.
Следуя методу, аналогичному изложенному, получают следующие соединения:
3-(4-Метокси-бензоил)-2-метил-5-нитро-бензофуран
Т.пл. 167oC (метилэтилкетон).
Чистота (ЖХВД): 99,9%
2-Изопропил-3-(4-метокси-бензоил)-5-нитро-бензофуран маслянистый
Чистота (ЖХВД): 99,6%
3-(4-Метокси-бензоил)-5-нитро-2-фенил-бензофуран
Т.пл. 153oC (метилэтилкетон).
Чистота (ЖХВД): 99,8%
3-(4-Метокси-бензоил)-2-этил-5-нитро-бензофуран
Т.пл. 130oC (метанол).
Чистота (ЖХВД): 99,5%
3-(4-Метокси-бензоил)-5-нитро-2-пропил-бензофуран
Т.пл. 73oC (метанол).
Чистота (ЖХВД): 99,1%
2-(4-Метокси-бензоил)-3-метил-5-нитро-бензофуран
Т.пл. 180oC.
Чистота (ЖХВД): 99,02%
3-(4-Метокси-бензоил)-2-метил-7-нитро-бензофуран
Т.пл. 130-132oC.
Чистота (ЖХВД): 98,32%
2-(4-Метокси-бензоил)-H-3-бутил-5-нитро-индол
Т.пл. 142oC (гептан/этилацетат).
2-(4-Метокси-бензоил)-H -3-бутил-1-метил-5-нитро-индол.
Т.пл. 102oC (этанол).
3-(4-Метокси-бензоил)-2-этил-1-метил-4-нитро-индол
Т.пл. 136oC (гептан/изопропанол 6/4).
d) н-2-бутил-3-(4-гидрокси-бензоил)-5-нитро-бензофуран
Нагревают с обратным холодильником в течение 20 ч 69,7 г (0,20 моль) n-2-бутил-3-(4-метокси-бензоил)-5-нитро-бензофурана в 510 мл дихлорэтана в присутствии 60 г (0,45 моль) хлорида алюминия. После реакции охлаждают, выливают на 510 мл ледяной воды, обезвоживают, промывают органическую фазу до нейтральности и высушивают конечный продукт в вакууме при 50oC.
Таким образом получают 61,2 г н-2-бутил-3(4-гидрокои-бензоил)-5-нитро-бензофурана.
Выход: 90,1%
Чистота (ЖХВД): 99,19%
Т.пл. 121oC.
Следуя методу, описанному выше, получают и следующие соединения:
3-(4-Гидрокси-бензоил)-2-метил-5-нитро-бензофуран
Т.пл. 182oC (изопропанол).
Чистота: (ЖХВД): 99,7%
3-(4-Гидрокси-бензоил)-2-изопропил-5-нитро-бензофуран
Т.пл. 132oC.
Чистота (ЖХВД): 99,9%
3-(4-Гидрокси-бензоил)-5-нитро-2-фенил-бензофуран
Т.пл. 207oC (хлороформ)
Чистота (ЖХВД): 100%
2-Этил-3-(4-гидрокси-бензоил)-5-нитро-бензофуран
Т.пл. 152oC (дихлорэтан)
Чистота (ЖХВД): 99,4%
3-(4-Гидрокси-бензоил)-5-нитро-н-2-пропил-бензофуран
Т.пл. 119oC (толуол).
Чистота (ЖХВД): 98,8%
2-(4-Гидрокси-бензоил)-3-метил-5-нитро-бензофуран
Т.пл. 235oC (метанол).
Чистота (ЖХВД): 96,19%
3-(4-Гидрокси-бензоил)-2-метил-7-нитро-бензофуран
Т.пл. 201oC (метилэтилкетон).
Чистота (ЖХВД): 98,51%
e) n-2-Бутил-3-[4-(ди-n-3-бутиламино-пропокси)-бензоил] -5-нитро-бензофуран
В течение 0,5 ч перемешивают смесь, состоящую из 11,9 г (0,035 моль) н-2-бутил-3-(4-гидрокси-бензоил)-5-нитро-бензофурана и 4,8 г (0,035 моль) карбоната калия в 60 мл метилэтил-кетона. После чего добавляют 7,2 г (0,035 моль) 1-хлор-ди-n-З-бутиламино-пропана и нагревают с обратным холодильником 20 ч. Охлаждают, обезвоживают образовавшиеся соли, промывают метил-этил-кетоном и выпаривают досуха. Остаток растворяют в 250 мл этилового эфира и промывают 2 раза 500 мл 5% гидроксида натрия. Промывают водой, высушивают на сульфате натрия, обезвоживают и обесцвечивают активированным углем. Фильтруют, затем выпаривают.
Таким образом получают 15,8 г н-2-бутил-3-[4-(ди-н-3-бутиламино-пропокси)бензоил]-5-нитро-бензофурана.
Выход: 88,76%
Чистота (ЖХВД): 98,25%
Т.пл. (оксалат): 84oC (эфир/изопропанол).
Следуя методу, аналогично описанному выше, получают следующие соединения:
3-[4-(Ди-н-3-бутиламино-пропокси)-бензоил]-5-нитро-2-метил-бензофуран.
Т.пл. 63oC (изопропиловый эфир).
Чистота (ЖХВД): 98,9%
3-[4(3-Третизолбутиламино-пропокси)-бензоил-н-2-бутил-5-нитробензофуран
Т.пл. (щавелевая кислота): 244oC (ацетон/метанол).
3-{ 4-[N-метил-N-(3,4-диметокси-b-фенетил)-3-амино-пропокси] -бензоил}-5-нитро-n-2-бутил-бензофуран
Т.пл. (щавелевая кислота): 114oC (ацетон).
3-[4-(Ди-н-3-бутиламино-пропокси)-бензоил]-2-этил-5-нитро-бензофуран
Т.пл. (хлоргидрат): 139oC (этилацетат).
Чистота (ЖХВД): 99,6%
3-[4-(Ди-н-3-бутиламино-пропокси)-бензоил]-5-нитро-n-2-пропил-бензофуран
Т.пл. 126oC (этилацетат).
Чистота: 97,9%
н-2-Бутил-3-[4-(3-диэтиламино-пропокси)-бензоил]-5-нитро-бензофуран
Т.пл. (хлоргидрат): 131oC (этилацетат)
Чистота (ЖХВД): 98,4%
3-[4-(Ди-н-3-бутиламино-пропокси)-бензоил]-2-метил-7-нитро-бензофуран
Т.пл. (толуолсульфонат): 118oC (этилацетат)
Чистота (ЖХВД): 99,44%
2-[4-(Ди-н-3-бутиламино-пропокси)-бензоил]-3-метил-5-нитро-бензофуран
Т.пл. (фумаровая кислота): 148oC (этилацетат).
Чистота (ЖХВД): 99,8%
3-[4-(Ди-н-3-бутиламино-пропокси)-бензоил]-5-нитро-2-изопропил-бензофуран
Масло.
Чистота (ЖХВД): 99%
3-[4-(Ди-н-3-бутиламино-пропокси)-бензоил]-5-нитро-2-фенил-бензофуран
Т.пл. 95oC (изопропиловый эфир).
Чистота (ЖХВД): 98,5%
f) 5-Амино-3-[4-(ди-н-3-бутиламино-пропокси)-бензоил]-n-2-бутилбензофуран
В аппарате для гидрогенизации перемешивают под давлением 3,4 атм (3,44•105 Па) водорода 20,4 г (0,04 моль) n-2-бутил-3-[4-(ди-н-3-бутиламино-пропокси)-бензоил]-5-нитро-бензофурана в 200 мл этанола в присутствии 0,6 г оксида платины. Когда давление достигает 2,7 атм (2,73•105 Па), реакция завершается, что требует примерно 20 мин.
Таким образом получают 5-амино-3-[4-(ди-н-3-бутиламино-пропокси)-бензоил]-н-2-бутил-бензофуран с выходом 98,4%
Чистота (ЖХВД): 95,28%
Пример 2. Получение диоксалата 5-амино-3[4-(ди-н-3-бутиламино-пропокси)-бензоил]-2-метил-бензофурана
К раствору 5-амино-3[4-(ди-н-3-бутиламино-пропокси)-бензоил]-2-метил-бензофурана в диэтиловом эфире прибавляют раствор щавелевой кислоты в диэтиловом эфире, фильтруют и рекристаллизуют в метаноле.
Таким образом получают диоксалат 5-амино-3[4-(ди-н-3-бутиламино-пропокси)-бензоил]-2-метил-бензофурана.
Т.пл. 136oC.
Чистота (ЖХВД): 99,3%
Пример 3. Получение хлоргидрата n-2-бутил-3-[4-(ди-н-3-бутиламино-пропокси)-бензоил]- 5-метилсульфонамидо-бензофурана (SR 33589b)
а) n-2-Бутил-3[4-(ди-н-3-бутиламино-пропокси)-бензоил]-5-метилсульфонамидо-бензофуран
К раствору из 68,3 г (0,15 моль) 5-амино-3-[4-(ди-n-3-бутиламинопропокси)-бензоил] -n-2-бутил-бензофурана и 23,6 г (0,23 моль) триэтиламина в 750 мл дихлорэтана прибавляют по каплям раствор из 17,6 г (0,154 моль) метансульфонилхлорида в 375 мл дихлорэтана. Перемешивают в течение 20 ч и выливают в 500 мл воды. Декантируют, промывают водой и выпаривают досуха. Затем очищают элюционной хроматографией на колонке кремнезема (элюант: этилацетат), таким образом получают сырой продукт (79,5г; сырой выход 100%).
Получают 48 г очищенного н-2-бутил-3[4-(ди-н-3-бутиламинопропокси)-бензоил]-5-метилсульфонамидо-бензофурана очищенного.
Выход: 61,6%
Обработка гексаном полученного таким образом продукта дает фракцию из 44 г кристаллического вещества (чистота ЖХВД: 96,1%) и фракцию из 4 г кристаллического вещества (чистота ЖХВД: 99%) P.F. 65,3%
В) Хлоргидрат n-2-бутил-3-[4(ди-н-3-бутиламино-пропокси)-бензоил] -5-метилсульфонамидо-бензофурана очищенного.
Растворяют 2 г н-2-бутил-3-[4(ди-н-3-бутиламино-пропокси)-бензоил]-5-метилсульфонамидо-бензофурана в 40 мл безводного этилацетата.
Постоянно помешивая, прибавляют хлороводородный эфир до pH=3. Через несколько минут хлоргидрат начинает осаждаться. Его фильтруют через 0,75 ч, это позволяет получить 2,03 г белого продукта.
Таким образом получают хлоргидрат н-2-бутил-3-[4-(ди-н-3-бутиламино-пропокси)-бензоил]-5-метилсульфонамидо-бензофуран.
Т.пл. 143oC (ацетон).
Пример 4. Получение диоксалата 5-амино-н-2-бутил-3-[4(ди-н-2-бутиламино-этокси-бензоил]-бензофурана
а) 3-[4-(2-Бром-этокси)-бензоил]-н-2-бутил-5-нитро-бензофуран
В течение 0,5 ч перемешивают смесь, образованную 23,22 г (0,06 моль) н-2-бутил-3-(4-гидрокси-бензоил)-5-нитро-бензофурана и 10 г (0,07 моль) безводного карбоната калия, тщательно измельченного в 400 мл метила-этил-кетона. Затем прибавляют 45 г (0,24 моль) 1,2-дибром-этана и нагревают с обратным холодильником 6 ч. Охлаждают, отфильтровывают минеральные соли, промывают ацетоном и выпаривают досуха под вакуумом. Очищают полученный сырой продукт элюционной хроматографией на колонке кремнезема (элюант: толуол).
Таким образом получают 15 г 3-[4-(2-бром-этокси)-бензоил]-н-2-бутил-5-нитро-бензофурана после перекристаллизации в пентане.
Выход: 56%
Т.пл. 81oC.
Чистота (ЖХВД): 95,2%
По описанной выше методике можно получить следующие вещества:
3-[4-(5-Бром-пентокси)-бензоил]-н-2-бутил-5-нитро-бензофуран
Т.пл. 55oC (пентан).
Чистота (ЖХВД): 98%
3-[4-(5-Бром-пропокси)-бензоил]-н-2-бутил-5-нитро-бензофуран
Чистота (ЖХВД): 91,28%
в) Хлоргидрат н-2-бутил-3-[4-(ди-н-2-бутиламино-этокси)-бензоил]-5-нитро-бензофуран
Нагревают с обратным холодильником в течение 3 дней смесь, состоящую из 15 г (0,0336 моль) 3-[4-(2-бром-этокси)-бензоил]-н-2-бутил-5-нитро-бензофурана, 17,3 г (0,134 моль) ди-п-бутиламина и 18,5 г (0,134 моль) безводного карбоната калия в 200 мл толуола. Охлаждают, выливают в воду, декантируют органическую фазу, экстрагируют водную фазу 3 порциями 50 мл толуола; объединяют органические фазы и промывают водой. Высушивают на сульфате натрия, фильтруют и выпаривают досуха в вакууме. Затем очищают элюционной хроматографией на колонке кремнезема (элюант: гексан/этилацетат 8/2), что дает 12,7 г (выход: 76,4%) желаемого соединения в основной форме. Формируют хлоргидрат в этиловом эфире и перекристаллизуют в этилацетате.
Таким образом получают хлоргидрат н-2-бутил-3-[4-(ди-н-2-бутиламино-этокси)-бензоил]-5-нитро-бензофуран
Т.пл. 1195oC.
Чистота (ЖХВД): 100%
Следуя методике, аналогичной описанной выше, получают следующие продукты:
Щавелевокислый н-2-бутил-3-[4-(ди-н-5-бутиламино-пентокси)-бензоил]-5-нитро-бензофуран
Т.пл. 106,7oC (изопропанол).
Чистота (ЖХВД): 99,6%
n-2-Бутил-3-[4-(н-3-бутиламино-пропокси)-бензоил]-5-нитро-бензофуран
Масло.
Чистота (ЖХВД): 97,8%
c) Диоксалат 5-амино-н-2-бутил-3-[4-(ди-n-2-бутиламино-этокси)-бензоил-бензофуран
Это вещество было получено по методике, описанной в примере 1.
Т.пл. 155oC (изопропанол).
Чистота (ЖХВД): 96%
Пример 5. Получение 3-[4-(ди-н-3-бутиламино-пропокси)-бензоил]-5-бис-метилсульфонамидо-2-этил-бензофурана
К раствору из 10 г (0,022 моль) 5-амино-3-[4-(ди-н-3-бутиламино-пропокси)-бензоил] -2-этил-бензофурана и 22,45 г (0,22 моль) триэтиламина в 200 мл тетрахлориде углерода прибавляют по каплям раствор из 7,56 г (0,066 моль) метансульфонилхлорида в 40 мл тетрахлорида углерода. Нагревают с обратным холодильником 20 ч, выливают на смесь льда и воды, после чего декантируют органическую фазу. Промывают водой, высушивают на сульфате натрия, фильтруют и выпаривают досуха. После чего очищают элюционной хроматографией на колонке кремнезема (элюант: этилацетат), затем перекристаллизуют полученный сырой продукт в гептане.
Таким образом получают 8,4 г 3-[4-(ди-н-3-бутиламино-пропокси)-бензоил] -5-бисметилсульфонамидо-2-этил-бензофурана.
Выход: 63%
Т.пл. 70oC.
Чистота (ЖХВД): 98,2%
Пример 6. Получение 3-/4-(ди-н-2-бутиламино-этокси)-бензоил/-n-2-бутил-5-метилсульфонамидо-бензофурана (SR 344888).
Перемешивают в течение 4 ч смесь, образованную 6,2 г (0,01 моль) 3-/4-(ди-н-2-бутиламино-этокси)-бензоил/-n-2-бутил-5-бисметилсульфонамидо-бензофурана и 8 г (0,2 моль) гидроксида натрия в 190 мл этанола. После чего выливают в большой объем воды и экстрагируют 3 раза 50 мл этилацетата. Промывают водой, высушивают на сульфате натрия, фильтруют и выпаривают досуха под вакуумом. Затем очищают элюционной хроматографией на колонке кремнезема (элюант: этилацетат). После чего перемешивают полученный продукт в гептане до получения кристаллов. Таким образом получают 4 г 3-/4-(ди-н2-бутиламино-этокси)-бензоил/-n-2-бутил-5-метилсульфонамидо-бензофурана, после перекристаллизации в гептане.
Выход: 74%
Т.пл. 86oC.
Чистота (ЖХВД): 98,08%
Пример 7. Получение диоксалата n-2-бутил-3/4-(ди-н-3-бутиламино-пропионамидо)-бензоил/-5-амино-бензофуран (SR 34512A)
a) 4-(3-хлор-пропионамино-бензойная кислота
В 250 мл сосуде растворяют 13,7 г (0,1 моль) p-аминобензойной кислоты в 100 мл уксусной кислоты при 10oC. Затем прибавляют 9,5 мл (12,7 г; 0,1 моль) хлор-пропионилхлорида. После 1 ч перемешивания при 10oC вводят водный раствор ацетата натрия (25 г в 100 мл воды) и фильтруют реакционную смесь. Промывают водой полученный таким образом твердый белый осадок и высушивают.
Таким образом получают 13,2 г 4-(3-хлор-пропионамидо)-бензойной кислоты с выходом 58%
Т.пл. 225oC.
Следуя методу, описанному выше, получают такое вещество, как 4-(4-хлор-бутирамидо)-бензоил
Выход: 46%
Т.пл. 220oC (разложение).
b) Хлорид 4-(3-хлор-пропионамидо)-бензоила
В сосуде 250 мл, снабженном охладительной трубкой и защитой с хлоридом кальция, помещают при перемешивании и обратном холодильнике (70oC), смесь из 13,2 г (0,058 моль) 4-(3-хлорпропионамидо)-бензойной кислоты в 100 мл тионилхлорида. После 0,5 ч выпаривают тионилхлорид и перекристаллизуют сырой реакционный продукт в 200 мл горячего толуола. После выпаривания получают 11,91 г хлорида 4-(3-хлор-пропионамидо)-бензоила.
Выход: 83%
Т.пл. 130oC.
По этой же методике приготовлено следующее соединение: Хлорид 4-(4-хлор-бутирамидо)-бензоил
Выход: 69%
Т.пл. 100oC (разложение).
c) 3-/4(3-Хлор-пропионамидо)-бензоил/-н-2-бутил-2-нитробензофуран
В сосуде 500 мл, снабженном защитой с хлоридом кальция, растворяют 11,91 г (0,048 моль) хлорида 4-(3-хлор-пропионамидо)-бензоила и 10,61 г (0,048 моль) 5-нитро-2-бутил-бензофурана в 280 мл 1,2-дихлор-этане. При сильном помешивании и 0oC вводят 19,84 г (0,149 моль) хлорида алюминия. Реакционную смесь перемешивают при комнатной температуре в течение 5 ч, затем выливают на 1 кг колотого льда, содержащего 50 мл концентрированной HCl. После перемешивания экстрагируют образовавшийся продукт 2 порциями 250 мл этилацетата. Объединяют органические фазы, высушивают на сульфате натрия, фильтруют и выпаривают растворители под вакуумом (1330 Па). Таким образом выделяют 19,7 г твердого сырого вещества, которое перекристаллизуют в 250 мл горячего толуола.
Таким образом получают 10,9 г 3-/4-(3-хлор-пропиоамидо)-бензоил/-n-2-бутил-5-нитро-бензофуран
Выход: 53%
По этой же методике получено следующее соединение:
3-/4-(4-Хлор-бутирамидо)-бензоил/-n-2-бутил-5-нитро-бензофуран
Выход: 77%
Т.пл. примерно 100oC (разложение).
d) Оксалат н-2-бутил-3-/4-(ди-н-3-бутиламино-пропионамидо)-бензоил/-5-нитро-бензофурана
В 100 мл сосуде, снабженном холодильником и защитой с хлоридом кальция, растворяют 10,9 г (0,025 моль) 3-/4-(3-хлор-пропионамидо)-бензоил/-н-2-бутил-5-нитро-бензофурана в 50 мл сухого бензола с обратным холодильником.
К реакционной среде затем прибавляют 13 мл (9,9 г; 0,076 моль) ди-n-бутиламина. После 5 ч реакции смесь охлаждают и гидролизуют 200 мл воды. Экстрагируют 2 раза 100 мл этилацетата, затем высушивают органическую фазу на сульфате натрия. Растворители фильтруют и выпаривают в вакууме (1330 Па). Сырой реакционный продукт хроматографируют на 800 г кремнезема (элюант: дихлорэтан/метанол 95/5) для выделения 13,31 г желаемого продукта (выход: 100% ) в виде основания. Затем образуют оксалатную соль в 250 мл абсолютного этанола и выделяют ее фильтрацией.
Таким образом получают оксалат н-2-бутил-3-/4-(ди-н-3-бутиламино-пропионамидо)-бензоил/-5-нитро-бензофуран.
Т.пл. 147oC (этанол).
Таким же образом получают следующий продукт:
Оксалат n-2-бутил-3-/4-(ди-н-4-бутиламино-бутирамидо)-бензоил/-5-нитро-бензофурана
Т.пл. 105oC.
e) Диоксалат n-2-бутил-3-/4-(ди-н-3-бутиламино-пропионамидо)-бензоил/-5-нитро-бензофурана
В 250 сосуде растворяют 9,58 г (0,018 моль) н-2-бутил-3-/4-(ди-н-3-бутиламино-пропионамидо)-бензоил/-5-нитро-бензофурана в виде основания, в 100 мл абсолютного этанола. Туда же добавляют 0,953 г 5% палладия на активированном угле и помещают реакционную смесь в атмосферу водорода. Сильно перемешивают 5 ч и фильтруют на шероховатом стекле. Затем выделенный таким образом этаноловый раствор обрабатывают 3,24 г (0,036 моль) щавелевой кислоты, так, чтобы образовался осаждающийся оксалат. Фильтруют и рекристаллизуют соль в 100 мл горячего этанола.
Таким образом получают 8,43 г диоксалата н-2-бутил-3-/4-(ди-н-3-бутиламино-пропионамидо)-бензоил/-5-амино-бензофурана
Выход: 70%
Т.пл. 145oC.
Пример 8. Получают щавелевокислый N-{н-2-бутил-3-[4-(ди-н-3-бутиламино-пропокси-бензоил]-5-бензофурил}-1,3-пропансултам
a) 5-амино-н-2-бутил-бензофуран
В аппарате для гидрогенизации перемешивают под давлением в 3,4 атм водорода, 8,8 г (0,04 моль) n-2-бутил-5-нитробензофурана в 100 мл этанола в присутствии 0,6 г оксида платины. Когда давление достигнет 2,7 атм, реакция прекращается, примерно через 20 мин. Отфильтровывают катализатор и выпаривают досуха в вакууме для получения 7,3 г (выход: 96,56%) сырого маслянистого продукта.
Таким образом получают 5-амино-н-2-бутил-бензофуран
b) 5-(н-2-Бутил-бензофурил-3-аммоний-1-пропан-сульфонат
Нагревают с обратным холодильником в течение 1 ч 2,85 г (0,015 моль) 5-амино-н-2-бутил-бензофурана и 1,85 г (0,015 моль) 1,3-пропан-султона в 500 мл ацетонитрила. Ожидаемый продукт осаждается в процессе реакции.
Охлаждают, обезвоживают, промывают этиловым эфиром и высушивают в вакууме для получения 2,9 г продукта, который перекристаллизовывают в 450 мл этаноле.
Таким образом получают 1,6 г 5-(н-2-бутил-бензофурил)-3-аммоний-1-пропан-сульфоната.
Выход: 34%
Т.пл. 250-253oC.
c) n-2-бутил-5-бензофурил-1,3-пропансултам
В течение 20 мин измельчают в ступке смесь из 0,78 г (0,0025 моль) 5-(н-2-бутил-бензофурил)-3-аммоний-1-пропан-сульфоната с 1,05 г (0,005 моль) пентахлорида фосфора. Затем разбавляют ледяной водой, перетирают, обезвоживают, промывают водой и высушивают в вакууме. Таким образом получают 0,4 г (n-2-бутил-5-бензофурил)-1,3-пропан-султама после перекристаллизации в циклогексане.
Выход: 54,5%
Т.пл. 84,5-86oC.
g) N-[n-2-бутил-3-(4-метокси-бензоил)-5-бензофурил]-1,3-пропансултам
К раствору из 7,35 г (0,025 моль) (Н-2-бутил-5-бензофурил-)-1,3-пропансултама 5,55 г (0,0325 моль) анизоилхлорида в 38 мл дихлорэтана, прибавляют в течение 45 мин 16,25 г (0,0625 моль) тетрахлорида олова. Перемешивание продолжают в течение 3 ч и выливают на смесь льда и воды. Перемешивают 30 мин, промывают органическую фазу 3 раза 50 мл воды, 1 раз 100 мл гидрокарбоната натрия, насыщаемого затем снова 100 мл воды. После выпаривания получают 9 г продукта, очищаемого хроматографией элюционной на колонке кремнезема (элюэнт: хлороформ). Таким образом получают 6 г N-[n-2-бутил-3-(4-метокси-бензоил)-5-бензофурил]-1,3-пропансултама после рекристаллизации в этаноле.
Выход: 56,1%
Т.пл. 104-107oC.
e) N-[n-2-Бутил-3-(4-гидрокси-бензоил)-5-бензофурил]-1,3-пропансултам
Нагревают с обратным холодильником 4 ч 2,15 г (0,005 моль) N-(н-2-бутил-4-метокси-5-бензофурил)-1,3-пропансултама в 33 мл дихлорэтана в присутствии 2,66 г (0,02 моль) хлорида алюминия. Охлаждают и выливают на смесь льда и воды. Экстрагируют органическую фазу 3 раза 20 мл гидроксида натрия 5% затем экстрагируют этот раствор 2 раза 25 мл дихлорметана. Подкисляют концентрированной HCl и перемешивают кислый раствор до кристаллизации. Обезвоживают, промывают водой и высушивают в вакууме.
Таким образом получают 1,8 г N-[н-2-бутил-3-(4-гидрокси-бензоил)-5-бензофурил]-1,3-пропансултама.
Выход: 86,9%
Т.пл. 79 -84oC.
f) Щавелевокислый N-{н-2-бутил-3-[4-(ди-н-3-бутиламино-пропокси) -бензоил]-5-бензофурил}-1,3-пропансултам
Это соединение было получено по методике, описанной в примере 1e.
Т.пл. 75oC (изопропанол).
Пример 9. Кислый фумарат n-2-бутил-3-{[4-(ди-n-3-бутиламино-пропокси)-фенил]-гидроксиметил}-5-метилсульфонамидо-бензофуран (SR 34173 A)
В 5-литровый сосуд, охлажденный до 0oC, вводят 53,1 г (0,0954 моль) н-2-бутил-3-[4-(ди-n-3-бутиламино-пропокси)-бензоил]-5-метилсульфонамидо-бензофурана, 2,5 л тетрагидрофурана и 285 мл метанола. Затем порциями добавляют 5,7 г (0,152 моль) боргидрида натрия. Когда прибавление закончится, перемешивают еще 2 ч. Хроматографией на тонком слое контролируют исчезновение карбонильного исходного продукта и прибавляют к реакционной среде 930 мл воды и 930 мл дихлорметана. Декантируют органическую фазу и экстрагируют водную фазу 2 раза 400 мл дихлорметана. Собирают органические фазы, промывают их водой и высушивают на сульфате натрия. Фильтруют и выпаривают досуха в вакууме. К полученному остатку добавляют изопропиловый эфир и нагревают. Отфильтровывают мало значащий нерастворимый продукт в нагретом виде, кристаллизуют для получения ожидаемого продукта в виде основания. Выделяют эфиром и образуют фумарат добавлением фумаровой кислоты в эфир.
Таким образом, получают кислый фумарат n-2-бутил-3-{[4-(ди-н-3-бутиламино-пропокси)-фенил]-гидроксиметил}-5-метил-сульфонамидобензофуран.
Выход: 52,5%
Т.пл. 94oC.
Пример 10. n-2-Бутил-3-[4-(ди-н-3-бутиламино-пропокси)-бензил] -5-метил-сульфонамидо-бензофуран (SR 34162)
В 500 мл сосуд, охлажденный до 0oC, вводят под струей азота, 100 мл трифторуксусной кислоты. Затем порциями добавляют 0,6 г (0,016 моль) боргидрида натрия. Перемешивают 0,5 ч при 0oC и по каплям добавляют раствор из 5,58 г (0,01 моль) n-2-бутил-3-{[4-(ди-н-3-бутиламино-пропокси)-фенил]-гидроксиметил} -5-метилсульфонамидо-бензофурана, растворенного в 500 мл дихлорметана. Когда прибавление закончится, перемешивают еще 40 мин при 0oC, затем разрушают избыток боргидрида натрия с помощью 5 мл воды. Выпаривают досуха в вакууме и к остатку прибавляют 250 мл воды и 250 мл дихлорметана. Отделяют органическую фазу. Промывают 2,5% раствором NaOH, затем водой и высушивают на сульфате натрия, фильтруют и выпаривают досуха в вакууме. Очищают элюционной хроматографией на кремнеземе смесью дихлорметан-метанол 85/15. Перемешивают с гексаном полученный кристаллический продукт и фильтруют.
Таким образом получают n-2-бутил-3-[4-(ди-н-3-бутиламино-пропокси)-бензил]-5-метил-сульфонамидо-бензофуран с выходом 66,7%
Чистота (ЖХВД): 97,1%
Пример 11. Получение диоксалата-5-амино-3-[4-(ди-н-3-бутиламино-пропокси)-бензоил]-2-этил-бензотиофена (SR 34407 A)
a) 2-Ацетил-5-нитро-бензотиофен
Доводят до 50oC раствор из 18,4 г (0,1 моль) 2-хлор-5-нитро-бензальдегида в 80 мл этанола. При помешивании прибавляют смесь из 12 г сульфида натрия (Na2S, 9 H2O) и 1,6 г серы. Продолжают нагревание при 50oC 0,5 ч, отмечают желтый осадок. Охлаждают до 20oC и прибавляют раствор из 6 г гидроксида натрия и 6 г сульфида натрия в 40 мл воды. Продолжают перемешивание при этой температуре 0,5 ч для получения красного раствора 5-нитро-2-тиобензальдегида. Охлаждают до 10oC при помощи ледяной бани и добавляют 9,2 г (0,1 моль) хлорацетона. Продолжают перемешивание при комнатной температуре 2 ч, затем выливают в 200 мл воды. Нейтрализуют при помощи уксусной кислоты и отфильтровывают образовавшийся таким образом коричневый осадок. Высушивают в вакууме при 50oC, получают 21 г 2-ацетил-5-нитро-бензотиофена, который очищают хроматографией на кремниевой колонке (элюант: дихлорэтан/гептан 9/1).
Т.пл. 103oC.
Выход: 95%
b) 2-Этил-5-нитро-бензотиофен
Охлаждают при помощи бани из льда и хлорида натрия до 0oCC раствор из 22,6 г (0,195 моль) триэтиламина в 50 мл дихлорметана. Затем вводят трифторид бора до насыщения среды (примерно 25 г). Поддерживая температуру 0oC, прибавляют раствор из 14,4 г (0,065 моль) 2-ацетил-5-нитро-бензотиофена в 50 мл дихлорметане. Продолжают перемешивание при 0oC в течение 0,5 ч, поддерживая очень слабую струю трифторида бора. Разлагают образовавшийся комплекс насыщенным раствором хлорида натрия, промывают 3 раза органическую фракцию раствором хлорида натрия и высушивают на безводном сульфате натрия. Фильтруют и выпаривают растворитель во вращающемся испарителе. Таким образом получают 16,6 г 2-этил-5-нитро-бензотиофена в виде твердого желтого вещества, очищаемого хроматографией на колонке кремнезема (элюант: гептан/этилацетат 9/1).
Т.пл. 55oC.
Выход: 61,9%
c) 3-(4-Метокси-бензоил)-2-этил-5-нитро-бензотиофен
Растворяют 9 г (0,0434 моль) 2-этил-5-нитро-бензотиофена в 300 мл дихлорэтана. Охлаждают раствор до 0oC при помощи бани лед/хлорид натрия. Затем прибавляют порциями 28,9 г (0,217 моль) хлорида алюминия, затем по каплям 7,5 г (0,0434 моль) анизоилхлорида в 100 мл дихлорэтана. Перемешивают при комнатной температуре 3 ч, выливают на лед и промывают 2 раза водой органическую фракцию. Высушивают на безводном сульфате натрия, фильтруют и выпаривают растворитель во вращающемся испарителе.
Таким образом получают 17 г 3-(4-метокси-бензоил)-2-этил-5-нитро-бензотиофена, который очищают хроматографией на колонке кремния (элюант: гептан/этилацетат 7/3).
Т.пл. 103oC.
Выход: 60,1%
d) 3-(4-Гидрокси-бензоил)-2-этил-5-нитро-бензотиофен
Нагревают до 185oC в течение 2,5 ч смесь из 7,7 г (0,0225 моль) 3-(4-метокси-бензоил)-2-этил-5-нитро-бензотиофена и 35 г хлоргидрата пиридина. Охлаждают и выделяют 100 мл воды. Фильтруют, промывают водой продукт на фильтре и высушивают в вакууме при 50oC. После очистки хроматографией на колонке кремнезема (элюант: гептан/этилацетат 6/4), получают 5,6 г 3-(4-гидрокси-бензоил)-2-этил-5-нитро-бензотиофена.
Т.пл. 210oC.
Выход: 76%
е) Щавелевокислый 3-[4-(ди-n-3-бутиламино-пропокси)-бензоил]- -2-этил-5-нитро-бензотиофен
Это вещество получено по методике, описанной в примере 1е.
Т.пл. около 86oC (диэтиловый эфир).
Аналогичным образом готовят следующее соединение: хлоргидрат 3-{N-метил N-(3-4-диметокси-b-фенэтил)3-амино-4-пропокси-бензоил} 2-этил-5-нитро-бензотиофен
Т.пл. 168oC (этилацетат/изопропанол 8/1).
f) Диоксалат 5-амино-3-[4-(ди-n-3-бутиламино-пропокси)-бензоил] -2-этил-бензотиофен
Это вещество было получено по методике, описанной в примерах 1f и 2.
Т.пл. 136oC (этилацетат/этанол 8/2).
Пример 12. Получение дихлоргидрата 5-амино-3-[4-(ди-n-3-бутиламино-пропокси-бензоил]-n-2-бутил-бензотиофена (SR 34479 A)
а) 2-бутироил-5-нитро-бензотиофен
Это вещество было подучено аналогично примеру 11a.
Выход: 52,2%
Т.пл. 158oC.
в) n-2-бутил-5-нитро-бензотиофен
Это вещество было получено по методике, аналогичной примеру 11b.
Плотное масло.
Выход: 72,3%
c) 3-(4-гидрокси-бензоил)-n-2-бутил-5-нитро-бензотиофен
Растворяют 7,3 г (0,033 моль) n-2-бутил-5-нитро-бензотиофена в 250 мл дихлорэтана. Охлаждают раствор до 0oC при помощи бани лед/хлорид натрия, затем добавляют порциями 22 г (0,165 моль) хлорида алюминия. После чего по каплям прибавляют 6 г (0,35 моль) анизоилхлорида в 50 мл дихлорэтана. Перемешивают при комнатной температуре около 12 ч, затем выливают на лед. Органическую фракцию 2 раза промывают водой, высушивают на безводном сульфате натрия, фильтруют и выпаривают растворитель во вращающемся испарителе. После чего очищают маслянистый остаток хроматографией на колонке кремнезема (элюант: дихлорэтан/этилацетат 98/2).
Таким образом получают 7,5 г 3-(4-гидрокси-бензоил)-n-2-бутил-5-нитро-бензотиофена.
Выход: 64,1%
R.F. 147oC.
d) Оксалат 3-[4-(ди-n-3-бутиламино-пропокси)-бензоил]-n-2-бутил-5-нитро-бензотиофен
Это вещество было получено по методике примера 7е.
Т.пл. около 88oC (диэтиловый эфир).
е) Дихлоргидрат 5-амино-3[4-(ди-н-3-бутиламино-пропокси)-бензоил]-n-2-бутил-бензотиофен
Это вещество было получено по методике, описанной в примерах 1f и 2.
Т.пл. 116oC (диэтиловый эфир).
Пример 13. Получение оксалата 5-амино-2-[4-(ди-н-3-бутиламинопропокси)-бензоил]-n-3-бутил-бензотиофена (SR 34224 A)
a) Хлорид 2-карбокси-n-3-бутил-5-нитро-бензотиофеновой кислоты
Суспензируют 15,2 г (0,054 моль) 2-карбокси-n-3-бутил-5-нитро-бензотиофена (патент RFA 2.854.014) в 50 мл хлорида тионила и 1 мл N,N-диметилформамида. Перемешивают и нагревают до полного растворения кислоты, затем дистиллируют избыток хлорида тионила во вращающемся испарителе. Выделяют твердый остаток в гептане, фильтруют, промывают продукт на фильтре гептаном, высушивают в вакууме при 60oC.
Таким образом получают 16,4 г хлорида 2-карбокси-Н-З-бутил-5-нитро-бензотиофена.
Т.пл. 96oC.
b) 2-(4-гидрокси-бензоил)-н-З-бутил-5-нитро-бензотиофен
Растворяют 7,3 г (0,02445 моль) хлорида 2-карбокси-n-3-бутил-5-нитро-бензотиофена в 240 мл дихлорэтана, охлаждают до 0oC, прибавляют 26,3 г (0,122 моль) хлорида алюминия. После 0,5 ч перемешивания при 0oC добавляют 7,94 г (0,0735 моль) анизола. Приводят к комнатной температуре, затем нагревают до 60oC в течение 6 ч. Выливают на ледяную воду, отделяют органическую фракцию и промывают водную фракцию дихлорэтаном. Объединяют органические фракции, промывают водой, высушивают на сульфате натрия, фильтруют, убирают растворитель на вращающемся испарителе. Затем очищают хроматографией на колонке кремнезема (элюант: дихлорэтан/этилацетат 98/2).
Таким образом получают 2,7 г 2-(4-гидрокси-бензоил)-н-3-бутил-5-нитро-бензотиофен.
Выход: 31%
Т.пл. 182oC (уксусная кислота/вода 9/1).
c) 2-[4-(ди-n-3-бутиламино-пропокси)-бензоил] -Н-3-бутил-5-нитробензотиофен
Растворяют 3,4 г (0,0095 моль) 2-(4-гидрокси-бензоил)-n-3-бутил-5-нитро-бензотиофена в 100 мл N,N-диметилформамида. Перемешивают, затем добавляют 7 г карбоната калия измельченного и безводного и 1,95 г (0,0095 моль) хлорида ди-n-бутиламинопропила. Нагревают до 100oC в течение 0,5 ч. Охлаждают и выливают продукт реакции в воду. Экстрагируют этилацетатом, органическую фракцию промывают водой, высушивают на сульфате натрия, фильтруют и удаляют этилацетат во вращающемся испарителе, что позволяет получить плотный маслянистый остаток. После этого очищают хроматографией на колонке кремнезема (элюант: дихлорэтан/этанол 9/1).
Таким образом получают 2-[4-ди-н-З-бутиламино-пропокси)-бензоил]-n-3-бутил-5-нитро-бензотиофен.
d) Оксалат 5-амино-2[4-(ди-n-3-бутиламино-пропокси)-бензоил]-н-3-бутилбензотиофен.
Это соединение получено по методике, описанной в примерах 1f и 2.
Т.пл. 135oC (изопропанол).
Пример 14. Получение 3[4-(ди-н-3-бутиламино-пропокси)-бензоил]-н-2-бутил-5-нитро-индол (SR 34127)
a) n-2-Бутил-5-нитро-индол
При помощи охлаждающей бани лед/хлорид натрия охлаждают до 0oC раствор из 11 г (0,064 моль) n-2-бутил-индола в 50 мл концентрированной серной кислоты. Поддерживая эту температуру, вводят по каплям раствор из 5,4 г нитрата натрия в 50 мл конц. серной кислоты (продолжительность: 1,5 часа). Перемешивают 0,25 ч и выливают на 400 г измельченного льда. Отфильтровывают желтый осадок и промывают холодной водой продукт, находящийся на фильтре.
Таким образом получают 13,5 г n-2-бутил-5-нитро-индола.
Выход: 96,7%
Т.пл. 105oC (изопропанол/вода 1/1).
Чистота ЖХВД99,1%
Таким же образом, как указано выше, получают следующий продукт: 5-нитро-2-фенил-индол.
Выход: 95%
Т.пл. 193oC (изопропанол/вода).
b) 3-(4-метоксибензоил)-n-2-бутил-5-нитро-индол
При перемешивании нагревают до 150oC за 0,25 ч (конец выделения HCl), смесь из 20 г (0,091 моль) н-2-бутил-5-нитро-индола и 16,2 г (0,091 моль) хлорида 4-метоксибензоила. Реакционную смесь выделяют в дихлорэтане, промывают водой и удаляют растворитель во вращающемся испарителе (твердый коричневый остаток). Затем очищают хроматографией на кремнеземной колонке (элюант: гептан/этилацетат 1/1).
Таким образом получают 23 г 3-(4-метокси-бензоил)-н-2-бутил-5-метокси-индола.
Выход: 72%
Т.пл. 170oC (гептан/изопропанол 8/2).
Чистота (ЖХВД): 98,7%
Таким же образом получают 4-метокси-2-бензоил-н-3-бутил-5-нитро-индол
Выход: 62,9%
Т.пл. 142oC (гептан/этилацетат 7/3).
2-(4-Метокси-бензоил)-n-3-бутил-1-метил-5-нитро-индол
Выход: 64,5%
Т.пл. 102oC (этанол).
c) 3-(4-Гидрокси-бензоил)-n-2-бутил-5-нитро-индол
Смешивают 12,3 г (0,035 моль) 3-(4-метокси-бензоил)-n-2-бутил-5-нитро-индола и 40,4 г (0,35 моль) хлоргидрата пиридина, затем нагревают до 180oC в течение 1,5 ч, поглощают водой, подкисляют HCl и фильтруют коричневый осадок. Промывают водой на фильтре, сырой продукт обрабатывают затем разбавленным раствором гидроксида натрия и 5 г активированного угля. Фильтруют на шероховатой пластинке и подкисляют фильтрат HCl. Фильтруют осадок и промывают водой продукт на фильтре. Затем высушивают в вакууме при 60oC.
Таким образом получают 9,4 г 3-(4-гидрокси-бензоил)-н-2-бутила-5-нитро-индола.
Выход: 79,6%
Т.пл. 230oC (вода/изопропанол 6/4).
Чистота (ЖХВД): 99,6%
Аналогичным способом получают следующие вещества:
2-(4-гидрокси-бензоил)-н-3-бутил-5-нитро-индол.
Выход: 77,7%
Т.пл. 181oC (вода/изопропанол 8/2).
2-(4-гидрокси-бензоил)-н-3-бутил-1-метил-5-нитро-индол.
Выход: 84,7%
Т.пл. 172oC (изопропанол/вода 6/4).
3-(4-гидрокси-бензоил)-2-этил-1-метил-4-нитро-индол.
Т.пл. 191oC (вода/уксусная кислота 7/3).
d) 3-[4-(Ди-n-3-бутиламино-пропокси)-бензоил]-Н-2-бутил-5-нитро-индол
Растворяют 5 г (0,015 моль) 3-(4-гидрокси-бензоил)-n-2-бутил-5-нитро-индола в 100 мл N,N-диметилформамида, перемешивают и добавляют 12 г безводного карбоната калия размельченного и 3 г (0,015 моль) хлорида ди-н-бутиламинопропила. Нагревают до 100oC в течение 0,5 ч, охлаждают и выливают продукт реакции в воду. Экстрагируют этиловым эфиром и этерифицированную фракцию промывают водой. Высушивают на сульфате натрия, фильтруют и удаляют эфир во вращающемся испарителе, это дает 5,1 г маслянистого остатка, который очищают хроматографией на колонке кремнезема (элюэнт: дихлорэтан + 5% этанол).
Таким образом получают 2,9 г 3-[4-(ди-n-3-бутиламино-пропокси)-бензоил] -Н-2-бутил-5-нитро-индола.
Выход: 38,1%
Т.пл. 116oC.
Пример 15. Получение диоксалата-5-амино-3-[4-(ди-н-3-бутиламино-пропокси)-бензоил]-н-2-бутил-индола (SR 34158A).
При комнатной температуре и под давлением 7 кг/см2 (6,867•102 Па) гидрогенизируют 4 г (0,0078 моль) 3-[4-(ди-n-3-бутиламино-пропокси)-бензоил]-н-2-бутил-5-нитро-индола в растворе в 100 мл этанола и в присутствии 0,150 г оксида платины. Фильтруют и выпаривают этанол, что дает 3,5 г вещества маслянистой консистенции (брутто-выход: 94,5% чистота ЖХВД: 95%). Затем очищают хроматографией на кремниевой колонке (элюэнт: гептан/этанол 9/1), полученный таким образом щелочной продукт превращают в диоксалат в среде диэтилового эфира.
Таким образом получают диоксалат 5-амино-3-[4-(ди-н-3-бутиламино-пропокси)-бензоил]-н-2-бутил-индола.
Пример 16. Получение хлоргидрата 3-[4-(ди-н-3-бутиламино-пропокси)-бензоил]-н-2-бутил-метилсульфонамидо-индола (SR 34138 A)
При комнатной температуре и помешивании прибавляют по каплям раствор из 5 г (0,04 моль) метансульфонилхлорида в 20 мл дихлорэтана, к раствору из 1,7 г (0,0035 моль) 5-амино-3-[4-(ди-н-3-бутиламино-пропокси)-бензоил]-2-н-бутил-индола и 0,6 г триэтиламина в 20 мл дихлорэтана. Продолжают перемешивание в течение 15 ч и промывают 2 раза водой продукт реакции. Высушивают на сульфате натрия, фильтруют и выпаривают дихлорэтан, что дает 2,1 г маслянистого остатка, который очищают хроматографией на колонке кремнезема (элюэнт: гептан/этилацетат 1/1). Получают 1 г 3-[4-(ди-н-3-бутиламино- пропокси)-бензоил]-н-2-бутил-5-метилсульфонамидо-индола (выход: 52,6% аморфное вещество), который выделяют в сухом этиловом эфире. Затем образуют хлоргидрат добавлением хлористоводородного эфира.
Таким образом получают 0,9 г хлоргидрата 3-[4-(ди-н-3-бутиламино-пропокси)-бензоил]-н-2-бутил-5-метилсульфонамидо-индола.
Т.пл. 112oC.
Чистота (ЖХВД): 99,1%
Пример 17. Получение хлоргидрата 3-[4-(ди-н-3-бутиламино-пропокси)-бензоил]-н-2-бутил-1-метил- -5-нитро-индола (SR 34147 А)
a) 3-(4-метокси-бензоил)-н-2-бутил-1-метил-5-нитро-индол
При перемешивании вводят в 300 мл бензола 0,8 г 1,4,7,10,13,16-гексаоксациклооктадекана (0,00303 моль) и 3,9 г (0,0351 моль) третбутоксида калия. После 0,25 ч прибавляют раствор из 10,7 г (0,0303 моль) 3-(4-метокси-бензоил)-n-2-бутил-5-нитро-индола в 60 мл бензола. Перемешивают в течение 0,25 ч, затем добавляют по каплям 5 г (0,0303 моль) метилиодида. Продолжают перемешивание при комнатной температуре в течение 18 ч, затем выливают в воду. Отделяют бензольную фракцию, промывают водную фракцию бензолом и высушивают на сульфате натрия. Фильтруют и удаляют бензол во вращающемся испарителе, что дает твердый коричневый остаток. Затем кристаллизуют в смеси этилацетат/гептан 1/1.
Таким образом получают 10,3 г 3-(4-метокси-бензоил)-н-2-бутил-1-метил-5-нитро-индола.
Т.пл. 163oC.
Чистота (ЖХВД): 98%
Таким же образом получают следующее вещество: 1-метил-5-нитро-2-фенил-индол из 5-нитро-2-фенилиндола.
Выход: 92%
Т.пл. 185oC (изопропанол/гептан).
b) 3-(4-гидрокси-бензоил)-н-2-бутил-1-метил-5-нитро-индол
Смешивают 10,3 г (0,023 моль) 3-(4-метокси-бензоил)-Н-2-бутил-1-метил-5-нитро-индола и 32,4 г (0,28 моль) хлоргидрата пиридина, затем нагревают до 180oC в течение 2 часов, выделяют водой, подкисляют HCl и фильтруют коричневый осадок. Промывают сырой продукт водой на фильтре, затем обрабатывают разбавленным раствором гидроксида натрия и 4 г активированного угля. Фильтруют на шероховатом стекле и подкисляют фильтрат HCl. Фильтруют сформировавшийся осадок, промывают продукт водой на фильтре и высушивают в вакууме при 60oC.
Таким образом получают 9,3 г 3-(4-гидрокси-бензоил)-н-2-бутил-1-метил-5-нитро-индол.
Выход: 83%
Т.пл. 198oC (изопропанол/вода 6/4).
Чистота (ЖХВД): 98,3%
c) Хлоргидрат 3-[4-(ди-н-3-бутиламино-пропокси-бензоил] -n-2-бутил-1-метил-5-нитро-индола
Это соединение было получено по методике, описанной в примере 14d, из 7 г (0,02 моль) 3-(4-гидрокси-бензоил)-н-2-бутил-1-метил-5-нитро-индола, 150 мл N,N-диметилформамида, 15 г измельченного безводного карбоната калия и 4,1 (0,02 моль) ди-n-бутиламинопропилхлорида для получения 9,1 г вещества в виде основания (выход: 87,5%). Это основание в виде масла в спокойном состоянии кристаллизуется. Его очищают хроматографией на колонке кремнезема (элюант: гептан/этанол 85/15).
Т.пл. (основание): 84oC (гептан).
Т.пл. (хлоргидрапта): 140oC.
Пример 18. Получение диоксалата 5-амино-3-[4-(ди-н-3-бутиламино-пропокси)-бензоил]-n-2-бутил-1-метил-5-нитро-индол (SR 34156 A)
Это вещество готовится по методике, описанной в примере 15, из 3,5 г (0,0124 моль) 3-[4-(ди-н-3-бутиламино-пропокси)-бензоил] -н-2-бутил-1-метил-5-нитро -индола, 150 мл этанола, 0,024 г оксида платины и при использовании водорода.
Полученное в виде сырого продукта основание масляной плотной консистенции (выход: 63,3%) очищают хроматографией на колонке кремнезема (элюант: гептан/этанол 95/5), затем превращают в диоксалат обработкой раствором щавелевой кислоты в диэтиловом эфире и перекристаллизуют в этаноле.
Таким образом получают диоксалат-5-амино-3-[4-(ди-н-3-бутиламино-пропокси)-бензоил]-н-2-бутил-1-метил-индола.
Т.пл. 168oC.
Чистота: 100%
Пример 19. Получение хлоргидрата 3-[4-(ди-n-3-бутиламино-пропокси)-бензоил]-n-2-бутил-5-метилсульфонамидо-1-метил-индола (SR 34152 A)
Это вещество получено по методике, описанной в примере 16, исходя из 3,4 г (0,007 моль) 5-амино-3-[4-(ди-Н-З-бутиламино-пропокси)бензоил] -n-2-бутил-1-метил-индола, 1,2 г триэтиламина, 40 мл дихлорэтана и 1,2 г (0,01 моль) метансульфонилхлорида в 40 мл дихлорэтана.
Полученное в сыром виде основание очищают хроматографией на кремнеземной колонке (элюант: гептан/этанол 85/15). Это основание представлено в аморфном виде (выход: 50% Т.пл. около 80oC).
Затем в среде этилового эфира при помощи хлороводородного эфира получают хлоргидрат.
Таким образом получают 1,6 г хлоргидрата 3-[4-(ди-н-3-бутил-амино-пропокси)-бензоил]-н-2-бутил-5-метилсульфонамидо-1-метил-1-индола.
Т.пл. около 100oC.
Чистота (ЖХВД): 98,14%
Пример 20. Получение 3-{4-[N-метил N-(3,4-диметокси-b-фенэтил)-3-амино-пропокси]-бензоил}-н-2-бутил-5-нитро-индол (SR 35175 А)
a) 3-[4-(3-хлор-пропокси)-бензоил]-н-2-бутил-5-нитро-индол
При перемешивании нагревают до 150oC за 0,25 ч (окончание выделения HCl), смесь из 2,18 г (0,01 моль) -н-2-бутил-5-нитро-индола и 2,33 г (0,01 моль) хлорида 4-(3-хлор-пропокси)-бензоила, реакционную смесь извлекают дихлорэтаном, промывают водой и удаляют растворитель во вращающемся испарителе, что дает 4,9 г сырого продукта. Его очищают хроматографией на колонке кремнезема (элюант: гептан/этилацетат 1/1).
Таким образом получают 2,8 г 3-[4-(3-хлор-пропокси)-бензоил]-н-2-бутил-5-нитро-индола, после перекристаллизации в смеси гептан/этилацетат 1/1.
Выход: 67,5%
Т.пл. 125oC.
Чистота ЖХВД: 98,6%
b) 3-{4-[N-Метил-N-(3,4-диметокси-b-(фенэтил)-3-амино-пропокси]-бензоил} -n-2-бутил-5-нитро-индол
При перемешивании нагревают до 60oC за 6 ч смесь из 6,15 г (0,015 моль) 3-[4-(3-хлор-пропокси)-бензоил] -Н-2-бутил-5-нитро-индола, 4,8 г (0,02 моль) хлоргидрата N-метил 3,4-диметокси-b-фенэтиламина, 9 г безводного карбоната калия, 1 г 1,4,7,10,13,16-гексаоксациклооктадекана и 75 мл ацетонитрила. Смесь выливают в воду, экстрагируют этиловым эфиром и промывают 2 раза водой эфирную фракцию. Высушивают на сульфате натрия, фильтруют и удаляют эфир во вращающемся испарителе. Очищают хроматографией на колонке кремнезема (элюант: этанол).
Таким образом получают 3,1 г требуемого вещества.
Выход: 36,9%
Т.пл. (оксалат): 211oC.
Пример 21. Получение диоксалата-5-амино-3-{4-[N-Метил N-(3,4-диметокси-b-фенэтил)-3-амино-пропокси]-бензоил}-н-2-бутил-индола (SR 34176 A)
Это вещество готовится по методике, описанной в примере 15, из 2,1 г (0,0054 моль) 3-{ 4-[N-метил-N-(3,4-диметокси-фенэтил)-3-амино-пропокси]-бензоил} -н-2-бутил-5-нитро-индола, 75 мл этанола, 0,106 г оксида платины, а также водорода, что дает 2,8 г смолистого вещества щелочного характера (выход: 96,5%). Оксалат получают в среде тетрагидрофуран/этиловый эфир 1/1. Таким образом получают требуемое соединение.
Т.пл. 138oC (этанол).
Пример 22. Получение хлоргидрата 3-{ 4-[N-метил-N-(3,4-диметокси-b-фенэтил)-3-амино-пропокси] -бензоил}-n-2-бутил- -5-метилсульфонамидоиндола (SR 34196 А)
Это вещество приготовлено по методике, описанной в примере 16, из 2,1 г (0,00386 моль) 5-амино-3-{4-[N-метил-N-(3,4-диметокси-b-фенэтил)-3-амино-пропокси] -бензоил} -2-бутил-индола, 0,6 г триэтиламина, 30 мл дихлорэтана и 0,48 г (0,0042 моль) метансульфонилхлорида в 20 мл дихлорэтана.
Т.пл. 125oC (изопропанол/эфир).
Чистота (ЖХВД): 99,8%
Пример 23. Получение оксалата 3-{ 4-[N-метил-N-(3,4-диметокси-b-фенэтил)-3-амино-пропокси]-бензоил}-n-2-бутил-1-метил-5-нитро-индола (SR 34230 А)
a) н-2-бутил-1-метил-5-нитро-индол
В течение 0,25 ч перемешивают 8,3 г (0,074 моль) трет. бутоксида калия и 1,7 г 1,4,7,10,13,16-гексаоксациклооктадекана в 600 мл бензола. Затем прибавляют раствор из 14 г (0,064 моль) n-2-бутил-5-нитро-индола в 500 мл бензола. Перемешивают 0,5 ч при комнатной температуре и добавляют раствор из 9,1 г (0,064 моль) метилиодида в 100 мл бензола. Продолжают перемешивание 3 ч, промывают водой и высушивают бензиловый раствор на сульфате натрия. Фильтруют и испаряют растворитель во вращающемся испарителе. Получают кристаллизующееся масло.
Таким образом получают 13,6 г требуемого вещества.
Выход: 91,5%
Т.пл. 77oC (изопропанол/вода 8/2).
Чистота (ЖХВД): 99,6%
b) 3-[4-(3-хлор-пропокси)-бензоил]-н-2-бутил-1-метил-5-нитро-индол
Это вещество получено по методике, описанной в примере 20а, из 8,1 г (0,035 моль) н-2-бутил-1-метил-5-нитро-индола и 8,2 г (0,035 моль) хлорида 4-(3-хлор-пропокси)-бензоила. Полученный продукт очищают хроматографией на колонке кремнезема (элюант: дихлорэтан/гептан 9-1).
Таким образом получают требуемое вещество (выход: 60,1%).
Т.пл. 125oC (изопропанол).
Чистота (ЖХВД): 98,1%
c) Оксалат 3-{4-[N-метил-N-(3,4-диметокси-b-фенэтил)-3-амино-пропокси] -бензоил}-н-2-бутил-1-метил-5-нитро-индола
Это вещество получают по методике, описанной в примере 20b, из 7,5 г (0,017 моль) 3-[4-(3-хлор-пропокси)-бензоил]-n-2-бутил-1-метил-5-нитро-индола, 3,93 г (0,017 моль) хлоргидрата N-метил-3,4-диметокси-b-фенэтиламина, 10 г безводного карбоната калия, 1,1 г 1,4,7,10,13,16-гексаоксацикkооктадекана и 100 мл ацетонитрила.
Таким образом получают 4,1 г требуемого вещества в виде масла.
Выход: 41%
Т.пл. около 80oC (изопропанол).
Пример 24. Получение 3-[4-(ди-н-3-бутиламино-пропокси)-бензоил]-n-2-бутил-ди-н-1-бутиламинопропил-5-нитро-индола (SR 34137 А)
5 г (0,015 моль) 3-(4-гидрокси-бензоил)-n-2-бутил-5-нитроиндола растворяют в 100 мл N,N-диметилформамида. Перемешивают, затем прибавляют 12 г размельченного безводного карбоната калия и 3 г (0,015 моль) хлорида ди-n-бутиламинопропила. Нагревают до 100oC за 0,5 ч, затем охлаждают и выливают продукт реакции в воду. Экстрагируют этиловым эфиром и промывают эфирную фракцию водой. Высушивают на сульфате натрия, фильтруют и удаляют эфир во вращающемся испарителе, что дает 5,1 г маслянистого остатка. Затем очищают хроматографией на колонке кремнезема (элюант: дихлорэтан + 5% этанол).
Таким образом получают 1 г требуемого продукта.
Т.пл. (диоксалат): 100oC (изопропанол).
Пример 25. Получение хлоргидрата 3-[4-(ди-н-3-бутиламино-пропокси)-бензоил]-н-2-бутил-5-метилсульфонамидо-1-метил-индола (SR 34152 А)
2,45 г (0,005 моль) 5-амино-3[4-(ди-n-3-бутиламино-пропокси)-бензоил]-н-2-бутил-1-метил-индола и 1,34 г (0,0077 моль) ангидрида метансульфоновой кислоты растворяют в 100 мл дихлорметана. Перемешивают, затем прибавляют 1 г триэтиламина. Перемешивают при комнатной температуре 24 ч и вываривают растворитель во вращающемся испарителе. Остаток выделяют в этилацетате, промывают водным раствором 2н бикарбоната натрия, затем водой. Высушивают на сульфате натрия, фильтруют и удаляют этилацетат во вращающемся испарителе. Получается остаток, который очищают хроматографией на колонке кремнезема (элюант: дихлорэтан + 2,5% этанола) и высушивают в вакууме. Затем из полученного таким образом основания образуют хлоргидрат добавлением хлороводородного эфира.
Таким образом получают требуемое вещество.
Т.пл. около 100oC.
Пример 26. Получение 3-[4-(ди-н-3-бутиламино-пропокси)-бензоил]-1-метил-5-нитро-2-фенил-индола (SR 34432)
a) 3-(4-Метокси-бензоил)-1-метил-5-нитро-индол
Прибавляют 10 г (0,039 моль) трифторметансульфоната серебра к раствору из 6,66 г (0,039 моль) анизоилхлорида в 100 мл дихлорметана. Перемешивают 1 ч при комнатной температуре и прибавляют затем 9,8 г (0,039 моль) 1-метил-2-фенил-индола. Снова перемешивают при комнатной температуре около 48 ч, затем прибавляют 40 мл 2н раствора гидроксида калия. Интенсивно перемешивают 12 ч фильтруют, промывают нерастворившееся вещество на фильтре смесью дихлорэтан изопропанол 1/1, затем органическую фракцию 2 раза промывают водой. Высушивают на безводном сульфате натрия, фильтруют и удаляют растворитель во вращающемся испарителе. Высушивают твердый остаток в вакууме при температуре 60oC и перекристаллизуют в смеси дихлорэтан/изопропанол 1/1.
Таким образом получают 7 г требуемого вещества.
Выход 47%
Т.пл. 229oC.
b) 3-(4-Гидрокси-бензоил)-1-метил-5-нитро-индол
Это вещество получают по методике, описанной в примере 14c.
Выход: 87,36%
Т.пл. 260oC.
c) 3-[4-(Ди-н-3-бутиламино-пропокси)-бензоил]-1-метил-5-нитро-2-фенил-индол
Это вещество подучено по методике, описанной в примере 14d.
Выход: 80%
Т.пл. 82oC.
Пример 27. Получение оксалата 3-[4-(ди-н-3-бутиламино-пропокси)-бензоил] -n-2-бутил-1-метилсульфонил индола (SR 34353 A)
Прибавляют 0,227 г гидрида натрия (суспензия в масле 55%) к раствору из 2,2 г (0,00475 моль) 3-[4-(ди-н-3-бутиламино-пропокси)-бензоил]-н-2-бутил-индола в 50 мл N,N-диметилформамида и 25 мл гексаметилфосфорамида. Перемешивают при комнатной температуре до окончания выделения водорода и затем прибавляют 0,544 г (0,00475 моль) хлорида метансульфонила в 10 мл N,N-диметилформамида. Продолжают перемешивание при комнатной температуре около 15 ч, затем выливают в воду. Экстрагируют этилацетатом, органическую фракцию 2 раза промывают водой и высушивают на безводном сульфате натрия. Фильтруют и удаляют растворитель во вращающемся испарителе, получают 1,5 г желаемого вещества в основной форме (бесцветное масло, плотное; выход: 60%). После чего образуют оксалат в смеси этилацетат/этиловый эфир.
Таким образом получают требуемое вещество.
Т.пл. 90oC (этилацетат/этиловый эфир).
Пример 28. Получение оксалата 2-н-бутил-3[4-(ди-н-3-бутиламино-пропокси)-бензоил]-7-карбэтокси-индолизина (SR 34226 А)
а) Бромид N-(2-гексанонил)-2-метил-н-этоксикарбонил-пиридина
Растворяют 19,5 г (0,118 моль) 2-метил-4-этоксикарбонил-пиридина в 35 г (0,19 моль) 1-бром-2-гексанонила и оставляют при комнатной температуре примерно на 15 ч. Перетирают твердую массу в сухом диэтиловом эфире. Фильтруют, промывают с тем же растворителем и высушивают в вакууме.
Таким образом получают 37,5 г требуемого вещества.
Выход: 92%
Т.пл. 139-140oC.
По описанной методике получают следующее соединение: бромид N-фенилацетил-2-метил-4-этоксикарбонил-пиридина.
Т.пл. 146-147oC (разложение) (этилацетат/метанол/диэтилэфир).
b) n-Бутил-7-карбэтокиси-индолизин
Растворяют 33 г (0,101 моль) бромида N-(2-гексанонил)-2-метил-4-этоксикарбонил-пиридина в 300 мл абсолютного этанола и прибавляют по каплям раствор из 70 мл триэтиламина в 300 мл абсолютного этанола, нагретого с обратным холодильником. Спустя 2 ч выпаривают досуха и растворяют остаток в этилацетате. Промывают водой, высушивают органический слой при помощи сульфата магния и выпаривают досуха. Затем полученный продукт очищают на колонке с 800 г кремнезема (элюант: гексан/этилацетат).
Таким образом получают 17,4 г требуемого вещества.
Выход: 70%
Т.пл. 47-48oC.
По описанной выше методике получают следующее вещество: 2-фенил-7-карбэтокси-индолизин.
Т.пл. 143-144oC (метанол/дихлорметан).
c) Оксалат n-2-бутил-3-[4-(ди-н-3-бутиламино-пропокси)-бензоил]-7-карбэтокси-индолизина
Нагревают до 95-100oC в течение 4,5 ч смесь из 0,35 г (38 моль) н-2-бутил-7-карбэтокси-индолизина и 14,2 г (38 моль) хлоргидрата 1-хлор-4-(ди-н-3-бутиламино-пропокси)-бензоила. Растворяют полученный сырой продукт в этилацетате и воде и нейтрализуют гидрокарбонатом натрия. Отделяют органический слой и высушивают на сульфате магния. Фильтруют и выпаривают. Затем очищают на колонке кремнезема с этилацетатом для получения 7,6 г желаемого вещества в виде основания (выход: 97%).
Затем в этилацетате образуют оксалатную соль и рекуперируют фильтрацией.
Т.пл. 140-142oC (этилацетат/метанол).
Пример 29. Получение хлоргидрата н-2-бутил-3-[4-(ди-н-3-бутиламино-пропокси)-бензоил]-7-карбокси-индолизина (SR 34227 А)
Растворяют 7,60 г (14,02 ммоль) n-2-бутил-3-[4-(ди-н-3-бутил-амино-пропокси)-бензоил] -7-карбэтокси-индолизина в 100 мл этанола, содержащего 60 мл 1М водного раствора гидроксида натрия. Нагревают с обратным холодильником за 24 ч, затем выпаривают в вакууме большую часть этанола. Прибавляют 300 мл воды и подкисляют концентрированной HCl. Экстрагируют осадок 3-мя фракциями по 150 мл дихлорметана, высушивают и растворители испаряют.
Таким образом получают 6,13 г требуемого вещества.
Выход: 79%
Т.пл. 190 -192oC (этилацетат/метанол).
Пример 30. Получение n-2-бутил-3-[4-(ди-н-3-бутиламино-пропокси)-бензоил]-7-бензилоксикарбамоил-индолизина (SR 34254)
Растворяют 7,10 г (13,08 ммоль) н-2-бутил-3-[4-(ди-Н-3-бутиламино-пропокси)-бензоил] -7-карбокси-индолизина в 100 мл сухого ацетона, содержащего 5,05 г (50 ммоль) триэтиламина. Охлаждают в бане с ледяной водой и прибавляют 1,70 г (15,67 ммоль) этилхлороформиата. После 1 ч прибавляют раствор из 10 г (150 ммоль) азида натрия в 70 мл воды. Немедленно образуется желтый осадок. Оставляют на 45 мин, затем выливают в воду. Экстрагируют этилацетатом, затем высушивают на сульфате магния и выпаривают растворитель. Остаток растворяют в 30 мл бензилового спирта и нагревают до 105-110oC на 2 ч. Растворитель удаляют путем дистилляции в вакууме и очищают сырой карбамат на колонке кремнезема (элюант: этилацетат).
Таким образом получают 6,08 г требуемого вещества.
Выход: 75%
Т.пл. 118-119oC (этилацетат).
Пример 31. Получение n-2-бутил-3-[4-(ди-n-3-бутиламино-пропокси)-бензоил]-7-амино-индолизина
Перемешивают в атмосфере водорода в течение 60 ч 6,10 г (10 ммоль) n-2-бутил-3-[4-(ди-n-3-бутиламино-пропокси)-бензоил]-7-бензилоксикарбамоил-индолизина и 10% палладия на 0,550 г активированного угля в 250 мл абсолютного этанола. Фильтруют на шероховатом стекле и выпаривают досуха для того, чтобы собрать желтые кристаллы.
Таким образом получают 4,76 г требуемого вещества.
Т.пл. 88-89oC (гексан).
Пример 32. Получение n-2-бутил-3-[4-(ди-n-3-бутиламино-пропокси)-бензоил]-7-метилсульфонамидо-индолизина (SR 34255)
При перемешивании при комнатной температуре прибавляют 1,65 г (4,04 ммоль) метансульфонилхлорида в сухом дихлорметане в раствор из 2,85 г (5,975 ммоль) н-2-бутил-3-[4-(ди-n-3-бутиламино-пропокси)-бензоил]-7-амино-индолизина в дихлорметане, содержащем 10 мл триэтиламина (избыток). Оставляют на 1 ч, выливают в воду и экстрагируют 3 фракциями по 75 мл каждая дихлорметана. Высушивают на сульфате магния и выпаривают экстракт для получения 3,47 г сырого сульфонимидного остатка. Затем растворяют этот сульфонимид в растворе гидроксида натрия (2,0 г; 50 ммоль) в 250 мл абсолютного этанола при комнатной температуре. Спустя 45 мин разбавляют 1 л воды и нейтрализуют до pH 7 концентрированной HCl, при этом образуется осадок. Экстрагируют 3 раза 150 мл этилацетата, высушивают и выпаривают экстракты. Затем очищают на колонке кремнезема с этилацетатом в качестве элюанта.
Таким образом получают 2,59 г требуемого вещества.
Выход: 78%
Т.пл. 87-88oC (гексан).
Пример 33. Получение n-2-бутил-3-[4-(ди-n-3-бутиламино-пропокси)-бензоил]-7-карбоксамидо-индолизина (SR 34296)
Нагревают в герметичной трубке около 15 ч при 100oC смесь из 1 г (1,87 ммоль) n-2-бутил-3-[4-(ди-n-3-бутиламино-пропокси)-бензоил]-7-карбэтокси-индолизина, 5 мл 25%-го аммиака и 25 мл метанола. Выпаривают досуха и растворяют в дихлорметане. Промывают водой, высушивают на сульфате магния и выпаривают. Очищают на колонке кремнезема смесью этилацетат/метанол 9/1. Затем кристаллизуют в гексан/этилацетате.
Таким образом получают 0,485 г требуемого вещества.
Выход 51%
Т.пл. 132oC (гексан/этилацетат).
Пример 34. Получение оксалата 2-фенил-3-[3-(ди-н-3-бутиламино-пропокси)-бензоил]-7-карбэтокси-индолизина (SR 34507 A)
a) 2-фенил-3-(3-бензилокси-бензоил)-7-карбэтокси-индолизин
Нагревают при 105-110oC за 4 ч смесь из 4 г (15,04 ммоль) 2-фенил-7-карбэтокси-индолизина и 4 г (16,22 ммоль) хлорида 3-бензилокси-бензоилхлорида. Очищают полученный продукт на колонке кремнезема со смесью гексан/этилацетат 4/1.
Таким образом получают 7,1 г требуемого вещества.
Выход: 90%
Маслянистый продукт.
Способом, аналогичным описанному выше, получают следующее вещество: 2-фенил-3-(4-бензилокси-бензоил)-7-карбэтокси-индолизин.
Т.пл. 115-117oC (метанол-дихлорметан).
b) 2-фенил-3-(3-гидрокси-бензоил)-7-карбэтокси-индолизин
Растворяют 6,5 г (13,63 ммоль) 2-фенил-3-(3-бензилокси-бензоил)-7-карбэтокси-индолизина в 300 мл абсолютного этанола, содержащего 0,300 г 5%-го палладия на угле и 15 г формиата аммония. Нагревают с обратным холодильником 24 ч, затем удаляют катализатор фильтрацией на шероховатом стекле и выпаривают досуха. Растворяют остаток в этилацетате, фильтруют и промывают соли 3 раза этилацетатом. Выпаривают растворитель и очищают сырой продукт на колонке кремнезема (элюант: гексан/этилацетат 1/1).
Таким образом получают 4,16 г требуемого вещества.
Выход: 83%
Т.пл. 193-195oC (гексан/этилацетат).
По методике, описанной выше, получают следующее вещество: 2-фенил-3-(4-гидрокси-бензоил)-7-карбэтокси-индолизин.
Т.пл. 135oC (этилацетат/гексан).
c) 2-фенил-3-[3-(ди-n-3-бутиламино-пропокси)-бензоил]-7-карбэтокси-индолизин
Растворяют 0,387 г (1 моль) 2-фенил-3-(3-гидрокси-бензоил)-7-карбэтокси-индолизина и 0,206 г (1 ммоль) ди-n-З-бутиламино-1-хлорпропана в 3 мл сухого диметилсульфоксида, содержащего 0,3 г карбоната калия и каталитическое количество иодида натрия. Выдерживают под азотом при комнатной температуре в течение 5 дней, затем выливают в воду и экстрагируют этилацетатом. Высушивают на сульфате магния и выпаривают экстракты. Затем очищают на колонке кремнезема (элюант: этилацетат).
Таким образом получают 0,503 г требуемого вещества.
Выход: 91%
Оксалат этого вещества аморфен.
Пример 35. Приготовление 3-{2-[5-(ди-Н-3-бутиламино-пропокси)-теноил]-5-бисметилсульфонамидо-н-2-бутил-бензофурана
a) 5-(Бисметилсульфонамидо)-н-2-бутил-бензофуран
К раствору из 14,6 г (0,077 моль) 5-амино-n-2-бутил-бензофурана в 500 мл тетрахлорида углерода, содержащего 77,9 г (0,77 моль) триэтиламина, прибавляют по каплям за 1,5 ч раствор из 26,45 г (0,231 моль) метансульфонилхлорида в 175 мл тетрахлорида углерода. Температура поднимается до 30oC. Затем нагревают с обратным холодильником в течение 6 ч. Охлаждают, выливают на смесь воды и льда, выпаривают органическую фазу и экстрагируют водную фазу 3 раза 150 мл метиленхлорида. Промывают водой 3 раза по 250 мл органические фазы, высушивают, фильтруют и выпаривают досуха в вакууме.
Таким образом, после перекристаллизации в изопропаноле получают 20,1 г требуемого вещества.
Выход: 75,5%
Т.пл. 126oC.
Чистота (ЖХВД): 99,5%
b) 3-[5-(Бисметилсульфонамидо)-2-(5-метокси-теонил)]-n-2-бутил-бензофуран
К раствору из 6,9 г (0,02 моль) 5-(бисметилсульфонамидо)-n-2-бутил-бензофурана в 40 мл хлороформа прибавляют за 10 мин и при температуре 24oC раствор из 7,3 г (0,028 моль) тетрахлорида олова в 10 мл хлороформа. Затем прибавляют за 3,5 ч раствор из 1,77 г (0,01 моль) хлорида-5-метокси-теноила в 15 мл хлороформа. Перемешивают реакционную среду в течение 48 ч, затем выливают в 60 мл 2Н хлороводородной кислоты. Декантируют и экстрагируют водную фазу 2 раза 50 мл этилового эфира, промывают органические фазы 40 мл воды, 40 мл гидроксида натрия 2Н, 35 мл воды, затем высушивают на сульфате натрия. Фильтруют и выпаривают досуха в вакууме. Очищают элюционной хроматографией на кремнеземе с хлороформом в качестве элюанта.
Таким образом получают 4,2 г требуемого вещества после перекристаллизации в этаноле.
Выход: 43,2%
Т.пл. 164-166oC.
Чистота (ЖХВД): 99,5%
c) 3-[5-(Бисметилсульфонамидо)-2-(5-гидрокси-теноил)] -n-2-бутил-бензофуран
При температуре 15 20oC прибавляют за 10 мин раствор из 17 мл (0,017 моль) трибромида бора (1М раствор в метиленхлориде) к раствору из 2,45 г (0,005 моль) 3-[5-(бисметилсульфонамидо)-2-(5-метокси-теонил)]-n-2-бутил-бензофурана в 20 мл хлороформа.
Нагревают с обратным холодильником в течение 4 ч, затем выливают на смесь воды и льда, куда добавляют 50 мл 2H HCl. Отфильтровывают образовавшееся твердое вещество и экстрагируют водную фазу 2 раза по 40 мл метиленхлорида. Промывают водой и высушивают на сульфате натрия, фильтруют и выпаривают досуха.
Таким образом получают 2 г требуемого вещества в виде твердого продукта.
Выход: 84,8%
Т.пл. 202-204oC.
Чистота: (ЖХВД): 99,6%
d) 3-{ 2-[5-(Ди-н-3-бутиламино-пропокси)-теноил]-5-бисметилсульфонамидо-n-2-бутил-бензофуран
Это вещество готовится по методике, описанной в примере 1e.
Используя методики, изложенные выше, получают следующие вещества:
5-Амино-3-[4-(ди-н-3-бутиламино-пропокси)бензоил] -2-изопропилбензофуран (пример 36)
Масло.
Чистота: 97,84%
Гемиоксалат 5-амино-3-[4-(ди-Н-3-бутиламино-пропокси)-бензоил] -2-фенил-бензофурана (пример 37)
Т.пл. 104oC (метанол).
Чистота: 98,2%
5-Амино-n-2-бутил-3-[4-(н-3-бутиламино-пропокси)-бензоил] -бензофуран (пример 38)
Масло.
Чистота: 97,83%
Хлоргидрат-5-амино-3-[4-(ди-н-3-бутиламино-пропокси)-3,5-диметилбензоил] -n-2-бутил-бензофурана (SR 33750 А) (пример 39)
Т.пл. 160-161oC (этилацетат).
Диоксалат 5-амино-3-[4-(3-тертиобутиламино-пропокси)-бензоил] -n-2-бутил-бензофурана (SR 33667 А) (пример 40)
Т.пл. 146oC (метанол).
Диоксалат 5-амино-3-{ 4-[N-метил-N-(3,4-диметокси-b-фенэтил)-3-амино-пропокси]-бензоил}-n-2-бутил-бензофурана (SR 33665 А) (пример 41)
Т.пл. 163oC (метанол).
n-5-бутилсульфонамидо-3-[4-(ди-н-3-бутиламино-пропокси)-бензоил]-n-2-бутил-бензофуран (SR 34193) (пример 42)
Т.пл. 78oC.
Кислый фумарат 3-[4-(ди-н-3-бутиламино-пропокси)-бензоил]-n-2-бутил-5-толилсульфонамидо-бензофурана (SR 34088 А) (пример 43)
Т.пл. 110oC (изопропанол).
n-2-Бутил-3-[4-(n-3-бутиламино-пропокси)-бензоил] -5-метил-сульфонамидо-бензофуран (SR 34174) (пример 44)
Т.пл. 86oC.
Оксалат n-2-бутил-3-[4-(ди-н-3-бутиламино-пропокси)-бензоил] -5-метилсульфонамидо-бензофурана (SR 33589 А) (пример 45)
Т.пл. 75oC (ацетон/гексан).
Хлоргидрат n-2-бутил-3-[4-(ди-n-3-бутиламино-пропокси)-бензоил]-5-трифторметилсульфонамидо-бензофурана (SR 34099 А) (пример 46)
Т.пл. 60oC (петролейный эфир 40-60oC).
Хлоргидрат n-2-бутил-3-{4-[N-метил-N-(3,4-диметокси-b-фенэтил)-3-амино-пропокси]-бензоил}-5-метилсульфонамидо-бензофурана (SR 33666) (пример 47)
Т.пл. 120oC (дихлорметан/эфир).
Гемиоксалат n-2-бутил-3-[4-(ди-Н-3-бутиламино-пропокси)- -3,5-диметил-бензоил]-5-метилсульфонамидо-бензофурана (SR 33751 А) (пример 48)
Т.пл. 71oC.
2-фенил-3-[4-(ди-н-3-бутиламино-пропокси)-бензоил] -5-метил-сульфонамидо-бензофуран (SR 34150) (пример 49)
Т.пл. 40oC.
p-Толуолсульфонат-2-изопропил-3-[4-(ди-Н-3-бутиламино-пропокси)-бензоил] -5-метилсульфонамидо-бензофурана (SR 34153 А) (пример 50)
Т.пл. 128oC (изопропанол).
р-Толуолсульфонат-2-изопропил-3-[4-ди-n-3-бутиламино-пропокси)-бензоил] -N,N-бис(метилсульфонил)амино-бензофурана (пример 51)
Т.пл. 142oC (изопропанол).
Диоксалат-5-амино-3-[4-(ди-н-3-бутиламинопропокси)-бензоил] -2-метил-бензофурана (SR 34287 А) (пример 52)
Т.пл. 136oC (метанол).
Чистота: 99,3%
5-Амино-3-[4-(ди-н-3-бутиламино-пропокси)-бензоил] -2-изопропил-бензофуран (пример 53)
Масло.
Чистота: 97,84%
5-Амино-3-[4-(ди-н-3-бутиламино-пропокси)-бензоил] -2-фенил-бензофуран (пример 54)
Масло.
Чистота: 98,2%
5-Амино-3-[4-(ди-н-3-бутиламино-пропокси)-бензоил] -n-2-пропилбензофуран (пример 55)
Диоксалат-5-амино-3[4-(ди-н-3-бутиламино-пропокси)-бензоил] -2-этилбензофурана (SR 34521 А) (пример 56)
Т.пл. 172oC (метанол).
Чистота: 99,25%
Дихлоргидрат 5-амино-н-2-бутил-3-[4-(3-диэтиламино-пропокси)-бензоил]-бензофурана (SR 34520 А) (пример 57)
Т.пл. 121,5oC (этанол).
Чистота: 98,7%
Дихлоргидрат 7-амино-3-[4-(ди-н-3-бутиламино-пропокси)-бензоил]-2-метил-бензофурана (SR 34405 А) (пример 58)
Т.пл. 160oC.
Чистота: 97,5%
Дихлоргидрат 5-амино-2-[4-(ди-н-3-бутиламино-пропокси)-бензоил]-3-метил-бензофурана (SR 34433 А) (пример 59)
Т.пл. 178oC (изопропанол).
Чистота: 99,2%
Диоксалат 5-амино-n-2-бутил-3-[4-(ди-н-5-бутиламино-пентокси)-бензоил] -бензофурана (SR 34486 А) (пример 60)
Чистота: 98,91%
Т.пл. 95oC (изопропанол).
5-Амино-n-2-бутил-3-[4-(н-3-бутиламино-пропокси)-бензоил] -бензофуран (пример 61)
Масло.
Чистота: 97,83%
3-[4-(Ди-n-3-бутиламино-пропокси)-бензоил] -5-метилсульфонамидо-2-фенил-бензофуран (SR 34150) (пример 62)
Т.пл. 40oC.
Чистота: 98,29%
Хлоргидрат 3-[4-(ди-н-3-бутиламино-пропокси)-бензоил]-2-метил-5-метилсульфонамидо-бензофурана (SR 34144) (пример 63)
Т.пл. 163oC (этанол).
Чистота: 99,75%
Толуолсульфонат 3-[4-(ди-н-3-бутиламино-пропокси)-бензоил] -2-изопропил-5-метилсульфонамидо-бензофурана (SR 34153 А) (пример 64)
Т.пл. 128oC (изопропанол).
3-[4-(Ди-n-3-бутиламино-пропокси)-бензоил] -n-2-бутил-n-5-бутилсульфонамидо-бензофуран (SR 34193) (пример 65)
Т.пл. 78oC.
Чистота: 99,82%
Хлоргидрат n-2-бутил-3-[4-(ди-н-3-бутиламино-пропокси)-бензоил]-5-трифторметилсульфонамидо-бензофурана (SR 34099) (пример 66)
Т.пл. 50-55oC.
Чистота: 99,4%
Кислый фумарат n-2-бутил-3-[4-(ди-n-3-бутиламино-пропокси)-бензоил]-5-тозиламино-бензофурана (SR 34088 А) (пример 67)
Т.пл. 110oC (изопропанол).
Чистота: 98,24%
n-2-Бутил-3-[4-(н-3-бутиламино-пропокси)-бензоил] -5-метил-сульфонамидо-бензофуран (SR 34174) (пример 68)
Т.пл. 86,4oC.
Чистота: 99,57%
Щавелевокислый 3-[4-(ди-н-3-бутиламино-пропокси)-бензоил]-2-метил-7-метилсульфонамидо-бензофуран (SR 34436 А) (пример 69)
Т.пл. 135oC (метилэтилкетон).
Чистота: 99,1%
3-[4-(ди-н-3-бутиламино-пропокси)-бензоил] - -5-бисметилсульфонамидо-n-2-бутил-бензофуран (SR 34477) (пример 70)
Т.пл. 56oC (гексан).
Чистота: 99,7%
3-[4-(Ди-н-3-бутиламино-пропокси)-бензоил] -5-бисметилсульфонамидо-n-2-пропил-бензофуран (SR 34555) (пример 71)
Т.пл. 57oC (пентан).
Чистота: 99,8%
3-[4-(Диэтиламино-пропокси)-бензоил] -n-2-бутил-5-бисметилсульфонамидо-бензофуран (SR 34505) (пример 72)
Т.пл. 83oC.
Чистота: 98,9%
p-Толуолсульфонат-3-[4-(ди-н-2-бутиламино-этокси)-бензоил]-5-бисметилсульфонамидо-n-2-бутил-бензофурана (пример 73)
Т.пл. 142oC (этилацетат).
Чистота: 98,42%
3-[4-(Ди-н-5-бутиламино-пентокси)-бензоил] -5-бисметилсульфонамидо-n-2-бутил-бензофуран (SR 34343) (пример 74)
Т.пл. 84oC.
Чистота: 97,1%
3-[4-Ди-н-3-бутиламино-пропокси)-бензоил] -7-биометилсульфонамидо-2-метил-бензофуран (SR 34403) (пример 75)
Т.пл. 108oC.
Чистота: 96,7%
2-[4-(Ди-н-3-бутиламино-пропокси)-бензоил] - -5-бисметилсульфонамидо-3-метил-бензофуран (SR 33602) (пример 76)
Т.пл. 125oC (метанол).
Чистота: 99
p-Толуолсульфонат 3-[4-(ди-н-3-бутиламино-пропокси)-бензоил]-5-бисметилсульфонамидо-2-изопропил-бензофурана (SR 34154) (пример 77)
Т.пл. 142oC (изопропанол).
Чистота: 98%
3-[4-(Ди-n-5-бутиламино-пентокси)-бензоил] -n-2-бутил-5-метилсульфонамидо-бензофуран (SR 34492) (пример 78).
Т.пл. 55oC.
Чистота: 96,21
Диоксалат 3-[4-(ди-н-3-бутиламино-пропокси)-бензоил]-2-этил-5-метилсульфонамидо-бензофурана (SR 34536 А) (пример 79)
Т.пл. 111oC (этилацетат).
3-[4-(Ди-н-3-бутиламино-пропокси)-бензоил] -п-2-пропил-5-метилсульфонамидо-бензофуран щавелевокислый (пример 80)
Т.пл. 145-147oC.
3-[4-(3-диэтиламино-пропокси)-бензоил] -n-2-бутил-5-метилсульфонамидо-бензофуран (SR 34523) (пример 81)
Т.пл. 65oC.
Чистота: 96,33%
Хлоргидрат 2-[4-(ди-н-3-бутиламино-пропокси)-бензоил]-3-метил-5-метилсульфонамидо-бензофурана (SR 34474 А) (пример 82)
Т.пл. 90oC.
Чистота: 99,6%
p-Толуолсульфонат 3-[4-(ди-н-3-бутиламино-пропокси)-бензоил]-2-изопропил-5-метилсульфонамидо-бензофурана (пример 83)
Т.пл. 128oC (изопропанол).
Чистота: 99%
Дихлоргидрат 5-амино-3-{4-[N-метил-N-(3,4-диметокси-b-фенэтил)-3-амино-пропокси]-бензоил}-2-этил-бензотиофена (SR 34453 А) (пример 84)
Выход: 81,2%
Т.пл. 138oC (диэтиловый эфир).
Хлоргидрат 3-[4-(ди-н-3-бутиламино-пропокси)-бензоил]-2-этил-5-метилсульфонамидо-бензотиофена (SR 34413 А) (пример 85)
Т.пл. 94oC.
Хлоргидрат 3-{4-[N-метил-N-(3,4-диметокси-b-фенэтил)-3-аминопропокси]-бензоил}-2-этил-5-метилсульфонамидо-бензотиофена (SR 34463 A) (пример 86)
Т.пл. около 110oC (диэтиловый эфир/тетрагидрофуран).
Хлоргидрат 3-[4-(ди-н-3-бутиламино-пропокси)-бензоил]-n-2-бутил-5-метилсульфонамидо-бензотиофена (SR 34489) (пример 87)
Т.пл. около 82oC (диэтиловый эфир).
Полуторный оксалат 5-амино-2-{4-[N-метил-N-(3,4-диметокси-b-фенэтил)-3-амино-пропокси]-бензоил}-n-3-бутил-бензотиофена (SR 34340 А) (пример 88)
Т.пл. около 120oC (этилацетат/этанол 7/3).
Хлоргидрат 2-[4-(ди-н-3-бутиламино-пропокси)-бензоил]-n-3-бутил-5-метилсульфонамидо-бензотиофена (SR 34232 А) (пример 89)
Т.пл. около 90oC (диэтиловый эфир).
Оксалата4-[N-метил-N-(3,4-диметокси-b-фенэтил)-3-амино-пропокси]-бензоил}-n-3-бутил-5-метилсульфонамидо-бензотиофен (SR 34371 А) (пример 90)
Т.пл. 136oC (этилацетат/изопропанол 9/1).
Оксалат 5-амино-3-{ 4-[N-метил-N-(3,4-диметокси-b-фенэтил)-3-амино-пропокси]-бензоил}-n-2-бутил-1-метил-индола (SR 34225 А) (пример 91)
Т.пл. 188oC (этанол).
Фумарат 3-{ 4-[N-метил-N-(3,4-диметокси-b-фенэтил)-3-амино-пропокси] -бензоил}-n-2-бутил-1-метил-5-метипсульфонамидо-индола (SR 34291) (Пр. 92)
Т.пл. 166oC (этилацетат).
Метансульфонат 5-амино-3-[4-(ди-н-3-бутиламино-пропокси)-бензоил]-n-2-бутил-ди-n-1-бутиламинопропил-индола (SR 34294 А) (пример 93)
Гигроскопичен.
Т.пл. около 85oC (диэтиловый эфир).
2-[4-(Ди-n-3-бутиламино-пропокси)-бензоил] -н-3-бутил-5-нитро-индол (SR 34358) (пример 94)
Т.пл. 80oC (гептан).
Диоксалат 2-[4-(ди-н-3-бутиламино-пропокси)-бензоил]-n-3-бутил-ди-n-1-бутиламинопропил-5-нитро-индола (SR 34359 А) (пример 95)
Т.пл. 79oC (изопропанол/диэтиловый эфир).
Метансульфонат 2-[4-(ди-н-3-бутиламино-пропокси)-бензоил]-n-3-бутил-1-метил-5-нитро-индола (SR 34305 А) (пример 96)
Т.пл. 115oC (этилацетат).
Оксалат 3-[4-(ди-н-3-бутиламино-пропокси)-бензоил]-2-этил-1-метил-4-нитро-индола (SR 34532 А) (пример 97)
Т.пл. около 84oC.
Оксалат 3-{4-N-метил-N-(3,4-диметокси-b-фенэтил)-3-амино-пропокси]-бензоил}-Н-2-бутил-1-метил-5-нитро-индола (SR 34230 А) (пример 98)
Т.пл. около 80oC (изопропанол).
3-[4-(Ди-n-3-бутиламино-пропокси)-бензоил] -н-2-бутил-ди-n-1-бутиламинопропил-5-метансульфонамидо-индол (SR 34304 А) (пример 99)
Т.пл. 81oC (гексан).
3-[4-(Ди-н-3-бутиламино-пропокси)-бензоил] -н-2-бутил-ди-n-1-бутил-аминопропил-5-трифторметилсульфонамидо-индол (SR 3434) (пример 100)
Т.пл. 142oC (гептан/этилацетат).
3-[4-(Ди-н-3-бутиламино-пропокси)-бензоил] -1-метил-2-фенил-5-метилсульфонамидо-индол (SR 34451) (пример 151)
Т.пл. 116oC (диэтиловый эфир).
Оксалат-5-амино-3-{ 4-[N-метил-N-(3,4-диметокси-b-фенэтил)-3-амино-пропокси]-бензоил}-н-2-бутил-1-метил-индол (SR 34225 А) (пример 102)
Т.пл. 188oC (этанол).
Дихлоргидрат-5-амино-3-[4-(ди-н-3-бутиламино-пропокси)-бензоил] -1-метил-2-фенил-индола (SR 34443 А) (пример 103)
Т.пл. 154oC (диэтиловый эфир).
Оксалат 5-амино-2-[4-(ди-н-3-бутиламино-пропокси)-бензоил] -n-3-бутил-1-метил-индола (SR 34333 А) (пример 104)
Т.пл. 110oC (изопропанол).
Трихлоргидрат 5-амино-2-[4-(ди-н-3-бутиламино-пропокси)- бензоил]-n-3-бутил-ди-n-1-бутиламинопропил-индола (SR 34449 А) (пример 105)
Т.пл. 130oC (диэтиловый эфир).
Фумарат 2-[4-(ди-н-3-бутиламино-пропокси)-бензоил] -n-3-бутил-1-метил-5-метилсульфонамидо-индола (R 34227 А) (пример 106)
Т.пл. около 85oC (этанол/диэтиловый эфир).
Оксалат 3-[4-(ди-Н-3-бутиламино-пропокси)-бензоил] -n-2-бутил-1-(4-метил-бензолсульфонил)-индола (SR 34376 А) (пример 107)
Т.пл. 98oC (диэтиловый эфир).
4-амино-3-[4-(ди-н-3-бутиламино-пропокси)-бензоил]-2-этил-1-метил-индол.
Оксалат: т. пл. 86oC (диэтиловый эфир) (пример 108) 3-[4-(Ди-n-3-бутиламино-пропокси)-бензоил] -2-этил-1-метил-4-метил-сульфонамидо-индол (пример 109)
Т.пл. 150oC (этилацетат/изопропанол).
Оксалат-2-фенил-3-[4-(ди-n-3-бутиламино-пропокси)-бензоил]-7-карбэтокси-индолизина (SR 34400 А) (пример 110)
Т.пл. 148-151oC (этилацетат/метанол).
Хлоргидрат 2-фенил-3-[4-(ди-н-3-бутиламино-пропокси-бензоил]-7-карбокси-индолизина (SR 34401 А) (пример 111)
Т.пл. 222-224oC (этилацетат/метанол).
Оксалат 2-фенил-3-[4-(ди-н-3-бутиламино-пропокси)-бензоил]-7-бензилоксикарбамоил-индолизина (SR 34402 А) (пример 112)
Т.пл. 177-178oC (этилацетат/метанол/диэтиловый эфир).
2-фенил-3-[4-(ди-n-3-бутиламино-пропокси)-бензоил]-7-амино-индолизин (SR 34408) (пример 113)
Т.пл. 102-103oC (гексан).
Хлоргидрат 2-фенил-3-[4-(ди-n-3-бутиламино-пропокси)-бензоил] -7-метилсульфонамидо-индолизин (SR 34417 А) (пример 114)
Т.пл. 190-191oC (этилацетат/метанол).
n-2-бутил-3-[4-(ди-н-3-бутиламино-пропокси)-бензоил] -N-7-метил-карбоксамидо-индолизин (SR 34330) (пример 115)
Т.пл. 94oC (гексан/дихлорметан).
Щавелевокислый н-2-бутил-3-[4-(ди-н-3-бутиламино-пропокси)-бензоил]-7-пирролидинокарбонил-индолизин (SR 34329 А) (пример 116)
Т.пл. 143-144oC (этилацетат/дихлорметан).
Оксалат 2-фенил-3-{ 4-[N-метил-N-(3,4-диметокси-b-фенэтил)-3-амино-пропокси]-бензоил}-7-карбэтокси-индолизина (SR 34484 А) (пример 117)
Т.пл. 162oC (метанол).
2-фенил-3-[3-(ди-н-3-бутиламино-пропокси)-бензоил] -7-карбокси-индолизин (SR 34515 A) (пример 118)
Т.пл. (хлоргидрат): 210-215oC (этилацетат/метанол).
Хлоргидрат фенил-3-{ 4-[N-метил-N-(3,4-диметокси-b-фенэтил)-3-амино-пропокси]-бензоил}-7-карбокси-индолизина (SR 34506 A) (пример 119)
Т.пл. 128-130oC (этилацетат/метанол).
Оксалат n-2-бутил-3-[4-(ди-н-3-бутиламино-пропионамидо-бензоил]-5-метил-сульфонамидо-бензофуран (SR 34335 A) (пример 120)
Т.пл. 162oC (метанол/диэтиловый эфир).
Оксалат n-2-бутил-3-[4-(ди-н-3-бутиламино-пропокси)-бензоил] -7-метилсульфонамидо-бензофурана (пример 121)
Т.пл. 81oC (изопропанол/диэтиловый эфир).
Чистота: 96,1%
Оксалат n-2-бутил-3-[4-(ди-н-3-бутиламино-пропокси)-3,5-дитретбутилбензоил]-5-метилсульфонамидо-бензофурана (пример 122)
Оксалат 2-фенил-3-[4-(ди-n-3-бутиламино-пропокси)-бензоил] -6-метилсульфонамидо-индолизина (пример 123) (SR 34203 А)
Желтый аморфный порошок.
Хлоргидрат 2-фенил-3-{ 4-[N-метил-N-(3,4-диметокси-b-фенэтил)-3-амино-пропокси)-бензоил} -7-метилсульфонамидо-индолизина (пример 124) (SR 34552 A)
Т.пл. 110oC (метанол/вода).
Оксалат 2-фенил-3-[4-(ди-n-3-бутиламино-пропокси)-бензоил] -7-карбэтокси-индолизина (пример 125) (SR 34547 A)
Желтый аморфный порошок.
7-Амино-3-[4-(ди-н-3-бутиламино-пропокси)-бензоил] -n-2-бутил-индолизин (пример 126) (SR 34399)
Т.пл. 88-89oC (n-гексан).
3-[4-(Ди-n-3-бутиламино-пропокси)-бензоил] -n-2-бутил-7-толил-сульфонамидо-индолизин (SR 34428) (пример 127)
Желтый аморфный порошок.
7-Амино-3-{ 4-[N-метил-N-(3,4-диметокси-b-фенэтил)-3-амино-пропокси] -бензоил}-2-фенил-индолизин (SR 34548) (пример 128)
Т.пл. 115-117oC (дихлорметан/метанол).
Оксалат n-2-бутил-3-{ 4-[N-метил-N-(3,4-метокси-b-фенэтил)-3-амино-пропокси)-бензоил}-7-бисметилсульфонамидо-индолизина (пример 129) (SR 34509 A)
Аморфный порошок.
Полуторный оксалат n-2-бутил-3-{4-[N-метил-N-(3,4-диметокси-b-фенэтил)-3-амино-пропокси] -бензоил} -7-метилсульфонамидо-индолизина (пример 130) (SR 34534 A)
Желтый аморфный порошок.
Хлоргидрат 2-фенил-3-[2-(ди-n-3-бутиламино-пропокси)-бензоил] -7-карбэтокси-индолизина (пример 131) (SR 34550 A)
Т.пл. 216-218oC (этилацетат/метанол).
Оксалат 2-фенил-3-[3-(ди-n-3-бутиламино-пропокси)-бензоил] -7-карбэтокси-индолизина (пример 132) (SR 34507 A)
Желтый аморфный порошок.
Пример 133. По известной в фармацевтике технологии была приготовлена капсула, содержащая следующие ингредиенты:
Ингредиент мг
Изобретенное соединение 100,0
Крахмалы 99,5
Коллоидальный кремнезем 0,5
200,0
Пример 134. По известной в фармацевтике технологии получают капсулы, каждая из которых содержит:
Соединение по изобретению 100,00 мг
Модифицированный кукурузный крахмал 138,50 мг
Тальк 50,00 мг
Безводный коллоидный оксид кремния 1,25 мг
Стеарат магния 2,50 мг
Микронизированная лактоза Вв количестве, достаточном для заполнения капсулы до 500 мг
Каждая капсула содержит 100 мг активного начала.
Пример 135 на биологическую активность соединений согласно изобретению. Соединения согласно изобретению испытывали на антиадренэргическую активность анти-a- и анти- b-типа. Методика испытаний описана выше. Были получены следующие результаты: 3-[4-(3-ди-н.бутиламино-пропокси)-бензоил]-2-н.бутил-1-(4-метил-бензолсульфонил)-индол-оксалат (пример 107). Анти-a- и анти-b-эффекты представлены в табл. 8.
2-н-Бутил-3-[4-(3-ди-н-бутиламино-пропионамидо)-бензоил] -5-аминобензофуран-диоксалат (пример 7)
1) Влияние на потенциальную продолжительность действия
доза: 10 мг/кг
D.P.A. 31%
2) анти-a- и анти-b-эффекты представлены в табл. 9.
3-[4-(5-ди-н-бутиламино-пентокси)бензоил] -2-н-бутил-5-метилсульфонамидо-бензофуран (пример 78)
Эффекты анти-a и анти-b представлены в табл. 10.
Далее испытывали соединения по изобретению на удлинение потенциальной продолжительности действия (D.P.A.) по методике, приведенной выше. Получили результаты, приведенные в табл. 11, 12.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ АМИНОФЕНОКСИПРОИЗВОДНЫХ | 1990 |
|
RU2032669C1 |
| Способ получения производных индолизина или их фармацевтически приемлемых солей | 1987 |
|
SU1528321A3 |
| Способ получения производных индолизина или их солей | 1977 |
|
SU674674A3 |
| Способ получения производных метилендифосфоновой кислоты | 1983 |
|
SU1333240A3 |
| Способ получения производных индолизина или их солей с органической или неорганической кислотой | 1983 |
|
SU1194272A3 |
| Способ получения производных метилендифосфоновой кислоты | 1984 |
|
SU1367859A3 |
| Способ получения производных индолизина или их солей | 1977 |
|
SU715025A3 |
| Способ получения производных индолизина или их солей | 1981 |
|
SU1109051A3 |
| Способ получения производных метилендифосфоновой кислоты | 1986 |
|
SU1410865A3 |
| Способ получения производных пиридазина | 1982 |
|
SU1356960A3 |
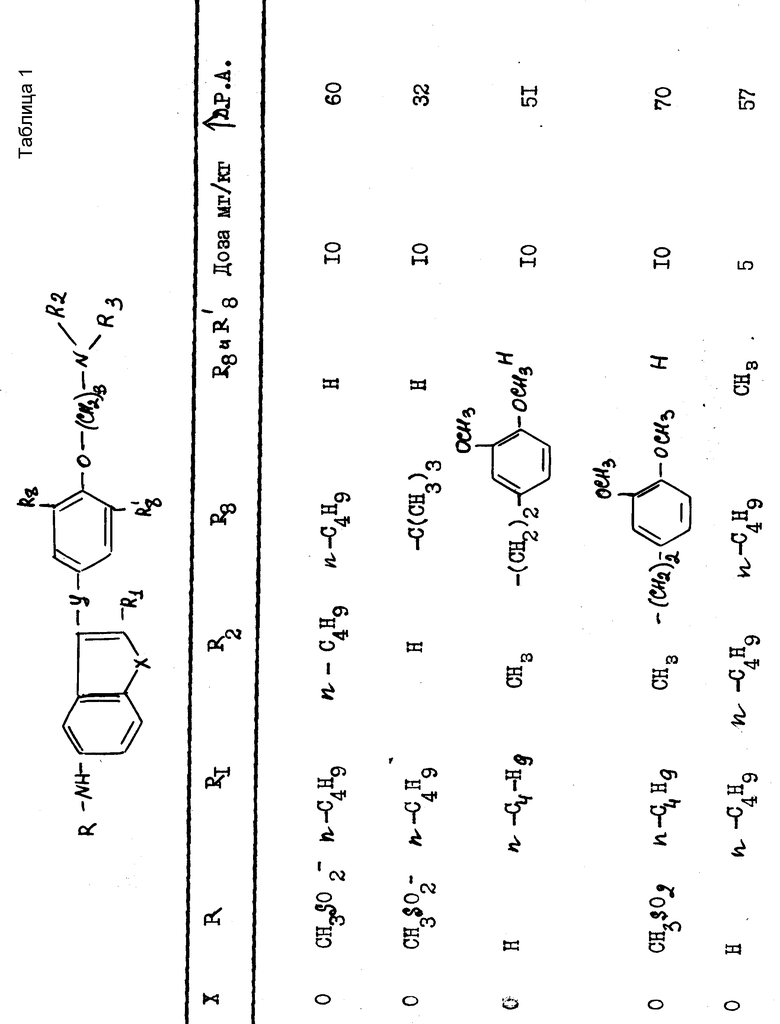
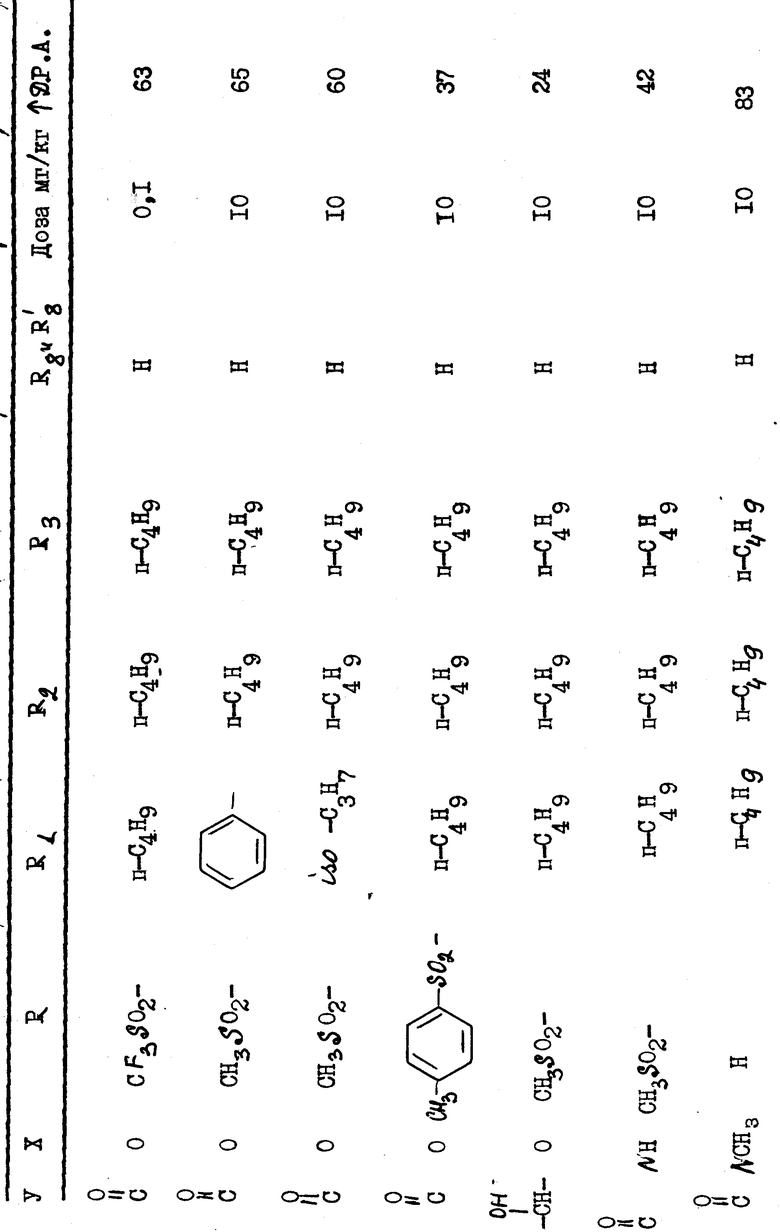
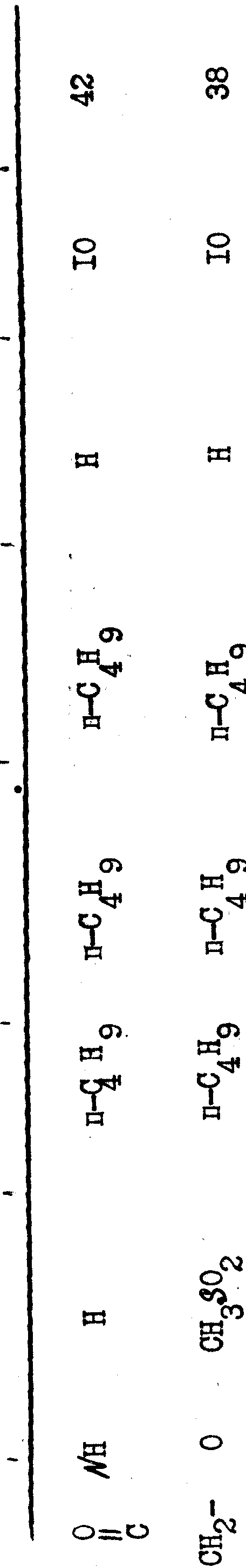
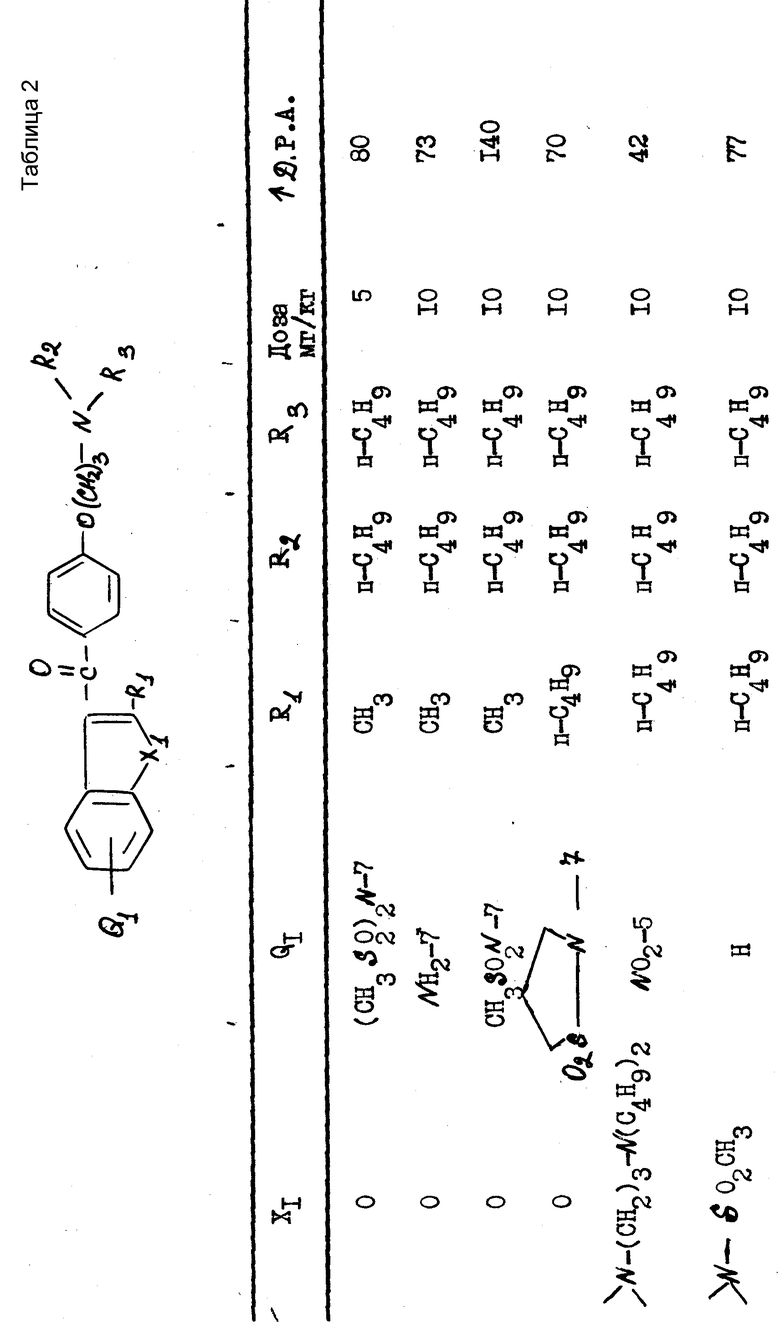
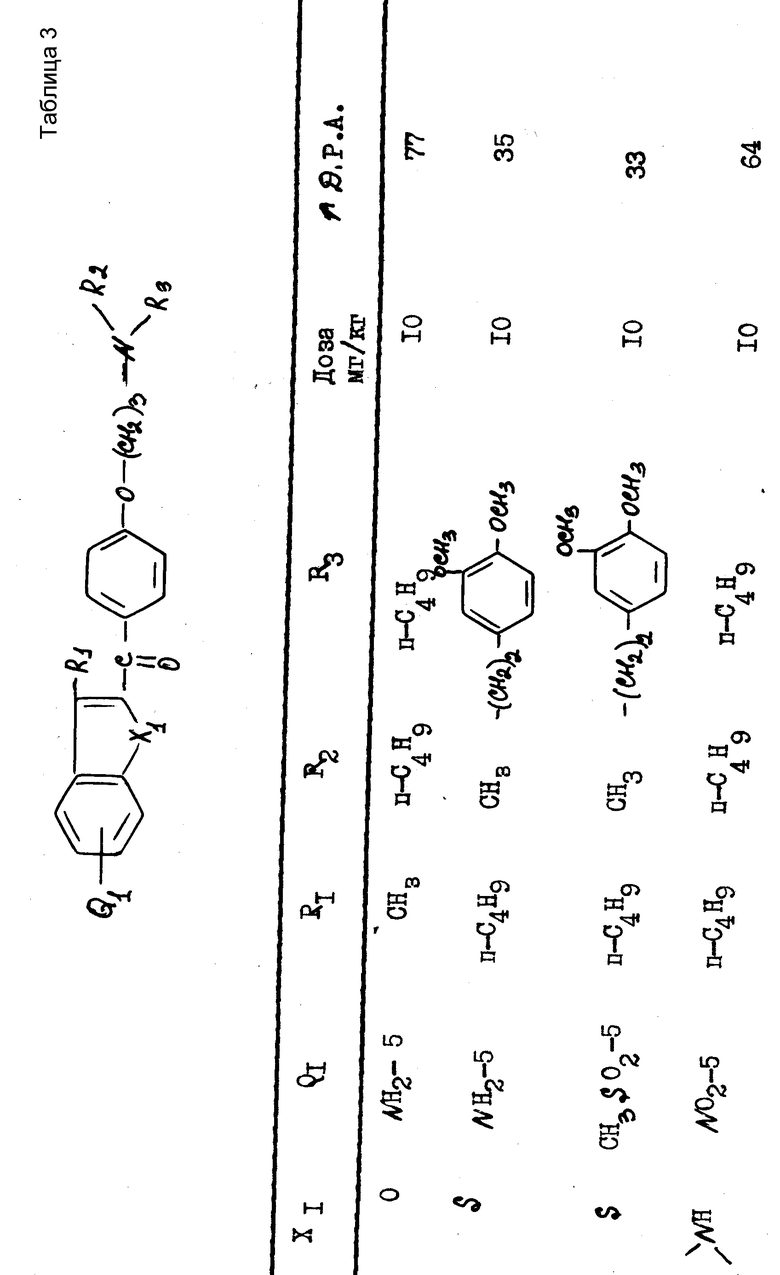
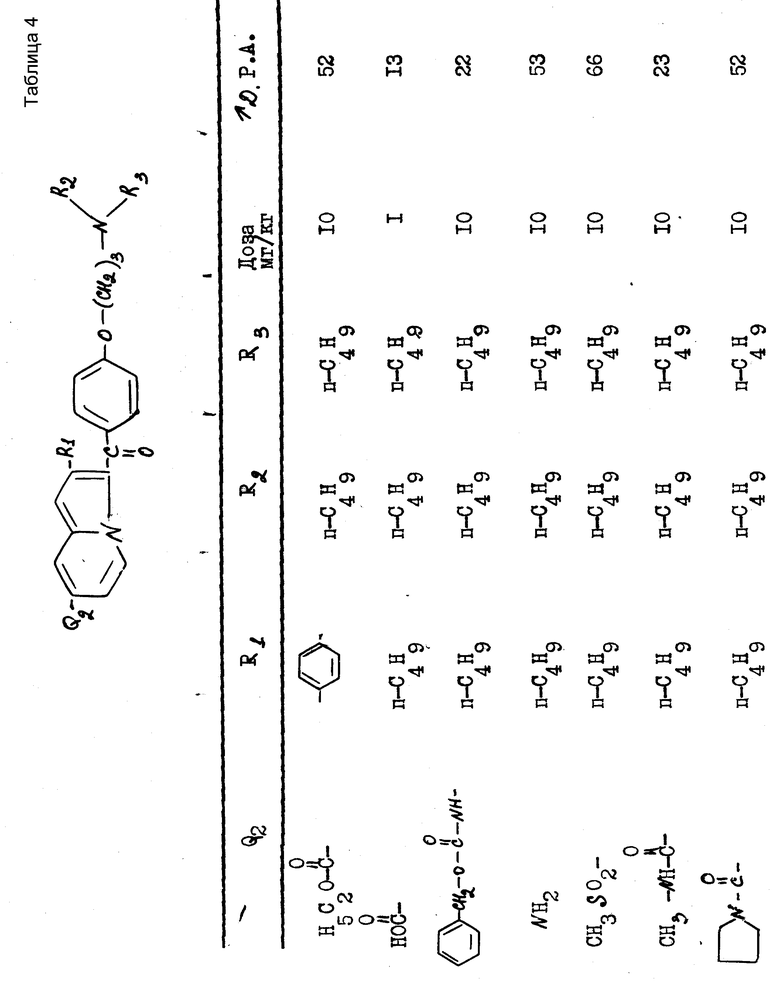
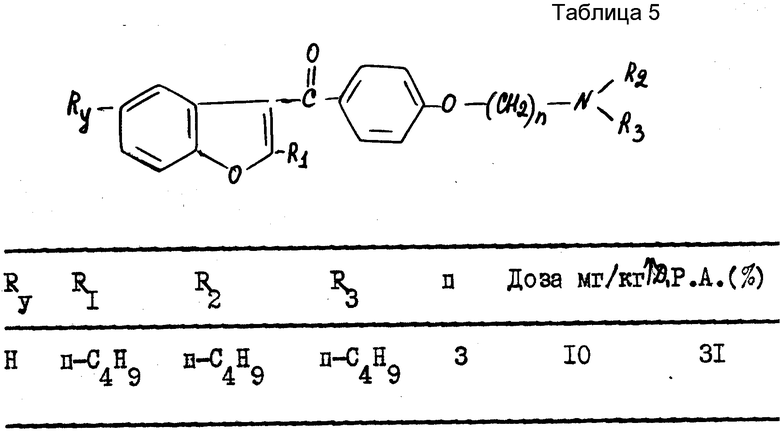
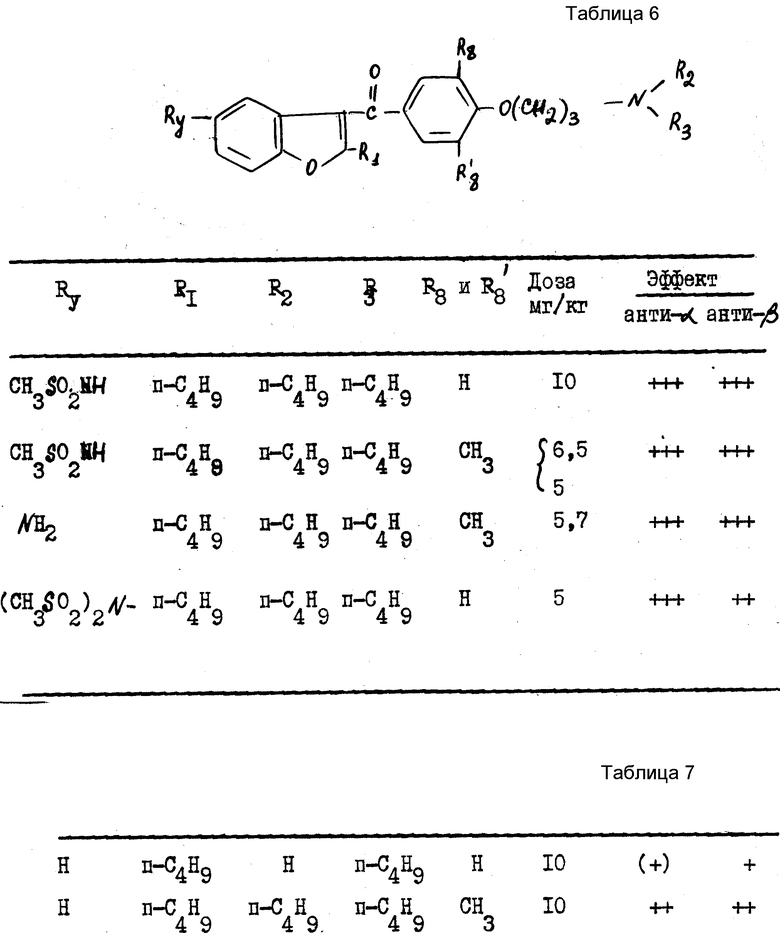

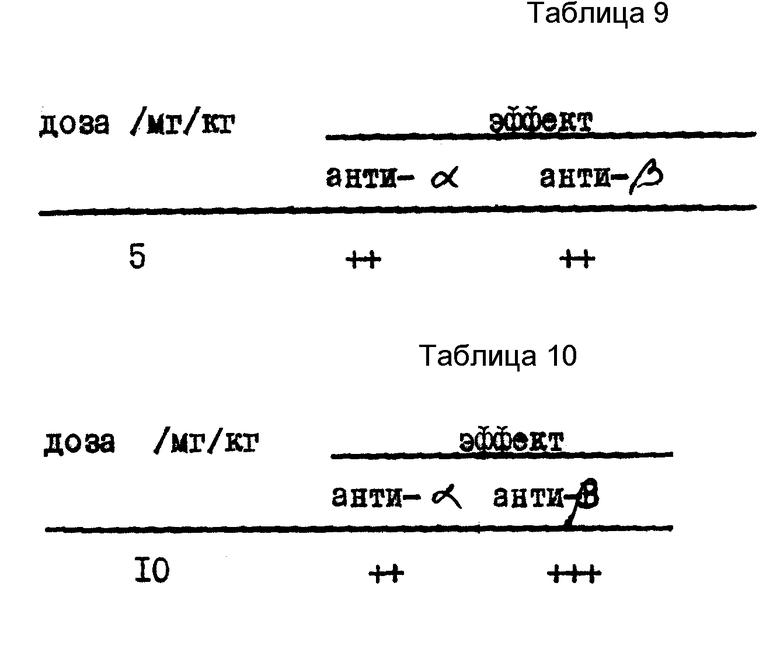
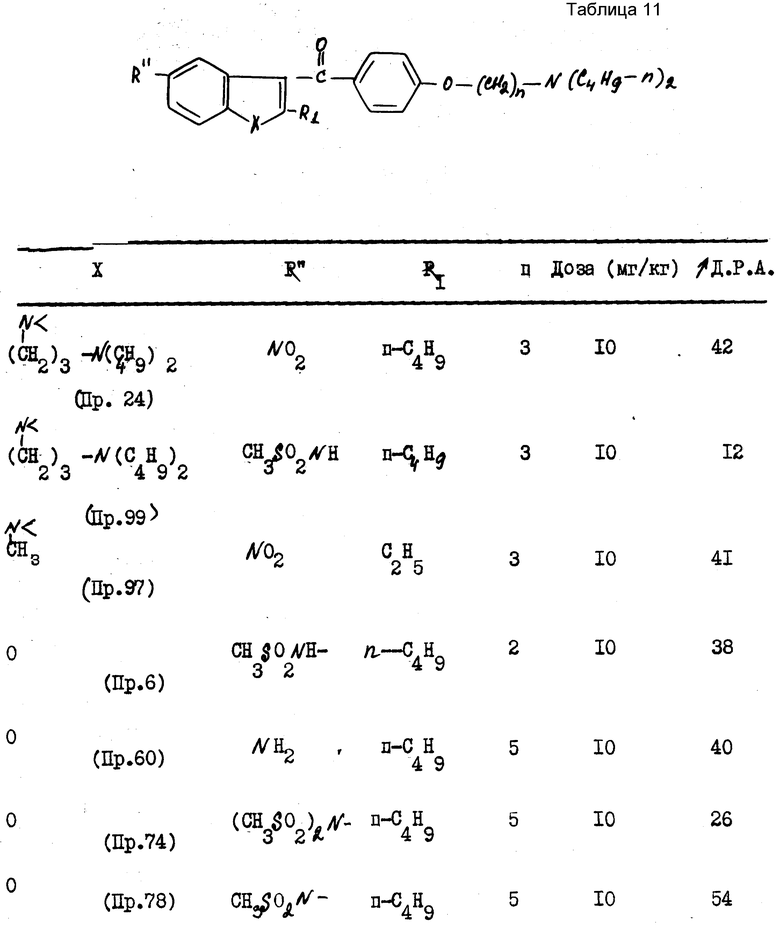
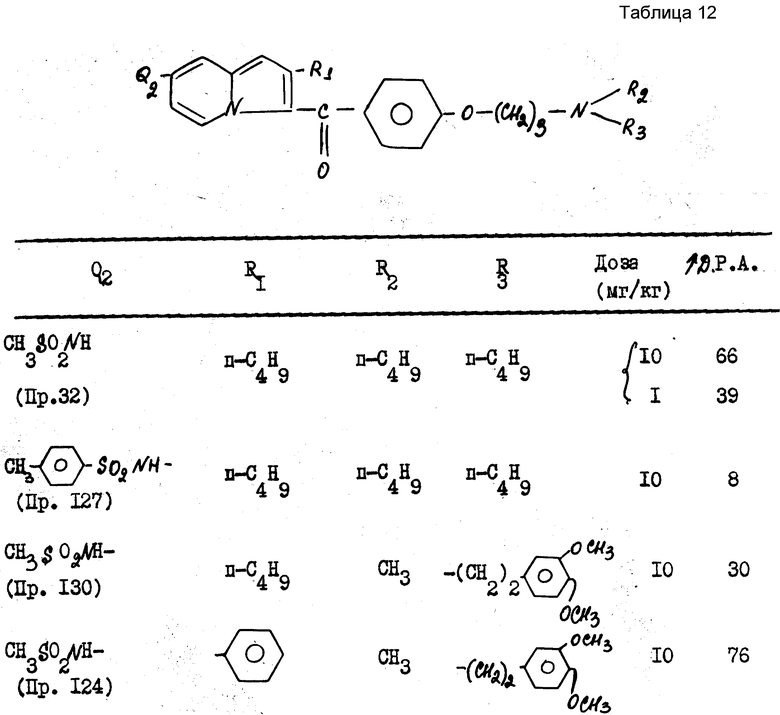
Использование: в медицине для лечения стенокардии. Сущность изобретения: продукт - производные бензофурана, бензотиофена, индола или индолизина ф-лы
где R2, R3 = H, C1-C6 алкил; n = 2-5; Геt = замещенные или нет
где X = O; S; A = O; NH-C(O)-; Y=-C(O)-; -CH(OH)-; -CH2-;
Реагент 1: 
Реагент 2: 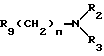 , где R9 - галоид, n = 2-5. 7 с. и 8 з.п. ф-лы, 12 табл.
, где R9 - галоид, n = 2-5. 7 с. и 8 з.п. ф-лы, 12 табл.
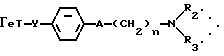
в которой Гет одна из групп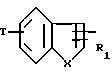
или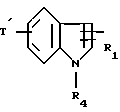
или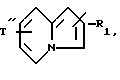
в которых Т обозначает группу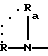
в которой R и Ra одинаковые или разные и обозначают водород, радикал -SO2R1, в котором R1 обозначает линейный или разветвленный алкильный радикал с С1 С6, трифторметильный радикал, фенильный радикал, возможно замещенный алкильным радикалом с С1 C4; причем Ra и R с атомом азота могут образовывать сульфонамидную группу или 1,1-диоксо-изотиазолидин-1,2-ильный цикл;
Т' водород, нитрогруппа, группа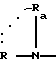
в которой R и Ra одинаковые или разные и означают водород, радикал -SO2R1, в котором R1 алкил С1 С6, линейный или разветвленный; Т" группа бензилоксикарбониламино, группа формулы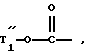
в которой T"1 водород или С1 С4-алкил; группа формулы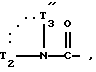
в которой T"2 и T"3 одинаковые или разные и означают водород или С1 С4-алкил или T"2 и T"3 образуют с атомом азота, с которым они соединены, цикл с 4 6 атомами углерода; группа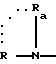
в которой R и Ra одинаковые или разные и означают водород, радикал SO2R1, где R1 алкил С1 С6, линейный или разветвленный, или фенил, возможно замещенный алкилом С1 С4;
Х -О- или -S-
Y радикал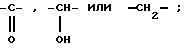
R1 алкил С1 С6 или фенил;
R2 водород, алкил С1 С6, линейный или разветвленный; R3 линейный или разветвленный алкил С1 - С6, радикал формулы Alk R6, в которой Alk линейный или разветвленный алкиленовый радикал С1 С5, R6 фенил, замещенный одним или несколькими алкоксильными группами С1 С4;
R4 водород, алкильный радикал С1 С4, радикал SO2R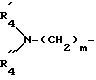
в котором R'4 и R"4 одинаковые или разные и обозначают алкильный радикал С1 С4, m число 1 3;
А -O- или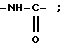
n 2 5, при условии, что когда R4 радикал -SO2R'1, T' обозначает водород, нитрогруппу,
также, как их фармацевтически совместимые соли.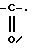
4. Производные формулы I по одному из пп.1 4, в которой А атом O.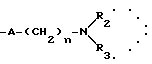
находится в положении 4.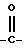
T, T' или T" группа R'-SO2-NH, в которой R' имеет те же значения, что указаны в п. 1, и Гет, Х, Y, R2, R3 и А имеют значения, указанные в п.1, отличающийся тем, что вводят в реакцию соединение формулы I по п.1, в котором R и Ra каждый является водородом с одним или двумя эквивалентами галогенида общей формулы
Гал-SO2-R'2,
или с ангидридом общей формулы (R'SO2)2O, в которой R' имеет значение, указанное в п.1, а Гал является атомом галогена, реакцию проводят в присутствии акцептора кислоты и в среде подходящего органического растворителя, при этом получают в виде свободного основания целевые соединения, которые при желании вводят в реакцию с органической или неорганической кислотой с получением фармацевтически приемлемой соли этих производных.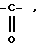
T, T' или T" является группой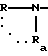
в которой R имеет указанные значения и Ra является алкилом, Гет, Х, Y, R2, R3, и А имеет указанные в п.1 значения, отличающийся тем, что проводят реакцию в щелочной среде соединения формулы I по п.1, в котором R имеет указанное значение и Ra является водородом с одним или двумя эквивалентами галогенида общей формулы R'a-Гал,
в которой Гал является атомом галогена, а R'a является алкилом С1, при этом получают в виде свободного основания целевые соединения, которые при желании вводят в реакцию с органической или неорганической кислотой с получением фармацевтически приемлемой соли этих производных.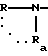
Y является группой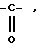
А является -O-, отличающийся тем, что конденсируют при 90 110oС в среде подходящего растворителя кетон общей формулы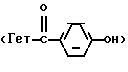
в которой Гет означает группу формулы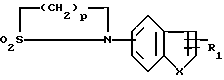
в которой R1, X и p имеют те же значения, что и в п.1, с соединением общей формулы
в которой R2, R3 и n имеют те же значения, что и в п.1, и R9 является атомом галогена, С1 С4-алкилсульфонилокси или С6 С1 0-арилсульфонилокси, при этом получают целевые соединения в виде свободных оснований, которые при желании вводят в реакцию с органической или неорганической кислотой с получением фармацевтически приемлемой соли.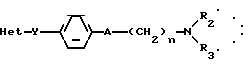
в которой R2, R3, Y, А и n имеют значения, указанные в п.1, и Гет является группой общей формулы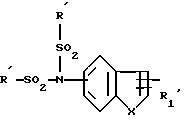
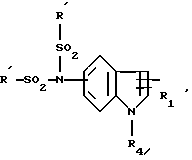
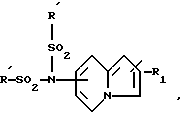
в которой R', R1, R4 и Х имеют те же значения, что указаны в п.1, гидроксидом щелочного металла, при этом получают целевые соединения, которые при желании вводят в реакцию с органической или неорганической кислотой с получением фармацевтически приемлемой соли.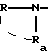
в которой R и Ra имеют указанные значения, и каждый является группой -SO2R', Y является группой
А является группой -O-, отличающийся тем, что проводят реакцию в присутствии основного агента при температуре кипения с обратным холодильником реакционной среды соединения общей формулы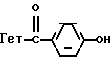
где Гет означает группу формулы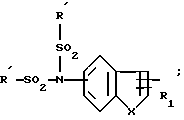
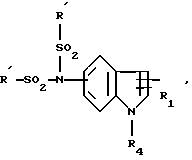
в которой R', R1, R4 и Х имеют те же значения, что указаны в п.1, с соединением общей формулы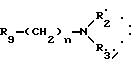
в которой R2, R3 и n имеют указанные в п.1 значения, R9 является атомом галогена, С1 С4-алкилсульфонилокси или С6 С1 0-арилсульфонилокси, при этом получают целевые соединения в виде свободного основания, которое при желании вводят в реакцию с органической или неорганической кислотой с получением фармацевтически приемлемой соли.
| Патент США N 3920707, кл | |||
| ЭЛЕКТРОМЕХАНИЧЕСКИЙ СНЕГООЧИСТИТЕЛЬ ДЛЯ ЖЕЛЕЗНЫХ ДОРОГ | 1922 |
|
SU549A1 |
| Патент США N 3947470, кл | |||
| ЭЛЕКТРОМЕХАНИЧЕСКИЙ СНЕГООЧИСТИТЕЛЬ ДЛЯ ЖЕЛЕЗНЫХ ДОРОГ | 1922 |
|
SU549A1 |
| ЕР, патент N 338746, кл | |||
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
Авторы
Даты
1997-11-10—Публикация
1991-08-05—Подача