Изобретение относится к гетероциклическим соединениям, обладающим ангиотензин II-антагонистической активностью.
Система ренин-ангиотензин (СРА) является протеолитическим (расщепляющим белок) каскадом, играющим основную роль в регулировании кровяного давления, и очевидно, вызывающим начало и способствующим поддержанию некоторых сердечно-сосудистых патологий, таких как гипертония и сердечная недостаточность.
Октапептидный гормонный ангиотензин II (АII)-конечный продукт СРА образуется в основном в крови при разложении ангиотензин-I-энзима экстракта коры надпочечников (энзима ЭКН), который локализуется в эндотелии кровеносных сосудов, легких, почек и многих других органов. Этот гормон оказывает на артерии сильное сосудосужающие воздействие в соответствии с его взаимодействием со специальными рецепторами, присутствующими на этих оболочках.
Одной из форм воздействия на СРА является АII-антагонизм на рецепторном уровне. Некоторые пептидные аналоги АII (например, саралазин, сармезин) известны для полностью антагонистического взаимодействия гормона, но их клиническое и экспериментальное применение ограничивается неполной агонистической активностью и недостатком оральной активности.
Недавно в качестве АII-рецепторных антагонистов были установлены некоторые 5- или 6-членные гетероциклические соединения. Примеры этих соединений патентуются в ЕР 253310, ЕР 323841, ЕР 324377, ЕР 409332, ЕР 411507, ЕР 412594А, ЕР 419048А. Настоящее изобретение относится к гетероциклическим производным, имеющим АII-антагонистические свойства, которые поэтому могут быть использованы для лечения различных сердечно-сосудистых патологий, таких как гипертония, сердечная недостаточность и внутриглазная гипертензия. Соединения изобретения имеют формулу (I):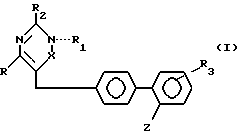
в которой R линейный или разветвленный C1-4-алкил;
R1 водород, линейный или разветвленный C1-4-алкил, арил или арилалкил, где арил-фенил, нафтил, 2-тиенил, необязательно замещенный на один или более галогенов, C1-4-алкил, C1-4-алкокси, гидрокси, карбокси или линейные или разветвленные C1-4-алкоксикарбонил-группы; когда N и X соединены двойной связью, R1 обычно отсутствует;
R2 водород, линейный или разветвленный C1-4-алкил, гидрокси, амино, арил, где арил, как определено выше, или группа общей формулы NHA, где A C2-7-ацил, CN, NO2, CONHB или CSNHB, где B - водород, линейный или разветвленный C1-4-алкил, C3-7-циклоалкил, арил, как определено выше;
R3 водород или один или более атомов галогена;
X CO или C-R4-группа, где R4 OR1 (где R1 должен обычно присутствовать и имеет вышеуказанные значения), арил, необязательно замещенный на карбокси или гидрокси-группы или CH2OR5, где R5 водород, низший алкил, арилалкил, где арилчасть определена выше;
-COOR6 группа, где R6 водород или линейный или разветвленный C1-4-алкил или тетразол-5-ил-группа общей формулы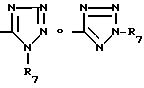
в которой R7 водород или C1-4-алкил, при условии, что если X -CO и R1 H, фенил или фенэтил, R2 не является водородом или алкилом.
Соединения, неохваченные представленной формулой, известны из ЕР 0435827.
Предпочтительными соединениями общей формулы (I) являются соединений, у которых
X CO;
R1 предпочтительно, водород; C1-4-алкил, фенил, бензил, тиенил, фуранил, необязательно, замещенный на карбокси или C1-4-алкоксикарбонил-группы;
R2 предпочтительно, водород; C1-4-алкил, амино, фенил, 2-тиенил, 2-фуранил, необязательно замещенный на карбокси или C1-4-алкоксикарбонил-группы;
R3 предпочтительно водород.
Другой группой предпочтительных соединений является соединения, в которых R2 водород или C1-4-алкил, а R1 C1-4-алкил, фенил, бензил, фуранил или тиенил, необязательно замещенный на карбокси или алкоксикарбонил-группа. Особенно предпочтительными являются соединения, у которых R2-амино. Особенно предпочтительными соединениями являются: 4-бутил-1-[(2-карбоксифенил)метил] -2-метил-5-[[2'-(1Н-тетразол-5-ил)бифенил -4] -метил]-пиримидин-6-он и 2-амино-6-бутил-5-[[2'-(1Н-тетразол-5-ил)бифенил-4-ил]метил]-пиримидин-4-он.
Соединения общей формулы (I) отличается метилбифенил-группой на атоме углерода вместо атома азота, как в известном уровне.
Изобретение включает в себя также фармацевтически приемлемые соли соединения общей формулы (I) с органическими или неорганическими основаниями или кислотами. Эти соли включают в себя аммониевые соли, соли щелочного металла, такого как Na и K, соли щелочно-земельного металла, такого как Ca, Mg, соли органического основания, например, с дициклогексиламином, N-метил-D-глюкамином, с аминокислотами, такими как аргинин, лизин и т.д. Примерами солей с органическими или неорганическими кислотами являются соли с такими кислотами, как например, хлористоводородная, бромистоводородная, серная, фосфорная, метансульфокислота, толуолсульфокислота, малеиновая, фумаровая, камфорсульфокислота и т.д.
Изобретение относится также к способу получения соединения общей формулы (I).
Соединения общей формулы (I), в которой Z-COOR6-группа (R6 C1-4-алкил) или замещенная тетразолил-группа, получаются взаимодействием 1,3-дикарбонилпроизводного или β -кетокислотного производного общей формулы (II).
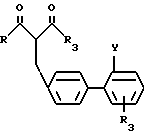
в которой R и R3 такие как определено для общей формулы (I);
R8 и OR9 группа (R9 метил или этил) или CH2OR5-группа, где R5 такой, как определено для общей формулы (I);
Y COOR6-группа, (R6 C1-4-алкил группа) или замещенная тетразолил-5-ил-группа, с соединениями общей формулы (III)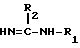
в которой R1 и R2 такие, как определено для общей формулы (I), при условии, что R1 по крайней мере, водород.
Реакция выполняется в протонном растворителе, таком как низший спирт (например, метанол, этанол, изопропиловый спирт), или в воде или в их смеси, или в апротонном растворителе, таком как бензол или толуол, необязательно в присутствии основания, таких как алкоголят (CH3ONa, C2H5ONa, тер-ButOK), гидроокись или карбонат щелочного или щелочно-земельного металла. Температура может изменяться от комнатной до температуры дефлегмации.
Образование гетероцикла может быть выполнено в присутствии кислот, таких как уксусная кислота или хлористоводородная кислота, при температуре от 20 до 80oC. Альтернативно соединения общей формулы (I) получаются из соединений общей формулы (IV)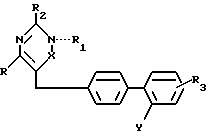
в которой R, R1, R2, R3 такие, как определено выше;
Y COOR6-группа (R6 C1-4-алкил), CN или тетразол-5-ил-группа, замещенная на трифенилметил-группу.
Когда Y является алкоксикарбонильной группой, соединение общей формулы (IV) может быть подвергнуто кислотному (например хлористоводородной, трифторуксусной, муравьиной, уксусной кислотами в протонных растворителях, таких как CH2Cl2, диоксан) или щелочному (гидроокиси калия в водно-спиртовых смесях при температурах от 20 до 80oC), гидролизу.
Когда Y является CN-группой, она может быть гидролизована сильными кислотами или основаниями, предпочтительно смесью 1:1 хлористоводородной кислоты и ледяной уксусной кислоты при нагревании в колбе с обратным холодильником, или NaOH в этаноле или этиленгликоле при температуре от 20oC до температуры кипения. CN-группа может быть превращена в тетразолилпроизводное обработкой NaN3 и NH4Cl в диметилформамиде при температурах от 40 до 120oC, или 1,3-биполярном присоединением триалкил- или триарил-станнилазидов в растворителях, таких как толуол или ксилол при температурах от 110 до 130oC.
Если Y тетразолил-группа, замещенная трифенилметил-группой, последняя может быть удалена обработкой уксусной, тетрафторуксусной или хлористоводородной кислотой или гидрогенолизом.
Соединения общей формулы (IV), в которой R1-водород, могут быть алкилированы в присутствии основания, таких как K2CO3, NaH, NaNH2, бутиллитий, LDA в апротонных полярных растворителях, таких как диметилформамид, (ДМФА), диметилсульфоксид (ДМСО), тетрагидрофуран (ТГФ) при температурах от -20oC до +30oC соединениями общей формулы (V)
X CH2 R1
в которой R1 такой, как определено выше, и X уходящие группы, такие как хлор, бром, иод или мезилат или тозилат-группы.
Соединения общей формулы (IV), в которых X R4, где R4-CH2OCH2-фенил, могут быть переведены в соответствующие гидроксипроизводные каталитическим гидрогенолизом в гидроксильном растворителе, таком как метанол, этанол в присутствии платины или палладия в качестве катализатора.
Соединения общей формулы (IV) получаются взаимодействием соединений общей формулы (II), в которой Y такой, как определено для общей формулы (IV) с соединениями общей формулы (III) в соответствии с ранее описанным способом.
Соединения общей формулы (II) получаются известным алкилированием β -дикетонов или b -кетоэфиров, как указано в примерах.
Описанные здесь соединения имеют антагонистическую активность с АII рецептором.
Были проведены ин-витро-испытания (ингибирование АII-индуцированного взаимодействия в аортах кроликов и 125I-Sar1-Ile8-АТП-замещение в коре надпочечников крыс) и ин-виво-испытание (ингибирование АII-индуцированного изменения кровяного давления у крысы с нормальным кровяным давлением под ганглионарным блоком).
Соединения изобретения являются активными в вышеуказанных испытаниях, например, в испытаниях ин-витро на аортах крыс некоторые соединения показали pA2 выше 6,5.
Соединения общей формулы (I) или их фармацевтически приемлемые соли могут быть использованы в фармацевтических композициях отдельно или в смеси с фармацевтически приемлемыми добавками, для приема внутрь или для парентерального применения. Фармацевтические композиции могут быть в твердой форме, такой как таблетки, капсулы или суппозитории, или в жидкой форме, такой как растворы, суспензии или эмульсии.
Кроме того, в случае парентерального применения фармацевтическая композиция может быть в форме стерильных растворов.
Соединения общей формулы (I) могут применяться в единичных дозах в пределах от 1 до 100 мг к пациентам, страдающим от сердечно-сосудистых патологий, таких как гипертония, острая и хроническая сердечная недостаточность, внутриглазная гипертензия. Также возможно использование в других патологиях, таких как вторичный гиперальдостеронизм, легочная гипертензия, почечные заболевания (гломерулонефрит, диабетическая нефропатия) или сосудистые нарушения (мигрень, синдром Рейнода).
Приведенные далее примеры дополнительно иллюстрируют изобретение.
Точки плавления являются неоткорректированными, структура и чистота соединений определялись элементарным анализом (C, H, N) и УФ-, ИК-, ЯМР- и масс-спектроскопией.
Флэш-хроматография (ФХ) проводилась на силикагеле по методике, описанной в работе W.C.Still, J.Org. Chem. 43, 2923 (1978)
Пример 1. 1-бензокси-2-,4-октадион.
К раствору, содержащему 4,9-метилбензилоксиацетата в 50 мл обезвоженного толуола, было добавлено в атмосфере азота 0,9 г CH3ONa и через 10 мин после него 2 мл 2-гексанона. После 10 ч перемешивания при комнатной температуре было добавлено 10 мл воды и уксусная кислота до pH 5. Толуольная фаза была отделена, а водная фаза была экстрагирована этилацетатом. Органические фазы, объединенные с толуольной фазой, были промыты насыщенным раствором NaCl, высушены над Na2SO4 и выпарены до полного удаления растворителя (досуха). Остаток был очищен ФХ (элюент: смесь 9:1 гексан: AcOEt). Было получено 2,5 г бледно-желтого масла (выход 63%); 1Н-ЯМР (200 МГц, CDCl3) дельта: 0,92 (т. 3Н), 1,22-1,68 (м. 4Н), 2,33 (т. 2Н), 4,07 (с, 2Н), 4,60 (с. 2Н), 5,85 (с, 1Н), 7,30-7,45 (м, 5Н).
Аналогично были получены следующие соединения:
1-бензилокси-2,4-гептадион
1-метокси-2,2-октадион,
1-метокси-2,4-гептадион;
1-[(4-метоксикарбонилфенил)метокси]-2,4-октадион.
Пример 2. 1-бензилокси-3-[(2'-метоксикарбонилбифенил-4-ил)метил]-2,4-октадион.
В суспензию, содержащую 0,16 г 80% NaH в 15 мл обезвоженного ДМФА, было добавлено в атмосфере азота 1,3 г 1-бензилокси-2,4-октадиона, растворенного в 5 мл обезвоженного ДМФА. После бурного выделения пузырьков газа было добавлено 2 г NaJ, после чего к смеси было добавлено по каплям 1,6 г - 4-бромметил-2'-метоксикарбонилбифенила, растворенного в 5 мл обезвоженного ДМФА. После перемешивания в течение 6 ч при комнатной температуре и в течение 6 ч при 70oC растворитель был выпарен, а остаток был обработан водой и экстрагирован Et2O. Органическая фаза была промыта насыщенным раствором NaCl, высушена над Na2SO4 и выпарена до полного удаления растворителя (досуха). Остаток был очищен ФХ (элюент: гексан: AcOEt=75:25). Было получено 1,3 г бледно-желтого масла (выход 52%); Н1-ЯМР (200 МГц, CDCl3) дельта: 0,80 (т. 3Н), 1,08-1,50 (м. 4Н), 2,17 (дт. 1Н), 2,47 (дт. 1Н), 3,03 (дд, 1Н), 3,22 (дд, 1Н), 3,62 (с, 3Н), 3,99 (с, 2Н), 4,19 (т, 1Н), 4,48 (с, 2Н), 7,10-7,55 (м, 12Н), 7,82 (дд, 1Н).
Аналогично были получены следующие соединения:
-1-бензилокси-3-[(2'-метоксикарбонилбифенил-4-ил)метил]-2,4-гептадион;
-1-метокси-3-[(2'-метоксикарбонилбифенил-4-ил)метил]-2,4-октадион;
-1-[(4-метоксикарбонилфенил)метокси]-3-[(2'-метоксикарбонилбифенил-4-ил) метил]-2,4-октадион;
1-бензилокси-3-[(2'-цианобифенил-4-ил)метил]-2,4-октадион,
1-бензилокси-3-[(2'-[N-трифенилметил(1Н-тетразол-5-ил)] бифенил-4-ил] -метил]-2,4-октадион.
Пример 3. Метил-3-оксогептаноат.
59 мл бутиллития 1,6 М в гексане было добавлено в атмосфере азота при 0oC к раствору, содержащему 14 мл диизопропиламина в 200 мл обезвоженного ТГФ.
После 20 мин перемешивания было добавлено по каплям 9,3 мл метилацетацетата, перемешивание было продолжено в течение 30 мин при 0oC, после чего было добавлено по каплям 54 мл бутиллития 1,6М в гексане. Еще через 30 мин к темно-оранжевому раствору было добавлено по каплям 8,4 мл пропилиодида. Температура реакционной смеси достигла комнатной температуры, и через 30 мин к ней было добавлено по каплям при температуре, поддерживающейся при 15oC, 50 мл 37% HCl, разбавленной 100 мл воды. Реакционная смесь была экстрагирована Et2O. Органическая фаза была промыта насыщенным раствором NaCl, высушена над Na2SO4 и выпарена до полного удаления растворителя (досуха). Остаток был очищен ФХ (элюент: AcOEt гексан 1:9). Было получено 8,3 г чистого масла (выход 61% ); 1Н-ЯМР (200 МГц, CDCl3) дельта: 0,90 (т, 3Н), 1,22-1,65 (м,4Н), 2,53 (т,2Н), 3,44 (с,2Н), 3,73 (с,3Н).
Аналогично был получен метил-3-оксогексаноат.
Пример 4. Метил -2-[(2'-метоксикарбонилбифенил-4-ил)метил]-3-оксогептаноат.
2,3 г метил-3-окосгептаноата, растворенного в 10 мл обезвоженного ТГФ, было добавлено по каплям к суспензии, содержащей 0,22 г 80% NaH в 30 мл обезвоженного ТГФ. После бурного выделения пузырьков газа 2,22 г 4-бромметил-2'-метоксикарбонилбифенила, растворенного в 10 мл обезвоженного ТГФ, было медленно добавлено по каплям, к прозрачному раствору. Через 15 мин была добавлена вода, и была добавлена уксусная кислота до кислотного pH. Реакционная смесь была экстрагирована AcOEt. Органическая фаза была промыта насыщенным раствором NaCl, высушена над Na2SO4 и выпарена до полного удаления растворителя (досуха). Остаток был очищен ФХ (элюент: гексан: AcOEt 8:2). Было получено 2,6 г чистого масла (выход 93%); 1Н-ЯМР (200 МГц, CDCl3) d 0,86 (т, 3Н), 1,15-1,62 (м, 3Н), 2,25-2,65 (м, 2Н), 3,20 (д, 2Н), 3,63 (с, 3Н), 3,71 (с, 3Н), 3,84 (т, 1Н), 7,12-7,58 (м, 7Н), 7,78 (дд, 1Н).
Аналогично были получены следующие соединения:
метил-2-[(2'-цианобифенил-4-ил)метил]-3-оксогептаноат;
1Н-ЯМР (CDCl3) d 0,85 (т, 3Н), 1,15-1,63 (м, 4Н), 2,27-2,67 (м, 2Н), 3,22 (д, 2Н), 3,71 (с, 3Н), 3,85 (т, 1Н), 7,23-7,79 (м, 84),
-метил-2-[[2'-[N-трифенилметил-(1Н-тетразол-5-ил)] бифенил-4-ил] -метил] -3-оксогептаноат; 1Н-ЯМР (CDCl3) d 0,84 (т, 3Н), 1,12-1,61 (м, 4Н), 2,18-2,62 (м, 2Н), 3,06 (д, 2Н), 3,66 (с, 3Н), 3,69 (т, 1Н), 6,81-7,52 (м, 22Н), 7,90 (дд, 1Н),
-метил-2-[(2'-метоксикарбонилбифенил-4-ил)метил]-3-оксогексаноат.
-метил-2-[(5'-хлор-2'-метоксикарбонилбифенил-4-ил)метил] -3-оксогептаноат;
-метил-2-[(2'-тербутоксикарбонилбифенил-4-ил)метил]-3-оксогептаноат.
Пример 5. 6-бутил-5-[(2'-метоксикарбонилбифенил-4-ил)метил]пиримидин-4-он.
К раствору, содержащему 0,37 г CH3ONa в 8 мл абсолютного метилового спирта было добавлено в атмосфере азота при охлаждении 0,18 г формамидгидрохлорида, вслед за которым было добавлено 0,87 г метил-2-[(2'-метоксикарбонилбифенил-4-ил)метил] -3-оксогептаноата, растворенного в 2 мл абсолютного метилового спирта. После перемешивания в течение 20 ч при комнатной температуре растворитель был выпарен, остаток был регенерирован H2O и значение pH было доведено до 5 разбавленной HCl. Водная фаза была экстрагирована Et2O, и твердое белое вещество, которое было выделено на границе фаз, было отфильтровано. Было получено 0,45 г (выход 53% т.пл.135-137oC) продукта.
Аналогично были получены следующие соединения:
5-[(2'-метоксикарбонилбифенил-4-ил)метил]-6-пропилпиримидин-4-он;
6-бутил-5-[(2'-метоксикарбонилбифенил-4-ил)метил]-2-метилпиримидин-4-он (т. пл.144-147oC);
4-бензилоксиметил-6-бутил-5-[(2'-метоксикарбонилбифенил-4-ил)метил] -метилпиримидин;
4-бутил-5-[(2'-метоксикарбонилбифенил-4-ил)метил] -6-метоксиметил-2 -метилпиримидин;
4-бутил-5-[(2'-метоксикарбонилбифенил-4-ил)метил] -6-[(4- метоксикарбонилфенил)метоксиметил]-2-метилпиримидин;
6-бутил-5-[(2'-цианобифенил-4-ил)метил]-пиримидин-4-он;
6-бутил-5-[[(2'-[N-трифенилметил-(1Н-тетразол-5-ил)]бифенил-4-ил]метил] пиримидин-4-она;
2-амино-6-бутил-5-[(2'-метоксикарбонилбифенил-4-ил)метил]пиримидин-4-он (т. пл.252-254oC).
6-бутил-2-гидркоси-5-[(2'-метоксикарбонилбифенил-4-ил)метил]пиримидин -4-он;
6-бутил-[(5'-хлор-2'-метоксикарбонилбифенил-4-ил)метил]пиримидин -4-он;
6-бутил-2-цианоамино-5-[(2'-метоксикарбонилбифенил-4-ил)метил] пиримидин-4-он (т.пл. 222-224oC);
6-бутил-5-[(2'-метоксикарбонилбифенил-4-ил)метил]-2- нитроаминопиримидин-4-он;
6-бутил-2-метил-5-[[2'-[N-трифенилметил-(1Н-тетразол-5-ил)] бифенил-4- ил] метил]пиримидин-4-он (т.пл.98-100oC);
2-амино-6-бутил-5-[[2'-(1Н-тетразол-5-ил)бифенил-4-ил]метил] пиримидин-4-он (т.пл.234-236oC).
Пример 6. 4-бутил-6-гидроксиметил-2-метил-5-[(2'-метоксикарбонилбифенил -4-ил)метил]пиримидин.
Раствор, содержащий 0,5 г 4-бензилоксиметил-6-бутил-2-метил-5-[(2' -метоксикарбонилбифенил-4-ил)метил] пиримидина в 50 мл этанола был гидрирован в присутствии 0,1 г 10% палладия на угле при атмосферном давлении и комнатной температуре. После теоретического водородопоглощения реакционная смесь была отфильтрована на целите, и растворитель был испарен с получением 0,38 г светлого масла, которое было непосредственно использовано без дополнительной очистки (выход 95%).
Пример 7. 6-бутил-5-[(2'-карбоксибифенил-4-ил)метил]пиримидин-4-он.
0,13 г NaOH, растворенного в 2 мл воды, было добавлено к раствору, содержащему 0,42 г 6-бутил-5-[(2'-метоксикарбонилбифенил-4-ил)метил]пиримидин-4-она в 10 мл метанола. После кипячения в течение 24 ч с перемешиванием растворитель был выпарен. Остаток был регенерирован водой и экстрагирован Et2O. Водная фаза была подкислена до pH 3. Полученное таким образом воскообразное вещество было обработано смесью H2O:Et2O. После фильтрования было получено 0,35 г белого твердого вещества (выход 88% т.пл. 197-200oC).
Аналогично были получены следующие соединения:
5-[(2'карбоксибифенил-4-ил)метил]-6-пропилпиримидин-4-он;
6-бутил-5-[(2'-карбоксибифенил-4-ил)метил] -2-метилпиримидин-4-он (т. пл. 208-210oC);
- 2-бутил-5-[(2'-карбоксибифенил-4-ил)метил] -6-гидркосиметил-2-метилпиримидин;
- 4-бутил-5-[(2'-карбоксибифенил-4-ил)метил] -2-метил-6-метоксиметилпиримидин;
4-бутил-5-[(2'-карбоксибифенил-4-ил)метил] -6-[(4-карбоксифенил) метоксиметил]пиримидин;
2-амино-6-бутил-5-[(2'-карбоксибифенил-4-ил)метил] пиримидин-4-он (т.пл. 190-195oC);
6-бутил-5-[(2'-карбоксибифенил-4-ил)метил]-2-гидроксипиримидин-4-он;
4-бутил-5-[(2'-карбоксибифенил-4-ил)метил] -1-[(4-карбоксифенил) метил]пиримидин-6-он (т.пл.141-144oC);
1-бензил-4-бутил-5-[(2'-карбоксибифенил-4-ил)метил] пиримидин-6-он (т.пл. 198-200oC);
4-бутил-5-[(2'-карбоксибифенил-4-ил)метил] -1-[(4-гидроксифенил) метил]пиримидин-6-он;
6-бутил-5-[(2'-карбокси-5-хлорбифенил-4-ил)метил]пиримидин-4-он;
4-бутил-5-[(2'-карбоксибифенил-4-ил)метил] -6-[(3-карбокситиен-2 -ил)метокси]-2-метилпиримидин (т.пл.180-185oC, с разложением);
4-бутил-5-[(2'-карбоксибифенил-4-ил)метил]-6-[(3-карбоксифуран-2 -ил)метил] -2-метилпиримидин (т.пл.149-152oC),
4-бутил-5-[(2'-карбоксибифенил-4-ил)метил]-1-[(2-карбоксифенил) метил]пиримидин-6-он (т.пл.185-187oC).
4-бутил-5-[(2-карбоксибифенил-4-ил)метил] -1-[(3-карбокситиен-2-ил) метил] -2-метилпиримидин-6-он (т.пл. 175-178oC, с разложением);
4-бутил-5-[(2'-карбоксибифенил-4-ил)метил]-1-[(3-карбоксифуран-2-ил) метил] -2-метилпиримидин-6-он (т.пл. 143-148oC, с разложением)
4-бутил-5-[(2'-карбоксибифенил-4-ил)метил] -1-[(тиен-2-ил)метил] пиримидин-6-он (т.пл.205-208oC);
6-бутил-5-[(2'-карбоксибифенил-4-ил)метил]-2- цианоаминопиримидин-4-он (т. пл.230-232oC);
6-бутил-5-[(2'-карбоксибифенил-4-ил)метил]-2-нитроаминопиримидин-4-он;
6-бутил-5-[(2'-карбоксибифенил-4-ил)метил] -2- фениламинокарбониламинопиримидин-4-он (т.пл. 229-231oC);
6-бутил-5-[(2'-карбоксибифенил-4-ил)метил] -2- циклогексиламинокарбониламинопиримидин-4-он (т.пл. 234-236oC).
6-бутил-5-[(2'-карбоксибифенил-4-ил)метил] -2- метиламинотиокарбониламинопиримидин-4-он (т.пл. 179-181oC),
2-аминокарбониламино-6-бутил-5-[(2'-карбоксибифенил-4-ил)метил] пиримидин-4-он;
4-бутил-1-[(3-карбокситиен-2-ил)метил]-5-[(2'-(1Н-тетразол-5-ил) бифенил-4-ил)метил]пиримидин-6-он (т.пл. 154-156oC);
4-бутил-1-[(3-карбоксифуран-2-ил)метил] -5-[(2'-(1Н-тетразол-5-ил) бифенил-4-ил)метил]пиримидин-6-он.
4-бутил-5-[(2'-карбоксибифенил-4-ил)метил]-6-[[4-карбоксифенил) метил]пиримидин (т.пл. 208-211oC)
Пример 8. 4-бутил-5-[(2'-метоксикарбонилбифенил-4-ил)метил]-1-[(4-метоксикарбонилфенил)метил]пиримидин-6-он.
0,6 г 6-бутил-5-[(2'-метоксикарбонилбифенил-4-ил)метил]пиримидин-4-она, растворенного в 3 мл обезвоженного ДМФА, было добавлено к суспензии, содержащей 0,05 г 80% NaH в 5 мл обезвоженного ДМФА, при перемешивании и при комнатной температуре.
После бурного выделения пузырьков газа было добавлено 0,7 мл метил-4-бромометилбензоата, растворенного в 2 мл обезвоженного ДМФА. После 3 ч перемешивания растворитель был испарен, а остаток был очищен ФХ (элюент: AcOEt: гексан: 1: 1). Было получено 0,7 г светлого масла (выход 85%); 1Н-ЯМР (200 МГц, CDCl3) d 0,91 (т, 3Н), 1,15-1,65 (м, 4Н), 2,62 (т, 2Н), 3,62 (с, 3Н), 3,91 (с, 3Н), 3,97 (с, 2Н), 5,15 (с, 2Н), 7,12-7,52 (м, 9Н), 7,78 (дд, 1Н), 7,98-8,10 (м, 2Н), 8,07 (с, 1Н).
Аналогично были получены следующие соединения:
1-бензил-4-бутил-5-[(2'-метоксикарбонилбифенил-4-ил)метил]пиримидин -6-он; 1Н-ЯМР (CDCl3) d 0,91 (т, 3Н), 1,20-1,65 (м, 4Н), 2,61 (т, 2Н), 3,61 (с, 3Н), 3,98 (с, 2Н), 5,10 (с, 2Н), 7,15-7,52 (м, 12Н), 7,78 (дд, 1Н), 8,05 (с, 1Н).
4-бутил-1-[(4-гидроксифенил)метил] -5-[(2'-метоксикарбонилбифенил -4-ил)метил]пиримидин-6-он,
4-бутил-5-[(2'-метоксикарбонилбифенил-4-ил)метил] -1- [(2-метоксикарбонилфенил)метил] пиримидин-6-он. 1Н-ЯМР (CDCl3) d 0,91 (т, 3Н), 1,25-1,65 (м, 4Н), 2,63 (т, 2Н), 3,61 (с, 3Н), 3,91 (с, 3Н), 3,97 (с, 2Н), 5,55 (с, 2Н), 7,12-7,57 (м, 10Н), 7,78 (дд, 1Н), 8,03 (дд, 1Н), 8,15 (с, 1Н);
4-бутил-5-[(2'-метоксикарбонилбифенил-4-ил)метил] -1- [(тиен-2-ил)метил] пиримидин-6-он; 1Н-ЯМР (CDCl3) d 0,96 (т, 3Н), 1,15-1,65 (м, 4Н), 2,60 (т, 2Н), 3,62 (с, 3Н), 3,98 (с, 2Н), 5,25 (с, 2Н), 6,89 (дд, 1Н), 7,08-7,53 (м, 9Н), 7,78 (дд, 1Н), 8,08 (с, 1Н),
4-бутил-5-[(2'-метоксикарбонилбифенил-4-ил)метил]-1-[(3- метоксикарбонилтиен-2-ил)метил] -2-метилпиримидин-6-он; 1Н-ЯМР (CDCl3) d 0,90 (т, 3Н), 1,20-1,65 (м, 4Н), 2,47 (с, 3Н), 2,58 (т, 2Н), 3,61 (с, 3Н), 3,90 (с, 3Н), 3,99 (с, 2Н), 5,91 (с, 2Н), 7,08-7,53 (м, 9Н), 7,78 (дд, 1Н);
4-бутил-5-[(2'-метоксикарбонилбифенил-4-ил)метил] -1- [(3-метоксикарбонилфуран-2-ил)метил] -2-метилпиримидин-6-он; 1Н-ЯМР (CDCl3) d 0,90 (т, 3Н), 1,15-1,65 (м, 4Н), 2,47 (с, 3Н), 2,57 (т, 2Н), 3,61 (с, 3Н), 3,88 (с, 3Н), 3,98 (с, 2Н), 5,69 (с, 2Н), 6,9 (д, 1Н), 7,12-7,55 (м, 8Н), 7,78 (дд, 1Н);
4-бутил-1-[(2-метоксикарбонилбифенил)метил]-2-метил-5- [[(2'-[N-трифенилметил-(1Н-тетразол-5-ил)] бифенил-4-ил] метил]пиримидин-6-он; 1Н-ЯМР (CDCl3) d 0,91 (т, 3Н), 1,15-1,65 (м, 4Н), 2,36 (с, 3Н), 2,53 (т, 2Н), 3,85 (с, 2Н), 3,93 (с, 3Н), 5,73 (с, 2Н), 6,75 (дд, 1Н), 6,82-7,10 (м, 8Н), 7,18-7,48 (м, 16Н), 7,75 (дд, 1Н), 8,08 (дд, 1Н);
4-бутил-1-[(3-метоксикарбонилтиен-2-ил)метил]-2-метил-5- [[2'-[N-трифенилметил-(1-тетразол-5-ил)] бифенил-4-ил] метил]пиримидин-6-он; 1Н-ЯМР (CDCl3) d 0,88 (т, 3Н), 1,20-1,65 (м, 4Н), 2,46 (с, 3Н), 2,50 (т, 2Н), 3,86 (с, 2Н), 3,90 (с, 3Н), 5,87 (с, 2Н), 6,80-7,55 (м, 24Н), 7,88 (дд, 1Н),
4-бутил-1-[(3-метоксикарбонилфуран-2-ил)метил] -2-метил-5- [[2'-[N-трифенилметил-(1Н-тетразол-5-ил)] бифенил-4-ил] метил] пиримидин-6-он; 1Н-ЯМР (CDCl3) d 0,90 (т, 3Н), 1,15-1,65 (м, 4Н), 2,46 (с, 3Н), 2,50 (т, 2Н),3,86 (с, 2Н), 3,88 (с, 3Н), 5,66 (с, 2Н), 6,69 (д, 1Н), 6,80-7,55 (м, 23Н), 7,88 (дд, 1Н);
4-бутил-1-[(4-метоксикарбонилфенил)метил] -2-метил-5-[[2'- [N-трифенилметил-(1Н-тетразол-5-ил)] бифенил-4-мл] метил]пиримидин-6-он; 1Н-ЯМР (CDCl3) d 0,91 (т, 3Н), 1,15-1,65 (м, 4Н), 2,36 (с, 3Н), 2,53 (т, 2Н), 3,85 (с, 2Н), 3,93 (с, 3Н), 5,33 (с, 2Н), 6,75 (дд, 1Н), 6,82-7,10 (м, 8Н), 7,18-7,48 (м, 16Н), 7,78 (дд, 1Н), 8,08 (дд, 1Н);
4-бутил-5-[(2'-метоксикарбонилбифенил-4-ил)метил]-6-[(4- метоксикарбонилфенил)метокси]пиримидин; 1Н-ЯМР (CDCl3) d 0,91 (т,3Н), 1,20-1,70 (м, 4Н), 2,77 (т, 2Н), 3,61 (с, 3Н), 3,90 (с, 3Н), 4,08 (с, 2Н), 5,48 (с, 2Н), 7,05-7,55 (м, 9Н), 8,81 (дд, 1Н), 7,93-8,01 (м, 2Н), 8,63 (с, 1Н);
4-бутил-5-[(2'-метоксикарбонилбифенил-4-ил)метил] -6- [(2-метоксикарбонилфенил)метокси] пиримидин; 1Н-ЯМР (CDCl3) d 0,91 (т, 3Н), 1,20-1,70 (м, 4Н), 2,77 (т, 2Н), 3,58 (с, 3Н), 3,86 (с, 3Н), 4,09 (с, 2Н), 5,86 (с, 2Н), 7,06-7,56 (м, 10Н), 7,78 (дд, 1Н), 7,98 (дд, 1Н), 8,63 (с, 1Н);
4-бутил-5-[(2'-метоксикарбонилбифенил-4-ил)метил] -6- [(3-метоксикарбонилтиен-2-ил)метокси] -2-метилпиримидин; 1Н-ЯМР (CDCL3) d 0,89 (т, 3Н), 1,20-1,65 (м, 4Н), 2,59 (с, 3Н), 2,71 (т, 2Н), 3,59 (с, 3Н), 3,87 (с, 3Н), 4,06 (с, 2Н), 5,96 (с, 2Н), 7,12-7,52 (м, 9Н), 7,78 (дд, 1Н);
4-бутил-5-[(2'-метоксикарбонилбифенил-4-ил)метил] -6- [(3-метоксикарбонилфуран-2-ил)метокси] -2-метилпиримидин; 1-Н-ЯМР (CDCl3) d 0,88 (т, 3Н), 1,20-1,65 (м, 4Н), 2,58 (с, 3Н), 2,65 (т, 2Н), 3,60 (с, 3Н), 3,81 (с, 3Н), 3,96 (с, 2Н), 5,71 (с, 2Н), 6,72 (д, 1Н), 7,02-7,55 (м, 8Н), 7,78 (дд, 1Н);
4-бутил-6-[(4-метоксикарбонилфенил)метокси]-2-метил-5- [[2'-[N-трифенилметил-(1Н-тетразол-5-ил)] бифенил-4-ил] метил] пиримидин; 1Н-ЯМР (CDCl3) d 0,86 (т, 3Н), 1,20-1,70 (м, 4Н), 2,56 (с, 3Н), 2,62 (т, 2Н), 3,88 (с, 3Н), 3,90 (с, 2Н), 5,42 (с, 2Н), 6,82-7,03 (м, 8Н), 7,15-7,52 (м, 17Н), 7,85-8,00 (м, 2Н);
4-бутил-6-[(2-метоксикарбонилфенил)метокси]-2-метил-5- [[2'-[N-трифенилметил-(1Н-тетразол-5-ил)] бифенил-4-ил] метил] пиримидин; 1Н-ЯМР (CDCl3) d 0,86 (т, 3Н), 1,15-1,60 (м, 4Н), 2,56 (с, 3Н), 2,62 (т, 2Н), 3,84 (с, 3Н), 3,91 (с, 2Н), 5,80 (с, 2Н), 6,82-7,03 (м, 8Н), 7,15-7,52 (м, 17Н), 7,85-8,00 (м, 2Н);
4-бутил-6-[(3-метоксикарбонилтиен-2-ил)метокси] -2-метил-5- [[2'-[N-трифенилметил-(1Н-терразол-5-ил)] бифенил-4-ил] метил]пиримидин; 1Н-ЯМР (CDCl3) d 0,86 (т, 3Н), 1,20-1,60 (м, 4Н), 2,59 (с, 3Н), 2,61 (т, 2Н), 3,85 (с, 3Н), 3,93 (с, 2Н), 5,93 (с, 2Н), 6,82-7,48 (м, 24Н), 7,87 (дд, 1Н);
4-бутил-6-[(3-метоксикарбонилфуран-2-ил)метокси]-2-метил-5- [[2'-[N-трифенилметил-(1Н-тетразол-5-ил)] бифенил-4-ил] метил]пиримидин; 1Н-ЯМР (CDCl3) d 0,86 (т, 3Н), 1,20-1,60 (м, 4Н), 2,55 (с, 2Н), 2,59 (с, 3Н), 3,80 (с, 3Н), 3,85 (с, 2Н), 5,69 (с, 2Н), 6,70 (д, 1Н), 6,80-7,50 (м, 23Н), 7,87 (дд, 1Н).
Пример 9. 6-бутил-5-[(2'(1Н-тетразол-5-ил)бифенил-4-ил] метил]пиримидин-4-он.
Способ A.
0,11 г азида натрия и 0,09 г хлорида аммония было добавлено в атмосфере азота к раствору, содержащему 0,2 г ди-6-бутил-5-[(2'-цианобифенил-4-ил)метил] пиримидин-4-она в 2 мл обезвоженного ДМФА. После взаимодействия в течение 16 ч при 100oC и 60 ч при 120oC реакционная смесь была охлаждена и к ней было добавлено такое же количество, как первоначально взятое количество азида натрия и хлорида аммония. Еще через 50 ч при 120oC твердая составляющая была отфильтрована и растворитель был перегнан под вакуумом. Остаток был регенерирован водой и экстрагирован AcOEt, органическая фаза была высушена над Na2SO4, и растворитель был выпарен. Неочищенный материал был очищен ФХ (Элюент: AcOEt/MeOH) с получением 12 г белого твердого вещества (выход 53%).
Способ В.
1 мл трифторуксусной кислоты и 1 мл воды были добавлены к раствору, содержащему 0,3 г 6-бутил-5-[[2'-[N-трифенилметил- (1Н-тетразол-5-ил)]бифенил-4-ил] -метил] пиримидин-4-он в 5 мл ТГФ. После перемешивания в течение 24 ч при комнатной температуре реакционная смесь была обработана NaOH до нейтральности, и растворитель был выпарен. Остаток был очищен ФХ согласно способу А. Было получено 0,11 г белого твердого вещества (выход 60%).
Аналогично были получены следующие соединения:
- 6-бутил-2-метил-5-[[2'-(1Н-тетразол-5-ил)бифенил-4-ил] метил]-пиримидин-4-он; (т.пл.238-240oC, с разложением);
- 1-бензил-4-бутил-5-[[2'-(1Н-тетразол-5-ил)бифенил-4-ил]метил]пиримидин-6-он;
4-бутил-1-[(2-карбоксифенил)метил] -2-метил-5-[[2'-(1Н-тетразол -5-ил)бифенил-4-ил]метил]пиримидин-6-он (т.пл.193-196oC).
4-бутил-6-[(2-метоксикарбонилфенил)метокси]-2-метил-5-[[2'- (1Н-тетразол-5-ил)бифенил-4-ил]метил]пиримидин (т.пл.103-105oC);
4-бутил-1-[(3-меткосикарбонилтиен-2-ил)метил] -2-метил-5-[[2'- (1Н-тетразол-5-ил)бифенил-4-ил]метил]-пиримидин-6-он (т.пл. 100-105oC);
4-бутил-6-[(3-метоксикарбонилтиен-2-ил)метокси]-2-метил-5-[[2'- (1Н-тетразол-5-ил)бифенил-4-ил]метил]пиримидин (т.пл. 100-105oC);
4-бутил-1-[(3-метоксикарбонилфуран-2-ил)метил] -2-метил-5-[[2'- (1Н-тетразол-5-ил)бифенил-4-ил]метил]пиримидин-6-он;
4-бутил-6-[(3-метоксикарбонилфуран-2-ил)метокси]-2-метил-5-[[2'- (1Н-тетразол-5-ил)бифенил-4-ил]метил]пиримидин;
4-бутил-1-[(4-карбоксифенил)метил] -2-метил-5-[[2'-(1Н-тетразол -5-ил)бифенил-4-ил]метил]пиримидин-6-он;
4-бутил-6-[(4-метоксикарбонилфенил)метокси]-2-метил-5- [[2'-(1Н-тетразол-5-ил)бифенил-4-ил]метил]-пиримидин.
Пример 10. 6-бутил-5-[(2'-метоксикарбонилбифенил-4-ил)метил] -2 -фениламинокарбониламинопиримидин-4-он.
0,27 г фенилизоцианата было добавлено при 0oC к раствору, содержащему 0,3 г 2-амино-6-бутил-5-[(2'-метоксикарбонилбифенил-4-ил)-метил]пиримидин-4-она в 6 мл сухого ДМФА. После перемешивания при комнатной температуре в течение 30 мин смесь была выпарена досуха и остаток был перекристаллизован из ДМФА, было получено 0,22 г белого твердого вещества (выход 56% т.пл. 217-219oC).
Аналогично были получены следующие соединения:
6-бутил-2-циклогексиламинокарбониламино-5-[(2'- метоксикарбонилбифенил-4-ил)метил]пиримидин-4-он (т.пл. 220-222oC),
6-бутил-5-[(2'-метоксикарбонилбифенил-4-ил)метил] -2- метиламинотиокарбониламинопиримидин-4-он (т.пл. 186-188oC),
2-аминокарбониламино-6-бутил-[(2'-метоксикарбонилбифенил-4-ил) метил]пиримидин-4-он.
Пример 11. 2-ацетиламино6-бутил-5-[[2'-(1Н-тетразол-5-ил)бифенил-4-ил] метил]пиримидин-4-он.
10 мл Ac2O было добавлено к суспензии 2-амино-6-бутил-5-[[2'-(1Н-тетразол-5-ил)бифенил-4-ил] метил]пиримидн-4-она в толуоле. После других добавлений Ac2O раствор был выпарен досуха. Остаток был очищен ФХ (элюент: смесь CH2Cl2: MeOH: AcOH=89,9:10:10). Было получено 15 мг белого твердого вещества (выход 32% т.пл. 205-208oC).
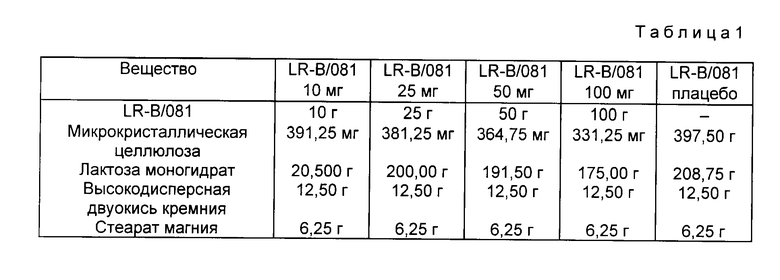
Для иллюстрации фармацевтической композиции заявитель приводит следующие примеры конкретных рецептур. В этих примерах в качестве активного компонента использовано соединение по п.2 формулы, под названием LR-B/081.
Рецептура 1.
Получение таблеток.
Для одной порции в 625,0 г для получения таблеток LR-B/081 5 мг, LR-B/081 10 мг, LR-B/081 25 мг, LR-B/081 50 мг, LR-B/081 100 мг или LR-B/081 плацебо необходимо следующее количество ингредиентов, приведенное в табл.1.
Настоящие дозированные формы получают прямым таблетированием.
Фармацевтически активный ингредиент растирается в порошок с высокодисперсной двуокисью кремния и лактозомоногидратом и затем смешивается с другими указанными ингредиентами. Таблетирование осуществляется с помощью эксцентрика для прессования таблеток.
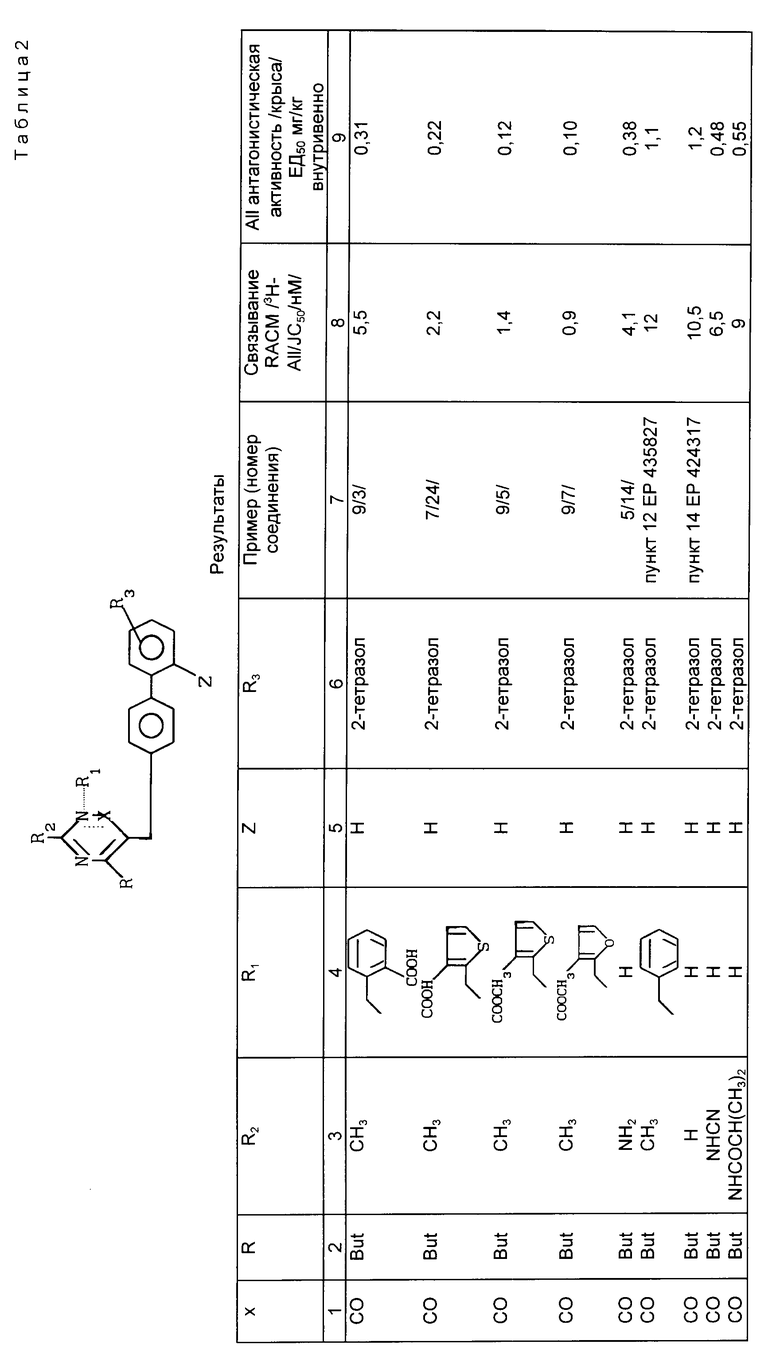
В табл.2 представлены результаты биологической активности для заявленных соединений.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПИРИМИДИНОНОВЫЕ СОЕДИНЕНИЯ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1999 |
|
RU2233278C9 |
| ЗАМЕЩЕННЫЕ ПИРИМИДИНЫ, ИЛИ ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ, ИЛИ N-ОКСИДЫ, СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ | 1992 |
|
RU2113437C1 |
| ПРОИЗВОДНЫЕ ДИАМИНОПИРИМИДИНА И СПОСОБЫ ИХ ПОЛУЧЕНИЯ | 2012 |
|
RU2587981C2 |
| ГЕТЕРОЦИКЛИЧЕСКОЕ СОЕДИНЕНИЕ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СПОСОБ АНТАГОНИЗИРОВАНИЯ АНГИОТЕНЗИНА II | 1992 |
|
RU2168510C2 |
| ПРОИЗВОДНЫЕ ИМИДАЗОЛА | 1992 |
|
RU2017733C1 |
| ПРОИЗВОДНЫЕ ТЕТРАЗОЛА | 1992 |
|
RU2091376C1 |
| ПРОИЗВОДНЫЕ 1-БИФЕНИЛМЕТИЛИМИДАЗОЛА, ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ ИЛИ ЭФИРЫ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 1992 |
|
RU2092481C1 |
| ПРОИЗВОДНЫЕ ПИРРОЛПИРИМИДИНОНА, СПОСОБ ПОЛУЧЕНИЯ И ИХ ПРИМЕНЕНИЕ | 2001 |
|
RU2263676C2 |
| ПРОИЗВОДНЫЕ БЕНЗИМИДАЗОЛА, СПОСОБ ИХ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКИЙ СОСТАВ НА ИХ ОСНОВЕ | 1991 |
|
RU2057126C1 |
| НОВОЕ ПРОИЗВОДНОЕ ПИПЕРИДИНА И СОДЕРЖАЩАЯ ЕГО ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ИНГИБИРОВАНИЯ АУТОТАКСИНА | 2022 |
|
RU2834850C2 |
Производные пиримидина, имеющие ангиотензин II-антагонистическую активность, общей формулы (I)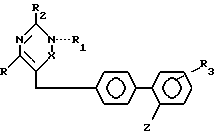
Соединения общей формулы (I), в которой R, R1, R2, R3, X и Z - группы имеют значения, приведенные в описании, и наделены AII-антагонистическими свойствами. 4 с. и 3 з. п. ф-лы, 2 табл.
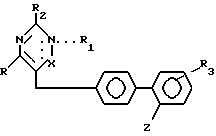
где R линейный или разветвленный C1 C4-алкил;
R1 H, линейный или разветвленный C1 C4 алкил, арил или арилалкил, где арил фенил, 2-тиенил, 2-фуранил, необязательно замещенный C1 C4-алкилом, C1 C4-алкокси-, карбокси- или линейной или разветвленной C1 - C4-алкоксикарбонилгруппой, где N и X соединяются двойной связью, R1 не присутствует;
R2 H, C1 C4-линейный или разветвленный алкил, амино, арил, где арил имеет указанное значение, или группа общей формулы NHA, где A C2 C7-ацил, CN, NO2, CONHB или CSNHB, где B представляет H, C1 C4-линейный или разветвленный алкил, C3 C7-циклоалкил, арил как определено выше;
R3 H;
Х CО или CR4-группа, где R4 может быть OR1 ( где R1 должен присутствовать и имеет указанные выше значения), арил, необязательно замещенный карбокси-, или CH2OR5, где R5 - H, низший алкил, арилалкил, где арил часть такая, как определено выше;
Z группа COOR6-, где R6 H или линейный или разветвленный C1 C4-алкил, или тетразол-5-ил общей формулы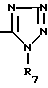
или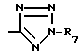
где R7 H, при условии, что, когда Х CО и R1 Н или фенил, R2 не является Н или алкилом,
и их фермацевтически приемлемые соли.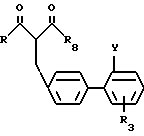
где R и R3 такие, как определено для общей формулы I;
R8 представляет группу OR9 (R9 метил или этил) или CH2OR5-группу, где R5- как определено для общей формулы I;
Y группа COOR6 (R6 C1 C4-алкил) или замещенный тетразол-5-ил-группа, подвергают взаимодействию с соединением общей формулы III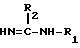
где R1 и R2 как определено для общей формулы I, при условии, что R1 по крайней мере Н.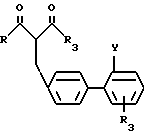
где R и R3 как определено для общей формулы I;
R8 OR9-группа (R9 метил или этил) или CH2OR5-группа, где R5 как определено для общей формулы I;
Y группа COOR6 (R6 C1 C4-алкил), CN-группа, тетразол-5-ил-группа, замещенная трифенилметилом,
подвергают взаимодействию с соединением общей формулы III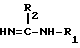
где R1 и R2 как определено для общей формулы I, при условии, что R1 по крайней мере Н,
с получением соединения общей формулы IV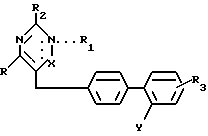
где R, R1 R3 как определено выше;
Y COOR6-группа (R6 C1 C4-алкил), CN-группа,
причем соединение общей формулы IV впоследствии превращают в соединение общей формулы I.
| EP, заявка, 435827, кл.A 61K 31/505, 1991. |
Авторы
Даты
1997-12-10—Публикация
1994-01-31—Подача