Техническая область
Данное изобретение относится к новым пиримидиноновым соединениям и их фармацевтически приемлемым солям. Данное изобретение также относится к способу получения новых пиримидиноновых соединений и фармацевтической композиции, содержащей пиримидиноновые соединения.
Исходный уровень техники
Пиримидиноновые производные по данному изобретению и их фармацевтически приемлемые соли применимы в качестве антагонистов ангиотензина II, в частности, при лечении сердечно-сосудистых заболеваний, обусловленных связыванием ангиотензина II с его рецепторами.
Ренин-ангиотензиновая система играет центральную роль в регуляции давления крови в человеческом организме. Ангиотензин II, состоящий из восьми аминокислот, продуцируется при расщеплении ангиотензина I ангиотензинпревращающим ферментом (АПФ), локализующимся в артериальных кровеносных сосудах легких. Ангиотензин II взаимодействует со специфическими рецепторами, присутствующими в кровеносных сосудах, гладкой мускулатуре, почках и надпочечниках, вызывая повышение давления крови и концентрации электролитов.
Поэтому было получено несколько антагонистических соединений для подавления действия ангиотензина II путем селективного блокирования его рецепторов.
В основном были предложены пептидные антагонисты, аналогичные ангиотензину II, но их клиническое применение было ограничено из-за их короткого периода полувыведения, отсутствия действия при пероральном приеме, а также из-за локального повышения давления крови.
Недавно было опубликовано много исследований в отношении непептидных антагонистов ангиотензина II (патенты США ¹4207324, 4340598, 4576958, 4582847 и 4880804; European Patent Laying-Open Publication Nos. 028834, 245637, 253310, 291969, 323841 и 324377). В European Patent Laying-Open Publication Nos. 028834 и 253310 описаны имидазольные производные, замещенные бифенилом (например, лозартан), и в European Patent Laying-Open Publication No.245637 - имидазопиридиновые производные (например, L158809) как сильные антагонисты ангиотензина II.
В European Patent Laying-Open Publication Nos.4073426, 419048 и 445811 описаны пиримидиноновые производные, подобные соединениям данного изобретения по их 6-членной гетероциклической кольцевой структуре, включающей азот, которая очень отличается от 5-членных имидазольных производных. Но эти пиримидиноновые соединения имеют более низкую активность, чем имидазольные производные, описанные в вышеупомянутой заявке.
Между тем, авторы данного изобретения подали заявку РСТ (WO 96-08476) на новые соединения, обладающие значительно высокой активностью (in vitro (аорта кролика), 60-70% подавление при 10-8-10-9 моля в исследовании расширения кровеносного сосуда in vitro), которая в 50 раз выше активности имидазольных производных, известных по вышеупомянутой заявке, или равна ей.
Описание изобретения
При поиске новых пиримидиноновых соединений были получены новые пиримидиноновые производные тиоамида и амидина, которые превосходят пиримидиноновые производные, описанные ранее, или указанные имидазольные производные по активности и времени действия.
Объектом данного изобретения поэтому является получение новых пиримидиноновых производных и их фармацевтически приемлемых солей, которые эффективно подавляют действие ангиотензина II, с высокой активностью.
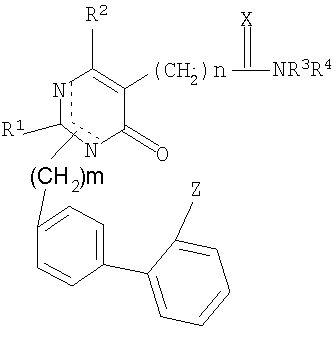
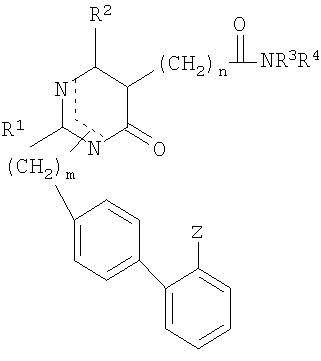
Для достижения вышеназванных целей данное изобретение представляет пиримидиноновые производные и их фармацевтически приемлемые соли, имеющие формулу (I):
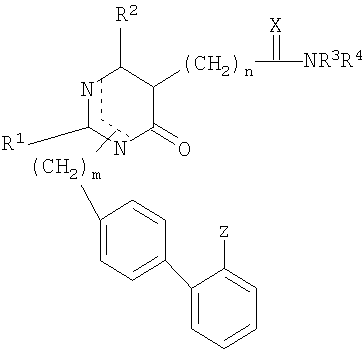
где
R1 представляет собой C1-C4 алкил с прямой или разветвленной цепью, циклоалкил, C1-C4 алкилалкокси или C1-C4 алкилмеркапто;
R2 представляет собой Н, галоген, C1-C4 алкил, арил или арилалкил;
R3, R4 являются одинаковыми или различными и представляют собой Н, C1-C4 алкил с прямой или разветвленной цепью, циклоалкил, арил, арилалкил, C1-C4 алкил- или арилкарбонил, C1-C4 алкоксикарбонил или замещенный аминокарбонил, который необязательно замещен Н, галогеном, гидрокси, C1-C4 алкокси, амино, алкиламино или диалкиламино (причем каждый алкил имеет C1-C5), C1-C4 алкоксикарбонилом, карбокси или замещенным аминокарбонилом,
R3 и R4 вместе с атомом N образуют 4-8-членное гетероциклическое кольцо, которое может быть дополнительно замещенным одним или двумя заместителями, выбранными из группы, состоящей из циклоалкила, арила или арилалкила, галогена, гидрокси и C1-C4 алкокси, амино, алкиламино или диалкиламино (причем каждый алкильный остаток имеет C1-C5), C1-C4 алкоксикарбонила, карбокси или замещенного аминокарбонила и C1-C4 алкила, с прямой или разветвленной цепью, который необязательно замещен Н; и гетероциклическое кольцо может дополнительно включать -О-, -S-, -SO-, -SO2-, >N-R5;
R5 представляет собой Н, C1-C4 алкил, арил, арилалкил, замещенный алкенил, пиридил, пиримидил, C1-C4 алкил или арилкарбонил, C1-C4 алкоксикарбонил, замещенный аминокарбонил, CN или SO2NR3R4;
Х представляет собой S или >N-R5 и
Z представляет CN, COOR3, SO2NR3R4 или тетразол-5-ильный радикал, имеющий нижеприведенную общую формулу
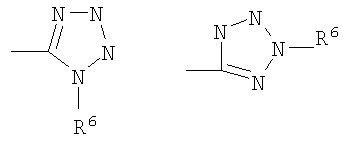
где R6 представляет собой Н, трет-бутил или трифенилметил;
m равно 1 или 2;
n равно 1, 2, 3, 4, 5 или 6.
Пиримидиноновые соединения по данному изобретению и их фармацевтически приемлемые соли проявляют высокую активность.
Предпочтительными являются такие соединения, в которых R1 представляет собой этил, н-пропил, н-бутил, циклопропил, этокси или пропокси; R2 представляет собой Н, галоген или C1-C4 алкил с прямой или разветвленной цепью; R3 и R4 являются одинаковыми или различными и представляют собой Н, метил, этил, пропил или бутил, или R3 и R4 вместе с атомом N образуют 4-8-членное циклическое кольцо, которое может быть дополнительно замещено одним или двумя заместителями, выбранными из группы, состоящей из циклоалкила, арила или арилалкила, галогена, гидрокси, C1-C4 алкококси, амино, алкиламино или диалкиламино (причем каждый алкильный остаток имеет C1-C5), C1-C4 алкоксикарбонила, карбокси и замещенного аминокарбонила и C1-C4 алкила с прямой или разветвленной цепью, который необязательно замещен по Н; и гетероциклическое кольцо может дополнительно включать -О-, -S-, -SO-, -SO2-, >N-R5; R5 представляет собой Н, C1-C4 алкил, арил, арилалкил, замещенный алкенил, пиридил, пиримидил, C1-C4 алкил или арилкарбонил, C1-C4 алкоксикарбонил, замещенный аминокарбонил, CN или SO2NR3R4, более предпочтительно, Н, C1-C4 алкил, C1-C4 алкоксикарбонил, замещенный аминокарбонил, CN или SO2NR3R4; Х представляет S или >N-R5; Z является тетразол-5-ильным радикалом и m равно 1.
Наилучший способ осуществления изобретения
Фармацевтически приемлемые соли данного изобретения включают неорганические соли, получаемые путем реакции соответствующих пиримидиноновых соединений (I) с гидроксидами щелочных металлов или щелочноземельных металлов, таких как гидроксид натрия, гидроксид калия, гидроксид кальция или гидроксид магния, карбонатами щелочных металлов или щелочноземельных металлов, таких как карбонат натрия, карбонат калия, карбонат кальция или карбонат магния, или алкоголятами щелочных металлов или щелочноземельных металлов, таких как натрий, калий, кальций или магний, и органические соли, получаемые путем реакции с органическим амином в Н2O, спиртах, таких как метанол, этанол, изопропиловый спирт, трет-бутиловый спирт и т.д., тетрагидрофуране или их смесях.
Соединение (I) может быть получено по схеме реакции (I) из нижеприводимого соединения (II).
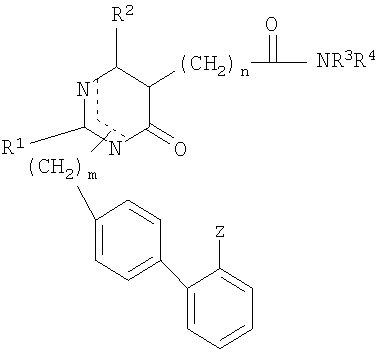
[Схема реакции I]
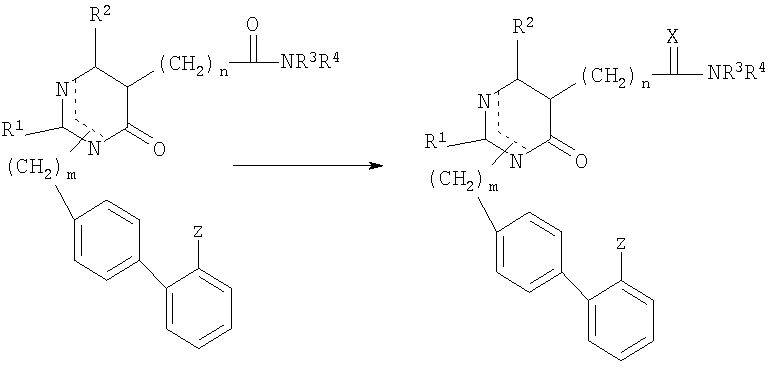
где R1, R2, R3, R4, X, Z, m и n имеют значения, которым дано определение выше.
Исходные материалы для соединения формулы II могут быть получены по способу, который описан в РСТ application Laying-Open Publication No. WO 96-08476, авторами данной заявки. Соединение формулы I, в котором Х представляет собой S, может быть легко получено путем реакции соединения (II) с Р4S10, бис(трициклогексилтартар)сульфидом или реагентом Лоэссона в растворителе, выбранном из бензола, дихлорметана или тетрагидрофурана. Иначе соединение формулы I, в котором Х представляет собой NR5, может быть легко получено из соединения (II) путем присоединения замещенного амина после получения промежуточного соединения иминия с использованием такого реагента как оксалилхлорид, оксихлорид фосфора или этилхлорформиат в растворителе, выбранном из бензола, эфира или тетрагидрофурана.
Характерными соединениями данного изобретения являются следующие соединения, причем указанный в скобках номер соединения представляет наименование, используемое в описании.
2-н-бутил-5-аминотиокарбонилметил-6-метил-3-[[2'-(1Н-тетразол-5-ил)бифенил-4-ил]метил]пиримидин-4(3Н)-он(соединение 1),
2-н-бутил-5-диметиламинотиокарбонилметил-6-метил-3-[[2'-(1H-тетразол-5-ил)бифенил-4-ил]метил]пиримидин-4(3Н)-он(соединение 2),
2-н-бутил-5-диэтиламинотиокарбонилметил-6-метил-3-[[2'-(1Н-тетразол-5-ил)бифенил-4-ил]метил]пиримидин-4(3Н)-он(соединение 3),
2-н-бутил-5-гептаметилениминотиокарбонилметил-6-метил-3-[[2'-(1Н-тетразол-5-ил)бифенил-4-ил]метил]пиримидин-4(3Н)-он (соединение 4),
2-н-бутил-5-тиоморфолинотиокарбонилметил-6-метил-3-[[2'-(1Н-тетразол-5-ил)бифенил-4-ил)метил]пиримидин-4(3Н)-он(соединение 5),
2-н-бутил-5-морфолинотиокарбонилметил-6-метил-3-[[2'-(1Н-тетразол-5-ил)бифенил-4-ил]метил] пиримидин-4(3Н)-он (соединение 6),
2-н-бутил-5-пиперидинотиокарбонилметил-6-метил-3-[[2'-(1Н-тетразол-5-ил)бифенил-4-ил]метил] пиримидин-4(3Н)-он (соединение 7),
2-н-бутил-5-пирролидинотиокарбонилметил-6-метил-3-[[2'-(1Н-тетразол-5-ил)бифенил-4-ил]метил] пиримидин-4(3Н)-он (соединение 8),
2-н-бутил-5-азетидинотиокарбонилметил-6-метил-3-[[2'-(1Н-тетразол-5-ил)бифенил-4-ил]метил] пиримидин-4(3Н)-он (соединение 9),
2-н-бутил-5-(2'-аминотиокарбонилэтил)-6-метил-3-[[2'-(1Н-тетразол-5-ил)бифенил-4-ил]метил] пиримидин-4(3Н)-он (соединение 10),
2-н-бутил-5-(2'-диметиламинотиокарбонилэтил)-6-метил-3-[[2'-(1Н-тетразол-5-ил)бифенил-4-ил]метил]пиримидин-4 (3Н)-он (соединение 11),
2-н-бутил-5-(2'-диэтиламинотиокарбонилэтил)-6-метил-3-[[2'-(1Н-тетразол-5-ил)бифенил-4-ил]метил] пиримидин-4(3Н)-он (соединение 12),
2-н-бутил-5-(2'-тиоморфолинотиокарбонилэтил)-6-метил-3-[[2'-(1Н-тетразол-5-ил)бифенил-4-ил]метил] пиримидин-4(3Н)-он (соединение 13) и
2-н-бутил-5-(2'-морфолинотиокарбонилэтил-6-метил-3-[[2'-(1Н-тетразол-5-ил)бифенил-4-ил]метил] пиримидин-4(3Н)-он (соединение 14).
Соединение формулы I и его фармацевтически приемлемые соли можно вводить перорально или парентерально в обычной дозированной форме, такой как таблетки, капсулы, порошки, лепешки, сухие микстуры, мази, суспензии или растворы, изготавливаемые в соответствии с обычной фармацевтической практикой.
Соединения формулы I и т.д. можно вводить в дозировке от примерно 40 мг/кг до примерно 100 мг/кг веса тела предпочтительно в сутки.
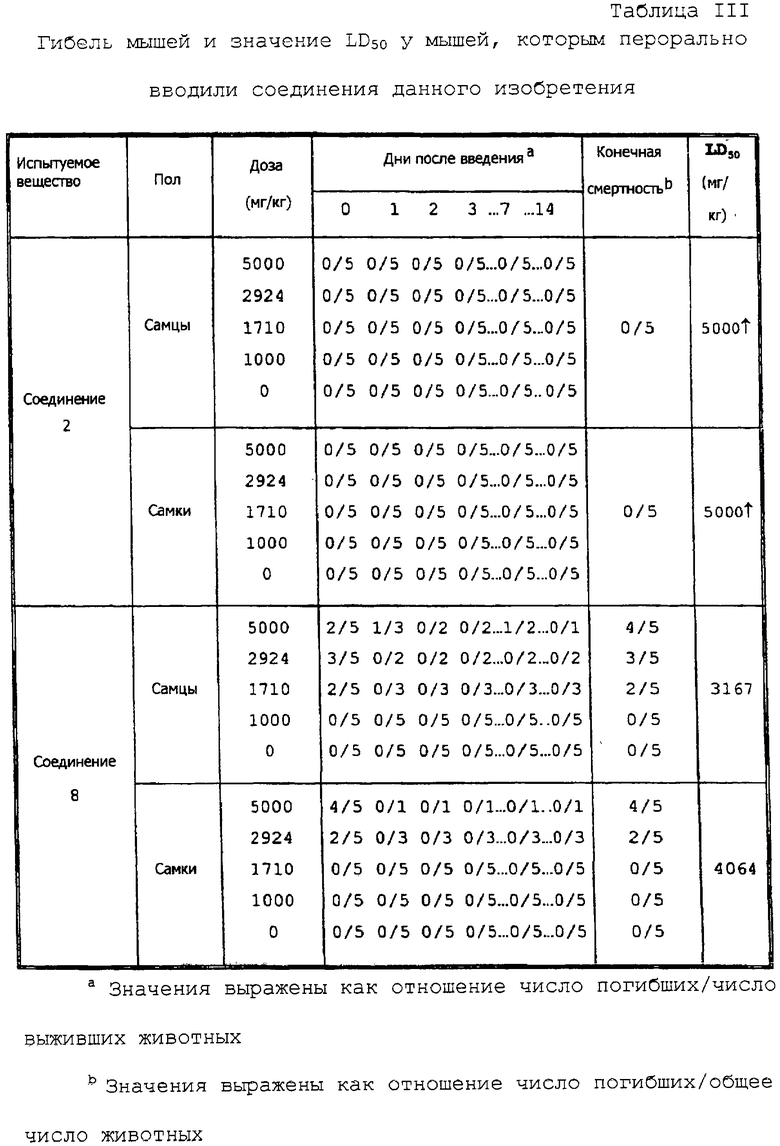
Соединения данного изобретения имеют чрезвычайно низкую токсичность. LD50 у мышей составляет свыше 5000 мг/кг веса тела, как показано в экспериментальном испытании 2.
Данное изобретение будет описано более детально здесь далее в отношении предпочтительных осуществлений, и как таковые, они не должны рассматриваться как ограничивающие объем данного изобретения.
ПРИМЕР 1
2-н-бутил-5-аминотиокарбонилметил-6-метил-3-[[2'-(1Н-тетразол-5-ил)бифенил-4-ил]метил]'пиримидин-4(3Н)-он (соединение 1)
СПОСОБ 1
1,2 г 2-н-бутил-5-аминокарбонилметил-6-метил-3-[[2'-(N-трифенилметилтетразол-5-ил)бифенил-4-ил]метил] пиримидин-4(3Н)-она (WO 96-08476) растворяют в 20 мл бензола при комнатной температуре и туда добавляют 600 мг реагента Лоэссона. После нагревания смеси и перемешивания ее в течение 5 часов смесь охлаждают до комнатной температуры, ненужное твердое вещество отфильтровывают и концентрируют под пониженным давлением. Осадок отделяют и очищают хроматографией, используя смесь ацетат/гексан (1:2), с получением 700 мг (57%) промежуточного продукта.
После растворения промежуточного продукта в 100 мл тетрагидрофурана раствор охлаждают до 0-5°С и к нему медленно добавляют 5 мл 4 М раствора соляной кислоты. Раствор нагревают в колбе с обратным холодильником в течение 4 часов и затем нейтрализуют добавлением 4 М раствора гидроксида натрия. Водный слой насыщают твердым хлоридом натрия и три раза экстрагируют хлороформом. Органический раствор, полученный таким образом, промывают рассолом и затем сушат и концентрируют с помощью безводного сульфата магния. Остаток после хроматографии элюируют, используя хлороформ и смесь хлороформ/метанол (9:1) с получением 310 мг (65%) соединения 1.
СПОСОБ 2
500 мг 2-н-бутил-5-аминокарбонилметил-6-метил-3-[[(1Н-тетразол-5-ил)бифенил-4-ил]метил] пиримидин-4(3Н)-она (WO 96-08476) растворяют в 20 мл тетрагидрофурана при комнатной температуре и туда добавляет 400 мг реагента Лоэссона. После нагревания смеси и перемешивания ее в течение 5 часов смесь охлаждают до комнатной температуры, ненужное твердое вещество отфильтровывают и остаток концентрируют под пониженным давлением. Остаток выделяют и очищают хроматографией, используя хлороформ и смесь хлороформ/метанол (9:1) с получением 200 мг (45%) соединения 1.
Т. пл.: 94,6~102,3°С
TCXRf: 0,33 (5% МеОН в СНСl3)
1H ЯMP(ДMCO-d6): δ 0,83 (т, 3Н), 1,19-1,40 (м, 2Н), 1,48~1,65 (м, 2Н), 2,21 (с, 3Н), 2,60 (с, 2Н), 3,35 (с, 2Н), 5,27 (с, 2Н), 7,01~7,09 (м, 4Н), 7,39~7,61 (м, 4Н), 6,83 (с, 1Н), 7,07 (с, 4Н), 7,30 (с, 1Н), 7,40~7,68 (м, 4Н).
По тому же способу получают следующие соединения.
ПРИМЕР 2
2-н-бутил-5-диметиламинотиокарбонилметил-6-метил-3-[[2'-(1Н-тетразол-5-ил)бифенил-4-ил]метил] пиримидин-4(3Н)-он (соединение 2)
Т. пл.: 96,8~101,8°С
TCXRf: 0,28 (5% МеОН в СНСl3)
1H ЯМР(СDСl3): δ 0,89 (т, 3Н), 1,28~1,45 (м, 2Н), 1,58~1,74 (м, 2Н), 2,26 (с, 3Н), 2,63 (с, 2Н), 3,44 (с, 3Н), 3,46 (с, 3Н), 3,77 (с, 2Н), 5,22 (с, 2Н), 7,07(с, 5Н), 7,33-7,60 (м, 3Н), 7,94 (дд, 1Н).
ПРИМЕР 3
2-н-бутил-5-диэтиламинотиокарбонилметил-6-метил-3-[[2'-(1Н-тетразол-5-ил)бифенил-4-ил]метил] пиримидин-4(3Н)-он (соединение 3)
Т. пл.: 96,8~98,6°С
TCXRf: 0,31 (5% МеОН в СНСl3)
1H ЯМР(СDСl3): δ 0,91 (т, 3Н), 1,26 (т, 3Н), 1,31~1,45 (м, 2Н), 1,61~1,80 (м, 2Н), 2,31 (с, 3Н), 2,67 (т, 2Н), 3,76 (кв, 2Н), 3,81 (с, 2Н), 3,99 (кв, 2Н), 5,26 (с, 2Н), 7,01~7,18 (м, 3Н), 7,20-7,28 (м, 1Н), 7,33~7,41 (м, 1Н), 7,45~7,62 (м, 2Н), 8,06 (дд, 1Н).
ПРИМЕР 4
2-н-бутил-5-гептаметилениминотиокарбонилметил-6-метил-3-[[2'-(1Н-тетразол-5-ил)бифенил-4-ил]метил] пиримидин-4(3Н)-он (соединение 4)
Т. пл.: 104,2~107,3°С
TCXRf: 0,47 (7% МеОН в СНСl3)
1H ЯМР (CDCl3): δ 0,83 (т, 3Н), 1,21~1,30 (м, 2Н), 1,40~1,70 (м, 8Н), 1,71~1,95 (м, 4Н), 2,21 (с, 3Н), 2,53 (т, 2Н), 3,60~3,88 (м, 4Н), 4,02 (с, 2Н), 5,15 (с, 2Н), 6,98~7,09 (м, 5Н), 7,22~7,58 (м, 3Н), 7,77(дд, 1Н).
ПРИМЕР 5
2-н-бутил-5-тиоморфолинотиокарбонилметил-6-метил-3-[[2'-(1Н-тетразол-5-ил)бифенил-4-ил]метил] пиримидин-4(3Н)-он (соединение 5)
Т. пл.: 115,5~119,1°С
TCXRf: 0,33 (7% МеОН в СНСl3)
1H ЯМР (CDCl3): δ 0,91 (т, 3Н), 1,31~1,48 (м, 2Н), 1,61~1,74 (м, 2Н), 2,30 (с, 3Н), 2,65 (т, 2Н), 2,72~2,84 (м, 4Н), 3,81 (с, 2Н), 4,22 (т, 2Н), 4,59 (т, 2Н), 5,25 (с, 2Н), 7,03~7,15 (м, 5Н), 7,35~7,61 (м, 3Н), 8,00 (дд, 1Н).
ПРИМЕР 6
2-н-бутил-5-морфолинотиокарбонилметил-6-метил-3-[[2'-(1Н-тетразол-5-ил)бифенил-4-ил]метил] пиримидин-4(3Н)-он (соединение 6)
Т. пл.: 91,8~94,3°С
TCXRf: 0,30 (7% МеОН в СНСl3)
1H ЯМР (СDСl3): δ 0,92 (т, 3Н), 1,31~1,48 (м, 2Н), 1,63~1,81 (м, 2Н), 2,34 (с, 3Н), 2,69 (т, 2Н), 2,68~2,82 (м, 4Н), 3,85 (с, 2Н), 3,97 (с, 2Н), 4,34 (т, 2Н), 5,27 (с, 2Н), 7,05~7,20 (м, 5Н), 7,35~7,65 (м, 3Н), 8,05 (дд, 1Н).
ПРИМЕР 7
2-н-бутил-5-пиперидинотиокарбонилметил-6-метил-3-[[2'-(1Н-тетразол-5-ил)бифенил-4-ил]метил] пиримидин-4(3Н)-он (соединение 7)
Т. пл.: 94,2~97,6°С
TCXRf: 0,37 (5% МеОН в СНСl3)
1H ЯМР (СDСl3): δ 0,91 (т, 3Н), 1,31~1,48 (м, 2Н), 1,61~1,80 (м, 8Н), 2,30 (с, 3Н), 2,67 (т, 2Н), 3,72~3,90 (м, 4Н), 4,26 (с, 2Н), 5,25 (с, 2Н), 7,03~7,15 (м, 5Н), 7,35~7,61 (м, 3Н), 8,01 (дд, 1Н).
ПРИМЕР 8
2-н-бутил-5-пирролидинтиокарбонилметил-6-метил-3-[[2'-(1Н-тетразол-5-ил)-бифенил-4-ил]метил] пиримидин-4(3Н)-он (соединение 8)
Т. пл.: 94,4~97,3°С
TCXRf: 0,26 (5% МеОН в СНСl3)
1H ЯМР (СDСl3): δ 0,91 (т, 3Н), 1,31~1,48 (м, 2Н), 1,61~1,8 (м, 2Н), 1,91~2,18 (м, 4Н), 2,32 (с, 3Н), 2,67 (т, 2Н), 3,60~3,90 (м, 6Н), 5,24 (с, 2Н), 7,03~7,15 (м, 5Н), 7,35~7,61 (м,3Н), 8,02 (дд, 1Н).
ПРИМЕР 9
2-н-бутил-5-азетидинотиокарбонилметил-6-метил-3-[[2'-(1H-тетразол-5-ил) бифенил-4-ил]метил] пиримидин-4(3Н)-он (соединение 9)
Т. пл.: 92,4~93,8°С
TCXRf: 0,24 (5% МеОН в СНСl3)
1H ЯМР (СDСl3): δ 0,91 (т, 3Н), 1,31~1,45 (м, 2Н), 1,61~1,75 (м, 2Н), 2,20~2,35 (м, 2Н), 2,39 (с, 3Н), 2,67 (т, 2Н), 3,59 (с, 2Н), 4,21 (т, 2Н), 4,47 (т, 2Н), 5,24 (с, 2Н), 7,03-7,15 (м, 4Н), 7,18~7,25 (м, 1Н), 7,35~7,61 (м, 3Н), 8,04 (дд, 1Н).
ПРИМЕР 10
2-н-бутил-5-(2'-аминотиокарбонилэтил)-6-метил-3-[[2'-(1Н-тетразол-5-ил)бифенил-4-ил]метил] пиримидин-4(3Н)-он (соединение 10)
Т. пл.: 97,8~99,0°C
TCXRf: 0,43 (5% МеОН в СНСl3)
1H ЯМР (СDСl3): δ 0,93 (т, 3Н), 1,32~1,48 (м, 2Н), 1,62~1,80 (м, 2Н), 2,40 (с, 3Н), 2,60-2,80 (м, 4Н), 2,87 (т, 2Н), 5,27 (с, 2Н), 7,10~7,25 (м, 4Н), 7,35~7,65 (м, 4Н), 8,10 (дд, 1Н).
ПРИМЕР 11
2-н-бутил-5-(2'-диметиламинотиокарбонилэтил)-6-метил-3-[[2'-(1Н-тетразол-5-ил)бифенил-4-ил]метил]пиримидин-4(3Н)-он (соединение 11)
Т. пл.: 76,2~81,2°С
TCXRf: 0,21 (5% МеОН в СНСl3)
1H ЯМР (ДМСО-d6): δ 0,90 (т, 3Н), 1,28~1,45 (м, 2Н), 1,58~1,74 (м, 2Н), 2,37 (с, 3Н), 2,63 (т, 2Н), 2,85~3,05 (м, 4Н), 3,42 (с, 3Н), 3,47 (с, 3Н), 5,23 (с, 2Н), 6,95~6,13 (м, 4Н), 7,27~7,65 (м, 4Н), 7,87 (дд, 1Н).
ПРИМЕР 12
2-н-бутил-5-(2'-диэтиламинотиокарбонилэтил)-6-метил-3-[[2'-(1Н-тетразол-5-ил)бифенил-4-ил]метил]пиримидин-4(3Н)-он (соединение 12)
Т. пл.: 77,8~81,1°С
TCXRf: 0,37 (5% МеОН в СНСl3)
1H ЯМР (СDСl3): δ 0,88 (т, 3Н), 1,12~1,45 (м, 8Н), 1,55~1,74 (м, 2Н), 2,37 (с, 3Н), 2,59 (т, 2Н), 2,85~3,15 (м, 4Н), 3,70 (кв, 2Н), 3,37 (кв, 2Н), 5,20 (с, 2Н), 6,90~7,05 (м, 4Н), 7,20~7,55 (м, 4Н), 7,78 (дд, 1Н).
ПРИМЕР 13
2-н-бутил-5-(2'-тиоморфолинотиокарбонилэтил)-6-метил-3-[[2'-(1Н-тетразол-5-ил)бифенил-4-ил]метил] пиримидин-4(3Н)-он (соединение 13)
Т. пл.: 80,1~83,3°С
TCXRf: 0,28 (5% МеОН в СНСl3)
1H ЯМР (СDСl3): δ 0,91 (т, 3Н), 1,30~1,45 (м, 2Н), 1,60~1,70 (м, 2Н), 2,39 (с, 3Н), 2,55~2,90 (м, 8Н), 2,97 (т, 2Н), 4,22 (т, 2Н), 4,58 (т, 2Н), 7,04~7,25 (м, 5Н), 7,35~7,42 (м, 1Н), 7,45~7,65 (м, 2Н), 8,08 (дд, 1H).
ПРИМЕР 14
2-н-бутил-5-(2'-морфолинотиокарбонилэтил)-6-метил-3-[[2'-(1Н-тетразол-5-ил)бифенил-4-ил]метил]пиримидин-4(3Н)-он (соединение 14)
Т. пл.: 92,2~94,7°С
TCXRf: 0,39 (7% МеОН в СНСl3)
1H ЯМР (СDСl3): δ 0,91 (т, 3Н), 1,30~1,45 (м, 2Н), 1,60~1,75 (м, 2Н), 2,39 (с, 3Н), 2,67 (т, 2Н), 2,88 (т, 2Н), 3,05 (т, 2Н), 3,65~3,80 (м, 4Н), 3,94 (т, 2Н), 4,31 (т, 2Н), 5,27 (с, 2Н), 7,04~7,30 (м, 5Н), 7,38-7,42 (м, 1Н), 7,50-7,68 (м, 2Н), 8,08 (дд, 1Н).
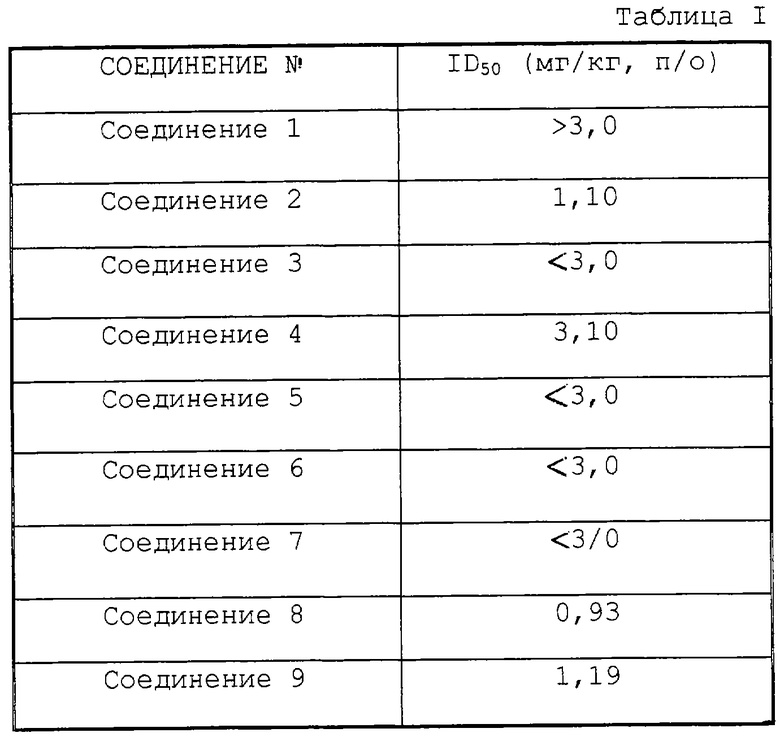
Антагонистическую активность соединения (I) по отношению к ангиотензину II, который получают по способу в соответствии с предпочтительным воплощением настоящего изобретения, оценивали у крыс. Результаты представлены в таблице 1.
Экспериментальное испытание I
Антагонизм в отношении ангиотензина II in vivo у находящихся в сознании крыс с нормальным давлением крови.
SD крысам-самцам (Charles River Japan, 9 недель, 300-350 г) делали анестезию пентобарбиталом в дозе 50 мг/кг в/б. В левую бедренную артерию и правую бедренную вену вставляли канюли. Заполненный гепарином катетер (50 Ед/мл) вводили подкожно (п/к) в дорсальную сторону шеи и закрепляли снаружи.
Крысам позволяли восстановиться в течение ночи после анестезии и давали им свободный доступ воде, но отказывали в пище.
На следующий день катетер бедренной артерии соединяли с датчиком давления (СОВЕ 041-500-508, США), соединенным с полиграфом (GRASS Model 7, США), для контроля артериального давления крови. После соответствующего периода уравновешивания вводили ангиотензин II (0,1 мкг/кг) в бедренную вену три раза за контрольный период.
Испытуемые соединения затем вводили перорально (п/о) в постоянном объеме 2 мл/кг.
После этого инъекции ангиотензина II повторяли в установленные сроки.
Значения ID50, дозу испытуемого соединения, необходимую для получения 50% подавления вызванной ангиотензином II прессорной реакции, рассчитывали по пику процента подавления с использованием нескольких доз испытуемого соединения.
Экспериментальное испытание II
Испытание на острую токсичность
Соответствующие 5 мышей из системы ICR, которые были получены из Korean Laboratory Animal Center, размножали в поликарбонатном ящике для размножения в условиях размножения с температурой 23±1°С, влажностью 55±5%, откачиванием 10-15 раз/час, 12-часовым циклом флуоресцентного освещения и уровнем освещения в 150-300 люкс.
После наблюдения за мышами в течение одной недели акклиматизационного периода разведения только нормальных мышей отбирали для лабораторной работы. Мышей кормили стерилизованной пищей для лабораторных животных, которая изготавливается Cheil Jedang Co., Ltd, и давали им очищенную воду для питья.
Во время периода акклиматизации мышей, которые были оценены как здоровые, взвешивали и разделяли на группы по случайной выборке. Индивидуальную идентификацию лабораторных животных обеспечивали путем нанесения пигмента на шерсть и нанесения этикеток на ящик для разведения.
Определение дозы проводили по результатам предварительного испытания таким образом, что в группе, получавшей максимальную дозу, как самцам, так и самкам назначалось 5000 мг/кг, а азеотропия установлена на 1,71. В группах, получавших соответственно средневысокую, среднюю и средне низкую дозу, назначалось представленное ниже, а контрольной группе вводили путем инъекции физиологический раствор.
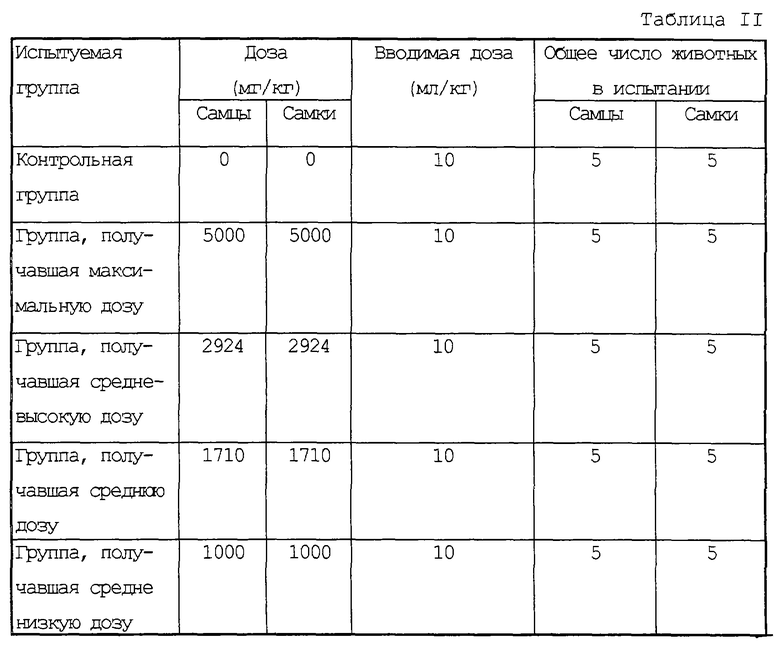
Перед введением испытуемых соединений вес лабораторных животных находился в интервале 24-28 г у самцов и в интервале 19-28 г у самок, соответственно. Лабораторные животные были в возрасте 6 недель.
Препараты испытуемых веществ перед введением растворяли в физиологическом растворе. Дозу рассчитывали на вес тела, который определяли перед введением, и вводили перорально мышам, которых выдерживали голодными в течение 18 часов перед испытанием.
Наблюдение клинических симптомов, таких как общие изменения, симптомы токсичности и гибель, осуществляли для всех лабораторных животных один раз каждый час в течение 6 часов после введения в сам день введения и один раз в день, начиная со следующего дня по 14 день введения.
Испытуемую группу, которой вводили испытуемые вещества, и контрольную группу взвешивали в день введения, на первый, третий, седьмой, десятый и четырнадцатый дни после введения в преопределенное время для всех животных, которые выжили.
После окончания испытания всем животным делали легкую анестезию эфиром и умертвляли кровопусканием. Вид внутренних органов животных тщательно оценивали невооруженными глазами. Животных, которые погибли при испытании, обследовали тем же способом.
ПРИМЕРЫ 15-28
Изготовление таблеток
Указанные ниже ингредиенты с (1) по (4) смешивали и гранулировали. К гранулам добавляли стеарат магния (5), смешивали и прессовали с получением таблеток (200 мг) (пример 15).
Подобным же образом получали таблетки, содержащие другие соединения с (2) по (14) данного изобретения (примеры с 16 по 28).

ПРИМЕРЫ 29-42
Изготовление капсул
Обычным путем смешивают ингредиенты, указанные в таблице 2, гранулируют и распределяют с получением отдельных капсул (200 мг) (пример 29).
Подобным же образом получали капсулы, содержащие другие соединения с (2) по (14) данного изобретения (примеры с 30 по 42).
Возможность промышленного применения
В соответствии с данным изобретением можно получить новые соединения общей формулы (I), которые применимы в качестве антагонистов ангиотензина II.
Хотя предпочтительные осуществления данного изобретения были изложены в иллюстративных целях, опытные специалисты поймут, что возможны различные изменения, добавления и замены без выхода из объема и сущности данного изобретения, которые изложены в сопутствующей формуле изобретения.
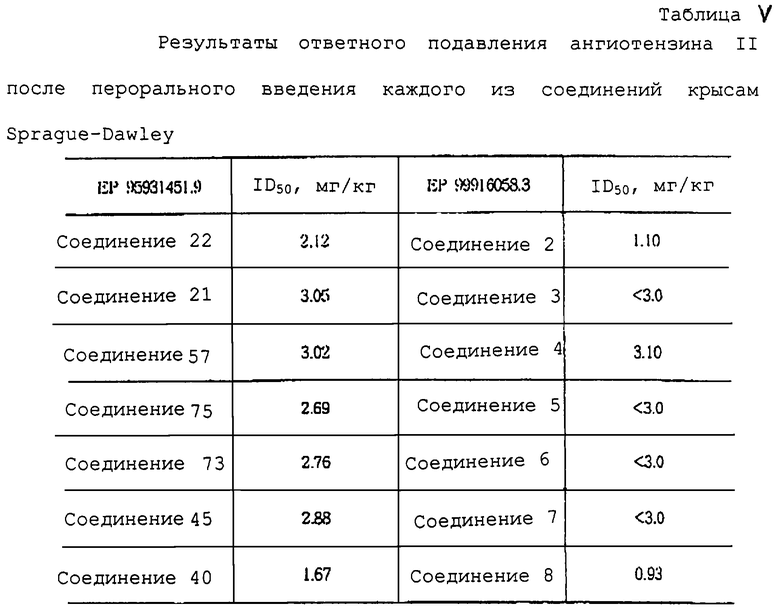
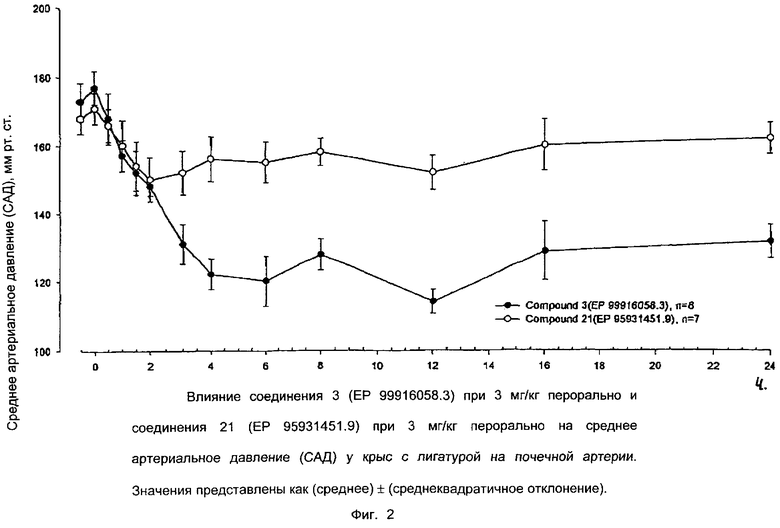
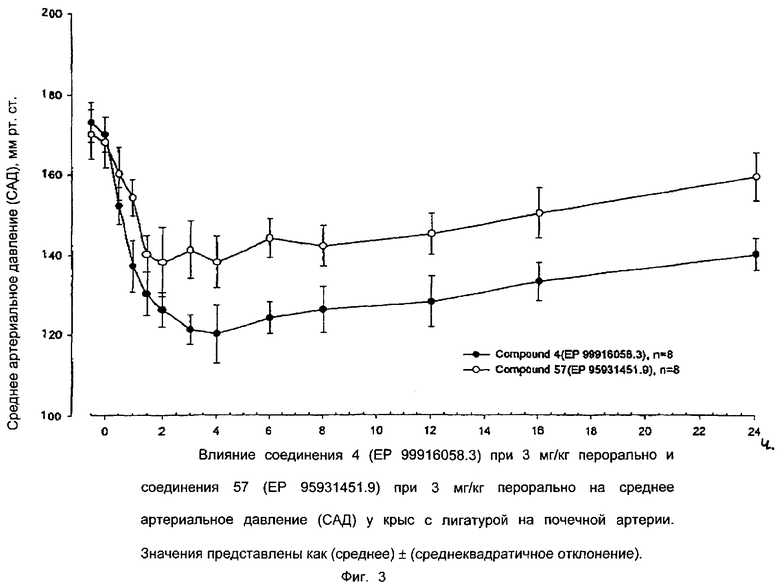
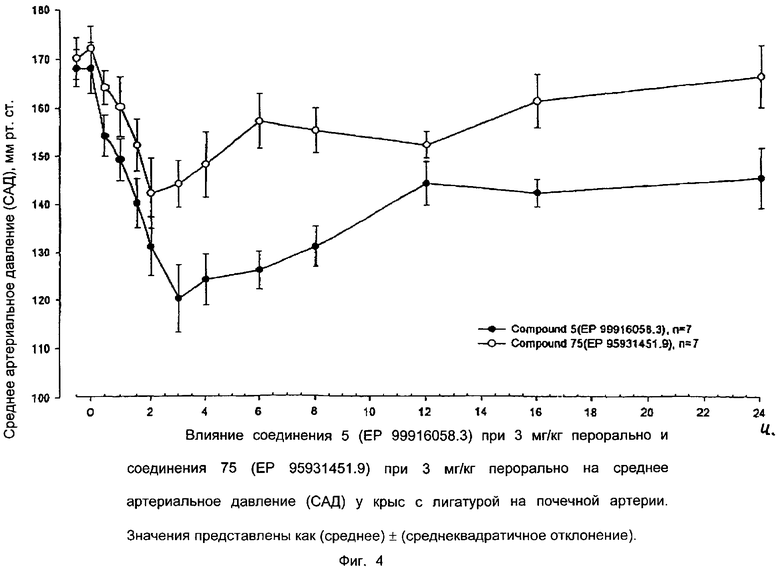
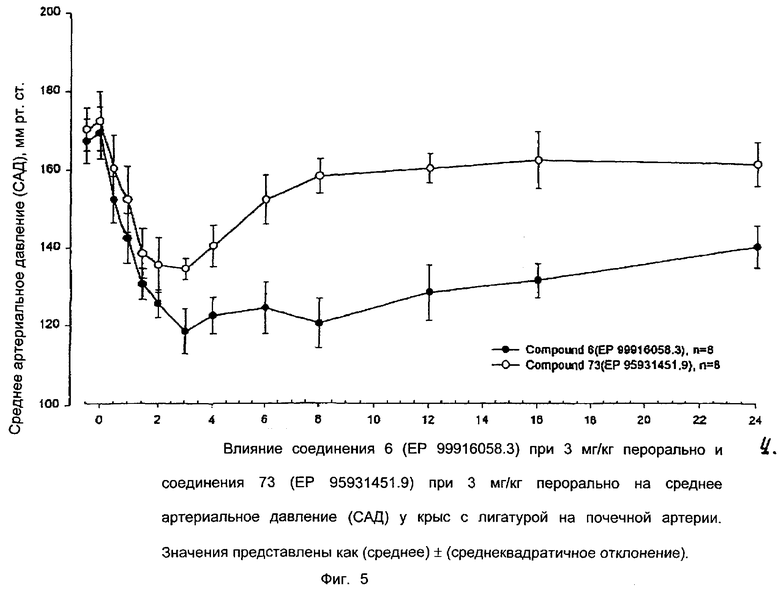
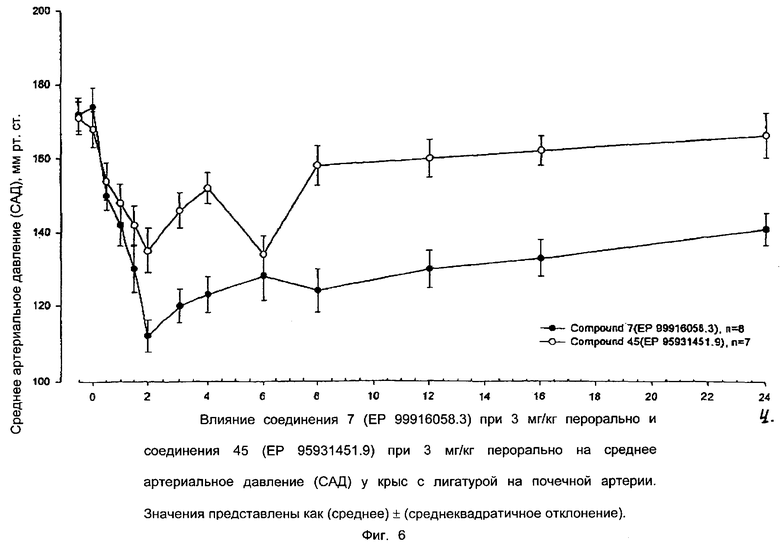
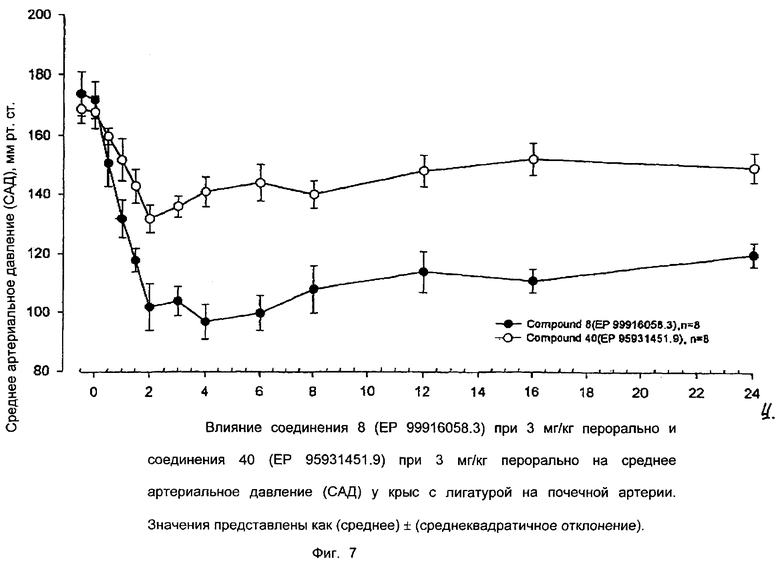
Ниже приводятся фиг. 1-7, на которых показано преимущество соединений настоящего изобретения по сравнению с известными соединениями.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНЫЕ ПИРИМИДИНА, СПОСОБ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ | 1994 |
|
RU2098411C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПИРИМИДИНОНОВОГО СОЕДИНЕНИЯ И ЕГО ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫХ СОЛЕЙ | 2001 |
|
RU2263675C2 |
| ПРОИЗВОДНЫЕ ПИРРОЛПИРИМИДИНОНА, СПОСОБ ПОЛУЧЕНИЯ И ИХ ПРИМЕНЕНИЕ | 2001 |
|
RU2263676C2 |
| ИМИДАЗО-АННЕЛИРОВАННЫЕ ИЗО- И ГЕТЕРОЦИКЛЫ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 1992 |
|
RU2076105C1 |
| НОВЫЕ АЦИКЛИЧЕСКИЕ НУКЛЕОЗИДФОСФОНАТНЫЕ ПРОИЗВОДНЫЕ, ИХ СОЛИ И СПОСОБ ПОЛУЧЕНИЯ ЭТИХ СОЕДИНЕНИЙ | 2002 |
|
RU2266294C2 |
| НОВОЕ ПРОИЗВОДНОЕ ПИПЕРИДИНА И СОДЕРЖАЩАЯ ЕГО ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ИНГИБИРОВАНИЯ АУТОТАКСИНА | 2022 |
|
RU2834850C2 |
| ПРОИЗВОДНОЕ БЕНЗАМИДА, СПОСОБ ЕГО ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ПРОФИЛАКТИКИ ИЛИ ЛЕЧЕНИЯ РАКА, СОДЕРЖАЩАЯ ЕГО В КАЧЕСТВЕ АКТИВНОГО ИНГРЕДИЕНТА | 2022 |
|
RU2841260C2 |
| ГЕТЕРОЦИКЛИЧЕСКОЕ СОЕДИНЕНИЕ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СПОСОБ АНТАГОНИЗИРОВАНИЯ АНГИОТЕНЗИНА II | 1992 |
|
RU2168510C2 |
| ПРОИЗВОДНОЕ ПИРИМИДИНА, ПОДАВЛЯЮЩЕЕ РОСТ РАКОВОЙ КЛЕТКИ, И ЕГО МЕДИЦИНСКОЕ ПРИМЕНЕНИЕ | 2020 |
|
RU2792849C1 |
| ПРОИЗВОДНЫЕ БЕНЗИМИДАЗОЛА, СПОСОБ ИХ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКИЙ СОСТАВ НА ИХ ОСНОВЕ | 1991 |
|
RU2057126C1 |
Данное изобретение относится к новым пиримидиноновым соединениям формулы (I) и их фармацевтически приемлемым солям, обладающим сильным антагонистическим действием в отношении рецепторов к ангиотензину II, тем самым полезным при лечении сердечно-сосудистых заболеваний, обусловленных связыванием ангиотензина II с его рецепторами. Изобретение также относится к способу получения соединения формулы (I) реакцией соединения (II)с P4S10 или реагентом Лоэссона в растворителе, выбранном из бензола, дихлорметана или тетрагидрофурана, и к фармацевтической композиции на основе соединения формулы (I). В соединении формулы (I)R1 представляет собой C1-C4 алкил с прямой цепью; R2 представляет собой C1-C4 алкил; R3 и R4 являются одинаковыми или различными и представляют собой Н, C1-C4 алкил с прямой или разветвленной цепью, или R3 и R4 вместе с атомом N образуют 4-8-членное гетероциклическое кольцо, которое может дополнительно включать -О-, -S-, -SO-, -SO2-;
X представляет собой S и Z представляет радикал тетразол-5-ил, имеющий нижеприведенную общую формулу
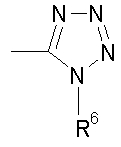 или\tab
или\tab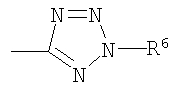
где R6 представляет собой Н;m равно 1 или 2, и n равно 1, 2, 3, 4, 5 или 6. 3 н. и 5 з.п. ф-лы, 7 ил., 5 табл.
 (I)
(I)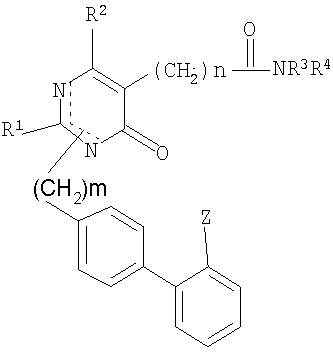 (II)
(II)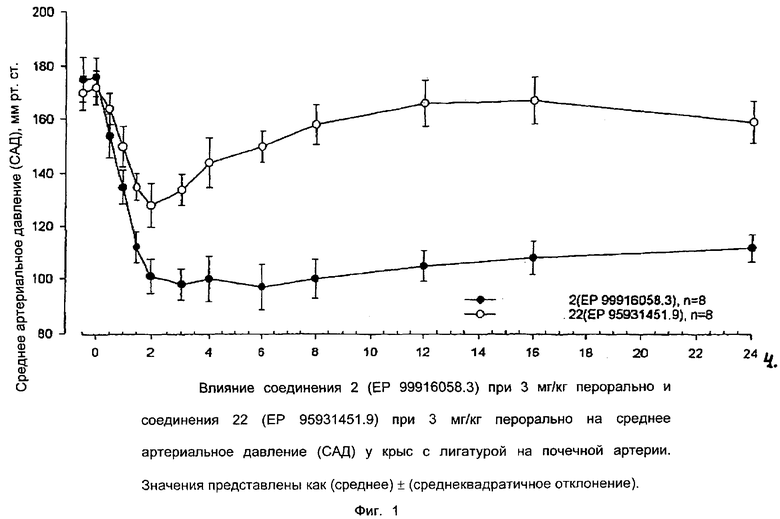
1. Пиримидиноновое соединение формулы (I)
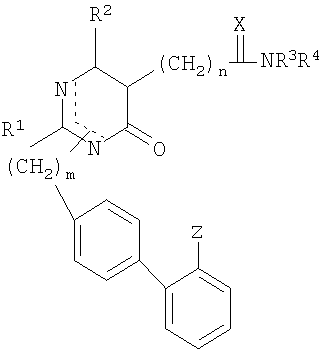
или его фармацевтически приемлемые соли,
где R1 представляет собой C1-C4 алкил с прямой цепью;
R2 представляет собой C1-C4 алкил;
R3 и R4 являются одинаковыми или различными и представляют собой Н, C1-C4 алкил с прямой или разветвленной цепью или R3 и R4 вместе с атомом N образуют 4-8-членное гетероциклическое кольцо, которое может дополнительно включать -О-, -S-, -SO-, -SO2-;
X представляет собой S;
Z представляет радикал тетразол-5-ил, имеющий общую формулу
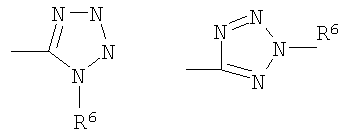
где R6 представляет собой Н;
m = 1 или 2;
n = 1, 2, 3, 4, 5 или 6.
2. Соединение или его фармацевтически приемлемые соли по п.1, где R1 представляет собой этил, н-пропил, н-бутил, и R2 представляет собой C1-C4 алкил с прямой или разветвленной цепью.
3. Соединение или его фармацевтически приемлемые соли по п.2, где R3 и R4 являются одинаковыми или различными и представляют собой Н, метил, этил, пропил или бутил или R3 и R4 вместе с атомом N образуют 4-8-членное гетероциклическое кольцо, которое может включать -О-, -S-, -SO-, -SО2-.
4. Соединение или его фармацевтически приемлемые соли по п.3, где Z представляет собой тетразол-5-ильный радикал и m = 1.
5. Соединение или его фармацевтически приемлемые соли по п.1, причем указанное соединение формулы (I) является одним выбранным из группы, включающей
2-н-бутил-5-аминотиокарбонилметил-6-метил-3-[[2'-(1Н-тетразол-5-ил)бифенил-4-ил]метил]пиримидин-4(3Н)-он (соединение 1),
2-н-бутил-5-диметиламинотиокарбонилметил-6-метил-3-[[2'-(1Н-тетразол-5-ил)бифенил-4-ил]метил]пиримидин-4(3Н)-он (соединение 2),
2-н-бутил-5-диэтиламинотиокарбонилметил-6-метил-3-[[2'-(1Н-тетразол-5-ил)бифенил-4-ил]метил] пиримидин-4(3Н)-он (соединение 3),
2-н-бутил-5-гептаметилениминотиокарбонилметил-6-метил-3-[[2'-(1Н-тетразол-5-ил)бифенил-4-ил]метил]пиримидин-4(3Н)-он (соединение 4),
2-н-бутил-5-тиоморфолинотиокарбонилметил-6-метил-3-[[2'-(1Н-тетразол-5-ил)бифенил-4-ил)метил]пиримидин-4(3Н)-он (соединение 5),
2-н-бутил-5-морфолинотиокарбонилметил-6-метил-3-[[2'-(1Н-тетразол-5-ил)бифенил-4-ил]метил]пиримидин-4(3Н)-он (соединение 6),
2-н-бутил-5-пиперидинотиокарбонилметил-6-метил-3-[[2'-(1Н-тетразол-5-ил)бифенил-4-ил]метил]-пиримидин-4(3Н)-он (соединение 7),
2-н-бутил-5-пирролидинотиокарбонилметил-6-метил-3-[[2'-(1Н-тетразол-5-ил)бифенил-4-ил]метил] пиримидин-4(3Н)-он (соединение 8),
2-н-бутил-5-азетидинотиокарбонилметил-6-метил-3-[[2'-(1Н-тетразол-5-ил}бифенил-4-ил]метил]пиримидин-4(3Н)-он (соединение 9),
2-н-бутил-5-(2'-аминотиокарбонилэтил)-6-метил-3-[[2'-(1Н-тетразол-5-ил)бифенил-4-ил]метил]пиримидин-4(3Н)-он (соединение 10),
2-н-бутил-5-(2'-диметиламинотиокарбонилэтил)-6-метил-3-[[2'-(1Н-тетразол-5-ил)бифенил-4-ил]метил]пиримидин-4(3Н)-он (соединение 11),
2-н-бутил-5-(2'-диэтиламинотиокарбонилэтил)-6-метил-3-[[2'-(1Н-тетразол-5-ил)бифенил-4-ил]метил]пиримидин-4(3Н)-он (соединение 12),
2-н-бутил-5-(2'-тиоморфолинотиокарбонилэтил)-6-метил-3-[[2'-(1Н-тетразол-5-ил)бифенил-4-ил]метил]пиримидин-4(3Н)-он(соединение 13) и
2-н-бутил-5-(2'-морфолинотиокарбонилэтил-6-метил-3-[[2'-(1Н-тетразол-5-ил)бифенил-4-ил]метил]пиримидин-4(3Н)-он (соединение 14).
6. Фармацевтическая композиция, обладающая антагонистическим действием против ангиотензина II, содержащая терапевтически эффективное количество соединения по пп.1-5 и фармацевтически инертный носитель.
7. Соединение по пп.1-5, обладающее антагонистическим действием против ангиотензина II, применимое при сердечно-сосудистых заболеваниях.
8. Способ получения соединения (I) по п.1, в котором Х представляет S, реакцией соединения формулы (II)
с P4S10 или реагентом Лоэссона в растворителе, выбранном из бензола, дихлорметана или тетрагидрофурана:
где R1, R2, R3, R4, Z, m и n имеют те же значения, которые даны в п.1.
| WO 9608476 A1, 21.03.1996 | |||
| N-ЗАМЕЩЕННЫЕ ГЕТЕРОЦИКЛИЧЕСКИЕ ПРОИЗВОДНЫЕ ИЛИ ИХ СОЛИ, ПРОМЕЖУТОЧНЫЕ ПРОИЗВОДНЫЕ ПИРИМИДИНА И ИМИДАЗОЛИНА И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ОСНОВЕ ЗАМЕЩЕННЫХ ГЕТЕРОЦИКЛИЧЕСКИХ ПРОИЗВОДНЫХ | 1991 |
|
RU2099331C1 |
| 1970 |
|
SU419048A3 | |
| Электромагнитный гусеничный механизм устройства для передвижения по произвольно ориентированным в пространстве стальным поверхностям | 1975 |
|
SU550313A1 |
| Муфта включения | 1976 |
|
SU607077A1 |
| Устройство для срезания сучьев | 1975 |
|
SU561664A1 |
| Способ получения производных симм-триазина | 1973 |
|
SU481614A1 |
| AKIHIRO O | |||
| et al | |||
| Preparation of condensed pyrimidinone derivatives as angiotensin II antagonists | |||
| Chemical Abstracts (Columbus Ohio,USA) | |||
| Топка с качающимися колосниковыми элементами | 1921 |
|
SU1995A1 |
Авторы
Даты
2004-07-27—Публикация
1999-04-26—Подача