Изобретение относится, в общем, к синтезу пептидов in vitro, а более конкретно к синтезу растущих пептидов на рибосомах Escherichia cali с использованием разновидностей синтетической тРНК.
В течение длительного времени исследователи пытаются разработать методологию, которая сделает возможной эффективную модификацию и образование пептидов вне пределов живых клеток. Одним из технических компонентов такой попытки является модификация тРНК с измененным аникодоном или сайтами распознавания для энзиматического аминоацилирования. Модифицированные тРНК делают относительно простым замещение различных аминокислот в участке-мишени белка посредством образования единственного нового кодона, который моет прочитываться каждой из серий модифицированных тРНК-т.
Используя серии модифицированных тРНК по одной на каждую из различных аминокислот, специфическую аминокислоту можно включить в белок в том участке(ах) мишени, который представляет интерес. Поскольку в любой системе в большинстве случаев синтезируется только один белок, действие аминокислотного замещения на активность полипептида можно измерить напрямую без образования клона для каждого аминокислотного замещения и без проблем, часто связанных с экспрессией и последующей проверкой белка, который образуется в интактных клетках.
В конечном счете в связи с усовершенствованием способности предсказывать третичную структуру белка по его аминокислотной последовательности будет возможно производить полностью спланированные белки, используя мРНК, которая содержит только 20 кодонов, по одному на каждую из 20-и естественно существующих аминокислот, для которых имеется кодон в универсальном генетическом коде. Аминокислоты также могут быть включены в один или более специфических участков в белке путем использования модифицированных тРНК, содержащих антикодоны для некоторых из 41 неиспользованного кодона. Далее посредством использования предпочтительнее химического, чем энзиматического аминоацилирования модифицированных тРНК будет возможно включать в эти искусственные белки аминокислоты, которые не имеют естественно существующего партнера. Это сделает возможным проектирование, проверку и производство искусственных ферментов, которые используют каталитические механизмы и субстраты, которые не существуют в живых организмах.
Ацилирование тРНК специфической аминокислотой может быть выполнено путем либо химической, либо энзиматической реакции, в последнем случае используя аминоацил-тРНК синтетазы (АС). Методы химического аминоацилирования тРНК известны (Робертсон С.А. и др., 1989, Nucl. Acid Res., 17: 9649 - 9660; Хаген М. и др., 1988, J. Org. Chem., 53: 5040 - 5045).
В живых системах АС должна с высокой специфичностью распознавать как аминокислоту, так и тРНК, которую нужно аминоацилировать. Распознавание АС-зами разновидностей тРНК зависит от специфических структурных особенностей тРНК. Не существует одного единственного набора структурных особенностей у различных тРНК, который определяет их распознавание родственной АС./Ц, де Дюв, 1988, Nature, 333: 117 - 118. Очевидно, что многие из структурных особенностей для идентификации тРНК не являются строго консервативными у определенных разновидностей тРНК в различных организмах. Было обнаружено значительное разнообразие в специфичности аминоацилирования синтетических тРНК АС-зами из E.coli, дрожжей и ретикулоцитов кроликов, а также в условиях, при которых осуществляется аминоацилирование (температура, концентрация соли и опермина или опермидина). Выяснены некоторые принципы распознавания тРНК родственной АС. По-видимому, некоторые АС имеют жесткие требования ко всему антикодону, в то время как другие распознают только часть антикодона. Очевидно, Мет-тРНК АС является в высокой степени зависимой от антикодона ЦАУ (Гош Г. и др, 1990, Biochem, 29 : 2220 - 2225); АС для других тРНК могут требовать второго или третьего нуклеотида антикодона.
Ас-азы для других аминокислот, по-видимому, распознают особенности тРНК, которые являются независимыми от антикодона, но отвечают за участки положительного, а в некоторых случаях - отрицательного распознавания где-либо в другом месте структуры тРНК. Результат Шимелла и Хоу демонстрирует, что пара оснований ГЭ-Ц70 в аминокислотной шпильке тРНК Ала является первичным участком распознавания для Ала-тРНК АС (Хоу Ю.М. и др., 1988, Nature, 333: 140 - 145).
Теперь имеется потенциальная возможность спроектировать и получить in vitro синтетические тРНК, которые аминоацилируются энзиматически и могут быть использованы в бесклеточных трансляционных системах. Эти синтетические тРНК могут иметь большое значение для выяснения функции рибосомы, в особенности, в отношении движения растущего пептида внутри рибосомы и его свертывании в активную конформацию. Точное положение и конформация растущего пептида в процессе его формирования в рибосоме остаются неизвестными.
Целью изобретения, следовательно, является предоставление синтетических тРНК.
Другой целью изобретения является предоставление методов получения синтетических тРНК-т.
Следующей целью изобретения является предоставление полипептидов, образующихся in vitro с использованием синтетических тРНК.
В соответствии с настоящим изобретением тРНКЦис, тРНКСер, тРНК
На фиг. 1-9 представлены последовательности для пЦИС, пСЕР, пАЛА и нФМЕТ. Последовательности для тРНКЦис (ГЦА) и тРНКСер (ГГА) взяты из работы (Спринзл М. и др. 1984, Nucl. Acid Res. 12: г1 - г131). Указано расположение участков рестрикции и промотора РНК-полимеразы Т7 из 17 оснований. Буквы, показанные сверху каждой последовательности, представляют нуклеодиты в последовательности дикого типа, которые были замещены. В каждой тРНК подчеркнут антикодон ААА. 1А: ген тРНКЦис (ААА) (пЦИС или последовательность 1Д, N 1) был сконструирован из четырех синтетических олигомеров, которые ренатурировали (отжиг) и лигировали с pUC18, расщепленной Hind 111/Bam H1. Эти четыре олигомера показаны сплошными линиями сверху и снизу последовательности пЦИС. Звездочкой над последовательностью пЦИС указано место, где было вставлено основание. 1В: ген тРНКСер (ААА) (пСЕР или последовательность 1Д, N 2) был сконструирован посредством копирования гена тРНКСер (ГГА) из генома E. coli при помощи ПЦР с использованием двух специфических затравок. Эти затравки показаны сплошными линиями сверху и снизу последовательности пСЕР. Для увеличения аминоацилирования в пСЕР произведена замена Т на А. 1С: ген тРНК
Конформация растущего пептида при его вытягивании за пределы рибосомы, вероятно, является решающей в определении того, как свертывается окончательный пептидный продукт. Приведено неопровержимое доказательство того, что некоторые, а возможно и все растущие пептиды, образующиеся на естественных мРНК-х, выходят из рибосомы на внешней поверхности большой рибосомной субъединицы в точке, отдаленной от пептидил-трансферазного центра (Бернау Ц. и др. 1980, Proc. Natl. Acod. Sci. США 79 : 3111 - 3115). Участок растущих пептидов, содержащий 30 - 40 аминокислот, защищен от протеолиза рибосомой (Макин Л.И. и др., 1976, J/ Mоl. Biol., 26 : 329 - 346). Это может отражать длину пептида, требующего для покрытия расстояния между пептидил-трансферазным центром и областью выхода.
Конформация естественных растущих пептидов в момент оставления ими пептидил-трансферазного центра неизвестна. (Пикинг У.Д. и др. 1990, J. Biol. Chem. , 266 : 1534 - 1542) продемонстрировали, что в процессе элонгации растущие полифенилаланин и полилизин ведут себя соответственно по-разному при их формировании из поли(Y) и поли(A) соответственно. При попытке разобраться в этих результатах были созданы разновидности синтетической тРНК, которые способствуют поли(Y)-направленному синтезу полипептидов.
Материалы и химикаты. В предлагаемой заявке используются следующие сокращения, определяемые здесь как: ЭДТА, этилендиаминтетрауксусная кислота, двунатриевая соль: ХЕПЕС, N-(2-гидроксил)пиперазин-N'-2-этансульфокислота; ТРИС, трис-(гидроксиметил)аминометан; поли(Y), полиуридиловая кислота; поли(A), полиадениловая кислота; ацфен-тРНК, Фен-тРНК, которая была ацилирована по своей α -аминогруппе; СРМ-Фен-тРНК, Фен-тРНК, которая была меркаптоацетилирована по своей α -аминогруппе, а затем реагировала с СРМ; СРМ-Сер-тРНК, Сер-т-РНКСер (AAA), которая была меркаптоацетилирована по своей α -аминогруппе, а затем реагировала с СРМ; СРМ, 3-(4-малеимидофенил)-7-диэтиламино- 4-метилкумарин; тРНКЦис (AAA), синтетическая тРНКЦис, которая содержит антикодон AAA; тРНКСер (AAA), синтетическая тРНКСер, которая содержит антикодон AAA; тРНК
Плазмида pU C18 была приобретена у фирмы Bethesda Research Laboratories (Гэйтхерсбург, Мэрилэнд). Олигодезоксирибонуклеотиды были синтезированы на синтезаторе 381А фирмы Applied Biosystems (Фостер Сити, Калифорния) и очищены на колонке OPC фирмы Applied Biosystems в соответствии с рекомендациями производителя. Фрагмент Кленова ДНК-полимеразы, ДНК-лигаза Т4, рНазин и рестрикционные эндонуклеазы были получены от фирмы Promega Biotec (Мэдисон, Висконсин), рестрикционные эндонуклеазы BstNI и BstBI были приобретены у фирмы New England Biolabs (Беверли, Миннесота). Реагенты ПЦР были получены от фирмы Perkin. Elmer Cetus (Норуолк, Коннектикут). Двухтяжевое секвенирование выполняли с использованием набора Секвеназа П фирмы United States Bioshemicals (Кливлэнд, Огайо). [ α -35 S] дАТФ, [35 S] цистеин, [14C]фенилаланин и [14C]серин были приобретены у фирмы New England Nuclear (Бостон, Миннесота). Дезокси-, рибонуклеотиды и гуанозин монофосфат были получены от фирмы Pharmacia (Пискатауэй, Нью Джерси). CPM был получен от фирмы Molecular Probes (Джанкшн Сити, Орегон). Дрожжевая тРНКФен была получена от фирмы Sigma Chemical Co. (Сент-Луис, Миссури). Очищенный фактор инициации 2 (ИФ-2) E. coli был щедрым подарком д-ра Ц.Гуалерци (Институт Молекулярной Генетики Макса Планка, Берлин). Агароза ГТГ Nusieve была получена от фирмы FMC (Роклэнд, Мэн). Спектра-гель А202 был приобретен у фирмы Fisher Scientific (Хьюстон, Техас). РНК-полимераза T7 была выделена из E.coli BL 21, содержащего плазмиду pAR1219, и очищена в соответствии с методом Н.Даванлу и др., 1984, Proc. Natl. Acad. Sci., США, 949 : 71 - 78. E. coli K12, штамм А19 исходно был предоставлен нам д-рами К.Нейрхаузом и Х.Г.Уитманном, Берлин. Рост и хранение этих организмов, а также выделение рибосомных субъединиц описано О.Одомсом и др., 1980. Biochemistry, 19 : 5947 - 5954.
Конструкция пЦИС. Синтетическая тРНК, которая ацилируется цистеином, была выбрана из-за легкости и специфичности, с которыми цистеин-сульфгидрильные группы могут реагировать с малеимидными или галоидилкильными производными флуорофоров. Предварительные исследования показали, что Цис-тРНК синтетаза распознает пару оснований 3:70 акцепторной шпильки тРНК, а не композицию оснований антикодона (Ю.М.Хоу и др., 1988, Nature, 33 : 140 - 145). Таким образом можно сформировать Цис-тРНК, которая будет распознавать поли(Y) в бесклеточной трансляционной системе.
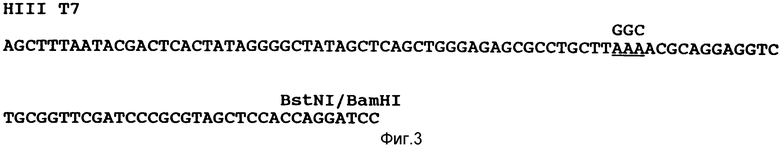
Ген тРНКЦис (AAA) (пЦис или последовательность IД, N 1), содержащий участок Hind 111, промотор РНК-полимеразы T7, мутантный ген E.coli, участок BstNI и участок BamHI, синтезировали, как показано на фиг. 1. Для того, чтобы сохранить, по возможности, наибольшее сходство с тРНКЦис дикого типа, были изменены только три участка в последовательности ее оснований. Первый участок - антикодон был изменен с ACAx на AAA. Затем для того, чтобы иметь возможность производить отбор трансформантов и дальнейшие генетические манипуляции, были созданы два внутренних участка рестрикции. В ножке Д был создан участок PstI путем замены оснований A21 и T24 на C21 и C24 соответственно. Для того, чтобы сохранить спаривание оснований в ножке, A10 было заменено на Г10. Участок SpeI был создан во внешней лопасти путем добавления основания А между основаниями У42 и С43.
В отдельных реакциях Hind 111/Pst1 олигомеры 5'-3' и 3'-5' и Pst1/BamH1 олигомеры 5'-3' и 3'-5' были ренатурированы нагреванием до 65oC и медленным охлаждением до 25oC. Полученные два двутяжелых олигомера лигировали и вставляли в pUC18, расщепленную Hind111/BamH1, путем инкубирования этих трех фрагментов в течение ночи при 16oC с ДНК-лигазой Т4. Лигированной смесью трансформировали штамм E.coli XLIB и рассевали его на чашки с агаризованной средой ЛБ, содержащей ампициллин и X-гал. Из трансформантов с плазмидами, содержащими вставку, отбирали те, в которых присутствовал полный ген тРНКЦис/(ААА); отбор проводили с использованием Spe1 - рестрикционного анализа плазмидной ДНК минилизатов. Затем определяли последовательность оснований обоих тяжей вставки.
Конструкция пСЕР. Как и в случае с Цис-тРНК-синтетазой, Сер-тРНК синтетаза распознает участки тРНК, отличающиеся от антикодона (Норманли Дж. и Абельсон Дж., 1989, Am. Rev. Biochem 58 : 1029 - 1049). Таким образом, синтетическую Сер-тРНК можно получать для использования в поли (Y)-направляемой трансляционной системе. Более легко по сравнению с химическим синтезом полной последовательности гена тРНКСер (ААА) (пСЕР или последовательность 1Д, N 2) были синтезированы два олигомера и использованы в качестве затравок в ПЦР для копирования гена из хромосомы E. coli (фиг. 2), 5'-затравка содержала четыре дополнительных нуклеотида на 5'-конце, 5' -3' Hind 111 последовательность, промотор РНК-полимеразы T7 и 43 основания тРНК, включая антикодон ААА, 3'-затравка включала четыре дополнительных нуклеотида, 3' -5' Bam H1 - и BstN1-последовательности и 12 оснований тРНК. В отличие от РНКЦис дикого типа рестрикционный BstB1 находится в пределах петли T тРНКСер, что делает ненужным новый участок рестрикции для целей отбора.
0,1 мл Реакционной смеси ПЦР, содержащий 100 пмоль каждой затравки, 20 нг хромосомной ДНК E. coli и 10 единиц ДНК-полимеразы Tag 1, покрывали минеральным маслом и подвергали одному циклу в 5 мин при 94oC, 29-и циклам в 1 мин при 94oC, 2-х мин при 55oC, 3-х мин при 72oC и одному циклу в 1 мин при 94oC, 2 мин при 55oC, 10 мин при 72oC. После окончания циклов реакционную смесь экстрагировали хлороформом, продукты разделяли электрофорезом в 4%-ном агарозном геле (ГТГ, Nusieve) с использованием 40 мМ трис-ацетат (pH 7,8) и 2 мМ ЭДТА. Основным продуктом был ожидаемый фрагмент из 124 п.о. После удаления агарозы фенольной экстракцией концы фрагмента из 124 п.о. были превращены в тупые с использованием фрагмента Кленова ДНК-полимеразы, а затем провели расщепление Hind 111 и Bam H1. После этого фрагмент лигировали с pUC18, расщепленной Hind 111/Bam H1 путем инкубации в течение ночи при 16oC с ДНК-лигазой T4. Из трансформантов, содержащих плазмиду с вставкой, отбирали те, в которых присутствовал полный ген тРНКСер/(ААА); отбор проводили с использованием BstBI-рестрикционного анализа плазмидной ДНК минилизатов. Затем определяли последовательность оснований обоих тяжей вставки.
Расщепление пЦИС и пСЕР рестриктазой BstN1 приводило к линейной транскрипционной матрице, имеющей единственный выступающий 5'-тимидин, который является комплементарным 3'-концевому аденозину тРНК. Таким образом можно ожидать, что осуществление транскрипции на пЦИС и пСЕР, расщепленных BstN1, создаст РНК либо из 75, либо из 88 нуклеотидов соответственно, которые оканчиваются 3' АССА-последовательностью акцепторной ножки тРНК. Используя конечную концентрацию РНК-полимеразы T7 0,1 мг/мл, было получено 7 - 8 мкг тРНК на мкг матричной ДНК. Хотя Миллиган и Ахленбек (1989, Meth. Enzymel. 180 : 51 : 62) сообщили, что при трансскрибировании малых тРНК-т образуются незавершенные транскрипты, электрофорез в 20%-ных денатурирующих гелях показал только один основной РНК-продукт, остающийся после гель-фильтрационной хроматографии (данные не показаны).
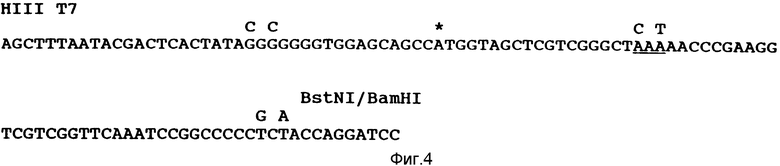
Конструкция пАДА и пФМЕТ. Были получены две другие новые тРНК. Эти тРНК энзиматически аминоацилировались аланином и обладали антикодоном ААА, что позволяет им распознавать матрицу поли (Y). Первая тРНК, тРНК
Вторая тРНК, тРНК
Следующие изменения были сделаны в тРНК
Транскрипция in vitro. Плазмидную ДНК для транскрипции готовили путем расщепления ее рестиктазой BstN1 (3) ед/мкг в течение одного часа при 60oC. Смесь экстрагировали фенолом, ДНК осаждали этанолом. ДНК в линейной форме (40 мкг) добавляли к 2 мл транскрипционной смеси, содержащей 50 мМ ХЕПЕС-КОН (pH 7,6), 10 мМ дитиотрейтола, 50 мМ NaCl, 4 мМ спермидина, 25 мМ MgCl2, 1,6 мМ ГТФ, 4 мМ ГМФ, АТФ, СТФ, УТФ, 50 ед pHазина, и 0,1 мг/мл РНК-полимеразы Т7. После инкубирования в течение 2 ч при 37oC матричную ДНК расщепляли с помощью 100 ед ДНКазы1, свободной от РНКаз. Короткие незавершенные транскрипты, лНТФ-ы и рНТФ-ы отделяли от транскриптов тРНК при помощи гель-фильтрации с использованием спектра-геля А202, уравновешенного 10 мМ ТРИС-HCl (pH 7,6), 1 мМ ЭДТА и 150 мМ NaCl. Фракцию тРНК экстрагировали один раз семсью фенол/хлороформ/изоамидовый спирт (25 : 24 : 1), один раз смесью хлороформ/изоамиловый спирт (24 : 1), а затем дважды осаждали этанолом.
Аминоацилирование тРНК. Синтетические РНК-ты аминоацилировали с использованием синтеза пшеничных проростков, которые присутствуют в белках фракции S-150, осажденных 0 - 70%-ным раствором сульфата аммония (Лакс С. и др. , 1986, Meth. Enzymol 118 : 109 : 128). Типичная смесь содержала 100 мМ ХЕПЕС-КОН (pH 7,8), 15 мМ Mg (ОАц)2, 2 мМ спермидина, 5 мМ дитиотрейтола, 5 мМ АТФ, 30 мкМ соответствующей радиоактивной аминокислоты (100 Сi моль), 0,8 мг/мл синтетазной фракции и 0,5 - 1 А260 тРНК/мл; смесь инкубировали в течение 20 мин при 27oC. Эффективность аминоацилирования определяли путем осаждения тРНК трихлоруксусной кислоты и измерения радиоактивности отфильтрованного осадка при помощи жидкостного сцинтилляционного счетчика.
Хотя тРНКЦис (ААА) была получена из гена тРНКЦис E. coli дикого типа, она не может аминоацилироваться синтетазой фракции S-150 E. coli. А синтетазы, которые содержат фракцию S-150 проростков пшеницы, осажденную 0 - 70% сульфатом аммония, действительно аминоацилируют тРНКЦис (ААА). Эта ферментная фракция также эффективно аминоацилирует синтетическую тРНКСер (ААА). На основании результатов реакций трансляции, в которых участвовала только фракция S-150 E. coli, можно заключить, что тРНКСер (ААА) также может быть достаточно хорошо аминоацилирована синтетазами E. coli (см. табл. 1).
Дрожжевая тРНКФен была аминоацилирована с использованием фракции S-150 E. coli в качестве источника аминоацил-тРНК-синтетазы (Хардести В. и др., 1971, Meth. Enzymol. 20 : 316 : 330), тРНКСер (ААА), тРНК
Эффективность аминоацилирования была различной для разновидностей синтетической тРНК, тРНКЦис (ААА), транскрибированную in vitro можно было аминоацилировать только на 20%, в то время как более 55% тРНКсер (ААА) было аминоацилировано синтетазами проростков пшеницы (данные не показаны). К несчастью цис-тРНКЦис (ААА) была нестабильна, что препятствовало ее выделению после аминоацилирования.
Нестабильность цис-тРНКЦис (ААА) препятствовала и последующей очистке, однако для дальнейшего исследования реакцию аминоацилирования можно было скомбинировать с реакцией трансляции E. coli. Напротив, сер-тРНКCер (ААА) была очень стабильной на протяжении неоднократных манипуляций, в процессе которых она была очищена и помечена кумарином.
Аминоацилирование тРНК
В табл. 1 представлен поли(У)-направляемый синтез полифенилаланина, полицистеина и полисерина. Все реакции были инициированы неэнзиматически путем предварительного связывания 60 пмоль Ацфен-тРНК или АцСер-тРНК в концентрации, равной концентрации рибосом в течение 5 мин при 37oC. Все образцы были инкубированы при 37oC в течение 30 мин; в это время концентрацию NaOH в образцах доводили до 0,1 М, а затем из инкубировали еще 15 мин при комнатной температуре для гидролиза связи тРНК-аминокислота. Белки реакционной смеси затем осаждали трихлоруксусной кислотой и отфильтровывали. Отфильтрованное вещество высушивали и измеряли его радиоактивность. Образцы при 28oC инкубировали 120 мин перед измерением включения [35S] цистеина.
Трансляция in vitro с использованием синтетических тРНК. Для проверки синтетической активности тРНКЦис (ААА) и тРНКСер (ААА), каждая из них была использована для поли(У)-зависимого полипептидного синтеза. Поли(У)-зависимое включение [14С]фенилаланина в полифенилаланин измеряли (Одом О. и др., 1980). Для неэнзиматической инициации 0,6 мкМ Ацфен-тРНК или АцСер-тРНК предварительно связывали с 0,6 мкМ рибосом E.coli в присутствии поли(У) в течение 10 мин при 37oC (Пикинг У.Д. и др., 1990). Для того, чтобы проверить чувствительность к эритромицину антибиотик в конечной концентрации 5 мкМ добавляли до этапа предварительной инкубации. Включение [14С]серина в полисерин проводили точно также, как и синтез полифенилаланина за исключением того, что тРНКФен E.coli была заменена на 1,17 А260/мл синтетической тРНКСер (ААА). Элонгацию начинали путем добавления фракции S-150 E.coli к конечному объекту 100 мкл.
Эксперимент по трансляции был модифицирован для облегчения поли/-(У)-зависимого синтеза полицистеина. Ацфен- тРНК или АцСер-тРНК/60 пмоль предварительно связывали с 60 пмоль рибосом, как описано выше. Затем смесь доводили до 100 мкл всем необходимым для трансляции за исключением тРНК и аминокислоты. Для начала полицистеинового синтеза реакцию аминоацилирования Цис-тРНКЦис (ААА), описанную выше, соединяли с реакцией трансляции посредством добавления равных объемов реакционных смесей для каждой реакции с образованием конечного объема в 200 мкл. Затем реакционную смесь инкубировали при 37oC в течение 30 мин или при 28oC в течение 120 мин для предоставления возможности реаминоацилирования тРНКЦис (ААА) цистеинил-тРНК-синтетазой пшеничных проростков, для того, чтобы проверить конформацию и окружение каждого растущего пептида. СРМ-Фен-ТРНК или СРМ-Сер-тРНК предварительно связывалось, как описано выше. Для обеспечения того, чтобы основная масса флюорофора действительно была связана, концентрация флуоресцентного аналога аминоацил-тРНК была снижена на, приблизительно, 10% по отношению к концентрации рибосом. Мечение СРМ аминокислотной группы каждой из двух синтетических [14С] аланил-тРНК также выполняли, как описано предварительно для природных и синтетических тРНК-т. СРМ-Ала-тРНК очищали при помощи C1 обратно-фазовой высокоэффективной жидкостной хроматографии, в сущности, как описано для СРМ-Сер-тРНКСер (ААА).
Результаты трансляции in vitro с использованием синтетических Цис- и Сер-тРНК-т и тРНКФен дикого типа показаны в табл. 1. Включение цистеина измеряли как при 37, так и при 28oC. Более низкая температура делает возможным большее реаминоацилирование тРНКЦис (ААА) ферментом пшеничных проростков. Все реакции трансляции были инициированы неэнзиматически с Ацфен-тРНК или АцСер-тРНК, которые предварительно связывались с рибосомами в молярном соотношении 1:1 в присутствии поли(У). Были образованы шесть типов реакционных смесей с рибосомами, несущими растущие полипептиды с N-Ацфен и N-АцСер на аминоконце в каждой третьей смеси соответственно. Также была проверена чувствительность синтеза каждого полипептида к подавлению 5 мкМ эритромицина. Параллельно для инициации каждого полипептида использовали [14С] Ацфен-тРНК в присутствии немеченой аминокислоты для того, чтобы оценить число рибосом, которые полностью активны в синтезе каждого типа растущего пептида (данные не показаны).
Более 1500 пмоль фенилаланина было включено в полифенилаланин в присутствии или отсутствии эритромицина (см. табл. 1). Было определено, что 30% (18 пмоль) рибосом в реакционных смесях было активно в полифенилаланиновом синтезе. Используя это значение, было вычислено, что растущие полифенилаланиновые пептиды составляют, приблизительно, 80 аминокислот в длину. Так как синтетическую тРНКСер (ААА) можно аминоацилировать при помощи неочищенной фракции S-150 E.coli, синтез полисерина выполняли таким же образом, как и синтез полифенилаланина. В том случае, однако, только около 500 пмоль серина было включено в полисерин. Этот синтез подавлялся эритромицином приблизительно на 90% (см. табл. 1). Только около 10% рибосом было активно в полисериновом синтезе, которые, однако, также давали среднюю длину пептида, приблизительно в 80 аминокислот (данные не показаны).
При 37oC 99 пмоль цистеина включались в полицистеин в течение 30 мин. Процесс на 41% подавлялся эритромицином (см. табл. 1). По произведенной оценке 15% (10 пмоль) рибосом было активно в полицистеиновм синтезе, что соответствует средней длине пептида, приблизительно в 10 аминокислот. Следует отметить, что этот синтез проводили в соединенной системе - аминоацилирование (пшеничные проростки): трансляция (E.coli). Только очень ограниченное реаминоацилирование тРНК синтетазой пшеничных проростков может осуществляться при 37oC. Для подбора лучших условий полицистеионовый синтез также инициировали при 28oC и проводили его при этой же температуре в течение 120 мин (см. табл. 1). В этом случае было включено 247 пмоль. Как и при 37oC, 10 пмоль рибосом было активно в полицистеиновом синтезе, что дает среднюю длину пептида, приблизительно в 25 аминокислот в этом случае.
Больший масштаб полифенилаланинового синтеза (большая средняя длина пептида, более высокое соотношение рибосом с растущими пептидами) в поли(У)-направляемой трансляционной системе может отражать атипичные свойства фенилаланиновых пептидов. Очевидно, что короткие фенилаланиноновые пептиды более легко осаждаются трихлоруксусной кислотой, чем короткие пептиды серина или цистеина. Это может способствовать относительно большей общей величине включения фенилаланина и, вероятно, является главным фактором, ответственным за относительно низкий процент рибосом, которые, по-видимому, активны в синтезе полисерина или полицистеина. Другим фактором, который может содействовать относительно большой величине общего включения фенилаланина, является протяженное время, в течение которого поддерживается почти линейная скорость пептидного синтеза в процессе образования полифенилаланина. Снижение скорости пептидного синтеза, которое наблюдается для большинства пептидов, отличающихся от полифенилаланина, может отражать подавление продуктом (реакции). (Спирин А.С. и др., 1988, Science, 242: 1162 - 1164). Наблюдали почти линейные скорости синтеза в течение многих часов, если пептидный продукт удаляли из реакционной смеси по мере его образования. Растущие полифенилаланиновые пептиды являются настолько нерастворимыми, что они могут эффективно удаляться из раствора во время реакции, приводя таким образом к ситуации, равноценной той, что складывается в непрерывно действующей трансляционной системе.
Результаты, представленные в табл. 1, также демонстрируют, что пол(У)-направляемый синтез полицистеина и полисерина с участием синтетических тРНК является чувствительным к подавлению эритромицином. В противоположность этому, синтез полифенилаланина не подавляется антибиотиком при тех же условиях. Это согласуется с предшествующими наблюдениями (Чинали Т. и др., 1988, Biochem. Biophy. Acta. 949: 71 - 78; Отака Т. и др., 1975, Proc. Natl. A. Sci. , США, 72: 2649 - 2652; Васкуез Д., 1979. Молекулярная биология, биохимия и биофизика, Шпрингер-Ферлаг, Берлин, т. 30, с. 312) и поддерживает гипотезу о том, что эта разница в чувствительности к эритромицину является результатом свойств самого растущего пептида.
Были сделаны попытки провести поли(У)-зависимый полипептидный синтез с использованием Ала- тРНК
Только тРНК
Были предприняты испытания для определения того, может ли АцАла- тРНК
Для определения числа инициированных растущих цепей использовали Ац [14С] аминоацил-тРНК в присутствии нерадиоактивного аланина.
[14С] Аланин использовали для измерения включенного Ала (пмоль) в полиаланин. Средняя длина растущего полиаланина выражается как пмоль Ала/пмоль растущих цепей, как описано в методах.
Флуоресцентные свойства остатка СРМ при α - аминогруппе этих двух аминоалицированных аланин-тРНК-т отражают локальное окружение флюорофора, когда тРНК-ы находятся в растворе в свободном состоянии или в связи с рибосомами. СРМ-Ала- тРНК
Эти функциональные различия могут отражать различия в структуре инициаторной и элонгаторной тРНК. Имеется много участков со строгой консервативностью у прокариотических инициаторных тРНК, которые отличают их от элонгаторных тРНК (Сеонг Б.Л. и др., 1987; Уакао Х. и др., 1989; Гуалерзи Ц.О. и др. , 1990, Biochem. 29: 5881 - 5889). Эти особенности включают отсутствие Уотсон-Криковской пары оснований между остатками 1 и 72, присутствие пары оснований пурин 11-пиримидин-24 в дигидросуридиновой шпильке (шпильке Д) и трех последовательных пар оснований Г-Ц в антикодоновой шпильке (Сеонг Б.Л. и др., 1987). Последняя особенность может быть вовлечена в отличии инициаторных тРНК от элонгаторных тРНК и являться требованием для специфического связывания участка П в рибосомах (Сеонг Б.Л. и др., 1987). Было показано, что сайт-специфические мутации в этом участке антикодоновой ножки приводят к постепенной утрате инициаторной функции у тРНК
Измерения флуоресценции при удлинении новых растущих полипептидов. Сначала СРМ-Фен-тРНК или СРМ-Сер-тРНК использовались для начала поли(У)-зависимого синтеза полифенилаланина, полицистеина и полисерина. Мечение СРМ α - группы дрожжевой Фен-тРНК описано у Одома О. и др. (1990). Сер-тРНКСер (ААА) был помечен сходным образом по α - группе серилового фрагмента. Флуоресцентные аналоги тРНК очищали обратно-фазовой ВЭЖХ на колонке C1 способом, сходным с тем, что описан для СРМ-Фен-ТРНК.
Измерение динамически-равновесной флуоресценции выполняли на спектрофлюориметре со счетом протонов, модель 8000 фирмы SLM Aminco Instruments, Inc.
(Урбана, Иллинойс), как описано предварительно (Ричлик У. и др., 1983, Biochemistry, 22 : 85 - 93). Спектральные данные накапливали при интервалах в 1 нм со скоростью развертки 0,5 с на приращение длины волны. Все измерения регулировались автоматически в соответствии с зависимостью длины волны от чувствительности фотоумножителя. Измерения флуоресценции были сделаны при поглощении света менее, чем 0,1, при возбуждающей длине волны в объеме 0,5 мл и при температуре 20oC для того, чтобы намеренно замедлить ход элонгаций. Измерения динамически-равномерной флуоресцентной анизотропии проводили, как описано (Одом О, 1984, Biochemistry, 23 : 5069 - 5076).
Анизотропия флуоресценции проб СРМ на этих аминокислотах была прослежена по мере формирования растущих пептидов. Связывание СРМ-фен-тРНК в пептидил-трансферазном центре рибосом приводит к увеличению флуоресцентной анизотропии с 0,18 до почти 0,36. Такая высокая флуоресцентная анизотропия отражает прочность, с которой аминокислота СРМ-Фен-тРНК удерживается в пептидилтрасферазном центре (Пикинг У.Д. и др., 1990). Синтез нескольких первых пептидных связей полифенилаланина приводит к снижению анизотропии, которая затем увеличивается по мере удлинения растущего пептида. В противоположность этому поли (А)-зависимый полилизиновый синтез приводит к быстрому падению анизотропии, так как аминоконцевая проба вытеснялась из пептидилтрансферазного центра без какого-либо последующего увеличения анизотропии.
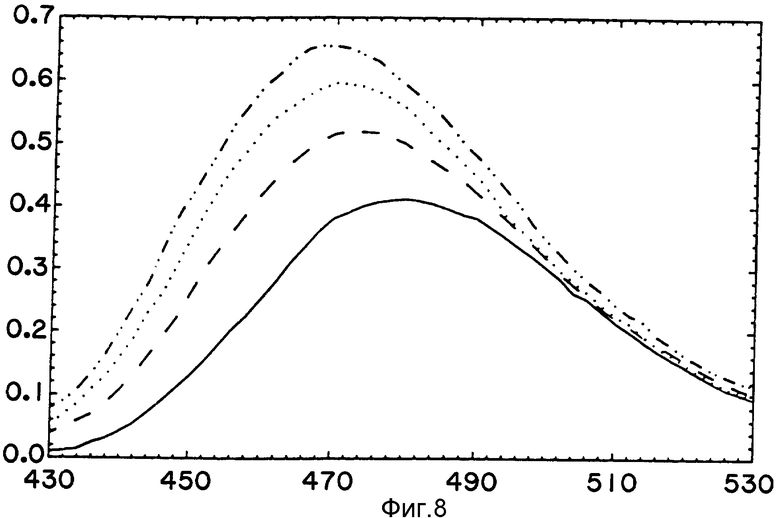
При инициации синтеза полицистеина или полисерина с СРМ-Фен-тРНК анизотропия резко падала таким образом, который в чем-то напоминал ранее наблюдавшийся у полидизина (фиг. 6). Однако в отличие от синтеза полилизина, анизотропия этих растущих пептидов впоследствии выравнивается на короткие периоды времени перед тем, как упасть еще раз (фиг. 6). Таких результатов можно ожидать, если аминоконцы обоих растущих пептидов выводятся из рибосом на расстоянии, равном длине в несколько аминокислот от пептидильного центра. Растущие сериновые пептиды более длинные, чем цистеиновые пептиды (см. табл. 1), из чего можно предположить более низкую конечную анизотропию первого. Основываясь на этих и предыдущих результатах, можно предположить, что полицистеиновый и полисериновый растущие полипептиды вытягиваются прямо в окружающей раствор, больше всего напоминая поли(А)-направляемый растущий полилизин.
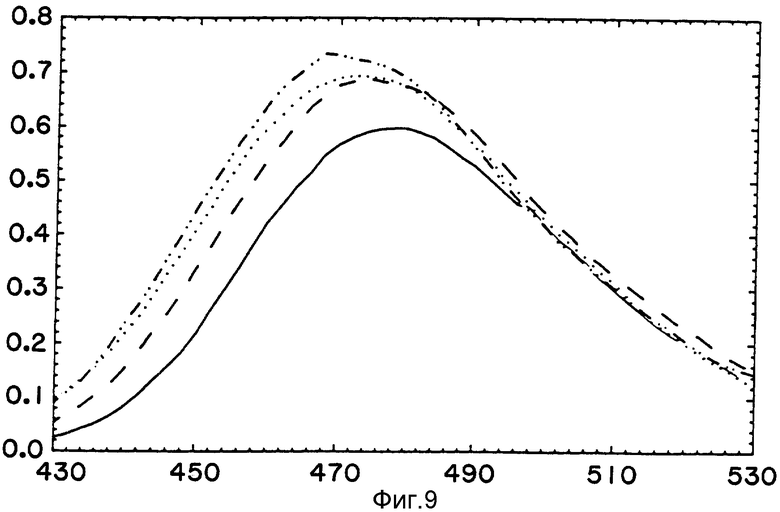
Для того, чтобы предоставить дополнительное доказательство того, что результаты, описанные выше, не являются результатом использования СРМ-Фен-РНК для инициации трансляции, каждая разновидность растущего полипептида, включая полифенилаланин, была инициирована с помощью СРМ-Сер-тРНК. За изменениями флуоресценции, которые появлялись по мере элонгации пептидов, следили, как описано выше. Как наблюдалось предварительно, анизотропия уменьшалась, когда образовывались первые пептидные связи полифенилаланина, а затем увеличивалась по мере удлинения пептида (фиг. 7) (Пикинг У.Д. и др., 1990). Анизотропия пробы СРМ-Сер также значительно снижалась, когда образовывались первые пептидные связи полицистеинового и полисеринового пептидов. Однако в противоположность результатам для полифенилаланина анизотропия не увеличивалась по мере удлинения полипептидов. Интересно, что снижение анизотропии останавливалось на короткий период после того, как к аминоконцевому СРМ-Сер добавлялись несколько аминокислот (по оценкам 3 или 4) (фиг. 7). Эти результаты похожи на те, что получены при инициации пептидов с помощью СРМ-Фен. Основание этого результата неясно. Оно может отражать конформацию короткого растущего пептида или специальную структурную особенность рибосом, с которой сталкивается проба при начальном удлинении пептида.
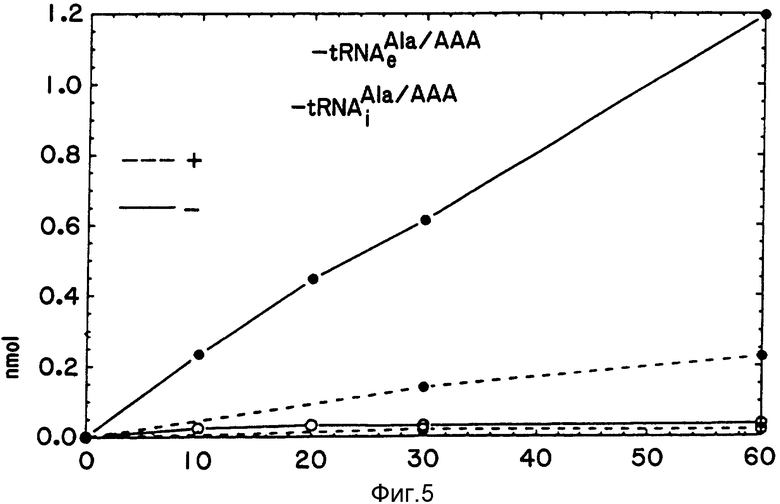
Для оценки средней длины растущих пилиаланиновых цепей (см. табл. 2), было необходимо экспериментально определить число рибосом, активных в поли(У)-зависимом полипептидном исследовании, описанном выше. Чтобы сделать это, 55 пмоль Ац [14C] Фен-тРНК (100 Ci/моль), Ац [14C] Ала- тРНК
Снова спектрофлюориметр со счетом протонов, модель 8000 фирмы SLM-Amincо Instruments, Inc. (Урбана, Иллинойс), был использован для измерения динамически-равновесной флуоресценции, как описано выше. Флуоресцентные тРНК связывали с рибосомами, как описано выше, за исключением того, что концентрация этих тРНК была снижена приблизительно на 10% по отношению к концентрации рибосом для обеспечения максимального связывания тРНК. Спектры измеряли при эмиссионных интервалах в 1 нм и скоростью развертки 0,5 с на приращение длины волны с возбуждающей длиной волны 385 нм. Измерения анизотропии и относительной интенсивности выполняли при эмиссионной длине волны 475 нм. Измерения автоматически корректировались в соответствии с зависимостью длины волны от чувствительности фотоумножителя. Измерения флуоресценции проводили при 20oC в объеме 0,6 мл. Все измерения были сделаны при поглощении света менее, чем 0,1, при возбуждающей длине волны, а измерения флуоресцентной анизотропии были сделаны, как предварительно описано у Пикинга У.Л. и др. 1991. Количественные выходы СРМ-Ала- тРНК
Интересно, что флуоресцентная анизотропия и количественный выход различны для двух тРНК в условиях проверки. Анизотропия свободной СРМ-Ала- тРНК
Эти результаты предполагают, что синтетическая инициаторная тРНК сохраняет связывающие способности естественной тРНК
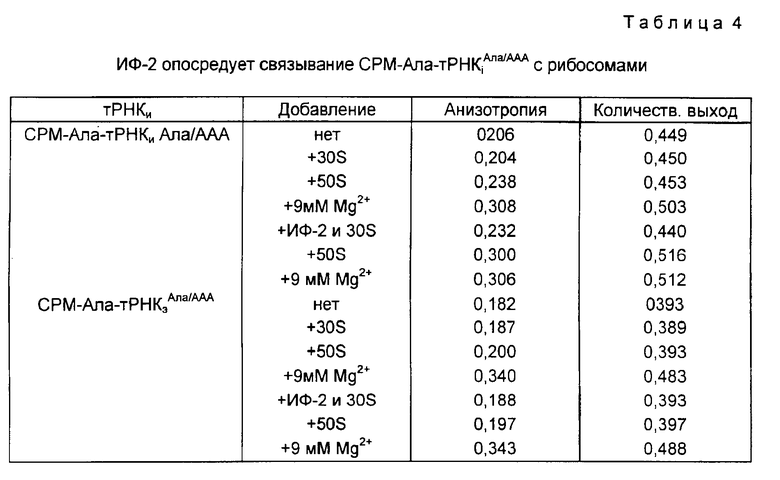
СРМ-Ала- тРНК
ИФ-2 и/или рибосомные 30S-субъединицы инкубировали с флуоресцентной тРНК в течение 15 мин при 37oC с 5 мМ Mg2+, присутствующим перед измерением флуоресценции. После каждого последующего добавления реакционную смесь инкубировали 10 мин при 37oC и затем 15 мин при 20oC (в кювете, используемой для измерений флуоресценции) перед считыванием флуоресценции. Все реакции выполняли в конечном объеме 600 мкл, как описано в методах. Вслед за добавлением рибосом концентрацию Mg2+ увеличивали на 9 мМ (для получения конечной концентрации в 15 мМ) с целью предоставить возможность для неэнзиматического связывания флуоресцентных тРНК-т. Затем вновь измеряли анизотропию и количественный выход в сравнительных целях.
Способность тРНК
Напротив, СРМ-Ала- тРНК
Флуоресценция кумаринового фрагмента СРМ очень чувствительна к гидрофобности, заряду и другим факторам ближайшего окружения пробы. Как и с обсуждающейся выше СРМ-Сер-тРНК, эта чувствительность окружения была использована для сравнения двух СРМ-Ала-тРНК-т в различных условиях. Спектры флуоресцентной эмиссии СРМ-Ала- тРНК
Интенсивность эмиссионного спектра СРМ-Ала- тРНК
При связывании эритромицина с рибосомами, уже содержащими СРМ-Ала- тРНК
Результаты с эритромицином и спарзомицином/пуромицином поддерживают заключение в том, что участок СРМ-Ала инициаторной тРНК удерживается в ином положении на рибосоме, чем такой же участок элонгаторной тРНК. Интересной особенностью этих результатов является то, что синтез полиаланина, инициируемый любой АцАла-тРНК, подавляется эритромицином, и каждая N-ацил-тРНК способна к реакции с пуромицином (в отсутствии спарзомицина), когда она связана с рибосомным участком П. Это предполагает, что участок СРМ-Ала инициаторной тРНК удерживается иначе по отношению к участкам связывания эритромицина и пуромицина, чем такой же участок элонгаторной тРНК, без очевидного эффекта на функцию каждого антибиотика. Причина такого различия в положении СРМ-Ала неясны, но, скорее всего, отражают различия в конформации тРНК, нежели функцию пептидильного переноса.
В кратком изложении синтетическая тРНКЦис(ААА), хотя и несколько хуже аминоацилируемая, эффективно использовалась для поли(У)-направляемого полицистеинового синтеза. Синтетическая тРНКСер(ААА) была гораздо лучшим субстратом для аминосацилирования и также эффективно использовалась в поли(У)-направляемой трансляционной системе. Интересной особенностью поли(У)-направляемого синтеза полицистеина и полисерина было то, что каждый был чувствителен к подавлению предварительно связанным эритромицином, будучи неэнзиматически инициированным либо с АцСер-тРНК, либо с Ацфен-тРНК. Это находится в прямой противоположности полифенилаланиновому синтезу, который не затрагивается эритромицином, когда он инициируется либо с Ацфен-тРНК, либо с АцСер-тРНК. Эти данные поддерживают вывод о том, что чувствительность к эритромицину является функцией растущего пептида, а не мРНК или РНК.
Для расширения этих данных были прослежены флуоресцентные свойства пробы СРМ, присоединенной к аминоконцевому фенилаланину или серину, по мере образования полифенилаланина, полицистеина или полисерина. Полифенилаланин, инициированный либо с СРМ-фенилаланина, либо с СРМ-серина, вел себя последовательно и, по-видимому, строился как нерастворимая масса, присоединенная к пептидил-трансферазному центру. С другой стороны, растущие пептиды, которые удлинялись с помощью цистеина или серина, по-видимому, выходили из пептидил-трансферазного центра прямо в окружающий раствор, когда они инициировались с АцСер-тРНК или с АцФен-тРНК. Этот результат сходен с тем, что наблюдался для полилизина.
При сравнении двух синтетических аланиновых тРНК-т, элонгаторная тРНК (тРНК
Предлагаемое изобретение хорошо приспособлено для выполнения задач и получения результатов и преимуществ, упоминавшихся ранее, а также других, ему присущих. В то время, как предлагаемые предпочтительные осуществления изобретения описаны с целью раскрытия его сущности, могут быть сделаны многочисленные изменения деталей синтеза и применения без отклонения от смысла предлагаемого изобретения и сферы прилагаемой формулы изобретения. Поэтому следует понимать, что нет намерения ограничить изобретение специфической раскрытой формой, а наоборот, изобретение охватывает все модификации, альтернативные конструкции и эквиваленты, находящиеся в пределах смысла предлагаемого изобретения и сферы прилагаемой формулы изобретения.




Изобретение относится к биотехнологии. Фрагмент ДНК, кодирующий ген тРНК Цис (ААА) с установленной нуклеотидной последовательностью, получают способом, при котором осуществляют получение олигомеров 5'-3' и 3'-5' Hind III/Pst и олигомеров 5'-3' и 3'-5' PstI/Bam H1. Олигомеры ренатурируют и формируют смесь для лигирования ренатурированных олигомеров и плазмиды pUC 18, расщепленной Hind III/Bam H1. Смесь инкубируют и трансформируют ей штамм Escherichia coli. Штамм культивируют на среде с ампицилином и X-гал. Отбирают трансформированные штаммы с плазмидами, содержащими фрагмент ДНК, и определяют последовательность его оснований. Изобретение обеспечивает синтез растущих пептидов на рибосомах Esherichia coli с использованием полученной синтетической тРНК. 2 с.п. ф-лы, 9 ил., 4 табл.

2. Способ получения фрагмента ДНК, кодирующего ген т РНК Цис (ААА), отличающийся тем, что осуществляют получение олигомеров 5'-3' и 3'-5' Hind III/Pst I и олигомеров 5'-3' и 3'-5' Pst I/Bam HI, проводят их ренатурацию, формируют смесь для лигирования ренатурированных олигомеров и плазмиды рИС 18, расщепленной Hind III/Bam HI, инкубируют смесь, инкубированной лигированной смесью трансформируют штамм Escherichia coli, проводят культивирование трансформированного штамма на среде с ампициллином и X-гал, отбирают трансформированные штаммы с плазмидами, содержащими целевой продукт, и определяют последовательность его основания.
| Nucl | |||
| Acid | |||
| Res., 1984, N 12, p | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
Авторы
Даты
1998-05-20—Публикация
1992-08-21—Подача