Изобретение относится к медицине, а именно к лепрологии, и может быть использовано, в частности, для диагностики лепры.
Из практики медицины известен способ обнаружения антител к M. leprae в сыворотке крови больных лепрой с применением иммуноферментного метода, где в качестве тест-антигена используются водорастворимые белки из лепром человека (Alonso S. M., Mangiaterra M.L., Szarfman A. La reaccion de immunoperoxidasias indirecta aplicata a la lepra humana // Medicina (Argent).-1978.-Vol. 38.- N 63.- P.541-544.). Способ позволяет проводить серологическую диагностику лепры, а также осуществлять исследования с целью прогнозирования заболевания. Недостатком способа является травматичность метода получения антигенного материала: необходимость взятия биоптатов из кожных поражений больных лепрой людей. Способ невозможно внедрить в клиническую практику, поскольку даже при распространенных процессах количества M.leprae в кожных лепромах больных лепроматозной лепрой недостаточно для получения диагностикума.
Известен также способ обнаружения антител к антигенам M.leprae в сыворотке крови больных лепрой на основе иммуноферментного анализа, где в качестве тест-антигена используются препараты из М.leprae, полученные из тканей экспериментально зараженных девятипоясных броненосцев (Stanford J.L., Rook G. A.W., Samuel N., Madlener F., Khamenei A.A., Nemati Т., Modabber F., Rees R.J.W. // Preliminary immunological studies in search of correlates of protective immunity carried out on some Iranian leprosy patients and their families.- Lepr. Rev.- 1980.- Vol.51.- N 4.- P.303-314.). Способ позволяет выявлять специфические антитела к М.leprae в сыворотке крови у больных лепрой, а также у лиц, находящихся в тесном семейном контакте с больными лепрой. К недостаткам способа относится необходимость воспроизведения на броненосцах экспериментальной лепрозной инфекции, которая развивается в течение 2-5 лег. Броненосцы имеют ограниченный ареал обитания (Южная Америка), не размножаются в неволе и требуют особых условий содержания. Выделение М.leprae из тканей броненосца предусматривает использование многоэтапного метода очистки, что в свою очередь повышает стоимость и усложняет процесс получения антигенного диагностикума.
Существует способ диагностики лепры иммуноферментным методом, при котором в сыворотке крови определяют антитела к M.leprae с помощью Dis-BSA, который является полусинтетическим аналогом специфического углеводного эпитопа M. leprae - фенольного гликолипида-1 (ФГЛ-1) (Cho S.N., Fujiwara Т., Hunter S. W. , Rea Т.Н., Gelber R.H., Brennan P.J. Use of an artifical antigen containing the 3,6-di-O- methyl- β -O-glycopyranosyl epitope for the serodiagnosis of leprosy // J. Infect. Dis. - 1984.- Vol. 140.- P.311-322). Способ позволяет выявлять в сыворотках крови больных лепрой антитела к видоспецифическому антигену M.leprae - ФГЛ-1. Уровень антител коррелирует с клиническими проявлениями болезни. Недостатком способа является ограниченные возможности тест-системы, связанные с выявлением антител лишь к одному эпитопу M. leprae. Антитела к данному антигену быстро исчезают под влиянием специфического лечения и через 1-1,5 года после начала химиотерапии не определяются, в то время как у большинства больных лепрой в эти сроки обнаруживаются M. leprae в коже и выявляются антитела в сыворотке крови к другим антигенным компонентам M.leprae.
Наиболее близким способом к предлагаемому является способ обнаружения антител к M.leprae в сыворотке крови человека и броненосца при лепре, где в качестве специфического тест-антигена использованы препараты из M.leprae, пассируемые на мышах и крысах (Дячина М.Н., Сухенко Л.Т., Ющенко А.А., Ермолин Г. А. Диагностические тест-системы на основе иммуноферментного метода при лепре // Журн. микробиол., эпидемиол., иммунобиол.-1985,- N 1.- С.64-68). Использование известного способа позволяет выявлять антитела к M.leprae в сыворотке крови больных лепрой людей и броненосцев с экспериментальной лепрозной инфекцией, причем уровни антител коррелируют со степенью активности лепрозного процесса. Способ также позволяет прогнозировать сроки развития экспериментальной лепрозной инфекции у броненосцев.
Недостатки способа в длительности и многоэтапности его осуществления:
- моделирование инфекционного процесса на экспериментальных животных с целью накопления бактериальной массы занимает в среднем 1,5-2 года;
- получение очищенных M.leprae связано с многоэтапным процессом выделения возбудителя из тканей животных с экспериментальной лепрозной инфекцией.
Известный способ принят авторами в качестве прототипа.
Целью предлагаемого изобретения является упрощение способа диагностики лепры.
Поставленная цель в изобретении достигается тем, что в иммуноферментном анализе в качестве тест-антигена используют культивируемые микобактерии - Mycobacterium lufu.
Отличительной особенностью осуществления способа является использование в иммуноферментном анализе (ИФА) в качестве антигеннного диагностикума препаратов из M.lufu, ранее не используемых для этих целей. Известно, что M. lufu пригодны как тест-штамм для первичного скрининга противолепрозных препаратов in vitro.
Проведенный анализ патентной и научной литературы показал, что в известных способах диагностики лепры M.lufu не применялись.
Отсутствие воспроизводимых методов культивирования M.leprae на питательных средах является серьезным препятствием на пути создания диагностических тест-систем. Лабораторные животные (мыши, крысы, броненосцы), в организме которых размножаются M.leprae, до настоящего времени являются единственным источником бактериальной массы, используемой для создания диагностических препаратов. Получение этих препаратов осложняется еще и тем, что M. leprae, полученные в результате пассажа на лабораторных животных, необходимо выделить из инфицированных тканей организма-хозяина. Очистка возбудителя лепры от тканей экспериментальных животных представляет собой сложный, трудоемкий, многоэтапный процесс, требующий участия квалифицированного персонала, специального оборудования и реагентов, что в свою очередь также затрудняет задачу получения диагностикума.
M. lufu, выделенные из почвы в Заире (Portaels, 1980), являются сапрофитными кислотоустойчивыми микобактериями, способными расти на питательных средах. Авторами предлагается M.lufu в качестве источника бактериальной массы для получения антигенного диагностикума вместо используемых в настоящее время некультивируемых in vitro M.leprae. Предлагаемый способ позволяет сократить сроки получения тест-антигена на 1,5-2 года, т.е. ограничить сроки до 1-2 недель.
Использование культивируемых M.lufu для получения тест-антигена является существенным отличием в подходе к диагностике лепры, и именно это отличие позволило получить положительный эффект в виде упрощения способа. Предлагаемый способ позволяет отказаться от использования M.leprae, не способных расти на искусственных питательных средах, в качестве материала для получения антигенного диагностикума.
Предлагаемый способ осуществляли следующим образом: кровь из пальца в количестве 0,1 мл собирали в пробирку и помещали на 1 час в термостат (+37oC), а затем в холодильник (+4oC) на 1 час для ретракции сгустка. Отстоявшуюся сыворотку исследовали с помощью иммуноферментного метода. Для длительного хранения сыворотку замораживали при -20oC.
Использовали два водорастворимых антигенных препарата:
- антиген из M.leprae, разрушенных ультразвуком;
- антиген из M.lufu, разрушенных ультразвуком.
Бактериальную массу M.leprae накапливали путем пассирования на мышах и крысах в течение 2-х лет. M.leprae выделяли из инфицированных тканей крыс с экспериментальной лепрой по методу Draper (Draper P. Problems related to purification of M.leprae from armadillos tissues and standartization of M. leprae preparations // Report on the Enlarged S.C.Mutina.- Geneva, 1979.- W. H. O. Document. - Annex I, prot. 1/79.- P.4-4,), включающего в себя дифференциальное центрифугирование тканевых гомогенатов в гредиенте плотности сахарозы. Отделение от тканевых частиц проводили в двухфазной полимерной системе, состоящей из 7% декстрана Т-500 (фирмы Pharmacia) и 5% полиэтиленгликоля с
молекулярной массой 6 кДа (фирмы BDH). Очищенные M.leprae подвергали ультразвуковому разрушению на аппарате MSE-100 (Англия) в физиологическом растворе в течение 7 мин при 18 кГц. Эффект разрушения контролировали микроскопически. Суспензию разрушенных M.leprae центрифугировали (10000 об./мин), надосадок использовали в качестве нативного водорастворимого антигена (УЗД-М.leprae).
M. lufu культивировали на среде Левенштейна-Йенсена в течение 7 дней. Антигены получали из синхронизированной холодом (при 4oC в течение 72 ч) культуры M.lufu. Клеточные культуры подвергали ультразвуковому разрушению на аппарате MSE-100 (Англия) в физиологическом растворе в течение 7 мин при 18 кГц. Эффект разрушения контролировали микроскопически. Суспензию разрушенных микобактерий центрифугировали (10000 об/мин), надосадок использовали в качестве нативного антигена (УЗД-M.lufu).
Постановку ИФА осуществляли на полистироловых планшетах для иммунологических реакций однократного применения (производственное объединение "Ленмедполимер" ТУ 64-2-278-79). Одновременно сенсибилизировали два планшета: 1-й - антигенами из M.leprae (УЗД-М.leprae), 2-ой - антигенами из М.lufu (УЗД-М.lufu).
Первый планшет сенсибилизировали УЗД-М.leprae в карбонат-бикарбонатном буфере pH 9,0-9,5 (1,18 г Na2CO3 3,47 г NaHCO3 и 0,2 г NaN3 растворяли в 1 л дистиллированной воды) из расчета 27 мкг антигена на 1 мл буфера в объеме 0,1 мл на 1 лунку (18 ч при +4oC). Затем планшет отмывали 3 раза в забуференном физиологическом растворе (34 г NaCI на 4 л воды, доводя 2M Na2PO4 pH до 7,4) с добавлением 0,05% твина-20, после чего в лунки планшета заливали по 0,01 мл 1% раствора бычьего сывороточного альбумина в 0,02 М фосфатно-солевом буфере (pH 7,4) и выдерживали 1 ч при +37oC. Затем вновь производили промывку лунок вышеуказанным способом и заливали лунки исследуемыми сыворотками больных лепрой, разведенными (1:400) фосфатно-солевым буфером (pH 7,3 - 7,4), содержащим 1% сыворотки крупного рогатого скота в объеме 0,1 мл. На планшете ставили также положительный контроль (сыворотки больных с активными проявлениями лепрозного процесса) и отрицательный контроль (донорские сыворотки) в том же разведении (1:400). Каждый образец сывороток заливали в 2 лунки (дубликат). Планшет инкубировали при +37oC 1 ч, после чего снова повторяли процесс отмывки. Затем в каждую лунку добавляли по 0,1 мл конъюгата (кроличьи антитела к общим иммуноглобулинам человека, меченые пероксидазой) в разведении 1: 1000 и инкубировали 1 ч при +37oC. После отмывки добавляли субстратную смесь - 5-аминосалициловая кислота с 0,05% перекисью водорода (к 100 мл подогретой до 70oC дистиллированной воды добавляли 80 мг 5- аминосалициловой кислоты, раствор охлаждали до комнатной температуры и устанавливали pH 5,5 - 6,0. К 18 мл полученного раствора добавляли 2 мл 0,05% раствора перекиси водорода). Планшет выдерживали при комнатной температуре 60 мин. При наличии в сыворотке антител к УЗД-M.leprae субстратная смесь окрашивалась в темно-коричневый цвет (положительная реакция), а контрольные лунки оставались бесцветными или слегка желтоватыми (отрицательная реакция). Результаты реакции оценивали инструментально на фотометре (Minireader MR 590, США), при длине волны 450 нм по интенсивности окраски исследуемого образца и выражали в единицах оптической плотности (ОП). Положительными считали образцы, показатели ОП которых в 2 и более раз превышали показатели в отрицательном контроле. ОП отрицательного контроля не превышала 0,2.
Одновременно осуществляли сенсибилизацию второго планшета. Антигены из M. lufu (УЗД-M.lufu) разводили в карбонат-бикарбонатном буфере pH 9,0-9,5 из расчета 33 мкг антигена на 1 мл буфера в объеме 0,1 мл на 1 лунку (1,18 Na2CO3, 3,74 NaHCO3 и 0,2 NaN3 растворяют в 1 л дистиллированной воды) и оставляют на 18 ч при +37oC). Затем планшет отмывали 3 раза в забуференном физиологическом растворе (34 г NaCl на 4 л воды, доводя 2М Na2PO4 pH до 7,4) с добавлением 0,05% твин-20. После промывки в лунки планшета заливали по 0,1 мл 1% раствора бычьего сывороточного альбумина в 0,02 М фосфатно-солевом буфере (pH 7,3-7,4) и выдерживали 1 ч при +37oC. Затем вновь производили промывку вышеуказанным способом и заливали в лунки исследуемые сыворотки больных лепрой (в объеме 0,1 мл), разведенные 1:400 фосфатно-солевым буфером pH 7,4 (0,584 г NaCI, 12,8 г Na2HPO4, 2,62 г NaHPO4), содержащим 1% сыворотки крупного рогатого скота. Таким же образом разводили сыворотки от больных с активной лепрой (положительный контроль) и сыворотки доноров (отрицательный контроль). Планшет инкубировали 1 ч при +37oC, после чего снова отмывали. Затем в каждую лунку добавляли по 0,1 мл конъюгата (кроличьи антитела к общим иммуноглобулинам человека, меченые пероксидазой) в разведении 1:1000 и выдерживали 1 ч при +37oC. После отмывки добавляли субстрат - 5-аминосалициловая кислота с 0,05% перекисью водорода. Планшет выдерживали при комнатной температуре 40-60 мин. При наличии в сыворотке антител к УЗД-M.lufu субстратная смесь окрашивалась в темно-коричневый цвет (положительная реакция), а контрольные лунки оставались бесцветными или слегка желтоватыми (отрицательная реакция). Результаты реакции оценивали на фотометре (Minireader MR 590, США), при длине волны 450 нм по интенсивности окраски исследуемого образца и выражали в единицах ОП. Положительными считали образцы, показатели ОП которых в 2 и более раз превышали показатели в отрицательном контроле. ОП отрицательного контроля не превышала 0,3.
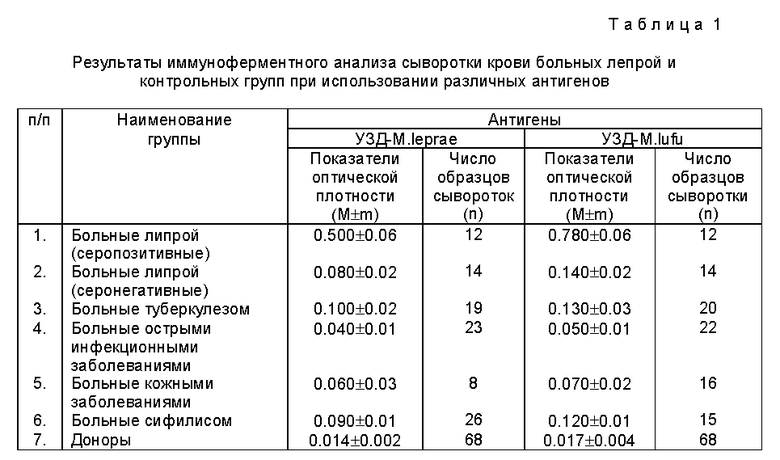
Изложенная сущность изобретения поясняется табл. 1, где представлены результаты иммуноферментного анализа сывороток крови больных лепрой и контрольных групп при использовании различных антигенов.
Таким образом, из данных табл.1 следует, что показатели уровня антител во всех исследуемых группах, полученные в тест-системе с использованием антигенов из М.leprae, полностью сопоставимы с показателями, полученными в ИФА, где тест-антигеном являются препараты из M.lufu.
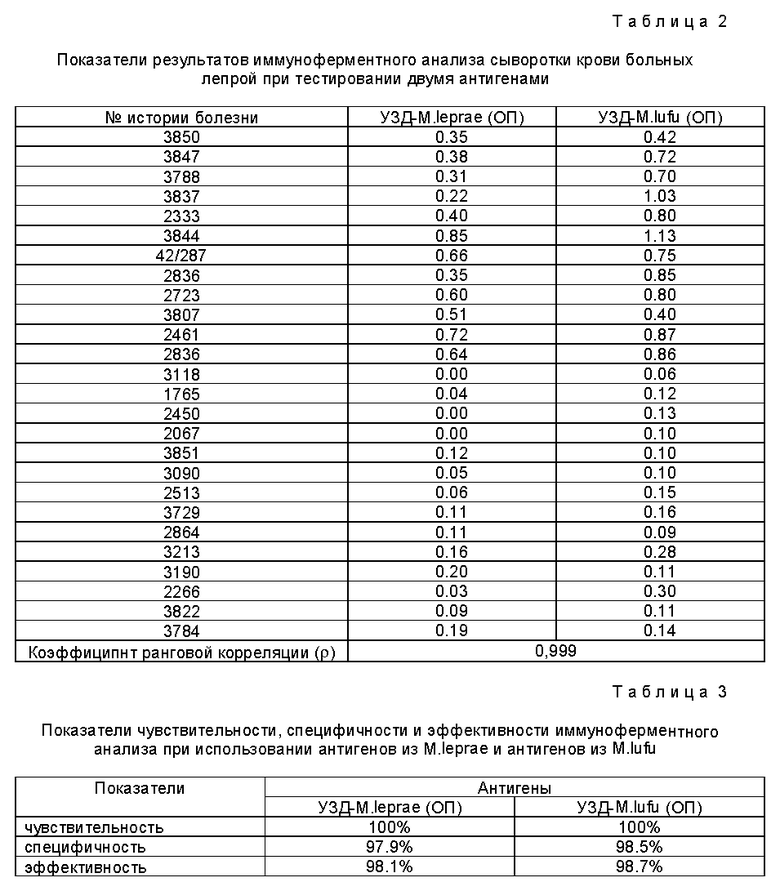
Результаты ИФА сывороток больных лепрой с использованием антигенов из М. leprae и из M.lufu представлены в табл.2.
Таким образом, из данных табл. 2 видно, что результаты ИФА с использованием в качестве антигена УЗД-M.leprae полностью коррелируют (ρ =0,999) с результатами ИФА, где в качестве тест-антигена использовали УЗД- M.lufu.
Авторами проведена оценка чувствительности, специфичности и эффективности иммуноферментного анализа. За диагностическую чувствительность ИФА принимали процентное выражение частоты истинно положительных результатов ИФА у больных с активными проявлениями лепрозного процесса.
За диагностическую специфичность ИФА принимали процентное выражение частоты истинно отрицательных результатов ИФА у лиц, не имеющих лепры.
За диагностическую эффективность принимали процентное выражение отношения истинных результатов ИФА к общему числу полученных результатов. Расчет чувствительности, специфичности и эффективности проводили с учетом рекомендаций Griner P.F., Mayewsky R.G., Mushlin A.Y. Selection and interpretation of diagnostic tests and procedures // Ann. Inter. Med.- 1981.- V.94, N 4.- P. 555-600, используя формулы:
чувствительность = ИП/Б•100%;
специфичность = ИО/НБ•100%;
эффективность = ИП+ИО/ИП+ЛП+ЛО+ИО •100%,
где 4 ИП - истинно положительные результаты; Б - общее число больных с активным проявлением лепрозного процесса; ИО - истинно отрицательные результаты; НБ - общее число не больных лепрой; ЛП - ложноположительные результаты; ЛО - ложноотрицательные результаты.
С использованием приведенных формул проводили сравнительную оценку диагностических тест-систем на основе ИФД с антигенами из M.leprae и из M.lufu (табл.З)
Таким образом, из данных табл. 3 видно, что при 100% чувствительности тест-система, в которой в качестве антигена использовали УЗД - M.lufu, обладает сопоставимой специфичностью и эффективностью с тест-системой, где в качестве антигена применяли УЗД- М.leprae.
Предлагаемый способ прошел успешную апробацию в НИИ по изучению лепры Минздравмедпрома РФ в 1994-1995 годах.
Ниже приводятся результаты апробации способа.
Пример 1. Больная А (и/б N 3844) впервые поступила в НИИ по изучению лепры 29.05.93 г. При поступлении: лепрозный процесс распространенный. Брови, ресницы разрежены, отмечается глубокая диффузная инфильтрация кожного покрова лица, ушных раковин и мочек ушей, большое количество дермальных и гиподермальных лепром. Локтевые, малоберцовые нервы утолщены, болезненны при пальпации. Анестезия по стволовому типу до верхней трети плеч, бедер. Бактериоскопический индекс (БИН) = 1,83+. Гистологическое исследование биоптата кожи: активно формирующаяся гранулема лепроматозной структуры (лепрома) на фоне лепрозной узловатой эритемы. Диагноз: лепроматозный тип лепры.
Серологическое обследование от 05.09.94 г. выявило наличие антител к M. leprae:
- показатели ОП с УЗД-M.leprae - 0,85 (норма < 0,20);
- показатели ОП с УЗД-M.lufii - 1,13 (норма < 0,30).
Таким образом, больная A на момент обследования являлась серопозитивной. Показатели оптической плотности уровня антител к УЗД-M.leprae и УЗД-M.lufu были сопоставимы между собой и более чем в 3 раза превышали фоновый уровень. Клинические, гистологические и бактериоскопические исследования подтверждали результаты серологического анализа.
Пример 2. Больной Л. (и/б N 2461) впервые поступил в НИИ по изучению лепры 21.06.55 г. При поступлении отмечалась диффузная инфильтрация лица, лепромы на конечностях, малоберцовые нервы утолщены, при пальпации болезненные. В соскобе со слизистой носа, в скарификате кожи обнаружены M.leprae. Гистологическое исследование биоптата кожи: инфильтрат лепроматозной структуры с наличием M.leprae. Диагноз: лепроматозный тип лепры, Получал специфическое лечение в течение 7 лет и был выписан в 1962 г. на амбулаторное лечение.
В 1991 г. больной поступает в клинику НИИ по изучению лепры с обострением лепрозного процесса. При осмотре кожных покровов обнаружена очаговая инфильтрация розового цвета с четкими краями в области живота, в области ягодиц с переходом на поясничную область. Локтевые и малоберцовые нервы утолщены. Анестезия до верхней трети плеч и верхней трети бедер. В скарификате кожи и тупф-препарате обнаружены M.leprae. Гистологическое исследование биоптата кожи: активно формирующийся инфильтрат лепроматозной структуры. Диагноз: лепроматозный тип лепры. Рецидив.
Серологическое обследование от 30.03.93 г. выявило наличие антител к M. leprae:
- показатели ОП с УЗД-M.leprae - 0,72 (норма < 0,20);
- показатели ОП с УЗД-M.lufu - 0,87 (норма < 0,30).
Таким образом, больной Л на момент обследования являлся серопозитивным. Показатели оптической плотности уровня антител к УЗД-M.leprae и УЗД-M.lufu были сопоставимы между собой и в 3 раза превышали фоновый уровень. Клинические, гистологические и бактериоскопические исследования подтверждали результаты серологического анализа.
Пример 3. Больной Г. (и/б N 1765) поступил в НИИ по изучению лепры 9.03.48 г. с диагнозом: лепроматозный тип лепры. Получал специфическое лечение в течение 15 лет. В настоящее время лепрозный процесс в регрессивном состоянии. При гистологическом исследовании биоптата кожи: инфильтрат лепроматозной структуры в состоянии отчетливого регресса, не содержащий микобактерий лепры. БИН = 0. Течение болезни безрецидивное. Больной находится под диспансерным наблюдением.
Серологическое обследование от 31.10.94 г. не выявило наличия антител к M.leprae:
- показатели ОП с УЗД-M.leprae - 0,04 (норма < 0,20);
- показатели ОП с УЗД-M.lufu - 0,12 (норма < 0,30).
Таким образом, больной Г, на момент обследования являлся серонегативным. Показатели оптической плотности уровня антител к УЗД-M.leprae и УЗД-M.lufu были сопоставимы между собой и не превышали фонового уровня. Клинические, гистологические и бактериоскопические исследования подтверждали результаты серологического анализа.
Предлагаемым способом достигается упрощение диагностики лепры по сравнению с прототипом, которое заключается:
в сокращении сроков получения антигенного диагностикума на 1,5-2 года, поскольку отсутствует необходимость воспроизведения экспериментальной лепрозной инфекции на лабораторных животных с целью накопления бактериальной массы;
в уменьшении затрат (квалифицированный персонал, реактивы, оборудование), связанных с очисткой микобактерий от тканей экспериментальных животных.
Таким образом, авторами предложен новый, никем ранее не предлагаемый, способ диагностики лепры.
Предлагаемый способ может быть рекомендован для использования в научных и клинических лабораториях противолепрозных учреждений системы здравоохранения.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ОПРЕДЕЛЕНИЯ ГРУППЫ РИСКА РЕЦИДИВА ЛЕПРЫ | 1993 |
|
RU2082979C1 |
| СПОСОБ ДИАГНОСТИКИ ЛЕПРЫ | 2000 |
|
RU2171689C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ M.LEPRAE У БОЛЬНЫХ С РЕГРЕССОМ ЗАБОЛЕВАНИЯ | 1997 |
|
RU2137137C1 |
| СПОСОБ ИММУНОПРОФИЛАКТИКИ ЭКСПЕРИМЕНТАЛЬНОЙ ЛЕПРОЗНОЙ ИНФЕКЦИИ | 1996 |
|
RU2135196C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ СПЕЦИФИЧЕСКОГО ПОРАЖЕНИЯ ПЕЧЕНИ У БОЛЬНЫХ ЛЕПРОЙ | 2009 |
|
RU2403869C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ АНТИТЕЛ К Mycobacterium leprae | 2012 |
|
RU2500423C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ АНТИТЕЛ К Mycobacterium leprae | 2012 |
|
RU2501022C2 |
| ШТАММ МИКОБАКТЕРИЙ MYCOBACTERIUM AVIUM, ИСПОЛЬЗУЕМЫЙ ДЛЯ ДИАГНОСТИКИ ЛЕПРЫ | 1994 |
|
RU2080377C1 |
| СПОСОБ ВЫЯВЛЕНИЯ АНТИТЕЛ К MYCOBACTERIUM LEPRAE НА ТВЕРДОМ НОСИТЕЛЕ | 2010 |
|
RU2468371C2 |
| СПОСОБ СТИМУЛЯЦИИ ОБРАЗОВАНИЯ АНТИТЕЛ ПРИ ИММУНИЗАЦИИ ЛАБОРАТОРНЫХ ЖИВОТНЫХ | 2001 |
|
RU2218175C2 |
Способ используется в медицине, а именно в лепрологии, в частности, для диагностики лепры. У пациента берут кровь из пальца и исследуют отстоявшуюся сыворотку с помощью иммуноферментного анализа. Для обнаружения антител к антигенам M. Leprae в сыворотках крови больных лепрой в иммуноферментном анализе в качестве тест-антигена используют культивируемые микобактерии Mycobacterium lufu . Способ прост в исполнении, при этом повышается точность диагностики лепры. 3 табл.
Способ диагностики лепры, состоящий в обнаружении антител к антигенам M. Leprae в сыворотках крови больных лепрой, отличающийся тем, что в иммуноферментном анализе в качестве тестантигена используют культивируемые микобактерии Mycobacterium lufu.
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| RU 93015117 A1, 10.12.95 | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ГРУППЫ РИСКА РЕЦИДИВА ЛЕПРЫ | 1993 |
|
RU2082979C1 |
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| Дячина М.Н | |||
| и др | |||
| Диагностические тест-системы на основе иммуноферментного метода при лепре | |||
| Микробиология, эпидемиология и иммунобиология | |||
| Приспособление для установки двигателя в топках с получающими возвратно-поступательное перемещение колосниками | 1917 |
|
SU1985A1 |
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1921 |
|
SU4A1 |
| Stonford J.L | |||
| et al | |||
| Preliminory immunjljgucal stadies in search of correlates of prjfective immunity carriod ont on some | |||
| Jranion leprosy patients and their Familtes, Yepr., Rev., 1980 | |||
| Способ запрессовки не выдержавших гидравлической пробы отливок | 1923 |
|
SU51A1 |
| P | |||
| Автоматический тормоз к граммофону | 1921 |
|
SU303A1 |
Авторы
Даты
1999-01-10—Публикация
1996-05-28—Подача