Изобретение относится к технологии получения L-лизина микробиологическим синтезом с использованием штаммов-продуцентов преимущественно типа Brevibacterium sp. ВНИИгенетика-90, Brevibacterium lactofermentum НИТИА-88 и им подобных и подходящих произвольных питательных сред.
При этом термин "получение L-лизина" здесь и далее обозначает преимущественно процесс получения культуральных жидкостей, содержащих L-лизин как целевой продукт в смеси с остатками питательной среды, микроорганизмами-продуцентами и иными продуктами их жизнедеятельности независимо от того, будет ли L-лизин впоследствии выделен в чистом виде или после упаривания и сушки культуральной жидкости использован иным образом, например, в виде концентрированной добавки в комбикорма для сельскохозяйственных животных, птиц и рыб.
Общеизвестно, что L-лизин относится к числу незаменимых аминокислот, производство которых в мировой экономике уже давно стало крупнотоннажным.
Поэтому к технологическим процессам производства лизина предъявляется комплекс систематически ужесточающихся трудносовместимых требований. Действительно, весьма желательно, чтобы эти процессы были:
как можно более производительными и
как можно менее материало- и энергоемкими.
Выполнение указанных требований может быть достигнуто различными средствами.
Одно из наиболее активно разрабатываемых направлений поиска таких средств предусматривает использование штаммов-продуцентов, способных к так называемому сверхсинтезу L-лизина, под которым подразумевают их способность обеспечивать концентрацию целевого продукта в культуральной жидкости свыше 10 (предпочтительно-свыше 20) г/л.
Штаммы такого типа обычно являются:
ауксотрофными мутантами, то есть способными к росту только в присутствии в питательных средах специфических ростовых веществ, преимущественно некоторых аминокислот, способность к внутриклеточному синтезу которых была утрачена вследствие мутации (см. Бекер В.Ф., Бекер М.Е. Лизин микробного синтеза - Рига: Зинатне, 1974, с.17 ), или
более приемлемыми аналог-резистентными ауксотрофными мутантами, синтез L-лизина которыми не ингибируется по мере нарастания его концентрации в культуральной жидкости (см. Жданова Н.И., Гусятинер М.М. Методы селекции и свойства штаммов микроорганизмов-продуцентов аминокислот// Обзорная информация// Сер. 11. Селекция и генетика промышленных микроорганизмов.-М.: ВНИИ-СЭНТИ, 1985, с. 4-17), или наконец, leaky-мутантами (то есть "ослабленными" мутантами) микроорганизмов, зависимыми от концентрации в питательных средах специфических ростовых веществ, способность к внутриклеточному синтезу которых была лишь понижена, но не утрачена вследствие мутации (см. в том же обзоре с.6).
Мутанты таких типов обычно принадлежат к родам Brevibacterium, Micrococcus и Corinebacterium.
Другое направление поиска средств снижения издержек на производство L-лизина, очевидно связанное с первым, предусматривает разработку и применение все более совершенных питательных сред, наиболее полно учитывающих потребности указанных штаммов в питательных веществах.
Примером может служить применение белково-витаминного концентрата (БВК или паприна) в качестве основы питательных сред для культивирования микроорганизмов-продуцентов аминокислот (см., соответственно: 1. Бекер В.Ф., Бекер М. Е. Лизин микробного синтеза - Рига: Зинатне, 1974, с.37-38; 2. Панкова Т. А. Применение кислотного гидролизата БВК при производстве лизина//Микробиологическая промышленность, 1983, N 3. с.9).
Однако БВК, получаемый микробиологическим синтезом с использованием культивируемых на парафинах нефти грибков рода Candida, в условиях систематического роста цен на энергоносители становится все менее доступным для промышленного микробиологического синтеза аминокислот. Кроме того, он опасен как аллерген для промышленного персонала, пожаро- и взрывоопасен при транспортировке и хранении и, наконец, служит источником трудноудаляемых балластных примесей в производстве высокоочищенного кристаллического L-лизина как целевого продукта.
Если же учесть, что синтез БВК экологически вреден, то ясно, что совершенствование процессов микробиосинтеза L-лизина не может ограничиваться лишь улучшением питательных сред.
Тем не менее, по мере решения проблемы утилизации отходов различных отраслей пищевой (в особенности, мясоперерабатывающей и молочной) промышленности проблема сбалансированного питания штаммов-продуцентов L-лизина решается все более эффективно и экологически рационально.
Примером может служить использование в процессах микробиологического синтеза частичного (по лактозе) гидролизата концентрированной молочной сыворотки как источника конвертируемых в аминокислоты моносахаридов (патент Франции 2526808).
Соответственно все большее значение приобретает дальнейшее совершенствование технологии микробиологического синтеза L-лизина как таковой.
В общих чертах эта наиболее близкая к предлагаемому способу технология широко известна специалистам из многочисленных промышленных регламентов (см. , например, пусковой регламент ПР-64-186-84 Трипольского биохимического завода) предусматривает приготовление и подачу в ферментер периодического действия порции комплексной по содержанию питательных веществ стерильной питательной среды, посев избранного штамма-продуцента L-лизина и ферментацию, включающую (обычно периодическую) подпитку ферментируемой биомассы питательными веществами, аэрацию и перемешивание культуральной жидкости, поддержание заданных значений температуры и pH среды.
После достижения максимально возможной концентрации целевого продукта в культуральной жидкости или после заполнения ферментера такой жидкостью до заданного уровня, смотря по тому, что наступит раньше, ферментацию прекращают, культуральную жидкость из ферментера удаляют на последующую переработку и процесс повторяют.
Однако суммарная продуктивность такого процесса и, особенно, удельный выход L-лизина в расчете на единицу питательного субстрата не соответствуют современным требованиям к ресурсосбережению, что обусловлено следующими причинами:
во-первых, конкуренцией двух направлений потребления питательных веществ лизин-продуцирующими микроорганизмами на стадии ферментации, первое из которых внешне выражается преимущественно в приросте биомассы и в меньшей степени в синтезе L-лизина, а второе - преимущественно в конверсии моносахаридов (в особенности глюкозы) в L-лизин и некоторые сопутствующие аминокислоты: глутаминовую кислоту, валин, аланин, изолейцин и др.;
во-вторых, существенной зависимостью направленности процесса от концентрации растворенного в культуральной жидкостью кислорода, недостаток которого из-за неполного окисления углеводов приводит к переключению биосинтеза на продуцирование слабых карбоновых кислот типа молочной, яблочной и некоторых других, а избыток стимулирует расход углеводов на дыхание микроорганизмов и соответственно активирует прирост биомассы и биосинтез сопутствующих аминокислот, что в обоих случаях ослабляет биосинтез L-лизина (см., например, Руклиша М. П. Физиолого-биохимическая характеристика продуцента лизина Brevibacterium sp.22 в периодическом и непрерывном процессе культивирования. -Рига, 1974, Канд.диссертация); и
в-третьих, существенной зависимостью направленности процесса от концентрации углеводов в используемой для подпитки свежей питательной среде (и соответственно в культуральной жидкости). Действительно, явный недостаток углеводов обуславливает прекращение синтеза лизина сверх необходимого для самообеспечения бактеральных клеток физиологического минимума, а явный избыток углеводов приводит к увеличению их расхода на синтез сопутствующих L-лизину аминокислот. Если же концентрация углеводов в культуральной жидкости превышает 15% по массе, то наблюдается известное специалистам угнетение развития микроорганизмов (см. Куцева Л.С., Клюева Н.М., Прикладная биохимия и микробиология, 1966, т.2, N 6, с.729).
Однако по имеющимся данным в практике промышленного биосинтеза L-лизина указанные факторы до сих пор системно не регулируются.
В связи с изложенным в основу изобретения положена задача путем изменения порядка и режимов подпитки ферментируемой биомассы свежей питательной средой создать такой стабилизированный одновременно по двум критериям: скорости прироста биомассы и скорости синтеза L-лизина - способ получения L-лизина, который обеспечивал бы совместное повышение как суммарной продуктивности биосинтеза, так и повышение удельного выхода L-лизина (в расчете на единицу питательного субстрата).
Поставленная задача решена тем, что в способе получения L-лизина, предусматривающем приготовление и подачу в ферментер периодического действия порции комплексной по содержанию питательных веществ стерильной питательной среды, посев избранного штамма-продуцента L-лизина и ферментацию, включающую подпитку ферментируемой биомассы питательными веществами, аэрацию и перемешивание культуральной жидкости, поддержание заданных значений температуры и pH среды, согласно изобретению, подпитку после посева подают непрерывно в течение всего цикла ферментации, при этом ростовые вещества и углеводы подают раздельно с расходами, учитывающими соотношение скоростей прироста биомассы и синтеза L-лизина.
Раздельная и осуществляемая с разными (обусловленными указанным соотношением) скоростями подпитка ростовыми веществами и источниками углерода позволяет существенно сузить интервал фактических колебаний их концентраций в культуральной жидкости. Тем самым удается поддерживать физиологическую активность микроорганизмов на уровне, близком к максимально возможному для используемого штамма, и соответственно оптимизировать биосинтез L-лизина.
Первое дополнительное отличие состоит в том, что для используемого штамма-продуцента предварительно определяют минимально допустимую для его развития концентрацию углеводов и подпитку, содержащую углеводы, подают с расходом, обеспечивающим в культурной жидкости их концентрацию с интервале 1,2 - 2,8 от упомянутого минимума, интенсивность дыхания биомассы непрерывно оценивают по парциальному давлению (или, что то же самое, по напряжению) кислорода в культуральной жидкости и подачей подпитки, содержащей ростовые вещества, поддерживают упомянутое напряжение на уровне не менее 12 мм рт.ст. При соблюдении указанных условий скорость биосинтеза L-лизина и его удельный выход приближают к максимально возможным для избранного штамма-продуцента.
Второе дополнительное отличие состоит в том, что в процессе ферментации в пробах культуральной жидкости периодически определяют отношение массы L-лизина к сухой биомассе штамма-продуцента и изменением расхода подпитки, содержащей ростовые вещества, поддерживают упомянутое отношение в интервале 2,4 - 2,9 г/г.
Далее сущность изобретения поясняется:
описанием предложенного способа в общем виде, включая описание методов измерения и контроля, со ссылками на прилагаемый чертеж, на котором приведены характерные для процессов периодической ферментации зависимости:
- парциального давления (напряжения) кислорода в культуральной жидкости от времени культивирования (кривая 1);
- концентрации сахара (т.е. источника углерода) в культуральной жидкости от времени культивирования (кривая 2);
конкретными примерами:
- определения минимально допустимых концентраций углеводов в культуральной жидкости и
- биосинтеза L-лизина предложенным способом;
результатами испытаний.
Предложенный способ в общем виде предусматривает:
предварительное определение критической, то есть минимально допустимой для развития избранного штамма-продуцента L-лизина концентрации углеводов в культуральной жидкости, для чего:
- готовят основную питательную среду, отличающуюся от ферментационной среды, предусмотренной для избранного штамма-продуцента, L-лизина тем, что концентрация источника углерода (т.е. углеводов) снижена в два раза,
- готовят дополнительную питательную среду, отличающуюся от основной тем, что в ней отсутствует источник углерода,
- лабораторный ферментер, снабженный датчиком парциального давления кислорода, заполняют основной питательной средой на 35% от его объема, устанавливают значения температуры, pH, аэрации и перемешивания, соответствующие режиму ферментации, вносят посевной материал в количестве 10% от объема питательной среды и далее непрерывно регистрируют показания датчика парциального давления кислорода и периодически определяют концентрацию источника углерода в культуральной жидкости,
- в культуральной жидкости непрерывно контролируют напряжение кислорода и строят (записывают) кривую 1,
- периодически, например, через каждый час, считая от момента посева штамма, в пробирки с антисептиком (например: хлороформом или формалином) отбирают пробы культуральной жидкости и определяют в них остаточную концентрацию углеводов и строят кривую 2,
- через два часа после наступления фазы стационарного роста культуры, которому соответствует участок РВ на кривой 1, приступают к разбавлению культуральной жидкости в лабораторном ферментере вышеуказанной дополнительной питательной средой со скоростью 0,3 объема на объем культуральной жидкости в час (началу разбавления соответствует точка C кривой 2), что приводит к прогрессирующему снижению концентрации углеводов в культуральной жидкости на фоне стабильности концентрации прочих питательных веществ,
- в момент резкого повышения напряжения кислорода в культуральной жидкости (обозначенный стрелкой вблизи точки B на кривой 1) в пробирку с антисептиком отбирают пробу (10-15 мл) культуральной жидкости и определенную в этой пробе остаточную концентрацию углеводов фиксируют как "минимально допустимую" для развития избранного штамма-продуцента L-лизина;
приготовление стерильной питательной среды определенного состава и ее внесение в ферментер;
посев избранного штамма-продуцента L-лизина;
ферментацию, включающую:
- раздельную подпитку ферментируемой биомассы свежей питательной средой, содержащей (отдельно) ростовые вещества и (отдельно) источники углерода (углеводы), проводимую с соблюдением следующих условий:
- во всех случаях биосинтеза L-лизина контролируют скорость прироста биомассы и скорость синтеза L-лизина и расходы указанных подпиток устанавливают с учетом соотношения указанных скоростей,
- предпочтительно подпитку, содержащую углеводы, подают с расходом, обеспечивающим их концентрацию в культуральной жидкости в интервале 1,2 - 2,8 от упомянутого минимума, а подпитку, содержащую ростовые вещества, подают с учетом результатов контроля напряжения кислорода в культуральной жидкости с таким расходом, чтобы упомянутое напряжение было не менее 12 мм рт.ст. ,
- еще более предпочтительно в процессе ферментации в пробах культуральной жидкости периодически определяют отношение массы L-лизина к сухой биомассе штамма-продуцента и расход подпитки, содержащей ростовые вещества, регулируют таким образом, что упомянутое отношение поддерживают в интервале 2,4 - 2,9 г/г;
- аэрацию и перемешивание культуральной жидкости,
- поддержание заданных значений температуры и pH среды;
прекращение ферментации;
удаление культуральной жидкости из ферментера и повторение процесса.
Примеры определения минимально допустимых концентраций углеводов в культуральной жидкости.
Пример 1 мк. Определение минимально допустимой концентрации углеводов в культуральной жидкости для штамма Brevibacterium sp. ВНИИгенетика-90
В качестве источника углеводов использовали свекловичную мелассу с содержанием сахаров 46%. Были приготовлены:
а) основная питательная среда следующего состава (г/л):
меласса - 125 (по сырому весу)
кукурузный экстракт - 25 (по сухому весу)
аммоний хлористый - 13
диаммоний фосфат - 1
б) дополнительная питательная среда такого состава (г/л):
кукурузный экстракт - 25 (по сухому весу)
аммоний хлористый - 13
диаммоний фосфат - 1
В лабораторный ферментер емкостью 1 л внесли 350 мл стерильной основной питательной среды. Стерильным концентрированным раствором аммиака установили pH в пределах 7,0 - 7,0. Температура питательной среды 30oC, расход воздуха на аэрацию 0,5 л/мин, избыточное давление воздуха 0,02 МПа, скорость мешалки 600 мин-1.
После достижения указанных параметров в питательную среду внести 30 мл посевного материала. Культивирование продолжали до начала фазы стационарного роста, что соответствует в данном примере 14-му часу (точка P на кривой 1 прилагаемого чертежа). Еще 2 ч продолжали ферментацию в том же режиме.
На 16-м часу начали вводить в ферментер стерильную дополнительную питательную среду со скоростью 120 мл/ч. Через 1,5 ч напряжение кислорода в культуральной жидкости резко возросло и за 8 мин увеличилось на 10 мм рт.ст. (стрелка вблизи точки B на кривой 1).
В этот момент в пробирку с тремя каплями хлороформа отобрали пробу культуральной жидкости объемом 15 мл. Анализ пробы показал остаточную концентрацию сахаров в культуральной жидкости 4 г/л как минимально допустимую (критическую) для данного продуцента лизина при использовании мелассы.
Пример 2мк. Определение минимально допустимой концентрации углеводов в культуральной жидкости для штамма Brevibacterium lactofermentum-88.
Определение проводили, как в примере 1. Анализ пробы показал, что для этого штамма-продуцента лизина критическая концентрация сахаров мелассы в культуральной жидкости равна 5,5 г/л.
Пример 3мк. Определение минимально допустимой концентрации углеводов в культуральной жидкости для штамма Brevibacterium flavum E-531
Определение проводили, как в примере 1. Анализ пробы показал, что для данного штамма-продуцента лизина критическая концентрация сахаров мелассы в культуральной жидкости равна 6,2 г/л.
Примеры биосинтеза L-лизина
Пример 1бс. Биосинтез L-лизина с использованием штамма Brevibacterium sp.ВНИИгенетика-90 (1)
Для получения посевного материала использовали стерильную питательную среду следующего состава (г/л):
меласса - 60 (по сырому весу)
кукурузный экстракт - 40 (по сухому весу)
аммоний хлористый - 5
мел - 8
По 50 мл указанной питательной среды внесли в колбы Эрленмейера емкостью 750 мл выращивали посевной материал в течение 24 ч при температуре 30oC на качалке при 250 мин-1.
Эксперименты по биосинтезу L-лизина предложенным способом проводили в четырех (А, Б, В и Г) лабораторных ферментерах емкостью 1л, оборудованных регулируемыми нагревателями со средствами контроля температуры, приспособлениями для аэрации с регулируемым расходом стерильного воздуха, мешалками с регулируемым числом оборотов, насосами-дозаторами для раздельной подачи подпитки (в виде дополнительных питательных сред) и датчиками напряжения кислорода в культуральной жидкости, с использованием следующих стерильных сред:
а) основной питательной среды следующего состава (в г/л):
кукурузный экстракт - 35 (по сухому весу)
меласса - 30 (по сырому весу)
аммоний хлористый - 7,5
диаммоний фосфат - 1,5,
б) первой дополнительной питательной среды (как подпитки-источника ростовых веществ) следующего состава (в г/л):
гидролизат БВК - 35 (по весу исходного БВК)
гидролизат кукурузного экстракта - 35 (по сухому весу исходного экстракта),
в) второй дополнительной питательной среды (как подпитки-источника углеводов) следующего состава (в г/л):
меласса - 650 (по сырому весу)
аммоний хлористый - 40,
г) 25%-ного водного раствора аммиака (как средства коррекции pH культуральной жидкости и дополнительного источника азота).
В каждый из ферментеров внесли по 200 мл основной питательной среды, включили аэрацию с подачей одного объема воздуха на 1 объем жидкости в минуту и мешалку на 600 мин-1, довели pH указанным раствором аммиака до 7,0 - 7,2, установили температуру на уровне 30-31oC, внесли по 20 мл посевного материала, содержащего указанный штамм-продуцент, и насосами-дозаторами начали подавать первую (с начальным расходом 4 мл/ч) и вторую (с начальным расходом 0,5 мл/ч) дополнительные (подпиточные) питательные среды.
Затем с учетом показаний датчика напряжения (парциального давления) кислорода в культуральной жидкости подачу второй дополнительной питательной среды регулировали таким образом, чтобы указанное давление в период пуска поддерживалось около (но не ниже) 12 мм рт.ст. во всех четырех ферментерах, а далее со следующими вариациями:
в ферментере A - с условием, чтобы концентрация сахаров в культуральной жидкости находилась в пределах от 1,2 до 2,8 от минимально допустимой;
в ферментере Б - в пределах от 0,8 до 1,2;
в ферментере В - в пределах от 2,8 до 3,5;
в ферментере Г - в пределах от 3,5 до 4,5.
Процессы прекращали после заполнения ферментеров культуральной жидкостью до уровня 700 мл и фиксировали время, за которое этот уровень был достигнут.
Для контроля в аналогичном ферментере Д, оборудованном лишь одним насосом-дозатором, с использованием того же штамма-продуцента проводили биосинтез L-лизина по способу-прототипу.
В этом контроле применяли две питательные среды:
а) основную, содержащую (в г/л):
меласса - 250 (по сырому весу)
гидролизат БВК - 7 (по весу исходного БВК)
кукурузный экстракт - 18 (по сухому весу)
аммоний хлористый - 19
диаммоний фосфат - 2
б) дополнительную (подпиточную), содержащую (в г/л):
меласса - 650 (по сырому весу)
гидролизат БВК - 4 (по весу исходного БВК)
кукурузный экстракт - 9 (по сухому весу)
аммоний хлористый - 40
В ферментер Д внесли 400 мл основной питательной среды, включили аэрацию с подачей одного объема воздуха на 1 объем жидкости в минуту и мешалку на 600 мин-1, довели pH указанным раствором аммиака до 7,0 - 7,2, установили температуру на уровне 30-31oC и избыточное давление 0,02-0,03 МПа и внесли 40 мл посевного материала, содержащего указанный штамм-продуцент.
После запуска процесса в культуральной жидкости периодически (не реже одного раза за 4 ч) контролировали концентрацию сахаров и при ее падении до 1,0 - 1,5%, что соответствовало снижению интенсивности дыхания биомассы до 35-65% от максимального значения, периодически же (через каждый час) подавали указанную подпиточную среду с расходом 8-12 мл за каждый впрыск, продолжавшийся 1-2 мин, с таким расчетом, чтобы указанная концентрация возрастала до 1,5-2,0%.
После достижения объема культуральной жидкости 700 мл подпитку прекращали и, контролируя концентрацию сахаров и фиксируя длительность процесса, продолжали фенментацию до момента, когда указанная концентрация снижалась до 0,6%.
В культуральных жидкостях во всех ферментерах общеизвестным методом определили концентрацию L-лизина (в г/л) и тривиальными вычислениями установили выход L-лизина (в %) в расчете на единицу массы потребленных при ферментации углеводов (сахаров).
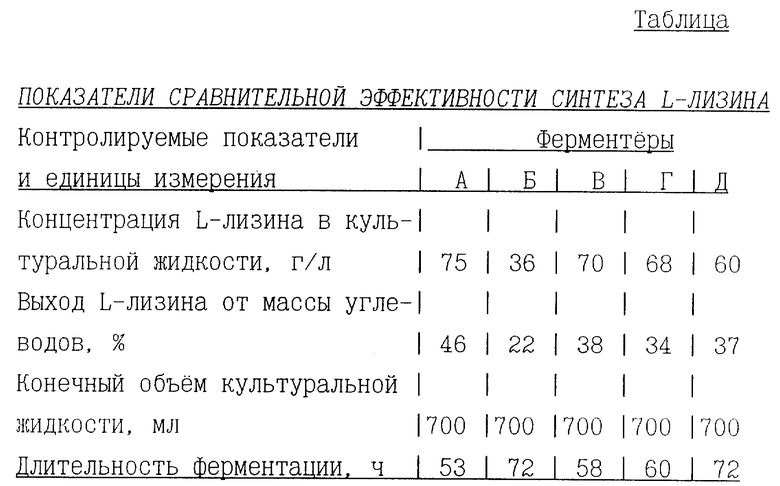
Сравнительные результаты приведены в таблице.
Как видно из таблицы, предложенный способ при соблюдении условий раздельной подпитки и балансировки расходов подпиточных сред с учетом скоростей прироста биомассы и синтеза целевого продукта (ферментер А) обеспечивает наилучшие результаты биосинтеза L-лизина, а при раздельной подпитке (ферментеры В и Г) обеспечивает повышение концентрации L-лизина в культуральной жидкости и повышение производительности биосинтеза.
Пример 2бс. Биосинтез L-лизина с использованием штамма Brevibacterium sp. ВНИИгенетика-90 (2)
Посевной материал нарабатывали и биосинтез целевого продукта проводили, как описано в (1бс) для ферментера А, с теми отличиями, что:
на 20-м часу ферментирования и далее через каждый 4 ч определяли соотношение массы лизина и сухой биомассы штамма-продуцента в культуральной жидкости и,
регулируя расход второй дополнительной питательной среды, удерживали это соотношение в пределах 2,4 - 2,9 г/г.
Длительность ферментации до наработки 700 мл культуральной жидкости составили 50 ч, концентрация L-лизина в культуральной жидкости 75 г/л, а выход L-лизина от массы потребленных углеводов составил 50%.
Пример 3бс. Биосинтез L-лизина с использованием штамма Brevibacterium lactofermentum НИТИА-88
Биосинтез целевого продукта проводили, как описано в 2бс, учитывая, что минимально допустимая концентрация углеводов в культуральной жидкости для указанного штамма равна 5,5 г/л.
Длительность ферментации до наработки 700 мл культуральной жидкости составила 56 ч. концентрация L-лизина в культуральной жидкости 72 г/л, а выход L-лизина от массы потребленных углеводов составил 45%.
Пример 4бс. Биосинтез L-лизина с использованием штамма Brevibacterium flavum E-531
Биосинтез целевого продукта проводили, как описано в 2бс, учитывая, что минимально допустимая концентрация углеводов в культуральной жидкости для указанного штамма равна 6,2 г/л.
Длительность ферментации до наработки 700 мл культуральной жидкости составила 54 ч. концентрация L-лизина в культуральной жидкости 60 г/л, а выход L-лизина от массы потребленных углеводов составил 45%.
Приведенные примеры биосинтеза L-лизина с использованием разных штаммов-продуцентов подтверждают промышленную применимость предложенного способа.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения @ -лизина | 1983 |
|
SU1157059A1 |
| СПОСОБ БИОСИНТЕЗА L-ЛИЗИНА | 2011 |
|
RU2486248C2 |
| ОСНОВА ПИТАТЕЛЬНОЙ СРЕДЫ ДЛЯ КУЛЬТИВИРОВАНИЯ МИКРООРГАНИЗМОВ | 1996 |
|
RU2108381C1 |
| ШТАММ БАКТЕРИЙ BREVIBACTERIUM SP. - ПРОДУЦЕНТ ЛИЗИНА | 1991 |
|
RU2027761C1 |
| ШТАММ BACILLUS SUBTILIS - ПРОДУЦЕНТ РИБОФЛАВИНА (ВАРИАНТЫ) | 1994 |
|
RU2081175C1 |
| Способ получения -гомосерина | 1978 |
|
SU840107A1 |
| ШТАММ БАКТЕРИЙ BREVIBACTERIUM SP. - ПРОДУЦЕНТ L-ЛИЗИНА | 1993 |
|
RU2034921C1 |
| СПОСОБ ПРОМЫШЛЕННОГО КУЛЬТИВИРОВАНИЯ ШТАММОВ E.coli, ПОЛУЧЕННЫХ НА ОСНОВЕ ШТАММА BL21(DE3), НЕСУЩЕГО ГЕН T7 RNA ПОЛИМЕРАЗЫ ПОД КОНТРОЛЕМ lacUV5 ПРОМОТОРА, С ПОВЫШЕННЫМ СИНТЕЗОМ БИОМАССЫ И ВЫХОДОМ ЦЕЛЕВОГО БЕЛКА В ТЕЛЬЦАХ ВКЛЮЧЕНИЯ | 2011 |
|
RU2473683C1 |
| Способ получения кормового L-лизина | 1988 |
|
SU1576566A1 |
| Способ получения L-триптофана | 1981 |
|
SU990814A1 |
Способ предусматривает приготовление стиральной питательной среды, посев штамма-продуцента L-лизина и ферментацию. Проводят подпитку биомассы питательными веществами по результатам определения интенсивности дыхания, аэрацию и перемешивание культуральной жидкости, поддержание заданных значений температуры и pH среды. Для повышения наработки целевого продукта в культуральной жидкости и совместного повышения суммарнной продуктивности процесса и удельного выхода L-лизина ( в расчете на единицу питательного субстрата) подпитку после посева подают непрерывно в течение всего цикла ферментации. Ростовые вещества и источники углерода (углеводы) подают раздельно с разными расходами, учитывающими соотношение скоростей прироста биомассы и синтеза L-лизина. Выход L-лизина от массы углеводов - до 46%. 2 з.п. ф-лы, 1 табл., 1 ил.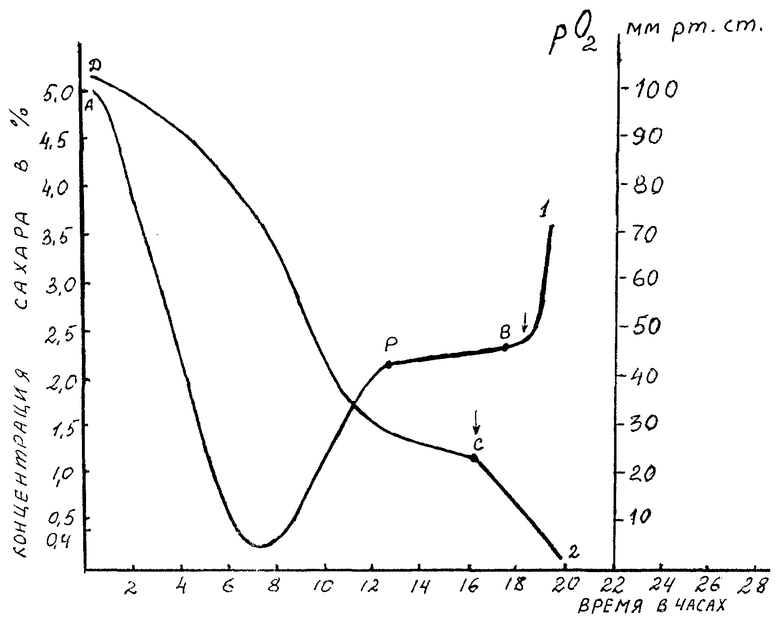
| Нефтяной конвертер | 1922 |
|
SU64A1 |
| Прибор для нагревания перетягиваемых бандажей подвижного состава | 1917 |
|
SU15A1 |
| Бекер В.Ф., Бекер М.Е | |||
| Лизин микробного синтеза | |||
| - Рига: Зинатне, 1974, с | |||
| Печь для сжигания твердых и жидких нечистот | 1920 |
|
SU17A1 |
Авторы
Даты
1999-01-27—Публикация
1996-03-18—Подача