Изобретение относится к биотехнологии, в частности к способу определения антифосфолипидных антител, и может быть использовано в биологии и медицине для определения антифосфолипидных антител в сыворотке крови человека при акушерских осложнениях (невынашивании беременности, токсикозах, внутриутробной задержке развития плода), ревматических заболеваниях (системной красной волчанке, системной склеродермии, ревматоидном артрите и др.), ряде заболеваний центральной нервной системы, злокачественных новообразованиях, лимфопролиферативных синдромах, при острых и хронических вирусных, бактериальных и паразитарных инфекциях (инфекционном мононуклеозе, туберкулезе, сифилисе, болезни Лима, СПИДе и др.).
Известен способ определения антифосфолипидных антител, заключающийся в том, что фосфолипиды диспергируют в дистиллированной воде с помощью ультразвукового дезинтегратора, фосфолипидную суспензию адсорбируют на поверхность лунок полистирольных микропланшетов при 50oC, планшеты обрабатывают 0,01М фосфатно-солевым буферным раствором, pH 7,2 (ФСБР), содержащим 2% бычьего сывороточного альбумина (БСА); планшеты инкубируют с сывороткой крови, разведенной 1:16 в ФСБР, содержащем 0,5% БСА и 0,05% твина-20 в течение 30 мин; планшеты промывают 3 раза ФСБР, содержащим 0,05% твина-20, и инкубируют с коньюгатом кроличьих поликлональных антител против иммуноглобулинов человека (IgM или IgG) с пероксидазой хрена, разведенным 1:2000 в ФСБР, содержащем 0,5% БСА и 0,05% твина-20, в течение 50 мин; планшеты промывают 5 раз ФСБР, содержащим 0,5% твина-20, и вносят в лунки субстратно-хромогенный раствор, содержащий тетраметилбензидин и перекись водорода, через 15 мин измеряют оптическую плотность каждой лунки при 450 нм [1].
Это методическое решение является наиболее близким к списываемому по технической сущности. Главным недостатком описанного метода является его недостаточно высокая чувствительность. К числу недостатков также следует отнести необходимость приготопления сенсибилизированных антигеном планшетов непосредственно перед проведением анализа из-за нестабильности фосфолипидов при хранении, применение высокой температуря (50oC) для адсорбции фосфолипидов на планшеты, применение детергента в буферах для промывания планшетов и разведения исследуемых образцов и коньюгата, использование поликлональных антител для детекции антифосфолипидных антител, что приводит к недостаточно высокой чувствительности, точности и воспроизводимости определения и обуславливает также высокую вероятность неспецифического связывания реагентов.
Технической задачей изобретения является появление чувствительности определения антифосфолипидных антител. Эта задача решается описываемым способом определения антифосфолипидных антител, заключающимся в диспергировании фосфолипидов в водной среде, содержащей криопротектор в весовом соотношении 1:1-1:3 с массой фосфолипида, адсорбции фосфолипидов на полистирольные планшеты при 30-40oC, обработке планшетов водным буферным раствором (pH 7,4±0,2), содержащим 0,5-2% инертного белка, желатина или бычьего сывороточного альбумина, инкубировании планшетов с сывороткой крови, разведенной в соотношении 1:20-1:60 по объему в водном растворе инертного белка с концентрацией 0,5-1%, промывании планшетов до и после инкубации водным буферным раствором, использовании для детекции антифосфолипидных антител конъюгата моноклональных антител против иммуноглобулинов человека с пероксидазой хрена и субстратно-хромогенной смеси, содержащей о-фенилендиамин и перекись водорода.
Практически способ осуществляется следующим образом.
15-20 кг фосфолипида диспергируют в 100 мл дистиллированной воды, содержащей в качестве криопротектора сахарозу в весовом соотношении 1:1 - 1:3 с массой фосфолипида, с помощью ультразвукового дезинтегратора при частоте 22 кГц и силе тока 5А в течение 3 мин. Полученную суспензию адсорбируют на полистирольные микропланшеты, 50 мкл на лунку, при 30-40oC в течение (18±2) ч. Планшеты промывают 4 раза ФСБР и обрабатывают раствором инертного белка желатина или БСА, в ФСБР с концентрацией 0,5-2%, 100 мкл на лунку, при комнатной температуре в течение 2 ч, промывают 4 раза ФСБР и инкубируют с исследуемыми образцами сыворотки крови, разведенными в объемном соотношении 1: 20-1: 60 ФСБР, содержащим 0,5-1% инертного белка, по 75 мкл на лунку, при (20±2)oC на шейкере в течение 60-30 мин. После 4-кратного промывания ФСБР планшеты инкубируют с раствором конъюгата мышиных моноклональных антител против иммуноглобулинов человека IgM или IgG с пероксидазой хрена в разведении 1:30000-1:100000 в ФСБР, содержащем 0,5-1% инертного белка, по 50 мкл на лунку, при (20±2)oC на шейкере в течении 60 мин. После 4-кратного промывания ФСБР в лунки добавляют субстратно-хромогенный раствор, содержащий о-фенилендиамин и перекись водорода, и через 15 мин измеряют оптическую плотность при 492 нм.
Отличительной особенностью предлагаемого способа является то, что диспергирование фосфолипидов проводится в водном растворе, содержанием криопротектор в весовом соотношении 1:1 - 1:3 с массой фосфолипидов, адсорбцию фосфолипидной суспензии на полистирольные микропланшеты проводят при 30-40oC, планшеты инкубируют с сывороткой, разведенной в объемных соотношениях 1:20 - 1: 60 водным буферным раствором без добавления детергента, содержащим только инертный белок, промывку планшетов до и после инкубаций проводят водным буферным раствором без детергента, для детекции антифосфолипидных антител использует конъюгаты мышиных моноклональных антител против иммуноглобулинов человека (IgM, IgG) с пероксидазой хрена и субстратно-хромогенную смесь, содержащую о-фенилендиамин и перекись водорода, измерение оптической плотности в лунках проводят при 492 нм. В соответствии с описываемым способом стадию диспергирования фосфолипидов необходимо проводить в присутствии криопротектора, адсорбцию фосфолипидов на планшеты необходимо проводить в интервале 30-40oC, тестируемую сыворотку разводить в объемных соотношениях 1:20 - 1:60 водным буферным раствором без детергента, содержащим только инертный белок, промывку планшетов до и после инкубации проводить водным буферным раствором без детергента для достижения технического результата. Предпочтительно в качестве фосфолипидов использовать фосфатидилхолин и фосфатидилэтаноламин, выделенные из куриного желтка, фосфатидилсерин и сфингомиелин, выделенные из мозга быка, кардиолипин, выделенный из сердца быка и фосфатидилинозитол, выделенный из дрожжей. Предпочтительно проводить диспергирование фосфатидилэтаноламина в водном растворе с криопротектором, дополнительно содержащем 1% уксусной кислоты.
Пример 1 (контрольный по прототипу). 17 мг яичного фосфатидилхолина диспергируют в 100 мл дистиллированной воды. Полученную суспензии адсорбируют на полистирольный микропланшет при 50oC. Планшеты промывают 3 раза ФСБР, содержащим 0,05% твина-20 (ФСБР-твин). Планшеты обрабатывают 2%-ным раствором БСА в ФСБР. Планшеты промывают 3 раза ФСБР-твин. Исследуемые сыворотки крови разводят 1: 16 в ФСБР, содержащим 0,5% БСА и 0,05% твина-20 (ФСБР-БСА-твин), инкубируют в течение 30 мин при комнатной температуре. Планшеты промывают 3 раза ФСБР-твин. Конъюгат мышиных моноклональных антител против IgM человека с пероксидазой хрена разводят в ФСБР-БСА-твин 1:100000, инкубируют при комнатной температуре в течение 30 мин, промывают 5 раз ФСБР-твин, инкубируют с субстратно-хромогенным раствором.
Пример 2. 17 мг яичного фосфатидилхолина диспергирует в 100 мл дистиллированной воды, содержащей 34 мг сахарозы с помощью ультразвукового дезинтегратора. Полученную суспензии ФХ адсорбируют на полистирольный микропланшет при 37oC. Планшет промывают 4 раза ФСБР и обрабатывают 2%-ным раствором БСА в ФСБР. Планшет промывают 4 раза ФСБР и инкубируют с исследуемыми образцами сыворотки крови, разведенными 1:50 в ФСБР, содержащем 0,5% БСА(ФСБР-БСА), в течение 80 мин. После 4-кратного промывания ФСБР планшеты инкубируют с раствором конъюгата мышиных моноклональных антител против IgM человека с пероксидазой хрена в разведении 1:100000 в ФСБР-БСА в течение 60 мин. После 4-кратного промывания ФСБР планшеты инкубируют с субстратно-хромогенным раствором.
Пример 3. Анализ проводят аналогично способу, описанному в примере 2, за исключением того, что планшеты обрабатывают 0,5%-ным раствором желатина в ФСБР, этот же раствор использует для разведения исследуемых сывороток и конъюгата мышиных моноклональных антител против иммуноглобулинов человека IgM.
Пример 4. Анализ проводят аналогично способу, описанному в примере 3, за исключением того, что в качестве конъюгата используют конъюгат мышиных моноклональных антител против иммуноглобулинов человека IgG с пероксидазой хрена в разведении 1:50000.
Пример 5. Анализ проводят аналогично способу, описанному в примере 3, за исключением того, что в качестве фосфолипида используют яичный фосфатидилэтаноламин, а при его диспергировании в водный раствор с криопротектором добавляют уксусную кислоту в количестве 1%.
Пример 5.1. Анализ проводят аналогично способу, описанному в примере 3, за исключением того, что в качестве фосфолипида используют фосфатидилсерин, выделенный из мозга быка.
Пример 6. Анализ проводят аналогично способу, описанному в примере 3, за исключением того, что в качестве фосфолипида используют сфингомиелин, выделенный из мозга быка.
Пример 7. Анализ проводят аналогично способу, описанному в примере 3, за исключением того, что в качестве фосфолипида используют кардиолипин, выделенный из сердца быка.
Пример 8. Анализ проводят аналогично способу, описанному в примере 3, за исключением того, что в качестве фосфолипида используют фосфатидилинозитол, выделенный из дрожжей.
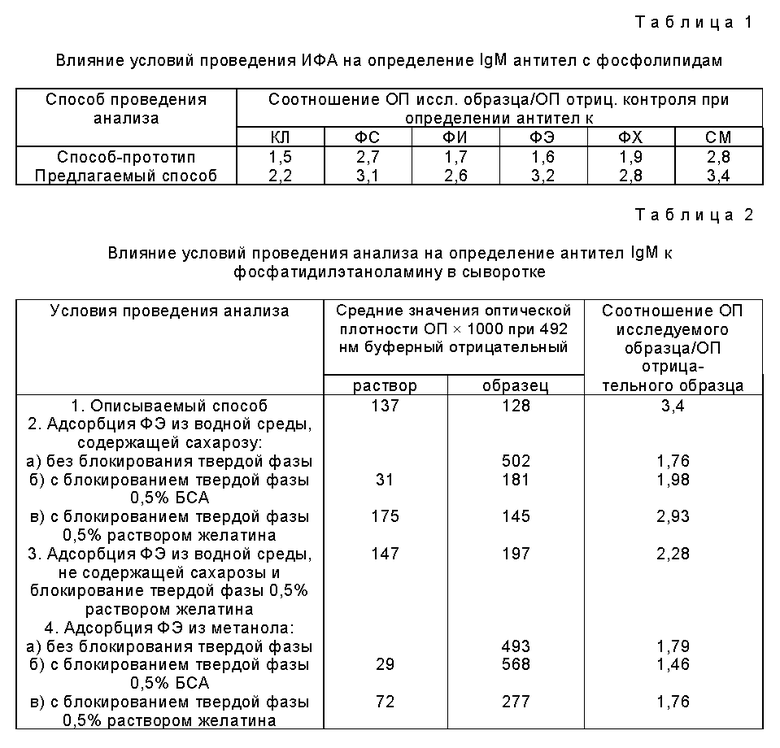
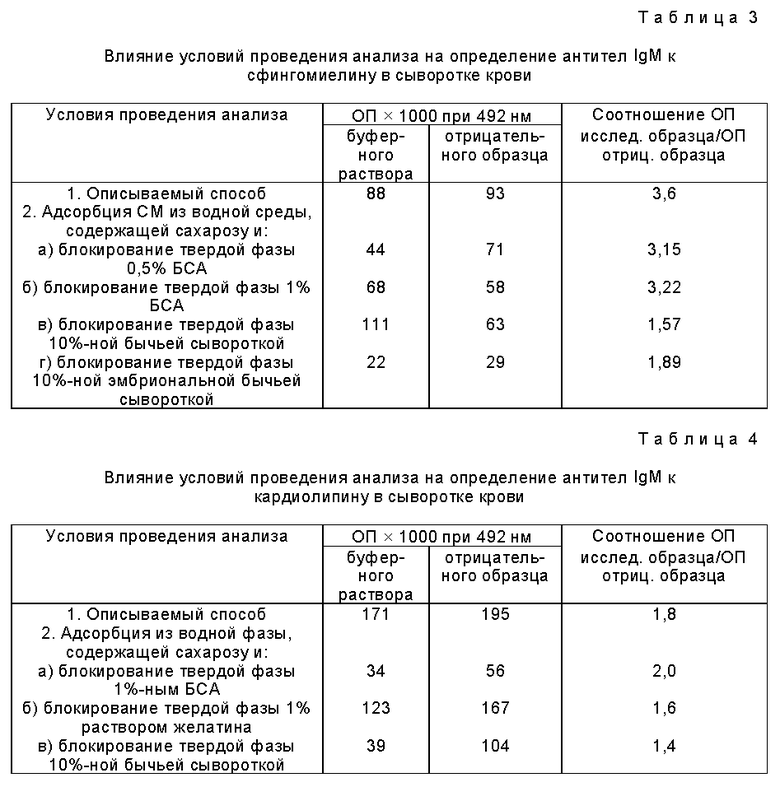
Описываемый способ обеспечивает в 1,5-2 раза более высокую чувствительность определения антифосфолипидных антител по сравнению со способом-прототипом. Из данных таблиц 1, 2, 3 и 4 видно, что описываемый способ по сравнению с другими вариантами обеспечивает более низкие значения оптической плотности для буферного раствора и отрицательных образцов, не содержащих антифосфолипидные антитела, и более высокие значения оптической плотности для положительных исследуемых образцов, а следовательно, обеспечивает более высокое соотношение оптической плотности исследуемого образца к оптической плотности отрицательного контроля и более высокую чувствительность и точность определения антифосфолипидных антител в сыворотке крови.
Применение описываемого способа дает возможность получения хороших результатов по определению антифосфолипидных антител при хранении готовых микропланшетов до 6 месяцев за счет: 1) использования значительно более насиженных фосфолипидов, менее подверженных окислению, по сравнении с прототипом, 2) применения более низких температур для адсорбции фосфолипидов на микропланшеты и 3) применения криопротекторов, позволяющих значительно повысить сохранность структуры липидного бислоя, а также самих липидов при длительном хранении. Кроме того, применение конъюгата моноклональных антител (вместо конъюгата поликлональных антител) с пероксидазой хрена для детекции антифосфолипидных антител позволяет существенно повысить чувствительность, специфичность и точность определения. Таким образом, описываемый способ позволяет существенно повысить качество определения антифосфолипидных антител в сыворотке крови, которое включает в себя улучшение таких параметров как чувствительность, специфичность, точность определения и воспроизводимость результатов.
Данное изобретение может быть использовано в биотехнологии и медицине для создания диагностикумов для определения антифосфолипидных антител при различных патологических состояниях и заболеваниях.
Литература
1. Kajino T. Amer J. Reproductive Immunology.- 1991. V.25, p. 28-34. "Polyclonal activation of IgM antibodies to phospholipids in patients with idiopathic fetal growth retardation"е
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ОПРЕДЕЛЕНИЯ АУТОАНТИТЕЛ К ПРОГЕСТЕРОНУ В СЫВОРОТКЕ И ПЛАЗМЕ КРОВИ ЧЕЛОВЕКА МЕТОДОМ ИММУНОФЕРМЕНТНОГО АНАЛИЗА | 2014 |
|
RU2567724C1 |
| СПОСОБ ЛАБОРАТОРНОЙ ДИАГНОСТИКИ ПРЕЖДЕВРЕМЕННОЙ НЕДОСТАТОЧНОСТИ ЯИЧНИКОВ ПО ОПРЕДЕЛЕНИЮ АУТОАНТИТЕЛ К СТЕРОИДОГЕННЫМ ФЕРМЕНТАМ ЦИТОХРОМА Р450 В СЫВОРОТКЕ (ПЛАЗМЕ) КРОВИ МЕТОДОМ ИММУНОФЕРМЕНТНОГО АНАЛИЗА | 2023 |
|
RU2829511C1 |
| РЕАГЕНТ ДЛЯ ИММУНОФЕРМЕНТНОГО АНАЛИЗА И СПОСОБ ИММУНОФЕРМЕНТНОГО ТЕСТИРОВАНИЯ СПЕЦИФИЧЕСКИХ АНТИТЕЛ ПРИ ОПИСТОРХОЗЕ, ВЫЗЫВАЕМОМ ПЕЧЕНОЧНОЙ ТРЕМАТОДОЙ OPISTHORHIS FELINEUS | 2001 |
|
RU2197736C1 |
| СПОСОБ ДОКЛИНИЧЕСКОЙ ДИАГНОСТИКИ ГЕСТОЗА | 1998 |
|
RU2135999C1 |
| СПОСОБ СЕРОДИАГНОСТИКИ HELICOBACTER PYLORI-ИНФЕКЦИИ ИММУНОФЕРМЕНТНЫМ АНАЛИЗОМ | 2001 |
|
RU2196993C1 |
| ШТАММ ВИРУСА КОРИ NOVO/96 ДЛЯ ПОЛУЧЕНИЯ АНТИГЕНА - КОМПОНЕНТА ТЕСТ-СИСТЕМЫ И ИММУНОФЕРМЕНТНАЯ ТЕСТ-СИСТЕМА ДЛЯ ДИАГНОСТИКИ АНТИТЕЛ К ВИРУСУ КОРИ | 2002 |
|
RU2230785C2 |
| Способ диагностики коронавирусного энтерита лошадей методом иммуноферментного анализа (варианты) | 2022 |
|
RU2796940C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ИММУНОГЕННОЙ АКТИВНОСТИ ВАКЦИНЫ ПРОТИВ БЕШЕНСТВА | 2016 |
|
RU2616898C1 |
| Иммуноферментная тест-система для серологической диагностики анаэробной энтеротоксемии животных и контроля напряженности поствакцинального иммунитета | 2016 |
|
RU2625031C1 |
| НАБОР ДЛЯ КОЛИЧЕСТВЕННОГО ОПРЕДЕЛЕНИЯ АВЕРМЕКТИНОВ МЕТОДОМ ОДНОСТАДИЙНОГО КОНКУРЕНТНОГО ИММУНОФЕРМЕНТНОГО АНАЛИЗА | 2009 |
|
RU2416094C1 |
Способ может быть использован в биотехнологии и медицине для определения антифосфолипидных антител при акушерских осложнениях. Фосфолипид диспергируют в водной среде, содержащей криопротектор при его весовом соотношении 1:1-1:3 с массой фосфолипида. Затем проводят адсорбцию фосфолипидной суспензии на полистирольные планшеты, при 30-40oC. Обрабатывают планшет водным буферным раствором при pH 7,4±0,2, содержащим желатин или бычий сывороточный альбумин (БСА) в концентрации 5-20 мг/мл. Затем осуществляют инкубирование с сывороткой крови, разведенной в соотношении 1:20-1:60 по объему в указанном водном буферном растворе, содержащем желатин или БСА в концентрации 5-10 мг/мл. Промывание планшет до и после инкубации проводят водным буферным раствором. В качестве конъюгата используют конъюгат моноклональных антител против иммуноглобулина человека с пероксидазой хрена. В качестве субстратно-хромогенной смеси используют субстратно-хромогенную смесь, содержащую о-фенилендиамин и перекись водорода. Оптическую плотность измеряют при длине волны 492 нм. При этом на стадии диспергирования в качестве фосфолипида используют фосфатидилхолин куриного желтка, или фосфатидилэтаноламин куриного желтка, или фосфатидилсерин мозга быка, или сфингомиелин мозга быка, или кардиолипин сердца быка, или фосфатидилинозитол дрожжей. При диспергировании фосфотидилэтаноламина в водную среду с криопротектором добавляют уксусную кислоту до конечной концентрации 10 мг/мл. Способ прост, информативен, его применение позволяет получить достоверные результаты при хранении готовых планшетов до 6 месяцев. 2 з.п.ф-лы, 4 табл.
субстратно-хромогенной смеси используют субстратно-хромогенную смесь, содержащую о-фенилендиамин и перекись водорода, а оптическую плотность измеряют при длине волны 492 нм.
| Kajino T | |||
| Policlonal activation of IgM antibodies to phospholipids in patiens with idiopatic fetal growthretardation, Amer.J.Reproductive Immunology, 1991, vol.25, p.28-34 | |||
| Способ определения изотипа антител | 1990 |
|
SU1720010A1 |
| Способ определения антител к ликопротеидам низкой плотности в крови | 1989 |
|
SU1705747A1 |
| Способ получения ферритинспецифичных антител | 1987 |
|
SU1505195A1 |
Авторы
Даты
1999-03-27—Публикация
1995-05-03—Подача