Настоящее изобретение относится к медицине, фармакологии и токсикологии и может быть использовано в медикобиологических исследованиях для определения про- и антиоксидантной активности различных факторов, в том числе лекарственных, токсических и экологических.
Известны способы оценки антиоксидантной активности лекарственных препаратов, ингибиторов активных форм кислорода и ферментативных антиоксидантов по определению уровня малонового диальдегида на спектрофотометре или по регистрации хемилюминесценции на хемолюминометре в гомогенатах тканей и других экспериментальных системах [1, 2].
Известен также спектрофотометрический способ оценки генерации анион-радикалов O2 (АР) под влиянием антиоксидантов и низкой температуры с помощью восстановления нитросинего тетразолия (НСТ) альвеолярными макрофагами (АМф). К суспензии альвеолярных макрофагов крыс добавляют частицы латекса и 0,4% раствор НСТ, затем инкубируют при 37oC. После инкубации реакцию останавливают добавлением соляной кислоты, центрифугируют, удаляют супернатант, а к клеткам добавляют пиридин и ставят на кипящую баню для экстрагирования образовавшегося в ходе реакции диформазана. Затем проводят спектрофотометрирование при длине волны 515 нм. Количество супероксиданион-радикала выражают в относительных единицах оптической плотности [3].
Недостатками известных способов являются:
1) регистрация методом хемилюминесценции суммарного пула активных форм кислорода (анион-радикалов, синглетного кислорода, перекиси водорода и др.) всеми типами клеток в исследуемом образце и невозможность определения продукции каких-либо активных радикалов селективно, например, анион-радикалов, без применения специфических, дефицитных и дорогостоящих люминофоров (фолазина, люцигенина и аналогов люциферина) [1, 2];
2) невозможность увидеть и оценить оксидантный потенциал какого-то одного типа клеток в неоднородной клеточной популяции (например, в гомогенате ткани, клетках крови, респираторном тракте, перитонеальной полости и т.д.) [1, 2, 3];
3) необходимость разделения клеток на отдельные фракции с помощью градиента фиколла-верографина, состоящего из дефицитных и дорогостоящих компонентов, с последующим определением хемилюминесценции и экстинкции в каждой из отдельных клеточных фракций [1, 2, 3];
4) необходимость использования очень токсичного и опасного вещества пиридина [3].
5) необходимость использования дорогостоящих приборов (хемолюминометра и спектрофотометра) [1, 2, 3].
Из известных способов оценки прооксидантного и антиоксидантного эффекта препаратов и факторов наиболее близким (прототипом) по технической сущности и достигаемому результату является способ определения антиоксидантной активности химических соединений, включающий воздействие препаратами на биологический объект (нейтрофилы человека), индукцию свободно-радикального окисления и оценку про- и антиоксидантной активности по разнице интенсивности хемолюминесценции нейтрофилов (Нф) крови в присутствии и в отсутствие исследуемого соединения [4].
Однако способ-прототип имеет следующие недостатки:
1) регистрируется люминол-зависимая хемилюминесценция суммарного пула активных форм кислорода (анион-радикалов, перекиси водорода и др.) в исследуемом образце клеток и невозможно определить селективно продукцию анион-радикалов без применения высокоспецифических, дефицитных и дорогостоящих люминофоров (фолазина, люцигенина и аналогов люциферина);
2) при регистрации хемилюминесценции невозможно увидеть и оценить оксидантный потенциал какого-то одного типа клеток в неоднородной клеточной популяции (например, в гомогенате тканей, клетках крови, респираторном тракте, перитонеальной полости и т.д.);
3) необходимо применять длительную и трудоемкую процедуру выделения нейтрофилов крови (или других клеток) на градиенте фиколла-верографина, состоящего из дефицитных и дорогостоящих компонентов, а потом определять хемилюминесценцию в полученной фракции нейтрофилов (или других клеток);
4) необходимо использовать дорогостоящий прибор - хемолюминометр.
Задачей настоящего изобретения является упрощение способа и обеспечение более адекватной оценки степени воздействия прооксидантных или антиоксидантных препаратов и факторов на продукцию анион-радикалов фагоцитирующими клетками за счет повышения селективности способа и обеспечения возможности определения продукции анион-радикалов разными типами фагоцитирующих клеток одновременно в одном исследуемом образце, а также устранение необходимости использования дорогостоящих приборов и реактивов.
Осуществление поставленной задачи достигается тем, что в способе оценки прооксидантной и антиоксидантной активности биохимических и физических факторов путем воздействия указанными факторами на биологический объект, индукции свободно-радикального окисления и оценки про- и антиоксидантной активности по разнице между биофизическими показателями при воздействии и в отсутствие воздействия исследуемых факторов, согласно изобретению в качестве биологического объекта используют монослои клеток лейкоконцентрата крови и/или бронхоальвеолярной лаважной (БАЛ) жидкости, полученные от животных, на которых воздействуют исследуемыми факторами in vivo, т. е. на организм животного в целом, а в качестве биофизических показателей используют показатели продукции анион-радикалов клетками монослоев лейкоконцентрата крови и/или бронхоальвеолярной лаважной жидкости, причем после формирования монослоев клеток к ним добавляют зимозановые гранулы (ЗГ) и нитро синий тетразолий (НСТ) в концентрациях, достаточных для последующего микроскопического исследования полученных препаратов, на основании которого в условных единицах (у. е.) рассчитывают индекс продукции анион-радикалов (ИПАР) фагоцитирующими клетками по формулам
для АМф ИПАР = Nд+ЗГ/100 АМф • Ид+ЗГ/10 АМф (у. е.),
для Нф крови ИПАР = Nд+ЗГ/100 Нф • Ид+ЗГ/10 Нф (у. е.),
и удельную продукцию анион-радикалов (УПАР) фагоцитирующими клетками по формулам:
для АМф УПАР = ИПАР • N АМф/г легких (у.е./г легких),
для Нф крови УПАР = ИПАР • N Нф/мм3 крови (у.е./мм3 крови),
где N - число
Nд+ЗГ - число диформазан-положительных ЗГ для 100 однотипных клеток в монослое (АМф, Нф):
Ид+ЗГ - интенсивность окрашивания диформазан-положительных ЗГ для 10 однотипных клеток в монослое (АМф, Нф),
и при понижении расчетных показателей ИПАР и УПАР относительно контрольных констатируют антиоксидантную активность, а при их повышении относительно контрольных - прооксидантную активность воздействующих факторов селективно по влиянию на продукцию анион-радикалов.
В качестве биохимических факторов используют полисахарид зимозан, полученный из дрожжевых клеток, вводимый однократно внутривенно в организм животных в дозе 100 мг/кг, и альфа-токоферол, вводимый внутрибрюшинно в организм животных в разовой суточной дозе 100 мг/кг в течение 8 суток, а в качестве физического фактора - содержание животных при -7oC в течение 8 суток. Указанные дозы вводимых препаратов и параметры физических факторов обеспечивают изменение численности альвеолярных макрофагов, их фагоцитарной способности и продукции ими анион-радикалов.
К монослою клеток добавляют зимозановые гранулы в концентрации 50-100 частиц на клетку с последующей инкубацией с ними в течение 1-2 часов и удалением нефагоцитируемых гранул, а нитросиний тетразолий добавляют к монослою клеток в количестве 0,2 мл, в концентрации 0,02-0,04% в бесцветной среде Хенкса с последующей инкубацией в течение 30-45 мин. Указанные количественные данные позволяют в оптимальных условиях провести микроскопические исследования.
Использованные дозы, схемы введения, сроки исследования влияния зимозана, альфа-токоферола и воздействия холода, возможные концентрации клеток, ЗГ и НСТ, а также длительность инкубации были подобраны в предварительно проведенных экспериментах.
Для сравниваемых значений продукции анион-радикалов в опыте и контроле необходимо соблюдать одинаковые условия инкубации клеток на каждом этапе.
Преимуществом предлагаемого способа по сравнению с прототипом является возможность селективного определения продукции анион-радикалов при воздействии исследуемых факторов на образцы клеток, а также возможность оценки оксидантного потенциала какого-то одного типа клеток в неоднородной клеточной популяции.
Совместно с другими параметрами данные о продукции анион-радикалов позволяют более объективно оценить прооксидантную и антиоксидантную активность биохимических и физических факторов.
Кроме того, предлагаемый способ позволяет наблюдать и оценивать под микроскопом функциональное состояние разных типов фагоцитирующих клеток лейкоцитов крови, не требует разделения лейкоконцентрата и БАЛ-жидкости на клеточные фракции, например, путем центрифугирования на градиенте фиколла-верографина, что упрощает и удешевляет технологический процесс.
Способ осуществляют следующим образом. Лабораторных животных подвергают in vivo воздействию биохимических или физических факторов. Лейкоконцентрат венозной крови из ретроорбитального синуса этих животных или БАЛ-жидкость получают в соответствии с описанными методами [5]. Не разделяя лейкоконцентрат или БАЛ-жидкость на клеточные фракции, добавляют питательную среду для культивирования, содержащую 10% сыворотки, доводят до концентрации 1 млн. кл./мл. Далее 0,5 мл суспензии клеток вводят в каждую камеру, приклеенную на предметном стекле, инкубируют при 37oC в течение 1-2 час для осаждения клеток, прикрепления их к стеклу и получения жизнеспособных монослоев этих клеток.
Полученные монослои клеток инкубируют в течение 1-2 час с ЗГ (d=4 мкм, 50-100 частиц/кл.), а затем - в течение 30 мин с (0,02-0,04)% раствором НСТ в бесцветной среде Хенкса. В результате восстановления НСТ анион-радикалами в процессе фагоцитирования ЗГ клетками полученных монослоев происходит отложение сине-фиолетового диформазана на ЗГ. Камеры снимают, монослои высушивают, ядра клеток окрашивают кармином и после микроскопирования оценивают индекс продукции анион-радикалов в условных единицах на основании числа диформазан-положительных ЗГ на 100 однотипных клеток, а также площади и интенсивности отложений диформазана на ЗГ для 10 однотипных клеток. Это обосновано тем, что в результате контакта ЗГ с фагоцитирующими клетками в присутствии НСТ происходит неравномерное отложение сине-фиолетового диформазана на ЗГ. При этом интенсивность и площадь окрашивания ЗГ может быть разной в зависимости от силы индуцируемой генерации АР. В связи с этим, степень окрашивания ЗГ диформазаном оценивают в 3-х балльной системе:
1 - слабая степень окрашивания всей площади одной ЗГ;
2 - средняя степень окрашивания всей площади одной ЗГ;
3 - высокая степень окрашивания всей площади одной ЗГ.
Кроме того, для 10 однотипных клеток с окрашенными ЗГ определяют интенсивность отложений диформазана на ЗГ, т.е. вычисляют какая часть всей площади ЗГ занята диформазаном определенной степени окрашивания. Например:
1) если 0,5 площади одной ЗГ окрашено с интенсивностью 1, то Ид+ЗГ = 0,5 • 1 = 0,5;
2) если 0,75 площади одной ЗГ окрашено с интенсивностью 2, то Ид+ЗГ = 0,75 • 2 = 1,5;
3) если 0,25 площади одной ЗГ окрашено с интенсивностью 3, то Ид+ЗГ = 0,25 • 3 = 0,75 и т.д.
В результате микроскопирования получают следующие исходные показатели:
Nд+ЗГ - число диформазан-положительных ЗГ для 100 однотипных клеток в монослое (АМф, Нф);
Ид+ЗГ - интенсивность окрашивания диформазан-положительных ЗГ для 10 однотипных клеток в монослое (АМф, Нф).
На основании этих показателей рассчитывают ИПАР - индекс продукции анион-радикалов для данного типа клеток (АМф, Нф), который представляет собой произведение числа диформазан-положительных ЗГ, в среднем присущего одной клетке, и интенсивности окрашивания диформазан-положительных ЗГ, в среднем присущей одной клетке данного типа.
Для АМф ИПАР = Nд+ЗГ/100 АМф • Ид+ЗГ/10 АМф (у.е.).
Для Нф крови ИПАР - Nд+ЗГ/100 Нф • Ид+ЗГ/10 Нф (у.е.).
Полученные данные статистически сравнивают с контрольными.
При анализе прооксидантного и антиоксидантного эффекта биологических, химических и физических факторов по ИПАР для определенного типа клеток учитывают количество этих клеток в контрольных и опытных образцах БАЛ-жидкости и лейкоконцентрата крови, которое тоже может меняться под влиянием исследуемых факторов. В связи с этим, прооксидантная эффективность воздействующих факторов на уровне целого организма может быть значительно выше при высокой численности данного типа клеток в образцах БАЛ-жидкости и крови. Напротив, антиоксидантная эффективность воздействующих факторов может быть значительно выше при низкой численности данного типа клеток в образцах БАЛ-жидкости и крови. Это служит основанием для расчета УПАР - удельной продукции анион-радикалов для данного типа клеток (АМф, Нф), которая представляет собой произведение ИПАР и концентрации рассматриваемых клеток в образцах БАЛ-жидкости и крови.
Для АМф УПАР = ИПАР • N АМф/г легких (у. е. /г легких).
Для Нф крови УПАР = ИПАР • N Нф/мм3 крови (у.е./мм3 крови).
Если на препаратах БАЛ-жидкости наблюдается достаточное количество Нф, то одновременно можно рассчитать ИПАР и УПАР не только для АМф, но и для Нф БАЛ-жидкости.
Если на препаратах лейкоконцентрата крови наблюдается достаточное количество моноцитов, то одновременно можно рассчитать ИПАР и УПАР не только для Нф, но и для моноцитов лейкоконцентрата крови.
Оценку прооксидантной или антиоксидантной эффективности биологических, химических и физических факторов делают на основании сравнения ИПАР и УПАР с их контрольными значениями. Чем больше отклонения обоих показателей от контроля, тем выше прооксидантный или антиоксидантный эффект соответствующего фактора в соответствующей дозе.
Пример конкретного применения предлагаемого способа
Крысам Вистар в первой группе в качестве биохимического фактора однократно внутривенно вводят дрожжевой полисахарид зимозан в дозе 100 мг/кг массы. Во второй группе в качестве химического фактора внутрибрюшинно в течение 8 сут вводят альфа-токоферол в суточной дозе 100 мг/кг. В третьей группе воздействие физического фактора моделируют содержанием крыс Вистар при -7oC в течение 8 сут. Оценку прооксидантной эффективности зимозана проводят через 5 сут, прооксидантной эффективности содержания в холоде - через 8 сут и антиоксидантной эффективности альфа-токоферола - через 8 сут после начала эксперимента. Крыс забивают под эфирным наркозом декапитацией с одновременным пережатием трахеи. Перед забоем из ретроорбитального синуса пастеровской пипеткой в пробирки с гепарином берут венозную кровь, из которой получают лейкоконцентрат. Легкие промывают средой 199 с гепарином. После подсчета клеток в камере Горяева получают монослои клеток БАЛ-жидкости и лейкоконцентрата крови в специально смонтированных на предметном стекле микрокамерах при инкубации в течение часа 0,5•106 клеток в среде 199 с 10% сыворотки. Затем полученные монослои инкубируют с ЗГ (50 частиц на клетку) в течение 2-х час. После этого монослои ополаскивают и добавляют 0,2 мл 0,02% раствора НСТ в бесцветной среде Хенкса и инкубируют еще 30 мин при 37oC. Далее снимают камеры, монослои ополаскивают, высушивают, фиксируют и окрашивают кармином. После микроскопирования при увеличении 1000 получают исходные данные.
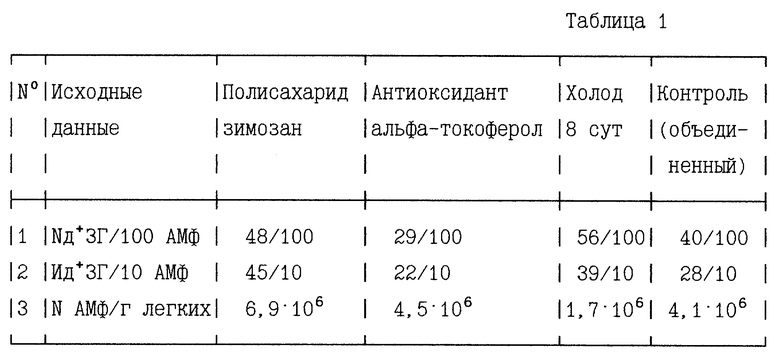
I. Оценку прооксидантной и антиоксидантной эффективности препаратов по ИПАР и УПАР для АМф в монослое БАЛ-жидкости осуществляют на основании исходных данных, приведенных в таблице 1 (отклонения от средних значений (m) в каждой группе из 4-5 животных меньше 5%).
В контрольной группе:
для АМф ИПАР = 0,4 • 2,8 = 1,12 у.е. (m=0,051)
для АМф УПАР = 1,12 • 4,1 • 106 = 4,592 • 106 у.е./г легких (m=0,222)
В группе оценки эффективности полисахарида зимозана:
для АМф ИПАР = 0,48 • 4,5 = 2,16 у.е. (m=0,097)
для АМф УПАР = 2,16 • 6,9 • 106 = 14,9 • 106 у.е./г легких (m=0,677)
В группе оценки эффективности антиоксиданта альфа-токоферола:
для АМф ИПАР = 0,29 • 2,2 = 0,638 у.е. (m=0,029)
для АМф УПАР = 0,638 • 4,5 • 106 = 2,871 • 106 у.е./г легких (m=0,138)
В группе оценки эффективности воздействия 8-ми сут холода:
для АМф ИПАР = 0,56 • 3,9 = 2,184 у.е. (m=0,099)
для АМф УПАР = 2,184 • 1,7 • 106 = 3,713 • 106 у.е./г легких (m=0,145)
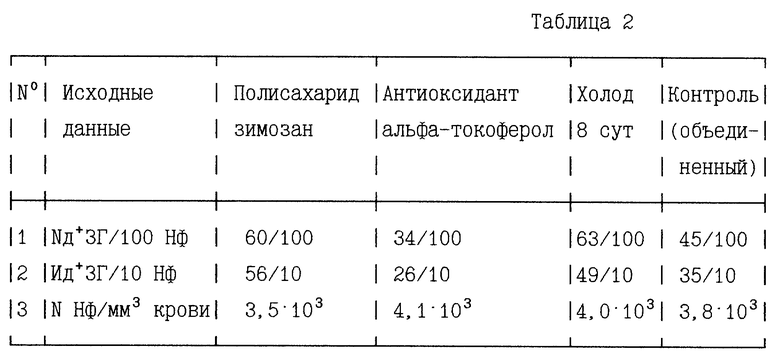
II. Оценку прооксидантной и антиоксидантной эффективности препаратов по ИПАР и УПАР для Нф в монослое лейкоконцентрата венозной крови осуществляют на основании исходных данных, приведенных в таблице 2 (отклонения от средних значений (m) в каждой группе из 4-5 животных меньше 5%).
В контрольной группе:
для Нф ИПАР = 0,45 • 3,5 = 1,575 y.e. (m=0,069)
для Нф УПАР = 1,575 • 3,8-103 = 5,985 • 103 у.е./мм3 крови (m=0,275)
В группе оценки эффективности полисахарида зимозана:
для Нф ИПАР = 0,60 • 5,6 = 3,36 y.e. (m=0,155)
для Нф УПАР = 3,36 • 3,5 • 103 = 11,76 • 103 у.е./мм3 крови (m=0,531)
В группе оценки эффективности антиоксиданта альфа-токоферола:
для Нф ИПАР = 0,34 • 2,6 = 0,884 y.e. (m=0,039)
для Нф УПАР = 0,884 • 4,1 • 103 = 3,624 • 103 у.е./мм3 крови (m=0,162)
В группе оценки эффективности воздействия 8-ми сут холода:
для Нф ИПАР = 0,63 • 4,9 = 3,09 у.е. (m= 0,099)
для Нф УПАР = 3,09 • 4,0 • 103 = 12,36 • 103 у.е./мм3 крови (m=0,145)
На основании сравнения полученных показателей ИПАР и УПАР с соответствующим контролем можно сделать вывод о высокой селективной эффективности зимозана как прооксиданта и высокой селективной эффективности альфа-токоферола как антиоксиданта в указанных дозах и способах введения, поскольку по всем расчетным показателям продукции АР наблюдается практически двукратное отличие от контроля. Содержание животных при -7oC в течение 8-ми сут оказывает сильное прооксидантное воздействие. Однако на фоне уменьшения численности АМф, УПАР для этих клеток даже ниже контроля, что может отражаться на общем снижении сопротивляемости легких различным инфекционным микроорганизмам в условиях холода, несмотря на повышение прооксидантного потенциала отдельно взятого АМф. Однако это требует осмысления в сочетании с другими показателями воздействия холода.
Если бы на препаратах БАЛ-жидкости было больше Нф, чем наблюдалось в данных примерах, то одновременно можно было рассчитать ИПАР и УПАР не только для АМф, но и для Нф БАЛ-жидкости.
Если бы на препаратах лейкоконцентрата крови было больше моноцитов, чем наблюдалось в данных примерах, то одновременно можно было рассчитать ИПАР и УПАР не только для Нф, но и для моноцитов лейкоконцентрата крови.
Предложенное техническое решение обеспечивает по сравнению с известными следующие преимущества:
- способ позволяет оценить прооксидантную или антиоксидантную эффективность препаратов и факторов на основании селективного определения продукции анион-радикалов клетками монослоев лейкоконцентрата крови или БАЛ-жидкости, что дает возможность получения более глубоких знаний о механизмах биологического и фармакологического действия исследуемых факторов и подбора наиболее оптимальных воздействующих доз;
- способ упрощает процедуру и расширяет технические возможности одновременного определения продукции анион-радикалов разными типами фагоцитирующих клеток в одном образце лейкоконцентрата крови или БАЛ-жидкости без фракционирования их на градиенте фиколла-верографина;
- способ позволяет адекватно оценить степень воздействия прооксидантных или антиоксидантных препаратов и факторов на продукцию анион-радикалов фагоцитирующими клетками без использования дорогостоящих приборов и реактивов.
Источники информации
1. Чайка Л. А., Поволоцкая В. А., Либина В. В. и др. Влияние парацетамола, его комбинаций с ацетилсалициловой и аскорбиновой кислотами на процессы перекисного окисления липидов в печени крыс //Экспериментальная и клиническая фармакология.-1996.-Т. 59, N1.-С. 43-46.
2. Зенков Н.К., Меньшикова Е.Б., Шергин С.М. Окислительный стресс. Диагностика, терапия, профилактика.-Новосибирск, 1993.-181 С.
3. Тнимов М.Х. Взаимосвязь активности макрофагов и перекисного окисления липидов биомембран легких при охлаждении. Диссертация на соискание уч. степ. канд. мед. наук. -Новосибирск, 1986.
4. Авторское свидетельство СССР N 1532869, МПК G 01 N 33/48, опубл. 1989., Бюл. N 48.
5. Е. Д. Гольдберг, А.М.Дыгай, В.П.Шахов. Методы культуры ткани в гематологии. -Томск, Издательство Томского Государственного университета, 1992. -С. 84-85.
Изобретение относится к медицине, токсикологии и фармакологии. Способ состоит в том, что от испытуемых животных, обработанных исследуемыми препаратами или факторами, получают жизнеспособные монослои клеток лейкоконцентрата венозной крови или бронхоальвеолярной лаважной жидкости, которые инкубируют с зимозановыми гранулами и раствором нитросинего тетразолия. На фиксированных и окрашенных кармином клетках монослоев при микроскопировании оценивают число и интенсивность окрашивания зимозановых гранул с отложениями диформазина. На основании этих исходных данных рассчитывают индекс продукции анион-радикалов и удельную продукцию анион-радикалов для конкретного типа клеток лейкоконцентрата венозной крови или бронхоальвеолярной лаважной жидкости и сравнивают их с контрольными. Под влиянием прооксидантов расчетные показатели увеличиваются, а под влиянием антоксидантов - уменьшаются относительно контроля. Способ позволяет упростить и обеспечить более адекватную оценку степени воздействия прооксидантных или антиоксидантных препаратов и факторов на продукцию анион-радикалов фагоцитирующими клетками. 2 з.п.ф-лы, 2 табл.
для АМФ ИПАР = Nд+ 3Г/100 АМФ • Ид+ 3Г/10 АМФ (у.е.),
для НФ крови ИПАР = Nд+ 3Г/100 НФ • Ид+ 3Г/10 НФ (у.е.)
и удельную продукцию анион-радикалов (УПАР) фагоцитирующими клетками по формулам
для АМФ УПАР = ИПАР • N АМФ/Г легких (у.е./г легких)
для НФ крови УПАР = ИПАР • N НФ/мм3 крови (у.е./мм3 крови),
где N - число;
АМФ - альвеолярные макрофаги;
НФ - нейтрофилы;
3Г - зимозановые гранулы;
Nд+ 3Г - число диформазан-положительных 3Г для 100 однотипных клеток в монослое (АМФ, НФ);
Ид+ 3Г - интенсивность окрашивания диформазан-положительных 3Г для 10 однотипных клеток в монослое (АМФ, НФ),
и при понижении расчетных показателей ИПАР и УПАР относительно контрольных констатируют антиоксидантную активность, а при их повышении относительно контрольных - прооксидантную активность воздействующих факторов селективно по влиянию на продукцию анион-радикалов.
| Способ определения антиоксидантной активности химических соединений | 1987 |
|
SU1532869A1 |
| Способ определения проокислительной активности химических веществ | 1989 |
|
SU1665305A1 |
| Способ определения малонового диальдегида в крови | 1990 |
|
SU1807410A1 |
Авторы
Даты
1999-05-10—Публикация
1996-08-08—Подача