Изобретения относятся к многокомпонентной системе для изменения, разложения и отбеливания лигнина лигнинсодержащих материалов или тому подобных веществ, а также к способу ее применения.
В настоящее время основными способами, применяемыми для получения целлюлозы, являются сульфатный и сульфитный способы. В обоих способах целлюлозу получают с применением варки и давления. Сульфатный способ работает с добавлением NaOH и Na2S, в то время как при сульфитном способе применяют Ca(HSO3)2 + SO2.
Главная цель всех способов состоит в удалении лигнина из применяемого растительного материала, древесины или однолетних растений.
Лигнин, являющийся вместе с целлюлозой и гемицеллюлозой главным компонентом растительного материала (стебля или ствола), должен быть удален, так как иначе невозможно получить бумагу, которая не желтеет и способна выдерживать высокие механические нагрузки.
В способах получения древесины применяются дефибрерные камни (получение древесной массы) или рафинеры (термомеханическая обработка), которые дефибрируют древесину путем размалывания после соответствующей предварительной (химической, термической или химико-термической) обработки.
Эта древесина еще содержит значительную часть лигнина. Она применяется прежде всего для изготовления газетной бумаги, бумаги для иллюстрированных изданий и т.д.
В течение ряда лет изучаются возможности применения ферментов для разложения лигнина. Механизм действия такого рода лигнолитических систем был выяснен лишь несколько лет назад, когда удалось благодаря созданию подходящих условий выращивания грибка белой гнили Phanerochaete chrysosporium и с помощью добавок индукторов получить достаточные количества фермента. При этом были обнаружены ранее неизвестные лигнин-пероксидазы и марганец-пероксидазы. Так как Phanerochaete chrysosporium является весьма эффективным разлагателем лигнина, то были сделаны попытки выделить ферменты этого грибка и использовать их в соответствующей форме для разложения лигнина. Однако это не удалось, так как оказалось, что ферменты приводят к реполимеризации лигнина, а не к его разложению.
То же самое относится и к другим лигнолитическим видам ферментов, таким как лакказы, которые окислительно разлагают лигнин с помощью кислорода вместо перекиси водорода. Было установлено, что во всех случаях имеют место аналогичные процессы. А именно образуются радикалы, которые снова реагируют друг с другом и тем самым приводят к полимеризации.
В настоящее время существуют лишь способы, которые работают с in-vivo системами (грибковыми системами). Основными моментами являются так называемая биологическая варка целлюлозы (biopulping) и биологическое отбеливание (biobleaching).
Под биологической варкой понимают обработку древесной щепы живыми грибковыми системами.
Существуют два вида применения.
1. Предварительная обработка щепы перед рафинированием или размалыванием для экономии энергии при получении древесины (например, термомеханическая обработка или получение древесной массы).
Преимущество этого вида применения состоит, как правило, в улучшении механических свойств материала, недостаток - в несколько худшей конечной белизне.
2. Предварительная обработка щепы (хвойная древесина/лиственная древесина) перед варкой целлюлозы (крафт-процесс, сульфитный процесс). Здесь цель состоит в снижении расхода химикатов на варку, улучшении варочной мощности и "расширенной варке" (extended cooking).
Преимущества этого вида применения состоят также в более значительном снижении числа Каппа после варки в сравнении с варкой без предварительной обработки.
Недостатки этих способов однозначно состоят в длительном времени обработки (несколько недель) и прежде всего в не устраненной опасности загрязнения во время обработки, если хотят отказаться от весьма неэкономичной стерилизации щепы.
Биологическое отбеливание также проводится в in-vivo системах. Вареную целлюлозу (хвойная древесина/лиственная древесина) перед отбеливанием засевают грибком и обрабатывают в течение от нескольких дней до нескольких недель. Только после этого длительного периода обработки наблюдается значительное снижение числа Каппа и повышение белизны, что делает процесс неэкономичным для включения в обычные схемы отбеливания.
Еще одним применением, проводимым большей частью с иммобилизованными грибковыми системами, является обработка сточных вод целлюлозной установки, в частности сточных вод отбельной установки, для их обесцвечивания и восстановления АОХ (восстановление хлорированных соединений в сточной воде, образующихся на стадиях отбелки хлором или двуокисью хлора).
Кроме того, известно применение гемицеллюлаз и других ксиланаз, маннаназ в качестве усилителя или ускорителя отбеливания ("Bleichbooster").
Эти ферменты должны действовать главным образом против повторно осажденного ксилана, отчасти перекрывающего остаточный лигнин после процесса варки, и повышать путем разложения лигнина доступность последнего для отбеливающих химикатов (прежде всего двуокиси хлора), применяемых в последующих стадиях отбелки. Доказанная в лаборатории экономия отбеливающих химикатов была подтверждена в крупном масштабе лишь условно, так что этот фермент можно отнести самое большое к классу отбеливающих добавок.
В качестве кофактора наряду с лигнолитическими ферментами применяют хелатные вещества (сидерофоры, например оксалат аммония) и поверхностно-активные биовещества.
В заявке PCT/EP87/00635 описывается система для удаления лигнина из содержащего лигнинцеллюлозу материала при одновременном отбеливании, работающая с лигнолитическими ферментами из грибков белой гнили с добавкой восстановителей и окислителей и фенольными соединениями в качестве посредников.
Согласно заявке DE 4008893C2 к окислительно-восстановительной системе добавляют "имитирующие вещества" ("Mimic Substanzen"), которые имитируют активный центр (простетическая группа) лигнолитических ферментов. Таким образом достигалось значительное улучшение производительности.
Согласно заявке PCT/EP92/01086 в качестве дополнительного усовершенствования применяют окислительно-восстановительный каскад с помощью фенольных и нефенольных ароматических соединений, "согласованных" по окислительному потенциалу.
Ограничивающим фактором крупнопромышленного применения для всех трех способов является то, что они применяются при низких плотностях массы (максимально до 4%), а способов, описанных в двух последних заявках, - еще опасность "выщелачивания" металлов при применении хелатных соединений, которые могут приводить прежде всего на последующих стадиях пероксидной отбелки к разрушению пероксида.
Из WO/12619, WO 94/12620 и WO 94/12621 известны способы, в которых активность пероксидазы усиливают посредством так называемых веществ-усилителей (Enhancer-Substanzen).
Вещества-усилители характеризуются в WO/12619 их периодом полураспада.
Согласно WO 94/12620 вещества-усилители охарактеризованы формулой A=N-N= B, причем A и B являются соответственно определенными циклическими остатками.
Согласно WO 94/12620 вещества-усилители являются органическими химикалиями, содержащими по меньшей мере два ароматических кольца, из которых по меньшей мере одно замещено соответственно определенными остатками.
Все три заявки относятся к "ингибированию переноса красителя" ("dye transfer inhibition") и применению соответствующих веществ-усилителей совместно с пероксидазами в качестве моющей добавки или моющей композиции из области моющих средств. Хотя в описании заявки указывается на применимость для обработки лигнина, однако собственно опыты с конкретными веществами, раскрытыми в заявке, показывают, что они как посредники для повышения белящего действия пероксидаз не оказывают никакого действия при обработке лигнинсодержащих материалов.
WO 94/29510 описывает способ ферментативной делигнификации, в котором ферменты применяют совместно с посредниками. В качестве посредников раскрываются, как правило, соединения со структурой NO-, NOH- или NRNOH.
Из приведенных в WO 94/29510 посредников наилучшие результаты в делигнификации получаются с 1-гидрокси-1H-бензотриазолом (ГБТ). ГБТ имеет, однако, различные недостатки.
Он доступен лишь по высоким ценам и не в достаточном количестве
Он реагирует в условиях делигнификации с образованием 1H-бензотриазола. Это соединение относительно трудно разлагаемо и в больших количествах может представлять угрозу загрязнения окружающей среды. В известной мере оно приводит к повреждению ферментов. Его делигнифицирующая скорость не слишком высока.
Поэтому поставлена задача предложить системы для изменения, разложения или отбеливания лигнина, лигнинсодержащих материалов или тому подобных веществ, которые не имеют вышеуказанных недостатков или имеют их в меньшей мере.
Настоящее изобретение относится к многокомпонентной системе для изменения, разложения или отбеливания лигнина, лигнинсодержащих материалов или тому подобных веществ, содержащей: а) в случае необходимости по меньшей мере один катализатор окисления, б) по меньшей мере один подходящий окислитель и в) по меньшей мере один посредник, отличающийся тем, что посредник выбран из группы N-арил-N-гидроксиамидов.
Неожиданно было установлено, что многокомпонентная система согласно изобретению с посредниками, выбранными из группы N-арил-N-гидроксиамидов, не имеет недостатков многокомпонентных систем, известных из уровня техники.
Предпочтительно в качестве посредников в многокомпонентной системе согласно изобретению применяют соединения общей формулы (I), (II) или (III)


а также их соли, простые или сложные эфиры,
где A - одновалентный гомо- или гетероароматический одно- или двухъядерный остаток и
D - двухвалентный гомо- или гетероароматический одно- или двухъядерный остаток, и
причем эти ароматические соединения могут быть замещены одним или несколькими одинаковыми или различными остатками R1, выбранными из группы галоген, гидрокси, формил, циано, карбамоил, карбокси, сложный эфир или соль карбоксиостатка, сульфоно, сложный эфир или соль сульфоноостатка, сульфамоил, нитро, нитрозо, амино, фенил, арил-C1-C5-алкил, C1-C12-алкил, C1-C5-алкокси, C1-C10-карбонил, карбонил-C1-C6-алкил, фосфо, фосфоно, фосфоноокси, сложный эфир или соль фосфонооксиостатка, и причем карбамоил, сульфамоил, амино и фенил могут быть не замещены или однократно либо многократно замещены остатком R2, а арил-C1-C5-алкил, C1-C12-алкил, C1-C5-алкокси, C1-C10-карбонил, карбонил-C1-C6-алкил могут быть насыщены или не насыщены, разветвлены или не разветвлены и однократно либо многократно замещены остатком R2, причем R2 одинаков или различен и означает гидрокси, формил, циано, карбокси, сложный эфир или соль карбоксиостатка, карбамоил, сульфоно, сульфамоил, нитро, нитрозо, амино, фенил, C1-C5-алкил, C1-C5-алкокси, C1-C5-алкилкарбонил, и по два остатка R1 и R2 могут быть попарно связаны через мостик [-CR3R4-]m, где m = 0, 1, 2, 3 или 4, и R3 и R4 одинаковы или различны и обозначают карбокси, сложный эфир или соль карбоксиостатка, фенил, C1-C5-алкил, C1-C5-алкокси, C1-C5-алкилкарбонил и одна или несколько несоседних групп [-CR3R4-] могут быть заменены на кислород, серу или на замещенный в случае необходимости C1-C5-алкильным остатком иминоостаток, а две соседние группы [-CR3R4-] могут быть заменены на группу [-CR3=R4-];
B - существующий в амидной форме одновалентный кислотный остаток кислот, выбранных из группы карбоновая кислота с числом C-атомов до 20, угольная кислота, полуэфир угольной кислоты или карбаминовой кислоты, сульфоновая кислота, фосфоновая кислота, фосфорная кислота, моноэфир фосфорной кислоты, диэфир фосфорной кислоты;
C - существующий в амидной форме двухвалентный кислотный остаток кислот, выбранных из группы моно- и дикарбоновая кислоты с числом C-атомов до 20, угольная кислота, сульфоновая кислота, фосфоновая кислота, фосфорная кислота, моноэфир фосфорной кислоты.
В качестве посредников в многокомпонентной системе согласно изобретению особенно предпочтительны соединения общей формулы (IV), (V), (VI) или (VII)




а также их соли, простые или сложные эфиры,
где Ar1 - одновалентный гомо- или гетероароматический одноядерный остаток;
где Ar2 - двухвалентный гомо- или гетероароматический одноядерный остаток, которые могут быть замещены одним или несколькими одинаковыми или различными остатками R7, выбранными из группы гидрокси, циано, карбокси, сложный эфир или соль карбоксиостатка, сульфоно, сложный эфир или соль сульфоноостатка, нитро, нитрозо, амино, C1-C12-алкил, C1-C5-алкокси, C1-C10-карбонил, карбонил-C1-C6-алкил, причем амино могут быть не замещены или однократно либо многократно замещены остатком R8, а C1-C12-алкил, C1-C5-алкокси, C1-C10-карбонил, карбонил-C1-C6-алкил могут быть насыщены или не насыщены, разветвлены или не разветвлены и однократно либо многократно замещены остатком R8, причем R8 одинаков или различен и обозначает гидрокси, карбокси, сложный эфир или соль карбоксиостатка, сульфоно, нитро, амино, C1-C5-алкил, C1-C5-алкокси, C1-C5-акилкарбонил и по два остатка R7 могут быть попарно связаны через мостик [-CR3R4]m, где m = 0, 1, 2, 3 или 4;
R3 и R4 имеют вышеуказанные значения, и одна или несколько несоседних групп [-CR3R4-] могут быть заменены на кислород, серу или на замещенный в случае необходимости C1-C5-алкильным остатком иминоостаток, а две соседние группы [-CR3R4-] могут быть заменены на группу [-CR3=CR4-];
R5 - одинаковые или различные остатки, выбранные из группы водород, фенил, арил-C1-C5-алкил, C1-C12-алкил, C1-C5-алкокси, C1-C10-карбонил, причем фенил может быть не замещен или однократно либо многократно замещен остатком R9, а арил-C1-C5-алкил, C1-C12-алкил, C1-C5-алкокси, C1-C10-карбонил могут быть насыщены или не насыщены, разветвлены или не разветвлены и однократно либо многократно замещены остатком R9, причем R9 одинаков или различен и обозначает гидрокси, формил, циано, карбокси, сложный эфир или соль карбоксиостатка, карбамоил, сульфоно, сульфамоил, нитро, нитрозо, амино, фенил, C1-C5-алкил, C1-C5-алкокси;
R6 обозначает двухвалентные остатки, выбранные из группы орто-, мета-, пара-фенилен, арилено-C1-C5-алкил, C1-C12-алкилен, C1-C5-алкилендиокси, причем фенил может быть не замещен или однократно либо многократно замещен остатком R9, а арил-C1-C5-алкил, C1-C12-алкил, C1-C5-алкокси могут быть насыщены или не насыщены, разветвлены или не разветвлены и однократно либо многократно замещены остатком R9;
p = 0 или 1;
q = 1, 2, 3.
Предпочтительно Ar1 обозначает фенильный остаток, а Ar2 орто-фениленовый остаток, причем Ar1 может иметь до пяти, а Ar2 до четырех одинаковых или различных остатков, выбранных из группы C1-C3-алкил, C1-C3-алкилкарбонил, карбокси, сложный эфир или соль карбоксиостатка, сульфоно, сложный эфир или соль сульфоноостатка, гидрокси, циано, нитро, нитрозо и амино, причем амино могут быть замещены двумя различными остатками, выбранными из группы гидрокси и C1-C3-алкилкарбонил.
Предпочтительно R5 обозначает одновалентный остаток, выбранный из группы водород, фенил, C1-C12-алкил, C1-C5-алкокси, причем C1-C12-алкил и C1-C5-алкокси могут быть насыщены или не насыщены, разветвлены или не разветвлены.
Предпочтительно R6 обозначает двухвалентные остатки, выбранные из группы орто- или пара-фенилен, C1-C12-алкилен, C1-C5-алкилендиокси, причем арил-C1-C5-алкил, C1-C12-алкил, C1-C5-алкокси могут быть насыщены или не насыщены, разветвлены или не разветвлены и однократно либо многократно замещены остатком R9.
Предпочтительно R9 обозначает карбокси, сложный эфир или соль карбоксиостатка, карбамоил, фенил, C1-C3-алкокси.
Примеры соединений, которые могут быть применены в многокомпонентной системе согласно изобретению в качестве посредников (компонент B), включают: N-гидроксиацетанилид, N-гидроксипивалоиланилид, N-гидроксиакриланилид, N-гидроксибензоиланилид, N-гидроксиметилсульфониланилид, N-гидрокси-N-фенилметилкарбамат, N-гидрокси-3-оксобутириланилид, N-гидрокси-4-цианоацетанилид, N-гидрокси-4-метоксиацетанилид, N-гидроксифенацетин, N-гидрокси-2,3-диметилацетанилид, N-гидрокси-2-метилацетанилид, N-гидрокси-4-метилацетанилид, 1-гидрокси-3,4-дигидрохинолин-(1H)-2-OH, N, N'-дигидрокси-N, N'-диацетил-1,3-фенилендиамин, N, N'-дигидроксиянтарная кислоты, дианилид N,N'-дигидроксималеиновой кислоты, дианилид N,N'-дигидроксищавелевой кислоты, дианилид N, N'-дигидроксифосфорной кислоты, N-ацетоксиацетанилид, N-гидроксиметилоксалиланилид, моноанилид N-дигидроксималеиновой кислоты.
В качестве посредников предпочтительны N-гидроксиацетанилид, N-гидроксиформанилид, N-гидрокси-N-фенилметилкарбамат, N-гидрокси-2-метилацетанилид, N-гидрокси-4-метилацетанилид, 1-гидрокси-3,4-дигидрохинолин-(1H)-2-он, а также N-ацетоксиацетанилид.
Многокомпонентная система согласно изобретению содержит посредники, более рентабельные, чем посредники, известные из уровня техники, в частности более рентабельные, чем ГБТ.
Кроме того, при применении посредников согласно изобретению достигается более высокая скорость делигнификациии.
Предпочтительно многокомпонентная система согласно изобретению включает по меньшей мере один катализатор окисления.
В качестве катализаторов окисления в многокомпонентной системе согласно изобретению применяются предпочтительно ферменты. В смысле изобретения понятие фермент охватывает также ферментативно активные протеины или пептиды или простетические группы ферментов.
В качестве фермента в многокомпонентной системе согласно изобретению могут применяться оксидоредуктазы классов от 1.1.1 до 1.97 по Международной номенклатуре ферментов Комитета Международного союза биохимии и молекулярной биологии (Enzyme Nomenclature, Academic Press, Inc., 1992, s. 24-154).
Предпочтительно применяются ферменты следующих классов.
Ферменты класса 1.1, включающие все дегидрогеназы, действующие на первичные, вторичные спирты и полуацетали, и имеющие в качестве акцепторов NAD+, или NADP+ (подкласс 1.1), цитохромы (1.1.2), кислород (O2), (1.1.3), дисульфиды (1.1.4), хиноны (1.1.5) или другие акцепторы (1.1.99).
Из этого класса особенно предпочтительны ферменты класса 1.1.5 с хинонами в качестве акцепторов и ферменты класса 1.1.3 с кислородом в качестве акцептора.
В частности, в этом классе предпочтительна целлобиоза: хинон-1-оксидоредуктаза (1.1.5.1).
Далее предпочтительны ферменты класса 1.2. Этот класс ферментов охватывает такие ферменты, которые окисляют альдегиды до соответствующих кислот или оксогрупп. Акцепторами могут быть NAD+, NADP+ (1.2.1), цитохромы (1.2.2), кислород (1.2.3), сульфиды (1.2.4), железосерные протеины (1.2.5) или другие акцепторы (1.2.99).
Особенно предпочтительны здесь ферменты группы (1.2.3) с кислородом в качестве акцептора.
Далее предпочтительны ферменты класса 1.3.
Этот класс объединяет ферменты, которые действуют на CH-группы донора.
Соответствующими акцепторами являются NAD+, NADP+ (1.3.1), цитохромы (1.3.2), кислород (1.3.3), хиноны или родственные соединения (1.3.5), железосерные протеины (1.3.7) или другие акцепторы (1.3.99).
Особенно предпочтительна билирубиноксидаза (1.3.3.5).
Здесь также особенно предпочтительны ферменты класса (1.3.3) с кислородом в качестве акцептора и (1.3.5) с хинонами и т.д. в качестве акцептора.
Далее предпочтительны ферменты класса 1.4, которые действуют на CH-NH2-группы донора.
Соответствующими акцепторами являются NAD+, NADP+ (1.4.1), цитохромы (1.4.2), кислород (1.4.3), дисульфиды (1.4.4), железосерные протеины (1.4.7) или другие акцепторы (1.4.99).
Особенно предпочтительны здесь также ферменты класса (1.4.3) с кислородом в качестве акцептора.
Далее предпочтительны ферменты класса 1.5, которые действуют на CH-NH-группы донора.
Соответствующими акцепторами являются NAD+, NADP+ (1.5.1), кислород (1.5.3), дисульфиды (1.5.4), хиноны (1.5.5) или другие акцепторы (1.5.99).
И здесь также особенно предпочтительны ферменты с кислородом (O2) (1.5.3) и с хинонами (1.5.5) в качестве акцепторов.
Далее предпочтительны ферменты класса 1.6, которые действуют на NADN или NADPH.
Акцепторами здесь являются NADP+ (1.6.1), гемпротеины (1.6.2), дисульфиды (1.6.4), хиноны (1.6.5) NO2-группы (1.6.6) и флавин (1.6.8) или другие акцепторы (1.6.99).
Особенно предпочтительны здесь ферменты класса 1.6.5 с хинонами в качестве акцепторов.
Далее предпочтительны ферменты класса 1.7, которые действуют на другие NO2-соединения в качестве доноров и которые имеют в качестве акцепторов цитохромы (1.7.2), кислород (O2) (1.7.3), железосерные протеины (1.7.7) или другие (1.7.99).
Здесь особенно предпочтителен класс 1.7.3 с кислородом в качестве акцептора.
Далее предпочтительны ферменты класса 1.8, которые действуют на серные группы в качестве доноров и имеют в качестве акцепторов NAD+, NADP+ (1.8.1), цитохромы (1.8.2), кислород (O2) (1.8.3), дисульфиды (1.8.4), хиноны (1.8.5), железосерные протеины (1.8.7) или другие (1.8.99).
Особенно предпочтителен класс 1.8.3 с кислородом (O2) и (1.8.5) в хинонами в качестве акцепторов.
Далее предпочтительны ферменты класса 1.9, которые действуют на гемгруппы в качестве доноров и имеют в качестве акцепторов кислород (O2) (1.9.3), NO2-соединения (1.9.6) и другие (1.9.99).
Особенно предпочтительна здесь группа 1.9.3 с кислородом (O2) в качестве акцептора (цитохромоксидазы).
Далее предпочтительны ферменты класса 1.12, действующие на водород в качестве донора.
Акцепторами являются NAD+ или NADP+ (1.12.1) или другие (1.12.99).
Кроме того, предпочтительны ферменты класса 1.13 и 1.14 (оксигеназы).
Далее предпочтительны ферменты класса 1.15, которые действуют на пероксидные радикалы в качестве доноров.
Особенно предпочтительна здесь пероксид-дисмутаза (1.15.1.1).
Далее предпочтительны ферменты класса 1.16.
В качестве акцепторов действуют NAD+, NADP+ (1.16.1) или кислород (O2) (1.16.3).
Особенно предпочтительны здесь ферменты класса 1.16.3.1 (ферроксидаза, например церулоплазмин).
Далее предпочтительными ферментами являются те, которые принадлежат к группе 1.17 (действие на CH2-группы, окисляемые до -CHOH-), 1.18 (действие на восстановленный ферредоксин в качестве донора), 1.19 (действие на восстановленный флаводоксин в качестве донора) и 1.97 (другие оксидоредуктазы).
Далее особенно предпочтительны ферменты группы 1.11, которые действуют на пероксид в качестве акцептора. Это единственный подкласс (1.11.1), который содержит пероксидазы.
Особенно предпочтительны здесь цитохром-C-пероксидазы (1.11.1.5), каталаза (1.11.1.6), пероксидаза (1.11.1.7), иодидпероксидаза (1.11.1.8), глутатион-пероксидаза (1.11.1.9), хлорид-пероксидаза (1.11.1.10), L-аскорбат-пероксидаза (1.11.1.11), фосфолипид-гидропероксид-глутатион-пероксидаза (1.11.1.12), марганец-пероксидаза (1.11.1.13), диарилпропанпероксидаза (лигниназа, лигнин-пероксидаза) (1.11.1.14).
Совершенно особенно предпочтительны ферменты класса 1.10, действующие на бифенолы и родственные соединения. Они катализируют окисление бифенолов и аскорбатов. Акцепторами служат NAD+, NADP+ (1.10.1), цитохромы (1.10.12), кислород (1.10.3) и другие (1.10.99).
Из них в свою очередь особенно предпочтительны ферменты класса 1.10.3 с кислородом (O2) в качестве акцептора.
Из ферментов этого класса предпочтительны ферменты катехол-оксидаза (тирозиназа) (1.10.3.1), L-асорбат-оксидаза (1.10.3.3), O-аминофенол-оксидаза (1.10.3.4) и лакказа (бензолдиол: оксиген-оксидоредуктаза (1.10.3.2), причем лакказы (бензолдиол: оксиген-оксидоредуктаза) (1.10.3.2) особенно предпочтительны.
Названные ферменты имеются в продаже или могут быть получены стандартными методами. В качестве организмов, продуцирующих ферменты, можно рассматривать, например, растения, животные клетки, бактерии и грибки. В принципе продуцентами ферментов могут быть организмы, как встречающиеся в природе, так и модифицированные методами генной инженерии. В качестве продуцентов ферментов также мыслимы части одноклеточных или многоклеточных организмов, прежде всего культуры клеток.
Для особенно предпочтительных ферментов, например ферментов из группы 1.11.1, в особенности же 1.10.3, и в частности для продуцирования лакказ применяются, например, грибки белой гнили, такие как Pleurotus, Phlebia и Trametes.
Многокомпонентная система согласно изобретению включает по меньшей мере один окислитель. В качестве окислителей могут применяться, например, воздух, кислород, озон, H2O2, органические пероксиды, надкислоты, такие как надуксусная кислота, надмуравьиная кислота, надсерная кислота, надазотная кислота, метахлорпероксибензойная кислота, хлорная кислота, пербораты, перацетаты, персульфаты, пероксиды или кислородсодержащие соединения и их радикалы, такие как OH, OOH, атомарный кислород, супероксид (O
Предпочтительно применяют такие окислители, которые либо могут быть генерированы соответствующими оксидоредуктазами, например диоксираны из лакказ плюс карбонилы, либо могут химически регенерировать посредник или превращать его непосредственно.
Изобретение относится также к применению веществ, пригодных согласно изобретению в качестве посредников для изменения, разложения или отбеливания лигнина, лигнинсодержащих материалов или тому подобных веществ.
Эффективность многокомпонентной системы при изменении, разложении или отбеливании лигнина, лигнинсодержащих материалов или тому подобных веществ часто усиливается в присутствии, наряду с названными компонентами, ионов Mg
В некоторых случаях дальнейшее повышение эффективности многокомпонентной системы согласно изобретению может быть достигнуто тем, что многокомпонентная система содержит наряду с ионами Mg
Применение многокомпонентной системы согласно изобретению в способе для обработки лигнина производится, например, тем, что соответствующим образом выбранные компоненты а) - в) по п. 1 формулы изобретения смешивают одновременно или в любой последовательности с водной суспензией лигнинсодержащего материала.
Предпочтительно способ с применением многокомпонентной системы согласно изобретению проводят в присутствии кислорода или воздуха при давлении от нормального до 10 бар и в пределах pH от 2 до 11, при температуре от 20 до 95oC, предпочтительно от 40 до 95oC, и плотности массы от 0,5 до 40%.
Неожиданный и необычный для применения ферментов при отбеливании целлюлозы результат состоит в том, что при применении многокомпонентной системы согласно изобретению повышение плотности массы позволяет достичь существенного снижения числа Каппа.
Из экономических соображений способ согласно изобретению предпочтительно проводят при плотностях массы от 8 до 35%, особенно предпочтительно при плотностях массы от 9 до 15%.
Неожиданно оказалось далее, то кислая промывка (pH от 2 до 6, предпочтительно от 4 до 5) или Q-стадия (pH от 2 до 6, предпочтительно от 4 до 5) перед стадией обработки ферментом/посредником приводит к значительному снижению числа Каппа для некоторых целлюлоз в сравнении с обработкой без этой специальной обработки. На Q-стадии применяются в качестве хелатообразователей обычные для этого вещества (такие, как ЭДТУК, ДТПУК). Они применяются предпочтительно в концентрации от 0,1 до 1% (в пересчете на сухую целлюлозу), особенно предпочтительно в концентрации от 0,1 до 0,5% (в пересчете на сухую целлюлозу).
В способе согласно изобретению применяют предпочтительно от 0,01 до 100000 IU (международных единиц = м.е.) фермента на грамм лигнинсодержащего материала. Особо предпочтительно применяемые количества фермента составляют от 0,1 до 100, в частности от 1 до 40 м.е. на грамм лигнинсодержащего материала (1 U соответствует конверсии 1 мкмоль диаммониевой соли 2,2'-азинобис(3-этил-бензотиазолин-6)-сульфокислоты (АБТС)/мин/мл фермента).
В способе согласно изобретению применяют предпочтительно от 0,01 мг до 100 мг окислителя на грамм лигнинсодержащего материала. Особенно предпочтительно применяют от 0,01 мг до 50 мг окислителя на грамм лигнинсодержащего материала.
В способе согласно изобретению применяют предпочтительно от 0,5 до 80 мг посредника на грамм лигнинсодержащего материала. Особенно предпочтительно применяют от 0,5 до 40 мг посредника на грамм лигнинсодержащего материала.
Одновременно могут быть добавлены восстановители, которые служат совместно с имеющимися окислителями для установления определенного окислительно-восстановительного потенциала.
В качестве восстановителей могут использоваться бисульфит натрия, дитионит натрия, аскорбиновая кислота, тиосоединения, меркаптосоединения или глутатион и др.
Реакция протекает, например, при использовании лакказы, с подачей воздуха или кислорода или при избыточном давлении воздуха, соответственно кислорода, при использовании пероксидаз (например, лигнин-пероксидаз, марганец-пероксидаз) в присутствии пероксида водорода. При этом, например, кислород может генерироваться с помощью системы пероксид водорода + каталаза, а пероксид водорода - с помощью системы глюкоза + GOD (глюкозооксидаза) или других систем in situ.
Кроме того, к системе могут быть добавлены образователи радикалов или поглотители радикалов (поглощение, например, радикалов OH или OOH). Последние могут улучшить взаимодействие между окислительно-восстановительными и радикальными посредниками.
В реакционный раствор могут быть добавлены и другие соли металлов.
Эти соли имеют важное значение во взаимодействии с хелатообразователями как радикалообразователи или окислительно-восстановительные центры. Соли образуют в реакционном растворе катионы. Такими ионами, например, являются Fe2 +, Fe3 +, Mn2 +, Mn3 +, Mn4 +, Cu2 +, Ca2 +, Ti4 +, Ce3 +, Al3 +. Имеющиеся в растворе хелаты, кроме того, могут служить как имитирующие вещества для ферментов, например для лакказ (медные комплексы) или для лигнин- или марганецпероксидаз (гемкомплексы). Под имитирующими веществами следует понимать вещества, которые имитируют простетические группы (здесь) оксидоредуктаз и могут, например, катализировать окислительные реакции.
Далее в реакционную смесь может быть добавлен NaOCl. Это соединение может образовывать во взаимодействии с пероксидом водорода атомарный кислород.
Наконец, можно работать с применением детергентов. В качестве таковых могут рассматриваться неионные, анионые, катионные и амфотерные поверхностно-активные вещества. Детергенты могут улучшить проникновение ферментов и посредников в волокно.
Также может способствовать реакции добавление полисахаридов и/или протеинов. В качестве полисахаридов здесь необходимо назвать, в частности, глюканы, маннаны, декстраны, леваны, пектины, альгинаты или растительные резины и/или собственные полисахариды, образованные грибками или продуцированные в смешанной культуре дрожжами, а в качестве протеинов - желатины и альбумин.
Эти вещества служат главным образом в качестве защитных коллоидов для ферментов.
Другими протеинами, которые могут быть добавлены, являются протеазы, такие как пепсин, бромелин, папаин и т.д. Они могут обеспечивать лучший доступ к лигнину благодаря разложению присутствующего в древесине экстенсина C, т.е. протеина, богатого гидроксипролином.
В качестве других защитных коллоидов могут рассматриваться аминокислоты, простые сахара, олигомерные сахара, полиэтиленгликоли (ПЭГ) самых различных молекулярных весов, полиэтиленоксиды, полиэтиленимины и полидиметилсилоксаны.
Способ согласно изобретению может применяться не только при делигнификации (отбелке) сульфатной, сульфитной, органозольной и других видов целлюлозы и древесины, но и вообще при получении целлюлозы, будь то из дерева или однолетних растений, если дефибрилирование происходит посредством обычных процессов варки (возможно, связанных с механическими способами и давлением), т. е. посредством весьма щадящей варки вплоть до значений числа Каппа в пределах от 50 до 120.
При отбелке целлюлозы, также как и при получении целлюлозы, обработку можно повторять многократно, либо после промывки и экстракции обработанного вещества посредством NaOH, либо без этих промежуточных стадий. Это обеспечивает еще более существенное снижение числа Каппа и значительное повышение белизны. Также можно перед обработкой ферментом/посредником включить стадию обработки кислородом или, как уже упоминалось, проводить кислую промывку или Q-стадию (хелатостадию).
Ниже изобретение подробнее поясняется на примерах.
Пример 1. Ферментативное отбеливание сульфатной целлюлозы из хвойной древесины с применением N-гидроксиацетанилида.
5 г абсолютно сухой целлюлозы (хвойная древесина делигнифицирована кислородом), плотность массы 30% (около 17 г во влажном состоянии), добавляют к следующим растворам:
A) 20 мл водопроводной воды смешивают с 56,5 мг N-гидроксиацетанилида при перемешивании, pH устанавливают раствором H2SO4 (0,5 моль/л) так, что после добавления целлюлозы и фермента pH равен 4,5.
B) 5 мл водопроводной воды смешивают с таким количеством лакказы Trametes versicolor, что в результате получается активность 15 U (1 U = конверсия 1 мкмоль АБТС/мин/мл фермента) на грамм целлюлозы.
Растворы А и Б объединяют и доводят до 33 мл.
После добавления целлюлозы месят в течение 2 мин тестомесильным устройством.
Затем массу помещают в реакционную бомбу, предварительно нагретую до 45oC, и инкубируют под избыточным давлением кислорода 1-10 бар в течение 1-4 часов.
После этого массу промывают над нейлоновым ситом (30 мкм) и экстрагируют в течение 1 часа при 60oC, 2%-ной плотности массы и 8% NaOH на грамм целлюлозы.
После повторной промывки определяют число Каппа. Результаты приведены в таблице.
Пример 2. Ферментативное отбеливание сульфатной целлюлозы из хвойной древесины с применением N-бензоил-N-фенилгидроксиламина.
5 г абсолютно сухой целлюлозы (хвойная древесина делигнифицирована кислородом), плотность массы 30% (около 17 г во влажном состоянии), добавляют к следующим растворам:
A) 20 мл водопроводной воды смешивают с 80 мг N-бензоил-N-фенилгидроксиламина при перемешивании, pH устанавливают раствором H2SO4 (0,5 моль/л) так, что после добавления целлюлозы и фермента pH равен 4,5.
B) 5 мл водопроводной воды смешивают с таким количеством лакказы Trametes versicolor, что в результате получается активность 15 U (1 U - конверсия 1 мкмоль АБТС/мин/мл фермента) на грамм целлюлозы.
Растворы А и Б объединяют и доводят до 33 мл.
После добавления целлюлозы месят в течение 2 мин тестомесильным устройством.
Затем массу помещают в реакционную бомбу, предварительно нагретую до 45oC, и инкубируют под избыточным давлением кислорода 1-10 бар в течение 1-4 часов.
После этого массу промывают над нейлоновым ситом (30 мкм) и экстрагируют в течение 1 часа при 60oC, 2%-ной плотности массы и 8% NaOH на грамм целлюлозы.
После повторной промывки определяют число Каппа. Результаты приведены в таблице.
Пример 3. Ферментативное отбеливание сульфатной целлюлозы из хвойной древесины с применением анилида N-гидрокси-3-оксомасляной кислоты.
5 г абсолютно сухой целлюлозы (хвойная древесина делигнифицирована кислородом), плотность массы 30% (около 17 г во влажном состоянии), добавляют к следующим растворам:
A) 20 мл водопроводной воды смешивают с 72,5 мг анилида N-гидрокси-3-оксомасляной кислоты при перемешивании, pH устанавливают раствором H2SO4 (0,5 моль/л) так, что после добавления целлюлозы и фермента pH равен 4,5.
B) 5 мл водопроводной воды смешивают с таким количеством лакказы Trametes versicolor, что в результате получается активность 15 U (1 U = конверсия 1 мкмоль АБТС/мин/мл фермента) на грамм целлюлозы.
Растворы А и Б объединяют и доводят до 33 мл.
После добавления целлюлозы месят в течение 2 мин тестомесильным устройством.
Затем массу помещают в реакционную бомбу, предварительно нагретую до 45oC, и инкубируют под избыточным давлением кислорода 1-10 бар в течение 1-4 часов.
После этого массу промывают над нейлоновым ситом (30 мкм) и экстрагируют в течение 1 часа при 60oC, 2%-ной плотности массы и 8% NaOH на грамм целлюлозы.
После повторной промывки определяют число Каппа. Результаты приведены в таблице.
Пример 4. Ферментативное отбеливание сульфатной целлюлозы из хвойной древесины с применением N-гидрокси-4-цианоацетанилида.
5 г абсолютно сухой целлюлозы (хвойная древесина делигнифицирована кислородом), плотность массы 30% (около 17 г во влажном состоянии), добавляют к следующим растворам:
A) 20 мл водопроводной воды смешивают с 66 мг N-гидрокси-4-цианоацетанилида при перемешивании, pH устанавливают раствором H2SO4 (0,5 моль/л) так, что после добавления целлюлозы и фермента pH равен 4,5.
B) 5 мл водопроводной воды смешивают с таким количеством лакказы Trametes versicolor, что в результате получается активность 15 U (1 U = конверсия 1 мкмоль АБТС/мин/мл фермента) на грамм целлюлозы.
Растворы А и Б объединяют и доводят до 33 мл.
После добавления целлюлозы месят в течение 2 мин тестомесильным устройством.
Затем массу помещают в реакционную бомбу, предварительно нагретую до 45oC, и инкубируют под избыточным давлением кислорода 1-10 бар в течение 1-4 часов.
После этого массу промывают над нейлоновым ситом (30 мкм) и экстрагируют в течение 1 часа при 60oC, 2%-ной плотности массы и 8% NaOH на грамм целлюлозы.
После повторной промывки определяют число Каппа. Результаты приведены в таблице.
Пример 5. Ферментативное отбеливание сульфатной целлюлозы из хвойной древесины с применением фенилового эфира N-гидрокси-N-фенилкарбаминовой кислоты.
5 г абсолютно сухой целлюлозы (хвойная древесина делигнифицирована кислородом), плотность массы 30% (около 17 г во влажном состоянии), добавляют к следующим растворам:
A) 20 мл водопроводной воды смешивают с 86 мг фенилового эфира N-гидрокси-N-фенилкарбаминовой кислоты при перемешивании, pH устанавливают раствором H2SO4 (0,5 моль/л) так, что после добавления целлюлозы и фермента pH равен 4,5.
B) 5 мл водопроводной воды смешивают с таким количеством лакказы Trametes versicolor, что в результате получается активность 15 U (1 U = конверсия 1 мкмоль АБТС/мин/мл фермента) на грамм целлюлозы.
Растворы А и Б объединяют и доводят до 33 мл.
После добавления целлюлозы месят в течение 2 мин тестомесильным устройством.
Затем массу помещают в реакционную бомбу, предварительно нагретую до 45oC, и инкубируют под избыточным давлением кислорода 1-10 бар в течение 1-4 часов.
После этого массу промывают над нейлоновым ситом (30 мкм) и экстрагируют в течение 1 часа при 60oC, 2%-ной плотности массы и 8% NaOH на грамм целлюлозы.
После повторной промывки определяют число Каппа. Результаты приведены в таблице.
Пример 6. Ферментативное отбеливание сульфатной целлюлозы из хвойной древесины с применением N-гидрокси-N-фенилформамида.
5 г абсолютно сухой целлюлозы (хвойная древесина делигнифицирована кислородом), плотность массы 30% (около 17 г во влажном состоянии), добавляют к следующим растворам:
A) 20 мл водопроводной воды смешивают с 51,5 мг N-гидрокси-N-фенилформамида при перемешивании, pH устанавливают раствором H2SO4 (0,5 моль/л) так, что после добавления целлюлозы и фермента pH равен 4,5.
B) 5 мл водопроводной воды смешивают с таким количеством лакказы Trametes versicolor, что в результате получается активность 15 U (1 U = конверсия 1 мкмоль АБТС/мин/мл фермента) на грамм целлюлозы.
Растворы А и Б объединяют и доводят до 33 мл.
После добавления целлюлозы месят в течение 2 мин тестомесильным устройством.
Затем массу помещают в реакционную бомбу, предварительно нагретую до 45oC, и инкубируют под избыточным давлением кислорода 1-10 бар в течение 1-4 часов.
После этого массу промывают над нейлоновым ситом (30 мкм) и экстрагируют в течение 1 часа при 60oC, 2%-ной плотности массы и 8% NaOH на грамм целлюлозы.
После повторной промывки определяют число Каппа. Результаты приведены в таблице.
Пример 7. Ферментативное отбеливание сульфатной целлюлозы из хвойной древесины с применением амида N-гидрокси-N-фенилпивалиновой кислоты.
5 г абсолютно сухой целлюлозы (хвойная древесина делигнифицирована кислородом), плотность массы 30% (около 17 г во влажном состоянии), добавляют к следующим растворам:
A) 20 мл водопроводной воды смешивают с 72,5 мг амида N-гидрокси-N-фенилпивалиновой кислоты при перемешивании, pH устанавливают раствором H2SO4 (0,5 моль/л) так, что после добавления целлюлозы и фермента pH равен 4,5.
B) 5 мл водопроводной воды смешивают с таким количеством лакказы Trametes versicolor, что в результате получается активность 15 U (1 U = конверсия 1 мкмоль АБТС/мин/мл фермента) на грамм целлюлозы.
Растворы А и Б объединяют и доводят до 33 мл.
После добавления целлюлозы месят в течение 2 мин тестомесильным устройством.
Затем массу помещают в реакционную бомбу, предварительно нагретую до 45oC, и инкубируют под избыточным давлением кислорода 1-10 бар в течение 1-4 часов.
После этого массу промывают над нейлоновым ситом (30 мкм) и экстрагируют в течение 1 часа при 60oC, 2%-ной плотности массы и 8% NaOH на грамм целлюлозы.
После повторной промывки определяют число Каппа. Результаты приведены в таблице.
Пример 8. Ферментативное отбеливание сульфатной целлюлозы из хвойной древесины с применением 1-гидрокси-3,4-дигидрохинолин-2(1H)-она.
5 г абсолютно сухой целлюлозы (хвойная древесина делигнифицирована кислородом), плотность массы 30% (около 17 г во влажном состоянии), добавляют к следующим растворам:
A) 20 мл водопроводной воды смешивают с 61,2 мг 1-гидрокси-3,4-дигидрохинолин-2(1H)-она при перемешивании, pH устанавливают раствором H2SO4 (0,5 моль/л) так, что после добавления целлюлозы и фермента pH равен 4,5.
B) 5 мл водопроводной воды смешивают с таким количеством лакказы Trametes versicolor, что в результате получается активность 15 U (1 U = конверсия 1 мкмоль АБТС/мин/мл фермента) на грамм целлюлозы.
Растворы А и Б объединяют и доводят до 33 мл.
После добавления целлюлозы месят в течение 2 мин тестомесильным устройством.
Затем массу помещают в реакционную бомбу, предварительно нагретую до 45oC, и инкубируют под избыточным давлением кислорода 1-10 бар в течение 1-4 часов.
После этого массу промывают над нейлоновым ситом (30 мкм) и экстрагируют в течение 1 часа при 60oC, 2%-ной плотности массы и 8% NaOH на грамм целлюлозы.
После повторной промывки определяют число Каппа. Результаты приведены в таблице.
Пример 9. Ферментативное отбеливание сульфатной целлюлозы из хвойной древесины с применением N-гидрокси-(2-метил)-ацетанилида.
5 г абсолютно сухой целлюлозы (хвойная древесина делигнифицирована кислородом), плотность массы 30% (около 17 г во влажном состоянии), добавляют к следующим растворам:
A) 20 мл водопроводной воды смешивают с 60,1 мг N-гидрокси-(2-метил)-ацетанилидом при перемешивании, pH устанавливают раствором H2SO4 (0,5 моль/л) так, что после добавления целлюлозы и фермента pH равен 4,5.
B) 5 мл водопроводной воды смешивают с таким количеством лакказы Trametes versicolor, что в результате получается активность 15 U (1 U = конверсия 1 мкмоль АБТС/мин/мл фермента) на грамм целлюлозы.
Растворы А и Б объединяют и доводят до 33 мл.
После добавления целлюлозы месят в течение 2 мин тестомесильным устройством.
Затем массу помещают в реакционную бомбу, предварительно нагретую до 45oC, и инкубируют под избыточным давлением кислорода 1-10 бар в течение 1-4 часов.
После этого массу промывают над нейлоновым ситом (30 мкм) и экстрагируют в течение 1 часа при 60oC, 2%-ной плотности массы и 8% NaOH на грамм целлюлозы.
После повторной промывки определяют число Каппа. Результаты приведены в таблице.
Пример 10. Ферментативное отбеливание сульфатной целлюлозы из хвойной древесины с применением этилового эфира 4-(N-ацетилгидроксиламино)-бензойной кислоты.
5 г абсолютно сухой целлюлозы (хвойная древесина делигнифицирована кислородом), плотность массы 30% (около 17 г во влажном состоянии), добавляют к следующим растворам:
A) 20 мл водопроводной воды смешивают с 83,7 мг этилового эфира 4-(N-ацетилгидроксиламино)-бензойной кислоты при перемешивании, pH устанавливают раствором H2SO4 (0,5 моль/л) так, что после добавления целлюлозы и фермента pH равен 4,5.
B) 5 мл водопроводной воды смешивают с таким количеством лакказы Trametes versicolor, что в результате получается активность 15 U (1 U = конверсия 1 мкмоль АБТС/мин/мл фермента) на грамм целлюлозы.
Растворы А и Б объединяют и доводят до 33 мл.
После добавления целлюлозы месят в течение 2 мин тестомесильным устройством.
Затем массу помещают в реакционную бомбу, предварительно нагретую до 45oC, и инкубируют под избыточным давлением кислорода 1-10 бар в течение 1-4 часов.
После этого массу промывают над нейлоновым ситом (30 мкм) и экстрагируют в течение 1 часа при 60oC, 2%-ной плотности массы и 8% NaOH на грамм целлюлозы.
После повторной промывки определяют число Каппа. Результаты приведены в таблице.

Многокомпонентная система, способ и применение касаются изменения, разложения или отбеливания лигнина, лигнинсодержащих материалов. Многокомпонентная система для изменения, разложения или отбеливания лигнина, лигнинсодержащих материалов содержит по меньшей мере один катализатор окисления, по меньшей мере один подходящий окислитель и по меньшей мере один посредник, выбранный из группы N-арил-N-гидроксиамидов. Способ осуществляют путем смешивания водной суспензии лигнинсодержащего материала с вышеуказанными компонентами одновременно или в любой последовательности. N-арил-N-гидроксиамиды применяют в качестве посредника для изменения, разложения или отбеливания лигнина и лигнинсодержащих материалов. Изобретение позволяет улучшить экологию окружающей среды и повысить степень делигнификации лигнина. 3 с. и 6 з.п. ф-лы. 1 табл.


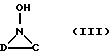
а также их солей, простых или сложных эфиров,
где А - одновалентный гомо- или гетероароматический одно- или двухядерный остаток;
D - двухвалентный гомо- или гетероароматический одно- или двухъядерный остаток,
причем эти ароматические соединения могут быть замещены одним или несколькими одинаковыми или различными остатками R1, выбранными из группы галоген, гидрокси, формил, циано, карбамоил, карбокси, сложный эфир или соль карбоксиостатка, сульфоно, сложный эфир или соль сульфоноостатка, сульфамоил, нитро, нитрозо, амино, фенил, арил-C1-C5-алкил, C1-C12-алкил, C1-C5-алкокси, C1-C10-карбонил, карбонил-C1-C6-алкил, фосфо, фосфоно, фосфоноокси, сложный эфир или соль фосфонооксиостатка, и причем карбамоил, сульфамоил, амино и фенил могут быть не замещены или однократно либо многократно замещены остатком R2, а арил-C1-C5-алкил, C1-C12-алкил, C1-C5-алкокси, C1-C10-карбонил,
карбонил-C1-C6-алкил могут быть насыщены или не насыщены, разветвлены или не разветвлены и однократно либо многократно замещены остатком R2, причем R2 одинаков или различен и означает гидрокси, формил, циано, карбокси, сложный эфир или соль карбоксиостатка, карбамоил, сульфоно, сульфамоил, нитро, нитрозо, амино, фенил, C1-C5-алкил, C1-C5-алкокси, C1-C5-алкилкарбонил и по два остатка R1 и R2 могут быть попарно связаны через мостик [-CR3R4-]m, где m = 0,1,2,3 или 4, R3 и R4 одинаковы или различны и обозначают карбокси, сложный эфир или соль карбоксиостатка, фенил, C1-C5-алкил, C1-C5-алкокси, C1-C5-алкилкарбонил и одна или несколько несоседних групп [-CR3R4-] могут быть заменены на кислород, серу или на замещенный в случае необходимости C1-C5-алкильным остатком иминоостаток, а две соседние группы [-CR3R4-] могут быть заменены на группу [-CR3 = R4-];
B - существующий в амидной форме одновалентный кислотный остаток кислот, выбранных из группы карбоновая кислота с числом C-атомов до 20, угольная кислота, полуэфир угольной кислоты или карбаминовой кислоты, сульфоновая кислота, фосфоновая кислота, фосфорная кислота, моноэфир фосфорной кислоты, диэфир фосфорной кислоты;
C - существующий в амидной форме двухвалентный кислотный остаток кислот, выбранных из группы моно- и дикарбоновая кислоты с числом C-атомов до 20, угольная кислота, сульфоновая кислота, фосфоновая кислота, фосфорная кислота, моноэфир фосфорной кислоты.
| Ветряный двигатель | 1925 |
|
SU3190A1 |
| DE 4008893 C2, 14.08.91 | |||
| Способ подсочки деревьев | 1929 |
|
SU20857A1 |
| Водогрейный аппарат | 1926 |
|
SU12620A1 |
| Способ крекирования нефти | 1926 |
|
SU12619A1 |
| Всасывающая коробка для засасывания воздуха, загрязненного пылью, газами, парами и проч. | 1926 |
|
SU12621A1 |
| Способ переработки газов,содержащий фтористый водород | 1969 |
|
SU345715A1 |
| АППАРАТ ДЛЯ УЛАВЛИВАНИЯ ЗАГРЯЗНЕНИЙ ИЗ ВЫБРОСНЫХ ПАРО-ГАЗОВЫХ СМЕСЕЙ Н. П. МАКСИМОВА | 1963 |
|
SU418201A1 |
| US 4830708 A, 16.05.89 | |||
| СПОСОБ ПОЛУЧЕНИЯ ЛИГНИНОЛИТИЧЕСКИХ ФЕРМЕНТОВ | 1992 |
|
RU2021371C1 |
| RU 94029671 A1, 20.06.96 | |||
| Способ получения беленой лигноцеллюлозной массы (его варианты) | 1991 |
|
SU1838488A3 |
| Способ отбелки сульфатной целлюлозы | 1988 |
|
SU1650835A1 |
Авторы
Даты
1999-05-20—Публикация
1997-08-12—Подача