Изобретение относится к технологии получения неорганических фторидов из кремнийфторидсодержащих газов и может найти применение в производстве фтористоводородной кислоты, фосфорных удобрений или в алюминиевой промышленности на стадии утилизации отходящих газов, имеющих в своем составе HF, SiF4 либо их смесь, при водной абсорбции которых образуется раствор HF, H2SiF6 либо их смесь.
Для решения проблемы извлечения фтора из фторидсодержащих и кремнийфторидсодержащих кислых растворов наиболее универсальным, материалоемким продуктом является Na2SiF6, у которого растворимость по F- в 4 раза ниже, чем у NaF при мольном соотношении Na:F = 1:3 в отличие от NaF, у которого мольное соотношение 1:1.
Однако при наличии смеси достаточно концентрированных кислот H2SiF6 и HF традиционным способом нейтрализации гидроокисью натрия либо содой нельзя выделить из раствора фтор и получить высококачественный продукт Na2SiF6 в одну стадию из-за образования смеси солей Na2SiF6 и NaF [1, с. 731-732] по реакциям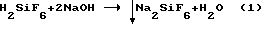
HF+NaOH _→ NaF+H2O (2)
и остаточного содержания NaF в маточном растворе до 48 г/л ввиду высокой его растворимости.
Избежать получения смеси солей можно либо при строгом выдерживании реагентов по реакции (1), в результате чего HF останется в маточном растворе, либо при содержании HF в смеси кислот HF и H2SiF6 не выше 1 М, в результате чего NaF в пределах его растворимости также останется в маточном растворе, либо при проведении реакции, известной из источников [1, с. 732]; [2, с. 179]: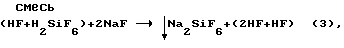
но в этом случае возникает сложная технологическая проблема фильтрации соли Na2SiF6 из маточного раствора плавиковой кислоты, а также проблема дальнейшей переработки маточных растворов низкоконцентрированной плавиковой кислоты.
Известен способ извлечения фтора из растворов [3, прототип] взаимодействием фтористого водорода с раствором метасиликата натрия по реакции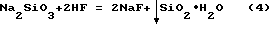
Недостатком данного способа является возможность выделения фтора только из разбавленных фторидных растворов, т.к. при достижении концентрации NaF в растворе более 48 г/л последний соосаждается совместно с выделяющейся в осадок двуокисью кремния.
Для извлечения соли NaF из полученного разбавленного раствора NaF на второй стадии процесса требуется значительный избыток Na2SiO3 в качестве высаливателя NaF. Степень извлечения NaF из растворов не превышает 66,6%.
Кроме того, этот способ неприемлем для использования его при переработке HF, содержащего примесь H2SiF6, т.к. при взаимодействии H2SiF6 и Na2SiO3 выпадает низкокачественная смесь: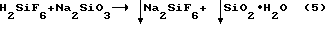
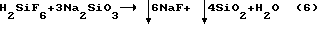
Задачей, решаемой изобретением, является извлечение в одну стадию фтора из фторидсодержащих растворов в виде высококачественной легкофильтрующейся соли Na2SiF6.
Решение поставленной задачи достигается тем, что в способе извлечения фтора из фторидсодержащих соединений путем обработки их метасиликатом натрия в качестве фторидсодержащих соединений используют раствор фтористоводородной кислоты и обработку ведут при мольном отношении метасиликата натрия к фтористоводородной кислоте, равном (1-1,2):6.
Пример 1.
При использовании в качестве фторидсодержащих соединений смеси раствора фтористоводородной кислоты с кремнефтористоводородной кислотой в раствор вводят фторид натрия в мольном отношении к кремнефтористоводородной кислоте, равном 2: 1, а затем метасиликат натрия и перемешивают в течение 2-6 часов при температуре 25-60oC.
Приливание метасиликата натрия к раствору фтористоводородной кислоты в количестве от стехиометрически необходимого до 20% избытка от мольного соотношения, соответствующего стехиометрическим коэффициентам 1:6 этих соединений в уравнении реакции, описывающей данный процесс: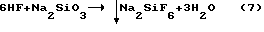
т. е. в мольном отношении Na2SiO3:HF = (1-1,2):6, обеспечивает нейтрализацию кислотного раствора до 4,5-6,9 pH, при котором в одну стадию достигается наиболее полное выделение фтора из раствора в виде соли Na2SiF6 практически при нейтральной среде маточного раствора, что значительно упрощает стадию фильтрации осадка Na2SiF6.
В то же время при обратной последовательности обработки одного реагента другим (как в прототипе) процесс взаимодействия метасиликата натрия с фтористоводородной кислотой при таком же мольном соотношении Na2SiO3:HF сопровождается сначала разложением Na2SiO3 на NaF и SiO2 по реакции (4), а затем, при достижении соотношения 1:6, получением смеси осадков SiO2 и Na2SiF6.
При наличии фтористоводородной кислоты в смеси с кремнефтористоводородной кислотой кремнефторид натрия и фтористоводородную кислоту получают добавлением фторида натрия к кремнефтористоводородной кислоте в мольном отношении 2:1 в соответствии с реакцией (3):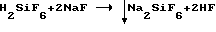
При этом фтористоводородная кислота, имеющаяся в смеси кислот, и фтористоводородная кислота, образовавшаяся в результате протекания реакции (3), остаются в маточном растворе. К полученной по реакции (3) пульпе добавляют, исходя из суммарного количества HF, раствор метасиликата натрия в количестве от стехиометрически необходимого при их мольном соотношении 1:6, соответствующем стехиометрическим коэффициентам этих соединений в уравнении реакции (7) до 20% избытка, т.е. в мольном отношении Na2SiO3:HF = (1-1,2):6.
В случае практически одновременного введения в раствор смеси кислот H2SiF6 и HF расчетного количества реагентов NaF и Na2SiO3 протекает в одну стадию суммарная реакция, включающая в себя одновременное протекание реакций (3) и (7):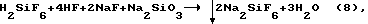
или в общем виде для всех возможных соотношений участвующих в реакции реагентов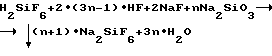
К заданному объему HF добавили при непрерывном перемешивании расчетный объем раствора Na2SiO3, избыток которого варьировали до 25% по отношению к стехиометрически необходимому по реакции (7).
Результаты опытов приведены в табл. 1.
Из результатов табл. 1 видно, что при расходе Na2SiO3 от стехиометрического до 20% избытка по отношению к мольному соотношению Na2SiO3:HF = 1:6 образуется высококачественный, с низким содержанием влаги, очень хорошо фильтрующийся Na2SiF6, тогда как при 25% избытке Na2SiO3 все свойства осадка резко ухудшаются, в том числе и фильтруемость, которая ухудшилась в 923 раза.
Анализ маточных растворов показывает, что наиболее эффективное извлечение F-иона из раствора HF достигается при введении 10-20% избытка Na2SiO3.
Пример 2.
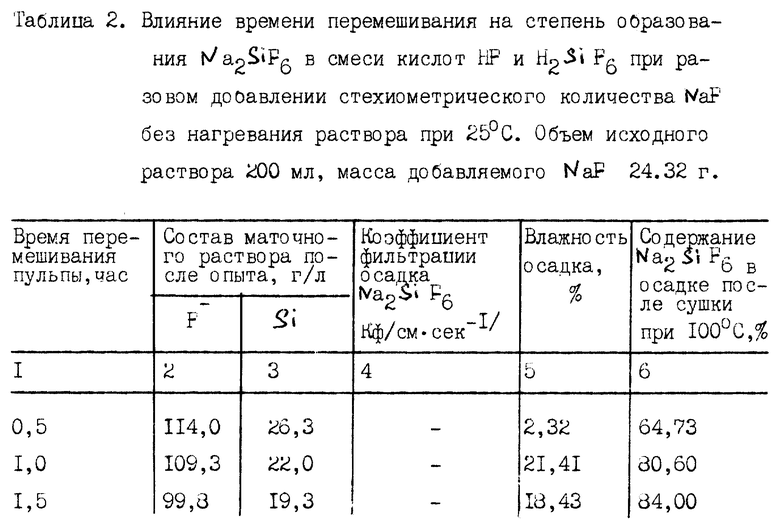
Пример 2 приведен с целью оптимизации времени перемешивания при протекании только реакции (3) без нагрева.
К раствору смеси кислот HF и H2SiF6 с содержанием фтора 128,25 г/л, Si 40,5 г/л добавляли стехиометрическое количество NaF в соответствии с реакцией (3). В каждом очередном опыте время перемешивания увеличивали. Результаты опытов приведены в табл. 2.
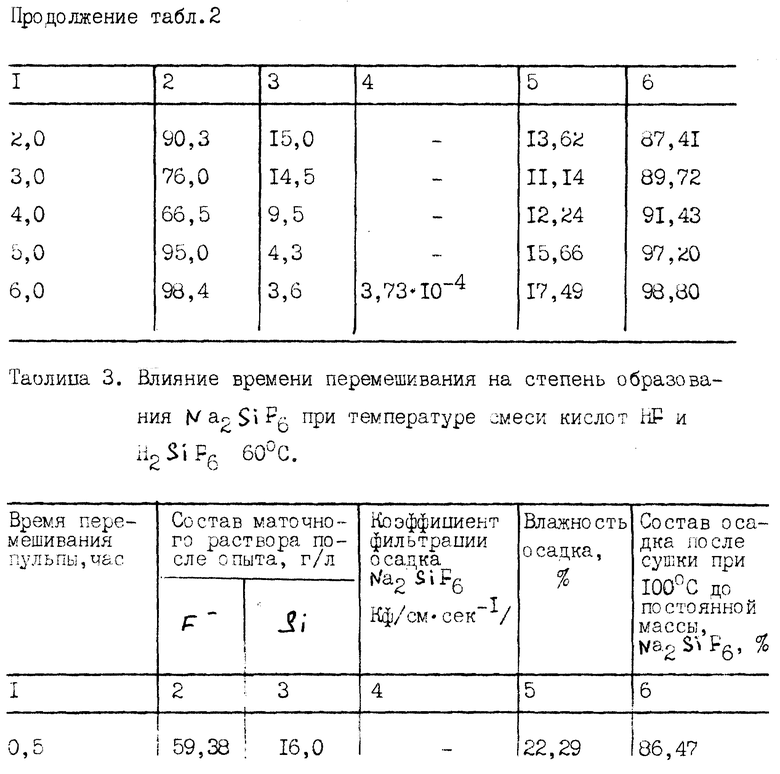
Из результатов в табл. 2 видно, что достаточно хороший результат по содержанию Na2SiF6 в полученном осадке и по остаточному содержанию кремния в маточном растворе фтористого водорода достигнут после 6 часов перемешивания пульпы без нагревания.
Пример 3.
Пример 3 приведен с целью оптимизации времени перемешивания раствора при протекании только реакции (3) с нагревом.
В данной серии опытов условия примера 2 сохранены, за исключением нагрева раствора до 60oC. Результаты приведены в табл. 3.
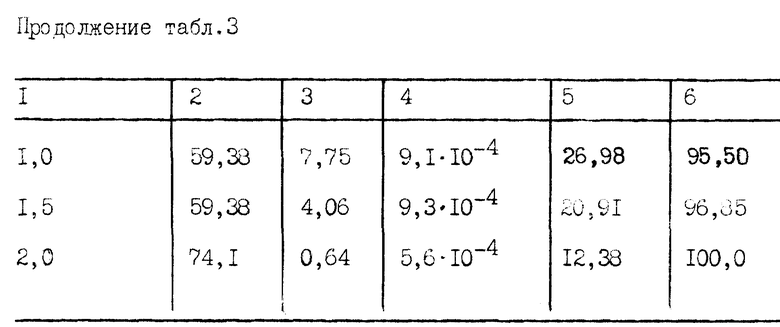
Из результатов табл. 3 видно, что благодаря повышению температуры смеси кислот до 60oC в течение 2 часов перемешивания достигнуты высокая степень образования Na2SiF6 и минимальное количество Si в маточном растворе фтористоводородной кислоты.
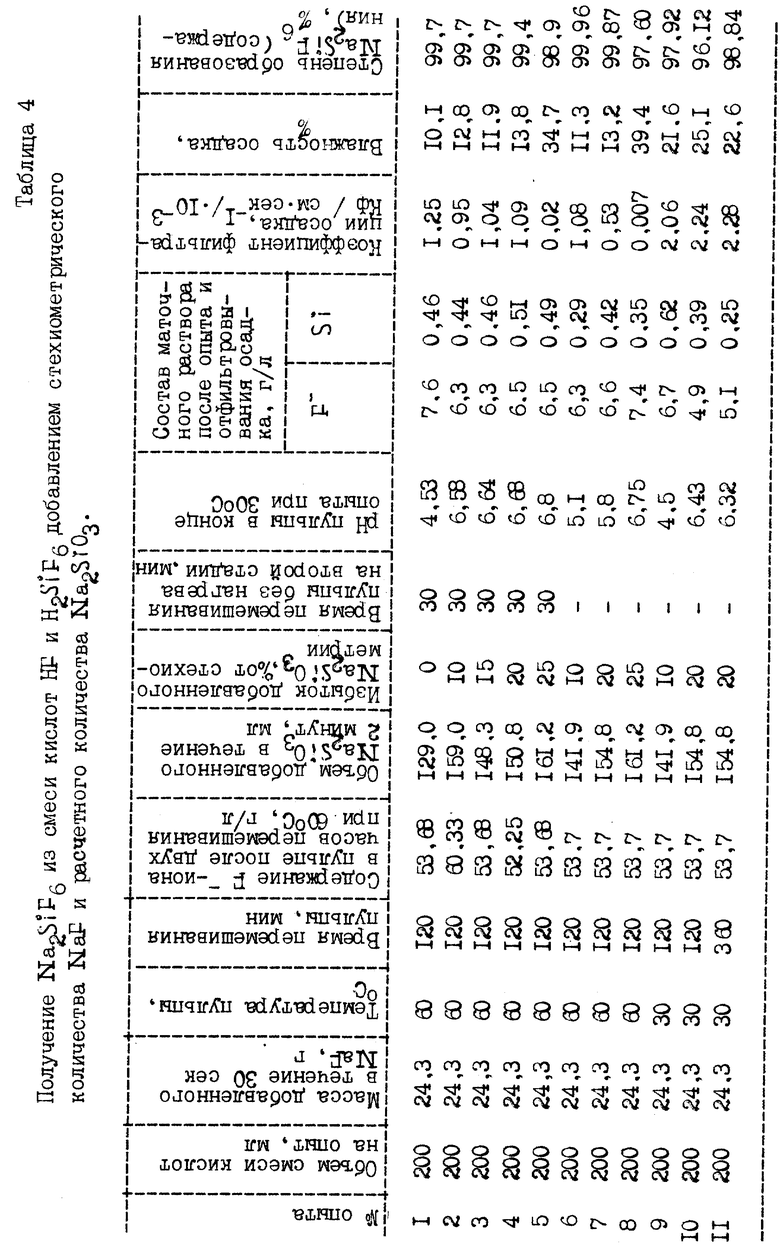
Пример 4 приведен с целью оптимизации процесса получения Na2SiF6 из смеси кислот HF и H2SiF6 при двустадийном и одностадийном проведении реакций (3) и (7). Извлечение фтора из раствора в первых пяти опытах, приведенных в табл. 4, осуществляли в две стадии, для чего в нагретую до 60oC смесь кислот добавляли стехиометрическое количество NaF по отношению к имеющейся в растворе H2SiF6 в соответствии с реакцией (3):
H2SiF6 + 2NaF = Na2SiO3 + 2HF
и перемешивали при данной температуре в течение 2 часов (оптимальная температура и время перемешивания определены опытами примеров 2, 3). Через 2 часа нагрев прекращали, анализировали маточный раствор на содержание F-иона и добавляли в пульпу при перемешивании, но без нагрева, расчетное количество Na2SiO3 с соответствующим избытком по отношению к стехиометрии по реакции (7)
6HF+Na2SiO3_→ Na2SiF6+3H2O
После 30 минут перемешивания процесс прекращали, замеряли величину pH при 30oC, осадок отфильтровали и анализировали состав маточного раствора и осадка.
Для проверки возможности проведения процесса извлечения F-иона из смеси кислот HF и H2SiF6 не в две, а в одну стадию, объединяющую протекание реакций (3) и (7) и описываемую суммарным уравнением реакции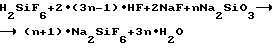
в опытах 6 - 8 в нагретую до 60oC смесь кислот добавляли стехиометрическое количество NaF по отношению к имеющейся H2SiF6 в растворе и сразу же приливали расчетное количество Na2SiO3 по отношению к HF, которая должна образоваться в результате реакции (3), после чего пульпу перемешивали при 60oC 2 часа, затем фильтровали и анализировали состав маточного раствора и полученной соли Na2SiF6, а в опытах 9-11 условия проведения были те же, что и в опытах 6-8, за исключением того, что на протяжении всего опыта нагрев не проводился.
Результаты опытов 1-11 из примера 4 приведены в таблице 4.
Из результатов опытов 1-4 табл. 4 видно, что при проведении двустадийного процесса и введении избытка Na2SiO3 до 20% получена высококачественная, с низким содержанием влаги, очень хорошо фильтруемая соль Na2SiF6, а уже в опыте 5 при введении 25% избытка Na2SiO3 от стехиометрии по реакции (7) получена недостаточного качества, с высоким содержанием влаги, очень плохо фильтруемая соль Na2SiF6 (в 60 раз хуже, чем в опытах 1-4).
Из результатов опытов 6-7, проведенных в одну стадию по реакции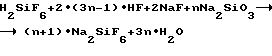
при одновременном введении NaF и Na2SiO3 в нагретую до 60oC смесь кислот HF и H2SiF6, видно, что в опыте 6 при введении 10% избытка Na2SiO3 получена самая высококачественная, легкофильтруемая, с низким содержанием влаги, соль Na2SiF6 при самом низком остаточном содержании Si в маточном растворе, тогда как в опыте 8 при 25% избытка Na2SiO3 получена очень плохо фильтруемая (в 76 раз худе предыдущего опыта), с высоким содержанием влаги, недостаточно качественная соль Na2SiF6.
Из результатов опытов 9-11 видно, что при проведении одностадийного процесса при 25oC (без нагрева раствора) и перемешивании в течение 6 часов получена хорошо фильтруемая, но с повышенным содержанием влаги и менее качественная соль Na2SiF6, хотя и соответствующая 1 сорту по ГОСТ 87-77 на натрий кремнефтористый технический.
Приведенные примеры подтверждают достижение поставленной цели - получения в одну стадию высококачественной легкофильтруемой соли Na2SiF6 как при обработке HF раствором Na2SiO3, так и при обработке смеси кислот HF и H2SiF6 стехиометрическим количеством фторида натрия в мольном соотношении H2SiF6 : NaF = 1:2 и раствором метасиликата натрия при расходе от стехиометрического до 20% избытка от мольного соотношения Na2SiO3 : HF = 1:6 при непрерывном перемешивании пульпы в течение 2-6 часов в зависимости от температуры в пределах 25-60oC. Более высокая температура нецелесообразна из-за повышенного испарения HF. Перемешивание менее двух часов не обеспечивает в полной мере достижения поставленной цели.
Количество добавляемого метасиликата натрия при проведении процесса получения Na2SiF6 как из HF (пример 1), так и из смеси HF и H2SiF6 (пример 4) может контролироваться не только исходя из расчетных данных по результатам анализа компонентов в растворе, но и по конечной величине pH пульпы, которая изменяется в пределах 4,5-6,90 pH в зависимости от конкретных условий проведения опыта, в том числе от температуры раствора, избытка Na2SiO6 и является строго определенной величиной для конкретного опыта.
Получаемая высококачественная соль Na2SiF6 может быть использована в качестве исходного продукта для получения Na3AlF6, NaF и белой сажи (SiO2), синтетического флюорита, а также в качестве инсектицида, антисептика древесины и т.п.
Литература
1. М.Е. Позин. Технология минеральных солей, М., Госхимиздат, 1961.
2. В. А. Зайцев и др. Производство фтористых соединений при переработке фосфатного сырья, М., Химия, 1982.
3. АС СССР 472900, кл. C 01 D 3/02, 1975 (прототип).
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ КРЕМНЕФТОРИДА НАТРИЯ | 2002 |
|
RU2226502C1 |
| СПОСОБ ПОЛУЧЕНИЯ ФТОРИДА НАТРИЯ ИЗ КРЕМНЕФТОРИСТЫХ СОЕДИНЕНИЙ | 2000 |
|
RU2175639C1 |
| СПОСОБ ПОЛУЧЕНИЯ ДИОКСИДА КРЕМНИЯ | 2000 |
|
RU2179951C1 |
| СПОСОБ ПОЛУЧЕНИЯ ВЫСОКОДИСПЕРСНОГО ДИОКСИДА КРЕМНИЯ | 2013 |
|
RU2564361C2 |
| СПОСОБ ПОЛУЧЕНИЯ СИНТЕТИЧЕСКОГО ФЛЮОРИТА | 2011 |
|
RU2465206C1 |
| СПОСОБ ПОЛУЧЕНИЯ КРЕМНЕФТОРИДА НАТРИЯ | 2012 |
|
RU2492142C1 |
| СПОСОБ ПОЛУЧЕНИЯ СИНТЕТИЧЕСКОГО ФЛЮОРИТА | 2011 |
|
RU2472705C1 |
| СПОСОБ ПОЛУЧЕНИЯ ФТОРИДОВ НАТРИЯ | 2001 |
|
RU2219124C2 |
| СПОСОБ СИНТЕЗА НЕОРГАНИЧЕСКИХ ФТОРСОДЕРЖАЩИХ СОЕДИНЕНИЙ | 2004 |
|
RU2278073C1 |
| СПОСОБ ПОЛУЧЕНИЯ КРЕМНЕФТОРИДА НАТРИЯ | 2009 |
|
RU2411183C1 |
Изобретение предназначено для получения неорганических фторидов. Способ заключается в том, что раствор фтористоводородной кислоты обрабатывают метасиликатом в мольном отношении метасиликата натрия к фтористоводородной кислоте, равном (1-1,2):6. При использовании смеси раствора фтористоводородной кислоты с кремнефтористоводородной кислотой в раствор вводят фторид натрия в мольном отношении к кремнефтористоводородной кислоте, равном 2:1, а затем метасиликат натрия и перемешивают в течение 2-6 ч при температуре 25-60°С. Изобретение позволяет извлечь фтор из фторидсодержащих соединений в виде высококачественной легкофильтрующей соли Na2SiF6. 1 з.п.ф-лы, 4 табл.
| Способ получения фтористого натрия | 1972 |
|
SU472900A1 |
| Способ извлечения фтора из отходящих газов | 1980 |
|
SU899465A1 |
| СПОСОБ ПОЛУЧЕНИЯ КРЕМНЕФТОРИСТЫХ СОЛЕЙ | 1991 |
|
RU2024429C1 |
| СПОСОБ УДАЛЕНИЯ ФТОРА ИЗ ФТОРСОДЕРЖАЩИХ РАСТВОРОВ | 1992 |
|
RU2042626C1 |
| НАДВОДНОЕ ТРАНСПОРТНО-ПУСКОВОЕ УСТРОЙСТВО "КАСАТКА" | 2005 |
|
RU2303762C1 |
| Устройство для селективного сбора пыльцы и искусственного опыления растений | 1988 |
|
SU1667748A1 |
| Поворотно-делительное устройство | 1985 |
|
SU1288023A1 |
| US 4057614 А, 08.11.1977 | |||
| СПОСОБ РАСПРЕДЕЛЕНИЯ АГЕНТА СУШКИ И УСТРОЙСТВО ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 2010 |
|
RU2443954C1 |
| ПОЗИН М.Е | |||
| Технология минеральных солей | |||
| - М: Госхимиздат, 1961, с | |||
| ПРИБОР ДЛЯ СОЖИГАНИЯ НЕФТИ | 1922 |
|
SU731A1 |
| и др | |||
| Производство фтористых соединений при переработке фосфатного сырья | |||
| - М.: Химия, 1982, с.179-181. | |||
Авторы
Даты
2000-09-10—Публикация
1998-06-01—Подача