Изобретение относится к области медицины и пригодно для лечения эпилепсии, невралгии тройничного нерва, несахарного диабета (в составе комбинированной терапии) и профилактики фазнопротекающих аффективных нарушений (маниакально-депрессивный психоз и другие психотические расстройства).
Одним из важнейших лекарственных средств, действующих на центральную нервную систему, является карбамазепин (химическое название - 5-карбамоил-5Н-дибенз[b, f] азепин) [Машковский М.Д. Лекарственные средства, т.1, изд. 12-е, М.,1993, с.44]. Выраженная антиконвульсивная активность карбамазепина удачно сочетается с наличием в его спектре антидепрессивных (тимолептических) и нормотимических психотропных свойств. Соединение снижает частоту и интенсивность эпилептических припадков и оказывает анальгетический эффект при невралгии тройничного нерва. Точный механизм действия карбамазепина не установлен. Полагают, что основное значение имеет блокада натриевых каналов, что приводит к стабилизации мембран, а также угнетению метаболизма катехоламинов и выделения глутамата. Снижение выделения глутамата и стабилизация мембран, возможно, обеспечивают противосудорожный эффект, а угнетение метаболизма катехоламинов - эффект при маниях.
Известна оральная лекарственная форма на основе карбамазепина, включающая ядро и оболочку, в которой имеется отверстие, соединяющее ядро с окружающей средой (патент ФРГ N3725824, 1988 г). Она содержит, мас.%:
Ядро
Карбамазепин - 40,8
Микрокристаллическая целлюлоза - 4,1
Оксипропилметилцеллюлоза - 2,6
Сополимер винилпирролидона и винилацетата 60:40 (Kollidon VA64) - 16,3
Полиэтиленгликоль (м.в. 5•106) - 16,3
Хлорид натрия - 16,3
Лаурилсульфат натрия - 1,2
Стеарат магния - 2,4
Всего 100,0
Оболочка
Ацетат целлюлозы (32,0) - 40,0
Ацетат целлюлозы (39,9) - 50,0
Полиэтиленгликоль 4000 - 10,0
Всего - 100,0
К недостаткам данного состава следует отнести достаточно сложную технологию его получения и необходимость использования тонкоизмельченного карбамазепина.
В патенте Швейцарии N 649080, 1985 г, описано следующее лекарственное средство, выбранное в качестве прототипа, мас.%:
Карбамазепин - 34,5
Лактоза - 34,5
Крахмал - 24,3
Желатин - 0,5
Тальк - 4,1
Стеарат магния - 0,7
Диоксид кремния - 1,4
Активный ингредиент смешивают с лактозой и частью крахмала (83% от суммарного количества крахмала в составе), смесь увлажняют этанольным раствором желатина, гранулируют и сушат. Сухие гранулы опудривают смесью оставшегося крахмала, талька, стеарата магния и диоксида кремния и полученную таблеточную массу прессуют в таблетки.
Однако указанный состав имеет относительно низкое содержание действующего вещества (35%). Кроме того, присутствие в составе талька в концентрации, превышающей разрешенную ГФ XI (не более 3%), дополнительно усиливает раздражающее действие карбамазепина на слизистую оболочку желудочно-кишечного тракта и может значительно увеличить вероятность побочных эффектов (тошнота, боли и дискомфорт в области желудка).
Известно, что карбамазепин практически полностью абсорбируется из желудочно-кишечного тракта, но очень медленно и вариабельно. Это наряду с высокой степенью его метаболизма в печени существенно отодвигает начало действия препарата после приема внутрь и снижает его биодоступность. Поэтому для улучшения биодоступности карбамазепина необходимо обеспечить быстрое высвобождение активного ингредиента из лекарственной формы.
Задача данного изобретения заключается в разработке фармацевтического состава противосудорожного и психотропного действия, который соответствует фармакопейным требованиям, стабилен при хранении и быстро высвобождает действующее вещество, а также простого и удобного способа получения лекарственной формы.
Поставленная цель достигается тем, что предлагаемое средство содержит в качестве активного начала карбамазепин и в качестве целевых добавок - аэросил, крахмал, глицерин, желатин, стеариновую кислоту и/или ее соли.
Оптимальное соотношение ингредиентов составляет, мас.%:
Карбамазепин - 61,0-82,0
Аэросил - 1,0-10,0
Глицерин - 0,1-3,0
Желатин - 0,6-5,0
Крахмал - 10,0-27,8
Стеариновая кислота и/или ее соли - 0,5-3,0
Заявляемое соотношение ингредиентов найдено экспериментально и обеспечивает необходимое качество состава.
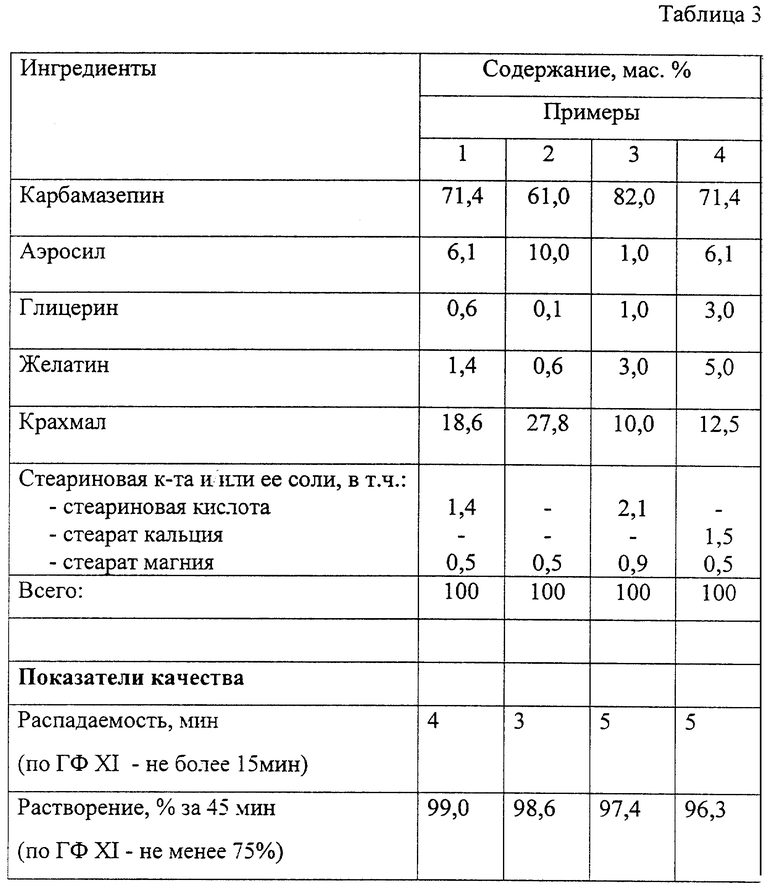
Совместное применение в композиции аэросила, крахмала, глицерина и желатина в указанных пропорциях дает возможность повысить содержание карбамазепина в лекарственной форме свыше 60% и обеспечивает при удовлетворительной прочности таблетки высокую скорость высвобождения действующего вещества. Так, распадаемость таблеток составляет 3-5 мин и при их растворении через 45 мин в среду растворения переходит 96-99% активного ингредиента (по ГФ XI - не менее 75%). Введение в состав в качестве опудривающих веществ стеариновой кислоты и/или ее солей позволяет добиться сыпучести гранулята, необходимой для нормального проведения процесса таблетирования. Предпочтительно использовать смесь стеариновокислого магния и стеариновой кислоты или стеариновокислого кальция.
Предлагаемая фармацевтическая композиция выполняется в виде твердой лекарственной формы, предпочтительно в форме таблеток, что позволяет обеспечить максимальную технологичность последующей фасовки и точность дозирования активного вещества.
Способ получения новой композиции включает смешение просеянных порошков карбамазепина, аэросила и крахмала с водным раствором желатина, в который добавлен глицерин, влажное гранулирование, сушку, сухую грануляцию и опудривание. Применение вместо используемого в прототипе этанольного раствора желатина раствора желатина и глицерина в воде, не ухудшая показатели распадаемости и растворения предлагаемого состава, существенно увеличивает прочность получаемых таблеток, что уменьшает их отбраковку в процессе фасовки. Проведение после сушки сухой грануляции дополнительно повышает прочность таблеток (до 9-10 кг). Концентрация желатина в увлажняющей жидкости составляет 1-5% и глицерина - 0,15-3,0%. Опудривание гранулята производят стеариновой кислотой, ее солями или их смесью, предпочтительно смесью стеариновокислого магния и стеариновой кислоты или стеариновокислого кальция в массовом соотношении 1: (2,3-3,0). Для придания предлагаемому средству формы таблетки полученный после опудривания состав прессуют на таблеточной машине.
Полученный фармацевтический состав соответствует фармакопейным требованиям (по внешнему виду, распадаемости, растворению и другим показателям), стабилен при хранении и имеет срок годности более 2 лет.
Была изучена относительная биодоступность заявляемого средства по сравнению с известным препаратом на основе карбамазепина. Исследования проводили на кроликах - самцах породы шиншилла после однократного введения препаратов per os в дозе 100 мг/кг. Найдено, что относительная биодоступность нового состава по сравнению с известным составляет 109%, при этом концентрация карбамазепина в крови через 1 час после введения эквивалентных доз препаратов была у предлагаемого состава на 15% больше, чем у известного.
Специфическая противосудорожная активность была изучена в тесте максимального электрошока, который является моделью большого эпилептического припадка. Эксперименты проводили на мышах-самцах массой 22-24 г. Контрольная и опытные группы включали по 8 животных. Электроды закреплялись на глазных яблоках (параметры тока 50 мА, 0,2 сек, 50 Гц). Припадок развивается с определенной последовательностью фаз: клонической, тонической, тонико-экстензорной. Активность определяется по количеству животных в группе, у которых не развивается тонико-экстензорная фаза (ТЭФ). Исследуемые препараты вводили per os; противосудорожное действие оценивали через 60 минут после введения (таблица 1).
При сравнительном изучении предлагаемого средства и известного показано, что заявленный состав проявляет существенное противосудорожное действие, вызывая блокаду тонико-экстензорной фазы (ТЭФ) у 37,5% животных при введении в дозе 15 мг/кг, и у 87,5% - в дозе 30 мг/кг. Известный состав с карбамазепином в дозе 15 мг/кг блокирует ТЭФ у 25%, и в дозе 30 мг/кг - у 75% животных.
Клинические исследования по изучению эффективности предлагаемого средства были проведены на больных специализированного (эпилептического) стационара Московского НИИ психиатрии МЗ РФ, госпитализированных в связи с учащением эпилептических припадков, декомпенсацией состояния, а также для целей коррекции терапии при фармакорезистентных формах болезни. Отбор больных производился на основе современных диагностических признаков (классификация эпилепсии и эпилептических припадков по МКБ - 10). Верификация диагноза осуществлялась с использованием клинико-неврологического, клинико-психопатологического, ЭЭГ-исследования, а также нейроофтальмологического и экспериментально-психологического обследования больных. Методика исследования предлагаемого средства включала два варианта:
А) Первичное назначение препарата в соответствии с клиническими показаниями больным, ранее не получавшим карбамазепина и его аналогов. При этом политерапия являлась основным методом лечения, в связи с фармакорезистентными формами течения эпилепсии. Использование предлагаемого средства в форме монотерапии представлено единичными наблюдениями.
Б) Замена ранее используемого в терапевтической схеме аналога на предлагаемое средство в эквивалентных дозах при неизменности как всех компонентов схемы, так и их дозировок в течение всего периода исследования.
Препарат назначался с 200 мг в сутки на один прием или по 100 мг 2 раза в сутки. Дальнейшее повышение доз носило ступенчатый характер и определялось с учетом клинического эффекта. Максимальная доза не превышала 800-1200 мг в сутки. Курс лечения составил 1 месяц, последующее наблюдение 1-3 месяца. У каждого пациента перед началом лечения, а также на 7, 14 и 30 дни терапии проводилась оценка физического, неврологического и психического состояния. ЭЭГ исследование, общий анализ крови и мочи оценивались до начала и в конце лечения.
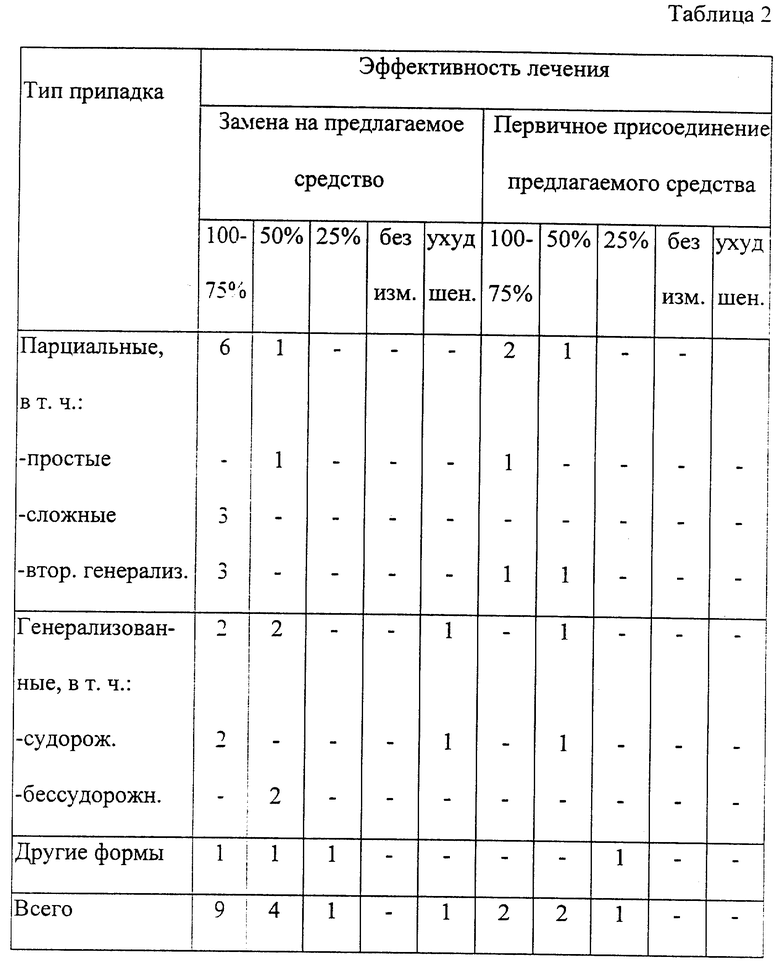
Анализу подвергнуто 20 пациентов, страдающих эпилепсией. Среди них было 12 женщин (60%) и 8 мужчин (40%), средний возраст пациентов составил 30,1 лет. У 16 пациентов (80%) диагностирована симптоматическая эпилепсия, в том числе у 11 (55%) - фокальная (преимущественно со сложными парциальными припадками), и у 5 (25%) - генерализованная с полиморфными (судорожными и бессудорожными) припадками. У 7 пациентов имело место сочетание фокальных и генерализованных форм припадков (в том числе первично и вторично генерализованная эпилепсия). Эпилептические припадки вследствие остаточных явлений органического заболевания мозга имели место у 4 человек, в возрасте от 21 до 30 лет, включенных в исследование (20%). По структурно-динамическим характеристикам болезни они соответствовали пациентам с симптоматической эпилепсией. Частота припадков составляла у 8 больных от 2-4 в неделю до 2-3 в день, у 7 больных не реже 1 раза в 1-2 недели и у 5 больных не реже 2 раз в месяц. По давности болезни обследованные пациенты распределились следующим образом: до 5 лет - 3 больных, от 5 до 10 лет - 10 больных, от 10 до 15 лет - 5 больных и более 15 лет - 2 больных. Указанная давность болезни и частота припадков свидетельствует о значительной тяжести течения болезни у обследованных больных.
В соответствии с общепринятыми в эпилептологии критериями клинической эффективности противоэпилептических препаратов оценка результатов лечения проводилась исходя из уровня достигнутого купирования или реакции припадков, при этом за 100% эффект принималось полное купирование припадков, при сокращении числа припадков на 75% эффект также оценивался как достаточно высокий. Результаты, отражающие урежение припадков на 50% или ниже - оценивались как частичная редукция. Кроме того, принималось во внимание отсутствие эффекта и ухудшение состояния.
На основе анализа полученных данных были получены результаты, представленные в таблице 2. Как видно из таблицы 2, в группе больных, где была проведена эквивалентная замена препарата, достигнуты наиболее высокие результаты и при сложных парциальных припадках и парциальных припадках с вторичной генерализацией, а также при генерализованных судорожных и др. (9 больных), что составляет в анализируемой группе 60% высокой эффективности. У 4 больных этой группы улучшение проявилось в форме 50% редукции припадков, что составило 26,7%. Среди пациентов, у которых предлагаемое средство применялось как впервые назначенное антиэпилептическое средство, полное купирование припадков имело место у 2 больных (40%), снижение их числа вдвое также у 2 пациентов (40%) и частичная редукция у одного пациента (20%).
Таким образом, предлагаемое средство в условиях проведенного клинического испытания обнаружило достаточно высокую эффективность. Купирование припадков на 100-75% имело место у 11 больных и сокращение их числа на 50% - у 6 пациентов, т.е. полное купирование припадков и их значительное сокращение достигнуто у 17 больных (85%). В ходе исследования была также установлена хорошая переносимость заявленного средства.
Изобретение иллюстрируется следующими примерами:
Пример 1. Смесь просеянных порошков карбамазепина (100,0 г), аэросила (8,5 г), сухого картофельного крахмала (26,0 г) увлажняют 133,4 г 1,5% водного раствора желатина, в который добавляют 0,8 г глицерина, перемешивают до равномерного распределения влаги. Влажную пасту гранулируют и сушат в псевдоожиженном слое до остаточной влажности 2%. Сухие гранулы размалывают, опудривают смесью из 1,94 г стеариновой кислоты и 0,68 г стеариновокислого магния и таблетируют. Получают 131,6 г таблеток карбамазепина со средней массой 0,28 г, которые соответствуют требованиям на фармацевтическое средство.
Примеры 2 - 4 выполняют аналогично. Содержание ингредиентов и показатели качества представлены в таблице 3. Полученные таблетки удовлетворяют требованиям на фармацевтическое средство.

Изобретение относится к области медицины, в частности к составу и способу получения противосудорожного и психотропного средства. Средство выполняют в виде твердой лекарственной формы, которая содержит аэросил, глицерин, желатин, крахмал, стеариновую кислоту и/или ее соли в определенном соотношении. Получают фармацевтический состав путем увлажнения смеси действующего вещества с наполнителями водным раствором желатина и глицерина, гранулирования, сушки, сухого гранулирования и таблетирования. Состав соответствует требованиям на фармацевтическое средство, стабилен при хранении и быстро высвобождает действующее вещество. 2 с. и 4 з.п.ф-лы, 3 табл.
Карбамазепин - 61,0 - 82,0
Аэросил - 1,0 - 10,0
Глицерин - 0,1 - 3,0
Желатин - 0,6 - 5,0
Крахмал - 10,0 - 27,8
Стеариновая кислота и/или ее соли - 0,5 - 3,0
2. Противосудорожное и психотропное средство по п.1, отличающееся тем, что оно выполнено в форме таблетки.
| Способ получения 10-циан-5н-ди-бЕНз-/ /АзЕпиН-5-КАРбОКСи-АМидА | 1979 |
|
SU828963A3 |
| DE 3813015 A1, 02.11.1989 | |||
| US 5466683 A, 14.11.1995 | |||
| DE 4211883 C1, 04.03.1993 | |||
| Экономайзер | 0 |
|
SU94A1 |
| ЙС4?СОЮЗНАГ! IfiAkHIriO-TEXHI^HEGHAF | 0 |
|
SU400609A1 |
Авторы
Даты
2000-10-10—Публикация
1999-10-28—Подача