Заявляемое соединение относится к области органической химии к классу 1,2,3,4-тетрагидроакридинов, а именно к 9-бензилиденгидразино-1,2,3,4-тетрагидроакридину формулы: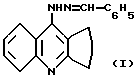
обладающему анальгетической и антимикробной активностью в отношении Staph. aureus, что позволяет предполагать возможность его применения в медицине в качестве анальгетического и противомикробного лекарственного средства.
Среди 9-гидразино-1,2,3,4-тетрагидроакридинов известны 9-(м-толуилгидразино) и 9-(n-нитробензоилгидразино)-1,2,3,4- тетрагидроакридина формулы: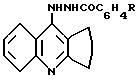
II: R = CH3 - м
III: R=NO2 - p,
проявляющие противовоспалительную активность. Анальгетическую и антимикробную активность эти соединения не проявляют. Известны и применяются в лечебной практике ортофен и фурацилин, которые взяты нами в качестве эталонов сравнения анальгетической и противомикробной активности (Машковский М. Д. Лекарственные средства. - М.: Медицина, 1993. - Т. 1. - С. 198; Т.2. - С. 358).
Цель изобретения - синтез нового производного 9-гидразино-1,2,3,4-тетрагидроакридина, проявляющего анальгетическое и противомикробное действие.
Поставленная цель достигается 9-бензилиденгидразино-1,2,3,4-тетрагидроакридином (I). Соединение формулы 1 получают при взаимодействии 9-хлор-1,2,3,4-тетрагидроакридина с гидразингидратом в растворе бутанола. Полученный гидрохлорид 9-гидразино-1,2,3,4-тетрагидроакридина вовлекают в реакцию с бензальдегидом в среде этанола. Полученную хлороводородную соль 9-бензилиденгидразино-1,2,3,4-тетрагидроакридина переводят в основание путем обработки 10%-ным раствором гидрокарбоната натрия.
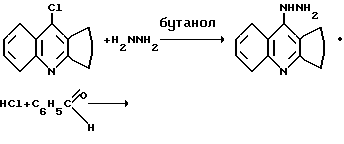
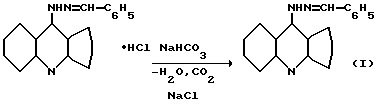
Соединение I - желтые игольчатые кристаллы, растворимое в этаноле, бутаноле, диметилформамиде, растворимое в неорганических кислотах, устойчивое на воздухе.
Пример 1 получения гидрохлорида 9-бензилиденгидразино-1,2,3,4-тетрагидроакридина.
К раствору 6,6 г (0,03 моль) 9-хлор-1,2,3,4-тетрагидроакридина в 50 мл бутилового спирта прибавляют 1,6 г (0,05 моль) гидразингидрата, нагревают 4 часа при температуре кипения бутанола. Выделившийся из горячей реакционной смеси продукт отфильтровывают и промывают в 50 мл кипящего бутанола. Выход 5,5 г (72%), Тпл. 277-278oC (разл.). Найдено,%: N 16,92; Cl 13,97. C13H16ClN3. Вычислено, %: N 16,83; Cl 14,20.
Пример 2 получения 9-бензилиденидразино-1,2,3,4-тетрагидроакридина (I).
2,4 г (0,01 моль) гидрохлорида 9-бензилиденгидразино-1,2,3,4-тетрагидроакридина в 50 мл этанола смешивают с 1,1 г (0,01 моль) бензальдегида и кипятят в течение 3 часа. Реакционную массу охлаждают, разбавляют водой и нейтрализуют 10%-ным раствором натрия гидрокарбоната. Выпавший осадок отфильтровывают и перекристаллизовывают дважды из водного этанола. Выход 2,25 г (75%), Тпл. 83-84oC. Найдено, %: C 79,54: H 6,12; N 14,00. C20H19N3. Вычислено, %: C 79,72: H 6,31; N 13,94.
В ИК-спектре соединения I, снятом в вазелиновом масле, наблюдается полоса поглощения вторичной аминогруппы в области 3310 см-1.
Спектр ПМР соединения I содержит сигналы протонов метиленовых групп при 1,80, 2,86, мультиплет с центром 7,66 (H ароматических колец и групп =CH-) и уширенный синглет при 8,66 (H группы NH).
Острую токсичность (ЛД50, мг/кг) соединения I определяли по В.Б. Прозоровскому при внутрибрюшинном введении белым мышам массой 16-20 г в виде взвеси в 2%-ной крахмальной слизи (Фармакол и токсикол.// 1978. - N 4.- С. 497-502).
Анальгетическая активность соединения.
Анальгетическое действие соединения I изучали в соответствии с Методическими указаниями по экспериментальному доклиническому изучению нестероидных противовоспалительных средств, одобренных фармакологическим комитетом МЗ СССР (протокол N 22 от 11.11.82).
Опыты проводили на беспородных белых мышах массой 16-22 г. Внутрибрюшинно мышам вводили 3%-ный раствор уксусной кислоты из расчета 300 мг/кг. У животных возникают "корчи". Реакцию у животных на введение уксусной кислоты учитывали в течение первых 20 минут после введения раздражителя. Исследуемое соединение вводили в дозе 1/10 ЛД50 за 30 минут до уксусной кислоты. Его эффективность оценивали по способности уменьшать количества "корчей" и выражали торможение "корчей" в % к контролю.
Для определения бактериостатической активности исследуемое вещество I растворяли в этиловом спирте 1:100 и разводили мясопептонным бульоном (МПБ) до соотношения 1: 500. Бактериостатическую активность изучали методом последовательных разведений полученного раствора МПБ по отношению к эталонным штаммам золотистого стафилококка и кишечной палочки. При этом использовали смыв суточной культуры стерильным физиологическим раствором хлорида натрия и готовили исходное разведение с концентрацией 500 млн. микробных тел в 1 мл смыва. Полученную смесь разводили стерильным МПБ в 100 раз. Это разведение бактериальной культуры с концентрацией 5 млн. микробных тел в 1 мл раствора является рабочим раствором.
Последний в количестве 0,1 мл вносили в 2 мл МПБ, содержащего соответствующее разведение исследуемого вещества. Таким образом, бактериальная нагрузка на 1 мл жидкости составляет 250 тыс. микробных тел. Через 18-20 ч (36-37oC) регистрировали наличие роста бактериальных культур или его отсутствие за счет бактериостатического действия препарата. За действующую дозу принимали минимальную ингибирующую концентрацию (МИК) препарата в мкг/мл, которая задерживает рост бактериальных культур.
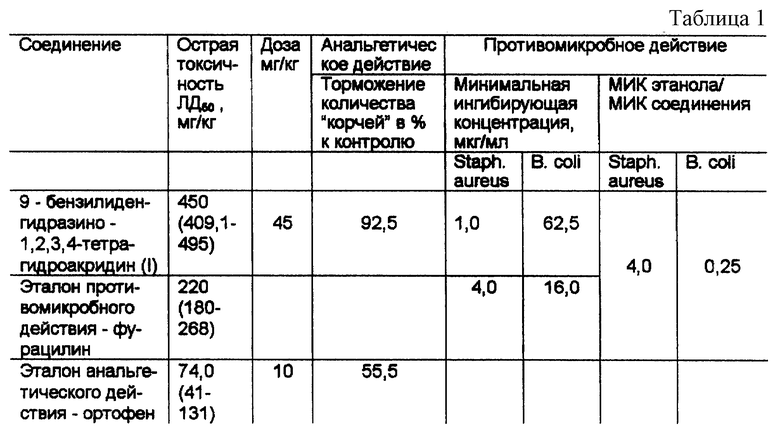
Как видно из приведенной таблицы, соединение I обладает выраженной анальгетической активностью. Число "корчей" за 20 минут наблюдения уменьшилось по сравнению с контролем на 92,5%, что превышает эталон ортофен на 37%. Соединение I в 6,1 раза менее токсично, чем аналог анальгетического действия - ортофен. Кроме того заявляемое соединение проявляет противомикробную активность в отношении золотистого стафилококка в разведении 1: 1000000, при атом МИК составляет 1 мкг/мл, превосходя по этому показателю аналог по действию в 4 раза. При этом соединение I менее токсично, чем фурацилин, в 2 раза.
Таким образом, соединение формулы I обладает выраженным анальгетическим действием, превосходя по этому показателю медицинский препарат ортофен, и более эффективно, чем фурацилин, в отношении эталонных штаммов Staph. aureus, при более низкой токсичности.
Описывается 9-бензилиденгидразино-1,2,3,4-тетрагидроакридин формулы I, который обладает анальгетической и антимикробной активностью в отношении Staph. aureus, что позволяет его применить в качестве анальгетического и противомикробного лекарственного средства. 1 табл. 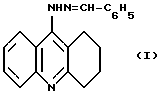
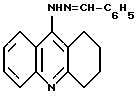
обладающий анальгетическим и притивомикробным действием в отношении Staph. Aureus.
| ПРОИЗВОДНЫЕ 9-АМИНОАКРИДИНА ИЛИ ИХ СОЛИ С ОРГАНИЧЕСКИМИ ИЛИ НЕОРГАНИЧЕСКИМИ КИСЛОТАМИ, ПРОЯВЛЯЮЩИЕ ПСИХОТРОПНУЮ, АНТИАМНЕСТИЧЕСКУЮ И ЛИПИДРЕГУЛИРУЮЩУЮ АКТИВНОСТЬ | 1991 |
|
RU2024509C1 |
| Фасонный камень | 1931 |
|
SU25705A1 |
| 1969 |
|
SU268871A1 | |
| МАШКОВСКИЙ М.Д | |||
| Лекарственные средства | |||
| - М.: Медицина, 1993, ч.1, с.198, ч.2, с.358. | |||
Авторы
Даты
2001-01-10—Публикация
1999-04-07—Подача