Настоящее изобретение относится к области энзимологии, в частности к способам предотвращения разложения активированного протеина C.
Протеин C представляет собой серин-протеазу и является природным антикоагулянтом, который играет роль в регуляции гемостаза за счет активирования факторов Va и VIIIa в классической схеме коагуляции. Человеческий протеин C образуется ин виво, главным образом, в печени в виде отдельного полипептида, содержащего 461 аминокислоту. Эта молекула предшественника претерпевает множество посттрансляционных модификаций, включая 1/ отщепление сигнальной последовательности из 42 аминокислот, 2/ протеолитическое удаление из одноцепочечного зимогена лизинового остатка в положении 155 и остатка аргинина в положении 156, до получения двухцепочечной формы молекулы /то есть легкой цепи из 155 аминокислотных остатков, присоединенной через дисульфидный мостик к содержащей серин-протеазу тяжелой цепи из 262 аминокислотных остатков/; 3/ зависящее от витамина К карбоксилирование девяти остатков глутаминовой кислоты в первых 42 аминокислотах легкой цепи, в результате чего получают 9 остатков гамма-карбоксиглутаминовой кислоты; и 4/ присоединение углеводов по четырем сайтам/ один в легкой цепи, а три - в тяжелой/. Тяжелая цепь содержит хорошо известную триаду серин-протеазы Asp 257, His 211 и Ser 360. И, наконец, цирбуляция 2-цепочечного зимогена активируется ин виво тромбином у поверхности фосфолипида в присутствии иона кальция. Активирование происходит за счет удаления додекапептида по N-концу тяжелой цепи, в результате чего образуется активированный протеин C /aPC/, обладающий энзиматической активностью.
При работе с большими количествами и высокими концентрациями aPC наблюдается протеолитический разрыв /Clip/ по лизиновому остатку в положении 308 тяжелой цепи. Последовательность нового N-конца, образующегося в результате этого разрыва, начинается с C Glu-Ala-Zys и приводит к образованию III аминокислотного фрагмента, названного "EKA фрагментом" из C-терминального конца тяжелой цепи. EAK фрагмент ковалентно не связан с легкой цепью или N-концевым участком тяжелой цепи за счет дисульфидных связей. EAK фрагмент содержит также активный сайт серии из серин-протеазы, но не содержит остатков Asp или His. Так было обнаружено, что препараты протеина C с EAK фрагментом имеют измененную антикоагулянтную активность. Настоящее изобретение включает способы предотвращения или минимизации деградации молекулы протеина C за счет содержания молекулы при пониженных pH, в денатурирующем агенте или при экстремальных концентрациях соли.
Для целей настоящего изобретения в части его раскрытия и в формуле изобретения использованы следующие термины:
aPC - активированный человеческий протеин C,
APTT - время частичной активации тромбопластина,
AU - амидолитические единицы,
BME - бета-меркаптоэтанол,
CHES - 2/N-циклогексиламино/этансульфокислота,
EAK фрагмент - Фрагмент III аминокислот, возникающий при разрыве в положении 308 тяжелой цепи протеина C,
EДTA - этилендиаминтетрауксусная кислота,
HEPES - N-2-гидроксиэтилпиперазин-N-2-этансульфокислота,
HPC - зимоген человеческого протеина C,
MEA - 2-аминоэтанол,
MES - 2-/N-морфолино/-этансульфокислота.
"Возникающий" /Nascent/ протеин - полипептид, образующийся при трансляции мРНК транскрипта до любой посттрансляционной модификации. Однако такие посттрансляционные модификации, как гамма-карбоксилирование остатков глутаминовой кислоты и гидроксилирование остатков аспарагиновой кислоты, могут начаться до того, как протеин будет полностью транслирован с мРНК транскрипта.
Активность протеина C - любое свойство протеина С человека, ответственное за протеолитическую, амидолитическую, эстеролитическую и биологическую /антикоагулянтную или профибринолитическую/ активности. Способы тестирования антикоагулянтной и амидолитической активностей протеина C хорошо известны специалистам, например, см. Grinnell et al., 1987, Bio/Technology 5:1189-1192.
rHPC - рекомбинантно полученный зимоген человеческого протеина C.
Зимоген - энзиматически неактивный предшественник протеолитического энзима. Зимоген протеина C, в том смысле, как здесь использован, обозначает секретированные неактивные формы, одной или двух цепей протеина C.
Все сокращения, касающиеся аминокислот и использованные в настоящем описании, соответствуют принятым Патентным Ведомством США и указанным в 37 C,F.R. 1.822 /b/ /2/ /1990/.
Настоящее изобретение относится к способам предотвращения или минимизации аутодеградации активированного протеина C.
Настоящее изобретение иллюстрируется осуществлением процессинга очистки и/или хранения активированного протеина C при низких значениях pH, например, от около 6,3 до около 7,0. Аутодеградация aPC может быть также сведена к минимуму за счет инкубирования aPC в 3М мочевине /полное выделение aPC активности достигается после удаления денатурирующего агента/ или за счет инкубирования aPC в присутствии экстремальных концентраций соли. Для целей настоящего описания экстремальная концентрация соли означает концентрацию выше, чем около 0,4 моля, или ниже, чем около 0,05 молей. Настоящее изобретение включает также aPC композиции, которые поддерживают aPC при низких значениях pH, в денатурирующем агенте или при экстремальных концентрациях соли.
Роль протеина C в поддержании гемостаза привлекает большой интерес к этому соединению, как к терапевтическому агенту для широкого крута сосудистых заболеваний. Получение протеина C человека в больших количествах и с высокими концентрациями привело к обнаружению того факта, что молекула может претерпевать аутодеградацию, что, в свою очередь, ведет к снижению антикоагулянтной активности. Аутодеградация aPC приводит к образованию фрагмента III аминокислот, называемого "EAK фрагментом", из C-терминального конца тяжелой цепи. EAK фрагмент не присоединен ковалентно к легкой цепи или N-терминальному участку тяжелой цепи за счет дисульфидных связей. EAK фрагмент содержит также активный сайт серинового остатка серин-протеазы, но не содержит Asp или His остатков. Таким образом, препараты протеина C с EAK фрагментом обладают измененной антикоагулянтной активностью за счет присутствия протеолитического разрыва.
Для уменьшения или предотвращения аутодеградации, которая ведет к образованию EAK фрагмента, интактную активированную молекулу протеина C можно содержать при pH от около 6,3 до около 7,0. Молекулу нужно содержать в условиях с pH в этом интервале на протяжении всех процессов очистки и активации, а также при получении окончательного раствора композиции. Для поддержания pH раствора можно использовать множество различных буферных систем. Представители таких буферных систем включают Трис-ацетат, цитрат натрия, цитрат-глицин и фосфат натрия. Специалистам известно и множество других буферных систем, которые доступны, и которые можно использовать в способах настоящего изобретения.
Другой аспект настоящего изобретения относится к предотвращению или уменьшению образования EAK фрагмента за счет поддержания активированной молекулы протеина C в растворе с экстремальной концентрацией соли. Так, например, при pH 7,0 в натрийфосфатном буфере образование фрагмента EAK минимально, если в буфере нет соли. Однако при pH 7,0 в натрийфосфатном буфере образование EAK фрагмента также минимально, если концентрация натрийхлорида в буфере составляет около 0,4М. Между этими двумя концентрациями соли образование EAK фрагмента происходит с различными скоростями; но специалистам должно быть ясно, что поддержание концентраций соли между 0,05М и около 0,4М наиболее легко предотвращает или минимизирует образование EAK фрагмента. Предпочтительны другие концентрации соли ниже 0,05М /например, 0,01М или 0,005М/, хотя наилучшие фармацевтические композиции соответствуют значениям pH около 7,0 без добавления к раствору соли. Специалистам должно быть ясно, что можно использовать много различных солей при получении фармацевтических соединений и композиций. Представители подходящих для использования солей включают хлорид калия, хлорид кальция и, что наиболее предпочтительно, хлорид натрия.
Еще один аспект изобретения относится к предотвращению или уменьшению аутодеградации активированного протеина C за счет осуществления очистки и/или получения композиции в присутствии денатурирующего агента. Можно использовать многие денатурирующие агенты, но наиболее предпочтительным агентом является мочевина в концентрациях около 3М.
Настоящее изобретение не ограничено способами получения активированного протеина C. Хотя наиболее эффективно получение молекул активированного протеина C с использованием рекомбинантной технологии ДНК, последние достижения в области крупномасштабной очистки протеина позволяют выделять значительные количества активированного протеина C из сыворотки человека. Получение таких больших количеств протеина C позволяет одновременно обрабатывать высокие концентрации активированного протеина C. Как было указано ранее, авторы обнаружили, что концентрации активированного протеина C выше уровня около 50 мкг/мл демонстрируют аутодеградацию молекул активированного протеина C, сопровождающуюся соответствующим падением антикоагулянтной активности. Наиболее важным фактом является то, что скорость аутодеградации повышается с повышением концентрации активированного протеина C в растворе. При промышленном производстве не эффективно вести процессы очистки больших количеств продукта при очень низких концентрациях протеина.
Так как промышленное и фармацевтическое применение получения активированного протеина C требует обработки молекул при концентрациях, значительно превосходящих 50 мкг, настоящее изобретение позволяет специалистам получать большие количества продукта без существенной потери активности продукта. Композиции настоящего изобретения позволяют хранить стабильные растворы активированного протеина C в течение более длительного промежутка времени, нежели те, которые были известны специалистам ранее.
Специалистам должно быть ясно, что способы настоящего изобретения позволяют пользователям получать большие объемы активированного протеина C с более высокими концентрациями, нежели те, которые можно было получать ранее, без опасности потерь продукта за счет аутодеградации. Кроме того, стабильные фармацевтические композиции настоящего изобретения можно легко использовать для лечения пациентов, страдающих заболеваниями в соответствии с указаниями Taylor, Jr. et al. в патенте США N 5009889, данные которого включены сюда по ссылке.
Далее приводятся примеры, как средство иллюстрации настоящего изобретения, и они никоим образом не ограничивают это изобретение.
Пример 1
Получение человеческого протеина C
Рекомбинантный человеческий протеин C /rHPC/ получают в клетках 293 человеческой почки способами, хорошо известными специалистам, например способом Jan патент США 4981952 /включен в качестве ссылки/. Ген, кодирующий человеческий протеин C, раскрыт и в заявке Bang et al., патент США 4775624 /включен в качестве ссылки/. Плазмида, которую используют для экспрессии человеческого протеина C в клетки 293, представляет собой плазмиду pLPC, которая раскрыта Bang et al. в патенте США 4992373. Конструирование плазмиды pLPC раскрыто также в Европейской патентной публикации N 0445939 и у Grinnell et al. 1937 Bio/Thechnology 5:1189-1192 /включены в качестве ссылки/. Короче, плазмиду трансфектируют в клетки 293, затем стабильные трансформанты идентифицируют, субкультивируют и выращивают на среде, не содержащей сыворотки. После ферментации микрофильтрацией получают не содержащую клеток среду.
Человеческий протеин C выделяют из культуральной жидкости, адаптируя методики Jan, патент США 4981952. Очищенную среду доводят до 4 мМ в ЕДТА перед тем, как абсорбируют на анионообменной смоле /Fast-Flow Q, Pharmacia/. После промывки 4 объемами колонки 20мМ Tris 200 мМ NaCl pH 7,4 и 2 объемами колонки 20 мМ Tris, 150 мМ NaCl, pH 7,4, связанный зимоген рекомбинантного человеческого протеина C элюируют 20 мМ Tris, 150 мМ NaCl, 10 мМ CaCl2, pH 7,4. Элюированный протеин оказывается более 95% чистоты после элюирования по данным электрофореза в SDS - полиакриламидном геле.
Дальнейшую очистку протеина осуществляют, получая ЗМ в NaCl протеин с последующей адсорбцией на смоле с гидрофобным взаимодействием /Toyopearl Phenyl 650 M, Toso Haas/, уравновешенной в 20 мМ Tris, 3 М NaCl, 10 мМ CaCl2, pH 7,4. После промывки 2 объемами уравновешивающим буфером колонки без CaCl2, рекомбинантный человеческий протеин C элюируют 20 мМ Tris, pH 7,4. Элюированный протеин подготавливают для активации, удаляя остатки кальция. Рекомбинантный человеческий протеин C пропускают через металлическую афинную колонку /Chelex-100, Bio-Rad/ для удаления кальция, и снова связывают на анионообменнике /Fast Flow Q, Pharmacia/. Обе эти колонки устанавливают в серию и уравновешивают 20 мМ Tris, 150 мМ NaCl, 5 мМ EDTA, pH 7,4. После загрузки протеина колонку Chelex-100 промывают одним объемом колонки того же самого буфера, перед тем, как колонки разъединяют. Анионообменную колонку промываю 3 объемами уравновешивающего буфера перед тем, как элюируют протеин 0,4М NaCl, 20 мМ Tris - ацетата, pH 6,5. Концентрации протеина в растворах рекомбинантного человеческого протеина C и рекомбинантного активированного протеина C определяют по коэффициенту экстинкции на 280 нм /УФ/.
E0,1% = 1,85 или 1,95 соответственно.
Пример 2
Активирование рекомбинантного человеческого протеина C
Бычий тромбин соединяют с активированной CH-Сефарозой 4В /Pharmacia/ в присутствии 50 мМ HEPES, pH 7,5 при 4oC. Реакцию сочетания ведут на смоле, уже помещенной в колонку, используя примерно 5000 ед. тромбина на мл смолы. Раствор тромбина циркулирует через колонку в течение примерно 3 часов перед тем, как добавляют MEA до концентрации 0,6 мл/л циркулирующего раствора. MEA-содержащий раствор циркулирует еще 10-12 часов для того, чтобы обеспечить полную блокаду непрореагировавших аминов на смоле. После блокирования смолу с присоединенным тромбином промывают 10 объемами колонки 1М NaCl 20 мМ Tris, pH 6,5 для удаления всего неспецифически связанного протеина, и используют в реакциях активации после уравновешивания активационным буфером.
Очищенный rHPC доводят до 5 мМ в EDTA /для хелатирования/ всего оставшегося кальция/ и разбавляют до концентрации 2 мг/мл 20 мM Tris, pH 7,4 или 20 мМ Tris-ацетата, pH 6,5. Этот материал пропускают через тромбиновую колонку, уравновешенную при 37oC 50 мМ NaCl и либо 20 мМ Tris pH 7,4, либо 20 мМ Tris-ацетата, pH 6,5. Скорость потока устанавливают такой, чтобы обеспечить примерно 20-минутное контактирование между rHPC и тромбиновой смолой. Выходящую жидкость собирают и немедленно проводят анализ на амидолитическую активность. Если материал не обладает специфической активностью /амидолитической/ по сравнению со стандартом aPC его рециклизуют в тромбиновую колонку для активации rHPC до завершения. После этого проводят разбавление 1: 1 материала 20 мМ буфера /указанного ранее/ с pH либо 7,4, либо 6,5 для поддержания aPC при низких концентрациях, пока ожидаются следующие стадии обработки.
Удаление выщелаченного тромбина из материала aPC завершают, связывая aPC с анионообменной смолой /Fast Flow Q, Pharmacia/ уравновешенной в активационном буфере /либо 20 мМ Tris, pH 7,4, либо 20 мМ Tris-ацетат, pH 6,5/ 150 мМ NaCl. Тромбин не взаимодействует с анионообменной смолой в этих условиях, но проходит через колонку в вытекающий образец. После того, как aPC загружают в колонку, ее промывают 2 - 6 объемами 20 мМ уравновешивающего буфера перед элюированием связанного aPC, со стадией элюирования, используя 0,4 М NaCl либо в 5 мМ Tris - ацетате, pH 6,5, либо в 20 мМ Tris, pH 7,4. Большие объемы промывок облегчают более полное удаление додекапептида. Этот материал элюируют из колонки и хранят либо в замороженном растворе /-20oC/, либо в виде лиофилизированного порошка.
Амидолитическую активность /AU/ aPC определяют по высвобождению p-нитроанилида из синтетического субстрата H-D-Phe-Pip-Arg-p-нитроанилида /S-2238/, поставляемого Kabi Vitrum, с использованием Вескман DU-7400 спектрофотометра. Одну единицу активированного протеина C определяют как количество энзима, необходимое для высвобождения 1 мкмоля p-нитроанилина за 1 минуту при 25oC, pH 7,4, используя коэффициент экстинкции для p-нитроанилина на 405 нм 9620 М-1 см-1.
Антикоагулянтную активность активированного протеина C определяют, измеряя пролонгирование времени свертывания в анализе на время свертывания частично активированного тромбопластина /APTT/. Стандартную кривую получают при разбавлении буфером /1 мг/мл BSA степени чистоты для радиоиммуноанализа, 20 мМ Tris, pH 7,4, 150 мМ NaCl, 0,02% NaN3/ в интервале концентраций протеина C от 125 до 1000 нг/мл, когда образцы приготавливают для нескольких разбавлении в этом интервале концентраций.
В каждую кювету с образцами добавляют 50 мкл холодной лошадиной плазмы и 50 мкл восстановленного частично активированного тромбопластинового временного реагента /APTT реагент, Сигма/, и инкубируют при 37oC в течение 5 минут. После инкубирования в каждую кювету добавляют 50 мкл соответствующего образца или стандарты. Буфер разбавления используют вместо образца или стандарта для определения основного времени свертывания. Таймер фиброметра /CoA Screener Hemostasis Analyzer American Labor включают сразу после добавления 50 мкл 37oC 30 мМ CaCl2 к каждому образцу или стандарту. Концентрацию активированного протеина C в образцах рассчитывают из уравнения линейной регрессии стандартной кривой. Указанные времена свертывания представляют собой среднее из минимум трех повторов, включая и кривые для стандартов.
Для получения образцов для сравнительных измерений, полной аутодеградации aPC /7,3 мг/мл/ в 20 мМ Tris, 150 мМ NaCl достигают, спустя 44 часа инкубирования при 25oC или после концентрирования на анионообменной смоле /FFQ, Pharmacia/ pH 7,4 при 4oC. Анализы на амидолитическую активность, HPLC /ВЭЖХ/, N-теминальное секвенирование и SDS-PAGE осуществляют на образцах для подтверждения и количественного определения степени аутодеградации и сайтов расщепления аминокислотной последовательности.
Пример 3
Анализы стабилизации активированного протеина C
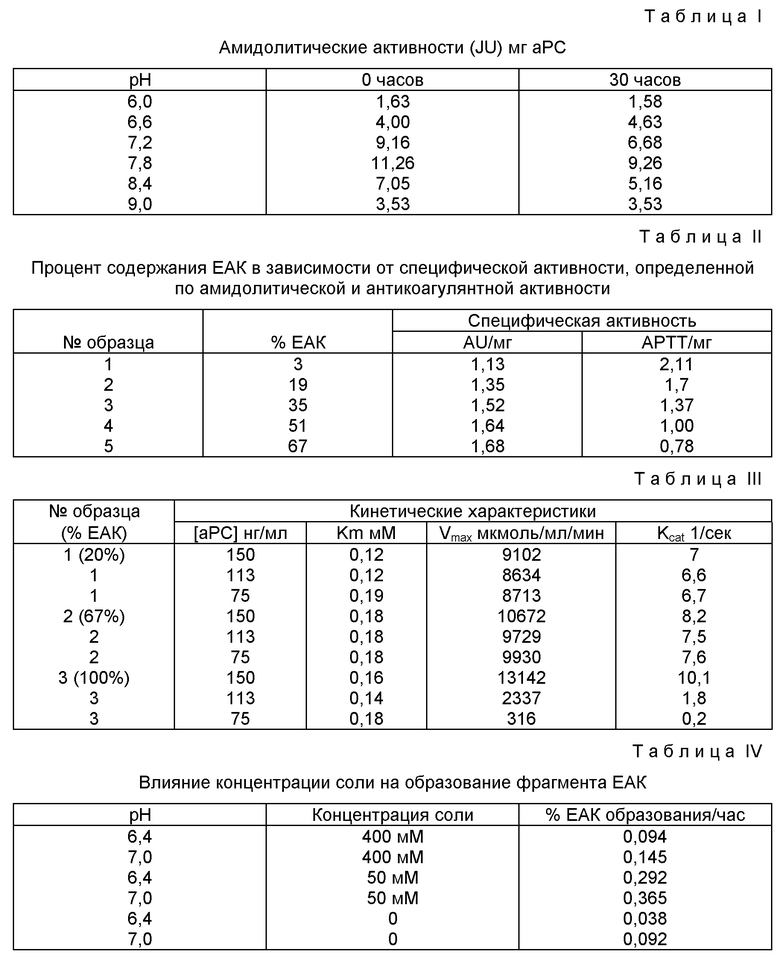
Влияние pH на активность aPC определяют, контролируя AU. Для определения pH условий в интервале 6-9,3 /с 0,3 pH инкрементами/ используют три буферные системы, используя 50 мМ каждого из MES /pH 5,5-7/, HEPES /pH 6,8-8,2/ и CHES /pH 8,6-10/. APC разбавляют до конечной концентрации 0,4 мг/мл соответствующим pH буфером и инкубируют при этой концентрации перед измерением активности. Образцы оценивают вначале и спустя 30 часов при 4oC, используя амидолитические анализы при инкубационных pH. Эти измерения показывают колоколообразную pH зависимость амидолитической активности. Результаты этих анализов приводятся далее в таблице I.
Максимальная активность для aPC составляет 7,4, тогда как экстремальные значения pH 6 и 9,3 дают существенно сниженную активность. Хотя aPC, по-видимому, сохраняет некоторую амидолитическую активность при экстремальных значениях pH, эти данные дают возможность предположить, что аутодеградация снижается, если избежать таких условий, при которых aPC имеет максимальную активность.
Для того, чтобы определить, является ли pH зависимость амидолитической активности функцией образования EAK фрагмента, aPC образцы инкубируют при pH 6,0, 7,5 и 9,0, 1,5 мг/мл при 4oC в течение 18 часов. Количество образующегося EAK определяют, интегрируя площадь под EAK ВЭЖХ пиком, а также качественно оценивая EAK полосу в SDS-PAGE. Эти данные свидетельствуют о том, что не происходит увеличения EAK образования в процессе инкубирования при pH 6,0, тогда как наблюдается примерно 30% возрастание при pH 7,5 и 50% при pH 9,0. Несмотря на повышенные уровни образования EAK фрагмента в образцах с pH 7,5 и 9,0, препараты все еще обладают высокой AU активностью при оценке при pH 7,4. Таким образом, образование EAK фрагмента нет необходимости связывать с потерей амидолитической активности.
Скорее EAK фрагмент должен оставаться достаточно связанным с остальной aPC тяжелой цепью для сохранения функциональности серин-протеазы. Если оно и существует, то более высокое содержание EAK фрагмента связано с более высокой амидолитической активностью.
EAK фрагмент содержит активный сайт серина /остаток 360/ каталитической триады /включая His 211 и Asp 257, находящиеся в N-терминальной части тяжелой цепи/. Поэтому, если EAK фрагмент ковалентно не связан с остальной частью тяжелой цепи, его протеолитический разрыв может привести к снижению энзиматической активности. Чтобы определить влияние различных количеств EAK на антикоагулянтную активность, несколько различных порций aPC приготавливают по способу примеров 1 и 2.
Амидолитические анализы проводят для концентраций субстратов в интервале 22 - 198 мкМ N S-2238, APC концентраций в интервале 1,6 - 3,3 нМ /75-150 г/мл/, 20 мМ Tris, pH 7,4, 150 мМ NaCl. Результаты этого анализа приведены далее в таблице II.
pH зависимость деградации используют для получения aPC образцов, которые содержат различные количества EAK. Эти образцы получают по способам примеров 1 и 2. Образцы с различным содержанием EAK фрагмента сравнивают с интактным aPC /менее 3% EAK фрагмента/. Амидолитические кинетические характеристики, включая Km, Kсат и Vmax значения, определяют для каждой из этих порций для трех различных концентраций энзимов, и результаты суммированы в таблице III.
Значения Km для трех aPC образцов, по-видимому, одинаковы /в пределах ошибки эксперимента/ и дают среднее значение 0,16 мМ субстрата. Это предполагает, что афинность для S-2238 субстрата не нарушается при деградации aPC. Неожиданно оказалось, что деградированный материал все еще обладает AU активностью, практически аналогичной активности интактного aPC.
Активированный протеин C может иметь интактную амидолитическую функциональность от трипептидного субстрата /NS-2238/ даже при высоком содержании EAK фрагмента. Ин витро антикоагуляционную активность можно определить в APTT анализе.
Неожиданно оказалось, что высокая AU активность не коррелирует с антикоагулянтной активностью. Тогда как AU активность возрастает с увеличением содержания EAK, APTT активность снижается с увеличением содержания EAK.
Влияние солевой концентрации на образование EAK фрагмента и стабильность активированного протеина C изучали, инкубируя образцы активированного протеина C при различных pH уровнях и концентрациях соли, затем измеряя процент образования EAK фрагмента в час. Концентрации протеина C в анализе были 4-5 мг/мл. Все анализы проводят в 5-20 мМ фосфатном буфере. В качестве соли используют хлорид натрия /если присутствует соль/, и все анализы проводят при 25oC. Процент образования EAK фрагмента в час определяют, интегрируя ВЭЖХ. Результаты этих анализов представлены в таблице IV.
Пример 4.
Композиция активированного протеина C
Человеческий активированный протеин C получали согласно методике, описанной в примерах 1 и 2. Комбинации активированного протеина C основаны на данных изучения стабильности активированного протеина C, представленные в примере 3. Композиция активированного протеина C включает активированный протеин C в концентрации 0,4 мг/мл, хлорид натрия в концентрации ниже 0,05 М или выше 0,40 М, натрийфосфатный буфер в концентрации от 0,05 М до 0,020 М при pH от 6,4 до 7,0. Описанная композиция активированного протеина C имеет пониженное содержание EAK фрагмента.
Изобретение относится к биотехнологии. Изобретение осуществляют инкубированием в растворе соли активированного протеина С (аРС) при низких значениях рН, около 6,3 - 6,5. Аутодеградацию аРС можно также минимизировать за счет инкубирования аРС в ЗМ мочевине. Полное выделение аРС активности достигается после удаления денатурирующего агента или за счет инкубирования аРС в присутствии экстремальных концентраций соли. Настоящее изобретение касается стабилизированной композиции активированного протеина С, которая поддерживает аРС при низких значениях рН, в денатурирующем агенте или при экстремальных концентрациях соли. Изобретение обеспечивает минимальную аутодеградацию аРС. 3 с. и 14 з.п. ф-лы, 4 табл.
| US 3557002, 19.01.1971 | |||
| US 3950513 A, 13.04.1976 | |||
| СИДЕНЬЕ ТРАНСПОРТНОГО СРЕДСТВА | 1996 |
|
RU2105521C1 |
Авторы
Даты
2001-05-27—Публикация
1995-01-04—Подача