Изобретение относится к области экспериментальной медицины и может быть использовано в онкологии, иммунологии, микробиологии, биохимии, патофизиологии, фтизиатрии для разработки новых способов лечения.
Среди ксенобиотиков - чужеродных для организма соединений, наиболее распространенными являются полициклические ароматические углеводороды (ПАУ). ПАУ благодаря хорошей растворимости в липидах легко проникают в организм и интенсивно обезвреживаются во многих органах и тканях. Однако при интенсивном и длительном поступлении ПАУ в организм процессы обезвреживания могут сопровождаться повреждением клеточных структур, а это, в свою очередь, лежит в основе повреждающего воздействия ПАУ, в частности их канцерогенного и мутагенного эффектов.
У рабочих вредных производств, имевших превышение предельно допустимой концентрации по ПАУ, наблюдается увеличение как онкологических заболеваний, так и заболеваний по другим показателям (воспалительные процессы, острые вирусные инфекции, заболевания нервной системы и т. д. ) (Капитульекий В. Б. итоги и перспективы изучения условий труда в коксохимическом производстве. Актуальные проблемы гигиены в металлургической и горнодобывающей промышленности. М. : Институт им. Ф. Ф. Эрисмана, 1985, с. 18-23).
Известны способы повышения резистентности экспериментальных животных к ксенобиотикам, согласно которым организм подвергается воздействию ПАУ и микроорганизмов.
В одном из способов на организм мышей воздействуют одним из ПАУ - 7,12 - диметилбензантраценом, затем вносят в кишечник кроорганизмы - бифидобактерии, лактобациллы и эубактерии (Шендеров Б. А. Микроэкологические аспекты канцерогенеза. Антибиотики и химиотерапия, 1990 т. 38, 10, с. 7-12).
В другом способе крысам вводяг туляремийную вакцину, затем через 15 суток после заражения вводят одно из ПАУ - 3,4 - бенз(а)пирен (Нерсесян А. К. Влияние иммунизации туляремийной вакциной на бластомогенез и мутагенез, индуцированные 3,4-бенз(а)пиреном у крыс. Экспериментальная онкология, 1985, т. 7, 1, с. 38-40).
Однако введение указанных микроорганизмов подопытным животным не способно значительно изменить патогенетические механизмы воздействия ПАУ и не затрагивает фундаментальных механизмов защиты к мутагенному и канцерогенному воздействию последних.
Наиболее близким по технической сущности и достигаемому результату является способ повышения резистентности экспериментальных животных к ксенобиотикам, выбранный в качестве прототипа (см. заявку 95102037/14 (003911) от 13.02.95 "Способ иммуномодуляции у экспериментальных животных").
Известный способ включает воздействие ПАУ суммарной дозой 200 мг с последующим введением вирулентного штамма H37Rv микобактерий туберкулеза в дозе 0,1 мг.
Введение микобактерий туберкулеза (МВТ) изменяет патогенетические механизмы воздействия ПАУ на организм подопытных животных. Однако подобное изменение недостаточно выражено для того, чтобы судить о повышении резистентности организма к мутагенному и канцерогенному воздействию этих ксенобиотиков.
Задача, на решение которой направлено заявляемое изобретение, заключается в коррекции патогенетических механизмов воздействия ПАУ на организм экспериментальных животных с нивелированием их мутагенного и канцерогенного воздействия.
Для решения этой задачи в способе повышения резистентности экспериментальных животных к ксенобиотикам, включающем воздействие ПАУ суммарной дозой 200 мг с последующим введением вирулентного штамма Н37Rv микобактерий туберкулеза в дозе 0,1 мг, согласно изобретению крысам и морским свинкам дополнительно вводят глутамат натрия в дозе 1 г/кг животного в течение 1-2 месяцев, начиная с 15 дня после введения микобактерий туберкулеза, а ПАУ воздействуют в течение 2-6 месяцев.
Автором установлено, что воздействие на морских свинок и крыс ПАУ приводит к нарушению их клеточного иммунитета, выражаемого в уменьшении процента Т- и В-лимфоцитов в иммунограмме и увеличении 0-лимфоцитов. В целом полученные результаты соответствуют данным литературы о нарушении иммунной системы при воздействии ПАУ на организм (И. Е. Ковалев, Н. В. Шипулина, Н. В. Томилина. Индукция цитохрома Р-450 и последующая индукция иммунного ответа у крыс при хроническом введении ксенобиотиков. Фармакология и токсикология, 1990, т. 53, 1, с. 51-53).
Отмеченные нарушения связаны с тем, что воздействие ПАУ на организм экспериментальных животных сопровождается истощением цистеина и глутатиона в тканях кроветворной и лимфоидной систем (печень, костный мозг, селезенка). Одновременно в печени регистрируется резкая стимуляция биосинтеза аргинина и мочевины; в легких возрастает концентрация полиаминов; в печени значительно возрастает содержание неорганического сульфата. В легких, крови и печени возрастает содержание глутаминовой кислоты.
Имеются данные литературы о том, что при канцерогенезе, а тем более в опухолях, индуцированных ПАУ, резко возрастает содержание богатых азотом метаболитов (полиамины, аминокислоты, нуклеиновые кислоты). В то же время содержание метаболитов, имеющих в своем составе серу (цистеин), уменьшается.
Так, увеличение неорганического сульфата влияет на заряды гистонов и нуклеиновых кислот и может иметь отношение к повреждающему воздействий ПАУ на ядерный аппарат клетки. (Хьюз М. Неорганическая химия биологических процессов, пер. с англ. М. : Мир, 1983. -416 с. ). Значительное накопление аргинина и полиаминов имеет отношение к канцерогенезу, т. к. для этого процесса характерно увеличение в повреждаемой ткани аргинина и полиаминов - стимуляторов пролиферативных процессов (Шапот B. C. Биохимические аспекты опухолевого роста. М. : Мир, 1975, 304 с. ).
Автором установлено, что при воздействии ПАУ суммарной дозой 200 мг в течение 2-6 месяцев в организме морских свинок и крыс выявляется перестройка неспецкфических запретных механизмов на преобладание богатых азотом метаболитов- адаптогенов и обеднение организма серосодержащими веществами (цистеин, глутатион).
При воздействии ПАУ сроком свыше 8 месяцев характер изменений остается постоянным, кроме того, в более позднем сроке могут сказываться факторы старения организма экспериментальных животных.
Введение подопытным животным вирулентного штамма Н37Rv микобактерий туберкулеза в дозе 0,1 мг после воздействия ПАУ cуммарной дозой 200 мг в течение 2-8 месяцев приводит к противоположной динамике исследуемых азотcодержащих и серосодержащих метаболитов. Содержание гдутаминовой кислоты, полиаминов, аргинина, мочевины, неорганического сульфата в тканях резко уменьшается, в уровень цистеина и глутатиона возрастает.
Очевидно, именно эти сдвиги обеспечивают антимутагенное воздействие МВТ, которое установлено автором в микроядерном тесте. Количество микроядер в полихроматофилах костного мозга крыс снижается более чем в 2 раза, в то время как под воздействием ПАУ оно имеет трехкратное увеличение по отношению к интактным животным; см. табл. 1.
Дополнительное введение подопытным животным глутамата натрия в дозе 0,1 г/кг массы животного, осуществляемое с 15 дня после введения МБТ и продолжающееся в течение 1-2 месяцев, потенцирует образование цистеина и глутатиона.
Следует отметить, что цистеин является лимитирующим фактором биосинтеза глутатиона в печени, где происходит преимущественное образование этого трипептида и обеспечение им всего организма. В свою очередь от обеспечения глутатионом во многом зависит устойчивость тканей к канцерогенному и мутагенному воздействию ксенобиотиков.
Количество микроядер в полихроматофилах костного мозга крыс после введения глутамата натрия практически нормализуется, приближаясь к интактной группе (табл. 1).
Таким образом, в основе антимутагенного и антиканцерогенного воздействия последовательно вводимых МБТ и глутамата натрия после воздействия на организм морских свинок и крыс ПАУ лежит способность усиливать в организме образование цистеина и глутатиона - мощных антиканцерогенных и антимутагенных субстратов.
Доза вирулентного штамма Н37Rv микобактерий туберкулеза 0,1 мг выбрана для получения отчетливых результатов как на свинках, так и на крысах. К меньшим дозам крысы не чувствительны, а дозы более выбранной вызывают слишком бурный туберкулез у морских свинок, поэтому выявленное автором переключение механизмов, связанных с обменом серы и азота, становится менее наглядным.
Для наглядности и быстроты проведения эксперимента выбран вирулентный штамм Н37Rv - человеческий вирулентный штамм, который при заражении подопытных животных приводит к быстрой генерализации экспериментального туберкулеза у морских свинок, а у крыс - к отчетливым сдвигам в иммунной системе и метаболизме аминокислот, связанных с обменом азота и серы в исследуемых тканях.
Автором установлено, что существенное изменение патогенетических механизмов и максимальное потенцирование этих изменений наблюдается при выбранной дозе глутамата натрия 1 г/кг массы животного, вводимой в течение 1-2 месяцев, начиная с 15 дня после введения МБТ. В случае введения глутамата натрия сразу после заражения МБТ или позже, например через 1-1,5 месяца, эффект от совместного воздействия был меньше.
Способ осуществляют следующим образом. Группам экспериментальных животных - морским свинкам и крысам вводят в трахею под эфирным наркозом разовую дозу ПАУ в виде смеси: каменноугольная смола (КС) - 5% раствор в подсолнечном масле - 0,5 мл и 0,1% раствор сажи (газовая и ламповая поровну) в физиологическом растворе - 0,5 мл.
После воздействия КС с сажей суммарной дозой 200 мг животным вводят вирулентный штамм Н37Rv микобактерий в дозе 0,1 мг в паховую складку. Через 15 дней после введения вирулентного штамма МВТ подопытным животным подкожно вводят глутамат натрия в дозе 1 г/кг массы ежедневно в течение 1-2 месяцев.
Для осуществления способа использовались свинки и крысы - животные заведомо различной видовой чувствительности к воздействию ПАУ и МБТ.
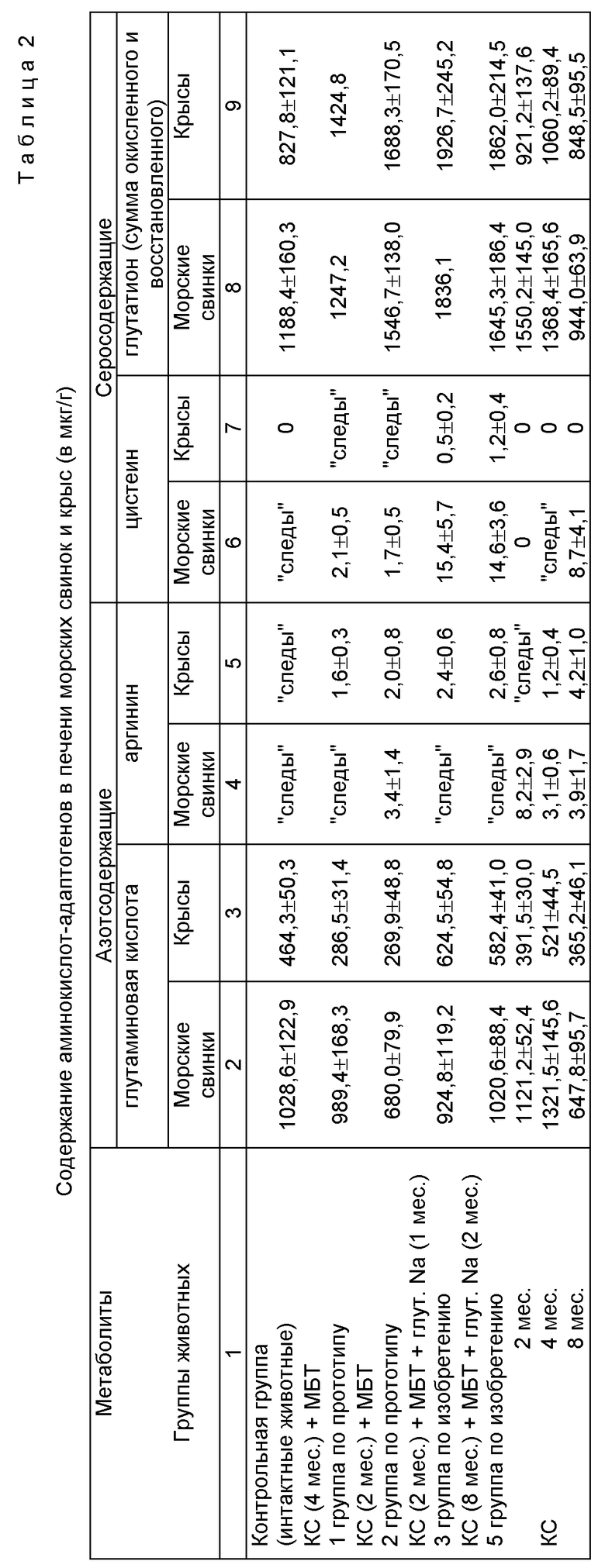
После проведения способа у животных исследовали содержание аминокислот-адаптогенов в печени, численные значения которых представлены в таблице 2.
Пример 1. Наблюдали группы животных: контрольную группу (интактные животные) морских свинок (крыс) и группу морских свинок (крыс), подвергавшихся воздействию КС и сажи в течение 4-х месяцев с интенсивностью введения разовой дозы 2 раза в месяц с последующим введением вирулентного штамма Н37Rv МБТ (I группа по прототипу).
У животных I группы содержание цистеина и глутатиона возрастает по сравнению с контрольной группой, а содержание глутаминовой кислоты по сравнению с той же группой снижается. Однако отмеченные сдвиги не всегда отчетливы.
Пример 2. Взяты следующие группы животных: контрольная группа (интактные животные) морские свинки (крысы), морские свинки (крысы), на которых воздействовали КС и сажей в течение 2-х месяцев с интенсивностью введения разовой фазы 1 раз в неделю с последующим воздействием МБТ (2 группа - по прототипу), и морские свинки (крысы), подвергавшиеся воздействию ПАУ в течение 2-х месяцев (интенсивность 1 раз в неделю) с последующим введением вирулентного штамма Н37Rv МБТ и глутамата натрия (3 группа - по изобретению).
У животных 3 группы по сравнению с группой по изобретению (2 группа) наблюдается отчетливое увеличение цистеина в лечении крыс, а у морских свинок его содержание значительно выражено. Одновременно в 3 группе наблюдается увеличение глутатиона по сравнению со всеми рассматриваемыми группами. Это является основой резистентности организма животных к мутагенному и канцерогенному воздействию ПАУ. Отмеченные показатели существенно повышают таковые у интактных животных. У животных 3 группы не отмечается существенного повышения содержания глутаминовой кислоты и аргинина от уровня интактных животных.
Пример 3. Пор наблюдением находились две группы животных: морские свинки (крысы), подвергавшиеся воздействию КС и сажи в течение 8 месяцев (интенсивность 1 раз в месяц) с последующим введением МБТ (4 группа - по прототипу), и морские свинки (крысы), на которых воздействует КС и сажей 8 месяцев (интенсивность 1-2 раза в месяц) с последующим введением штамма МБТ и глутамата натрия в течение 2 месяцев (5 группа - по изобретению).
В 4 группе животных по сравнению с 5 группой наблюдается достаточно отчетливое увеличение цистеина у морских свинок и некоторое повышение его у крыс. У крыс имеется тенденция к увеличению глутатиона, а у животных обоих видов - тенденция к снижению глутаминовой кислоты.
Все отмеченные сдвиги по увеличению количества цистеина и глутатиона и снижению глутаминовой кислоты еще более выражены по отношению к животным, подвергавшимся воздействию КС и сажи в течение 2, 4, 8 месяцев.
Приведенные данные из таблицы 2 свидетельствуют о коррекции патогенетических механизмов воздействия ПАУ и нивелировании их мутагенного и канцерогенного воздействия.
Таким образом, предлагаемый способ обладает качественным преимуществом как по отношению к прототипу, так и другим имеющимся экспериментальным исследованиям, что выражается в коррекции патогенетических механизмов воздействия ПАУ и возможности регулировать антимутагенную и аниканцерогенную устойчивость организма к ксенобиотикам. Вследствие этого улучшается выживаемость животных, клиническое состояние и возможность их использования при экспериментальном моделировании.
Предлагаемый способ может быть использован в экспериментальной медицине для разработки способов биотерапии опухолей.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ИММУНОМОДУЛЯЦИИ У ЭКСПЕРИМЕНТАЛЬНЫХ ЖИВОТНЫХ | 1995 |
|
RU2112549C1 |
| СПОСОБ СТИМУЛЯЦИИ ИММУНОБИОЛОГИЧЕСКОЙ РЕЗИСТЕНТНОСТИ | 1996 |
|
RU2148995C1 |
| СПОСОБ ЛЕЧЕНИЯ ЭКСПЕРИМЕНТАЛЬНОГО ТУБЕРКУЛЕЗА | 2000 |
|
RU2165761C1 |
| СПОСОБ ЛЕЧЕНИЯ ЭКСПЕРИМЕНТАЛЬНОГО ТУБЕРКУЛЕЗА | 2001 |
|
RU2207127C1 |
| ПРОТИВОТУБЕРКУЛЕЗНЫЙ ПРЕПАРАТ | 2002 |
|
RU2211035C1 |
| СПОСОБ ОЦЕНКИ ТЯЖЕСТИ ТУБЕРКУЛЕЗНОЙ ИНФЕКЦИИ | 2005 |
|
RU2305286C2 |
| СПОСОБ ЛЕЧЕНИЯ ТУБЕРКУЛЕЗА | 2002 |
|
RU2212240C1 |
| СПОСОБ ЛЕЧЕНИЯ ТУБЕРКУЛЕЗА ЛЕГКИХ С ПРЕИМУЩЕСТВЕННО ПРОДУКТИВНЫМ ТИПОМ ТКАНЕВОЙ РЕАКЦИИ | 2000 |
|
RU2204409C2 |
| СПОСОБ ЛЕЧЕНИЯ ТУБЕРКУЛЕЗА | 2004 |
|
RU2269346C1 |
| ЛЕКАРСТВЕННОЕ СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ ТУБЕРКУЛЕЗА | 2013 |
|
RU2523792C9 |

Изобретение относится к экспериментальной медицине. На морских свинок и крыс воздействуют полициклическими ароматическими углеводородами (ПАУ) суммарной дозой 200 мг в течение 2-8 месяцев с последующим введением вирулентного штамма Н37Rv микобактерий туберкулеза (МБТ) в дозе 0,1 мг, дополненным глутаматом натрия в дозе 0,1 г/кг массы животного. Глутамат натрия вводят в течение 1-2 месяцев, начиная с 15 дня после введения вирулентного штамма МБТ. Данное изобретение может быть использовано в онкологии, иммунологии, микробиологии, биохимии, патофизиологии, фтизиатрии для разработки новых способов лечения. 2 табл.
Способ повышения резистентности экспериментальных животных к ксенобиотикам, согласно которому организмы этих животных подвергают воздействию полициклических ароматических углеводородов (ПАУ) суммарной дозой 200 мг, включающему последующее разовое введение морским свинкам и крысам вирулентного штамма H37Rv микобактерий туберкулеза в дозе 0,1 мг, отличающийся тем, что воздействие указанных ксенобиотиков осуществляют в течение 2-8 месяцев, а с 15 дня после разового введения вирулентного штамма Н37Rv микобактерий туберкулеза вводят глутамат натрия в дозе 1 г/кг массы животного в течение 1-2 месяцев.
| RU 95102037 A1, 13.02.1995 | |||
| СПОСОБ ОЦЕНКИ МИКРОСОМАЛЬНОЙ СИСТЕМЫ ПЕЧЕНИ ПРИ ДЕЙСТВИИ КСЕНОБИОТИКОВ АЛКИЛИРУЮЩЕГО ТИПА | 1995 |
|
RU2104539C1 |
| СРЕДСТВО ДЛЯ ПРОФИЛАКТИКИ РАКА "ФУКУС" | 1995 |
|
RU2116798C1 |
| ПНЕВМАТИЧЕСКАЯ ЗЕРНОУБОРОЧНАЯ МАШИНА | 1996 |
|
RU2097959C1 |
| ШТАММ БАКТЕРИЙ AGROBACTERIUM TUMEFACIENS, ОСУЩЕСТВЛЯЮЩИЙ ДЕГРАДАЦИЮ ФЕНОЛА | 1993 |
|
RU2077575C1 |
Авторы
Даты
2002-01-27—Публикация
1998-06-09—Подача