Изобретение относится к органическим люминофорам, а более конкретно - к растворимым в воде органическим люминофорам, не имеющим окраски при дневном освещении, и полупродуктам для них. Основная область использования изобретения - невидимые при дневном освещении флуоресцентные штемпельные краски и чернила на водной основе, используемые при мануальной защите офисной, бухгалтерской и другой важной деловой документации, а также в микробиологических исследованиях.
Подавляющая часть известных в настоящее время растворимых в воде люминофоров - это окрашенные, т.е. поглощающие в видимой области спектра люминофоры, такие как сульфородамины, флуоресцеин натрия, эозины, акридины, куркумин, рибофлавин, эритрозин и некоторые другие (ЕР 1291396 A1). Это ограничивает возможность их использования для мануальной защиты.
Среди почти бесцветных растворимых в воде люминофоров в качестве аналога можно назвать только некоторые растворимые в воде оптические отбеливатели (Б.М.Красовицкий, Б.М.Болотин «Органические люминофоры», изд. «Химия» Л.О., 1976 г., с.222-240). Однако эти отбеливатели обладают только сине-голубой флуоресценцией.
Техническая задача, на решение которой направлено данное изобретение, заключается в создании новых растворимых в воде органических люминофоров, не поглощающих в видимой области спектра и флуоресцирующих различными цветами в области от синего до желто-оранжевого.
Положительный результат решения поставленной задачи достигается синтезом известными методами новых, ранее не описанных соединений - производных ряда 2-фенилбензазолов, содержащих кислотные группы, обеспечивающие растворимость в воде, и группы, образующие внутримолекулярную водородную связь. Наличие внутримолекулярной водородной связи обусловливает аномально большой сдвиг Стокса, который и является причиной возникновения зеленой, желтой или оранжевой флуоресценции у соединений, не поглощающих в видимой области спектра.
Пример 1. 4-Амино-3-(бензо[d]тиазол-2-ил)бензолсульфокислота (I).
137,7 г 2-аминотиофенола нагревают до 110° и добавляют небольшими порциями за 1 час 203,9 г изатового ангидрида, избегая сильного вспенивания. Затем поднимают температуру до 140° и продолжают нагревание при этой температуре в течение 2-4 часов до полного исчезновения 2-аминотиофенола. Расплавленную массу выливают в эмалированную кювету и после охлаждения застывшую массу растирают, а затем кипятят 2-3 часа с раствором 12 г NaOH в 3,5 л воды. Осадок отделяют фильтрованием и промывают холодной водой до исчезновения голубой флуоресценции в промывных водах. Осадок сушат при 80°. Получают 200 г 2-(бензо[d]тиазол-2-ил)фениламина. Продукт без дополнительной очистки используют в следующей стадии.
100 г измельченного 2-(бензо[d]тиазол-2-ил)фениламина присыпают при перемешивании порциями по 5-6 г за 2 часа к 500 мл аккумуляторной кислоты и размешивают до полного растворения. Раствор фильтруют через стеклянный фильтр и выливают на смесь 500 г льда и 500 г воды. После того как реакционная масса остынет до комнатной температуры, осадок отфильтровывают, промывают изопропиловым спиртом и сушат при 80°. Получают 120 г сернокислой соли 2-(бензо[d]тиазол-2-ил)фениламина. Все количество полученной сернокислой соли нагревают при 200° и остаточном давлении 10 мм рт.ст. в течение 7-8 часов до прекращения выделения воды. После охлаждения содержимое колбы заливают 4 л воды, добавляют NaOH до рН 9-10 и кипятят с активированным углем в течение 30 минут. Горячий раствор фильтруют. Фильтрат охлаждают до комнатной температуры и подкисляют соляной кислотой до рН 1. Желтый осадок отделяют фильтрованием и промывают ацетоном. Получают соединение I. Выход 100 г. Найдено: С-51,0; Н-3,3; N-9,1. Вычислено для C13H10N2O3S2: С-50,97; Н-3,29; N-9,14.
Пример 2. Натриевая соль 4-(4,6-Дихлор-1,3,5-триазин-2-иламино)-3-(бензо[d]тиазол-2-ил)бензолсульфокислоты (II)
Суспензию 20,0 г соединения I в 400 мл ацетона охлаждают до температуры 0-2°С и одновременно из двух капельных воронок при перемешивании прибавляют за 1 час растворы 18,5 г хлористого цианура в 150 мл ацетона и 100 мл 10%-ного водного раствора Na2СО3. Перемешивание продолжают до исчезновения исходного соединения I (проба на ТСХ. Элюент: пиридин-изопропанол - конц. аммиак в объемном соотношении 2:2:1). По завершении реакции отфильтровывают продукт II и промывают его на фильтре 100 мл ацетона. Сушат при комнатной температуре. Выход 35 г. Продукт нерастворим в воде. Флуоресцирует зеленым. Найдено: С-40,4; Н-1,7; N-14,7. Вычислено для C16H8Cl2N5NaO3S2: C-40,35; H-1,69; N-14,7.
Пример 3. Натриевая соль 4-(4-Хлор-6-[(3-сульфофениламино)-1,3,5-триазин-иламино])-3-(бензо[d]тиазол-2-ил)бензолсульфокислоты (III)
35 г соединения II (пример 2) вносят в 400 мл воды, добавляют 15,6 г натриевой соли мета-аминобензолсульфокислоты и медленно нагревают до кипения. Осадок растворяется. Кипячение продолжают 3 часа, охлаждают до 60°, вносят 5 г активированного угля и кипятят 30 минут. Горячий раствор фильтруют. После охлаждения фильтрата до комнатной температуры к нему добавляют 1 л ацетона. Выпавший люминофор отфильтровывают, промывают на фильтре ацетоном и сушат на воздухе. Выход 52 г. Люминофор хорошо растворяется в воде. Цвет флуоресценции - зеленый. Найдено: С - 41,5; Н - 2,1; С1 - 5,6; N -13,2. Вычислено для С22Н13ClN6Na2O6S3: С-41,61; Н-2,06; С1-5,58; N-13,23. Вещество хорошо растворяется в воде. Бесцветный водный раствор имеет желтую флуоресценцию с максимумом 550 нм.
Пример 4. Пентакалиевая соль 4-(4,6-бис-диацетилимино-1,3,5-триазин-2-иламино)-3-(бензо[d]тиазол-2-ил)бензолсульфокислоты (IV)
35,7 г соединения II, 500 мл воды и раствор 25 г иминодиуксусной кислоты и 20 г карбоната натрия в 150 мл воды медленно нагревают до кипения и кипятят 3 часа. Весь осадок переходит в раствор. Массу охлаждают до 60°, добавляют 5 г активированного угля, кипятят еще 30 минут и горячий раствор фильтруют. Фильтрат подкисляют соляной кислотой до рН 1-2 и нагревают до полного растворения выпавшего осадка. Оставляют на ночь при комнатной температуре. Выпавший осадок отфильтровывают, промывают водой и сушат на воздухе. Выход кислой формы соединения IV составляет 38 г.
100 г кислой формы соединения IV заливают 500 мл воды и к смеси постепенно добавляют карбоната калия, добиваясь полного растворения осадка. В раствор вносят 5 г активированного угля, кипятят 10 минут и фильтруют. Остывший фильтрат выливают на 1,5 л ацетона при интенсивном перемешивании. Выпавший осадок отделяют фильтрованием, промывают ацетоном и сушат при комнатной температуре. Выход 111 г. Найдено: С-34,4; Н-1,9; N-11,7; S-7,6. Вычислено для С27Н19N4К5O11S2: С-34,40; Н-1,92; N-11,70; S-7,65. Вещество хорошо растворяется в воде. Бесцветный водный раствор имеет желтую флуоресценцию с максимумом 570 нм.
Пример 5. Динатриевая соль 4-(4-(2-(бензо[d]тиазол-2-ил)-4-сульфофенил-амино)-6-хлор-1,3,5-триазин-2-иламино)-3-(бензо[d]тиазол-2-ил)бензолсульфокислоты (V)
3,83 г соединения I и 5 г соединения II заливают 150 мл воды, доводят рН смеси 10%-ным водным раствором карбоната натрия до 8-10 и кипятят 3 часа, поддерживая рН в указанном интервале, добавляя, если требуется, раствор Na2CO3. Образовавшийся белый осадок отделяют фильтрованием, промывают на фильтре водой и сушат при комнатной температуре. Выход 6,1 г. Вещество обладает желтой флуоресценцией. Трудно растворимо в воде. Найдено: С-45,4; Н-2,0; N-12,8. Вычислено для:C29H16ClN7Na2O6S4 С-45,34; Н-2,10; N-12,76.
Пример 6. Динатриевая соль 4-(4-(2-(бензо[d]тиазол-2-ил)-4-сульфофенил-амино)-6-морфолино-1,3,5-триазин-2-иламино)-3-(бензо[d]тиазол-2-ил)бензолсульфокислоты (VI)
6 г соединения V, 0,73 г морфолина и 150 мл воды кипятят 3 часа, поддерживая рН смеси 8-10 с помощью водного раствора карбоната натрия (см. пример 5). Через 30 минут после начала кипения осадок переходит в раствор. По охлаждении профильтрованный раствор выливают в ацетон. Выпавший осадок отделяют фильтрованием, промывают ацетоном и сушат при комнатной температуре. Выход 3,5 г. Найдено: С-48,4; Н-3,0; N-13,7; S-15,7. Вычислено для C33H24N8Na2O7S4: C-48,40; Н-2,95; N-13,68; S-15,66. Вещество хорошо растворяется в воде. Бесцветный водный раствор имеет оранжевую флуоресценцию с максимумом 582 нм.
Пример 7. Динатриевая соль 4-(2-карбамоилбензолсульфоноил)-3-(бензо[d]тиазол-2-ил)бензолсульфокислоты (VII)
5 г соединения I и 80 мл воды нагревают до растворения осадка, охлаждают до 25° и присыпают 1,85 г ацетата натрия. При этом наблюдается частичное выпадение осадка. К реакционной массе придают сразу 5,52 г ангидрида орто-сульфобензойной кислоты и перемешивают при комнатной температуре в течение 3 часов до полного исчезновения на тонкослойной хроматограмме соединения I. Далее к реакционной массе добавляют активированный уголь, кипятят 15 минут и фильтруют. Фильтрат упаривают на водяной бане досуха, осадок промывают ацетоном, растворяют в минимальном количестве воды и высаживают ацетоном. Получают белый порошок с желтой флуоресценцией. Выход 3,7 г. Найдено: С-45,0; Н-2,2; N-5,3; S-18,1. Вычислено для C20H12N2Na2О7S3: C-44,94; H-2,26; N-5,24; S-18,00. Вещество хорошо растворяется в воде. Бесцветный водный раствор имеет желто-зеленую флуоресценцию с максимумом 547 нм.
Пример 8. Динатриевая соль 4-(4-(карбоксиметиламино)-6-хлор-1,3,5-триазин-2-ипамино)-3-(бензо[d]тиазол-2-ил)бензолсульфокислоты (VIII)
3,52 г глицина и 2,5 г карбоната натрия растворяют в 150 мл воды. К этому раствору добавляют 20 г соединения II и 300 мл воды. Суспензию медленно нагревают до 60° (осадок растворяется). Раствор осторожно подкисляют соляной кислотой до рН 1-2. Выпавший осадок отделяют фильтрованием, промывают водой и сушат при комнатной температуре. Получают 4 г соединения VIII в виде свободной кислоты.
100 г соединения VIII в виде свободной кислоты заливают 500 мл воды и присыпают 40,9 г карбоната натрия до полного растворения осадка, добавляют активированный уголь, кипятят 10 минут, фильтруют. К остывшему фильтрату добавляют 500 мл ацетона и эту смесь приливают к 1 л ацетона. Выпавший осадок отделяют фильтрованием, промывают ацетоном и сушат при комнатной температуре. Выход 111 г. Найдено: С-40,3; Н-2,0; N-15,6. Вычислено для C18H11ClN6Na2O5S2: C-40,27; H-2,07; N-15,65 Вещество хорошо растворяется в воде. Бесцветный водный раствор имеет желто-зеленую флуоресценцию с максимумом 548 нм.
Пример 9. Динатриевая соль 4-(4-(3-сульфофениламино)-6-морфолино-1,3,5-триазин-2-иламино)-3-(бензо[d]тиазол-2-ил)бензолсульфокислоты (IX)
2 г Соединения III, 0,3 г морфолина и 60 мл воды нагревают до кипения. Кипятят 3 часа, поддерживая рН 8-10. После охлаждения раствор выливают в 1 л ацетона. Выпавший осадок отделяют фильтрованием, промывают ацетоном и сушат при комнатной температуре. Выход 0,38 г. Найдено: С-48,4; Н-3,1; N-13,6; S-15,7. Вычислено для C33H24N8Na2O7S4: C-48,40; Н-2,95; N-13,68; S-15,66. Вещество хорошо растворяется в воде. Бесцветный водный раствор имеет желтую флуоресценцию с максимумом 565 нм.
Пример 10. Тринатриевая соль 4-(4,6-бис-(карбоксиметиламино)-1,3,5-триазин-2-иламино)-3-(бензо[d]тиазол-2-ил)бензолсульфокислоты (X)
Синтез ведут точно так же, как соединения VIII, но берут удвоенное количество глицина. Выход соединения Х 110 г. Найдено: С-40,2; Н-2,4; N-16,5. Вычислено для C20H14N7Na3O7S2: C-40,21; H-2,36; N-16,41. Вещество хорошо растворяется в воде. Бесцветный водный раствор имеет желтую флуоресценцию с максимумом 565 нм.
Пример 11. Натриевая соль 4-амино-3-(бензо[d]оксазол-2-ил)бензолсульфокислоты
Тщательно перемешанную смесь 109,13 г 2-аминофенола и 203,9 г изатового ангидрида нагревают при 140° в течение 2-4 часов до прекращения выделения углекислого газа. Затем подключают вакуум (остаточное давление около 50 мм рт.ст.) и продолжают нагревание при 180° в течение 3-4 часов до прекращения выделения воды. Расплавленную массу выливают в фарфоровую ступку и после застывания измельчают, а затем кипятят 2-3 часа с раствором 12 г едкого натра в 3500 мл воды. После охлаждения образовавшуюся суспензию отделяют фильтрованием, промывают холодной водой до исчезновения голубой флуоресценции промывных вод и сушат при 80°. Выход 2-(бензо[d]оксазол-2-ил)фениламина 180-185 г. Продукт без дополнительной очистки используют на следующей стадии.
К 500 мл аккумуляторной кислоты при перемешивании, порциями по 5-6 г за 2 часа присыпают 100 г тщательно измельченного 2-(бензо[d]оксазол-2-ил)фениламина и размешивают до полного растворения осадка. Раствор фильтруют через стеклянный фильтр и выливают на смесь 500 г льда и 500 г воды. После того как реакционная масса охладится до комнатной температуры, отделяют фильтрованием осадок, промывают его изопропиловым спиртом и сушат при 80°. Выход сернокислой соли 2-(бензо[d]оксазол-2-ил)фениламина 110 г. Весь полученный продукт нагревают при 200° и остаточном давлении 50 мм рт.ст. в течение 7-8 часов до прекращения выделения воды. После охлаждения продукт суспендируют в 4 л воды, добавляют едкий натр до рН 9-10, активированный уголь и кипятят 30 минут. Затем горячий раствор фильтруют. Осадок на фильтре промывают 500 мл горячей воды. Объединенные фильтраты охлаждают до комнатной температуры, подкисляют соляной кислотой до рН 1. Выпавший желтый осадок отделяют фильтрованием, промывают ацетоном и сушат при комнатной температуре. Выход соединения XI 90 г. Найдено: С-53,8; Н-3,5; N-9,6; S-11,0. Вычислено для C13H10N2O4S: C-53,79; H-3,47; N-9,65; S-11,05.
Пример 12. Натриевая соль 4-(4,6-Дихлор-1,3,5-триазин-2-иламино)-3-(бензо[d]оксазол-2-ил)бензолсульфокислоты (XII)
Получают точно так же, как соединение II, но вместо соединения I берут 19,6 г соединения XI. Выход соединения XII 32 г. Найдено: С-41,8; Н-1,7; N-15,2. Вычислено для C16H8Cl2N5NaO4S: C-41,76; H-1,75; N-15,22.
Пример 13. Динатриевая соль 4-(4-Хлор-6-[(3-сульфофениламино)-1,3,5-триазин-2-иламино])-3-(бензо[d]оксазол-2-ил)бензолсульфокислоты(XIII) 1 г соединения XII, 0,43 г метаниловой кислоты, 50 мл воды и 5 мл 10%-ного водного раствора карбоната натрия нагревают при 40-45° в течение 4 часов до полного растворения компонентов. Горячий раствор фильтруют. Фильтрат подкисляют соляной кислотой до рН 1. Выпавший осадок отделяют фильтрованием, промывают водой и переносят в 25 мл воды. Доводят карбонатом натрия рН смеси до 8,0-8,5, фильтруют. Фильтрат разбавляют 200 мл изопропилового спирта. Выпавший осадок соединения XIII отделяют фильтрованием и сушат при 80°. Выход 1 г. Найдено: С-42,7; Н-2,1; N-13,6. Вычислено для C22H13ClN6Na2O7S2: C-42,69; H-2,12; N-13,58. Вещество хорошо растворимо в воде. Бесцветный водный раствор имеет зеленую флуоресценцию с максимумом при 517 нм.
Пример 14. Триаммонийная соль 4-(4-хлор-6-диацетилимино-1,3,5-триазин-2-иламино)-3-(бензо[d]оксазол-2-ил)бензолсульфокислоты (XIV)
1,5 г соединения XII, 0,435 г иминодиуксусной кислоты, 75 мл воды и 10 мл 10%-ного водного раствора карбоната натрия нагревают 4 часа при 40-45° до полного растворения компонентов, фильтруют и подкисляют фильтрат соляной кислотой до рН 1,0. Выпавший осадок отделяют фильтрованием, промывают водой и переносят в 40 мл воды. Доводят 25% раствором аммиака рН среды до 8,0-8,5. Раствор фильтруют. Фильтрат выливают в 300 мл изопропилового спирта. Выпавший осадок соединения XIV отделяют фильтрованием и сушат при 80°. Выход 1,3 г. Найдено: С-41,0; H-4,1; N-21,4. Вычислено для C20H24ClN9O8S: C-40,99; H-4,13; N-21,51. Вещество хорошо растворимо в воде. Бесцветный водный раствор имеет зеленую флуоресценцию с максимумом при 517 нм.
| название | год | авторы | номер документа |
|---|---|---|---|
| БЕСЦВЕТНЫЕ ПРИ ДНЕВНОМ ОСВЕЩЕНИИ ЛЮМИНЕСЦЕНТНЫЕ КРАСКИ ДЛЯ ХУДОЖЕСТВЕННЫХ РАБОТ | 2010 |
|
RU2429263C1 |
| БЕСЦВЕТНЫЙ ОРГАНИЧЕСКИЙ ЛЮМИНОФОР ЖЕЛТОГО СВЕЧЕНИЯ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2003 |
|
RU2247117C1 |
| Бесцветные органические люминофоры | 2016 |
|
RU2650518C2 |
| БЕСЦВЕТНЫЕ ЛЮМИНОФОРЫ РЯДА ФЕНИЛБЕНЗАЗОЛОВ | 2018 |
|
RU2683327C1 |
| Способ получения 2-(о-арилсульфониламинофенил)-4(3Н)-хиназолинонов | 2019 |
|
RU2700579C1 |
| ТРИАЗИНСОДЕРЖАЩИЕ АНИОННЫЕ СОЕДИНЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ | 1997 |
|
RU2170731C2 |
| КОНДЕНСИРОВАННАЯ ГЕТЕРОЦИКЛИЧЕСКАЯ СИСТЕМА 2,3-ДИГИДРОПИРИДО [1,2,3-DE]-1,4-БЕНЗОКСАЗИНИЯ | 1995 |
|
RU2100359C1 |
| СПОСОБ ПОЛУЧЕНИЯ ОРГАНИЧЕСКИХ люминофорой?^? J^'^;0-ТЕХШЕСКА | 1971 |
|
SU309036A1 |
| Производные 1,4-бис-(5-арилоксазолил-2)-бензола в качестве органических люминофоров сине-зеленого свечения | 1983 |
|
SU1082787A1 |
| 2-(4-Дифторметилсульфонилфенил)-5арилоксазолы в качестве люминофоров | 1976 |
|
SU606859A1 |
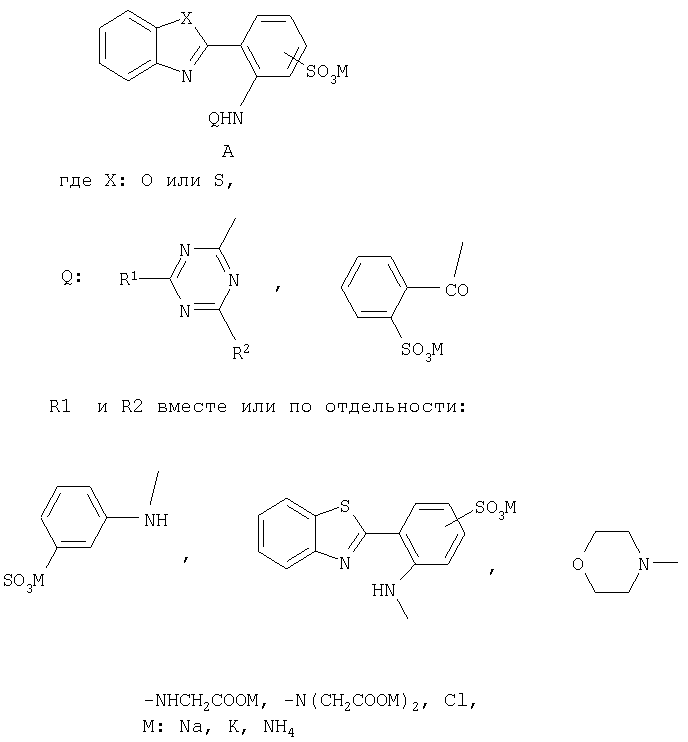
Изобретение относится к бесцветным при дневном освещении органическим люминофорам, в частности к новым, растворимым в воде, бесцветным люминофорам А
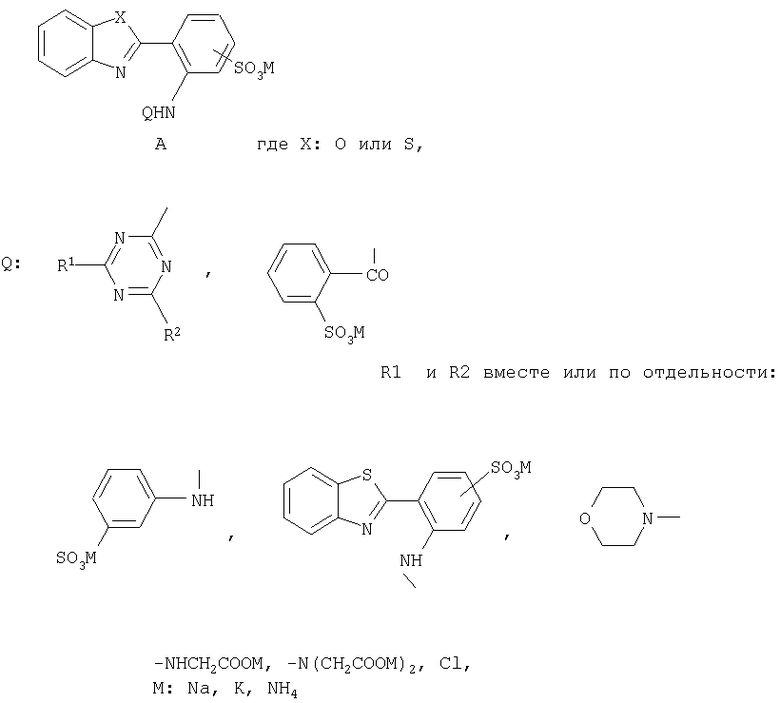
По сравнению с известными бесцветными органическими люминофорами - оптическими отбеливателями, обладающими только сине-голубой флуоресценцией, новые люминофоры флуоресцируют в области от синего до желто-оранжевого цвета и могут быть использованы в качестве компонентов флуоресцентных, бесцветных при дневном освещении, чернил для струйных принтеров или штемпельных красок.
Соединения общей формулы А
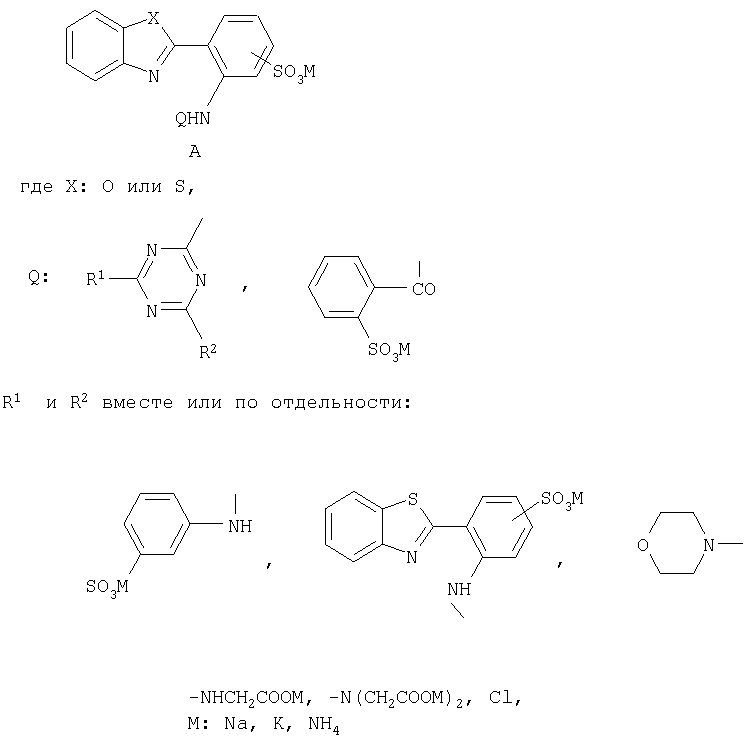
в качестве бесцветных растворимых в воде органических люминофоров различных цветов свечения.
| КРАСОВИЦКИЙ Б.М., БОЛОТИН Б.М., Органические люминофоры | |||
| - М., Х., 1984, с.192-203 | |||
| Кулачок для привода клапана | 1979 |
|
SU1070326A1 |
| ПРОИЗВОДНЫЕ 1,2 -БИС (5-ФЕНИЛОКСАЗОЛИЛ-2) БЕНЗОЛА В КАЧЕСТВЕ ОРГАНИЧЕСКОГО ЛЮМИНОФОРА СИНЕГО СВЕЧЕНИЯ | 1992 |
|
RU2039744C1 |
| 2-(5-ФЕНИЛОКСАЗОЛИЛ-2)-5-(5-АРИЛОКСАЗОЛИЛ-2)-БЕНЗОЙНЫЕ КИСЛОТЫ В КАЧЕСТВЕ ОРГАНИЧЕСКИХ ЛЮМИНОФОРОВ СИНЕ-ЗЕЛЕНОГО СВЕЧЕНИЯ В ОРГАНИЧЕСКИХ РАСТВОРИТЕЛЯХ И ВОДНОЙ СРЕДЕ | 1982 |
|
SU1078859A1 |
| СПОСОБ ПОЛУЧЕНИЯ 2- | 0 |
|
SU199894A1 |
Авторы
Даты
2006-11-10—Публикация
2005-07-28—Подача