Техническая область
Настоящее изобретение относится к новым соединениям или их солям, оказывающим ингибирующее действие на VLA-4 (очень поздний антиген-4), и лекарственным средствам, содержащим эти соединения в качестве эффективного ингредиента.
Предпосылки создания изобретения
Основная патологическая особенность воспалительных и аутоиммунных заболеваний состоит в аккумуляции активированных лейкоцитов на поврежденной ткани (воспаленной ткани). Процесс от миграции лейкоцитов из сердечно-сосудистой системы до перемещения (трансмиграции) к месту воспаления включает четырехстадийные каскадные реакции, которые влияют друг на друга: (1) адгезию и «перекатывание», (2) активацию, (3) прочную адгезию и (4) трансмиграцию (Springer, T., Ann. Rev. Physiol., 57: 827 (1995)).
Сначала лейкоциты прилипают к васкулярному эндотелию в слабой степени и перемещаются (катятся) по его поверхности. Затем имеет место активация клеток, опосредованная растворимыми хемоаттрактантами, в результате начинается образование более прочной связи между лейкоцитами и васкулярными эндотелиальными клетками. Это прочное связывание последовательно вызывает адгезию и трансмиграцию лейкоцитов через пространство между васкулярными эндотелиальными клетками. Эти стадии происходят непрерывно и каждая стадия является необходимой для осуществления трансмиграции лейкоцитов. Это предполагает также, что трансмиграция лейкоцитов регулируется на каждой стадии. Этот факт дает много интересных направлений с точки зрения фармации.
Известен ряд рецепторов in vivo. Из них рецепторы, принимающие участие в трансмиграции лейкоцитов, характеризуются тем, что они принадлежат к семейству молекул адгезии клеток (Carlos and Harlan, Blood, 82: 2068 (1994)). Начальная адгезия и «перекатывание» опосредуются рецептором адгезии, названным «селектином». Прочная адгезия опосредуется взаимодействием между интегринами на поверхности лейкоцитов и молекулами суперсемейства иммуноглобулинов, экспрессированными на эндотелиальной поверхности сосудов. Эти интегрины и молекулы адгезии типа иммуноглобулинов в основном участвуют в трансмиграции лейкоцитов. Проходят ли лейкоциты через внеклеточный матрикс или останавливаются у места воспаления после трансмиграции, зависит от интегринов.
Интегрины являются большим семейством гетеродимерных гликопротеинов, в каждом из которых ассоциированы две неэквивалентные α- и β-субъединицы (Heynes, R., Cell, 69: 11(1992)). Существует, по меньшей мере, 16 α-субъединиц (от α-1 до α-9, αL, αM, αD, αX, αЕ, AIIb, αV), которые отличаются друг от друга, и, по меньшей мере, 9 β-субъединиц (от β-1 до β-9), которые отличаются друг от друга. Интегрины относят к подсемейству на основе β-субъединиц. Лейкоциты экспрессируют много разных интегринов, в том числе α4β1, α5β1, α6β1, α4β7, αLβ2, αXβ2 и αVβ3.
Интегрин α4β1 известен как очень поздний антиген (очень поздний антиген-4; VLA-4) или CD49d/CD29. Он экспрессируется моноцитами, лимфоцитами, эозинофилами и базоцитами и служит в качестве фактора модификации, который является ключевым при различных воспалительных дефектах (Helmer, M. Ann. Rev. Immunol., 8: 365 (1990)). Интегрин α4β1 функционирует в качестве рецептора для молекулы-1 адгезии васкулярных клеток (VCAM-1), а также в качестве рецептора для фибронектина (FN) внеклеточного белка (Elices, et al., Cell, 60: 577 (1990)).
В последние годы в нижеуказанных исследованиях было доказано, что селективное ингибирование адгезии, опосредованной α4β1/VCAM-1, станет основой способа лечения аутоиммунных и аллергических воспалительных заболеваний.
Описанный конкретно эксперимент in vivo доказал, что моноклональное антитело, которое блокирует путь α4β1/VCAM-1, обладает противовоспалительным действием и тормозит развитие заболеваний (Lobb et al., J. Clin., Invest., 94: 1722-28 (1944)). Кроме того, описывается подавление антителами анти-α4 как индуцированной антигеном повышенной чувствительности дыхательных путей, так и накопления лейкоцитов в альвеолярном секрете дыхательных путей у морских свинок, использованных в качестве модели легочного воспаления (Pretolani, et al., J. Exp.Med., 180: 795 (1994); подавление антителом α4 или VCAM-1 трансмиграции эозинофилов на дыхательных путях мышей, использованных в качестве антиген-индуцированной модели (Nakajima et al., J. Exp.Med., 179: 1145-1994)), замедление или подавление лечением моноклональным телом α4 или VCAM-1 появления замедленной кожной гиперчувствительности у мышей и обезьян (Chisholm et al., Eur. J. Immunol., 179: 1145 (1994), Silber et al., J. Clin., Invest., 95: 1554 (1993); модель отторжения при трансплантации сердца вследствие (связанного с этим) специфического иммуносупрессивного действия (Isobe et al., J. Immunol., 153: 5810 (1994)); болезнь «трансплантат против хозяина» после трансплантации костного мозга у мышей (Yang et al., Proc. Natl. Acad. Sci. USA, 90; 10494 (1993)); и экспериментальный аутоиммунный энцефаломиелит у крыс и мышей. (Yednock, et al., Nature., 356: 63(1992), Baron, et al., J. Exp.Med., 177: 57(1993)).
Кроме того, имеется сообщение о значительном замедлении возникновения диабета введением диабетическим мышам без ожирения, используемым в качестве модели in vivo, растворимого слитого белка VCAM-иммуноглобулин (Ig), полученного слиянием двух N-концевых областей Ig человека с общей частью IgG1 человека в соответствии с Rational Drug Design (значительные замедления возникновения адаптивно-переносимого аутоиммунного диабета у неожиревших мышей (Jakubowski et al., J. Immunol., 155: 938 (1995). Другим сообщением является то, что в результате синтеза циклического пептидного антагониста с использованием трехмерной кристаллической структуры VCAM-1-фрагмента для имитации части связывающей петли интегрина α4 у домена-1 VCAM-1, CQIDSPC синтезированного VCAM-1-пептида приводил к ингибированию адгезии VLA-4-экспрессирующих клеток с очищенным VCAM-1 (Wang et al., Proc. Natl. Acad. Sci. USA, 92: 5714 (1995).
В качестве другой стратегии сообщается о блокировании адгезии α4β1 к любому из сайтов связывания соответствующего ему рецептора, то есть фибронектина, включающего в себя домен соединяющего сегмента-1 (CS-1) (E.A. Wayner, J. Cell. Biol., 116; 489 (1992)) и ингибирование in vitro синтетическим тетрапептидом CS-1 (фенилуксусная кислота-Leu-Asp-Phe-d-Pro-амид) адгезии лейкоцитов, опосредованной VLA-4, и ослабление прогрессирования заболеваний коронарных артерий при трансплантации сердца кроликам (Molossi et al., J. Clin. Invest., 95: 2601 (1995)).
Кроме того, имеется несколько сообщений по соединениям, проявляющим in vitro ингибирующую VLA-4 активность (патент США №5821231, WO96/22966, WO97/03094, WO98/04247 и WO98/04913.
Однако все еще не обнаружены лекарственные средства, проявляющие достаточную эффективность при пероральном введении и имеющие клиническую эффективность.
Целью настоящего изобретения, следовательно, является создание лекарственного средства, которое служит в качестве селективного ингибитора VLA-1, проявляет эффективность при пероральном введении и которое можно вводить в течение продолжительного периода времени.
Описание изобретения
Принимая во внимание вышесказанное, авторы настоящего изобретения провели исследование в отношении имеющих низкую молекулярную массу и непептидных соединений. В результате этого обнаружено, что соединения, представленные нижеописанной формулой (I) селективного, ингибируют связывание молекул клеточной адгезии с VLA-4 и являются пригодными для профилактики или лечения различных заболеваний, опосредованных миграцией и адгезией лейкоцитов, что привело к созданию настоящего изобретения.
В настоящем изобретении, таким образом, предложено соединение, представленное следующей формулой (I):
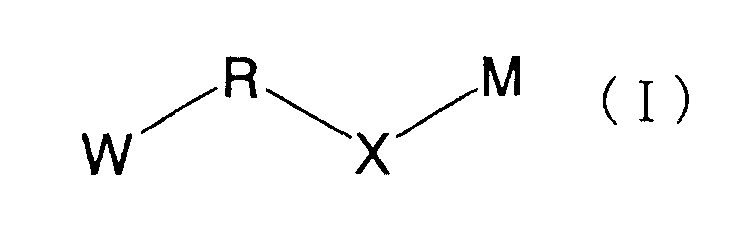
(где W представляет WA-A1-WB- (в которой WA представляет замещенную или незамещенную арильную группу или замещенную или незамещенную одновалентную гетероциклическую группу, А1 представляет -NR1-, простую связь, -С(О)-, -С(О)NR1-, замещенную или незамещенную виниленовую группу, этиниленовую группу,
-CR1aR1b-O-, -CR1a=CR1b-C(O)NR1- или -CR1a=CR1b-C(O)- (в которой R1 представляет атом водорода или низшую алкильную группу и R1a и R1b, каждый независимо, представляют атом водорода или низшую алкильную группу) и WB представляет замещенную или незамещенную ариленовую группу или замещенную или незамещенную двухвалентную гетероциклическую группу);
R представляет простую связь, -NH-, -OCH2-, алкениленовую группу или -(СН2)n- (где n равно 1 или 2);
Х представляет -С(О)-, -СН2- или -S(O)2- и
М представляет группу следующей формулы (iii), (iv) или (v):
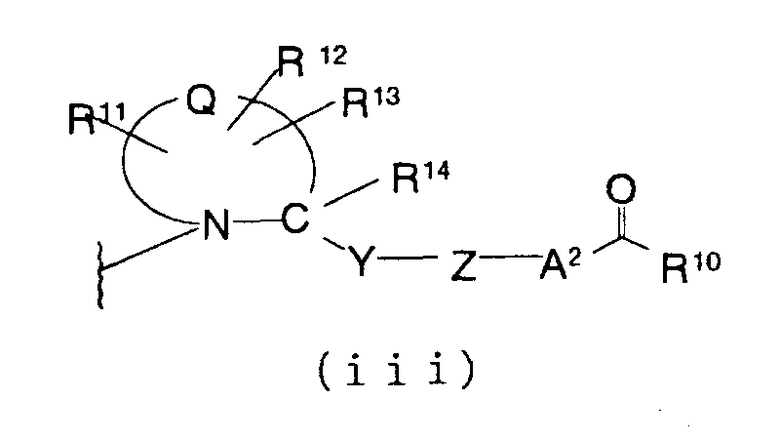
(в которой
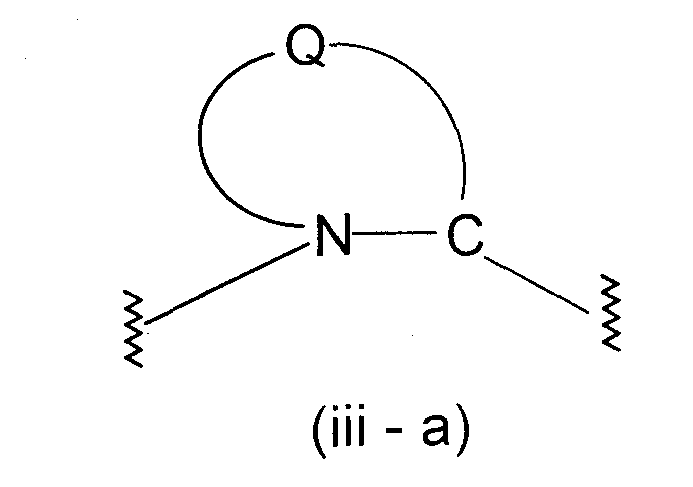
представляет двухвалентную 4-, 5-, 6- или 7-членную гетероциклическую группу (в которой атом азота связан c X и Q представляет атом углерода, серы, кислорода или азота), R11, R12 и R13, каждый независимо, представляют атом водорода, гидроксильную группу, аминогруппу, атом галогена, цианогруппу, карбоксильную группу, алкоксикарбонильную группу, карбамоильную группу, замещенную или незамещенную моно- или диалкиламинокарбонильную группу, замещенную или незамещенную алкильную группу, замещенную или незамещенную арильную группу, замещенную или незамещенную гетероарильную группу, замещенную или незамещенную алкоксигруппу, замещенную или незамещенную моно- или диалкиламиногруппу, замещенную или незамещенную циклоалкиламиногруппу, замещенную или незамещенную алкилсульфониламиногруппу, замещенную или незамещенную арилсульфониламиногруппу, замещенную или незамещенную арилоксигруппу, замещенную или незамещенную гетероарилоксигруппу, замещенную или незамещенную бензилоксигруппу, замещенную или незамещенную алкилтиогруппу, замещенную или незамещенную циклоалкилтиогруппу, замещенную или незамещенную арилтиогруппу, замещенную или незамещенную алкилсульфонильную группу, замещенную или незамещенную циклоалкилсульфонильную группу или замещенную или незамещенную арилсульфонильную группу, или R11 и R12 либо R12 и R13 могут соединяться, образуя вместе с атомом, образующим гетероциклическую группу, с которым группы от R11 до R13 связаны, 3-7-членный циклический углеводород или гетероцикл (который может иметь в кольце 1-3 заместителя, выбранных из гидроксильной группы, атомов галогена, аминогруппы, алкильных групп, алкоксигрупп, арильных групп, арилоксигрупп, алкиламиногрупп, бензилоксигруппы и гетероарильных групп), R14 представляет атом водорода или замещенную или незамещенную низшую алкильную группу, Y представляет простую связь, -С(О)-, -С(О)NH- или неразветвленную или разветвленную двухвалентную алифатическую С1-12-углеводородную группу, которая может иметь С3-6-спирокольцо или может иметь один или несколько атомов углерода, замещенных на
-О-, -S-, -S(O)2-, -C(O)- или -NY1- (где Y1 представляет атом водорода или низшую алкильную группу), Z представляет замещенную или незамещенную ариленовую группу, замещенную или незамещенную гетероариленовую группу или замещенную или незамещенную циклоалкиленовую группу, А2 представляет простую связь, алкениленовую группу, алкиниленовую группу, -(СН2)t- или -О(СН2)v- (где t равно 1, 2 или 3 и v равно 0, 1, 2 или 3) и R10 представляет гидроксил или низшую алкоксигруппу),
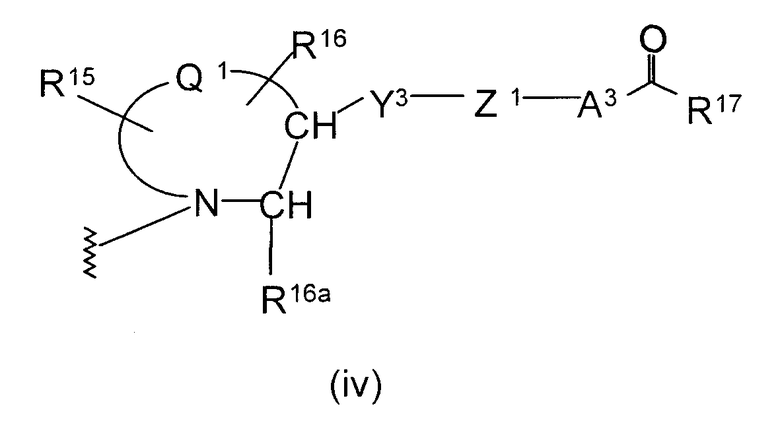
(в которой
представляет двухвалентную 4-, 5-, 6- или 7-членную гетероциклическую группу (в которой атом азота связан с Х, и Q1 представляет атом углерода, серы, кислорода или азота), R15 и R16, каждый независимо, представляют атом водорода, гидроксильную группу, атом галогена, замещенную или незамещенную алкильную группу или алкоксигруппу, R16a представляет атом водорода или замещенную или незамещенную алкильную группу, Y3 представляет
-О-, -S-, -S(O)2-, -(CH2)fO- или -NY4- (где f равно 1, 2 или 3 и Y4 представляет атом водорода или низшую алкильную группу), Z1 представляет замещенную или незамещенную ариленовую группу, замещенную или незамещенную гетероариленовую группу или замещенную или незамещенную циклоалкиленовую группу, А3 представляет простую связь, алкениленовую группу, алкиниленовую группу или -(СН2)е- (где е равно 1, 2 или 3) и R17 представляет гидроксильную группу или низшую алкоксигруппу),
(где R18 представляет -NR20- (где R20 представляет атом водорода, замещенную или незамещенную алкильную группу, замещенную или незамещенную циклоалкильную группу, замещенную или незамещенную арильную группу, замещенную или незамещенную бензильную группу, замещенную или незамещенную низшую алкенильную группу или замещенную или незамещенную алкинильную группу), Z2 представляет неразветвленную или разветвленную двухвалентную алифатическую С1-12-углеводородную группу, которая может иметь С3-6-спирокольцо, может иметь один или несколько атомов углерода, замещенных двухвалентной С3-8-циклоалкиленовой группой, или может иметь один или несколько атомов углерода, замещенных на -О-, -S-, -S(O)2-, -C(O)- или -NR21- (где R21 представляет атом водорода или замещенную или незамещенную низшую алкильную группу), Q2 представляет простую связь, замещенную или незамещенную ариленовую группу, замещенную или незамещенную гетероариленовую группу или замещенную или незамещенную циклоалкиленовую группу, L представляет простую связь, замещенную или незамещенную низшую алкиленовую группу или замещенную или незамещенную низшую алкениленовую группу и R19 представляет гидроксил или низшую алкоксигруппу)), или соль его и лекарственное средство, содержащее такое соединение.
В настоящем изобретении предложены также лекарственное средство и композиция, которые включают фармацевтически приемлемый носитель и вышеописанное соединение или его соль.
В настоящем изобретении предложено также использование вышеописанного соединения или его соли для получения лекарственного средства.
В настоящем изобретении предложен также способ лечения заболевания, вызванного клеточной адгезией, который включает введение вышеуказанного соединения или его соли.
Лучший способ осуществления изобретения
Соединение настоящего изобретения представлено вышеописанной формулой (I). Алкильная группа в формуле означает неразветвленную или разветвленную насыщенную углеводородную группу, имеющую от 1 до 12, предпочтительно, от 1 до 8 атомов углерода. Примеры ее включают метильную, этильную, пропильную, изопропильную, нормальную бутильную, изобутильную, третичную бутильную, пентильную, гептильную и октильную группы.
Низшая алкильная группа означает неразветвленную или разветвленную насыщенную углеводородную группу, имеющую от 1 до 8, предпочтительно, от 1 до 6 атомов углерода. Примеры ее включают метильную, этильную, пропильную, изопропильную, нормальную бутильную, изобутильную, третичную бутильную и пентильную группы.
Алкиленовая группа означает двухвалентную группу, образованную вышеуказанными примерами алкильной группы. Примеры ее включают метиленовую, этиленовую, пропиленовую, изопропиленовую, нормальную бутиленовую, изобутиленовую, пентиленовую, гексиленовую, гептиленовую и октиленовую группы.
Алкенильная группа означает неразветвленную или разветвленную С2-12-, предпочтительно, С2-8-группу, образованную ненасыщенным углеводородом, содержащим, по меньшей мере, одну двойную связь. Примеры ее включают винильную, пропенильную, изопропенильную, 1-бутенильную, 2-бутенильную, 1,3-бутадиенильную, 1-изобутенильную, 1-пентенильную, 1-гептенильную и 1-октенильную группы.
Алкениленовая группа означает двухвалентную группу, образованную вышеуказанной в примерах алкенильной группой. Примеры ее включают виниленовую, пропениленовую, изопропениленовую, 1-бутениленовую, 2-виниленовую, 1-изобутениленовую, 1-пентениленовую, 1-гептениленовую и 1-октениленовую группы.
Алкинильная группа означает неразветвленную или разветвленную С2-12-, предпочтительно, С2-8-группу, образованную ненасыщенным углеводородом, содержащим одну тройную связь. Примеры ее включают этинильную, пропинильную, 1-бутинильную, 2-бутинильную, 1-пентинильную, 1-гептинильную и 1-октинильную группы.
Алкиниленовая группа означает двухвалентную группу, образованную вышеуказанной в примерах алкинильной группой. Примеры ее включают этиниленовую, пропиниленовую, 1-бутиниленовую, 2-бутиниленовую, 1-пентиниленовую, 1-гептиниленовую и 1-октиниленовую группы.
Циклоалкильная группа означает циклоалкильную группу, имеющую от 3 до 10, предпочтительно, от 3 до 6 атомов углерода. Примеры ее включают циклопропильную, циклобутильную, циклопентильную и циклогексильную группу. Циклоалкиленовая группа означает двухвалентную группу, образованную указанной выше в примерах циклоалкильной группой. Циклоалкильная группа в этом случае имеет значения, указанные выше. Примеры циклоалкиленовой группы включают циклопропиленовую, циклобутиленовую, циклопентиленовую и циклогексиленовую группы.
Алифатическая углеводородная группа означает неразветвленную, разветвленную или циклическую углеводородную группу, имеющую от 1 до 18 атомов углерода, предпочтительно, от 1 до 12 атомов углерода, и она включает алкильную, циклоалкильную, алкенильную и алкинильную группы и их комбинации. Примеры ее включают этильную, пропильную, пропинильную и 2,4-гептадиенильную группы.
Арильная группа означает ароматическую моноциклическую или конденсированную углеводородную группу, имеющую от 6 до 18, предпочтительно, от 6 до 10 атомов углерода, и примеры ее включают фенильную и нафтильную группы.
Ариленовая группа означает двухвалентную группу, образованную указанной выше в примерах арильной группой, и примеры ее включают фениленовую и нафтиленовую группы.
Циклическая углеводородная группа означает насыщенную или ненасыщенную (включая ароматическую) моноциклическую группу, имеющую от 3 до 7 атомов углерода, и примеры ее включает циклопропан, циклобутан, циклопентан, циклопентен, циклогексан, циклогексен, циклогептан и бензол.
Гетероарильная группа означает одновалентную группу, образованную моноциклическим или конденсированным ароматическим гетероциклом, имеющим в качестве составной части кольца от 5 до 18 атомов, включающих, по меньшей мере, один атом кислорода, азота и/или серы, предпочтительно, группу, образованную ароматическим гетероциклом, имеющим от 5 до 14 атомов. Примеры моноциклического ароматического гетероцикла включают пиррол, 2Н-пиррол, тиофен, фуран, имидазол, пиразол, изоксазол, изотиазол, тиазол, оксазол, оксадиазол, 1,3,4-тиадиазол, триазол, тетразол, пиримидин, пиразин, пиримидин, пиридазин, 2Н-пиран и 4Н-пиран. Среди конденсированных ароматических гетероциклов примеры бициклических гетероциклов включают индол, индолизин, изоиндол, 1Н-индазол, 2Н-индазол, пурин, 4Н-хинолидин, изохинолин, хинолин, фталазин, нафтилидин, хиноксалин, хиназолин, циннолин, бензопиран, бензо[b]тиофен, 2,3-бензофуран, 3,4-бензофуран, бензоксазол, бензотиазол, бензизоксазол, бензоизотиазол, бензимидазол, бензотриазол, 1Н-пирроло(2,3-b)пиридин, 1Н-пирроло(2,3-с)пиридин, 1Н-пирроло(3,2-c)пиридин, 1Н-пирроло(3,2-b)пиридин, 3Н-пирроло(2,3-b)пиридин, 3Н-пирроло(2,3-с)пиридин, 3Н-пирроло(3,2-с)пиридин, 3Н-пирроло(3,2-b)пиридин, дигидропирроло(2,3-b)пиридин, дигидропирроло(2,3-с)пиридин, дигидропирроло(3,2-c)пиридин, дигидропирроло(3,2-b)пиридин, оксазоло(4,5-b)пиридин, оксазоло(4,5-с)пиридин, оксазоло(5,4-c)пиридин, оксазоло(5,4-b)пиридин, тиазоло(4,5-b)пиридин, тиазоло(4,5-с)пиридин, тиазоло(5,4-c)пиридин, тиазоло(5,4-b)пиридин и пиридо(1,2-а)пиримидин. Примеры трициклического ароматического гетероцикла включают карбазол, карболин, феноксазин, ксантен, ксантон, дибензофуран и дибензотиофен.
Гетероариленовая группа означает двухвалентную группу, образованную вышеуказанными примерами гетероарильной группой.
Гетероциклическая группа означает группу, образованную моноциклическим или конденсированным алифатическим или ароматическим гетероциклом, имеющим в качестве составной части от 5 до 18 атомов, предпочтительно, от 5 до 14 атомов, включая, по меньшей мере, один атом кислорода, азота и/или серы. Примеры алифатической гетероциклической группы являются схожими с указанными выше примерами гетероарильной группы. Примеры ароматической гетероциклической группы включают пирролидин, пирролин, имидазолидин, имидазолин, индолин, тетрагидрофуран, дигидрофуран, тетрагидротиофен, дигидротиофен, тиазолидин, тиазолин, оксазолин, оксазолидин, изоксазолидин, изоксазолин, пиперидин, морфолин, тиаморфолин, пиперазин, тетрагидропиран, тетрагидробензимидазол, тетрагидробензофуран, тетрагидробензотиофен, тетрагидробензотиазол, тетрагидробензоксазол, тетрагидрохинолин, тетрагидроизохинолин и тетрагидрохиназолин.
Атом галогена означает атом фтора, хлора, брома и иода.
Примеры алкоксигруппы включают метокси, этокси, пропокси, изопропокси, нормальную бутокси, изобутилокси, третичную бутокси, пентилокси, гексилокси, гептилокси и октилоксигруппы.
Низшая алкоксигруппа означает неразветвленную или разветвленную алкоксигруппу, имеющую от 1 до 8, предпочтительно, от 1 до 6 атомов углерода и примеры ее включают метокси, этокси, пропокси, изопропокси, нормальную бутокси, изобутилокси, третичную бутокси, пентилокси и гексилоксигруппы.
Примеры арилоксигруппы включают фенокси и нафтилоксигруппы.
Примеры гетероарилоксигруппы включают пиридилокси- и индолоксигруппы.
Примеры алкилтиогруппы включают метилтио, этилтио, пропилтио, изопропилтио, нормальную бутилтио, изобутилтио, третичную бутилтио, пентилтио, гексилтио, гептилтио и октилтиогруппы.
Примеры циклоалкилтиогруппы включают циклопропилтио, циклобутилтио, циклопентилтио, циклогексилтио и циклооктилтиогруппы.
Примеры арилтиогруппы включают фенилтио и нафтилтиогруппы.
Примеры алкилсульфонильной группы включают метилсульфонильную, этилсульфонильную, пропилсульфонильную, изопропилсульфонильную, нормальную бутилсульфонильную, изобутилсульфонильную, третичную бутилсульфонильную, пентилсульфонильную, гексилсульфонильную, гептилсульфонильную и октилсульфонильную группы.
Примеры циклоалкилсульфонильной группы включают циклопропилсульфонильную, циклобутилсульфонильную, циклопентилсульфонильную, циклогексилсульфонильную и циклооктилсульфонильную группы.
Примеры арилсульфонильной группы включают фенилсульфонильную и нафтилсульфонильную группы.
Нижеследующие группы являются конкретными примерами W-R-X- в формуле (I).



В соединении, представленном формулой (I), W означает группу формулы: WA-A1-WB.
В формуле WA представляет замещенную или незамещенную арильную группу или замещенную или незамещенную одновалентную гетероциклическую группу. Эта арильная группа является одинаковой с вышеуказанной арильной группой, причем особенно предпочтительной является фенильная группа. Гетероциклической группой, предпочтительно, является одновалентная группа, образованная, например, из пиридина, тиазола, пиримидина, пиррола, индола, изохинолина, хинолина, индолина, тетрагидрохинолина, индазола, бензизотиазола, бензизоксазола, бензотиазола или бензоксазола. Примеры заместителя для арильной группы или гетероциклической группы включают низшие алкильные группы, низшие алкоксигруппы, атомы галогена, аминогруппу и гидроксильную группу. Арильная группа или гетероциклическая группа может быть замещена, по меньшей мере, одним из этих заместителей.
WB представляет замещенную или незамещенную ариленовую группу или замещенную или незамещенную двухвалентную гетероциклическую группу. Эта ариленовая группа является сходной с вышеуказанной ариленовой группой, причем особенно предпочтительной является фениленовая группа. Гетероциклической группой, предпочтительно, является двухвалентная группа, образованная, например, из пиридина, тиазола, пиримидина, пиррола, индола, изохинолина, хинолина, индолина, тетрагидрохинолина, бензотиазола или бензоксазола. Примеры заместителя для ариленовой группы или гетероциклической группы включают низшие алкильные группы, низшие алкоксигруппы, атомы галогена, аминогруппу и гидроксильную группу. Ариленовая группа или гетероциклическая группа может быть замещена, по меньшей мере, одним из этих заместителей.
А1 представляет -NR1-, простую связь, -С(О)-, -С(О)NR1-, замещенную или незамещенную виниленовую группу, этиниленовую группу, -CR1aR1b-O, -CR1a=CR1b-C(O)NR1 или -CR1a=CR1b-C(O)- (в которой R1 представляет атом водорода или низшую алкильную группу и R1a и R1b, каждый независимо, представляет атом водорода или низшую алкильную группу), из которых предпочтительными являются простая связь, -NH-, -C(O)NH-.
Группа формулы: WA-A1-WB, предпочтительно, представляет группу следующей формулы (i) или (ii)
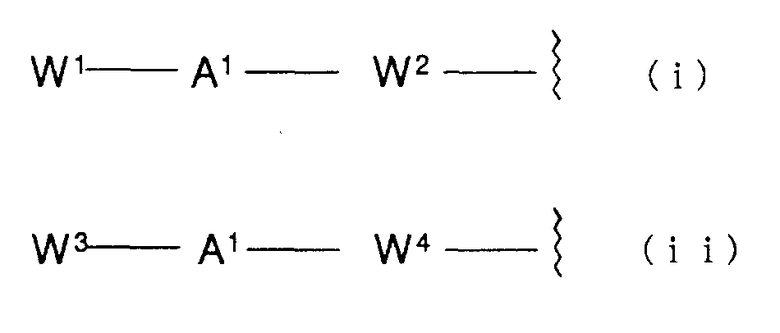
В формуле (i) W1 представляет замещенную или незамещенную арильную группу или замещенную или незамещенную одновалентную гетероциклическую группу, и предпочтительными группами являются такие группы, примеры которых приводятся выше в WA. Особенно предпочтительные примеры включают фенильную, пиридильную, индолильную, изохинолинильную, индолинильную, тетрагидрохинолинильную и бензоксазолильную группы, и каждая из фенильной, пиридильной, индолильной, изохинолинильной, индолинильной, тетрагидрохинолинильной, индазолильной, бензизотиазолильной, бензизоксазолильной, бензотиазолильной и бензоксазолильной групп замещена низшей алкильной группой, низшей алкоксигруппой или атомом галогена. W2 представляет замещенную или незамещенную двухвалентную бициклическую гетероциклическую группу и, особенно предпочтительной является группа, представленная следующей формулой (i-a), (i-b) или (i-c).

В вышеуказанных формулах Х1 представляет атом кислорода или серы, причем, особенно предпочтительным является атом кислорода.
R2 и R3, каждый независимо, представляет атом водорода, атом галогена, низшую алкильную группу, гидроксильную группу, низшую алкоксигруппу или аминогруппу, из которых особенно предпочтительными являются атом водорода, атом галогена, низшая алкильная группа или низшая алкоксигруппа.
С правой стороны вышеуказанной формулы (i-a), (i-b) или (i-c) связь с R является предпочтительной и указанная связь является, предпочтительно, связью с R в пара-положении кольца бензола относительно атома азота в формуле (i-a), (i-b) или (i-c).
В формуле (ii) W3 представляет замещенную или незамещенную одновалентную бициклическую гетероциклическую группу. Предпочтительными в качестве W3 являются группы, представленные следующими формулами от (ii-a) до (ii-j).
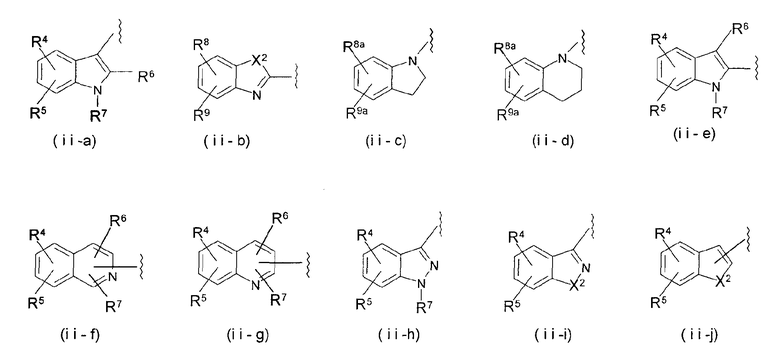
В формуле Х2 представляет атом кислорода или серы, причем особенно предпочтительным является атом кислорода.
R4, R5, R8, R9, R8a и R9a, каждый независимо, представляют атом водорода, атом галогена, низшую алкильную группу, гидроксильную группу, низшую алкоксигруппу или аминогруппу, из которых предпочтительным является атом водорода, атом галогена, низшая алкильная группа или низшая алкоксигруппа.
Из них особенно предпочтительными являются группы формул (ii-a), (ii-b), (ii-h) и (ii-i).
W4 представляет замещенную или незамещенную ариленовую группу или замещенную или незамещенную двухвалентную моноциклическую гетероциклическую группу, предпочтительно, фениленовую группу, пиридиленовую группу или фениленовую или пиридиленовую группу, замещенную низшей алкильной группой, низшей алкоксигруппой или атомом галогена.
А1 и R1, предпочтительно, присоединены в пара-положении на фениленовой или пиридиленовой группе.
R представляет простую связь, -NH-, -OCH2-, алкениленовую группу или -(СН2)n- (где n равно 1 или 2), из которых особенно предпочтительной является -СН2-.
Х представляет -С(О)-, -СН2- или -S(O)2-, причем особенно предпочтительной является -С(О)-.
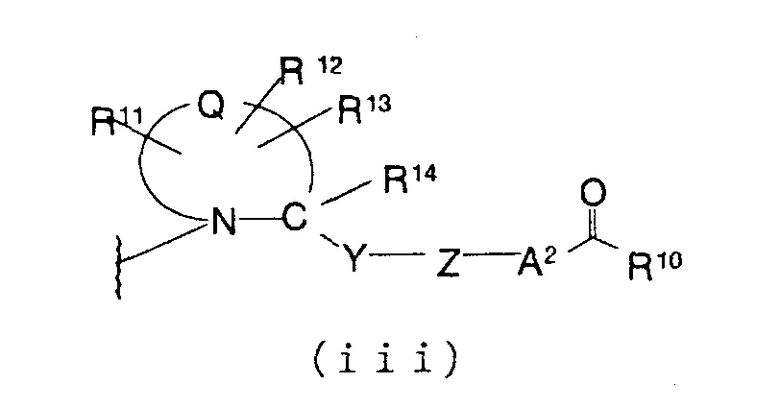
В соединении, представленном формулой (I), М представляет описанную ниже группу формулы (iii), (iv) или (v).
Формула (iii):
Конкретные примеры групп формулы (iii-b):
в формуле (iii) приводятся ниже
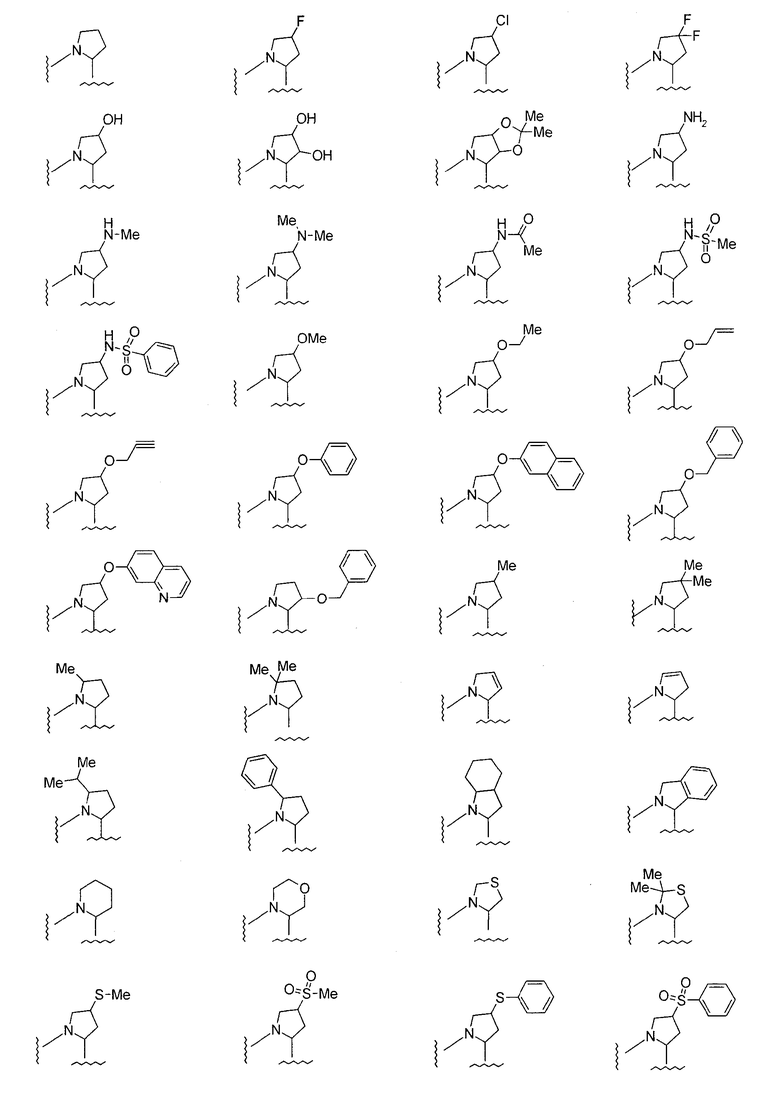
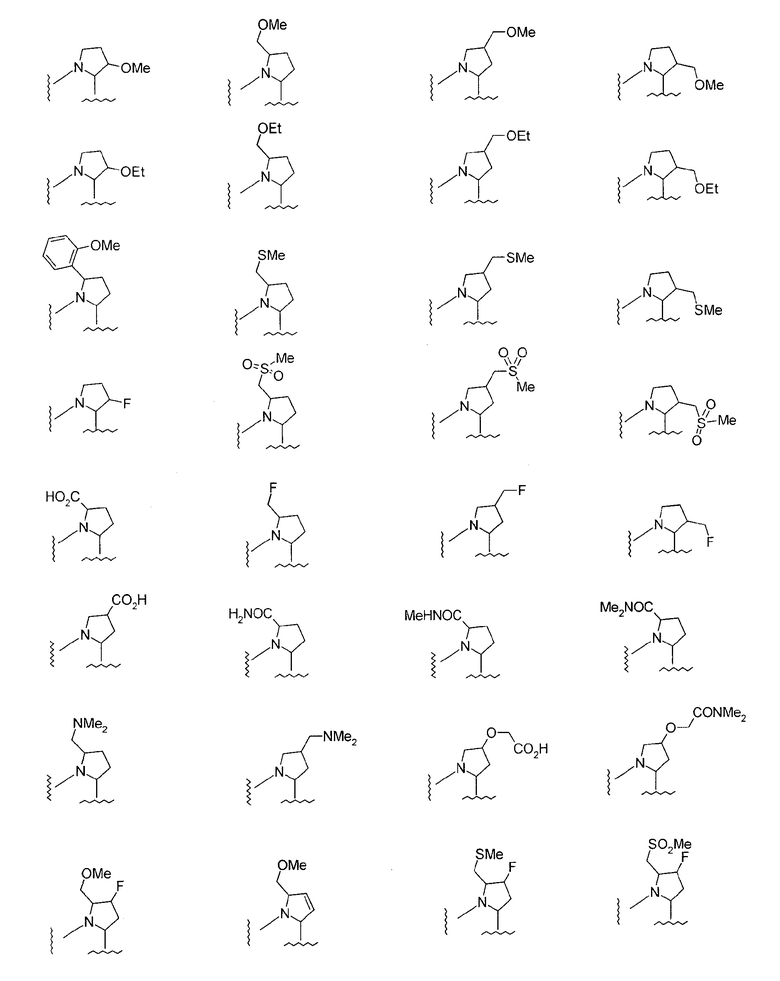
В этой формуле
представляет двухвалентную 4-, 5-, 6- или 7-членную гетероциклическую группу, предпочтительной из которых является 5- или 6-членная гетероциклическая группа, имеющая в качестве Q атом углерода, кислорода или азота, причем особенно предпочтительной является двухвалентная группа, образованная кольцом пирролидина.
Здесь, когда Q представляет двухвалентную группу, образованную кольцом пирролидина, наиболее предпочтительно, чтобы абсолютная конфигурация 2-положения, с которым связана группа -Y-Z-A2-C(O)-R10, была равна конфигурации природного L-пролина.
R11, R12 и R13, каждый независимо, представляют атом водорода, гидроксильную группу, аминогруппу, атом галогена, цианогруппу, карбоксильную группу, алкоксикарбонильную группу, карбамоильную группу, замещенную или незамещенную моно- или диалкиламинокарбонильную группу, замещенную или незамещенную алкильную группу, замещенную или незамещенную арильную группу, замещенную или незамещенную гетероарильную группу, замещенную или незамещенную алкоксигруппу, замещенную или незамещенную моно- или диалкиламиногруппу, замещенную или незамещенную циклоалкиламиногруппу, замещенную или незамещенную алкилсульфониламиногруппу, замещенную или незамещенную арилсульфониламиногруппу, замещенную или незамещенную арилоксигруппу, замещенную или незамещенную гетероарилоксигруппу, замещенную или незамещенную бензилоксигруппу, замещенную или незамещенную алкилтиогруппу, замещенную или незамещенную циклоалкилтиогруппу, замещенную или незамещенную арилтиогруппу, замещенную или незамещенную алкилсульфонильную группу, замещенную или незамещенную циклоалкилсульфонильную группу или замещенную или незамещенную арилсульфонильную группу, или R11 и R12 или R12 и R13 могут быть соединены, образуя вместе с атомом, образующим гетероциклическую группу, с которым связаны группы от R11 до R13, 3-7-членный циклический углеводород или гетероцикл (гетероцикл может иметь в кольце 1-3 заместителя, выбранных из гидроксильной группы, атомов галогена, аминогруппы, алкильных групп, алкоксигрупп, арильных групп, арилоксигрупп, алкиламиногрупп, бензилоксигруппы и гетероарильных групп).
Примеры алкильной, арильной, гетероарильной и алкоксигрупп являются схожими с такими группами, описанными выше. Примеры моно- или диалкиламиногруппы включает монометиламино, моноэтиламино, изопропиламино, диметиламино и диэтиламиногруппы. Примеры циклоалкиламиногруппы включают циклопропиламино, циклобутиламино и циклопентиламиногруппы; примеры алкилсульфониламиногруппы включают метансульфониламино, трифторметансульфониламино и этансульфониламиногруппы и примеры арилсульфониламиногруппы включают бензолсульфониламино и нафтилсульфониламиногруппы. Примеры заместителя для них включают атомы галогена, низшие алкильные группы, низшие алкоксигруппы, гидроксильную группу, аминогруппу, ациламиногруппы и алкиламиногруппы.
В случае, когда R11 и R12 или R12 и R13 соединяются с образованием 3-7-членного циклического углеводорода или гетероцикла вместе с атомом, составляющим гетероциклическую группу, с которым связаны R11 - R13, примеры таким образом образованного кольца включают кольцо дигидроиндола, кольцо тетрагидроиндола, кольцо изоиндолина и кольцо тетрагидроизохинолина.
Предпочтительно, чтобы любой из R11, R12 и R13 представлял гидроксильную группу, замещенную или незамещенную алкоксигруппу, замещенную или незамещенную алкильную группу или атом галогена. Особенно предпочтительной является метоксильная группа, метоксиметильная группа или атом фтора.
R14 представляет атом водорода или замещенную или незамещенную алкильную группу, из которых предпочтительным является атом водорода и метильная группу, особенно предпочтительным является атом водорода.
В формуле (iii) Y представляет простую связь, -С(О)-,
-С(О)NH- или неразветвленную или разветвленную двухвалентную алифатическую С1-12-углеводородную группу, которая может иметь С3-6-спирокольцо или может иметь один или несколько атомов углерода, замещенных на -О-, -S-. -S(O)2-, -C(O)- или -NY1- (где Y1 представляет атом водорода или низшую алкильную группу). Примеры неразветвленной или разветвленной двухвалентной алифатической углеводородной группы, образованной 1-12 атомами углерода, включают метиленовую, этиленовую, пропиленовую, изопропиленовую, 2,2-диметилбутиленовую и 3,3-диметилпентиленовую группу. Когда алифатическая углеводородная группа образует спирокольцо, образованное 3-6 атомами углерода, образовавшееся кольцо представляет собой, например, циклопропан, циклобутан или циклогексан.
Из них в качестве Y предпочтительными являются -СН2О-,
-CH2S-, -CH2S(O)2-, -(CH2)2-, -CH=CH-, -C≡C- или -СН2NY1-, особенно, -СН2О-.
Z представляет замещенную или незамещенную ариленовую группу, замещенную или незамещенную гетероариленовую группу или замещенную или незамещенную циклоалкиленовую группу. Эти ариленовые, гетероариленовые и циклоалкиленовые группы являются сходными с группами, примеры которых приводятся выше. Примеры заместителя для них включают низшие алкильные группы, низшие алкоксигруппы, атомы галогена, гидроксильную группу, аминогруппу и алкиламиногруппы. В качестве Z предпочтительными являются фениленовая, пиридиленовая и циклогексиленовая группы, причем особенно предпочтительной является циклогексиленовая группа. Когда Z представляет циклогексиленовую группу, наиболее предпочтительно, чтобы относительная конфигурация групп -Y- и -А2-, являющихся заместителями на кольце циклогексана, была 1,4-транс-конфигурацией.
А2 представляет простую связь, алкениленовую группу, алкиниленовую группу, -(СН2)t- или -О(СН2)v- (где t равно 1, 2 или 3 и v равно 0, 1, 2 или 3), из которых особенно предпочтительной является простая связь.
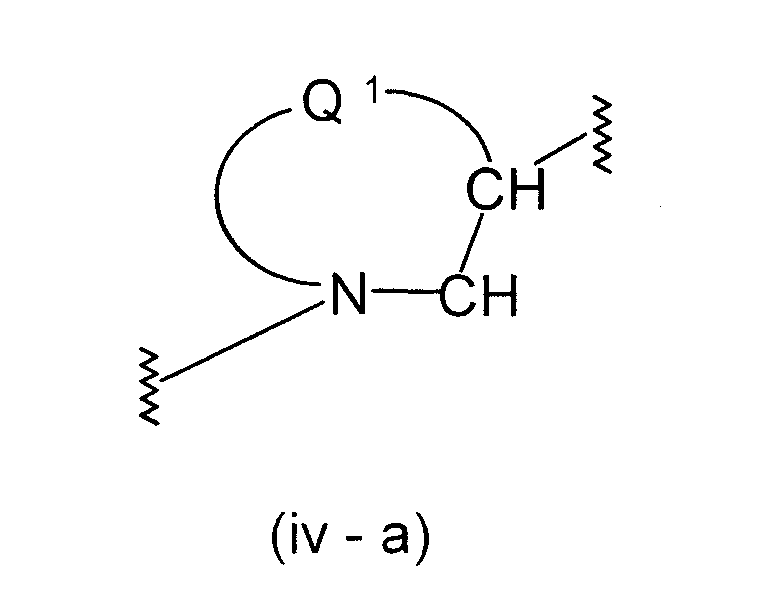
Формула (iv):

Конкретными примерами групп формулы (iv-b)
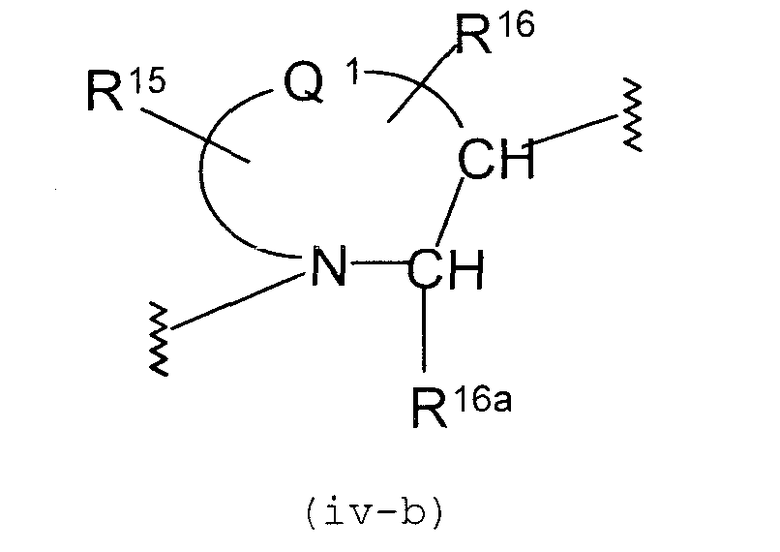
в формуле (iv) являются нижеуказанные примеры:
В вышеуказанной формуле
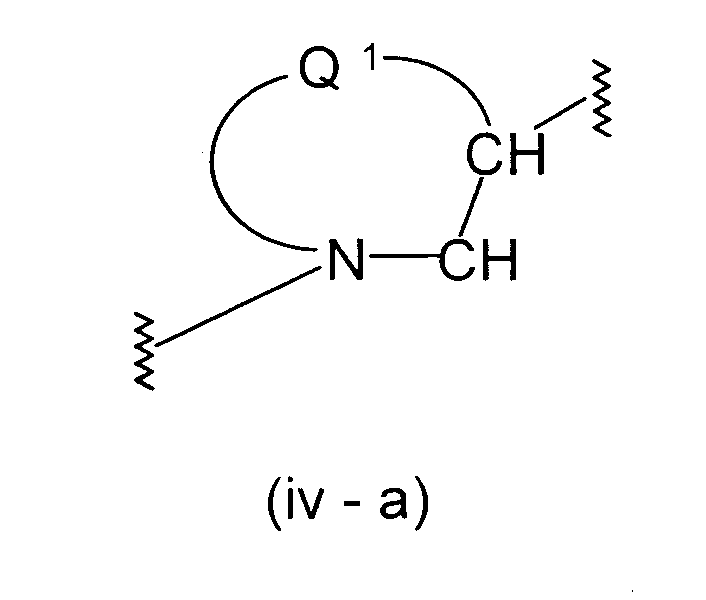
представляет двухвалентную 4-, 5-, 6- или 7-членную гетероциклическую группу, где 5- или 6-членная гетероциклическая группа, имеющая в качестве Q1 атом углерода, кислорода или азота, является предпочтительной, причем особенно предпочтительной является двухвалентная группа, образованная кольцом пирролидина.
R15 и R16, каждый независимо, представляет атом водорода, гидроксильную группу, атом галогена, замещенную или незамещенную алкильную группу или алкоксигруппу, где предпочтительной является атом галогена, замещенная или незамещенная алкильная группа или алкоксигруппа, причем особенно предпочтительным является атом фтора, метоксильная группа или метоксиметильная группа.
Y3 представляет -О-, -S-, -S(O)2-, -(CH2)fО- или -NY4- (где f равно 1, 2 или 3 и Y4 представляет атом водорода или низшую алкильную группу), причем особенно предпочтительной является -О- или -СН2О-.
Z1 представляет замещенную или незамещенную ариленовую группу, замещенную или незамещенную гетероариленовую группу или замещенную или незамещенную циклоалкиленовую группу. Приведенные выше примеры в Z являются предпочтительными.
А2 представляет простую связь, алкениленовую группу, алкиниленовую группу или -(СН2)е- (где е равно 1, 2 или 3), где простая связь является особенно предпочтительной.
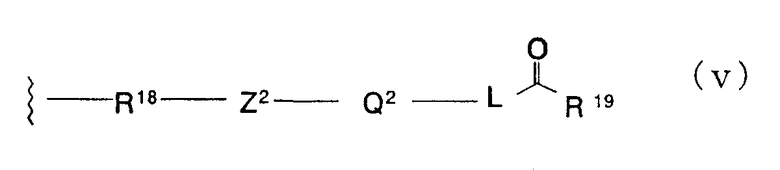
Формула (v):
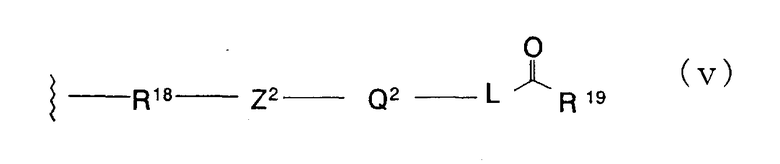
В формуле (v) R18 представляет -NR20- и R20 представляет атом водорода, замещенную или незамещенную алкильную группу, замещенную или незамещенную циклоалкильную группу, замещенную или незамещенную арильную группу, замещенную или незамещенную бензильную группу, замещенную или незамещенную низшую алкенильную группу или замещенную или незамещенную алкинильную группу. Эти алкильные, циклоалкильные, арильные, низшие алкенильные и алкинильные группы являются сходными с группами, примеры которых приведены выше. Заместители для них включают алкоксигруппы, алкильные группы, атомы галогена и гидроксильную группу.
В качестве R20 предпочтительными являются замещенные или незамещенные алкильные группы, замещенные или незамещенные алкенильные группы и замещенные или незамещенные алкинильные группы, причем особенно предпочтительными являются метильная группа, 2-фторметильная группа, аллильная группа и пропаргильная группа.
Z2 представляет неразветвленную или разветвленную двухвалентную алифатическую С1-12-углеводородную группу, которая может иметь С3-6-спирокольцо и может иметь один или несколько атомов углерода, замещенных двухвалентной С3-8-циклоалкиленовой группой, или может иметь один или несколько атомов углерода, замещенных на -О-, -S-. -S(O)2-, -C(O)- или -NR21- (где R21 представляет атом водорода или замещенную или незамещенную низшую алкильную группу). В качестве Z2 предпочтительными являются вышеуказанные примеры групп в Y формулы (iii).
Q2 представляет простую связь, замещенную или незамещенную ариленовую группу, замещенную или незамещенную гетероариленовую группу или замещенную или незамещенную циклоалкиленовую группу. В качестве Q2 предпочтительными являются вышеуказанные примеры групп в Z.
L представляет простую связь, замещенную или незамещенную низшую алкиленовую группу или замещенную или незамещенную низшую алкениленовую группу. Низшая алкиленовая и низшая алкениленовая группы сходны с группами, описанными выше, и заместители для них включают низшие алкильные группы и атомы галогена. В качестве L предпочтительными являются простая связь и низшая алкениленовая группа.
В качестве М предпочтительной является группа формулы (iii) или (iv). В случае, когда Z представляет циклогексиленовую группу и А2 представляет простую связь в формуле (iii), группа формулы (iii-c) является предпочтительной.
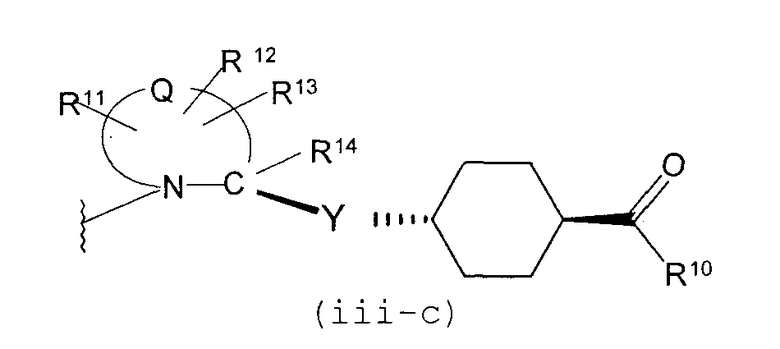
Особенно предпочтительной является группа формулы (iii-d).
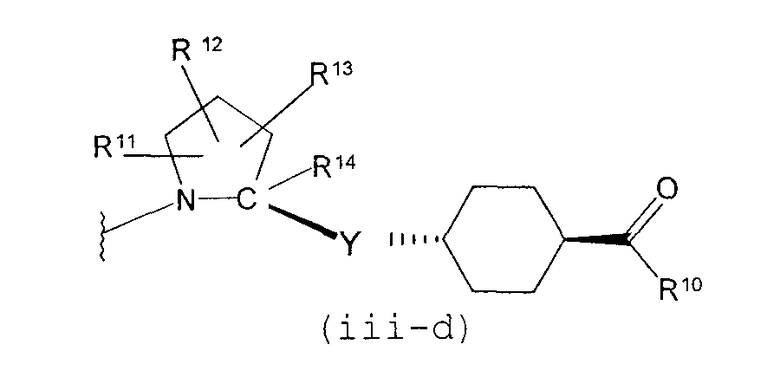
В случае, когда Z1 представляет циклоалкиленовую группу и А3 представляет простую связь в формуле (iv), группа формулы (iv-c) является предпочтительной.
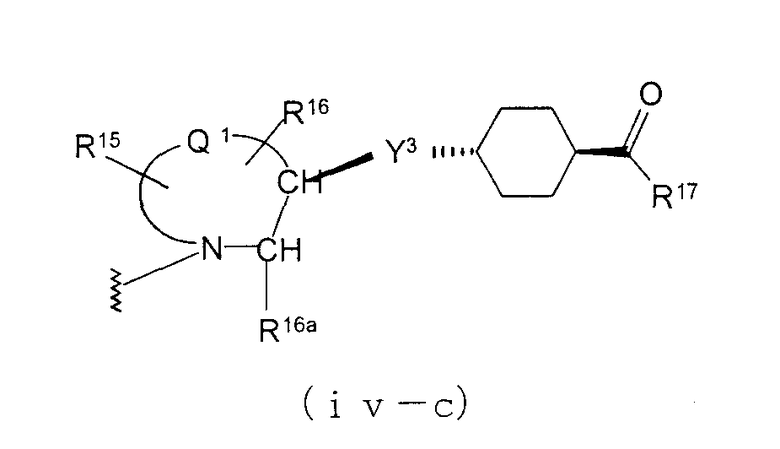
Особенно предпочтительной является группа формулы (iv-d).
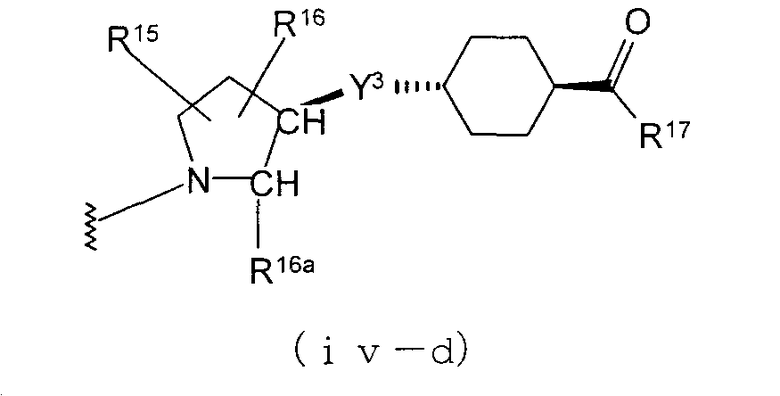
В качестве М особенно предпочтительной является группа формулы (iii).
Соединения (I) изобретения можно превратить в их физиологически приемлемые соли, если нужно, с использованием неорганической кислоты, такой как хлористоводородная кислота, серная кислота или фосфорная кислота, или органической кислоты, такой как муравьиная кислота, уксусная кислота или метансульфоновая кислота. Когда соединения (I) изобретения имеют кислотную группу, такую как карбоксильная группа, можно обычно образовывать основно-аддитивные соли. В качестве физиологически приемлемых солей возможными являются либо органические соли либо неорганические соли. Предпочтительные примеры включают соли щелочных металлов, такие как соль лития, соль натрия и соль калия, соли щелочноземельных металлов, такие как соль магния и соль кальция, соль аммония, соль триэтиламина, соль N-метилглюкамина и соль трис(гидроксиметил)аминометана.
Соединения изобретения в свободной форме или форме соли может существовать в виде сольвата.
Для сольвата конкретное ограничение не вводится, поскольку он является фармацевтически приемлемым сольватом. Конкретные примеры включают гидраты и этаноляты. Когда соединения (I) изобретения содержат атом азота, они могут существовать в виде форм их N-оксидов. Эти сольваты и формы N-оксидов также включены в настоящее изобретение.
В зависимости от вида или комбинации заместителей, соединения (I) изобретения или их соли образуют различные изомеры, например, геометрические изомеры, такие как цис-изомеры и транс-изомеры, и оптические изомеры, такие как d-изомеры и l-изомеры. Настоящее изобретение включает все эти стерические изомеры и их смеси при любом отношении.
Соединения изобретения можно синтезировать, например, по любой одной из нижеописанных схем от (схемы 1) до (схемы 18).
Соединения формулы (I), где X представляет -С(О)-, можно получить реакцией сочетания карбоновой кислоты (1) и циклического амина (2), (3) или его соли или нециклического амина (4) или его соли (на схеме
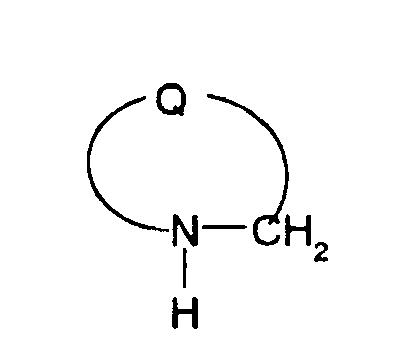
представляет 4-, 5-, 6- или 7-членный циклический амин и W, R, R11, R12, R13, R14, R15, R16, R16a, Y, Y1, Z, Z1, A2, A3, R10, R17, R20, Z2, Q2, L и R19 имеют такие же значения, как указаны выше).
Когда в соединении формулы (2), (3) или (4) R10, R17 или R19 представляет низшую алкоксигруппу, соединения, полученные вышеописанной реакцией сочетания, можно превратить в соединение соответствующей карбоновой кислоты щелочным гидролизом.
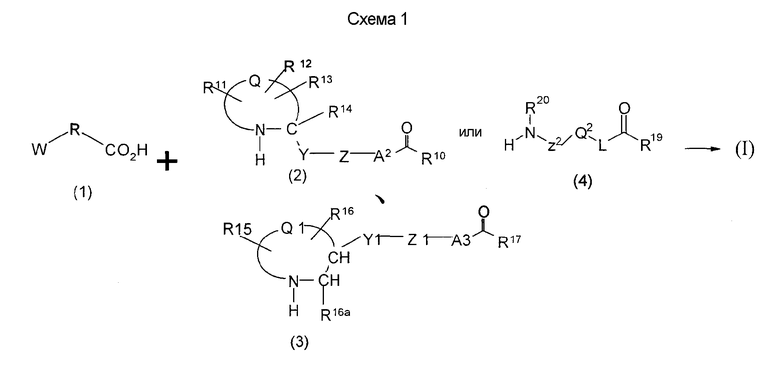
Соединение (I) на (схеме 1) можно получить известным способом. Соединение формулы (I) можно получить взаимодействием карбоновой кислоты (1) с циклическим амином (2) или (3) или нециклическим амином (4) по известному способу конденсации с использованием агента конденсации, такого как гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида, N,N-дициклогексилкарбодиимид или N,N-карбонилдиимидазол или его аналог, в инертном галогенированном углеводородной растворителе, таком как метиленхлорид, инертном углеводородном растворителе, таком как толуол, инертном растворителе типа простого эфира, таком как тетрагидрофуран, или инертном полярном растворителе, таком как N,N-диметилформамид, при температурном интервале от -20°С до точки кипения растворителя, предпочтительно, от 0°С до комнатной температуры. Эту реакцию можно также проводить в присутствии органического аминного основания, такого как триэтиламин или 4-диметиламинопиридин, или органического аминного основания и 1-гидроксибензотриазола.
На описанных ниже схемах от (схемы 1А) до (схемы 4) будет указан способ синтеза карбоновой кислоты (1), используемой в качестве исходного материала для вышеописанной реакции (в схемах Х1, R, R4, R5, W1, W2, W3 и W4 имеют такие же значения, как описаны выше, R23, каждый независимо, представляет атом водорода, атом галогена, низшую алкильную группу, гидроксильную группу, замещенную или незамещенную низшую алкоксигруппу или аминогруппу, R22 представляет низшую алкильную группу или бензильную группу и R24 представляет низшую алкильную группу).
На нижеописанной (схеме 1А) и (схеме 1В) указан способ получения соединения формулы (I), где А1 представляет простую связь.
Соединения формул (1А-5) и (1В-5) можно получить известным способом. Соединение (1А-4) можно получить, например, нагреванием и кипячением с обратным холодильником, в присутствии кислоты, такой как борная кислота, в инертном углеводородном растворителе, таком как ксилол, соединения формулы (1А-1), которое является коммерчески доступным или его можно легко получить известным способом, предпочтительно, соединения формулы (1А-2), которое было получено действием галогенангидрида кислоты, такого как оксалилхлорид, тионилхлорид, трихлорид фосфора или пентахлорид фосфора, предпочтительно, оксалилхлорида или тионилхлорида, и каталитического количества N,N-диметилформамида, на соединение (1А-1) в инертном галогенированном углеводородном растворителе, таком как метиленхлорид, инертном углеводородном растворителе, таком как толуол, или инертном растворителе типа простого эфира, таком как тетрагидрофуран, при температурном диапазоне от -20°С до точки кипения растворителя, вместе с соединением формулы (1А-3) (M. Tetrashima et al., Synthesis, 484 (1982)). Соединение (1А-4) также можно получить, когда радикал карбоновой кислоты формулы (1А-4) является формильным радикалом, посредством реакции циклизации с использованием Ph-I(OAc)2 (M.H. Jung et al., J. Med. Chem., 9, 56 (1999)). Карбоновую кислоту (1А-5) затем можно получить щелочным гидролизом эфирной части образовавшегося соединения известным способом. В случае бензилового сложного эфира целевой продукт можно получить, вместо вышеописанного щелочного гидролиза, каталитическим гидрированием для удаления бензильной части.
Соединение формулы (1В-4) можно получить проведением реакции нуклеофильного замещения соединения формулы (1В-1) или (1В-2) (где -Н связан с атомом азота азотсодержащего гетероцикла) и соединения формулы (1В-3) в инертном углеводородном растворителе, таком как ксилол, при температурном интервале от комнатной температуры до точки кипения растворителя. Эту реакцию можно проводить в присутствии органического основания, такого как триэтиламин, или неорганического основания, такого как карбонат калия. Реакцию можно проводить без растворителя при температурном интервале от комнатной температуры до 200°С.Посредством гидролиза или каталитического гидрирования образовавшегося соединения формулы (1В-4), как указано на (схеме 1А), можно получить соединение формулы (1В-5).


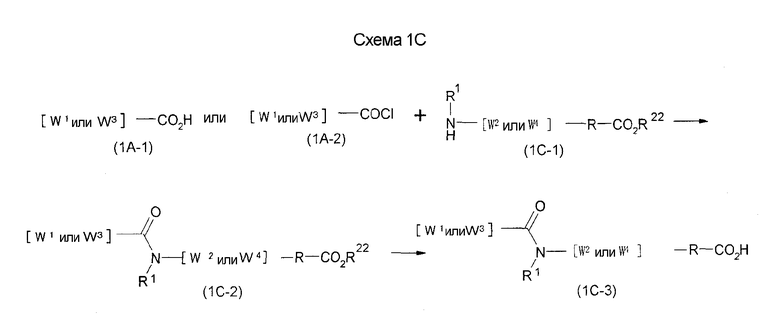
Нижеописанная (схема 1С) представляет собой способ получения соединения формулы (I), в которой А1 представляет -С(О)NR1-.
Соединение формулы (1С-3) можно получить известным способом. Например, соединение формулы (1С-2) можно получить взаимодействием соединения (1А-2), как указано на вышеописанной (схеме 1А), с соединением формулы (1С-1) в инертном галогенированном углеводородном растворителе, таком как метиленхлорид, инертном углеводородном растворителе, таком как толуол, или инертном растворителе типа простого эфира, таком как тетрагидрофуран, при температурном интервале от -20°С до точки кипения растворителя, предпочтительно, от комнатной температуры до точки кипения растворителя, в присутствии органического основания, такого как триэтиламин. В альтернативном случае соединение формулы (1С-2) можно получить взаимодействием соединения (1А-1), указанного в вышеописанной (схеме 1А), с соединением формулы (1С-1) с использованием агента конденсации, такого как гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида, N,N-дициклогексилкарбодиимид или N,N-карбонилдиимидазол или его аналог, в инертном галогенированном углеводородном растворителе, таком как метиленхлорид, инертном углеводородном растворителе, таком как толуол, инертном растворителе типа простого эфира, таком как тетрагидрофуран, или инертном полярном растворителе, таком как N,N-диметилформамид, при температурном интервале от -20°С до точки кипения растворителя. Эту реакцию можно проводить в присутствии органического аминного основания, такого как триэтиламин или 4-диметиламинопиридин, или неорганического основания и 1-гидроксибензотриазола. Соединение формулы (1С-3) можно получить посредством гидролиза или каталитического гидрирования образовавшегося соединения формулы (1С-2), как указано на (схеме 1А).
Нижеуказанная (схема 1D) является способом получения соединения формулы (I), в которой А1 представляет -С(О)- (в схеме -Н каждого из соединений (1D-2), (1D-5) и (1D-7) связан с атомом азота азотсодержащего гетероцикла).
Соединение формулы (1D-4) можно получить известным способом. Например, соединение формулы (1D-1) получают воздействием фосгена или эквивалента фосгена, такого как трифосген, на соединение (1 В-2), показанное на (схеме 1 В), в инертном галогенированном углеводородном растворителе, таком как метиленхлорид, инертном углеводородном растворителе, таком как толуол, или инертном растворителе типа простого эфира, таком как тетрагидрофуран, при температурном диапазоне от -20°С до точки кипения растворителя, предпочтительно, от -20°С до комнатной температуры. Затем на соединение (1D-1) воздействуют соединением формулы (1D-2), посредством чего можно получить соединение формулы (1D-3). Соединение формулы (1D-3) можно получить также аналогичным способом получением соединения формулы (1D-6) из соединения формулы (1D-5) и затем взаимодействием образовавшегося соединения с соединением формулы (1D-7). Соединение (1D-3) можно получить также воздействием N,N-карбонилдиимидазола на соединение формулы (1 В-2) или (1D-5) в инертном полярном растворителе, таком как N,N-диметилформамид, при температурном диапазоне от -20°С до точки кипения растворителя с последующим добавлением соединения (1D-2) в случае соединения (1 В-2) или соединения (1D-7) в случае соединения (1D-5) для проведения реакции. Соединение формулы (1D-3) затем подвергают гидролизу или каталитическому гидрированию, как показано на (схеме 1А), в результате чего можно получить соединение формулы (1D-4).

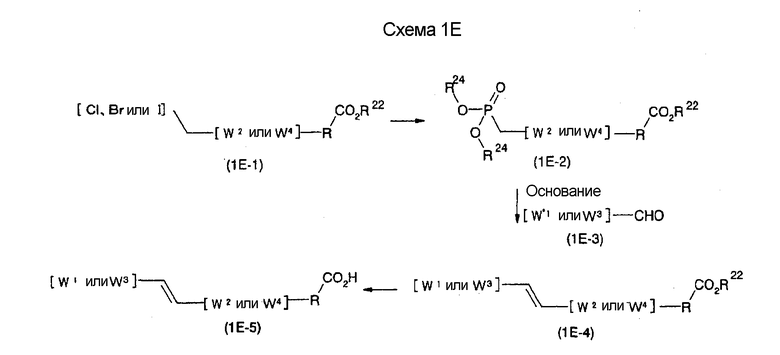
На нижеописанной (схеме 1Е) показано соединение формулы (I), где А1 представляет винилен.
Соединение формулы (1Е-4) на (схеме 1Е) можно получить реакций Виттига-Хорнера. Например, соединение формулы (1Е-4) можно получить воздействием триалкилфосфитного эфира на соединение формулы (1Е-1), которое является коммерчески доступным или которое можно легко получить известным способом, без применения растворителя при температурном интервале от комнатной температуры до 200°С с получением соответствующего диалкилфосфитного эфира (1Е-2); воздействием на него основания, такого как гидрид натрия, гексаметилдисилазан лития или метоксид натрия, в инертном спиртовом растворителе, таком как этанол, инертном углеводородном растворителе, таком как толуол, инертном растворителе типа простого эфира, таком как тетрагидрофуран, или инертном полярном растворителе, таком как диметилсульфоксид, при температурном интервале от -78°С до точки кипения растворителя, предпочтительно, от -20°С до комнатной температуры, с получением карбаниона и воздействием соединения формулы (1Е-3), которое является коммерчески доступным или которое можно легко получить известным способом, на карбанион. Соединение формулы (1Е-5) можно получить щелочным гидролизом образовавшегося соединения формулы (1Е-4).
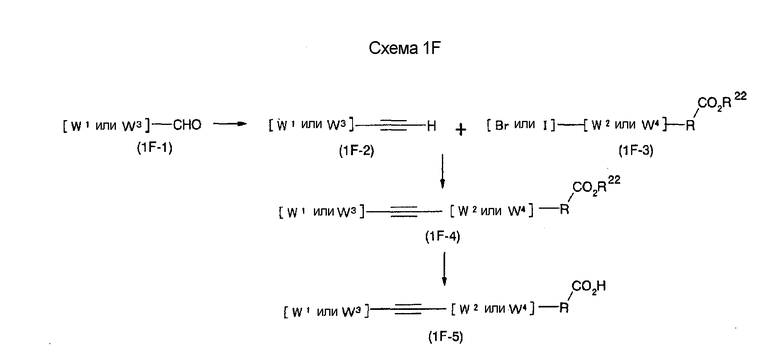
На нижеописанной (схеме 1F) указывается соединение формулы (I), где А представляет этинилен.
Соединение формулы (IF-4) можно получить известным способом. Например, соединение формулы (1F-1), которое является коммерчески доступным или которое можно легко получить известным способом, вводят в соответствующий дигалогенолефин по способу Corey и затем на образовавшееся соединение воздействуют литийорганическим соединением, таким как бутиллитий, посредством чего можно получить соединение формулы (1F-2). В альтернативном случае соединение формулы (1F-2) можно получить взаимодействием соединения (1F-1) с карбанионом, легко доступным из триметилсилилдиазометана и литийорганического соединения, с последующей перегруппировкой (Y. Ito et al., Synlett, 1163 (1997)). Затем проводят реакцию углерод-углеродного сочетания типа Heck с соединением формулы (1F-3), в результате чего можно получить соединение формулы (1F-4) (T. Eckert et al., Synth. Commun., 28, 327 (1998)). Соединение формулы (1F-5) можно получить щелочным гидролизом образовавшегося соединения формулы (1F-4).
На нижеописанных схемах от (схемы 2) до (схемы 4) указывается соединение формулы (I), в которой А1 представляет -NR1.
Соединение формулы (1а) на нижеописанной (схеме 2) можно получить известным способом. Например, производное анилина (6), которое известно само по себе или которое можно получить известным способом, и производное тиоизоцианата (7), которое является коммерчески доступным или которое можно получить известным способом, или ксантатное производное (8), которое можно получить известным способом, обрабатывают в инертном галогенированном углеводородном растворителе, таком как метиленхлорид, инертном углеводородном растворителе, таком как толуол, инертном растворителе типа простого эфира, таком как тетрагидрофуран, или инертном спиртовом растворителе, таком как этанол, при температурном интервале от -20°С до точки кипения растворителя, предпочтительно, от 0°С до комнатной температуры, в результате чего можно получить соответствующее производное тиомочевины (9). Известным способом образовавшееся соединение затем обрабатывают КО2 или Ni2O3, предпочтительно, оксидом ртути(II) (желтым), каждое из которых является коммерчески доступным, в инертном углеводородном растворителе, таком как толуол, инертном растворителе типа простого эфира, таком как тетрагидрофуран, или инертном полярном растворителе, таком как N,N-диметилформамид, при температурном интервале от -20°С до точки кипения растворителя, предпочтительно, от комнатной температуры до точки кипения растворителя, в результате чего можно получить соответствующие соединения с замкнутым кольцом (10) (A. Koshiro et al., Chem.Pharm.Bull., 1, 725 (1959); H.Ogura et al., ibid., 29, 1518 (1981); H.S.Chan et al., Chem.Lett., 1291 (1986)). Образовавшееся соединение затем подвергают гидролизу или способу каталитического гидрирования, как описано на (схеме 1), в результате чего можно получить карбоновую кислоту (1а).
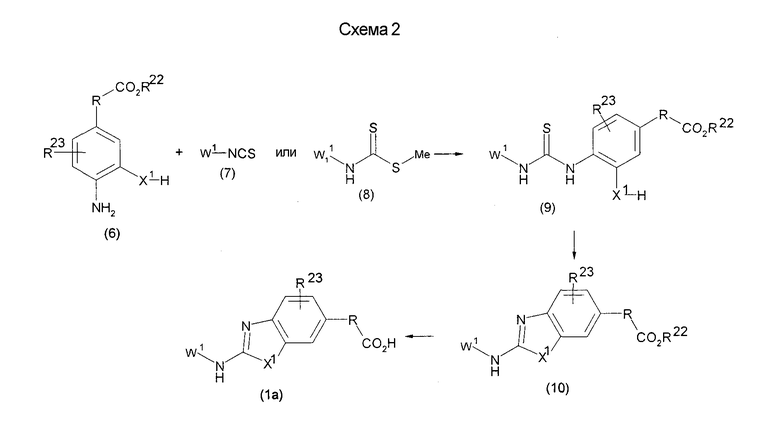
На нижеописанной (схеме 3) указывается другой способ получения соединения формулы (10). Производное мочевины (13) можно получить взаимодействием производного анилина (6) с изоцианатом (12), который является коммерчески доступным или который можно получить известным способом, в инертном галогенированном углеводородном растворителе, таком как метиленхлорид, в инертном углеводородном растворителе, таком как толуол, или инертном растворителе типа простого эфира, таком как тетрагидрофуран, при температуре от -20°С до точки кипения растворителя, предпочтительно, от 0°С до точки кипения растворителя. Затем, например, обработкой соединения (13) органической кислотой, такой как пара-толуолсульфонат пиридиния, в инертном галогенированном углеводородном растворителе, таком как метиленхлорид, при температурном интервале от комнатной температуры до точки кипения растворителя, получают соединение с замкнутым кольцом (10). (M.J.Suto et al., Tetrahedron Lett., 36, 7213 (1995)).
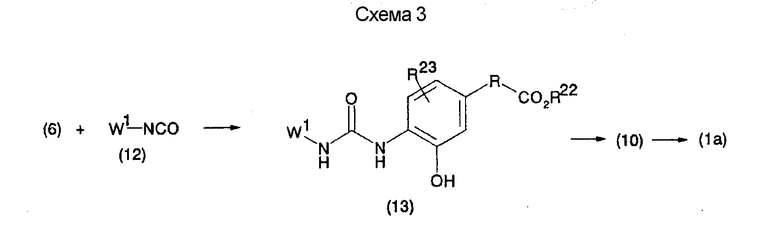
На нижеописанной (схеме 4) соединение формулы (1b) можно получить следующим способом. Производное 2-бензазолхлорида (16) и производное амина (17), каждое из которых являются коммерчески доступными или легко может быть получено известным способом, обрабатывают в инертном полярном растворителе, таком как N,N-диметилформамид, или инертном углеводородном растворителе, таком как ксилол, при температурном интервале от комнатной температуры до точки кипения растворителя, предпочтительно, от 100°С до точки кипения растворителя, или без растворителя при температурном интервале от комнатной температуры до 200°С, предпочтительно, от 100 до 200°С, в результате можно получить соединение формулы (18). Эту реакцию можно проводить в присутствии органического аминного основания, такого как триэтиламин, или неорганического основания, такого как карбонат калия. Затем гидролизом или гидрогенолизом эфирной части по способу гидролиза или каталитического гидрирования, как показано на (схеме 1А), можно получить карбоновую кислоту (1b).
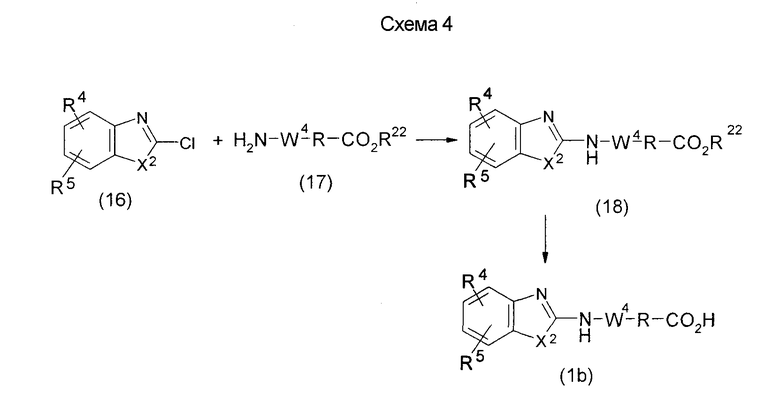
На нижеописанных схемах от (схемы 5) до (схемы 9) будет указан способ получения соединения формулы (2) или (3), которое используют в вышеописанной реакции в качестве исходного материала (на схеме R11, R12, R13, R14, R15, R16, A2, A3, Z, Z1, R10 и R17 имеют такие же значения, как описаны выше, Х4 представляет атом углерода или азота, Z3 представляет замещенную или незамещенную ариленовую группу или замещенную или незамещенную гетероариленовую группу, Z4 представляет замещенную или незамещенную циклоалкиленовую группу или замещенную или незамещенную гетероциклоалкиленовую группу, Z5 представляет замещенную или незамещенную ариленовую группу или замещенную или незамещенную гетероариленовую группу, R30 представляет низшую алкильную группу, Е представляет защитную группу (Protective Groups in Organic Synthesis, eds. by T.W.Greene and P.G.Wuts, John Wiley & Sons, Inc., New York, 1991) первичного или вторичного амина и n1 равно 0, 1 или 2).
На нижеописанной (схеме 5) указывается способ получения соединений формул (2а) и (2b), включающий стадию образования части с простой эфирной связью. Производное сложного эфира (20), коммерчески доступное или получаемое известным способом, можно превратить в соответствующее спиртовое производное (22) известным восстановлением. Например, спиртовое производное (22) можно получить, после кислотного или щелочного гидролиза производного сложного эфира (20) в соответствующую карбоновую кислоту (21), обработкой образовавшегося соединения бораном или восстанавливающим агентом такого типа в инертном галогенированном углеводородном растворителе, таком как метиленхлорид, инертном углеводородном растворителе, таком как толуол, или инертном растворителе типа простого эфира, таком как тетрагидрофуран, при температурном интервале от -20°С до точки кипения растворителя, предпочтительно, от 0°С до точки кипения растворителя. При этом восстановлении предпочтительная защитная группа должна быть введена в виде Е производного сложного эфира (20) и в качестве такой группы предпочтительной является третичная бутилоксикарбонильная группа. В альтернативном случае спиртовое производное (22) можно получить не через карбоновую кислоту (21), а непосредственно из производного сложного эфира (20). Например, спиртовое производное (22) можно получить обработкой производного сложного эфира (20) восстанавливающим агентом, таким как диизобутилалюминийгидрид, в инертном эфирном растворителе, таком как тетрагидрофуран, предпочтительно, в инертном углеводородном растворителе, таком как толуол, или в инертном галогенированном углеводородном растворителе, таком как метиленхлориде, при температурном интервале от -78°С до точки кипения растворителя, предпочтительно, от 0°С до комнатной температуры. Кроме того, в этом случае предпочтительная защитная группа должна быть введена в виде производного сложного эфира Е (20), и в качестве такой группы предпочтительной является третичная бутилоксикарбонильная группа. После того, как образование связи простого эфира реакцией Мицунобу с фенолом, таким как метил-4-гидроксибензоат, и введение арильной группы или гетероарильной группы проводят одновременно, защитную группу Е удаляют.Когда Е представляет третичную бутилоксикарбонильную группу, снятие зашиты проводят обработкой трифторуксусной кислотой без использования растворителя или в инертном галогенированном углеводородном растворителе, таком как метиленхлорид, в результате чего можно получить соединение формулы (2а). Получение соединения (23) с простой эфирной связью можно осуществить из соединения (22), но вместо применения вышеописанной реакции Мицунобу превращением первичной гидроксигруппы соединения (22) в элиминирующую (отцепляющую) группу, такую как мезилоксигруппа, и затем обработкой образовавшегося соединения фенолом, таким как метил-4-гидроксибензоат, в инертном полярном растворителе, таком как N,N-диметилформамид, при температурном интервале от 0°С до 90°С в присутствии неорганического основания, такого как гидрид натрия или карбонат калия. В этом случае предпочтительной защитной группой Е является, например, бензилоксикарбонильная группа.
Когда Z3 соединения (23) представляет фениленовую группу, производное циклогексана (24) можно получить восстановлением кольца бензола известным способом. Например, восстановленное производное (24) можно получить каталитическим гидрированием соединения формулы (23) в инертном спиртовом растворителе, таком как метанол, в присутствии катализатора, такого как палладий, оксид платины, предпочтительно, родий, в атмосфере водорода при давлении от 1 до 1000 атм, предпочтительно, от 1 до 100 атм ((R.A.Finnegan et al., J. Org. Chem., 30, 4145 (1965); A.I.Meyers et al., Org. Synth., 51, 103 (1971)). Вышеуказанное восстановление, предпочтительно, проводят в присутствии уксусной кислоты или трифторуксусной кислоты. Затем удаляют защитную группу Е, например, обработкой, когда Е представляет третичную бутилоксикарбонильную группу, трифторуксусной кислотой способом без использования растворителя или в инертном галогенированном углеводородном растворителе, таком как метиленхлорид, в результате чего можно получить соединение (2b). Соединение (2b) можно получить также удалением защитной группы Е у соединения (23) с последующим вышеописанным восстановлением.
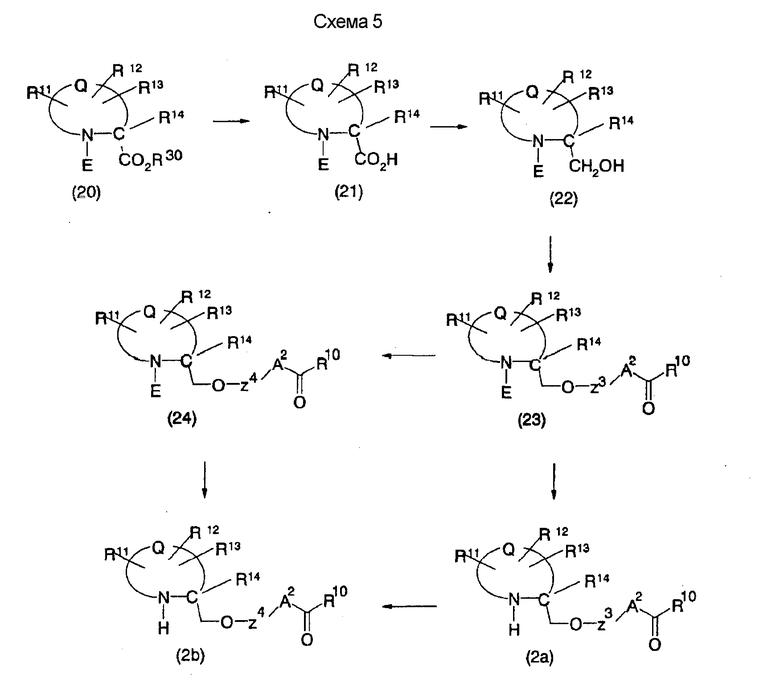
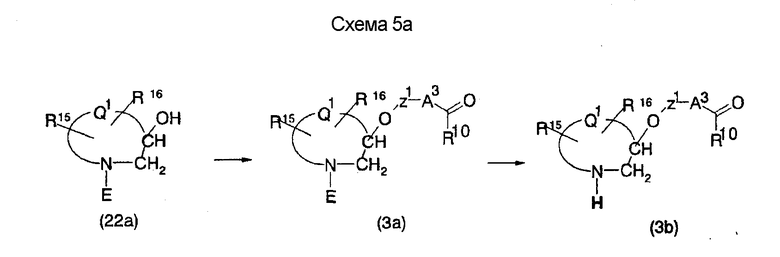
На нижеописанной (схеме 5а) показан способ, делающий возможным получение соединения формулы (3а) и (3b) по способу получения (схемы 5) с использованием в качестве исходного материала соединения формулы (22а), которое является коммерчески доступным или его получают известным способом. Производное первичного спирта можно получить известным способом, например, превращением вторичной гидроксигруппы соединения (3а) в элиминирующую группу, такую как мезилоксигруппа, превращением ее в цианогруппу действием цианирующего агента, такого как цианид калия, затем превращением ее в формильную группу с использованием диизопропилалюминийгидрида и проведением восстановления борогидридом натрия. Соединение, которое имеет один атом углерода между атомом кислорода и кольцом в соединении (3b), можно получить с использованием образовавшегося производного первичного спирта в качестве исходного материала по вышеописанному способу образования простой эфирной связи. (A.Tarnowsky et al., Bioorg. Med. Chem. Lett., 1, 573 (1997)).
На нижеописанной (схеме 6) указывается способ получения производного сульфида, сульфоксида или сульфона (2m) известным способом с использованием производного спирта (22) в качестве исходного материала.
Например, соединение формулы (25) можно получить превращением первичной гидроксильной группы спиртового производного (22) в элиминирующую группу, такую как мезилоксигруппа, и затем обработкой образовавшегося соединения тиолом, который является коммерчески доступным или который можно получить известным способом, в инертном растворителе типа простого эфира, таком как тетрагидрофуран, инертном галогенированном углеводородном растворителе, таком как метиленхлорид, предпочтительно, в инертном полярном растворителе, таком как N,N-диметилформамид, при температурном интервале от -20°С до точки кипения растворителя, предпочтительно, от комнатной температуры до точки кипения растворителя, в присутствии основания, такого как карбонат калия или гидрид натрия. При превращении образовавшегося соединения по известной реакции окисления его сульфидную часть можно превратить в сульфоксидную или сульфоновую группу.
Например, соединение (25) можно превратить в соответствующее сульфоксидное или сульфоновое соединение обработкой его коммерчески доступной 3-хлорпербензойной кислотой или пероксидом, таким как пероксид водорода, в инертном галогенированном углеводородном растворителе, таком как метиленхлорид, при температурном интервале от -78°С до точки кипения растворителя, предпочтительно, от -20°С до комнатной температуры. Защитную группу Е затем удаляют у соединения (25) или его сульфоксидного или сульфонового производного, в результате чего можно получить соединение (2m).

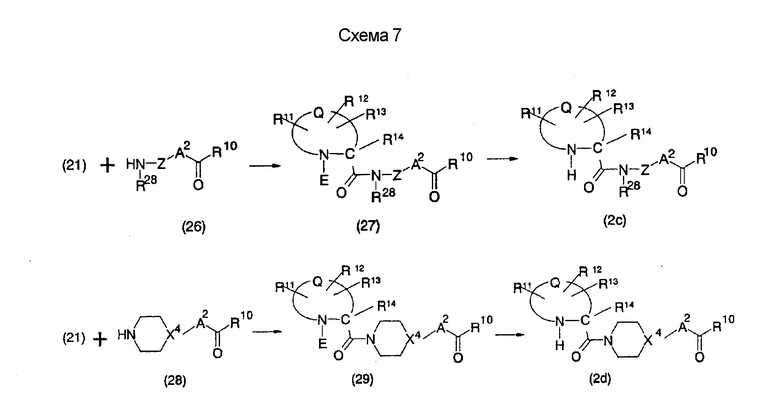
На нижеописанной (схеме 7) приведен способ получения соединений формул (2 с) и (2d), включающий стадию образования амидной связи. Производное амида (27) или (29) можно получить взаимодействием производного карбоновой кислоты (21) и амина с незамкнутым кольцом (26) или циклического амина (28), который является коммерчески доступным или его получают известным способом, с использованием агента конденсации, такого как гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида, N,N-дициклогексилкарбодиимид или N,N-карбонилдиимидазол или его аналог, в инертном галогенированном углеводородном растворителе, таком как метиленхлорид, инертном углеводородном растворителе, таком как толуол, инертном растворителе типа простого эфира, таком как тетрагидрофуран, или инертном полярном растворителе, таком как N,N-диметилформамид, при температурном интервале от
-20°С до точки кипения растворителя, предпочтительно, от 0°С до комнатной температуры. Эту реакцию можно также проводить в присутствии органического аминного основания, такого как триэтиламин или N,N-диметиламинопиридин, или органического аминного основания и 1-гидроксибензотриазола. Снятием защиты Е можно получить соединение формулы (2 с) или (2d).
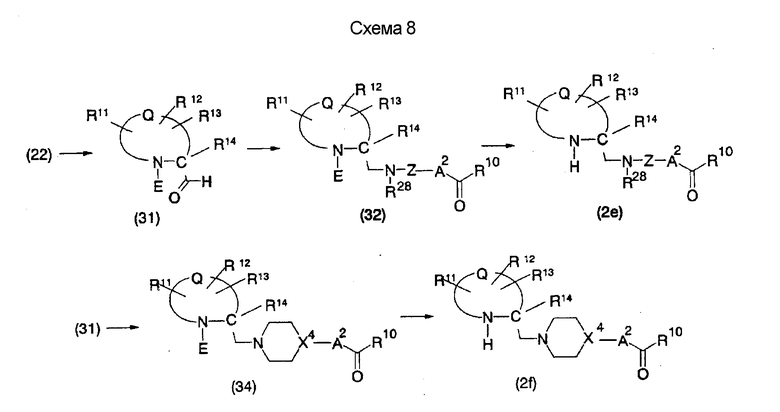
На нижеописанной (схеме 8) приводится способ получения соединения формулы (2е) или (2f), включающий стадию N-алкилирования. Производное спирта (22) в (схеме 5) можно превратить в соответствующее производное альдегида (31) окислением первичной гидроксильной группы в альдегидную известным способом. Например, пригодным для превращения является окисление с использованием хромовой кислоты или окисление с использованием диметилсульфоксида, например, окисление Сверна (Swern). Образовавшееся производное альдегида (31) затем подвергают реакции восстановительного N-алкилирования с использованием вышеуказанного производного амина (26) или (28) известным способом. Эту реакцию восстановления можно проводить с использованием восстанавливающего агента, такого как цианоборогидрид натрия или триацетоксиборогидрид натрия, в инертном спиртовом растворителе, таком как метанол, или инертном растворителе типа простого эфира, таком как тетрагидрофуран. Когда используют цианоборогидрид натрия, реакцию, предпочтительно, проводят в кислотных условиях, например, в присутствии уксусной кислоты. Реакцию N-алкилирования можно также проводить каталитическим гидрированием с использованием коммерчески доступного катализатора, такого как палладий на угле. Удалением защитной группу Е у восстановленного производного (32) или (34) можно получить соединение формулы (2е) или (2f).
На нижеописанной (схеме 9) приводится способ получения соединений формул (2g), (2h) и (2i), которые являются соединениями формулы (2), где Y представляет углерод-углеродную тройную связь (этинильная группа), углерод-углеродную двойную связь (винильная группа) и углерод-углеродную простую связь (этильная группа) соответственно.
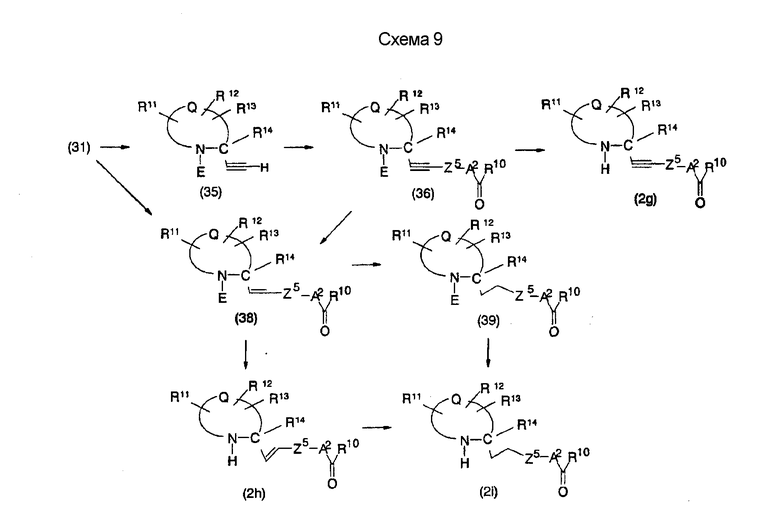
Ацетиленовое производное (35) можно получить из соединения (31) по известной реакции образования тройной связи, например, взаимодействием триметилсилилдиазометана с основанием, таким как диизопропиламид лития, в инертном растворителе типа простого эфира, таком как тетрагидрофуран, при температурном интервале от -78°С до точки кипения растворителя и затем взаимодействием образовавшегося соединения с вышеописанным производным альдегида (31). (Y. Ito et al., Synlett, 1163 (1997). Полученное таким образом ацетиленовое соединение затем подвергают взаимодействию, известным способом, с производным арилгалогенида или трифторметилсульфонилоксиарил производным, которое является коммерчески доступным или которое можно получить известным способом, в присутствии палладиевого катализатора, такого как тетракистрифенилфосфинпалладий или ацетат палладия, и органического основания, такого как диизопропиламин, или неорганического основания, такого как карбонат калия, в инертном полярном растворителе, таком как N,N-диметилформамид, при температурном интервале от -20°С до точки кипения растворителя, предпочтительно, от 0°С до точки кипения, в результате чего можно получить соответствующее этинилпроизводное (36). (T. Eckert et al., Synth Commun., 28, 327 (1998)). Удалением защитной группы Е у образовавшегося производного можно получить соединение формулы (2g). Примером предпочтительной защитной группы Е может быть трет-бутоксикарбонильная группа.
Винильное производное (38) можно получить известным способом посредством использования вышеописанного производного альдегида (31) в качестве исходного материала. Соединение формулы (38) можно получить взаимодействием реагента Виттиг-Хорнера, который является коммерчески доступным или который можно получить известным способом, с основанием, таким как гексаметилдисилазан лития, в инертном растворителе типа простого эфира, таком как тетрагидрофуран, при температурном интервале от -78°С до точки кипения растворителя, предпочтительно, от -78°С до комнатной температуры, и затем взаимодействием образовавшегося соединения с производным альдегида (31). Затем удалением защитной группы Е можно получить соединение формулы (2h). В альтернативном случае винилпроизводное (38) можно получить способом, в котором вышеописанное этинилпроизводное (36), используемое в качестве исходного материала, подвергают известной реакции восстановления. Например, этинилпроизводное (36) подвергают каталитическому гидрированию в инертном спиртовом растворителе, таком как этанол, в присутствии катализатора Линдлара и органического аминного основания, такого как хинолин, действующего в качестве каталитического яда, в результате чего можно получить винилпроизводное (38). Кроме того, при получении винилпроизводного следует использовать предпочтительную защитную группу Е, в качестве которой предпочтительно используют третичную бутоксикарбонильную группу.
Этилпроизводное (39) можно получить каталитическим гидрированием этинилпроизводного (36) или винилпроизводного (38), используемого в качестве исходного материала. Затем защитную группу Е удаляют, в результате чего можно получить соединение формулы (2i). В альтернативном случае соединение формулы (2i) можно получить каталитическим гидрированием этинилпроизводного (2g) или винилпроизводного (2h).
В нижеописанных схемах от (схемы 10) до (схемы 13) способ получения пирролидина показан как конкретный пример способа получения соединения формулы (20), используемого в качестве исходного материала в (схеме 5) (в схемах R30 представляет низшую алкильную группу, R31, R33, R36 и R34, каждый независимо, представляет замещенную или незамещенную алкильную группу, замещенную или незамещенную арильную группу или замещенную или незамещенную гетероарильную группу, Х5 представляет цианогруппу, аминогруппу, азидогруппу, атом галогена, замещенную или незамещенную моноалкиламиногруппу, замещенную или незамещенную диалкиламиногруппу, замещенную или незамещенную циклоалкиламиногруппу, замещенную или незамещенную алкилсульфониламиногруппу, замещенную или незамещенную аллилоксигруппу, замещенную или незамещенную алкилтиогруппу, замещенную или незамещенную алкилсульфоксидную группу или замещенную или незамещенную алкилсульфоновую группу, и Е имеет такие же значения, как описаны выше).
На нижеописанной (схеме 10) показан способ получения соединения, имеющего заместитель, введенный в 4-положение пирролидина. Производное сложного эфира (41) можно получить взаимодействием коммерчески доступного 4-гидрокси-L-пролина (40) с гидрохлоридом метанола, например, при температурном интервале от комнатной температуры до точки кипения растворителя. Образовавшееся производное сложного эфира затем обрабатывают в смеси инертных полярных растворителей, таких как вода и ацетонитрил, в присутствии ангидрида кислоты, такого как ди-трет-бутилдикарбонат, ацилгалогенида, такого как бензилоксикарбонилхлорид, органического аминного основания, такого как триэтиламин, или неорганического основания, такого как карбонат калия, посредством чего можно получить соединение формулы (20а). Вторичную гидроксильную группу производного спирта (20а) можно превратить во вторичную гидроксильную группу, имеющую противоположную стерическую конфигурацию, реакцией Мицунобу. Например, производное спирта (20а) и муравьиную кислоту подвергают реакции Мицунобу для введения формилоксигруппы во вторичную гидроксильную группу с последующим щелочным гидролизом с использованием неорганического основания, такого как карбонат калия, предпочтительно, бикарбонат натрия, в результате чего можно получить соединение (20b).

Алкоксипроизводные (20 с) и (20d) можно получить обработкой вторичной гидроксильной группы производных спиртов (20а) и (20b) известным способом или при сохранении стерической структуры известным способом. Например, алкоксисоединения (20 с) и (20d) можно получить обработкой спиртовых соединений (20а) и (20b) в инертном растворителе типа простого эфира, такого как тетрагидрофуран, или инертном полярном растворителе, таком как N,N-диметилформамид, при температурном интервале от -20°С до точки кипения растворителя, предпочтительно, от -20°С до комнатной температуры в присутствии алкилгалогенида, такого как метилиодид или бензилбромид, и неорганического основания, такого как гидрид натрия. Когда соответствующее бензилоксипроизводное получают вышеописанным алкилированием, предпочтительным является добавление неорганического основания к реакционной смеси на конечной стадии реакции при температурном интервале от -20°С до комнатной температуры. Соединение формулы (I), имеющее гидроксигруппу в 4-положении кольца пирролидина, можно получить, например, защитой 4-гидроксильной группы кольца пирролидина соединения (20а) или (20b) третичной бутилдиметилсилильной группой и затем использованием образовавшегося соединения в качестве исходного материала.
Известной реакцией нуклеофильного замещения типа SN2 вторичных гидроксильных групп соединений (20а) и (20b) эти соединения можно превратить в соединения (20е) и (20f), соответственно. Например, атом фтора можно ввести обработкой, например, соединения (20а) фторирующим реагентом, таким как трифторид диэтиламиносеры, в инертном галогенированном углеводородном растворителе, таком как метиленхлорид, при температурном интервале от -78°С до точки кипения растворителя, предпочтительно, от 0°С до комнатной температуры (L.Demange et al., Tetrahedron Lett., 39,1169 (1998)). В альтернативном случае атом фтора можно ввести превращением вторичных гидроксильных групп соединений (20а) и (20b) в элиминирующую группу, такую как алкил- или арилсульфонилоксигруппа, например, мезилоксигруппу, и затем обработкой образовавшегося соединения фторидом щелочного металла, таким как фторид калия, или фторидом щелочноземельного металла, таким как фторид цезия, в инертном полярном растворителе, таком как N,N-диметилформамид или этиленгликоль (G.Giardina et al., Sylett, 1, 57 (1995)). Цианогруппу можно ввести в мезилоксипроизводное воздействием на него агентом цианирования, таким как цианид калия. Вторичную гидроксильную группу каждого из соединений (20а) и (20b) можно превратить в атом хлора взаимодействием ее с трифенилфосфином в растворителе, тетрахлориде углерода, при температурном интервале от -20°С до точки кипения растворителя, предпочтительно, от комнатной температуры до точки кипения растворителя. (T.R.Webb et al., J. Org. Chem., 56, 3009 (1991)). Ее можно превратить в фенокси или фталоильную группу реакцией Мицунобу. Эту фталоильную группу можно превратить в аминогрупу известным способом обработкой ее коммерчески доступным гидразингидратом в инертном спиртовом растворителе, таком как этанол. Кроме того, эту аминогруппу можно превратить в моноалкиламино или диалкиламиногруппу вышеописанной реакцией восстановительного аминирования или обработкой галогенидом углерода, таким как иодметан, в присутствии органического аминного основания, такого как триэтиламин, или неорганического основания, такого как карбонат калия.
Вышеописанное превращение в аминогруппу можно проводить альтернативным способом. Например, после превращения вторичной гидроксильной группы каждого из соединений (20а) и (20b) в элиминирующую группу, такую как мезилоксигруппу, соединение обрабатывают азидом лития или азидом натрия в инертном полярном растворителе, таком как N,N-диметилформамид, или инертном растворителе типа простого эфира, таком как тетрагидрофуран, при температурном интервале от -20°С до точки кипения растворителя, в результате чего можно получить соответствующее азидное производное. Его затем обрабатывают трифенилфосфином и водой в известном способе восстановления в инертном растворителе типа простого эфира, таком как тетрагидрофуран, при температурном интервале от -20°С до точки кипения растворителя или подвергают каталитическому гидрированию или восстановлению восстанавливающим агентом, таким как борогидрид натрия, в известном способе для превращения этой группы в аминогруппу. Введение заместителя в 3-положение кольца пирролидина можно также проводить с использованием коммерчески доступного транс-3-гидрокси-L-пролина в качестве исходного материала по способу, описанному на (схеме 10).
На нижеописанной (схеме 11) указывается способ получения дегидропирролидина (20g) известным способом. Например, производное 3,4-дегидропирролидина (20g) можно получить превращением вторичной гидроксильной группы производного (20а) в элиминирующую группу, такую как мезилоксигруппа или атом брома, предпочтительно, атом иода, и затем обработкой образовавшегося соединения органическим аминным основанием, таким как 1,8-диазабицикло(5,4,0)-7-ундецен. В альтернативном случае производное 3,4-дегидропирролидина (20g) можно получить превращением вторичной гидроксильной группы производного (20а) в вышеописанную элиминирующую группу, обработкой фенилселенилнатрием, который был получен из дифенилдиселенида и борогидрида натрия, в метаноле и затем обработкой пероксидом, таким как пероксид водорода, в метиленхлориде в присутствии пиридина. (H.Rueger et al., Can.J.Chem., 60, 2918 (1982)).
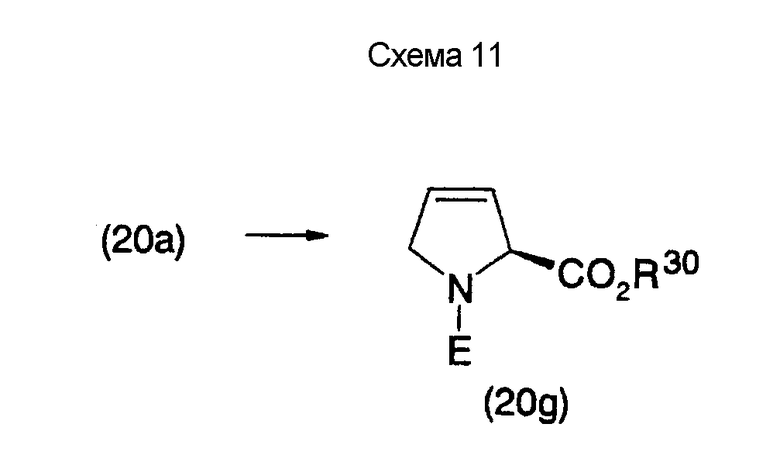
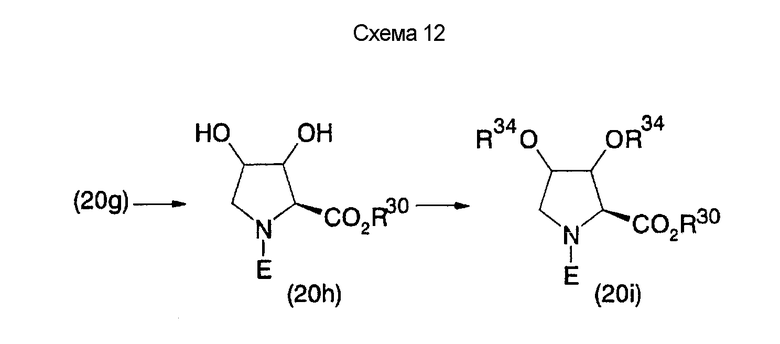
На нижеописанной (схеме 12) конкретно указан способ получения 3,4-дигидропроизводного (20h) и 3,4-диалкоксипроизводного (20i) известным способом с использованием в качестве исходного материала соединения (20g), показанного на схеме (11).
Соединение (20g) можно превратить в его соответствующее 3,4-дигидроксипроизводное (20h) обработкой его коммерчески доступным окисляющим агентом, таким как производное 4-метилморфолин-4-оксида и тетраоксид осмия, в смеси инертного полярного растворителя, такого как ацетон, с водой или инертного растворителя типа простого эфира, такого как тетрагидрофуран, с водой при температурном интервале от -20°С до точки кипения растворителя, предпочтительно, от 0°С до комнатной температуры. Затем образовавшееся соединение можно превратить в диалкоксипроизводное (20i) обработкой алкилгалогенидом, таким как метилиодид или бензилбромид, в присутствии неорганического основания, такого как гидрид натрия, в инертном полярном растворителе, таком как N,N-диметилформамид. Или производное (20i), имеющее циклический ацеталь или циклический кеталь, введенный в него, можно получить обработкой коммерчески доступным агентом кетализации или агентом ацетализации в инертном полярном растворителе, таком как N,N-диметилформамид, или инертном галогенированном углеводородном растворителе, таком как метиленхлорид, в присутствии органической кислоты, такой как тозиловая кислота. (J.E.Baldwin et al., Tetrahedron Lett., 35, 4649 (1994); D.M.Goli et al., Carbohydr.Res., 259, 219 (1994)). Вышеописанный кеталь или ацеталь является пригодным в качестве защитной группы для вторичной гидроксильной группы в 3,4-положении. Кетальное или ацетальное производное можно использовать в качестве исходного материала для получения соединения формулы (I), имеющего 3,4-дигидроксипирролидин.
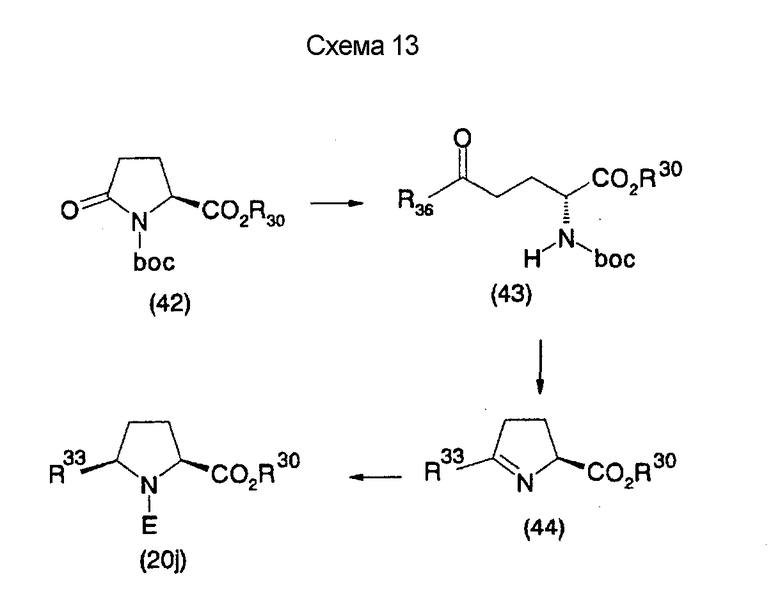
На нижеописанной (схеме 13) приведен способ получения производного (20j), имеющего заместитель, введенный в 5-положение пирролидина известным способом. Например, коммерчески доступный N-(третичный бутилоксикарбонил)-L-пироглутаматный эфир (42) можно превратить в соответствующее производное с раскрытым кольцом (43) обработкой литийорганическим реагентом, таким как фениллитий, или реактивом Гриньяра, таким как метилмагнийбромид, в инертном растворителе типа эфира, таком как тетрагидрофуран, при температурном интервале от -20°С до точки кипения растворителя, предпочтительно, от -20°С до комнатной температуры.
Затем образовавшееся производное можно превратить в соответствующее производное циклического имина (44) обработкой в кислотных условиях, предпочтительно, трифторуксусной кислотой, для удаления третичной бутоксикарбонильной группы. Каталитическим гидрированием образовавшегося соединения можно получить соответствующее производное пирролидина (20j), имеющее 2,5-цис-конфигурацию (J.V.Betsbrugge et al., Tetrahedron, 54, 1753 (1998)). Его можно также получить, вместо способа каталитического гидрирования, восстановлением имина восстанавливающим агентом, таким как цианоборогидрид натрия. Производное пирролидина, имеющее 2,5-транс-конфигурацию, можно получить, например, посредством использования коммерчески доступного бензилглицидилового эфира в качестве исходного материала по процедуре Такано (S.Takano et al., Tetrahedron Lett., 30, 3805 (1989)).
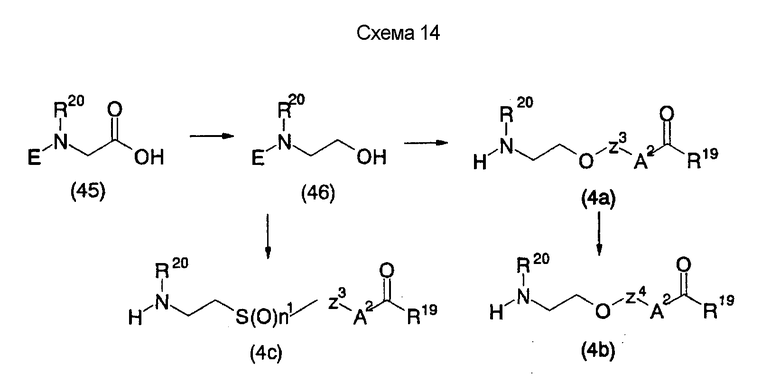
На нижеуказанных схемах от (схемы 14) до (схемы 18) показан способ получения соединения формулы (4), служащего в качестве исходного материала на (схеме 1), из коммерчески доступной аминокислоты, например, глицина (на этих схемах E, R20, R10, R28, R20, Z, Z3, Z4, A2, X4, n1 и R19 имеют такие же значения, как описаны выше).
На нижеописанной (схеме 14) показано, что соединения формул (4а), (4b) и (4 с) можно синтезировать по способу получения, как показано выше на (схеме 5) и (схеме 6), посредством использования в качестве исходного материала производного глицина (45), которое можно получить известным способом.
На нижеописанной (схеме 15) показано, что соединения формул (4d) и (4е) можно получить по способу получения, показанному на (схеме 7), с использованием вышеописанного производного глицина (45) в качестве исходного материала
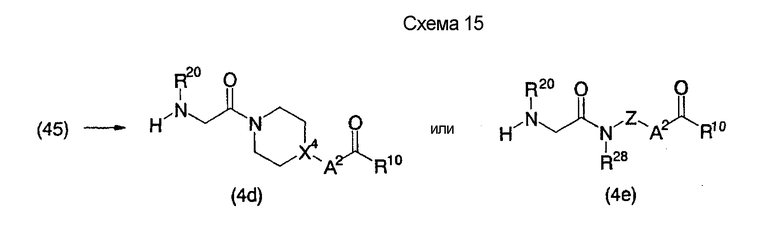
На нижеописанной (схеме 16) показано, что соединения формул (4f) и (4g) можно получить по способу получения, показанному на (схеме 8), с использованием вышеописанного спиртового производного (46) в качестве исходного материала.
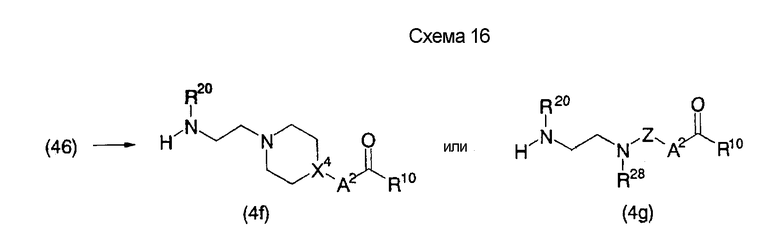
На нижеописанной (схеме 17) показано, что соединения формул (4h), (4i) и (4j) можно получить по способу получения, показанному на (схеме 9), с использованием вышеописанного производного спирта (46) в качестве исходного материала.

На нижеописанной (схеме 18) показано, что первичный амин (48), который является коммерчески доступным или который можно получить известным способом, можно превратить в соединение формулы (4k) по реакции восстановительного N-алкилирования, как показано на (схеме 8), взаимодействием первичного амина с производным альдегида (49), который является коммерчески доступным или который можно получить известным способом.
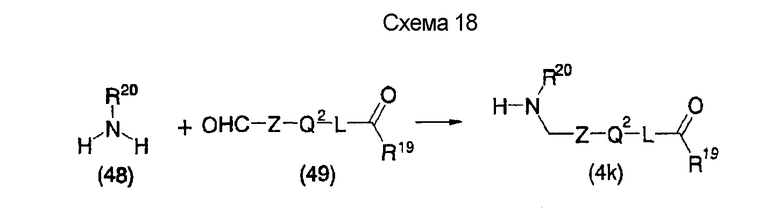
Как описано далее в примерах испытания, соединения изобретения или их соли, полученные таким образом, селективно ингибируют связывание молекул клеточной адгезии с VLA-4 и в то же время проявляют высокую пероральную абсорбцию. В соответствии с этим, соединения изобретения являются пригодными в качестве профилактического или лекарственного средства для лечения заболеваний, вызванных относящейся к VLA-4 клеточной адгезии, то есть различных заболеваний, опосредованных миграцией и адгезией лейкоцитов, таких как воспалительные заболевания, аутоиммунные заболевания, метастазы, бронхиальная астма, риностеноз, диабет, артрит, псориаз, рассеянный склероз, воспалительные кишечные заболевания и отторжение при трансплантации.
Лекарственное средство настоящего изобретения можно вводить различными путями введения, включая пероральное введение.
В виде инъекции их можно вводить любым способом, включающим внутривенную инъекцию, внутримышечную инъекцию или подкожное введение.
Такие готовые препаративные формы можно получить выбором подходящей формы в зависимости от пути введения и адаптированием к ней обычно используемого способа.
Примеры перорально вводимых готовых препаративных форм включают таблетки, порошки, гранулы, капсулы, растворы, сиропы, эликсиры и масляные или водные суспензии. Инъекции иногда содержат стабилизатор, антисептик, солюбилизирующий агент или тому подобное. Возможно также, что раствор для инъекции, который может содержать такую добавку, инкапсулируют в контейнер, его можно лиофилизовать в твердую готовую препаративную форму и, при желании, реконструировать (восстановить до готовой к употреблению формы) при использовании. Жидкие готовые препаративные формы включают растворы, суспензии и эмульсии. При их получении в качестве добавки можно добавить суспендирующий агент или эмульгирующий агент.
Лекарственное средство, содержащее соединение изобретения, предпочтительно вводят взрослому человеку периодически один раз в день с подходящими интервалами. Дозировка находится в диапазоне от 0,01 мг до 2000 мг, предпочтительно, от 0,1 мг до 1000 мг.
Лекарственное средство настоящего изобретения, если требуется, можно использовать в комбинации с противовоспалительным, антиартритным, адренокортикальным стероидом (кортикостероидом), иммуносуппрессантом, антипсориатическим, бронхолитическим средством, лекарственным средством для бронхиальной астмы или антидиабетическим средством в пределах, не наносящих ущерб действию соединений изобретения.
Примеры
Настоящее изобретение далее описано подробно примерами.
В примерах «IR», «NMR» и «MS» означают «инфракрасный абсорбционный спектр (ИК)», «спектр ядерного магнитного резонанса (ЯМР)» и «масс-спектрометрию (МС)», соответственно. Отношение элюирующего растворителя, используемого для разделения и очистки хроматографией, означает объемное отношение. «IR» означает ИК-спектроскопию в таблетке KBr или способом ATR. В скобках «NMR» означает растворитель для измерения с ТМС (тетраметилсиланом), используемым в качестве внутреннего стандарта. «Anal. Calcd for rational formula» означает вычисленную величину элементного анализа, тогда как найденная (измеренная) величина указана после «Found». «HPLC» представляет аббревиатуру высокоэффективной жидкостной хроматографии (ВЭЖХ) и в скобках указывается колонка и элюирующий растворитель.
Пример 1
4-((4S)-Фтор-1-(2-фениламино-6-бензоксазолилацетил-(2S)-пирролидинилметокси)бензойная кислота:
(Стадия 1) Синтез метил-2-фениламинобензоксазол-6-ацетата
Метил-3-гидрокси-4-нитрофенилацетат (592 мг, 2,81 ммоль) растворяют в этаноле (10 мл) с последующим добавлением 5% палладия на угле (194 мг). Образовавшуюся смесь подвергают каталитическому гидрированию на протяжении ночи при перемешивании при комнатной температуре и нормальном давлении. После удаления катализатора из реакционной смеси фильтрованием через целит при пониженном давлении, осадок на фильтре промывают этанолом (30 мл). Фильтрат перемешивают при комнатной температуре. После добавления фенилизотиоцианата (370 мкл, 3,09 ммоль) и перемешивания при комнатной температуре в течение одного часа добавляют оксид ртути(II) (желтый) (1,1 г, 5,07 ммоль). Реакционную смесь нагревают при кипячении с обратным холодильником в течение 3 часов. Смесь затем охлаждают и нерастворимое вещество отфильтровывают при пониженном давлении. Фильтрат перегоняют при пониженном давлении. Остаток очищают хроматографией на колонке с силикагелем, посредством чего метил-2-фениламинобензоксазол-6-ацетат (480 мг, 61%) получают в виде белого твердого вещества из фракций, элюированных смесью хлороформ-этилацетат (10:1, об./об.).
1H-ЯМР (CDCl3) δ: 3,69 (с, 2H), 3,70 (с, 3H), 7,11 (м, 2H), 7,24 (м, 1H), 7,30 (с, 1H), 7,50-7,38 (м, 3H), 7,59 (д, J=1,2 Гц, 2H).
(Стадия 2) Синтез 2-фениламинобензоксазол-6-уксусной кислоты
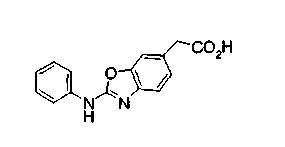
В тетрагидрофуране (который далее обозначен аббревиатурой «ТГФ» (2 мл) и метаноле (2 мл) растворяют метил-2-фениламинобензоксазол-6-ацетат (460 мг, 1,63 ммоль) с последующим добавлением 1 н. NaOH (3,3 мл) при перемешивании при комнатной температуре. После дополнительного перемешивания на протяжении ночи при комнатной температуре реакционную смесь концентрируют до небольшого объема. Концентрат подкисляют уксусной кислотой. Полученные таким образом кристаллы собирают фильтрованием, промывают водой и затем сушат, тем самым получая 2-фениламинобензоксазол-6-уксусную кислоту (348 мг, 80%) в виде бледно-желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 3,64 (с, 2H), 7,03 (т, J=7,6 Гц, 1H), 7,11 (дд, J=1,2, 8,0 Гц, 1H), 7,35-7,40 (м, 4H), 7,76 (д, J=8,8 Гц, 2H), 10,60 (ушир.с, 1H), 12,4 (ушир., 1H).
(Стадия 3) Синтез метил-4-((4S)-фтор-1-(2-фениламино-6-бензоксазолилацетил)-(2S)-пирролидинилметокси)бензоата
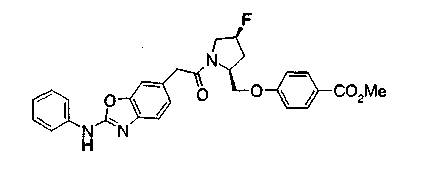
В N,N-диметилформамиде (который далее обозначен аббревиатурой «ДМФ») (12 мл) растворяют 2-фениламинобензоксазол-6-уксусную кислоту (309 мг, 1,15 ммоль) и метил-4-((4S)-фтор-(2S)-пирролидинилметокси)бензоат (292 мг, 1,15 ммоль) с последующим добавлением гидрохлорида 1-этил-3-(3-диметиламинопропил)карбодиимида (далее обозначен аббревиатурой «EDC·HCl») (331 мг, 1,73 ммоль), 1-гидроксибензотриазола (который далее обозначен аббревиатурой «HOBt») и 4-диметиламинопиридина (который далее обозначен аббревиатурой «DMAP») при перемешивании при комнатной температуре. Реакционную смесь далее перемешивают на протяжении ночи при комнатной температуре. Реакционную смесь разбавляют этилацетатом. Разбавленную смесь затем промывают насыщенным раствором соли, сушат над безводным сульфатом магния и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси хлороформ-метанол (10:1, об./об.) метил-4-((4S)-фтор-1-(2-фениламино-6-бензоксазолилацетил-(2S)-пирролидинилметокси)бензоат (560 мг, 96%) получают в виде бледно-коричневого порошка.
1H-ЯМР (CDCl3) δ: 1,20-1,25 (м, 1H), 2,02-2,22 (м, 1H), 2,32-2,56 (ряд дд, J=15,0, 19,6 Гц, общий 1H), 3,63-4,13 (м, общий 4H), 3,85 (с, 3H), 4,51 (дд, J=4,4,8,8 Гц, 1H), 4,62 (дт, J=4,4,8,8 Гц, 1H), 5,29 (АВкв., 1H), 6,84 (т, J=8,8 Гц, 1H), 6,95 (д, J=9,2 Гц, 2H), 7,08 (т, J=6,3 Гц, 2H), 7,31-7,42 (м, 3H), 7,60 (т, J=6,8 Гц, 2H), 7,90-8,00 (м, 2H).
(Стадия 4) Синтез 4-((4S)-фтор-1-(2-фениламино-6-бензоксазолилацетил-(2S)-пирролидинилметокси)бензойной кислоты
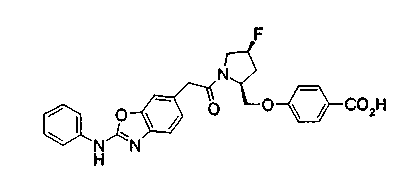
В ТГФ (8 мл) и метаноле (2 мл) растворяют метил-4-((4S)-фтор-1-(2-фениламино-6-бензоксазолилацетил)-(2S)-пирролидинилметокси)бензоат (383 мг, 0,76 ммоль). После добавления 0,25 н. NaOH (2 экв.) смесь перемешивают на протяжении ночи при комнатной температуре. Реакционную смесь разбавляют смесью хлороформ-метанол (5:1, об./об.). Разбавленную смесь промывают 1 н. HCl, сушат над безводным сульфатом магния и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из фракций элюирования смесью хлороформ-метанол (5:1, об./об.) получают 4-((4S)-фтор-1-(2-фениламино-6-бензоксазолилацетил)-(2S)-пирролидинилметокси)бензойную кислоту (210 мг, 56%) в виде светло-коричневого порошка.
ИК (KBr) 2977, 1683, 1643, 1604 см-1;
1H-ЯМР (ДМСО-d6) δ: 1,09 (т, J=7,0 Гц, 1H), 2,24-2,31 (м, 2H), 3,75-4,42 (м, общий 7H), 5,44 (м, общий 1H), 7,00-7,12 (м, 4H), 7,37 (м, 4H), 7,75 (д, J=8,4 Гц, 2H), 8,87 (д, J=8,4 Гц, 2H).
МС (FAB) m/z 490 (M++1);
Анал. Вычисл. для C27H24FN3O5·2,75H2O: C, 60,16; H, 5,52; N, 7,80.
Найдено: C, 60,46; H, 5,19; N, 7,24.
Пример 2
4-((4S)-Фтор-1-(2-(2-метилфениламино-6-бензоксазолилацетил-(2S)-пирролидинилметокси)бензойная кислота:
(Стадия 1) Синтез бензил-5-фтор-2-нитрофенилового эфира
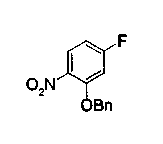
В ДМФ (300 мл) 5-фтор-2-нитрофенол (10,0 г, 63,7 ммоль), бензилбромид (10,9 г, 63,7 ммоль) и карбонат калия (13,2 г, 95,6 ммоль) перемешивают при 80°С в течение 4 часов. После охлаждения реакционную смесь выливают в воду (200 мл) с последующей экстракцией эфиром (2×200 мл). Экстракт промывают насыщенным раствором соли (200 мл), сушат над безводным сульфатом магния и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, в результате чего из фракций элюирования смесью гексан-этилацетат (4:1) получают указанное в заголовке соединение (14,3 г, 91,3%) в виде бледно-желтого аморфного вещества.
1H-ЯМР (CDCl3) δ: 5,22 (с, 2H), 6,71-6,75 (м, 1H), 6,83 (дд, J=10,3, 2,5 Гц, 1H), 7,33-7,47 (м, 5H), 7,96 (дд, J=9,1, 5,4 Гц, 1H).
(Стадия 2) Синтез диэтил-3-бензилокси-4-нитрофенилмалоната
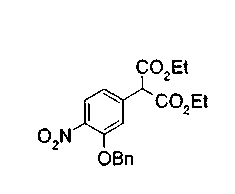
Гидрид натрия (4,63 г, 115,7 ммоль) суспендируют в ДМФ (100 мл). При охлаждении при 0°С и перемешивании по каплям добавляют диэтилмалонат (18,5 г, 115,7 ммоль). После того как энергичное выделение газообразного водорода прекращается, к реакционной смеси при 0°С добавляют раствор бензил-5-фтор-2-нитрофенилового эфира (14,3 г, 57,8 ммоль) в ДМФ (100 мл). Реакционную смесь перемешивают в течение 15 часов при комнатной температуре. Добавляют воду (500 мл) и смесь экстрагируют этилацетатом (300 мл). Экстракт промывают насыщенным раствором соли (200 мл), сушат над безводным сульфатом магния и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, в результате чего из элюатных фракций смеси гексан-этилацетат (3:1) получают указанное в заголовке соединение (22,0 г, 100%) в виде желтого масла.
1H-ЯМР (CDCl3) δ: 1,24-1,28 (м, 6H), 4,18-4,29 (м, 4H), 4,62 (с, 1H), 5,25 (с, 2H), 7,05 (дд, J=8,3, 1,7 Гц, 1H), 7,29-7,48 (м, 6H), 7,85 (д, J=8,3 Гц, 1H).
(Стадия 3) Синтез 3-гидрокси-4-нитрофенилуксусной кислоты
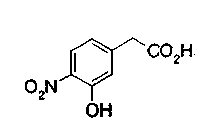
Смесь диэтил-3-бензилокси-4-нитрофенилмалоната (22,0 г, 57,8 ммоль), уксусной кислоты (100 мл) и концентрированной хлористоводородной кислоты (200 мл) нагревают при кипячении с обратным холодильником в течение в течение 15 часов при перемешивании. После охлаждения реакционной смеси до комнатной температуры растворитель отгоняют из реакционной смеси при пониженном давлении. Таким образом полученное твердое вещество собирают фильтрованием при пониженном давлении с последующей сушкой при пониженном давлении, получая при этом указанное в заголовке соединение (5,45 г, 48%) в виде светло-желтого аморфного вещества.
1H-ЯМР (ДМСО-d6) δ: 3,64 (с, 2H), 6,88 (дд, J=8,3, 1,6 Гц), 7,05 (с, 1H), 7,85 (д, J=8,3 Гц, 1H), 10,90 (с, 1H), 12,55 (ушир.с, 1H).
(Стадия 4) Синтез метил-3-гидрокси-4-нитрофенилацетата
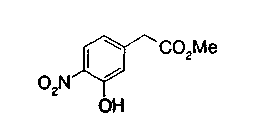
К 3-гидрокси-4-нитрофенилуксусной кислоте (5,45 г, 27,6 моль) и метанолу (100 мл) добавляют концентрированную серную кислоту (0,5 мл). Смесь затем нагревают при кипячении с обратным холодильником в течение 4 часов при перемешивании. После охлаждения до комнатной температуры реакционную смесь перегоняют при пониженном давлении для удаления растворителя. К остатку добавляют воду (100 мл) с последующей экстракцией эфиром (300 мл). Экстракт промывают последовательно насыщенным водным раствором (100 мл) бикарбоната натрия и насыщенным раствором соли (100 мл), сушат над безводным сульфатом магния и перегоняют при пониженном давлении для удаления растворителя, в результате чего указанное в заголовке соединение (4,90 г, 84%) получают в виде желтого кристаллического порошка.
1H-ЯМР (CDCl3) δ: 3,67 (с, 2H), 3,73 (с, 3H), 6,91 (д, J=8,3 Гц, 1H), 7,08 (с, 1H), 8,06 (д, J=8,3 Гц, 1H), 10,59 (с, 1H).
(Стадия 5) Синтез метил-2-(2-метилфениламино)-6-бензоксазолилацетата
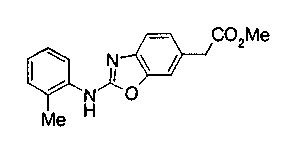
В этаноле (20 мл) растворяют метил-3-гидрокси-4-нитрофенилацетат (1,00 г, 4,74 ммоль) с последующим добавлением катализатора 5% палладий/уголь (500 мг). При перемешивании при комнатной температуре смесь подвергают каталитическому гидрированию в течение 15 часов. После фильтрования реакционной смеси через целит для удаления нерастворимого вещества к фильтрату добавляют 2-толилизотиоцианат (765 мкл, 5,69 ммоль) при перемешивании при комнатной температуре. Реакционную смесь перемешивают в течение 15 часов. После добавления оксида ртути(II) (желтый) (1,72 г, 7,94 ммоль), смесь нагревают при кипячении с обратным холодильником в течение 5 часов при перемешивании. Реакционную смесь затем охлаждают до комнатной температуры. После фильтрования реакционной смеси через целит при пониженном давлении растворитель отгоняют из фильтрата при пониженном давлении. Остаток очищают хроматографией на колонке с силикагелем, в результате чего из фракций элюирования смесью хлороформ-этилацетат (10:1) получают указанное в заголовке соединение (1,18 г, 84%) в виде желтого масла.
1H-ЯМР (CDCl3) δ: 2,35 (с, 3H), 3,69 (с, 2H), 3,70 (с, 3H), 7,07 (т, J=8,1 Гц, 1H), 7,12 (дд, J=8,1, 1,5 Гц, 1H), 7,22-7,33 (м, 3H), 7,40 (д, J=8,1 Гц, 1H), 8,06 (д, J=8,1 Гц, 1H).
(Стадия 6) Синтез 2-(2-метилфениламино)-6-бензотиазолилуксусной кислоты
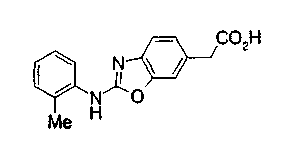
ТГФ (30 мл) и 0,25 н. NaOH (32 мл, 8,00 ммоль) добавляют к метил-2-(2-метилфениламино)-6-бензоксазолилацетату (1,18 г, 3,98 ммоль) с последующим перемешиванием при комнатной температуре в течение 5 часов. Реакционную смесь выливают в 1 н. HCl (50 мл) с последующей экстракцией смесью хлороформ-метанол (5:1, 2×200 мл). Экстракт сушат над безводным сульфатом магния и перегоняют при пониженном давлении для удаления растворителя, в результате чего) получают указанное в заголовке соединение (867 мг, 77%) в виде бледно-желтого аморфного вещества.
1H-ЯМР (ДМСО-d6) δ: 2,31 (с, 3H), 3,64 (с, 2H), 7,09-7,13 (м, 2H), 7,24-7,30 (м, 3H), 7,39 (д, J=1,0 Гц, 1H), 7,80 (дд, J=7,3, 1,5 Гц, 1H).
МС (ESI) m/z, 283 (M++1).
(Стадия 7) Синтез метил-4-((4S)-фтор-1-(2-(2-метилфениламино)-6-бензоксазолилацетил)-(2S)-пирролидинилметокси)бензоата
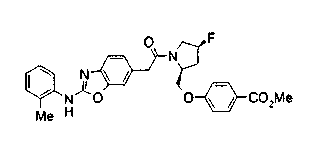
В ДМФ (10 мл) растворяют 2-(2-метилфениламино)-6-бензоксазолилуксусную кислоту (300 мг, 1,06 ммоль) и 4-((4S)-фтор-(2S)-пирролидинилметокси)бензоат (269 мг, 1,06 ммоль). После добавления EDC·HCl (305 мг, 1,59 ммоль), HOBt (кат.) и DMAP (кат.) при перемешивании при комнатной температуре смесь перемешивают при комнатной температуре в течение 15 часов. Добавляют воду (200 мл) и смесь экстрагируют этилацетатом (200 мл). Экстракт промывают насыщенным раствором соли (2×200 мл), сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, в результате чего из элюатных фракций смеси хлороформ-этилацетат (9:1) указанное в заголовке соединение (573 мг, 100%) получают в виде желтой пены.
1H-ЯМР (CDCl3) δ: 2,06-2,59 (ряд м, 5H), 3,68-4,15 (ряд м, 8H), 4,52-4,65 (м, 2H), 5,24 и 5,37 (м, каждый, общий 1H), 6,86-7,42 (ряд м, 9H), 7,94-8,07 (м, 3H).
МС (ESI) m/z, 518 (M++1).
(Стадия 8) Синтез 4-((4S)-фтор-1-(2-(2-метилфениламино)-6-бензоксазолилацетил)-(2S)-пирролидинилметокси)бензойной кислоты

В ТГФ (10 мл) растворяют метил-4-((4S)-фтор-1-(2-(2-метилфениламино)-6-бензоксазолилацетил)-(2S)-пирролидинилметокси)бензоат (573 мг, 1,11 ммоль). После добавления 0,25 н. NaOH (8,8 мл, 2,2 ммоль) при перемешивании при комнатной температуре смесь экстрагируют при комнатной температуре в течение 15 часов. Реакционную смесь выливают в 1 н. HCl (50 мл) с последующей экстракцией смесью хлороформ-метанол (5:1, 2×200 мл). Экстракт промывают безводным сульфатом магния и затем перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси хлороформ-метанол (от 20:1 до 10:1) указанное в заголовке соединение (365 мг, 65%) получают в виде бесцветного кристаллического твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 2,25-2,51 (ряд м, общий 5H, включая c, 3H, при d 2,30), 3,70-4,67 (ряд м, 7H), 5,30-5,50 (м, общий 1H), 7,03-7,09 (м, 4H), 7,24-7,34 (м, 4H), 7,81-7,91 (м, 3H), 9,61 (ушир.с, 1H).
МС (ESI) m/z, 504 (M++1);
Анал. Вычисл. для C28H26FN3O5 ·0,5H2O: C, 65,62; H, 5,31; N, 8,20.
Найдено: C, 65,97; H, 5,61; N, 7,73.
Пример 3
4-((4S)-фтор-1-(4-метокси-2-(2-метилфениламино)-6-бензоксазолилацетил)-(2S)-пирролидинилметокси)бензойная кислота:
(Стадия 1) Синтез 3,5-дифтор-2-нитрофенола
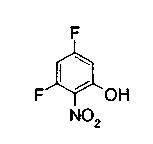
Диметилсульфоксид (который далее обозначается аббревиатурой «ДМСО») (50 мл) и 10 н. NaOH (12 мл, 120 ммоль) добавляют к 1,3,5-трифтор-2-нитробензолу (10,0 г, 56,5 ммоль). Смесь перемешивают при комнатной температуре в течение 15 часов. Добавляют воду (100 мл) и эфир (200 мл) для разделения реакционной смеси на слои. Таким образом полученный водный слой подкисляют 1 н. HCl с последующей экстракцией эфиром (2×200 мл). Экстракт сушат над безводным сульфатом магния и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси хлороформ-этилацетат (10:1) получают указанное в заголовке соединение (7,97 г, 81%) в виде желтого кристаллического порошка.
1H-ЯМР (CDCl3) δ: 6,53-6,59 (м, 1H), 6,66-6,70 (м, 1H), 10,87 (д, J=1,2 Гц, 1H).
(Стадия 2) Синтез 3,5-дифтор-2-нитроанизола
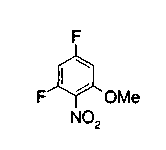
В ДМФ (50 мл) растворяют 3,5-дифтор-2-нитрофенол. Добавляют карбонат калия (10,4 г, 75,5 ммоль) и метилиодид (6,3 мл, 100,6 ммоль) и смесь перемешивают в течение 15 часов при комнатной температуре. Добавляют воду (300 мл) с последующей экстракцией эфиром (500 мл). Экстракт промывают насыщенным раствором соли (2×200 мл), сушат над безводным сульфатом магния и перегоняют при пониженном давлении для удаления растворителя, получая при этом указанное в заголовке соединение (8,29 г, 87%) в виде желтого кристаллического порошка.
1H-ЯМР -ЯМР (ДМСО-d6) δ: 3,97 (с, 3H), 7,21-7,27 (м, 2H).
(Стадия 3) Синтез ди-трет-бутил-3-фтор-5-метокси-4-нитрофенилмалоната
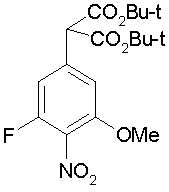
В ДМФ (60 мл) суспендируют гидрид натрия (2,75 г, 68,7 ммоль). При перемешивании при 0°С по каплям добавляют ди-трет-бутилмалонат (14,9 г, 68,7 ммоль). После того как энергичное выделение газообразного водорода прекращается, добавляют раствор 3,5-дифтор-2-нитроанизола (5,20 г, 27,5 ммоль) в ДМФ (40 мл). Реакционную смесь перемешивают при 80°С в течение 4 часов. После охлаждения реакционной смеси до комнатной температуры, добавляют воду (200 мл) для завершения реакции с последующей экстракцией эфиром (300 мл). Экстракт промывают насыщенным раствором соли (200 мл), сушат над безводным сульфатом магния и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси гексан-этилацетат (10:1) получают указанное в заголовке соединение (6,56 г, 62%) в виде желтого масла.
1H-ЯМР (CDCl3) δ: 1,48 (с, 18H), 3,94 (с, 3H), 4,41 (с, 1H), 6,92 (м, 2H).
(Стадия 4) Синтез 3-фтор-5-метокси-4-нитрофенилуксусной кислоты
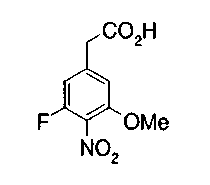
Уксусную кислоту (7 мл) и концентрированную хлористоводородную кислоту (7 мл) добавляют к ди-трет-бутил-3-фтор-5-метокси-4-нитрофенилмалонату (4,88 г, 12,7 ммоль). Смесь нагревают при кипячении с обратным холодильником в течение 15 часов при перемешивании. После охлаждения реакционную смесь перегоняют при пониженном давлении для удаления растворителя. К остатку добавляют 1 н. NaOH (200 мл) и эфир (200 мл) для разделения его на слои. Таким образом полученный водный слой подкисляют 1 н. HCl с последующей экстракцией эфиром (200 мл). Экстракт сушат над безводным сульфатом магния и перегоняют при пониженном давлении для удаления растворителя, тем самым получают указанное в заголовке соединение (2,83 г, 97%) в виде светло-коричневого твердого вещества.
1H-ЯМР (CDCl3) δ: 3,68 (с, 2H), 3,93 (с, 3H), 6,78 (м, 2H), 9,31 (ушир.с, 1H).
(Стадия 5) Метил-3-бензилокси-5-метокси-4-нитрофенилацетат
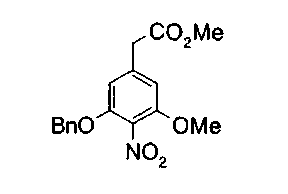
Гидрид натрия (918 мг, 23,0 ммоль) добавляют по частям к бензиловому спирту (30 мл). После того как энергичное выделение газообразного водорода прекратится, к реакционной смеси добавляют раствор 3-фтор-5-метокси-4-нитрофенилуксусной кислоты (2,63 г, 11,5 ммоль) в бензиловом спирте (20 мл). После перемешивания при 50°С в течение 15 часов реакционную смесь охлаждают. К смеси добавляют 1 н. NaOH (100 мл) с последующей экстракцией эфиром (200 мл). После добавления 1 н. HCl к водному слою смесь экстрагируют эфиром (2×20 мл). Экстракт сушат над безводным сульфатом магния и затем перегоняют при пониженном давлении для удаления растворителя, в результате чего получают светло-желтое масло. К образовавшемуся маслу добавляют метанол (50 мл) и концентрированную серную кислоту (0,5 мл) и смесь нагревают и кипятят с обратным холодильником в течение 4 часов при перемешивании. Реакционную смесь затем охлаждают до комнатной температуры. После добавления насыщенного водного раствора бикарбоната натрия для нейтрализации смесь экстрагируют хлороформом (2×250 мл). Экстракт сушат над безводным сульфатом магния и затем перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, тем самым из элюатных фракций хлороформа получают указанное в заголовке соединение (2,77 г, 61%) в виде желтого масла.
1H-ЯМР (CDCl3) δ: 3,58 (с, 2H), 3,69 (с, 3H), 3,88 (с, 3H), 5,15 (с, 2H), 6,55 (с, 1H), 6,60 (д, J=1,2 Гц, 1H), 7,36 (м, 5H).
(Стадия 6) Синтез метил-4-метокси-2-(2-метилфениламино)-6-бензоксазолилацетата

В этаноле (100 мл) растворяют метил-3-бензилокси-5-метокси-4-нитрофенилацетат (2,77 г, 8,36 ммоль) с последующим добавлением катализатора 5% палладий/уголь (1 г) После перемешивания при комнатной температуре образовавшуюся смесь подвергают каталитическому гидрированию в течение 15 часов. Реакционную смесь фильтруют через целит при пониженном давлении для удаления нерастворимого вещества. К фильтрату добавляют 2-толилтиоизоцианат (1,35 мл, 10,0 ммоль) при перемешивании при комнатной температуре. Смесь перемешивают при комнатной температуре в течение 15 часов. Добавляют оксид ртути(II) (желтый) (3,08 г, 14,2 ммоль) и смесь нагревают и кипятят с обратным холодильником в течение 4 часов при перемешивании. После охлаждения реакционной смеси до комнатной температуры нерастворимое вещество отфильтровывают через целит.Остаток, полученный отгонкой растворителя из фильтрата, очищают хроматографией на колонке с силикагелем, тем самым из элюатных фракций смеси хлороформ-этилацетат (4:1) получают указанное в заголовке соединение (1,30 г, 48%) в виде коричневого масла.
1H-ЯМР (CDCl3) δ: 2,33 (с, 3H), 3,66 (с, 2H), 3,71 (д, J=0,49 Гц, 3H), 3,96 (с, 3H), 6,67 (с, 1H), 6,93 (д, J=0,49 Гц, 1H), 7,05 (т, J=7,3 Гц, 1H), 7,20 (д, J=7,3 Гц, 1H), 7,28 (м, 1H), 8,06 (д, J=8,1 Гц, 1H).
(Стадия 7) Синтез 4-метокси-2-(2-метилфениламино)-6-бензоксазолилуксусной кислоты
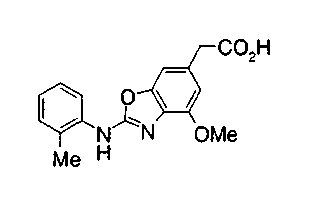
В ТГФ (30 мл) растворяют метил-4-метокси-2-(2-метилфениламино)-6-бензоксазолилацетат (1,30 г, 3,98 ммоль) с последующим добавлением 0,25 н. NaOH (32 мл, 8,00 ммоль). Смесь перемешивают при комнатной температуре в течение 15 часов. Реакционную смесь выливают в 1 н. HCl (100 мл) с последующей экстракцией смесью хлороформ-метанол (4:1, 2×200 мл). Экстракт сушат над безводным сульфатом магния и отгоняют при пониженном давлении для удаления растворителя, тем самым указанное в заголовке соединение (1,24 г, 100%) получают в виде коричневого аморфного вещества.
1H-ЯМР (CDCl3) δ: 2,30 (с, 3H), 3,75 (м, 2H), 3,93 (с, 3H), 6,70 (с, 1H), 6,93 (с, 1H), 7,05 (с, 1H), 7,17-7,21 (м, 2H), 7,74 (д, J=7,1 Гц, 1H).
(Стадия 8) Синтез метил-4-((4S)-фтор-1-(4-метокси-2-(2-метилфениламино)-6-бензоксазолилацетил)-(2S)-пирролидинилметокси)бензоата
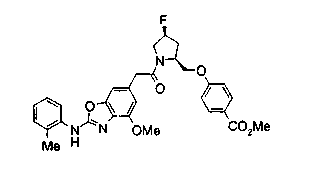
В ДМФ (10 мл) растворяют 4-метокси-2-(2-метилфениламино)-6-бензоксазолилуксусную кислоту (200 мг, 0,640 ммоль) и метил-4-((4S)-фтор-(2S)-пирролидинилметокси)бензоат.EDC·HCl (184 мг, 0,960 ммоль), HOBt (кат.) и DMAP (кат.) добавляют при перемешивании при комнатной температуре и перемешивание продолжают в течение 15 часов. К реакционной смеси добавляют воду (200 мл) с последующей экстракцией этилацетатом (300 мл). Экстракт промывают насыщенным раствором соли (2×200 мл), сушат над безводным сульфатом магния и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, тем самым указанное в заголовке соединение (312 мг, 89%) получают из элюатных фракций смеси хлороформ-метанол (20:1) в виде желтого вязкого масла.
1H-ЯМР (CDCl3) δ: 2,04-2,57 (ряд м, 5H), 3,61-4,14 (ряд м, 11H), 4,48-4,65 (м, 2H), 5,22 и 5,36 (м, каждый, общий 1H), 6,66 (д, J=8,8 Гц, 2H), 7,03-7,08 (м, 1H), 7,20-7,29 (м, 2H), 7,51 (ушир.с, 1H), 7,95-8,03 (м, 2H).
(Стадия 9) Синтез 4-((4S)-фтор-1-(4-метокси-2-(2-метилфениламино)-6-бензоксазолилацетил)-(2S)-пирролидинилметокси)бензойной кислоты

В ТГФ (5 мл) растворяют метил-4-((4S)-фтор-1-(4-метокси-2-(2-метилфениламино)-6-бензоксазолилацетил)-(2S)-пирролидинилметокси)бензоат (312 мг, 0,570 ммоль) с последующим добавлением 0,25 н. NaOH (4,6 мл, 1,15 ммоль). Образовавшуюся смесь нагревают и кипятят с обратным холодильником в течение 4 часов при перемешивании. После охлаждения реакционной смеси до комнатной температуры в нее выливают 1 н. HCl (100 мл). Таким образом образованные кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при пониженном давлении, тем самым указанное в заголовке соединение (100 мг, 33%) получают в виде светло-желтого аморфного вещества.
1H-ЯМР (ДМСО-d6) δ: 2,17-2,51 (ряд м, общий 5H, включая с, 3H, при d 2,30), 3,35-4,66 (ряд м, общий 10H, включая с, 3H, при d 3,89), 5,32-5,51 (м, 1H), 6,68 и 6,99 (с, каждый, общий 1H), 7,03-7,09 (м, 3H), 7,23-7,27 (м, 2H), 7,85-7,92 (м, 3H).
МС (FAB) m/z, 534 (M++1);
Анал. Вычисл. для С29Н28FN3O6·0,25H2O: C, 64,74; H, 5,34; N, 7,81.
Найдено: C, 64,68; H, 5,49; N, 7,67.
Пример 4
4-(4,4-Дифтор-1-(2-(2-метилфениламино)-6-бензоксазолилацетил)-2S-пирролидинилметокси)бензойная кислота:
(Стадия 1) Синтез метил-4-(4,4-дифтор-1-(2-(2-метилфениламино)-6-бензоксазолилацетил)-2S-пирролидинилметокси)бензоата
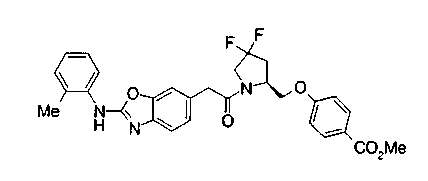
В ДМФ (6,6 мл) растворяют метил-4-(4,4-дифтор-(2S)-пирролидинилметокси)бензоат (160,2 мг, 0,591 ммоль), 2-(2-метилфениламино)-6-бензоксазолилуксусную кислоту (166,7 мг, 0,591 ммоль) и HOBt (16,0 мг, 0,118 ммоль). К образовавшемуся раствору добавляют EDC·HCl (169,8 мг, 0,886 ммоль) при комнатной температуре. Образовавшуюся смесь перемешивают на протяжении ночи при комнатной температуре. После разбавления реакционной смеси этилацетатом разбавленную смесь промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси гексан-этилацетат (1:1, об./об.) получают указанное в заголовке соединение (324,3 мг, 100%) в виде светло-оранжевого аморфного вещества.
1H-ЯМР (CDCl3) δ: 2,37 (3H, с), 2,47-2,70 (2H, м), 3,67 (1H, д, J=15,2 Гц), 3,72 (1H, д, J=15,2 Гц), 3,74-4,02 (общий 5H, м, включая 3H, с при (3,84), 4,19 (1H, м), 4,38 (1H, м), 4,70 (1H, м), 6,80-7,43 (9H, ряд м), 7,95 (2H, м), 8,08 (1H, д, J=8,0 Гц).
(Стадия 2) Синтез 4-(4,4-дифтор-1-(2-(2-метилфениламино)-6-бензоксазолилацетил)-2S-пирролидинилметокси)бензойной кислоты
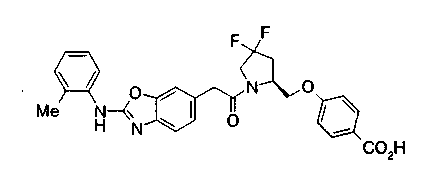
В ТГФ (6,5 мл) растворяют метил-4-(4,4-дифтор-1-(2-(2-метилфениламино)-6-бензоксазолилацетил)-2S-пирролидинилметокси)бензоат (324,3 мг, 0,606 ммоль). К образовавшемуся раствору добавляют 0,25 н. NaOH (6,5 мл) при 0°С.После перемешивания на протяжении ночи при комнатной температуре реакционную смесь далее перемешивают на протяжении ночи при 50°С.Реакционную смесь концентрируют с последующей нейтрализацией 1 н. HCl. Полученные таким образом кристаллы собирают фильтрованием, промывают водой и сушат при 20°С, тем самым получают указанное в заголовке соединение (271,9 мг, 88% для 2 стадий) в виде бледно-коричневого твердого вещества.
ИК (KBr) 3440, 1685, 1641, 1604, 1577 см-1;
1H-ЯМР (ДМСО-d6) δ: 2,28 (3H, с), 2,38-2,86 (2H, м), 3,65-4,27 (6H, м), 4,54 (1H, м), 6,95-7,38 (8H, ряд м), 7,79 (1Н, д, J=8,0 Гц), 7,82-7,93 (3H, м), 9,62 (1H, ушир.с).
МС (ESI) m/z 522 (M++1).
Анал. Вычисл. для С28Н25F2N3O5 (0,75H2O: C, 62,86; H, 4,99; N, 7,85; F, 7,10.
Найдено: C, 63,09; H, 5,04; N, 7,66; F, 6,83.
Пример 5
4-((2S,4S)-1-(2-(2-Хлорфениламино)-6-бензоксазолилацетил)-4-фтор-2-пирролидинилметокси)бензойная кислота:
(Стадия 1) Синтез метил-(2-(2-хлорфениламино)-6-бензоксазолилацетата
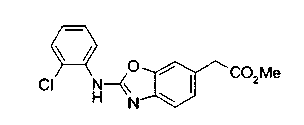
В метаноле (50 мл) растворяют метил-4-амино-3-гидроксифенилацетат (2,30 г, 12,7 ммоль). После добавления 2-метилфенилтиоизоцианата (1,99 мл, 15,2 ммоль) при комнатной температуре смесь перемешивают при комнатной температуре в течение 3 часов. К реакционной смеси добавляют оксид ртути (желтый) (2,75 г, 15,2 ммоль). Смесь затем перемешивают при 50°С в течение 50 минут.После охлаждения до комнатной температуры реакционную смесь концентрируют при пониженном давлении. Полученный таким образом остаток очищают хроматографией на колонке с силикагелем (силикагель: 100 г), посредством чего из элюатных фракций смеси хлороформ-этилацетат (10/1) получают указанное в заголовке соединение (3,35 г, 83%) в виде светло-желтого твердого вещества.
1H-ЯМР (CDCl3) δ: 3,71 (с, 5H), 7,03 (дт, J=7,6,1,5 Гц, 1H), 7,16 (дд, J=8,1, l,7 Гц, 1H), 7,33 (д, J=1,0 Гц, 1H), 7,36-7,43 (м, 3H), 7,46 (д, J=8,1 Гц, 1H), 7,52 (ушир., 1H), 8,55 (дд, J=8,3, 1,7 Гц, 1H).
(Стадия 2) Синтез 2-(2-хлорфениламино)-6-бензоксазолилуксусной кислоты
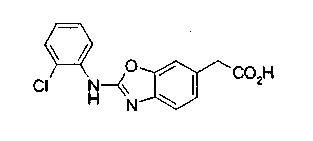
В ТГФ (200 мл) растворяют метил-2-(2-хлорфениламино)-6-бензоксазолилацетат (3,35 г, 10,6 ммоль). После разбавления 0,25 н. NaOH (200 мл) смесь перемешивают при комнатной температуре в течение 16 часов. Реакционную смесь перегоняют при пониженном давлении для удаления растворителя. Остаток подкисляют 1 н. HCl с последующей экстракцией смесью хлороформ/метанол (10/1). Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя, тем самым указанное в заголовке соединение (2,94 г, 92%) получают в виде бледно-коричневого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 3,62 (с, 2H), 7,09 (д, J=7,8 Гц, 1H), 7,19 (т, J=7,1 Гц, 1H), 7,31 (д, J=8,l Гц, 1H), 7,39 (с, 1H), 7,41 (д, J=7,6 Гц, 1H), 7,52 (д, J=7,3 Гц, 1H), 8,08 (д, J=6,8 Гц, 1H), 9,99 (ушир., 1H).
(Стадия 3) Синтез метил-4-((2S,4S)-1-(2-(2-хлорфениламино)-6-бензоксазолилацетил)-4-фтор-2-пирролидинилметокси)бензоата
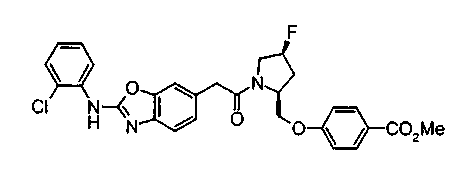
В ДМФ (5 мл) 2-(2-хлорфениламино)-6-бензоксазолилуксусную кислоту (303 мг, 1,0 ммоль), метил-4-((2S,4S)-4-фтор-2-пирролидинилметокси)бензоат (253 мг, 1,0 ммоль), EDC·HCl (288 мг, 1,5 ммоль), HOBt (203 мг, 1,5 ммоль) и триэтиламин (0,70 мл, 5,0 ммоль) перемешивают при комнатной температуре в течение 14 часов. Реакционную смесь выливают в ледяную воду (30 мл) с последующей экстракцией этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем (силикагель: 50 г), посредством чего из элюатных фракций смеси хлороформ-ацетон (10/1) получают указанное в заголовке соединение (360 мг, 67%) в виде бесцветного аморфного вещества.
1H-ЯМР (CDCl3) δ: 2,05-2,30 (м, 1H), 2,35-2,60 (м, 1H), 3,75 (д, J=4,6 Гц, 2H), 3,868 и 3,870 (каждый с, общий 3H, амидные изомеры), 3,88-4,09 (м, 3H), 4,54-4,63 (м, 2H), 5,32 (дт, J=52,8,3,9 Гц, 1H), 6,87 и 6,99 (каждый д, J=8,8 и 9,0 Гц соответственно, общий 2H, амидные изомеры), 7,04 (т, J=6,4 Гц, 1H), 7,14 (д, J=8,1 Гц, 1H), 7,33 (с, 1H), 7,36-7,53 (м, 4H), 7,96 и 7,99 (каждый д, каждый J=9,0 Гц, общий 2H, амидные изомеры), 8,54 (дд, J=8,3,1,2 Гц, 1H).
МС (ESI) m/z 538 (M++1), 540 (M++3).
(Стадия 4) Синтез 4-((2S,4S-1-(2-(2-хлорфениламино)-6-бензоксазолилацетил)-4-фтор-2-пирролидинилметокси)бензойной кислоты
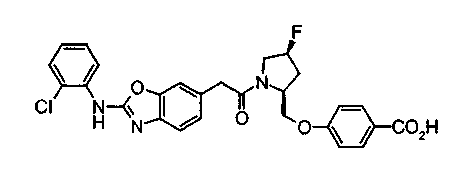
В ТГФ (20 мл) растворяют метил-4-((2S,4S-1-(2-(2-хлорфениламино)-6-бензоксазолилацетил)-4-фтор-2-пирролидинилметокси)бензоат (360 мг, 0,669 ммоль) с последующим добавлением 0,25 н. NaOH (20 мл). Образовавшуюся смесь перемешивают при комнатной температуре в течение 18 часов. Реакционную смесь перегоняют при пониженном давлении для удаления растворителя. Остаток затем подкисляют 1 н. HCl с последующей экстракцией смесью хлороформ/метанол (10/1). Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают тонкослойной хроматографией на силикагеле и разделяют с использованием смеси (хлороформ/метанол (20/1)), посредством чего получают указанное в заголовке соединение (273 мг, 78%) в виде бесцветного аморфного вещества.
ИК (KBr) 3396, 2978, 2941, 1701, 1637, 1603, 1572 см-1;
1H-ЯМР (ДМСО-d6) δ: 2,23-2,37 (м, 2H), 3,32 (ушир., 2H), 3,76-4,72 (м, 7H), 5,31-5,57 (м, 1H), 7,02-7,11 (м, 3H), 7,18 (т, J=6,1 Гц, 1H), 7,28-7,35 (м, 1H), 7,37 (с, 1H), 7,41 (дт, J=8,0,1,5 Гц, 1H), 7,52 (дд, J=8,0,1,2 Гц, 1H), 7,86 и 7,89 (каждый д, J=8,8 и 10,9 Гц соответственно, общий 2H, амидные изомеры), 8,09 (д, J=7,3 Гц, 1H), 8,31 (с, 1H).
МС (ESI) m/z 524 (M++1), 526 (M++3).
Пример 6
4-((2S,4S)-1-(7-Фтор-2-(2-метилфениламино)-6-бензоксазолилацетил)-4-фтор-2-пирролидинилметокси)бензойная кислота:
(Стадия 1) Синтез 1-бензилокси-2,3-дифтор-6-нитробензола
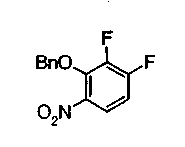
В ТГФ (200 мл) растворяют 2,3-дифтор-6-нитрофенол (10,0 г, 57,1 ммоль) с последующим добавлением карбоната калия (15,8 г, 114,2 ммоль) и бензилбромида (7,47 мл, 62,8 ммоль) при комнатной температуре. Реакционную смесь перемешивают при 60°С в течение 6 часов. К реакционной смеси добавляют ДМФ (100 мл) и смесь перемешивают при 60°С в течение 24 часов. После охлаждении до комнатной температуры реакционную смесь перегоняют при пониженном давлении для удаления растворителя. Остаток разбавляют эфиром (100 мл), промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем (силикагель: 100 г), тем самым из элюатных фракций смеси гексан/этилацетат (4/1) получают указанное в заголовке соединение (4,17 г, 28%) в виде желтого твердого вещества.
1H-ЯМР (CDCl3) δ: 5,29 (с, 2H), 7,00 (м, 1H), 7,38 (м, 3H), 7,46 (м, 2H), 7,66 (м, 1H).
(Стадия 2) Синтез ди-трет-бутил-(3-бензилокси-2-фтор-4-нитрофенил)малоната. 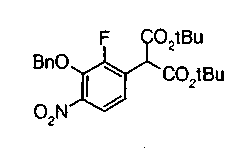
В ТГФ (100 мл) растворяют 1-бензилокси-2,3-дифтор-6-нитробензол (4,17 г, 15,7 ммоль) и ди-трет-бутилмалонат (3,52 мл, 15,7 ммоль). К образовавшемуся раствору добавляют по частям гидрид натрия (60% в масле, 1,26 г, 31,4 ммоль) при перемешивании при 0°С. Реакционную смесь перемешивают при 0°С в течение 30 минут и затем при 80°С в течение 9 часов. Добавляют ди-трет-бутилмалонат (7,04 мл, 31,4 ммоль) и гидрид натрия (60%; 2,52 г, 52,8 ммоль) и смесь перемешивают при 80°С в течение 2 дней. После охлаждения до комнатной температуры реакционную смесь выливают в ледяную воду (100 мл) с последующей экстракцией этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем (силикагель: 200 г), тем самым из элюатных фракций смеси гексан/этилацетат (8/1) получают указанное в заголовке соединение (6,87 г, 95%) в виде оранжевого твердого вещества.
1H-ЯМР (CDCl3) δ: 1,47 (с, 9H), 1,49 (с, 9H), 4,83 (с, 1H), 5,28 (с, 2H), 7,33-7,41 (м, 4H), 7,61 (д, J=8,5 Гц, 1H).
(Стадия 3) Синтез 2-фтор-3-гидрокси-4-нитрофенилуксусной кислоты

Ди-трет-бутил-(3-бензилокси-2-фтор-4-нитрофенил)малонат (6,87 г, 14,9 ммоль), уксусную кислоту (200 мл) и концентрированную хлористоводородную кислоту (35 мл) перемешивают при 120 в течение 6 часов. После охлаждения до комнатной температуры реакционную смесь концентрируют при пониженном давлении, тем самым получают указанное в заголовке соединение в виде коричневого масла (это соединение предоставляют для следующей реакции без дополнительной очистки).
(Стадия 4) Синтез метил-2-фтор-3-гидрокси-4-нитрофенилацетата
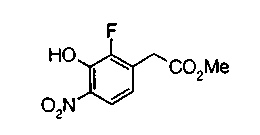
В метаноле (300 мл) вышеуказанную 1-бензилокси-2-фтор-6-нитрофенилуксусную кислоту (14,9 ммоль) и концентрированную серную кислоту (2 мл) перемешивают при 70°С в течение 4 часов. После охлаждения до комнатной температуры реакционную смесь концентрируют при пониженном давлении. Остаток нейтрализуют насыщенным водным раствором бикарбоната натрия с последующей экстракцией хлороформом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем (силикагель: 200 г), тем самым из элюатных фракций смеси гексан/этилацетат (4/1) получают указанное в заголовке соединение (5,22 г, 100%) (2 стадии)) в виде коричневого твердого вещества.
1H-ЯМР (CDCl3) δ: 3,74 (с, 3H), 3,76 (д, J=1,2 Гц, 2H), 6,90 (дд, J=9,0,6,3 Гц, 1H), 7,88 (дд, J=9,0, 2,0 Гц, 1H), 10,51 (с, 1H).
(Стадия 5) Синтез метил-4-амино-3-гидрокси-2-фторфенилацетата
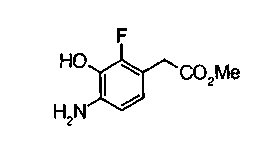
Метил-2-фтор-3-гидрокси-4-нитрофенилацетат (5,22 г, 14,9 ммоль), восстановленный железный порошок (2,66 г, 47,7 ммоль), тригидрат ацетата натрия (2,03 г, 14,9 ммоль) и уксусную кислоту (5,54 мл) нагревают и кипятят с обратным холодильником при 110°С в течение 4 часов в смеси метанол:вода (1:4, 300 мл). После охлаждения до комнатной температуры реакционную смесь фильтруют через целит при пониженном давлении для удаления нерастворимого вещества. Фильтрат затем концентрируют с последующей экстракцией этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем (силикагель: 50 г), тем самым из элюатных фракций смеси гексан/этилацетат (2/1) получают указанное в заголовке соединение (1,29 г, 44%) в виде коричневого масла.
1H-ЯМР (CDCl3) δ: 3,54 (с, 2H), 3,68 (с, 3H), 4,99 (с, 2H), 6,42 (д, J=7,6 Гц, 1H), 6,53 (д, J=7,1 Гц, 1H).
(Стадия 6) Синтез метил-7-фтор-2-(2-метилфениламино)-6-бензоксазолилацетата
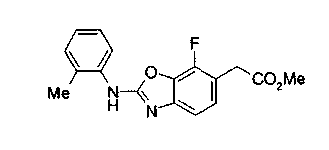
Метил-4-амино-3-гидрокси-2-фторфенилацетат (1,29 г, 6,48 ммоль) растворяют в метаноле (20 мл). При комнатной температуры добавляют о-толилтиоизоцианат (1,05 мл, 7,78 ммоль) и смесь перемешивают в течение 5 часов. К реакционной смеси добавляют оксид ртути(II) (желтый) (1,68 г, 7,77 ммоль) с последующим перемешиванием при 80°С в течение дополнительных 3 часов. После охлаждения реакционной смеси до комнатной температуры растворитель отгоняют при пониженном давлении. Остаток очищают хроматографией на колонке с силикагелем (силикагель: 100 г), тем самым из элюатных фракций смеси хлороформ/этилацетат (10/1) получают указанное в заголовке соединение (1,31 г, 64% (2 стадии)) в виде светло-коричневого твердого вещества.
1H-ЯМР (CDCl3) δ: 2,34 (с, 3H), 3,72 (с, 3H), 3,74 (с, 2H), 7,05-7,10 (м, 2H), 7,15 (д, J=7,8 Гц, 1H), 7,21 (д, J=8,6 Гц, 1H), 7,29 (т, J=7,8 Гц, 1H), 7,32 (ушир., 1H), 8,01 (д, J=8,1 Гц, 1H).
(Стадия 7) Синтез 7-фтор-2-(2-метилфениламино)-6-бензоксазолилуксусной кислоты
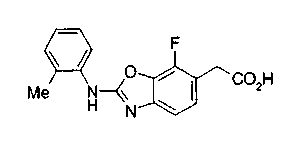
Метил-7-фтор-2-(2-метилфениламино)-6-бензоксазолилацетат (1,31 г, 4,17 ммоль) растворяют в ТГФ (30 мл) с последующим добавлением 0,25 н. NaOH (30 мл). Образовавшуюся смесь перемешивают при комнатной температуре в течение 20 часов. Реакционную смесь перегоняют при пониженном давлении для удаления растворителя. Остаток подкисляют 1 н. HCl с последующей экстракцией смесью хлороформ/метанол (10/1). Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя, посредством чего указанное в заголовке соединение (1,08 г, 86%) получают в виде светло-коричневого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 2,30 (с, 3H), 3,68 (с, 2H), 7,09-7,18 (м, 3H), 7,25 (д, J=6,9 Гц, 2H), 7,80 (д, J=8,1 Гц, 1H), 8,30 (с, 1H), 12,46 (ушир., 1H).
МС (ESI) ra/z 301 (M++1).
(Стадия 8) Синтез метил-4-((2S,4S)-1-(7-Фтор-2-(2-метилфениламино)-6-бензоксазолилацетил)-4-фтор-2-пирролидинилметокси)бензоата
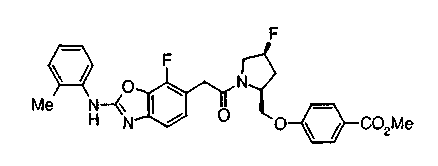
В ДМФ (5 мл) 7-фтор-2-(2-метилфениламино)-6-бензоксазолилуксусную кислоту (300 мг, 1,0 ммоль), метил-4-((2S,4S)-4-фтор-2-пирролидинилметокси)бензоат (253 мг, 1,0 ммоль), EDC·HCl (288 мг, 1,5 ммоль), HOBt (203 мг, 1,5 ммоль) и триэтиламин (0,70 мл, 5,0 ммоль) перемешивают при комнатной температуре в течение 14 часов. После того как реакционную смесь выливают в ледяную воду (20 мл) смесь экстрагируют этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем (силикагель: 50 г), посредством чего из элюатных фракций смеси хлороформ-ацетон (10/1) получают указанное в заголовке соединение (490 мг, 92%) в виде бесцветного аморфного вещества.
1H-ЯМР (CDCl3) δ: 2,10-2,30 (м, 1H), 2,35 (с, 3H), 2,58 (дд, J=19,8, 15,2 Гц, 1H), 3,74 (с, 2H), 3,86 (с, 3H), 3,87-4,22 (м, 3H), 4,54-4,63 (м, 2H), 5,30-5,43 (м, 1H), 6,90 и 6,98 (каждый д, каждый J=9,1 Гц, общий 2H, амидные изомеры), 7,04-7,13 (м, 3H), 7,21 (д, J=7,8 Гц, 2H), 7,30 (т, J=8,1 Гц, 1H), 7,94 (д, J=9,1 Гц, 2H), 8,05 (д, J=8,3 Гц, 1H).
МС (ESI) m/z 536 (M++1).
(Стадия 9) Синтез 4-((2S,4S)-1-(7-Фтор-2-(2-метилфениламино)-6-бензоксазолилацетил)-4-фтор-2-пирролидинилметокси)бензойной кислоты
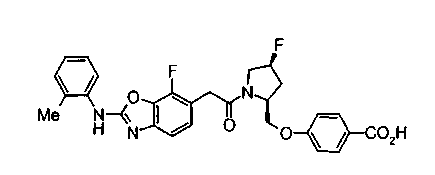
Метил-4-((2S,4S)-1-(7-Фтор-2-(2-метилфениламино)-6-бензоксазолилацетил)-4-фтор-2-пирролидинилметокси)бензоат (490 мг, 0,915 ммоль) растворяют в ТГФ (40 мл). К образовавшемуся раствору добавляют 0,25 н. NaOH (40 мл) с последующим перемешиванием при комнатной температуре в течение 14 часов. Реакционную смесь перегоняют при пониженном давлении для удаления растворителя. Остаток подкисляют 1 н. HCl с последующей экстракцией смесью хлороформ/метанол (10/1). Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем (силикагель: 50 г), посредством чего из элюатных фракций смеси хлороформ/метанол (20/1) получают указанное в заголовке соединение (394 мг, 83%) в виде бесцветного аморфного вещества.
ИК (KBr) 3249, 3051, 2978, 1685, 1641, 1579, 1510 см-1;
1H-ЯМР (ДМСО-d6) δ: 2,20-2,26 (м, 2H), 2,31 (с, 3H), 3,74-4,80 (м, 7H), 5,35-5,55 (м, 1H), 7,03-7,14 (м, 5H), 7,25 (т, J=6,6 Гц, 2H), 7,80 (д, J=8,0 Гц, 1H), 7,86 и 7,90 (каждый д, J=8,8 и 9,0 Гц соответственно, общий 2H, амидные изомеры), 9,89 (ушир., 1H), 12,62 (ушир., 1H).
МС (ESI) m/z 522 (M++1).
Пример 7
4-((4S)-Диметиламино-1-(2-(2-метилфениламино)-6-бензоксазолилацетил)-(2S)-пирролидинилметокси)бензойная кислота:
(Стадия 1) Синтез метил-4-((4S)-диметиламино-1-(2-(2-метилфениламино)-6-бензоксазолилацетил)-(2S)-пирролидинилметокси)бензоата
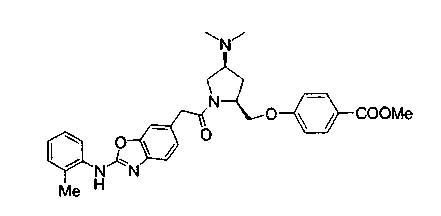
В метиленхлориде (15 мл) EDC·HCl (144 мг, 0,5 ммоль) добавляют к метил-4-((4S)-диметиламино-(2S)- пирролидинилметокси)бензоату (140 мг, 0,5 ммоль), 2-(2-метилфениламино)-6-бензоксазолилуксусной кислоте (141 мг, 0,5 ммоль), HOBt (68 мг, 0,5 ммоль) и триэтиламину (208 мкл, 1,5 ммоль) при перемешивании при 0°С. Реакционную смесь перемешивают при комнатной температуре в течение 16 часов. Затем растворитель отгоняют при пониженном давлении. К остатку добавляют воду (30 мл) и смесь экстрагируют этилацетатом. Экстракт промывают насыщенным водным раствором бикарбоната натрия, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Полученный таким образом остаток очищают тонкослойной хроматографией на силикагеле, посредством чего из элюатных фракций смеси метанол-метиленхлорид (5:95, об./об.) получают указанное в заголовке соединение (230 мг, 85%) в виде бесцветного масла.
1H-ЯМР (CDCl3) δ: 2,24-2,61 (м, 11H), 3,17-3,22 (м, 1H), 3,71-3,87 (м, 5H), 4,11-4,21 (м, 1H), 4,42-4,52 (м, 1H), 6,86-7,37 (м, 9H), 7,94 (д, J=7,6 Гц, 2H), 8,10 (д, J=8,0 Гц, 1H).
(Стадия 2) Синтез 4-((4S)-диметиламино-1-(2-(2-метилфениламино)-6-бензоксазолилацетил)-(2S)-пирролидинилметокси)бензойной кислоты
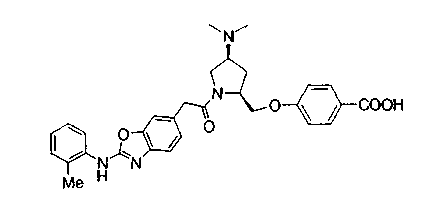
В ТГФ (6,0 мл) и метаноле (3,0 мл) растворяют метил-4-((4S)-диметиламино-1-(2-(2-метилфениламино)-6-бензоксазолилацетил)-(2S)-пирролидинилметокси)бензоат (230 мг, 0,42 ммоль) с последующим добавлением 1 н. NaOH (1,5 мл, 1,5 ммоль). Образовавшуюся смесь перемешивают при 70°С в течение 4 часов. Реакционную смесь концентрируют при пониженном давлении и остаток подкисляют водой и 1 н. HCl. Таким образом полученные кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при пониженном давлении, в результате чего указанное в заголовке соединение (130 мг, 59%) получают в виде белого кристаллического вещества.
ИК (KBr) 2950, 1639, 1573, 1438, 1245, 1166;
1H-ЯМР (ДМСО-de) δ: 1,80-2,50 (м, 11H), 3,50-4,30 (м, 8H), 6,98-7,35 (м, 8H), 7,80-7,87 (м, 3H).
МС (FAB) m/z 529 (M+H)+;
Анал. Вычисл. для С30Н32N4O5·1,3H2O: C, 65,27; H, 6,32; N, 10,15.
Найдено: C, 65,48; H, 6,21; N, 9,88.
Пример 8
4-((2S,4S)-4-Гидрокси-1-(2-(2-метилфениламино)-6-бензоксазолилацетил)-(2S)-2-пирролидинилметокси)бензойная кислота:
(Стадия 1) Синтез метил-4-((2S,4S)-4-ацетокси-1-(2-(2-метилфениламино)-6-бензоксазолилацетил)-2-пирролидинилметокси)бензоата

В ДМФ (10 мл) смесь 2-(2-метилфениламино)-6-бензоксазолилуксусной кислоты (318 мг, 1,13 ммоль), 4-((2S,4S)-4-ацетокси-2-пирролидинилметокси)бензоата (330 мг, 1,13 ммоль), EDC·HCl (325 мг, 1,70 ммоль), HOBt (230 мг, 1,70 ммоль) и триэтиламина (1,18 мл, 8,50 ммоль) перемешивают при комнатной температуре в течение 21 часа. Реакционную смесь выливают в ледяную воду (30 мл) с последующей экстракцией этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем (силикагель: 40 г), посредством чего из элюатных фракций смеси хлороформ/ацетон (20/1) получают указанное в заголовке соединение (610 мг, 97%) в виде бесцветного аморфного вещества.
1H-ЯМР (CDCl3) δ: 2,03 (с, 3H), 2,30 (д, J=2,9 Гц, 2H), 2,36 (с, 3H), 3,56 и 3,59 (каждый с, общий 1H, амидные изомеры), 3,70 (с, 2H), 3,86 (с, 3H), 3,88 (м, 1H), 3,99-4,13 (м, 1H), 4,46-4,60 (м, 2H), 5,29-5,40 (м, 1H), 6,68 и 6,97 (каждый дд, каждый J=8,8 и 2,2 Гц соответственно, общий 2H, амидные изомеры), 7,08 (т, J=7,1 Гц, 2H), 7,22 и 7,24 (каждый с, общий 2H, амидные изомеры), 7,27 и 7,30 (каждый с, общий 2H, амидные изомеры), 7,36 (дд, J=7,8, 2,7 Гц, 1H), 7,96 (дд, J=9,0, 2,4 Гц, 2H), 8,01 и 8,04 (каждый с, общий 1H, амидные изомеры).
МС (ESI) m/z 558 (M++1).
(Стадия 2) Синтез 4-((2S,4S)-4-гидрокси-1-(2-(2-метилфениламино)-6-бензоксазолилацетил)-2-пирролидинилметокси)бензойной кислоты
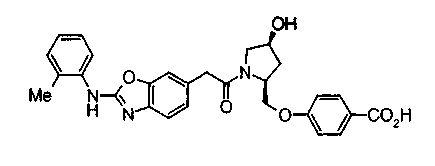
К раствору метил-4-((2S,4S)-4-ацетокси-1-(2-(2-метилфениламино)-6-бензоксазолилацетил)-2-пирролидинилметокси)бензоата (610 мг, 1,09 ммоль) в ТГФ (40 мл) добавляют 0,25 н. NaOH (40 мл). Образовавшуюся смесь перемешивают при комнатной температуре в течение 18 часов. Реакционную смесь концентрируют при пониженном давлении. Остаток подкисляют 1 н. HCl с последующей экстракцией смесью хлороформ-метанол (10/1). Экстракт промывают водой и насыщенным раствором соли, сушат над безводным сульфатом натрия и концентрируют при пониженном давлении для удаления растворителя, в результате чего получают указанное в заголовке соединение (500 мг, 92%) в виде светло-розового аморфного вещества.
ИК (ATR) 3211, 2941, 2877, 1682, 1639, 1604, 1576,
1439 см-1;
1H-ЯМР (ДМСО-d6) δ: 1,91-2,20 (м, 2H), 2,30 (с, 3H), 3,21 (д, J=13,2 Гц, 1H), 3,42 (д, J=11,3 Гц, 1H), 3,71 и 3,73 (каждый д, J=4,7 и 6,1 Гц соответственно, общий 1H, амидные изомеры), 4,18-4,59 (м, 4H), 5,16 и 5,18 (каждый д, каждый J=2,9 Гц, общий 1H, амидные изомеры), 7,01 и 7,08 (каждый д, J=9,1 и 8,3 Гц, общий 1H, амидные изомеры), 7,05 (д, J=9,1 Гц, 2H), 7,20-7,32 (м, 4H), 7,81 (д, J=7,8 Гц, 1H), 7,86 и 7,89 (каждый д, J=8,8 и 9,1 Гц, общий 2H, амидные изомеры), 9,61 (ушир., 1H), 12,56 (ушир., 1H).
МС (ESI) m/z 502 (M++1).
Пример 9
4-((3R,4S)-Изопропилидендиокси-1-(2-(2-метилфениламино)-6-бензоксазолилацетил)-(2R)-пирролидинилметокси)бензойная кислота:
(Стадия 1) Синтез 1-бензилоксикарбонил-(3R,4S)-изопропилидендиокси-(2S)-пирролидинилкарбоновой кислоты
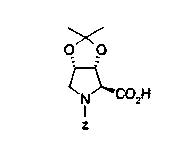
К раствору метил-1-бензилоксикарбонил-(3R,4S)-изопропилидендиокси-2-пирролидинилкарбоксилата в ТГФ (250 мл) добавляют 0,25 н. NaOH (255 мл). Образовавшуюся смесь перемешивают на протяжении ночи при комнатной температуре. Реакционную смесь подкисляют 1 н. HCl с последующей экстракцией этилацетатом. Экстракт сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя, в результате чего указанное в заголовке соединение (9,87 г, 96%) получают в виде бесцветного масла.
1H-ЯМР (CDCl3) δ: 1,32 (с, 3H), 1,46 (д, J=2,7 Гц, 3H), 3,61 (м, 1H), 3,82 и 3,92 (каждый д, каждый J=12,7 Гц, общий 1H, амидные изомеры), 4,58 и 4,64 (каждый с, общий 1H, амидные изомеры),), 4,77 (т, J=5,1 Гц, 1H), 4,83 и 4,89 (каждый д, каждый J=5,9 Гц, общий 1H, амидные изомеры), 5,15 и 5,19 (д и с, J=2,4 Гц, общий 2H, амидные изомеры), 7,31-7,37 (м, 5H).
(Стадия 2) Синтез 1-бензилоксикарбонил-(3R,4S)-изопропилидендиокси-(2R)-пирролидинилметанола
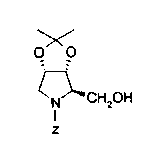
К раствору 1-бензилоксикарбонил-(3R,4S)-изопропилидендиокси-(2S)-пирролидинилкарбоновой кислоты (9,87 г, 30,7 ммоль) в ТГФ (200 мл) добавляют раствор комплекса боран-диметилсульфид (6,14 мл, 61,4 ммоль) при 0°С. После перемешивания при комнатной температуре в течение 2 часов реакционную смесь нагревают и кипятят с обратным холодильником в течение дополнительных 2 часов. Реакционную смесь затем охлаждают до комнатной температуры и концентрируют при пониженном давлении. К остатку добавляют воду (10 мл). Смесь экстрагируют этилацетатом. Экстракт промывают водой и насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем (силикагель: 200 г), посредством чего из элюатных фракций смеси хлороформ-метанол (20/1) получают указанное в заголовке соединение (10,1 г, 100%) в виде бесцветного масла.
1H-ЯМР (CDCl3) δ: 1,31 (с, 3H), 1,45 (с, 3H), 3,56-4,74 (м, 7H), 5,14 (с, 2H), 7,34 (м, 5H).
(Стадия 3) Синтез метил-4-(1-бензилоксикарбонил-(3R,4S)-изопропилидендиокси-(2R)-пирролидинилметокси)бензоата
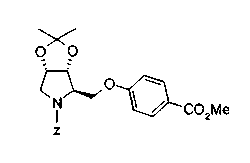
DIAD (138 мл, 0,70 ммоль) добавляют по каплям к раствору 1-бензилоксикарбонил-(3R,4S)-изопропилидендиокси-(2R)-пирролидинилметанола (312 мг, 0,64 ммоль), метил-4-гидроксибензоата (67 мл, 0,70 ммоль) и трифенилфосфина (184 мг, 0,70 ммоль) в ТГФ (7 мл) при перешивании при 0°С в потоке газообразного азота. Реакционную смесь перемешивают при комнатной температуре в течение 3 часов. Остаток, полученный концентрированием реакционной смеси при пониженном давлении, очищают хроматографией на колонке с силикагелем (силикагель: 10 г), посредством чего из элюатных фракций смеси гексан/этилацетат (4/1) получают указанное в заголовке соединение (321 мг, 83%) в виде бесцветного масла.
1H-ЯМР (CDCl3) δ: 1,01 (с, 6H), 1,03 (с, 3H), 2,23 (м, 1H), 2,63 (м, 1H), 3,61 (д, J=12,5 Гц, 1H), 3,80-4,27 (м, 4H), 4,84 (ушир., 1H), 5,01 и 5,08 (АВкв., каждый J=12,2 Гц, общий 1H, амидные изомеры), 6,75-6,87 (м, 3H), 7,19-7,63 (м, 15H).
(Стадия 4) Синтез метил-4-((3R,4S)-изопропилидендиокси-(2R)-пирролидинилметокси)бензоата
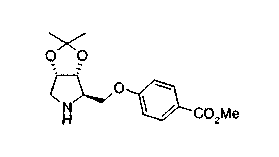
В этаноле (170 мл) суспендируют метил-4-(1-бензилоксикарбонил-(3R,4S)-изопропилидендиокси-(2R)-пирролидинилметокси)бензоат (2,37 г, 5,76 ммоль) и 10% палладий на угле (240 мг) с последующим каталитическим гидрированием в течение одного дня при перемешивании при комнатной температуре и нормальном давлении. Катализатор отфильтровывают и фильтрат концентрируют при пониженном давлении. Полученный таким образом остаток очищают хроматографией на колонке с силикагелем (силикагель: 100 г), посредством чего из элюатных фракций смеси хлороформ/ацетон (20/1) получают указанное в заголовке соединение (930 мг, 53%) в виде коричневого масла.
1H-ЯМР (CDCl3) δ: 1,35 (с, 3H), 1,50 (с, 3H), 3,02 (дд, J=13,7, 4,1 Гц, 1H), 3,13 (д, J=13,7 Гц, 1H), 3,58 (т, J=6,3 Гц, 1H), 3,88 (с, 3H), 3,90 (дд, J=9,3, 6,6 Гц, 1H), 4,02 (дд, J=9,5, 3,9 Гц, 1H), 4,74 (д, J=5,6 Гц, 1H), 4,79 (м, 1H), 6,90 (д, J=9,0 Гц, 2H), 7,98 (д, J=9,0 Гц, 2H).
(Стадия 5) Синтез метил-4-((3R,4S)-изопропилидендиокси-1-(2-(2-метилфениламино)-6-бензоксазолилацетил)-(2R)-пирролидинилметокси)бензоата
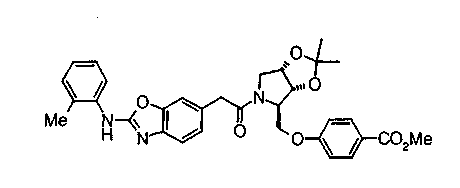
В ДМФ (10 мл) смесь 2-(2-метилфениламино)-6-бензоксазолилуксусной кислоты (184 мг, 0,651 ммоль), метил-4-((3R,4S)-изопропилидендиокси-(2R)-пирролидинилметокси)бензоата (200 мг, 0,651 ммоль), EDC·HCl (187 мг, 0,977 ммоль), 1-гидроксибензотриазола (132 мг, 0,977 ммоль) и триэтиламина (0,45 мл, 3,26 ммоль) перемешивают при комнатной температуре в течение 22 часов. Реакционную смесь выливают в ледяную воду (30 мл) и смесь экстрагируют этилацетатом. Экстракт промывают водой и насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Полученный таким образом остаток разделяют и очищают тонкослойной хроматографией на силикагеле с применением смеси (хлороформ/ацетон (5/1)), посредством чего получают указанное в заголовке соединение (389 мг, 100%) в виде бесцветного аморфного вещества.
1H-ЯМР (CDCl3) δ: 1,32 (с, 3H), 1,40 (с, 3H), 2,35 (с, 3H), 3,67-3,78 (м, 4H), 3,79 (с, 3H), 4,13 (дд, J=9,8, 1,9 Гц, 1H), 4,43 (дд, J=9,8, 3,4 Гц, 1H), 4,68 (с, 1H), 4,80 (д, J=6,1 Гц, 1H), 4,89 (т, J=5,4 Гц, 1H), 6,76 (д, J=8,8 Гц, 2H), 7,03 (д, J=8,l Гц/ 1H), 7,07 (д, J=7,3 Гц, 1H), 7,13 (с, 2H), 7,21 (д, J=7,3 Гц, 1H), 7,29-7,38 (м, 2H), 7,93 (дд, J=7,1, 1,7 Гц, 2H), 8,05 (д, J=8,1 Гц, 1H). МС (ESI) m/z 572 (M++1).
(Стадия 6) Синтез 4-((3R,4S)-3,4-изопропилидендиокси-1-(2-(2-метилфениламино)-6-бензоксазолилацетил)-(2R)-пирролидинилметокси)бензойной кислоты
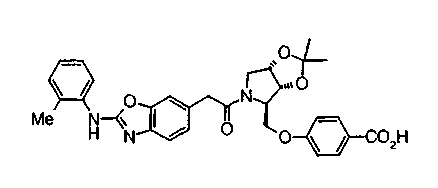
К раствору метил-4-((3R,4S)-изопропилидендиокси-1-(2-(2-метилфениламино)-6-бензоксазолилацетил)-(2R)-пирролидинилметокси)бензоата (188 мг, 0,329 ммоль) в ТГФ (15 мл) добавляют 0,25 н. NaOH (15 мл). Образовавшуюся смесь перемешивают при комнатной температуре в течение 17 часов. Реакционную смесь затем концентрируют при пониженном давлении. Полученный таким образом остаток подкисляют 1 н. HCl. Осажденные таким образом кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при пониженном давлении, посредством чего указанное в заголовке соединение (149 мг, 81%) получают в виде бесцветного твердого вещества.
ИК (ATR) 2989, 2939, 1685, 1639, 1604, 1576, 1510 см-1;
1H-ЯМР (ДМСО-d6) δ: 1,18, 1,23, 1,25 и 1,30 (каждый с, общий 6H, амидные изомеры), 2,39 (с, 3H), 3,65 и 3,69 (каждый д, J=6,1 и 5,4 Гц соответственно, общий 1H, амидные изомеры), 3,74 и 3,78 (каждый с, общий 1H, амидные изомеры), 3,82 и 3,85 (каждый с, общий 1H, амидные изомеры), 3,92 и 3,95 (каждый д, J=7,8 и 6,1 Гц соответственно, общий 1H, амидные изомеры), 4,11-4,20 (м, 2H), 4,43 и 4,54 (м и т, J=4,4 Гц, общий 1H, амидные изомеры), 4,74 (дд, J=6,1,2,4 Гц, 1H), 4,84 и 4,92 (каждый т, J=4,4 и 3,9 Гц соответственно, общий 1H, амидные изомеры), 7,00 (с, 1H), 7,02 (с, 1H), 7,02 (с, 1H), 7,04 (с, 1H), 7,08 (д, J=7,1 Гц, 1H), 7,19-7,25 (м, 3H), 7,31 и 7,33 (каждый с, общий 1H, амидные изомеры), 7,79 (д, J=7,8 Гц, 1H), 7,86 и 7,89 (каждый дд, каждый J=9,1, 2,2 Гц, общий 2H, амидные изомеры), 9,61 (ушир., 1H);
МС (ESI) m/z 558 (M++1);
Анал. Вычисл. для C31H31N3O7·0,7H2O: C, 65,30; H, 5,73; N, 7,37.
Найдено: C, 65,46; H, 5,67; N, 7,04.
Пример 10
4-((3R,4S)-Дигидрокси-1-(2-(2-метилфениламино)-6-бензоксазолилацетил)-(2R)-пирролидинилметокси)бензойная кислота:
(Стадия 1) Синтез метил-4-((3R,4S)-дигидрокси-1-(2-(2-метилфениламино)-6-бензоксазолилацетил)-(2R)-пирролидинилметокси)бензоата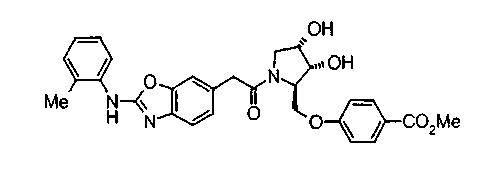
Смесь метил-4-((3R,4S)-изопропилидендиокси-1-(2-(2-метилфениламино)-6-бензоксазолилацетил)-(2R)-пирролидинилметокси)бензоата (201 мг, 0,352 ммоль) и метанола, в который введен газообразный HCl (20 мл), перемешивают при комнатной температуре в течение 16 часов. Реакционную смесь концентрируют при пониженном давлении. К остатку добавляют воду (30 мл) и смесь экстрагируют этилацетатом. Экстракт промывают насыщенным водным раствором бикарбоната натрия и насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя, в результате чего указанное в заголовке соединение (144 мг, 77%) получают в виде аморфного вещества (это соединение предоставляют для следующей реакции без дополнительной очистки).
(Стадия 2) Синтез 4-((3R,4S)-дигидрокси-1-(2-(2-метилфениламино)-6-бензоксазолилацетил)-(2R)-пирролидинилметокси)бензойной кислоты
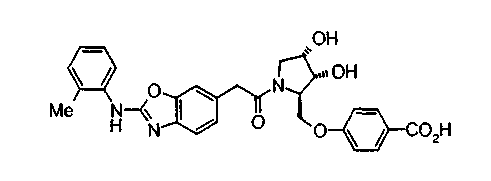
К раствору метил-4-((3R,4S)-дигидрокси-1-(2-(2-метилфениламино)-6-бензоксазолилацетил)-(2R)-пирролидинилметокси)бензоата (144 мг, 0,271 ммоль) в ТГФ (4 мл) добавляют 0,25 н. NaOH (4 мл). Образовавшуюся смесь перемешивают при комнатной температуре в течение 21 часа. Реакционную смесь концентрируют при пониженном давлении. После добавления к остатку 1 н. HCl для его подкисления смесь экстрагируют смесью хлороформ/метанол (10/1). Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Полученный таким образом остаток очищают хроматографией на тонкослойной колонке силикагеля с использованием смеси (хлороформ/метанол (10/1), в результате чего указанное в заголовке соединение (24 мг, 17%) получают в виде бесцветного аморфного вещества.
ИК (ATR) 3205, 3060, 2937, 1687, 1639, 1604, 1576, 1512, 1487, 1439 см-1;
1H-ЯМР (ДМСО-d6) δ: 2,30 (с, 3H), 3,39 (м, 1H), 3,65-3,80 (м, 3H), 4,00 (д, J=2,9 Гц, 1H), 4,04 (с, 1H), 4,15-4,23 (м, 2H), 4,30 (д, J=3,9 Гц, 1H), 5,08 (ушир., 2H), 7,02 (д, J=8,8 Гц, 3H), 7,07 (т, J=7,3 Гц, 1H), 7,23 (д, J=7,6 Гц, 3H), 7,30 (с, 2H), 7,80 (д, J=8,1 Гц, 1H), 7,86 (д, J=8,8 Гц, 2H), 9,60 (ушир., 1H).
МС (ESI) m/z 518 (M++1).
Пример 11
4-((2S,4S)-1-(2-(2-Метилфениламино)-6-бензоксазолилацетил)-4-(2-нафтилокси)-2-пирролидинилметокси)бензойная кислота:
(Стадия 1) Синтез метил-(2S,4S)-1-трет-бутоксикарбонил-4-(2-нафтилокси)-2-пирролидинилкарбоксилата
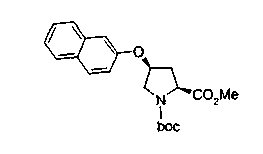
DIAD (3,72 мл, 18,9 ммоль) добавляют к раствору метил-(2S,4S)-1-трет-бутоксикарбонил-4-гидрокси-2-пирролидинилкарбоксилата (4,22 г, 17,2 ммоль), 2-нафтола (2,73 г, 18,9 ммоль и трифенилфосфина (4,96 г, 18,9 ммоль) в ТГФ (80 мл) при перемешивании при комнатной температуре в потоке газообразного азота. Смесь перемешивают на протяжении ночи при комнатной температуре. Остаток, который получают концентрированием реакционной смеси при пониженном давлении, очищают хроматографией на колонке с силикагелем (силикагель: 600 г), посредством чего из элюатных фракций смеси хлороформ/этилацетат (10/1) получают указанное в заголовке соединение (5,37 г) в виде аморфного вещества (это соединение применяют для следующей реакции без дополнительной очистки).
(Стадия 2) Синтез (2S,4S)-1-трет-бутоксикарбонил-4-(2-нафтилокси)-2-пирролидинилкарбоновой кислоты

К раствору метил-(2S,4S)-1-трет-бутоксикарбонил-4-(2-нафтилокси)-2-пирролидинилкарбоксилата (5,37 г) в ТГФ (116 мл) добавляют 0,25 н. NaOH (116 мл, 29,0 ммоль). Образовавшуюся смесь перемешивают на протяжении ночи при комнатной температуре. Реакционную смесь концентрируют при пониженном давлении. Остаток подкисляют 1 н. HCl с последующей экстракцией хлороформом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Полученный таким образом остаток перекристаллизовывают из смеси гексан-хлороформ, в результате чего указанное в заголовке соединение (4,44 г, 85%) (2 стадии) получают в виде белого кристаллического порошка.
1H-ЯМР (ДМСО-d6) δ: 1,37 и 1,41 (каждый с, общий 9H, амидные изомеры), 2,26 (д, J=13,9 Гц, 1H), 2,65 (м, 1H), 3,47 (д, J=11,5 Гц, 1H), 3,81 (м, 1H), 4,30 (м, 1H), 5,14 (м, 1H), 7,02-7,86 (м, 7H).
(Стадия 3) Синтез (2S,4S)-1-трет-бутоксикарбонил-4-(2-нафтилокси)-2-пирролидинилметанола
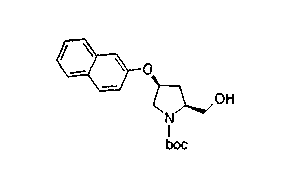
Комплекс боран-диметилсульфид (0,63 мл, 6,3 ммоль) добавляют к раствору (2S,4S)-1-трет-бутоксикарбонил-4-(2-нафтилокси)-2-пирролидинилкарбоновой кислоты (1,12 г, 3,13 ммоль) в ТГФ (30 мл) при перемешивании при 0°С.Реакционную смесь перемешивают при 50°С в течение 1,5 часа. После охлаждения реакционной смеси до 0°С к ней добавляют воду (20 мл). Смесь затем экстрагируют этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем (силикагель: 50 г), посредством чего из элюатных фракций смеси хлороформ/метанол (50/1) получают указанное в заголовке соединение (1,10 г, 100%) в виде светло-желтого масла.
1H-ЯМР (CDCl3) δ: 1,48 (с, 9H), 2,45 (м, 1H), 3,58-4,80 (м, 4H), 5,01 (ушир., 1H), 7,04-7,99 (м, 7H).
(Стадия 4) Синтез метил-4-((2S,4S)-1-трет-бутоксикарбонил-4-(2-нафтилокси)-2-пирролидинилметокси)бензоата
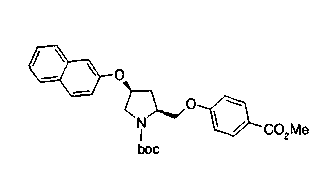
DIAD (0,37 мл, 1,86 ммоль) добавляют к раствору (2S,4S)-1-трет-бутоксикарбонил-4-(2-нафтилокси)-2-пирролидинилметанола (640 мг, 1,86 ммоль), метил-4-гидроксибензоата (283 мл, 1,86 ммоль) и трифенилфосфина (488 мг, 1,86 ммоль) в ТГФ (18 мл) при перешивании при комнатной температуре в потоке газообразного азота. Реакционную смесь перемешивают при комнатной температуре в течение ночи при комнатной температуре. Остаток, полученный концентрированием реакционной смеси при пониженном давлении, очищают хроматографией на колонке с силикагелем (силикагель: 100 г), посредством чего из элюатных фракций смеси гексан/этилацетат (2/1) получают указанное в заголовке соединение (830 мг, 93%) в виде бесцветного масла.
1H-ЯМР (CDCl3) δ: 1,49 и 1,51 (каждый с, общий 9H, амидные изомеры), 2,34 (м, 1H), 2,53 (д, J=14,2 Гц, 1H), 3,72-3,85 (м, 1H), 3,86 и 3,87 (каждый с, общий 3H, амидные изомеры), 4,17 (м, 1H), 4,26-4,52 (м, 2H), 5,06 (ушир., 1H), 6,87 (д, J=8,8 Гц, 1H), 6,94 (д, J=8,8 Гц, 2H), 7,04 (ушир., 2H), 7,33 (т, J=7,3 Гц, 1H), 7,42 (т, J=7,3 Гц, 1H), 7,64-8,02 (м, 5H).
(Стадия 5) Синтез метил-4-((2S,4S)-4-(2-нафтилокси)-2-пирролидинилметокси)бензоата
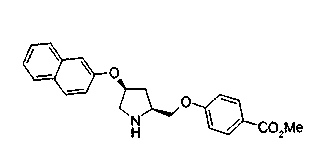
Трифторуксусную кислоту (6 мл) добавляют к раствору метил-4-(2S,4S)-1-трет-бутоксикарбонил-4-(2-нафтилокси)-2-пирролидинилметокси)бензоата (870 мг, 1,74 ммоль) в метиленхлориде (24 мл). Образовавшуюся смесь перемешивают на протяжении ночи при комнатной температуре. К остатку, полученному концентрированием реакционной смеси при пониженном давлении, добавляют 1 н. NaOH при охлаждении льдом, чтобы сделать остаток щелочным, с последующей экстракцией метиленхлоридом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем (силикагель: 100 г), посредством чего из элюатных фракций смеси гексан/этилацетат (2/1) получают указанное в заголовке соединение (750 мг, 100%) в виде черного масла.
1H-ЯМР (CDCl3) δ: 1,99 (дд, J=14,2, 5,G Гц, 1H), 2,48 (м, 1H), 3,22 (дд, J=12,2, 4,G Гц, 1H), 3,43 (д, J=12,5 Гц, 1H), 3,67 (м, 1H), 3,86 и 3,87 (каждый с, общий 3H, амидные изомеры), 4,11 (м, 2H), 5,04 (м, 1H), 6,83 (д, J=8,5 Гц, 1H), 6,89 (д, J=8,8 Гц, 2H), 7,07 (д, J=2,0 Гц, 1H), 7,12 (д, J=9,0 Гц, 1H), 7,33 (дт, J=8,1,1,2 Гц, 1H), 7,44 (дт, J=6,8,1,2 Гц, 1H), 7,70 (д, J=8,1 Гц, 1H), 7,75 (дд, J=9,0, 5,1 Гц, 2H), 7,90 (д, J=8,5 Гц, 1H), 7,96 (дд, J=6,8, 2,0 Гц, 2H).
(Стадия 6) Синтез метил-4-((2S,4S)-1-(2-(2-метилфениламино)-6-бензоксазолилацетил)-4-(2-нафтилокси)-2-пирролидинилметокси)бензоата
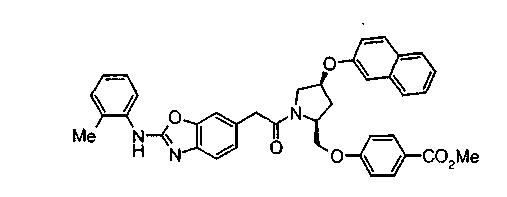
В ДМФ (10 мл) смесь 2-(2-метилфениламино)-6-бензоксазолилуксусной кислоты (141 мг, 0,50 ммоль), метил-4-((2S,4S)-4-(2-нафтилокси)-2-пирролидинилметокси)бензоата (189 мг, 0,50 ммоль), EDC·HCl (144 мг, 0,75 ммоль), HOBt (101 мг, 0,75 ммоль) и триэтиламина перемешивают при комнатной температуре в течение 16 часов. Реакционную смесь выливают в ледяную воду (30 мл) с последующей экстракцией этилацетатом. Экстракт промывают ледяной водой и насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток разделяют и очищают хроматографией на колонке с тонкослойным силикагелем с применением смеси (хлороформ/ацетон (5/1)), посредством чего получают указанное в заголовке соединение (312 мг, 97%) в виде бесцветного аморфного вещества.
1H-ЯМР (CDCl3) δ: 2,35 и 2,36 (каждый с, общий 3H, амидные изомеры), 2,38 и 2,57 (м и д, J=14,5 Гц, общий 1H, амидные изомеры), 3,74 (с, 2H), 3,86 (с, 3H), 3,88 и 3,94 (м и дд, J=12,7, 5,2 Гц, общий 1H, амидные изомеры), 4,17-4,31 (м, 2H), 4,56 (дд, J=9,3, 3,7 Гц, 1H), 4,65 (м, 1H), 5,12 (ушир., 1H), 6,83 и 6,86 (ушир., и д, J=8,8 Гц соответственно, общий 1H, амидные изомеры), 6,97 (д, J=8,8 Гц, 1H), 7,04-7,13 (м, 4H), 7,22 (д, J=7,3 Гц, 1H), 7,26-7,33 (м, 2H), 7,35 (д, J=8,0 Гц, 1H), 8,39 (т, J=8,1 Гц, 1H), 7,44 (т, J=6,9 Гц, 1H), 7,67 (д, J=8,1 Гц, 1H), 7,74 (т, J=10,3 Гц, 2H), 7,94 и 7,98 (каждый д, каждый J=8,6 Гц, общий 2H, амидные изомеры), 8,08 (д, J=8,6 Гц, 1H).
МС (ESI) m/z 642 (M++1).
(Стадия 7) Синтез 4-((2S,4S)-1-(2-(2-метилфениламино)-6-бензоксазолилацетил)-4-(2-нафтилокси)-2-пирролидинилметокси)бензойной кислоты
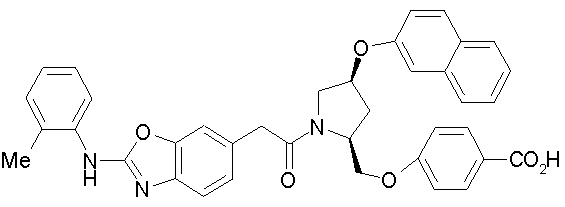
К раствору метил-4-((2S,4S)-1-(2-(2-метилфениламино)-6-бензоксазолилацетил)-4-(2-нафтилокси)-2-пирролидинилметокси)бензоата (312 мг, 0,486 ммоль) в ТГФ (20 мл) добавляют 0,25 н. NaOH (20 мл). Образовавшуюся смесь перемешивают при комнатной температуре в течение 15 часов. Реакционную смесь затем концентрируют при пониженном давлении. Остаток подкисляют 1 н. HCl. Осажденные таким образом кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при пониженном давлении, в результате чего указанное в заголовке соединение (253 мг, 83%) получают в виде светло-розового твердого вещества.
ИК (ATR) 3060, 2941, 2879, 1682, 1639, 1603, 1576, 1510, 1439 см-1;
1H-ЯМР (ДМСО-d6) δ: 2,30 (с, 3H), 2,31-2,44 (м, 1H), 3,78 (с, 2H), 3,86 и 3,89 (каждый с, общий 1H, амидные изомеры), 3,99-4,78 (м, 5H), 5,25 и 5,32 (каждый м, общий 1H, амидные изомеры), 7,02-7,10 (м, 4H), 7,16 (дд, J=9,2, 2,2 Гц, 1H), 7,24 (м, 1H), 7,25 (с, 1H), 7,27 (м, 1H), 7,33-7,38 (м, 3H), 7,46 (т, J=7,1 Гц, 1H), 7,77-7,89 (м, 7H), 9,62 (ушир., 1H).
МС (ESI) m/z 470 (M++1);
Анал. Вычисл. для С38Н33N3O6·1,0 H2O: C, 70,68; H, 5,46; N, 6,51.
Найдено: C, 70,51; H, 5,41; N, 6,27.
Пример 12
4-((2S,4S)-1-(2-(2-Метилфениламино)-6-бензоксазолилацетил)-4-фенокси-2-пирролидинилметокси)бензойная кислота:
(Стадия 1) Синтез метил-(2S,4S)-1-трет-бутоксикарбонил-4-фенокси-2-пирролидинилкарбоксилата
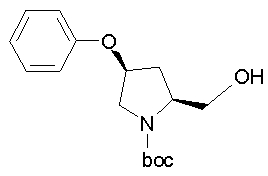
DIAD (4,13 мл, 21,0 ммоль) добавляют к раствору метил-(2S,4S)-1-трет-бутоксикарбонил-4-гидрокси-2-пирролидинилкарбоксилата (4,69 г, 19,1 ммоль), фенола (1,98 л, 21,0 ммоль) и трифенилфосфина (5,51 г, 21,0 ммоль) в ТГФ (80 мл) при перешивании при комнатной температуре в потоке газообразного азота. Реакционную смесь перемешивают при комнатной температуре в течение ночи. Остаток, полученный концентрированием реакционной смеси при пониженном давлении, очищают хроматографией на колонке с силикагелем (силикагель: 700 г), посредством чего из элюатных фракций смеси хлороформ/этилацетат (10/1) получают указанное в заголовке соединение (5,31 мг, 86%) в виде бесцветного масла.
1H-ЯМР (CDCl3) δ: 1,43 и 1,48 (каждый ушир., общий 9H, амидные изомеры), 2,48 (м, 1H), 3,75 (ушир., 3H), 4,42-4,96 (м, 2H), 6,88-7,35 (м, 5H).
(Стадия 2) Синтез (2S,4S)-1-трет-бутоксикарбонил-4-фенокси-2-пирролидинилкарбоновой кислоты

К раствору метил-(2S,4S)-1-трет-бутоксикарбонил-4-фенокси-2-пирролидинилкарбоксилата (5,31 г, 16,5 ммоль) в ТГФ (132 мл) добавляют 0,25 н. NaOH (132 мл, 33,0 ммоль). Реакционную смесь перемешивают при комнатной температуре. Остаток, полученный концентрированием реакционной смеси при пониженном давлении, подкисляют 1 н. HCl с последующей экстракцией хлороформом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Полученные таким образом сырые кристаллы перекристаллизовывают из смеси гексан-хлороформ, в результате чего указанное в заголовке соединение (2,96 г, 58%) получают в виде белого кристаллического порошка.
1H-ЯМР (ДМСО-d6) δ: 1,36 (с, 9H), 2,16 (д, J=13,2 Гц, 1H), 2,56 (м, 1H), 3,46 (м, 1H), 3,71 (дт, J=12,0, 5,4 Гц, 1H), 4,26 (дт, J=9,5, 7,1 Гц, 1H), 4,99 (м, 1H), 6,85 (м, 2H), 6,94 (т, J=7,3 Гц, 1H), 7,28 (т, J=7,3 Гц, 1H).
(Стадия 3) Синтез (2S,4S)-1-трет-бутоксикарбонил-4-фенокси-2-пирролидинилметанола
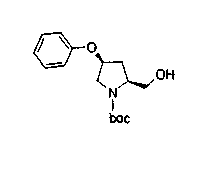
Комплекс боран-диметилсульфид (1,55 мл, 15,5 ммоль) добавляют к раствору (2S,4S)-1-трет-бутоксикарбонил-4-фенокси-2-пирролидинилкарбоновой кислоты (2,39 г, 7,76 ммоль) в ТГФ (50 мл) при перемешивании при 0°С.Реакционную смесь перемешивают при такой же температуре в течение 10 минут и затем при 50°С в течение 2 часов. После охлаждения реакционной смеси до 0°С к ней добавляют воду (30 мл) с последующей экстракцией этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем (силикагель: 60 г), посредством чего из элюатных фракций смеси хлороформ/метанол (50/1) получают указанное в заголовке соединение (2,83 г, 100%) в виде бесцветного масла.
1H-ЯМР (CDCl3) δ: 1,47 (с, 9H), 1,95 (ушир., 1H), 2,36 (м, 1H), 3,56-3,74 (м, 3H), 3,89-4,52 (м, 3H), 4,85 (ушир., 1H), 6,84 (дд, J=8,8, 1,2 Гц, 2H), 6,97 (т, J=7,2 Гц, 1H), 7,29 (т, 2H, J=7,8 Гц).
(Стадия 4) Синтез метил-4-((2S,4S)-1-трет-бутоксикарбонил-4-фенокси-2-пирролидинилметокси)бензоата
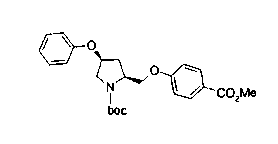
DIAD (0,64 мл, 3,25 ммоль) добавляют по каплям при перемешивании к смеси (2S,4S)-1-трет-бутоксикарбонил-4-фенокси-2-пирролидинилметанола (1,16 г, 3,25 ммоль), метил-4-гидроксибензоата (494 мг, 3,25 ммоль) и трифенилфосфина (852 мг, 3,25 ммоль) в ТГФ (30 мл) при комнатной температуре в потоке газообразного азота. После завершения добавления по каплям реакционную смесь перемешивают при комнатной температуре в течение 20 минут и при 80°С в течение 8 часов. После охлаждения реакционную смесь концентрируют при пониженном давлении. Остаток очищают хроматографией на колонке с силикагелем (силикагель: 200 г), посредством чего из элюатных фракций смеси хлороформ/этилацетат (20/1) получают указанное в заголовке соединение (2,07 мг, 100%) в виде бесцветного масла.
1H-ЯМР (CDCl3) δ: 1,56 (с, 9H), 2,30 (м, 1H), 2,47 и 2,49 (каждый ушир., общий 1H, амидные изомеры), 3,69-3,80 (м, 3H), 3,88 (с, 3H), 4,08-4,49 (м, 2H), 4,94 (т, J=4,9 Гц, 1H), 6,82 (д, J=8,1 Гц, 2H), 6,96 (м, 3H), 7,27 (м, 2H), 7,96 (д, J=8,1 Гц, 2H).
(Стадия 5) Синтез метил-4-((2S,4S)-4-фенокси-2-пирролидинилметокси)бензоата

Трифторуксусную кислоту (20 мл) добавляют к раствору метил-4-((2S,4S)-1-трет-бутоксикарбонил-4-фенокси-2-пирролидинилметокси)бензоата (2,02 г, 3,25 ммоль) в метиленхлориде (100 мл). Образовавшуюся смесь перемешивают при комнатной температуре в течение 5 часов. Реакционную смесь затем концентрируют при пониженном давлении. Остаток разбавляют метиленхлоридом (50 мл) с последующим промыванием 1 н. NaOH. Органический слой фракционируют с последующим промыванием насыщенным раствором соли, сушкой над безводным сульфатом натрия и перегонкой при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем (силикагель: 70 г), посредством чего из элюатных фракций смеси хлороформ/ацетон (10/1) - хлороформ/метанол (10/1) получают указанное в заголовке соединение (970 мг, 91%) в виде коричневого масла.
1H-ЯМР (CDCl3) δ: 1,88 (дд, J=12,9, 4,3 Гц, 1H), 2,39 (кв.кв., J=6,8,6,8 Гц, 1H), 2,83 (ушир., 1H), 3,19 (дд, J=12,0, 5,1 Гц, 1H), 3,33 (д, J=12,0 Гц, 1H), 3,64 (м, 1H), 3,87 (с, 3H), 4,07 (м, 2H), 4,88 (м, 1H), 6,86 (д, J=8,5 Гц, 2H), 6,90 (д, J=7,1 Гц, 2H), 6,94 (д, J=7,3 Гц, 1H), 7,26 (д, J=7,3 Гц, 2H), 7,96 (д, J=9,0 Гц, 2H).
(Стадия 6) Синтез метил-4-((2S,4S)-1-(2-(2-метилфениламино)-6-бензоксазолилацетил)-4-фенокси-2-пирролидинилметокси)бензоата
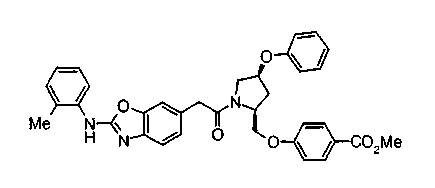
В ДМФ (10 мл) смесь 2-(2-метилфениламино)-6-бензоксазолилуксусной кислоты (351 мг, 1,07 ммоль), метил-4-((2S,4S)-4-фенокси-2-пирролидинилметокси)бензоата (303 мг, 1,07 ммоль), EDC·HCl (308 мг, 1,61 ммоль), HOBt (218 мг, 1,61 ммоль) и триэтиламина (0,74 мл, 5,35 ммоль) перемешивают при комнатной температуре в течение 21 часа. Реакционную смесь выливают в ледяную воду (30 мл) с последующей экстракцией этилацетатом. Экстракт промывают ледяной водой и насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем (силикагель: 40 г), посредством чего из элюатных фракций смеси хлороформ/ацетон (10/1) получают указанное в заголовке соединение (640 мг, 100%) в виде желтого масла.
1H-ЯМР (CDCl3) δ: 2,17-2,52 (м, 5H), 3,68-3,80 (м, 3H), 3,86 (с, 3H), 3,88 (м, 1H), 4,12-4,29 (м, 1H), 4,53 (дд, J=13,0, 3,9 Гц, 1H), 4,62 (м, 1H), 4,97 (м, 1H), 6,80 (д, J=7,8 Гц, 2H), 6,86 (д, J=9,1 Гц, 1H), 6,95-6,99 (м, 2H), 7,07 (т, J=8,1 Гц, 2H), 7,21-7,33 (м, 5H), 7,39 (д, J=8,1 Гц, 1Н), 7,94-7,99 (м, 2H), 8,01 (с, 1H), 8,08 (д, J=8,3 Гц, 1H).
МС (ESI) m/z 592 (M++1).
(Стадия 7) Синтез 4-((2S,4S)-1-(2-(2-метилфениламино)-6-бензоксазолилацетил)-4-фенокси-2-пирролидинилметокси)бензойной кислоты
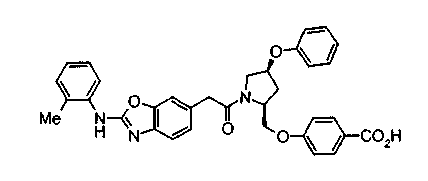
К раствору метил-4-((2S,4S)-1-(2-(2-метилфениламино)-6-бензоксазолилацетил)-4-фенокси-2-пирролидинилметокси)бензоата (640 мг, 1,07 ммоль) в ТГФ (30 мл) добавляют 0,25 н. NaOH (30 мл). Образовавшуюся смесь перемешивают при комнатной температуре в течение 14 часов. Реакционную смесь затем концентрируют при пониженном давлении. После добавления 1 н. HCl к остатку таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при пониженном давлении, в результате чего указанное в заголовке соединение (366 мг, 60%) получают в виде светло-розового твердого вещества.
ИК (ATR) 3060, 2985, 2941, 1687, 1639, 1603, 1576, 1489, 1439 см-1;
1H-ЯМР (ДМСО-d6) δ: 2,17-2,25 (м, 2H), 2,30 (с, 3H), 3,39-4,27 (м, 7H), 5,09-5,20 (м, 1H), 6,93 (д, J=7,8 Гц, 2H), 7,01-7,10 (м, 5H), 7,25-7,33 (м, 7H), 7,80-7,89 (м, 3Н), 9,64 (ушир., 1H).
МС (ESI) m/z 470 (M++1);
Анал. Вычисл. для С34Н31N3O6·1,0H2O: C, 68,56; H, 5,58; N, 7,05.
Найдено: C, 68,77; H, 5,61; N, 7,00.
Пример 13
4-((2S,4S)-4-Фтор-1-(2-(2-метилфениламино)-5-бензоксазолилацетил)-2-пирролидинилметокси)бензойная кислота:
(Стадия 1) Синтез метил-4-гидрокси-3-нитрофенилацетата
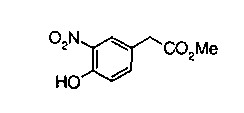
В смеси метанол/толуол (1:10, 55 мл) растворяют 4-гидрокси-3-нитрофенилуксусную кислоту (2,0 г, 10,1 ммоль). К образовавшемуся раствору добавляют по каплям триметилсилилдиазометан (2,0 М раствор в гексане, 5,0 мл). После перемешивания при комнатной температуре в течение 50 минут реакционную смесь перегоняют при пониженном давлении для удаления растворителя. Остаток разбавляют этилацетатом. Экстракт в этилацетате затем промывают насыщенным водным раствором бикарбоната натрия и насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя, в результате чего указанное в заголовке соединение (2,15 г, 100%) получают в виде желтого твердого вещества (это соединение применяют для следующей реакции без дополнительной очистки).
1H-ЯМР (CDCl3) δ: 3,63 (с, 2H), 3,72 (с, 3H), 7,13 (д, J=8,5 Гц, 1H), 7,52 (дд, J=8,8, 2,2 Гц, 1H), 10,53 (с, 1H).
(Стадия 2) Синтез метил-3-амино-4-гидроксифенилацетата
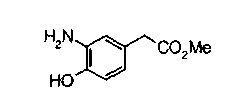
Метил-4-гидрокси-3-нитрофенилацетат (2,15 г, 10,1 ммоль) и катализатор 5% палладий/уголь (2,15 г) суспендируют в метаноле (100 мл). Образовавшуюся суспензию подвергают каталитическому гидрированию в течение 20 часов при перемешивании при комнатной температуре и нормальном давлении. Катализатор затем отфильтровывают из реакционной смеси. Фильтрат перегоняют при пониженном давлении для удаления растворителя, в результате чего указанное в заголовке соединение (1,72 г, 93%) получают в виде коричневого твердого вещества (это соединение применяют для последующей реакции без дополнительной очистки).
(Стадия 3) Синтез метил-2-(2-метилфениламино)-5-бензоксазолилацетата
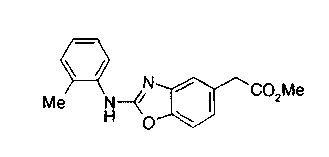
Метил-3-амино-4-гидроксифенилацетат (1,72 г, 9,49 ммоль) растворяют в метаноле (100 мл). При перемешивании при комнатной температуре добавляют о-толилтиоизоцианат (1,91 мл, 14,3 ммоль) с последующим перемешиванием при комнатной температуре в течение 24 часов. К реакционной смеси добавляют оксид ртути(II) (желтый) (3,49 г, 16,1 ммоль). Реакционную смесь затем перемешивают при комнатной температуре в течение 2,5 часа. После охлаждения до комнатной температуры реакционную смесь перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем (силикагель: 100 г), в результате чего из элюатных фракций смеси гексан/этилацетат (2/1) указанное в заголовке соединение (2,33 г, 83% (2 стадии)) получают в виде желтого масла.
1H-ЯМР (CDCl3) δ: 2,35 (с, 3H), 3,686 (с, 2H), 3,692 (с, 3H), 6,93 (ушир., 1H), 7,02 (дд, J=8,3, l,7 Гц, 1H), 7,07 (т, J=7,3 Гц, 1H), 7,22 (д, J=7,6 Гц, 1H), 7,25 (д, J=3,2 Гц, 1H), 7,30 (дт, J=8,6, 0,5 Гц, 1Н), 7,38 (д, J=1,5 Гц, 1H), 8,05 (д, J=8,1 Гц, 1H).
(Стадия 4) Синтез 2-(2-метилфениламино)-5-бензоксазолилуксусной кислоты
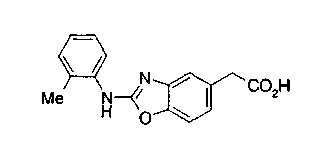
Метил-2-(2-метилфениламино)-5-бензоксазолилацетат (2,32 г, 7,86 ммоль) растворяют в ТГФ (40 мл). После добавления 0,25 н. NaOH (40 мл) при перемешивании при комнатной температуре смесь перемешивают в течение 15 часов. Остаток, который получают перегонкой реакционной смеси при пониженном давлении для удаления растворителя, подкисляют 1 н. HCl. Полученные таким образом кристаллы собирают фильтрованием при пониженном давлении, промывают водой, сушат при пониженном давлении, в результате чего указанное в заголовке соединение (894 мг) получают в виде бледно-черного кристаллического порошка. Водный слой экстрагируют смесью хлороформ/метанол (10/1). Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя, в результате чего указанное в заголовке соединение (1,03 г) получают в виде бесцветного твердого вещества (общий выход: 88%).
1H-ЯМР (CDCl3) δ: 2,29 (с, 3H), 3,50 (с, 2H), 6,96 (дд, J=8,1, 1,7 Гц, 1H), 7,09 (т, J=7,6 Гц, 1H), 7,23 (м, 3H), 7,36 (д, J=8,1 Гц, 1H), 9,46 (ушир., 1H), 12,28 (ушир., 1H). (Стадия 5) Синтез метил-4-((2S,4S)-4-Фтор-1-(2-(2-метилфениламино)-5-бензоксазолилацетил)-2-пирролидинилметокси)бензоата
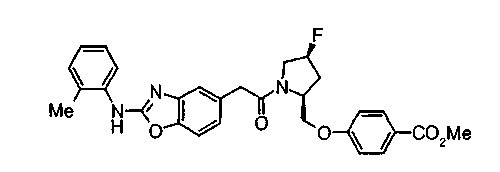
В ДМФ (5 мл) 2-(2-метилфениламино)-5-бензоксазолилуксусную кислоту (282 мг, 1,0 ммоль), метил-4-((2S,4S)-4-фтор-2-пирролидинилметокси)бензоат (253 мг, 1,0 ммоль), EDC·HCl (288 мг, 1,5 ммоль), HOBt (203 мг, 1,5 ммоль) и триэтиламин (0,70 мл, 5,0 ммоль) перемешивают при комнатной температуре в течение 18 часов. Реакционную смесь выливают в воду с последующей экстракцией этилацетатом. Экстракт промывают ледяной водой и насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем (силикагель: 50 г), посредством чего из элюатных фракций смеси хлороформ/ацетон (10/1) получают указанное в заголовке соединение (405 мг, 78%) в виде светло-коричневого аморфного вещества.
1H-ЯМР (CDCl3) δ: 2,03-2,26 (м, 1H), 2,49 (с, 3H), 2,53 (дд, J=19,5, 15,1 Гц, 1H), 3,63-3,82 (м, 3H), 3,87 (с, 3H), 3,92 (д, J=9,5 Гц, 1H), 4,02-4,15 (м, 1H), 4,50-4,64 (м, 2H), 5,29 (д, J=52,7 Гц, 1H), 6,86 и 7,03 (каждый д, J=8,8 и 8,3 Гц соответственно, общий 1H, амидные изомеры), 7,99 (д, J=8,8 Гц, 2H), 7,08 (т, J=7,6 Гц, 1H), 7,21-7,34 (м, 5H), 7,96 (д, J=9,0 Гц, 2H), 8,01 (т, J=8,1 Гц, 1H).
МС (ESI) m/z 518 (M++1).
(Стадия 6) Синтез 4-((2S,4S)-4-Фтор-1-(2-(2-метилфениламино)-5-бензоксазолилацетил)-2-пирролидинилметокси)бензойной кислоты
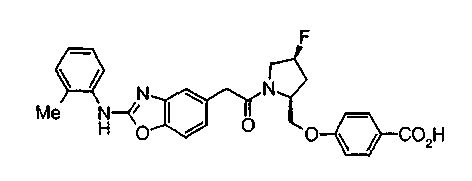
Метил-4-((2S,4S)-4-Фтор-1-(2-(2-метилфениламино)-5-бензоксазолилацетил)-2-пирролидинилметокси)бензоат (405 мг, 0,783 ммоль) растворяют в ТГФ (20 мл). К образовавшемуся раствору добавляют 0,25 н. NaOH (20 мл) с последующим перемешиванием при комнатной температуре в течение 18 часов. Реакционную смесь перегоняют при пониженном давлении для удаления растворителя. Остаток подкисляют 1 н. HCl. Полученные таким образом кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при пониженном давлении, в результате чего указанное в заголовке соединение (200 мг, 81%) получают в виде бесцветного кристаллического порошка.
ИК (KBr) 3423, 3251, 2973, 2941, 1685, 1643, 1579 см-1;
1H-ЯМР (ДМСО-d6) δ: 2,18-2,24 (м, 2H), 2,30 (с, 3H), 3,58-4,72 (м, 7H), 5,38 и 5,44 (каждый м, общий 1H, амидные изомеры), 6,98 (д, J=8,3 Гц, 1H), 7,02-7,13 (м, 4H), 7,19-7,28 (м, 3H), 7,37 (м, 1H), 7,78 (д, J=8,8 Гц, 2H), 7,87 (д, J=8,8 Гц, 2H), 9,72 (ушир., 1H).
МС (ESI) m/z 470 (M++1);
Анал. Вычисл. для C28H26FN3О5·1,1 H2О: C, 64,26; H, 5,43; F, 3,63; N, 8,03.
Найдено: C, 64,07; H, 5,34; F, 3,66; N, 8,01.
Пример 14
4-((2S,4S)-1-(4-(2-бензоксазолиламино)фенилацетил)-4-фтор-2-пирролидинилметокси)бензойная кислота:
(Стадия 1) Синтез этил-4-(2-бензоксазолиламино)фенилацетата
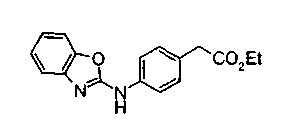
В ксилоле (10 мл) 2-хлорбензоксазол (1,00 г, 6,51 ммоль) и этил-4-аминофенилацетат (1,67 г, 6,51 ммоль) нагревают и кипятят с обратным холодильником в течение 10 часов. После охлаждения к реакционной смеси добавляют воду с последующей экстракцией этилацетатом. Экстракт промывают насыщенным раствором соли, сушат на сульфатом магния и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси гексан/этилацетат (3/1, об./об.) этил-4-(2-бензоксазолиламино)фенилацетат (2,08 г, 99%) получают в виде желтого твердого вещества.
1H-ЯМР (CDCl3) δ: 1,26 (т, J=7,1 Гц, 3H), 3,61 (2H, с), 4,16 (кв., J=7,1 Гц, 2H), 7,13 (тд, J=7,8, 1,2 Гц, 1H), 7,24 (тд, J=7,8, l,2 Гц, 1H), 7,31 (д, J=8,5 Гц, 2H), 7,34 (дд, J=7,8, 1,2 Гц, 1H), 7,49 (дд, J=7,8, 1,2 Гц, 1H), 7,57 (д, J=8,5 Гц, 2H), 7,67 (1H, ушир.с).
МС (ESI) m/z 297 (M++1).
(Стадия 2) Синтез 4-(2-бензоксазолиламино)фенилуксусной кислоты

В ТГФ (70 мл) растворяют этил-4-(2-бензоксазолиламино)фенилацетат (2,08 г, 7,02 ммоль) с последующим добавлением 0,25 н. NaOH (42,0 мл, 10,5 ммоль) при комнатной температуре. После перемешивания в течение 24 часов реакционную смесь выливают в 1 н. HCl (50 мл) при 0°С.Таким образом осажденные кристаллы собирают фильтрованием, в результате чего 4-(2-бензоксазолиламино)фенилуксусную кислоту (1,85 г, 98%) получают в виде твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 3,53 (2H, с), 7,12 (т, 1H, J=7,8 Гц, 1H), 7,21 (т, J=7,8 Гц, 1H), 7,25 (д, J=8,5 Гц, 2H), 7,44 (д, J=7,8 Гц, 1H), 7,47 (д, J=7,8 Гц, 1H), 7,68 (д, J=8,5 Гц, 2H), 10,56 (1H, с), 12,27 (1H, ушир.с). МС (ESI) m/z 269 (M++1).
(Стадия 3) Синтез метил-4-((2S,4S)-1-(4-(2-бензоксазолиламино)фенилацетил)-4-фтор-2-пирролидинилметокси)бензоата
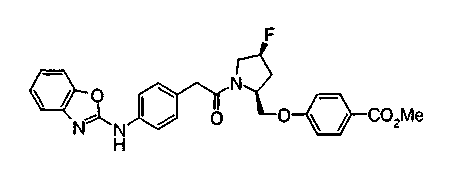
В ДМФ (8,8 мл) растворяют 4-(2-бензоксазолиламино)фенилуксусную кислоту (235 мг, 0,88 ммоль), метил-4-((4S)-фтор-(2S)-пирролидинилметокси)бензоат (222 мг, 0,88 ммоль), HOBt (24,0 мг, 0,18 ммоль) и триэтиламин (0,18 мл, 1,31 ммоль). К образовавшуюся раствору добавляют EDC·HCl (252 мг, 1,31 ммоль). После перемешивания образовавшейся смеси в течение 3 часов к ней добавляют воду (30 мл) с последующей экстракцией этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над сульфатом магния и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси гексан-этилацетат (1:2, об./об.) метил-4-((2S,4S)-1-(4-(2-бензоксазолиламино)фенилацетил)-4-фтор-2-пирролидинилметокси)бензоат (440 мг, 99%) получают в виде светло-желтого аморфного вещества.
1H-ЯМР (CDCl3) δ: 2,14 (1H, м), 2,56 (1H, м), 3,63 (д, J=15,1 Гц, 1H), 3,80 (д, J=15,1 Гц, 1H), 3,87 (3H, с), 3,76-4,07 (3H, м), 4,55 (1H, м), 4,64 (1H, м), 5,31 (1H, м), 6,99 (д, J=8,8 Гц, 2H), 7,12 (т, J=7,6 Гц, 1H), 7,23 (т, J=7,6 Гц, 1H), 7,27 (д, J=8,6 Гц, 2H), 7,33 (д, J=7,6 Гц, 1H), 7,48 (д, J=7,6 Гц, 1H), 7,58 (д, J=8,6 Гц, 2H), 7,96 (д, J=8,8 Гц, 2H).
МС (ESI) m/z 504 (M++1).
(Стадия 4) Синтез 4-((2S,4S)-1-(4-(2-бензоксазолиламино)фенилацетил)-4-фтор-2-пирролидинилметокси)бензойной кислоты
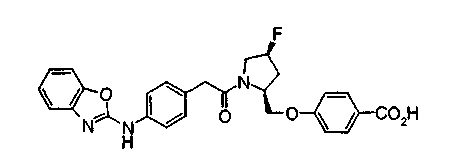
В ТГФ (10 мл) растворяют метил-4-((2S,4S)-1-(4-(2-бензоксазолиамино)фенилацетил)-4-фтор-2-пирролидинилметокси) бензоат (440 мг, 0,87 ммоль). При комнатной температуре к образовавшемуся раствору добавляют 0,25 н. NaOH (5,24 мл, 1,31 ммоль). После перемешивания при комнатной температуре в течение 24 часов реакционную смесь выливают в 1 н. HCl (30 мл) при 0°С и таким образом полученные кристаллы собирают фильтрованием. Кристаллы растворяют в хлороформе. Образовавшийся раствор промывают насыщенным раствором соли и затем перегоняют при пониженном давлении для удаления растворителя. Полученные таким образом сырые кристаллы перекристаллизовывают из смеси хлороформ-гексан, в результате чего указанное в заголовке соединение (388 мг, 91%) получают в виде бесцветного аморфного вещества.
ИК (KBr) 3417, 3278, 3058, 2958, 1681, 1644, 1604, 1573, 1513, 1459, 1432 см-1;
1H-ЯМР (ДМСО-d6) δ: 2,24-2,31 (2H, м), 3,63 (д, J=15,6 Гц, 1H), 3,68 (д, J=15,6 Гц, 1H), 3,77-3,92 (3H, м), 4,38-4,43 (2H, м), 5,44 (1H, м), 7,08 (д, J=8,5 Гц, 2H), 7,12 (т, J=8,1 Гц, 1H), 7,22 (т, J=8,1 Гц, 1H), 7,25 (д, J=8,5 Гц, 2H), 7,44 (д, J=8,1 Гц, 1H), 7,48 (д, J=8,1 Гц, 1H), 7,70 (д, J=8,5 Гц, 2H), 7,88 (д, J=8,5 Гц, 2H), 10,57 (1H, ушир.с), 12,63 (1H, с; ушир.с).
МС (ESI) m/z 504 (M++1);
Анал. Вычисл. для C27H24FN3O5·H2O: C, 63,90; H, 5,16; N, 8,28.
Найдено C, 63,96; H, 5,48; N, 7,86.
Пример 15
4-(1-(3-Хлор-4-(3-индолилкарбониламино)фенилацетил)-(4S)- фтор-(2S)-пирролидинилметокси)бензойная кислота:
(Стадия 1) Синтез этил-3-хлор-4-(3-индолилкарбониламино)фенилацетата
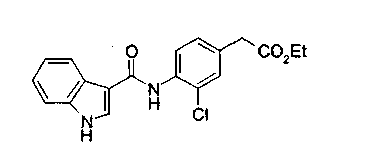
EDC·HCl (1,78 г, 9,28 ммоль) добавляют к раствору индол-3-карбоновой кислоты (1,00 г, 6,21 ммоль), этил-4-амино-3-хлорфенилацетата (1,33 г, 6,22 моль) и триэтиламина (1,80 мл, 12,9 ммоль). Смесь перемешивают при 70°С в течение 24 часов. После охлаждения до комнатной температуры к реакционной смеси добавляют воду (30 мл) с последующей экстракцией этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси гексан-этилацетат (1:1, об./об.) этил-3-хлор-4-(3-индолилкарбониламино)фенилацетат (1,25 г, 56%) получают в виде светло-желтого твердого вещества.
1H-ЯМР (CDCl3) δ: 1,27 (т, J=7,1 Гц, 3H), 3,59 (с, 2H), 4,17 (кв., J=7,1 Гц, 2H), 7,23 (м, 1H), 7,30-7,34 (м, 2H), 7,37 (д, J=2,0 Гц, 1H), 7,47 (м, 1H), 7,91 (д, J=2,9 Гц, 1H), 8,16 (м, 1H), 8,32 (ушир.с, 1H), 8,58 (д, J=8,5 Гц, 1H), 8,82 (ушир.с, 1H).
(Стадия 2) Синтез 3-хлор-4-(3-индолилкарбониламино)фенилуксусной кислоты
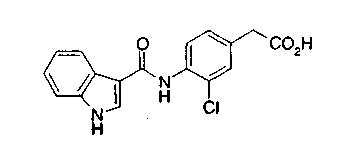
К раствору этил-3-хлор-4-(3-индолилкарбониламино)фенилацетата (1,25 г, 3,50 ммоль) в ТГФ (35 мл) добавляют 0,25 н. NaOH (21 мл, 5,23 ммоль) при перемешивании. Реакционную смесь затем перемешивают при комнатной температуре в течение 24 часов. Реакционную смесь выливают в 1 н. HCl (30 мл) при перемешивании при 0°С. Таким образом осажденные кристаллы собирают фильтрованием, в результате чего 3-хлор-4-(N-(3-индолилкарбонил)амино)фенилуксусную кислоту (1,05 г, 91%) получают в виде бесцветного твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 3,61 (с, 2H), 7,12-7,20 (м, 2H), 7,24 (д, J=8,3 Гц, 1H), 7,44 (с, 1H), 7,47 (д, J=7,3 Гц, 1H), 7,67 (д, J=8,3 Гц, 1H), 8,14 (д, J=7,3 Гц, 1H), 8,29 (с, 1H), 9,32 (с, 1H), 11,75 (ушир.с, 1H).
(Стадия 3) Синтез метил-4-(1-(3-хлор-4-(3-индолилкарбониламино)фенилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)бензоата
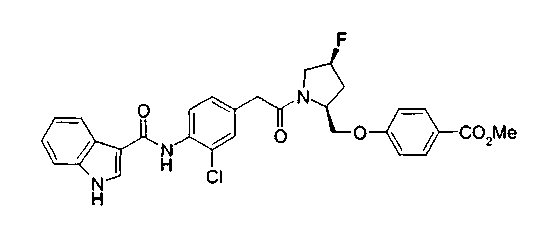
EDC·HCl (0,92 г, 4,79 ммоль) добавляют к раствору 3-хлор-4-(3-индолилкарбониламино)фенилуксусной кислоты (1,05 г, 3,19 ммоль), метил-4-((4S)-фтор-(2S)-пирролидинилметокси)бензоата (0,81 г, 3,19 ммоль), HOBt (86,3 мг, 0,64 ммоль) и триэтиламин (0,68 мл, 4,79 ммоль) в ДМФ (30 мл). Смесь затем перемешивают при 60°С в течение 10 часов. После охлаждения до комнатной температуры реакционную смесь выливают в воду (30 мл) с последующей экстракцией этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Таким образом осажденные кристаллы собирают фильтрованием, промывают водой и сушат при пониженном давлении, в результате чего метил-4-(1-(3-хлор-4-(3-индолилкарбониламино)фенилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)бензоат (0,73 г, 40%) получают в виде коричневого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 2,22-2,36 (м, 2H), 3,70 (д, J=16,l Гц, 1H), 3,76 (д, J=16,1 Гц, 1H), 3,80 (с, 3H), 3,82-3,97 (м, 3H), 4,39-4,44 (м, 2H), 5,47 (м, 1H), 7,10 (д, J=8,8 Гц, 2H), 7,14-7,25 (м, 2H), 7,42 (д, J=1,5 Гц, 1H), 7,47 (д, J=7,8 Гц, 1H), 7,66 (д, J=8,1 Гц, 1H), 7,90 (д, J=8,8 Гц, 2H), 8,14 (д, J=7,8 Гц, 1H), 8,29 (с, 1H), 9,33 (с, 1H), 11,76 (ушир.с, 1H).
(Стадия 4) Синтез 4-(1-(3-хлор-4-(3-индолилкарбониламино)фенилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)бензойной кислоты
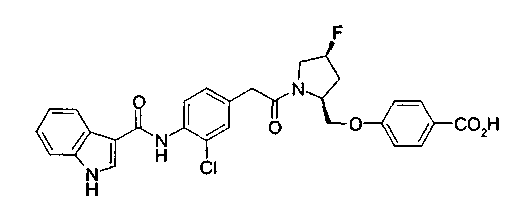
К раствору метил-4-(1-(3-хлор-4-(3-индолилкарбониламино) фенилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)бензоата (725 мг, 1,32 ммоль) в смеси ТГФ-метанол (60 мл, 5:1, об./об.) добавляют 0,25 н. NaOH (15,0 мл, 3,75 ммоль). Образовавшуюся смесь перемешивают при комнатной температуре в течение 18 часов. Реакционную смесь выливают в 1 н. HCl (20 мл) при 0°С.Таким образом осажденные кристаллы собирают фильтрованием, промывают водой и сушат при пониженном давлении, в результате чего 4-(1-(3-хлор-4-(N-(3-индолилкарбониламино)фенилацетил)-4-фтор-2-пирролидинилметокси)бензойную кислоту (399 мг, 55%) получают в виде бесцветного твердого вещества.
ИК (KBr) 3220, 2975, 1637, 1604, 1513, 14245, 1403 см-1;
1H-ЯМР (ДМСО-d6) δ: 2,27-2,33 (м, 2H), 3,60 (д, J=15,9 Гц, 1H), 3,76 (д, J=15,9 Гц, 1H), 3,81-4,05 (м, 3H), 4,40-4,49 (м, 2H), 5,47 (м, 1H), 7,06 (д, J=8,6 Гц, 2H), 7,15-7,21 (м, 2H), 7,24 (д, J=8,2 Гц, 1H), 7,43 (с, 1H), 7,48 (д, J=7,8 Гц, 1H), 7,68 (д, J=8,2 Гц, 1H), 7,90 (д, J=8,6 Гц, 2H), 8,14 (д, J=7,8 Гц, 1H), 8,30 (с, 1H), 9,35 (с, 1H), 11,81 (ушир.с, 1H).
FAB-МС m/z 550 (M++1);
Анал. Вычисл. для С29Н25С1FN3O5·3,25H2O: C, 57,24; H, 5,22; N, 6,91.
Найдено: C, 57,29; H, 5,55; N, 6,50.
Пример 16
4-((4S)-Фтор-1-(4-метокси-2-(2-метилфениламино)-6-бензоксазолил)оксиацетил-(2S)-пирролидинилметокси)бензойная кислота:
(Стадия 1) Синтез 5-фтор-3-метокси-2-нитрофенола
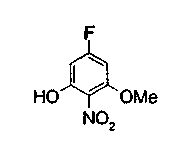
В 10 н. NaOH (13,1 мл, 131 ммоль) и ДМСО (25 мл) 3,5-дифтор-2-нитроанизол (8,29 г, 43,8 ммоль) перемешивают при 50°С в течение 5 часов. После охлаждения реакционную смесь выливают в 1 н. HCl (200 мл) с последующей экстракцией этилацетатом (300 мл). Экстракт промывают насыщенным раствором соли (2×100 мл), сушат над безводным сульфатом магния и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси гексан-этилацетат (4:1) получают указанное в заголовке соединение (4,14 г, 51%) в виде желтого масла.
1H-ЯМР (CDCl3) δ: 3,94 (с, 3H), 6,28 (дд, J=10,5, 2,7 Гц, 1H), 6,41 (дд, J=9,8, 2,7 Гц, 1H), 10,92 (с, 1H).
(Стадия 2) Синтез бензил-5-фтор-3-метокси-2-нитрофенилового эфира

В ДМФ (20 мл) 5-фтор-3-метокси-2-нитрофенол (4,14 г, 22,1 ммоль), бензилбромид (3,2 мл, 26,5 ммоль) и карбонат калия (4,58 г, 33,2 ммоль) перемешивают при 70°С в течение 5 часов. Реакционную смесь выливают в воду (200 мл) с последующей экстракцией этилацетатом (300 мл). Экстракт промывают насыщенным раствором соли (200 мл), сушат над безводным сульфатом магния и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси гексан-этилацетат (4:1) указанное в заголовке соединения (6,13 г, 100%) получают в виде желтого масла.
1H-ЯМР (CDCl3) δ: 3,86 (с, 3H), 5,13 (с, 2H), 6,35 (дд, J=10,3, 2,2 Гц, 1H), 6,38 (дд, J=10,3, 2,2 Гц, 1H), 7,33-7,38 (м, 5H).
(Стадия 3) Синтез 3-бензилокси-5-метокси-4-нитрофенола
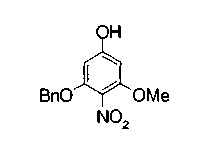
В 10 н. NaOH (5,8 мл, 58,0 ммоль) и ДМСО (20 мл) бензил-5-фтор-3-метокси-2-нитрофениловый эфир (5,35 г, 19,3 ммоль) перемешивают в течение 15 часов. Реакционную смесь выливают в 1 н. HCl (100 мл) с последующей экстракцией эфиром (300 мл). Экстракт промывают насыщенным раствором соли (2×100 мл), сушат над безводным сульфатом магния и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси хлороформ-этилацетат (4:1) указанное в заголовке соединение (1,43 г, 27%) получают в виде коричневого масла.
1H-ЯМР (CDCl3) δ: 3,81 (с, 3H), 5,08 (с, 2H), 6,10 (дд, J=10,8, 2,2 Гц, 2H), 6,37 (с, 1H), 7,34 (м, 5H).
(Стадия 4) Синтез метил-3-бензилокси-5-метокси-4-нитрофеноксиацетата
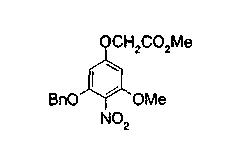
В ДМФ (10 мл), 3-бензилокси-5-метокси-4-нитрофенол (1,43 г, 5,20 ммоль), карбонат калия (1,08 г, 7,79 ммоль) и метилбромацетат (591 мкл, 6,24 ммоль) перемешивают при комнатной температуре в течение 2 дней. Реакционную смесь выливают в воду (200 мл) с последующей экстракцией эфиром (200 мл). Экстракт промывают насыщенным раствором соли (200 мл), сушат над безводным сульфатом магния и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси хлороформ-этилацетат (20:1) указанное в заголовке соединение (1,53 г, 85%) получают в виде желтого кристаллического твердого вещества.
1H-ЯМР (CDCl3) δ: 3,79 (с, 3H), 3,84 (с, 3H), 4,59 (с, 2H), 5,12 (с, 2H), 6,15 (с, 2H), 7,35 (м, 5H).
(Стадия 5) Синтез 3-бензилокси-5-метокси-4-нитрофеноксиуксусной кислоты
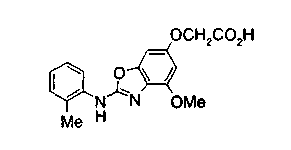
В этаноле (50 мл) растворяют метил-3-бензилокси-5-метокси-4-нитрофеноксиацетат (1,53 г, 4,41 ммоль) с последующим добавлением катализатора 5% палладий/уголь (1 г). При комнатной температуре и нормальном давлении смесь подвергают каталитическому гидрированию в течение 15 часов. Реакционную смесь фильтруют через целит при пониженном давлении для удаления нерастворимого вещества. Фильтрат перемешивают при комнатной температуре. К фильтрату добавляют 2-толилизотиоцианат (711 мкл, 5,29 ммоль). После перемешивания при комнатной температуре в течение 15 часов добавляют оксид ртути(II) (желтый) (1,62 г, 7,50 ммоль) и смесь нагревают и кипятят с обратным холодильником в течение 4 часов. После охлаждения до комнатной температуры реакционную смесь фильтруют через целит при пониженном давлении для удаления нерастворимого вещества. Фильтрат затем перегоняют при пониженном давлении для удаления растворителя. Образовавшийся маслянистый остаток растворяют в ТГФ (35 мл). К раствору добавляют 0,25 н. NaOH (35 мл, 8,75 ммоль) и смесь перемешивают при комнатной температуре в течение 15 часов. Реакционную смесь выливают в 1 н. HCl (100 мл) с последующей экстракцией смесью хлороформ-метанол (4:1, 2×200 мл). Экстракт сушат над безводным сульфатом магния и затем перегоняют при пониженном давлении для удаления растворителя. Смесь хлороформ-гексан добавляют к остатку для его кристаллизации, в результате чего указанное в заголовке соединение (487 мг, 34%) получают в виде светло-желтого аморфного вещества.
1H-ЯМР (ДМСО-d6) δ: 2,29 (с, 3H), 3,89 (с, 3H), 4,70 (с, 2H), 6,48 (д, J=7,3 Гц, 1H), 6,78 (д, J=2,0 Гц, 1H), 7,06 (т, J=7,3 Гц, 1H), 7,22-7,24 (м, 2H), 7,85 (д, J=8,3 Гц, 1H).
(Стадия 6) Синтез метил-4-((4S)-фтор-1-(4-метокси-2-(2-метилфениламино)-6-бензоксазолил)оксиацетил-(2S)-пирролидинилметокси)бензоата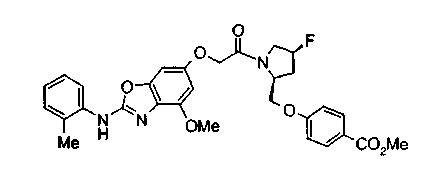
В ДМФ (4 мл) растворяют (4-метокси-2-(2-метилфениламино)-6-бензоксазолил)оксиуксусную кислоту (160 мг, 0,49 ммоль) и метил-4-((4S)-фтор-(2S)-пирролидинилметокси)бензоат (125 мг, 0,49 ммоль). К образовавшемуся раствору добавляют EDC·HCl (144 мг, 0,75 ммоль), HOBt и DMAP. Смесь перемешивают на протяжении ночи при комнатной температуре. Реакционную смесь затем разбавляют этилацетатом. Разбавленную смесь промывают насыщенным раствором соли, сушат над безводным сульфатом магния и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем и собирают элюатные фракции смеси хлороформ/метанол (20:1, об./об.). Их далее очищают хроматографией на колонке с тонкослойным силикагелем (ТСХ) с использованием смеси хлороформ-метанол (20:1, об./об.), в результате чего метил-4-((4S)-Фтор-1-(4-метокси-2-(2-метилфениламино)-6-бензоксазолил)оксиацетил-(2S)-пирролидинилметокси)бензоат (228 мг, 83%) получают в виде светло-коричневого твердого вещества.
ИК (KBr) 2950, 1714, 1645, 1591 см-1;
1H-ЯМР (CDCl3) δ: 2,06 (м, 2H), 2,23 (с, 3H), 2,42 (дд, J=15,1, 19,6 Гц, 1H), 3,74 (с, 3H), 3,80 (с, 3H), 3,86 (м, 1H), 3,94 (м, 1H), 4,39 (дд, J=4,0, 9,2 Гц, 1H), 4,51 (ушир., 1H), 4,55 (м, 1H), 5,13-5,30 (ряд м, общий 1H), 6,37 (д, J=2,4 Гц, 1H), 6,47 (д, J=2,4 Гц, 1H), 6,86 (д, J=8,8 Гц, 2H), 6,94 (м, 1H), 7,08 (м, 2H), 7,15 (м, 1H), 7,35 (ушир., 1H), 7,87 (т, J=8,8 Гц, 2H), 7,94 (д, J=8,0 Гц, 1H). МС (ESI) m/z 564 (M+H)+;
Анал. Вычисл. для С30Н30FN3O7·H2O: C, 61,96; H, 5,55; N, 7,22.
Найдено: C, 61,77; H, 5,55; N, 6,97.
(Стадия 7) Синтез 4-((4S)-Фтор-1-(4-метокси-2-(2-метилфениламино)-6-бензоксазолил)оксиацетил-(2S)-пирролидинилметокси)бензойной кислоты
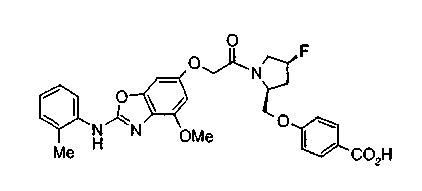
Метил-4-((4S)-фтор-1-(4-метокси-2-(2-метилфениламино)-6-бензоксазолил)оксиацетил-(2S)-пирролидинилметокси)бензоат (225 мг, 0,40 ммоль) растворяют в ТГФ (4 мл) и метаноле (1 мл) с последующим добавлением 0,25 н. NaOH (два эквивалента). Образовавшуюся смесь перемешивают на протяжении ночи при комнатной температуре. Реакционную смесь разбавляют смесью хлороформ-метанол (5:1, об./об.). Разбавленную смесь промывают 1 н. HCl, сушат над безводным сульфатом магния и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем. Собирают элюатные фракции смеси хлороформ-метанол (20:1, об./об.) и их очищают далее тонкослойной колоночной хроматографией (ТСХ) на силикагеле с использованием смеси хлороформ-метанол (20:1, об./об.), в результате чего 4-((4S)-фтор-1-(4-метокси-2-(2-метилфениламино)-6-бензоксазолил)оксиацетил-(2S)-пирролидинилметокси)бензойную кислоту (161 мг, 73%) получают в виде белого порошка.
ИК (KBr) 2951, 1645, 1593 см-1;
1H-ЯМР (ДМСО-d6) δ: 2,29 (с, 3H), 2,31 (м, 2H), 2,40 (м, 1H), 3,57 (дд, J=13,6,31,9 Гц, 1H), 3,84 (м, 2H), 3,89 (с, 3H), 4,06-4,25 (ряд м, общий 1H), 4,48 (м, 1H), 5,49 (ряд д, J=52,7 Гц, общий 1H), 6,49 (ряд д, J=2,4 Гц, общий 1H), 6,79 (ряд д, J=2,4 Гц, общий 1H), 7,01 (м, 1H), 7,04 (д, J=8,8 Гц, 2H), 7,22 (д, J=7,6 Гц, 2H), 7,82 (д, J=8,8 Гц, 1H), 7,87 (д, J=8,8 Гц, 2H), 9,41 (ушир., 1H).
МС (ESI) m/z 550 (M+H)+;
Анал. Вычисл. для C29H28FN3O7·2H2O: C, 59,48; H, 5,51; N, 7,18.
Найдено: C, 59,61; H, 5,13; N, 6,89.
Пример 17
4-(1-(2-(2-Метилфениламино)-6-бензотиазолилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоновая кислота
Изомер А и изомер В:
(Стадия 1) Синтез ди-трет-бутил-(3-фтор-4-нитрофенил)малоната
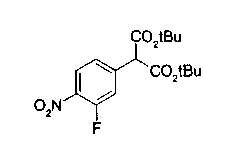
В ТГФ (400 мл) растворяют 2,4-дифторнитробензол (17,4 г, 109 ммоль) и ди-трет-бутилмалонат (27,0 мл, 120 ммоль). По частям при перемешивании при 0°С добавляют гидрид натрия (60% в масле, 4,82 г, 120 ммоль). Реакционную смесь затем перемешивают на протяжении ночи при комнатной температуре. Реакционную смесь выливают в 1,0 н. HCl (300 мл) с последующей экстракцией этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом магния и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси гексан-этилацетат (от 20:1 до 10:1) ди-трет-бутил-(3-фтор-4-нитрофенил)малонат (5,17 г, 13%) получают в виде светло-желтого масла.
1H-ЯМР (CDCl3) δ: 1,49 (с, 18H), 4,51 (с, 1H), 7,32 (д, J=8,4 Гц, 2H), 7,42 (дд, J=11,6, 2,0 Гц, 1H), 8,05 (т, J=8,4 Гц, 1H).
(Стадия 2) Синтез этил-3-фтор-4-нитрофенилацетата
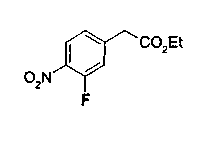
Трифторуксусную кислоту (25 мл) добавляют к раствору ди-трет-бутил-(3-фтор-4-нитрофенил)малоната (5,11 г, 14,4 ммоль) в метиленхлориде (50 мл). Образовавшуюся смесь перемешивают при комнатной температуре в течение 2 часов. Реакционную смесь концентрируют при пониженном давлении, получая при этом бесцветное твердое вещество. К твердому веществу добавляют концентрированную серную кислоту (1 мл) и этанол (50 мл) и смесь нагревают и кипятят с обратным холодильником в течение 2 часов. После охлаждения до комнатной температуры реакционную смесь концентрируют при пониженном давлении. К остатку добавляют ледяную воду (100 мл) с последующей экстракцией этилацетатом. Экстракт промывают насыщенным водным раствором бикарбоната натрия, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя, в результате чего этил-3-фтор-4-нитрофенилацетат (3,15 г, 96%) получают в виде желтого масла.
1H-ЯМР (CDCl3) δ: 1,27 (т, J=7,2 Гц, 3H), 3,69 (с, 2H), 4,18 (кв., J=14,4,7,2 Гц, 2H), 7,21 (д, J=8,8 Гц, 1H), 7,25 (д, J=10,0 Гц, 2H), 8,03 (т, J=8,0 Гц, 1H).
(Стадия 3) Синтез этил-3-(4-метоксибензилтио)-4-нитрофенилацетата
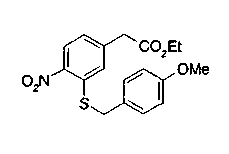
Гидрид натрия (60% в масле, 440 мг, 11,0 ммоль) добавляют по частям к раствору этил-3-фтор-4-нитрофенилацетата (2,09 г, 9,20 ммоль) и 4-метоксифенилбензилтиола (3,85 мл, 27,6 ммоль) в N-метилпирролидоне (30 мл) при перемешивании при 0°С. После завершения добавления реакционную смесь перемешивают при комнатной температуре в течение 5 часов. Реакционную смесь выливают в 1,0 н. HCl (30 мл) с последующей экстракцией эфиром. Экстракт промывают водой (дважды), сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси гексан-этилацетат (3:1) этил-3-(4-метоксибензилтио)-4-нитрофенилацетат (3,37 г, колич.) получают в виде желтого масла.
1H-ЯМР (CDCl3) δ: 1,27 (т, J=6,8 Гц, 3H), 3,65 (с, 2H), 3,80 (с, 3H), 4,16 (с, 2H), 4,17 (кв., J=14,4, 7,2 Гц, 2H), 6,87 (д, J=8,4 Гц, 2H), 7,15 (дд, J=8,4, 1,6 Гц, 1H), 7,33 (д, J=8,4 Гц, 2H), 8,17 (д, J=8,8 Гц, 1H).
(Стадия 4) Синтез этил-3-(4-метоксибензилтио)-4-аминофенилацетата
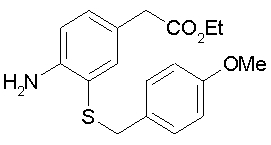
При перемешивании раствор этил-3-(4-метоксибензилтио)-4-нитрофенилацетата (3,33 г, 9,92 ммоль), хлорида аммония (542 мг, 10,1 ммоль) и восстановленный железный порошок (2,57 г, 46,1 ммоль) в смеси этанол/ТГФ/вода (2:2:1, 75 мл) нагревают и кипятят с обратным холодильником в течение 1,5 часа. После охлаждения реакционной смеси нерастворимое вещество отфильтровывают.Фильтрат перегоняют при пониженном давлении для удаления растворителя. Остаток нейтрализуют выливанием в него насыщенного водного раствора бикарбоната натрия с последующей экстракцией смесью хлороформ-метанол. Экстракт сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси хлороформ-этилацетат (20:1) этил-3-(4-метоксибензилтио)-4-аминофенилацетат (2,64 г, 86%) получают в виде желтого масла.
1H-ЯМР (CDCl3) δ: 1,27 (т, J=6,8 Гц, 3H), 3,45 (с, 2H), 3,81 (с, 3H), 3,90 (с, 2H), 4,16 (кв., J=14,0, 7,2 Гц, 2H), 4,24 (ушир.с, 2H), 6,69 (д, J=8,0 Гц, 1H), 6,80 (д, J=8,4 Гц, 2H), 7,06 (дд, J=8,4,2,0 Гц, 1H), 7,17 (с, 1H), 7,18 (с, 1H), 7,29 (с, 1H).
МС (ESI) m/z, 332 (M++H).
(Стадия 5) Синтез этил-4-(N'-(2-метилфенил)тиоуреидо)-3-(4-метоксифенилтио)фенилацетата
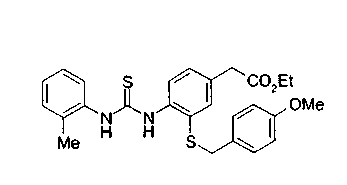
Раствор этил-3-(4-метоксибензилтио)-4-аминофенилацетата (2,55 г, 7,69 ммоль) и о-толилизоцианата (1,74 мл, 8,46 ммоль) а ацетонитриле (20 мл) перемешивают на протяжении ночи при 60°С. После охлаждения реакционной смеси растворитель отгоняют при пониженном давлении. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси гексан-этилацетат (3:1) этил-4-(N'-(2-метилфенил)тиоуреидо)-3-(4-метоксибензилтио)фенилацетат (1,66 г, 45%) получают в виде желтого масла.
1H-ЯМР (CDCl3) δ: 1,24 (т, J=7,2 Гц, 3H), 3,51 (с, 2H), 3,73 (с, 2H), 3,77 (с, 3H), 4,13 (кв., J=14,4, 7,2 Гц, 2H), 6,69 (д, J=8,8 Гц, 1H), 6,84 (д, J=8,8 Гц, 2H), 7,21-7,34 (ряд м, 6H), 7,60 (ушир.с, 1H), 8,10 (ушир.с, 1H), 8,32 (д, J=8,0 Гц, 2H).
МС (ESI) m/z, 481 (M++H).
(Стадия 6) Синтез этил-2-(2-метилфениламино)-6-бензотиазолилацетата

В этаноле (50 мл) этил-4-(N'-(2-метилфенил)тиоуреидо)-3-(4-метоксибензилтио)фенилацетат (1,63 г, 3,40 ммоль) и оксид ртути(II) (желтый) (1,10 г, 16,4 ммоль) перемешивают в течение одного часа при 70°С. Добавляют воду (50 мл) и смесь экстрагируют этилацетатом. Экстракт промывают водой и насыщенным водным раствором бикарбоната натрия, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси гексан-этилацетат (3:1) этил-2-(2-метилфениламино)-6-бензотиазолилацетат (922 мг, 83%) получают в виде светло-желтого масла.
1H-ЯМР (CDCl3) δ: 1,25 (т, J=7,2 Гц, 3H), 2,78 (с, 3H), 3,64 (с, 2H), 4,14 (кв., J=14,4, 7,6 Гц, 2H), 7,17-7,22 (м, 2H), 7,29 (т, J=7,2 Гц, 2H), 7,43 (д, J=8,0 Гц, 1H), 7,51 (ушир.с, 1H), 7,65 (д, J=8,0 Гц, 1H), 8,00 (ушир.с, 1H).
МС (ESI) m/z, 327 (M++H).
(Стадия 7) Синтез 2-(2-метилфениламино)-6-бензотиазолилуксусной кислоты
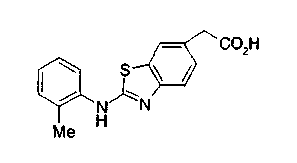
В смеси ТГФ-метанол (1:1, 20 мл) растворяют этил-2-(2-метилфениламно)-6-бензотиазолилацетат (907 мг, 2,78 ммоль). К образовавшемуся раствору добавляют 1,0 М NaOH (8,34 мл, 8,34 ммоль) с последующим перемешиванием на протяжении ночи при комнатной температуре. Реакционную смесь концентрируют при пониженном давлении. Остаток подкисляют 1,0 н. HCl. Полученные таким образом кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при 60°С при пониженном давлении, в результате чего 2-(2-метилфениламино)-6-бензотиазолилуксусную кислоту (675 мг, 81%) получают в виде белого кристаллического порошка.
1H-ЯМР (ДМСО-d6) δ: 2,59 (с, 3H), 3,88 (с, 2H), 7,37 (т, J=7,2 Гц, 1H), 7,44-7,46 (м, 1H), 7,52 (т, J=7,6 Гц, 2H), 7,69 (д, J=8,0 Гц, 1H), 7,90 (с, 1H), 8,13 (д, J=8,0 Гц, 1H).
МС (ESI) m/z, 299 (M++H).
(Стадия 8) Синтез метил-4-(1-(2-(2-метилфениламино)-6-бензотиазолилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилата
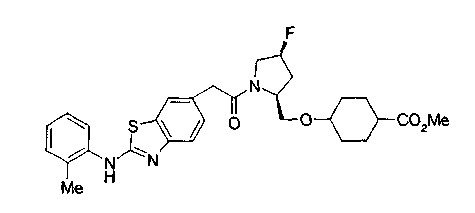
HOBt (14,0 мг, 0,10 ммоль) добавляют к раствору метил-4-((4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилата (259 мг, 1,00 ммоль), 2-(2-метилфениламино)-6-бензотиазолилуксусной кислоты (328 мг, 1,10 ммоль) и EDC·HCl (288 мг, 1,50 ммоль) в ДМФ (10 мл). Образовавшуюся смесь перемешивают на протяжении ночи при комнатной температуре. Реакционную смесь выливают в воду (30 мл) и смесь экстрагируют этилацетатом. Экстракт промывают водой, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси гексан-этилацетат (1:4) метил-4-(1-(2-(2-метилфениламино)-6-бензотиазолилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилат (409 мг, 76%), который является смесью двух диастереомеров, получают в виде бесцветного аморфного вещества.
1H-ЯМР (CDCl3), смесь ротамеров, δ: 1,20-1,30 (м, 1H), 1,39-1,55 (м, 2H), 1,56-1,72 (м, 2H), 1,77-1,92 (м, 3H), 1,99-2,15 (м, 3H), 2,20-2,55 (м, 2H), 2,34 (с, 3H), 3,20-3,40 (ряд м, 6H), 3,66, 3,70 и 3,72 (с, общий 3H), 5,15-5,30 (м, 1H), 7,16-7,20 (м, 2H), 7,26-7,28 (м, 3H), 7,45 (дд, J=8,4,3,6 Гц, 1H), 7,50-7,53 (м, 1H), 7,64-7,67 (м, 1H).
МС (ESI) m/z, 540 (M++H).
(Стадия 9) Синтез 4-(1-(2-(2-метилфениламино)-6-бензотиазолилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоновой кислоты, изомера А и изомера В
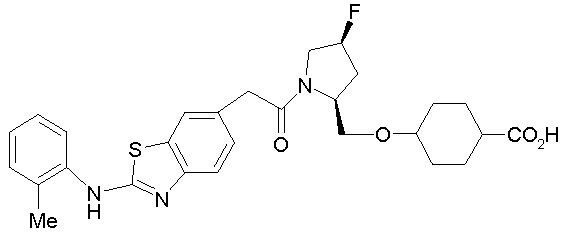
К раствору метил-4-(1-(2-(2-метилфениламино)-6-бензотиазолилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилата (397 мг, 0,74 ммоль), который является смесью диастереомеров, в смеси метанол-ТГФ (1:1, 10 мл) добавляют 0,25 М NaOH (8,83 мл, 2,21 ммоль). Образовавшуюся смесь перемешивают на протяжении ночи при комнатной температуре. Реакционную смесь выливают в 1 н. HCl (20 мл) и смесь экстрагируют смесью хлороформ-метанол. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя, посредством чего 4-(1-(2-(2-метилфениламино)-6-бензотиазолилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоновую кислоту (468 мг, 89%), смесь двух диастереомеров, получают в виде бесцветного аморфного вещества. Смесь этих двух диастереомеров разделяют ВЭЖХ (Shimpack PRC-ODS/30 мм×250 мм, ацетонитрил: 0,02 н.буфер ацетат натрия=1:1, 20 мл/мин), так что изомер А и изомер В получают, каждый, в форме бесцветного аморфного вещества.
Изомер A;
1H-ЯМР (CDCl3), смесь ротамеров, δ: 1,18-1,31 (м, 2H), 1,43-1,55 (м, 2H), 2,05-2,15 (м, 6H), 2,21-2,48 (м, 3H), 2,41 (с, 3H), 3,23-4,24 (ряд м, 6H), 5,16-5,30 (м, 1H), 7,17-7,29 (м, 4H), 7,44-7,52 (м, 3H), 7,58 (с, 1H).
МС (ESI) m/z, 526 (M++H).
Изомер В;
1H-ЯМР (CDCl3), смесь ротамеров, δ: 1,22-1,30 (м, 2H), 1,43-1,52 (м, 2H), 1,68-2,02 (м, 6H), 2,10-2,18 (м, 1H), 2,30 (с, 3H), 2,22-2,50 (м, 2H), 3,33-4,48 (ряд м, 6H), 5,14-5,29 (м, 1H), 7,17-7,27 (м, 5H), 7,43-7,50 (м, 3H);
МС (ESI) m/z, 526 (M++H).
Пример 18
6-((4S)-Фтор-1-(2-(2-метилфениламино)-6-бензоксазолилацетил)-(2S)-пирролидинилметокси)никотиновая кислота:
(Стадия 1) Синтез метил-6-((4S)-Фтор-1-(2-(2-метилфениламино)-6-бензоксазолилацетил)-(2S)-пирролидинилметокси)никотината
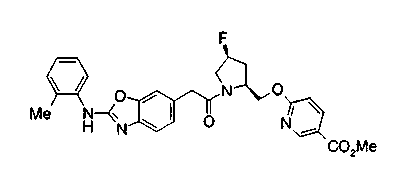
Метил-6-((4S)-фтор-(2S)-пирролидинилметокси)никотинат (202,0 мг, 0,794 ммоль), 2-(2-метилфениламино)-6-бензоксазолилуксусную кислоту (224,2 мг, 0,794 ммоль) и HOBt (21,5 мг, 0,159 ммоль) растворяют в ДМФ (8,5 мл). К образовавшейся смеси при перемешивании при комнатной температуре добавляют EDC·HCl (228,4 мг, 1,192 ммоль). Реакционную смесь далее перемешивают на протяжении ночи при комнатной температуре. Добавляют воду (30 мл) и смесь экстрагируют этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси хлороформ-этилацетат (5:1, об./об.) указанное в заголовке соединение (370,1 мг, 90%) получают в виде бесцветного аморфного вещества
1H-ЯМР (CDCl3) δ: 2,02-2,30 (1H, м, CH2), 2,34, 2,35 (общий 3Н, с, ArMe), 2,38-2,53 (1H, м, CH2), 3,65-4,83 (общий 10H, ряд м, включая 3H, с при (3,88, 3,90), 5,28 (1H, ушир. д, J=53,9), 6,71-8,88 (общий 11H, ряд м, ArH, NH). (Стадия 2) Синтез 6-((4S)-Фтор-1-(2-(2-метилфениламино)-6-бензоксазолилацетил)-(2S)-пирролидинилметокси)никотиновой кислоты
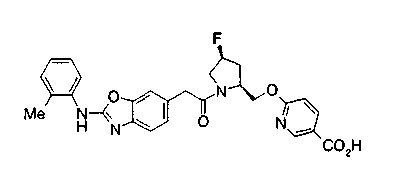
Метил-6-((4S)-фтор-1-(2-(2-метилфениламино)-6-бензоксазолилацетил)-(2S)-пирролидинилметокси)никотиновую кислоту (370,1 мг, 0,714 ммоль) растворяют в ТГФ (7,5 мл). При комнатной температуре добавляют 0,25 н. NaOH (7,5 мл). Реакционную смесь перемешивают на протяжении ночи при 50°С. Реакционную смесь концентрируют при пониженном давлении. Концентрат подкисляют 1 н. HCl. Таким образом полученные кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при 50°С при пониженном давлении, в результате чего указанное в заголовке соединение (214,8 мг, 60%) получают в виде светло-коричневого аморфного вещества.
ИК (KBr) 1683, 1637, 1600, 1573, 1244 см-1;
1H-ЯМР (ДМСО-d6) δ: 2,13-2,41 (5H, м, включая 3H, с при (2,31), 3,30-4,72 (общий 7H, ряд м), 5,43 (1H, ушир.д, J=52,8 Гц), 6,86-7,42 (общий 9H, ряд м), 7,79 (1H, м), 8,10-8,22 (1H, м), 8,71 (1H, м).
МС (ESI) m/z 505 (M++1);
Анал. Вычисл. для C27H25FN4O5·0,25H2O: C, 59,01; H, 5,50; N, 10,19; F, 3,46.
Найдено: C, 59,38; H, 5,31; N, 9,73; F, 3,30.
Пример 19
Метил-6-((4S)-фтор-1-(2-(2-метилфениламино)-6-бензоксазолилацетил)-(2S)-пирролидинилметокси)никотинат:
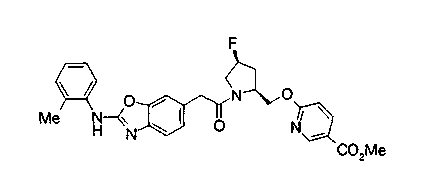
В смеси метанол/бензол (1/1, об./об.) (1,5 мл) растворяют 6-((4S)-Фтор-1-(2-(2-метилфениламино)-6-бензоксазолилацетил)-(2S)-пирролидинилметокси)никотиновую кислоту (51,6 мг, 0,1023 ммоль). К образовавшемуся раствору при перемешивании при 0°С по каплям добавляют триметилсилилдиазометан (2,0 М раствор в гексане, 0,08 мл, 0,1534 ммоль). После завершения добавления реакционную смесь перемешивают при комнатной температуре в течение 3 часов. Растворитель отгоняют при пониженном давлении. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси хлороформ-метанол (10:1, об./об.) указанное в заголовке соединение (44,4 мг, 84%) получают в виде бесцветного аморфного вещества.
1H-ЯМР (CDCl3) δ: 2,02-2,30 (1H, м), 2,34, 2,35 (общий 3H, с), 2,38-2,53 (1H, м), 3,65-4,83 (общий 10H, ряд м, включая общий 3H, с при (3,88, 3,90), 5,28 (1H, ушир.д, J=53,9), 6,71-8,88 (общий 11H, ряд м).
МС (ESI) m/z 519 (M++1).
Пример 20
4-((4S)-Метокси-1-(2-(2-метилфениламино)-6-бензоксазолилацетил)-(2S)-пирролидинилметокси) циклогексанкарбоновая кислота, изомер А и изомер В:
(Стадия 1) Синтез метил-(1-(трет-бутоксикарбонил)-(4S)-метокси-(2S)-пирролидинилметокси)бензоата

Метил-4-(1-(трет-бутоксикарбонил)-(4S)-гидрокси-(2S)-пирролидинилметокси)бензоат (1,03 г, 2,92 ммоль) и метилиодид (300 мкл, 5,91 ммоль) растворяют в ДМФ (20 мл). При перемешивании при 0°С по частям добавляют гидрид натрия (60% в масле, 145 г, 3,62 ммоль). После добавления всего количества гидрида натрия реакционную смесь далее перемешивают на протяжении ночи при комнатной температуре. Реакционную смесь затем выливают в воду и смесь экстрагируют этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом магния и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси гексан-этилацетат (4:1, об./об.) метил-4-(1-(трет-бутоксикарбонил)-(4S)-метокси-(2S)-пирролидинилметокси)бензоат (943 мг, 88%) получают в виде светло-желтого масла.
1H-ЯМР (CDCl3) δ: 1,46 (с, 9H), 2,03 (ушир., 1H), 2,27 (дд, J=1,6, 14,0 Гц, 1H), 3,27 (с, 3H), 3,50 (м, 2H), 3,86 (с, 3H), 3,91-4,00 (ушир., м, 2H), 4,12-4,36 (ушир., м, 2H), 6,94 (ушир., 2H), 7,95 (д, J=8,8 Гц, 2H).
(Стадия 2) Синтез метил-4-((4S)-метокси-(2S)- пирролидинилметокси)циклогексанкарбоксилата
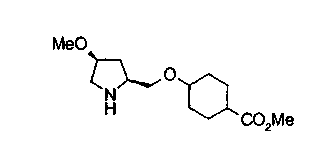
Метил-4-(1-(трет-бутоксикарбонил)-(4S)-метокси-(2S)-пирролидинилметокси)бензоат (943 мг, 2,56 ммоль) растворяют в этаноле (10 мл) и уксусной кислоте (1 мл). К образовавшемуся раствору добавляют катализатор родий-оксид алюминия (500 мг) и смесь подвергают каталитическому гидрированию на протяжении ночи при комнатной температуре при 5 атм. Катализатор отфильтровывают и фильтрат перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси гексан-этилацетат (3:1, об./об.) метил-4-(1-(трет-бутоксикарбонил)-(4S)-метокси-(2S)-пирролидинилметокси)циклогексанкарбоксилат (819 мг, 86%) получают в виде светло-желтого масла. Образовавшийся метил-4-(1-(трет-бутоксикарбонил)-(4S)-метокси-(2S)-пирролидинилметокси)циклогексанкарбоксилат (819 мг, 2,20 ммоль) затем растворяют в метиленхлориде (9 мл). После добавления трифторуксусной кислоты (4 мл) при 0°С смесь перемешивают при комнатной температуре в течение 1,5 часа. Реакционную смесь перегоняют при пониженном давлении для удаления растворителя. Остаток подщелачивают обработкой 1 н. NaOH с последующей экстракцией хлороформом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом магния и перегоняют при пониженном давлении для удаления растворителя, в результате чего метил-4-((4S)-метокси-(2S)- пирролидинилметокси)циклогексанкарбоксилат (2,53 г, 81%)%) получают в виде светло-желтого масла (смесь двух диастереомеров).
1H-ЯМР (CDCl3) δ: 1,47 (м, 3Н), 1,61 (м, 2H), 1,81 (м, 4H), 2,03 (м, 2H), 2,32 (м, 1H), 2,84 (дд, J=5,1, 11,5 Гц, 1H), 3,60 (д, J=11,5 Гц, 1H), 3,21 (ушир., 1H), 3,24 (с, 3H), 3,35-3,44 (м, 3H), 3,63 (с, 3H), 3,68 (ушир., 1H).
(Стадия 3) Синтез метил-4-((4S)-метокси-1-(2-(2-метилфениламино)-6-бензоксазолилацетил)-(2S)-пирролидинилметокси)циклогексанкарбоксилата
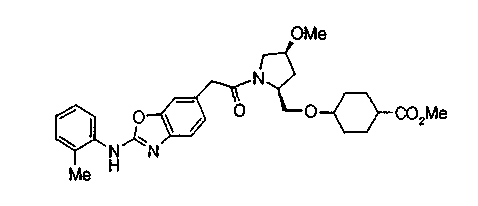
В ДМФ (7 мл) растворяют 2-(2-метилфениламино)-6-бензоксазолилуксусную кислоту (218 мг, 0,77 ммоль) и метил-4-((4S)-метокси-(2S)-пирролидинилметокси)циклогексанкарбоксилат (210 мг, 0,77 ммоль). К образовавшемуся раствору добавляют EDC·HCl (235 мг, 1,22 ммоль), HOBt (5,0 мг, 0,04 ммоль) и DMAP (5,0 мг, 0,04 ммоль) с последующим перемешиванием на протяжении ночи при комнатной температуре. Реакционную смесь разбавляют этилацетатом. Разбавленную смесь затем промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси хлороформ-метанол (10:1, об./об.) метил-4-((4S)-метокси-1-(2-(2-метилфениламино)- 6-бензоксазолилацетил)-(2S)-пирролидинилметокси)циклогексанкарбоксилат (385 мг, 93%) получают в виде светло-коричневого масла (смесь двух диастереомеров).
ИК (KBr) 2937, 1732, 1641, 1574 см-1;
1H-ЯМР (CDCl3) δ: 1,47 (м, 2H), 1,62 (м, 2H), 1,76-1,88 (м, 4H), 1,91-2,05 (м, 2H), 2,23 (м, 1H), 2,33 (д, 3H), 2,35 (м, 1H), 3,27 (д, 3H), 3,40-3,54 (м, 3H), 3,65 (д, 3H), 3,67 (м, 2H), 3,78-4,02 (ряд м, общий 2H), 4,12-4,26 (ряд м, общий 1H), 6,86 (ушир., 1H), 7,05 (кв., J=7,6 Гц, 2H), 7,15 (д, J=7,6 Гц, 1H), 7,28 (м, 2H), 7,37 (дд, J=2,6, 8,0 Гц, 1H), 8,07 (д, J=8,0 Гц, 1H).
МС (ESI) m/z 536 (M+H)+;
Анал. Вычисл. для С30Н37N3O6 ·0,5H2О: C, 66,16; H, 7,03; N, 7,72.
Найдено: C, 66,06; H, 6,96; N, 7,57.
(Стадия 4) Синтез 4-((4S)-метокси-1-(2-(2-метилфениламино)-6-бензоксазолилацетил)-(2S)-пирролидинилметокси)циклогексанкарбоновой кислоты, изомера А и изомера В
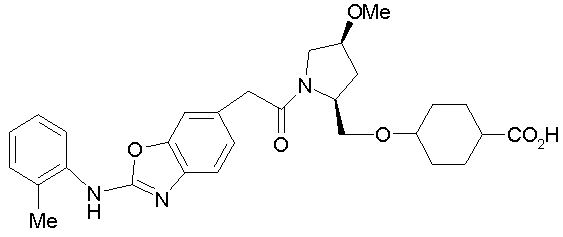
Метил-4-((4S)-метокси-1-(2-(2-метилфениламино)-6-бензоксазолилацетил)-(2S)-пирролидинилметокси)циклогексанкарбоксилат (940 мг, 1,79 ммоль) растворяют в ТГФ (15 мл) и метаноле (1 мл). К образовавшемуся раствору добавляют 0,25 н. NaOH (2 экв.) с последующим перемешиванием на протяжении ночи при комнатной температуре. Реакционную смесь разбавляют смесью хлороформ-метанол (5:1, об./об.). Разбавленную смесь промывают 1 н. HCl, сушат над безводным сульфатом магния и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси хлороформ-метанол (20:1, об./об.) 4-((4S)-метокси-1-(2-(2-метилфениламино)-6-бензоксазолилацетил)-(2S)-пирролидинилметокси)циклогексанкарбоновую кислоту (568 мг, 64%) получают в виде смеси двух диастереомеров. Смесь двух диастереомеров разделяют ВЭЖХ (Shimpack PRC-ODS/30 мм×250 мм, ацетонитрил: 0,02 н.буфер ацетат натрия=1:1, 20 мл/мин). Изомер А (39 мг, 11%) и изомер В (246 мг, 67%) получают, каждый, в форме светло-желтого кристаллического порошка.
Изомер A;
ИК (KBr) 2933, 1697, 1641, 1574 см-1;
1H-ЯМР (CDCl3) δ: 1,18 (м, 4H), 1,40 (м, 2H), 1,96 (м, 4H), 2,19 (м, 2H), 2,28 (с, 3H), 3,15 (м, 1H), 3,21 (д, J=4,4 Гц, 3H), 3,40 (м, 2H), 3,60 (м, 3H), 3,64-3,90 (ряд м, общий 3H), 4,04-4,19 (м, 1H), 5,17 (ушир., 1H), 7,02 (т, J=7,4 Гц, 2H), 7,16 (м, 1H), 7,23 (м, 2H), 7,66 (д, J=8,0 Гц, 1H).
МС (ESI) m/z 522 (M+H)+;
Анал. Вычисл. для С29Н35N3O6·1,75H2O: C, 62,97; H, 7,02; N, 7,60.
Найдено: C, 63,39; H, 7,04; N, 6,90.
Изомер В; ИК (KBr) 2931, 1697, 1641, 1574 см-1;
1H-ЯМР (CDCl3) δ: 1,48 (м, 2H), 1,64-1,98 (ряд м, общий 8H), 2,23 (м, 1H), 2,27 (с, 3H), 2,38 (м, 1H), 3,27 (д, J=6,8 Гц, 1H), 3,39-3,47 (м, 3H), 3,54 (кв., J=8,8 Гц, 1H), 3,66 (м, 2H), 3,88 (м, 2H), 4,20 (м, 1H), 7,05 (т, J=7,0 Гц, 2H), 7,19 (м, 1H), 7,30 (м, 2H), 7,81 (дд, J=8,0, 44,4 Гц, 1H).
МС (ESI) m/z 522 (M+H)+;
Анал. Вычисл. для С29Н35N3O6·H2O: C, 64,55; H, 6,91; N, 7,79.
Найдено: C, 64,81; H, 7,17; N, 7,00.
Пример 21
4-(1-(2-(2-Метилфениламино)-6-бензоксазолилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоновая кислота, изомер G и изомер Н:
(Стадия 1) Синтез метил-4-(N-карбобензокси)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилата, изомера А и изомера В
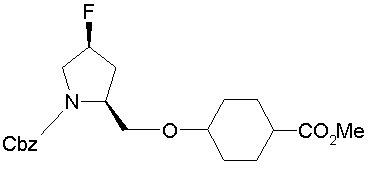
Метил-4-((4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилат (529 мг, 2,04 ммоль) и карбобензоксихлорид (от 30 до 35% раствор в толуоле, 1,21 мл, 2,04 ммоль) растворяют в метиленхлориде (20 мл). При перемешивании при комнатной температуре добавляют насыщенный водный раствор бикарбоната натрия (5 мл). Реакционную смесь далее перемешивают в течение 5,5 часа при комнатной температуре. Реакционную смесь выливают в воду (20 мл) и смесь экстрагируют этилацетатом. Экстракт затем сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси гексан-этилацетат (2:1) метил-4-(N-карбобензокси)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилат (648 мг, 85%), то есть смесь двух диастереомеров, получают в виде бесцветного масла. Поскольку смесь можно разделить на два диастереомера хроматографией при среднем давлении на колонке с силикагелем, из элюатных фракций смеси гексан-этилацетат (3:1) выделяют два изомера.
Изомер A:
1H-ЯМР (CDCl3) δ: 1,48 (ушир.с, 2H), 1,64 (ушир.с, 2H), 1,84 (ушир.с, 4H), 2,01-2,18 (м, 1H), 2,41-2,51 (м, 1H), 3,33-3,51 (м, 2H), 4,60-3,75 (м, 3H), 3,67 (с, 3H), 4,11-4,15 (м, 1H), 5,10-5,29 (ряд м, 3H), 7,30-7,37 (м, 5H).
МС (ESI) m/z, 394 (M++H).
Изомер B:
1H-ЯМР (CDCl3) δ: 1,26 (ушир.с, 2H), 1,44 (ушир.с, 2H), 1,99-2,13 (м, 5H), 2,39 (ушир.с, 1H), 2,39-2,48 (м, 1H), 3,18-3,36 (м, 2H), 3,61-3,86 (м, 3H), 3,67 (с, 3H), 4,14 (ушир.с, 1H), 5,10-5,29 (ряд м, 3H), 7,31-7,37 (м, 5H).
МС (ESI) m/z, 394 (M++H).
(Стадия 2) Синтез метил-4-((4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилата (изомера С)
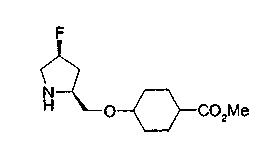
В метаноле (10 мл) метил-4-(N-карбобензокси)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилат (вышеописанный изомер А, 451 мг, 1,15 ммоль) и катализатор 20% гидроксид палладия/уголь (42 мг) подвергают каталитическому гидрированию на протяжении ночи при комнатной температуре и 1 атм. Катализатор отфильтровывают от реакционной смеси и фильтрат перегоняют при пониженном давлении для удаления растворителя, в результате чего метил-4-((4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилат (311 мг, 100%) получают в виде бесцветного твердого вещества (изомер С).
Результат рентгеноструктурного анализа подтвердил, что производное этого соединения является метил-цис-4-((4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилатом, заместители которого в 1- и 4-положении кольца циклогексана имеют относительную цис-конфигурацию.
1H-ЯМР (CDCl3), смесь ротамеров, δ: 1,50 (ушир.т, J=14,0 Гц, 2H), 1,61-1,66 (м, 2H), 1,80-2,01 (ряд м, 5H), 2,17-2,37 (м, 2H), 3,05-3,18 (м, 1H), 3,40-3,61 (ряд м, 5H), 3,64 (с, 3H), 5,01 (ушир.с, 1H), 5,14-5,30 (м, 1H).
МС (ESI) m/z, 360 (M++H).
(Стадия 3) Синтез метил-4-((4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилата (изомера D)

В метаноле (5 мл) метил-4-(N-карбобензокси)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилат (изомер В, 121 мг, 0,31 ммоль) и катализатор 20% гидроксид палладия/уголь (19 мг) подвергают каталитическому гидрированию на протяжении ночи при комнатной температуре и 1 атм. Катализатор отфильтровывают из реакционной смеси и фильтрат перегоняют при пониженном давлении для удаления растворителя, в результате чего метил-4-((4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилат (311 мг, колич.) получают в виде бесцветного твердого вещества (изомер D).
Результат рентгеноструктурного анализа подтвердил, что производное этого соединения является метил-транс-4-((4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилатом, заместители которого в 1- и 4-положении кольца циклогексана имеют относительную транс-конфигурацию.
1H-ЯМР (CDCl3), смесь ротамеров, δ: 1,21-1,31 (м, 2H), 1,41-1,51 (м, 2H), 1,74-1,87 (м, 1H),), 1,98-2,09 (м, 5H), 2,11-2,30 (м, 2H), 2,48 (ушир.с, 1H), 2,85-2,98 (м, 1H), 3,22-3,59 (ряд м, 5H), 5,12-5,26 (м, 1H).
МС (ESI) m/z, 360 (M++H).
(Стадия 4) Синтез метил-4-(1-(2-(2-метилфениламино)-6-бензоксазолилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилата (изомера E)
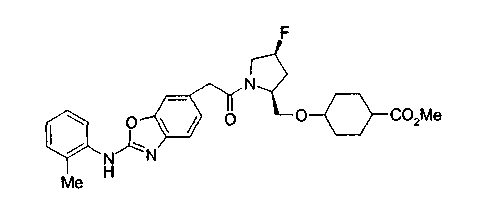
В ДМФ (10 мл) HOBt (5,2 мг, 0,04 ммоль) добавляют к метил-4-((4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилату (изомер С, 50 мг, 0,19 ммоль), 2-(2-метилфениламино)-6-бензоксазолилуксусной кислоте (59,9 г, 0,21 ммоль) и EDC·HCl (55,5 мг, 0,29 ммоль) при перемешивании при комнатной температуре. После перемешивания на протяжении ночи при комнатной температуре реакционную смесь выливают в воду (10 мл) и смесь экстрагируют этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси гексан-этилацетат (1:5) метил-4-(1-(2-(2-метилфениламино)-6-бензоксазолилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилат (92,0 мг, 91%) получают в виде бесцветного аморфного вещества (изомер Е).
1H-ЯМР (CDCl3), смесь ротамеров, δ: 1,46-2,48 (ряд м, 11H), 2,35 (с, 3H), 3,38-4,41 (ряд м, 8H), 3,64-3,68 (м, 3H), 5,15-5,30 (м, 1H), 7,07 (дд, J=16,0, 7,6 Гц, 2H), 7,21 (д, J=8,0 Гц, 1H), 7,30 (т, J=6,4 Гц, 2H), 7,32-7,40 (м, 1H), 8,07 (д, J=8,4 Гц, 1H).
(Стадия 5) Синтез метил-4-(1-(2-(2-метилфениламино)-6-бензоксазолилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилата (изомера F)
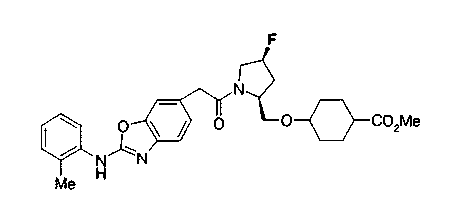
В ДМФ (10 мл) HOBt (8,0 мг, 0,04 ммоль) добавляют к метил-4-((4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилату (изомер D, 77 мг, 0,30 ммоль), 2-(2-метилфениламино)-6-бензоксазолилуксусной кислоте (92,2 г, 0,33 ммоль) и EDC·HCl (85,4 мг, 0,45 ммоль) при перемешивании при комнатной температуре. После дальнейшего перемешивания на протяжении ночи при комнатной температуре реакционную смесь выливают в воду (10 мл) и смесь экстрагируют этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси гексан-этилацетат (1:5) метил-4-(1-(2-(2-метилфениламино)-6-бензоксазолилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилат (142 мг, 91%) получают в виде бесцветного аморфного вещества (изомер F).
1H-ЯМР (CDCl3), смесь ротамеров, δ: 1,16-1,32 (м, 2H), 1,40-1,54 (м, 2H), 1,96-2,50 (ряд м, 7H), 2,36 (с, 3H), 3,21-3,29 (м, 1H), 3,32-3,52 (м, 1H), 3,50-4,39 (ряд м, 6H), 3,62-3,69 (м, 3H), 5,15-5,31 (м, 1H), 7,05-7,10 (м, 2H), 7,22 (д, J=7,2 Гц, 1H), 7,29-7,31 (м, 3H), 7,39-7,43 (м, 1H), 8,06 (д, J=8,0 Гц, 1H).
(Стадия 6) Синтез 4-(1-(2-(2-метилфениламино)-6-бензоксазолилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоновой кислоты (изомер G)
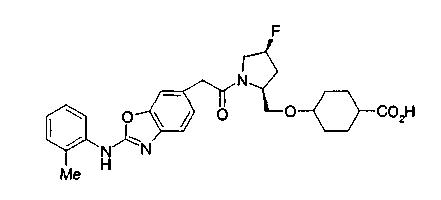
Метил-4-(1-(2-(2-метилфениламино)-6-бензоксазолилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилат (изомер Е, 92,0 мг, 0,18 ммоль) растворяют в смеси метанол-ТГФ (1:1, 10 мл). После добавления 0,25 М NaOH (0,53 мл, 2,11 ммоль) при перемешивании при комнатной температуре реакционную смесь перемешивают при комнатной температуре в течение 15 часов. К реакционной смеси затем добавляют 1,0 М NaOH (0,35 мл, 0,35 ммоль) с последующим перемешиванием при 50°С в течение 2,5 часа. Реакционную смесь выливают в 1 н. HCl (20 мл) и смесь экстрагируют смесью хлороформ-метанол. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси хлороформ-метанол (10:1) 4-(1-(2-(2-метилфениламино)-6-бензоксазолилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоновую кислоту (78,0 мг, 87%) получают в виде бесцветного аморфного вещества (изомер G). ИК (KBr) 2933, 1693, 1641, 1575 см-1;
1H-ЯМР (CDCl3) δ: 1,45-1,58 (м, 2H), 1,63-2,01 (ряд м, общий 6H), 2,10-2,25 (м, 1H), 2,40-2,62 (м, 1H), 2,34 и 2,35 (с, общий 3H), 3,30-4,48 (ряд м, 9H), 5,14-5,29 (м, 1H), 7,05-7,12 (ряд м, 2H), 7,20-7,33 (ряд м, 5H), 7,70 и 7,75 (д, J=8,0 Гц, общий 1H). МС (FAB) m/z 510 (M++H)
(Стадия 7) Синтез 4-(1-(2-(2-метилфениламино)-6-бензоксазолилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоновой кислоты (изомер H)

Метил-4-(1-(2-(2-метилфениламино)-6-бензоксазолилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилат (изомер F, 130 мг, 0,25 ммоль) растворяют в смеси метанол-ТГФ (1:1, 10 мл). После добавления 0,25 М NaOH (1,99 мл, 0,50 ммоль) при комнатной температуре реакционную смесь перемешивают при комнатной температуре в течение 1 часа. К реакционной смеси добавляют 1,0 М NaOH (0,74 мл, 0,74 ммоль) и смесь перемешивают при 50°С в течение 3 часов. Реакционную смесь выливают в 1 н. HCl (20 мл) и смесь экстрагируют смесью хлороформ-метанол. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси хлороформ-метанол (10:1) 4-(1-(2-(2-метилфениламино)-6-бензоксазолилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоновую кислоту (120 мг, 95%) получают в виде бесцветного аморфного вещества (изомер H).
ИК (KBr) 2937, 1699, 1641, 1574 см-1;
1H-ЯМР (CDCl3) δ: 1,20-1,31 (м, 2H), 1,43-1,56 (м, 2H), 2,10 (ушир.с, 5H), 2,21-2,50 (м, 1H), 2,34 (с, 3H), 3,24-4,48 (ряд м, 9H), 7,01 (ушир.с, 1H), 7,11 (ушир.с, 1H), 7,22-7,36 (ряд м, 5H), 7,81 (ушир.д, J=5,6 Гц, 1H).
МС (FAB) m/z 510 (M++H);
Анал. Вычисл. для С28Н32FN3O5: С, 66,00; H, 6,33; N, 8,25.
Найдено: C, 65,71; H, 6,42; N, 8,08.
Пример 22
4-(1-(2-(2-Метилфениламино)-6-бензоксазолилацетил)-(2S)-пирролидинилметокси)циклогексанкарбоновая кислота, изомер А и изомер В:
(Стадия 1) Синтез метил-4-(1-(2-(2-метилфениламино)-6-бензоксазолилацетил)-(2S)-пирролидинилметокси)циклогексанкарбоксилат (цис- и транс-формы)
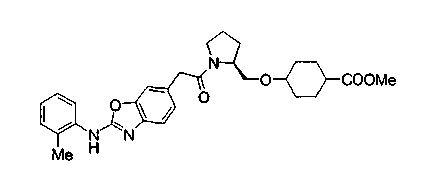
В метиленхлориде (20 мл) EDC·HCl (691 мг, 3,6 ммоль) добавляют при 0°С к метил-4-(1-(трет-бутоксикарбонил)-(2S)-пирролидинилметокси)циклогексанкарбоксилату (580 мг, 2,4 ммоль), 2-(2-метилфениламино)-6-бензоксазолилуксусной кислоте (678 мг, 2,4 ммоль), HOBt (324 мг, 2,4 ммоль) и триэтиламину (1,0 мл, 7,2 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 16 часов. Добавляют ледяную воду (10 мл) и смесь экстрагируют этилацетатом. Экстракт промывают насыщенным водным раствором бикарбоната натрия, 2 М водным раствором уксусной кислоты и насыщенным водным раствором бикарбоната натрия, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси гексан-этилацетат (1:2, об./об.) указанное в заголовке соединение (500 мг, 48%) получают в виде бесцветного масла.
1H-ЯМР (CDCl3) δ: 1,30-2,10 (м, 12H), 2,36 (с, 3H), 3,30-3,90 (м, 7H), 4,10-4,25 (м, 2H), 7,00-7,40 (м, 7H), 8,04-8,06 (м, 1H).
(Стадия 2) Синтез 4-(1-(2-(2-метилфениламино)-6-бензоксазолилацетил)-(2S)-пирролидинилметокси)циклогексанкарбоновая кислота, изомер А и изомер В
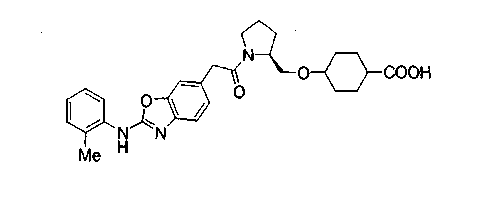
В ТГФ (10 мл) и метаноле (5 мл) растворяют метил-4-(1-(2-(2-метилфениламино)-6-бензоксазолилацетил)-(2S)-пирролидинилметокси)циклогексанкарбоксилат (580 мг, 1,1 ммоль), то есть смесь двух диастереомеров (цис- и транс-формы). После добавления 1 н. NaOH (1,5 мл, 1,5 ммоль) смесь перемешивают при 70°С в течение 24 часов. Остаток, полученный отгонкой растворителя при пониженном давлении, слабо подкисляют 1 н. HCl. Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении. Образовавшиеся кристаллы промывают водой и сушат при пониженном давлении, в результате чего 4-(1-(2-(2-метилфениламино)-6-бензоксазолилацетил)-(2S)-пирролидинилметокси)циклогексанкарбоновую кислоту получают в виде смеси двух диастереомеров. Смесь разделяют ВЭЖХ (колонка С18, элюирование смесью 0,02 н.ацетатный буфер-ацетонитрил (1:1, об./об.), в результате чего изомер А (150 мг, 27%) получают в виде белого кристаллического твердого вещества.
ИК (KBr) 2937, 2867, 1641, 1573, 1440, 1243 см-1;
1H-ЯМР (ДМСО-d6) δ: 1,39-1,85 (м, 10H), 2,23-2,28 (м, 2H), 2,29 (с, 3H), 3,41-4,03 (м, 9H), 7,01-7,08 (м, 2H), 7,21-7,28 (м, 4H), 7,80-7,82 (м, 1H).
МС (FAB) m/z 492 (M+H)+;
Анал. Вычисл. для С28Н33N3O5 ·0,2H2O: C, 67,91; H, 6,80; N, 8,49.
Найдено: C, 67,79; H, 6,77; N, 8,25.
Из элюатных фракций ВЭЖХ (колонка С18, элюирование смесью 0,02 н.ацетатный буфер-ацетонитрил (1:1, об./об.) изомер В (10 мг, 1,7%) получают в виде белого кристаллического твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 1,11-1,30 (м, 5H), 1,80-2,11 (м, 7H), 2,29 (с, 3H), 3,44-4,00 (м, 9H), 7,02-7,08 (м, 2H), 7,21-7,29 (м, 4H), 7,79-7,81 (м, 1H).
Пример 23
4-(1-(2-(2-Метилфениламино)-6-бензоксазолилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)-3-метилциклогексанкарбоновая кислота:
(Стадия 1) Синтез метил-4-гидрокси-3-метилбензоата
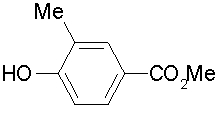
В ДМСО (10 мл) и метаноле (5 мл) растворяют 4-гидрокси-3-метилиодбензол (3,13 г, 13,4 ммоль), триэтиламин (4,11 мл, 29,5 ммоль), ацетат палладия (150 мг, 0,67 ммоль) и 1,3-бис(дифенилфосфино)пропан (276 мг, 0,67 ммоль). При перемешивании при комнатной температуре в течение 10 минут вводят газообразный монооксид углерода. Реакционную смесь далее перемешивают при 70°С в течение 2 дней в потоке газообразного монооксида углерода. После охлаждения до комнатной температуры реакционную смесь концентрируют.Концентрат выливают в воду (20 мл) с последующей экстракцией этилацетатом. Экстракт промывают последовательно водой (х 2) и насыщенным раствором соли (х 2), сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси гексан-этилацетат (5:1) метил-4-гидрокси-3-метилбензоат (2,00 г, 90%) получают в виде белого кристаллического твердого вещества.
1H-ЯМР (CDCl3) δ: 2,28 (с, 3H), 3,90 (с, 3H), 6,20 (ушир.с, 1H), 6,83 (д, J=8,4 Гц, 1H), 7,79 (д, J=8,4 Гц, 1H), 7,85 (с, 1H).
(Стадия 2) Синтез метил-4-((4S)-фтор-(2S)-пирролидинилметокси)-3-метилбензоата
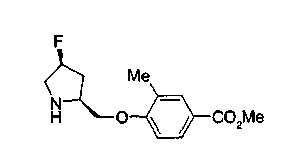
Метил-4-гидрокси-3-метилбензат (1,98 г, 11,9 ммоль), N-трет-бутоксикарбонил-(4S)-фтор-(2S)-пирролидинилметанол (2,87 г, 13,1 ммоль) и трифенилфосфин (3,43 г, 13,1 ммоль) растворяют в ТГФ (50 мл). При перемешивании при комнатной температуре добавляют диизопропилазодикарбоксилат (2,57 мл, 13,1 ммоль) и реакционную смесь перемешивают на протяжении ночи при 60°С. После охлаждения до комнатной температуры реакционную смесь концентрируют при пониженном давлении. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси гексан-этилацетат (4:1) получают метил-4-((4S)-фтор-(2S)-пирролидинилметокси)-3-метилбензоат. Это соединение дополнительно не очищают. Добавляют метиленхлорид (50 мл) и трифторуксусную кислоту (25 мл). Смесь затем перемешивают при комнатной температуре в течение 20 минут. К остатку, полученному отгонкой растворителя при пониженном давлении добавляют насыщенный водный раствор бикарбоната натрия, чтобы сделать смесь щелочной, с последующей экстракцией хлороформом. Экстракт сушат над безводным сульфатом натрия при пониженном давлении для удаления растворителя, в результате чего метил-4-((4S)-фтор-(2S)-пирролидинилметокси)-3-метилбензоат (551 мг, 17%) получают в виде бесцветного твердого вещества (это соединение применяют для следующей реакции без дополнительной очистки).
1H-ЯМР (CDCl3) δ: 1,53 (ушир.с, 1H), 1,63-1,76 (м, 1H), 1,86-2,01 (м, 1H), 1,92 (с, 3H), 2,58-2,71 (м, 1H), 3,01-3,10 (м, 1H), 3,26 (ушир.с, 1H), 3,55 (с, 3H), 3,72-3,82 (м, 2H), 4,84-5,00 (м, 1H), 6,49 (д, J=8,4 Гц, 1H), 7,51 (с, 1H), 7,53 (дд, J=8,8, 2,8 Гц, 1H).
МС (ESI) m/z, 309 (M++CH3CN).
(Стадия 3) Синтез метил-4-(N-трет-бутоксикарбонил-(4S)-фтор-(2S)-пирролидинилметокси)-3-метилбензоата
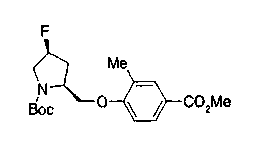
Метил-4-((4S)-фтор-(2S)-пирролидинилметокси)-3-метилбензоат (2,04 г, 7,63 ммоль) и ди-трет-бутилдикарбонат (2,00 г, 9,16 ммоль) растворяют в ацетонитриле (50 мл). При комнатной температуре добавляют 1,0 М NaOH (9,16 мл, 9,16 ммоль) и смесь перемешивают в течение 30 минут. Реакционную смесь выливают в 1,0 н. HCl (20 мл) с последующей экстракцией этилацетатом. Экстракт сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Полученные таким образом сырые кристаллы перекристаллизовывают из смеси этилацетат-гексан, в результате чего метил-4-(N-трет-бутоксикарбонил-(4S)-фтор-(2S)-пирролидинилметокси)-3-метилбензоат (2,43 г, 86%) получают в виде бесцветного кристаллического порошка.
МС (ESI) m/z, 368 (M++H). (Стадия 4) Синтез метил-4-((4S)-фтор-(2S)-пирролидинилметокси)-3-метилциклогексанкарбоксилата
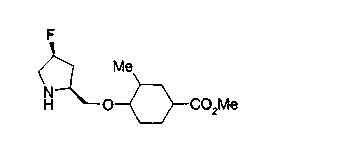
В смеси этанол-уксусная кислота (10:1, 16,5 мл) метил-4-(N-трет-бутоксикарбонил-(4S)-фтор-(2S)-пирролидинилметокси)-3-метилбензоат (2,26 г, 6,17 ммоль) и 5% родий-оксид алюминия подвергают каталитическому гидрированию при комнатной температуре при перемешивании в потоке газообразного водорода при давлении 5 атм. Катализатор отфильтровывают и из фильтрата растворитель отгоняют при пониженном давлении. Таким образом полученный остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси гексан-этилацетат (4:1) метил-4-(N-трет-бутоксикарбонил-(4S)-фтор-(2S)-пирролидинилметокси)-3-метилциклогексанкарбоксилат (2,22 г, 96%) получают в виде бесцветного масла. Образовавшийся метил-4-(N-трет-бутоксикарбонил-(4S)-фтор-(2S)-пирролидинилметокси)-3-метилциклогексанкарбоксилат (2,22 г, 5,94 ммоль) растворяют в метиленхлориде (30 мл). Добавляют трифторуксусную кислоту (10 мл) и смесь перемешивают при комнатной температуре в течение 30 минут. К остатку, который получают отгонкой растворителя при пониженном давлении, добавляют насыщенный водный раствор бикарбоната натрия для нейтрализации его с последующей экстракцией смесью хлороформ-метанол (приблизительно 10:1). Экстракт затем сушат над безводным сульфатом натрия и растворитель отгоняют при пониженном давлении, в результате чего метил-4-((4S)-фтор-(2S)-пирролидинилметокси)-3-метилциклогексанкарбоксилат (1,58 г, 98%), смесь диастереомеров, получают в виде бесцветного масла (это соединение применяют для следующей реакции без дополнительной очистки).
1H-ЯМР (CDCl3), смесь диастереомеров, δ: 0,97-1,00 (м, 3H), 1,23-1,33 (м, 1H), 1,54-1,69 (м, 5H), 1,80-1,94 (м, 1H), 2,05-2,22 (м, 3H), 2,28-2,35 (м, 1H), 2,78-2,91 (м, 1H), 3,24-3,37 (м, 4H), 3,59-3,69 (м, 1H), 3,65 и 3,66 (с, общий 3H), 5,10-5,26 (м, 1H).
(Стадия 5) Синтез метил-4-(1-(2-(2-метилфениламино)-6-бензоксазолилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)-3-метилциклогексанкарбоксилат
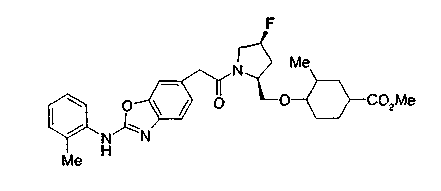
При комнатной температуре ДМФ (10 мл) и EDC·HCl (169 мг, 0,88 ммоль) добавляют к метил-4-((4S)-фтор-(2S)-пирролидинилметокси)-3-метилциклогексанкарбоксилату (219 мг, 0,59 ммоль), 2-(2-метилфениламино)-6-бензоксазолилуксусной кислоте (182 мг, 0,65 ммоль), HOBt (8,0 мг, 0,06 ммоль) и DMAP (7,2 мг, 0,06 ммоль). Смесь перемешивают на протяжении ночи при комнатной температуре. Реакционную смесь выливают в воду (30 мл) с последующей экстракцией этилацетатом. Экстракт промывают насыщенным раствором соли (три раза), сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Таким образом полученный остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси гексан-этилацетат (1:5) получают метил-4-(1-(2-(2-метилфениламино)-6-бензоксазолилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)-3-метилциклогексанкарбоксилат (344 мг, колич.), смесь двух диастереомеров, в виде бесцветного аморфного вещества.
1H-ЯМР (CDCl3), смесь диастереомеров и ротамеров, δ: 0,94-1,03 (м, 3H), 1,18-2,55 (ряд м, 12H), 2,36 (с, 3H), 3,18-4,52 (ряд м, 7H), 3,54-3,68 (м, 3H), 5,15-5,31 (м, 1H), 7,05-7,40 (ряд м, 7H), 8,05 (д, J=8,4 Гц, 1H).
МС (ESI) m/z, 538 (M++H).
(Стадия 6) Синтез 4-(1-(2-(2-метилфениламино)-6-бензоксазолилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)-3-метилциклогексанкарбоновой кислоты
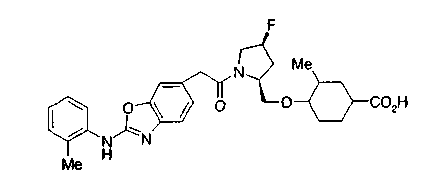
Метил-4-(1-(2-(2-метилфениламино)-6-бензоксазолилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)-3-метилциклогексанкарбоксилат (329 мг, 0,61 ммоль) растворяют в смеси метанол-ТГФ (15:2, 17 мл). К образовавшемуся раствору добавляют 0,25 М NaOH (4,90 мл, 1,22 ммоль) и смесь перемешивают на протяжении ночи при комнатной температуре. Реакционную смесь выливают в 1 н. HCl (10 мл) с последующей экстракцией смесью хлороформ-метанол (10:1, об./об.). Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси гексан-этилацетат (1:4) 4-(1-(2-(2-метилфениламино)-6-бензоксазолилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)-3-метилциклогексанкарбоновую кислоту (259 мг, 81%), смесь диастереомеров, получают в виде бесцветного масла.
1H-ЯМР (CDCl3), смесь диастереомеров и ротамеров, δ: 0,95-1,03 (м, 3H), 1,24-2,55 (ряд м, 12H), 2,34, 2,35 и 2,36 (с, общий 3H), 3,16-4,40 (ряд м, 7H), 5,10-5,30 (м, 1H), 7,06-7,85 (ряд м, 8H).
МС (ESI) m/z, 524 (M++H).
Пример 24
4-(1-(2-(2-Хлорфениламино)-6-бензоксазолилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоновая кислота, изомер А и изомер В:
(Стадия 1) Синтез метил-4-(1-(2-(2-хлорфениламино)-6-бензоксазолилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилат
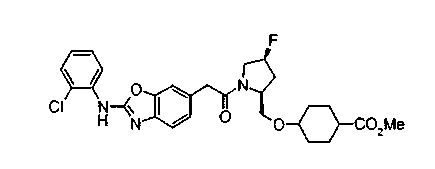
В ДМФ (10 мл) смесь 2-(2-хлорфениламино)-6-бензоксазолилуксусной кислоты (605 мг, 2,0 ммоль), метил-4-((4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилата (519 мг, 2,0 ммоль, смесь цис- и транс-форм), EDC·HCl (575 мг, 3,0 ммоль), HOBt (405 мг, 3,0 ммоль) и триэтиламина (1,39 мл, 10,0 ммоль) перемешивают при комнатной температуре в течение 16 часов. Реакционную смесь выливают в ледяную воду (30 мл) с последующей экстракцией этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем (силикагель: 50 г), посредством чего из элюатных фракций смеси хлороформ/ацетон (10/1) указанное в заголовке соединение (770 мг, 71%), смесь диастереомеров, получают в виде коричневого масла (это соединение применяют для следующей реакции без дополнительной очистки).
(Стадия 2) Синтез 4-(1-(2-(2-хлорфениламино)-6-бензоксазолилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоновой кислоты, изомера А и изомера В
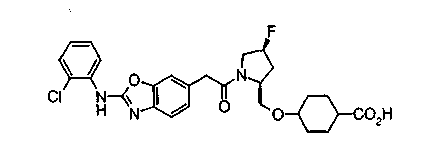
Метил-4-(1-(2-(2-хлорфениламино)-6-бензоксазолилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилат (770 мг, 1,42 ммоль), смесь диастереомеров, растворяют в ТГФ (20 мл). После добавления 0,25 н. NaOH (20 мл) образовавшуюся смесь перемешивают при комнатной температуре в течение 18 часов. Реакционную смесь затем концентрируют при пониженном давлении. Концентрат подкисляют 1 н. HCl с последующей экстракцией смесью хлороформ/метанол (10/1). Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Из остатка выделяют два диастереомера и очищают ВЭЖХ (С18, 30×300 мм, 0,02 М буфер ацетат натрия/ацетонитрил (1/1), 20 мл/мин). Их фракции перегоняют при пониженном давлении для удаления растворителя. После подкисления остатка 1 н. HCl проводят экстракцию смесью хлороформ/метанол (10/1). Экстракты промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя, в результате чего изомер А (161 мг, 21%) получают в виде светло-коричневого аморфного вещества, тогда как изомер В (631 мг, 71%) получают в виде светло-коричневого аморфного вещества.
Изомер А:
ИК (KBr) 3406, 2937, 2862, 1724, 1703, 1637, 1587, 1572, 1533 см-1;
1H-ЯМР (ДМСО-d6) δ: 0,82-1,41 (м, 4H), 1,83-2,20 (м, 6H), 3,16-4,32 (м, 9H), 5,22-5,43 (м, 1H), 706 (т, J=9,3 Гц, 1H), 7,18 (т, J=7,0 Гц, 1H), 7,32 (м, 2H), 7,41 (т, J=8,0 Гц, 1H), 8,67 (м, 1H).
МС (ESI) m/z, 530 (M++1), 532 (M++3),
Изомер B:
ИК (KBr) 3404, 2939, 1868, 1720, 1701, 1637, 1597 см-1;
1H-ЯМР (ДМСО-d6) δ: 1,44-1,72 (м, 7H), 2,12-2,36 (м, 3H), 3,14 (т, J=9,3 Гц, 1H), 3,37-4,42 (м, 8H), 5,24-5,44 (м, 1H), 7,06 (т, J=9,3 Гц, 1H), 7,18 (т, J=7,3 Гц, 1H), 7,29 и 7,31 (каждый с, общий 1H, амидные изомеры), 7,32 и 7,33 (каждый с, общий 1H, амидные изомеры), 7,41 (т, J=7,6 Гц, 1H), 7,52 (д, J=8,3 Гц, 1H), 8,08 (д, J=8,0 Гц, 1H).
МС (ESI), m/z 530 (M++1), 532 (M++3).
Пример 25
4-(1-(2-(2-Бромфениламино)-6-бензоксазолилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоновая кислота, изомер А и изомер В:
(Стадия 1) Синтез этил-2-(2-бромфениламино)-6-бензоксазолилацетата
Метил-3-гидрокси-4-аминофенилацетат (2,97 г, 16,4 ммоль) растворяют в метаноле (30 мл). К образовавшуюся раствору при перемешивании при комнатной температуре добавляют 2-бромфенилизотиоцианат (2,65 мл, 19,7 ммоль). Реакционную смесь затем перемешивают при комнатной температуре в течение 1,5 часа. К реакционной смеси добавляют оксид ртути(II) (желтый) (3,55 г, 16,4 ммоль) с последующим нагреванием и кипячением с обратным холодильником в течение 50 минут.После охлаждения реакционной смеси до комнатной температуры нерастворимое вещество отфильтровывают через целит при пониженном давлении. Фильтрат перегоняют при пониженном давлении для удаления растворителя. Остаток затем очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси гексан-этилацетат (4:1) этил-2-(2-бромфениламино)-6-бензоксазолилацетат (3,87 г, 66%) получают в виде бесцветного твердого вещества.
1H-ЯМР (CDCl3) δ: 3,71 (с, 3H), 3,73 (д, J=16,8 Гц, 2H), 6,94-6,98 (м, 1H), 7,15 (д, J=8,0 Гц, 1H), 7,32 (с, 1H), 7,38-7,43 (м, 1H), 7,46 (д, J=8,4 Гц, 1H), 7,53 (ушир.с, 1H), 7,55-7,58 (м, 1H), 8,52 (дд, J=8,4, 1,2 Гц, 1H).
МС (ESI) m/z 361 (M+), 363 (M++2).
(Стадия 2) Синтез 2-(2-бромфениламино)-6-бензоксазолилуксусной кислоты
Этил-2-(2-бромфениламино)-6-бензоксазолилацетат (3,82 г, 10,6 ммоль) растворяют в смеси ТГФ-метанол (1:1, 40 мл). К образовавшемуся раствору добавляют 1,0 М NaOH (52,0 мл, 52,0 ммоль) с последующим перемешиванием при комнатной температуре в течение 1,5 часа. К остатку, который получают отгонкой растворителя при пониженном давлении, подкисляют 1,0 н. HCl. Полученные таким образом кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат на протяжении ночи при пониженном давлении при 60°С, в результате чего 2-(2-бромфениламино)-6-бензоксазолилуксусную кислоту (3,40 г, 93%) получают в виде белого кристаллического порошка.
1H-ЯМР (ДМСО-d6) δ: 3,71 (с, 2H), 7,16 (д, J=8,0 Гц, 2H), 7,21 (т, J=8,0 Гц, 1H), 7,36 (д, J=8,0 Гц, 1H), 7,50 (с, 1H), 7,52 (т, J=7,6 Гц, 1H), 7,77 (д, J=8,0 Гц, 1H), 8,01 (д, J=7,6 Гц, 1H).
МС (ESI) m/z, 347 (M+), 349 (M++2).
(Стадия 3) Синтез метил-4-(1-(2-(2-бромфениламино)-6-бензоксазолилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилата

Метил-4-((4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилат (267 мг, 1,03 ммоль), 2-(2-бромфениламино)-6-бензоксазолилуксусную кислоту (357 мг, 1,03 ммоль) и HOBt (14,0 мг, 0,10 ммоль) растворяют в ДМФ (10 мл) К образовавшуюся раствору добавляют EDC·HCl (217 мг, 1,13 ммоль) и смесь перемешивают в течение ночи при комнатной температуре. Реакционную смесь выливают в воду (20 мл) с последующей экстракцией этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси гексан-этилацетат (1:5) метил-4-(1-(2-(2-бромфениламино)-6-бензоксазолилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилат (580 мг, 96%), смесь двух диастереомеров, получают в виде бесцветного аморфного вещества.
1H-ЯМР (CDCl3), смесь диастереомеров и ротамеров, δ: 1,24-2,54 (ряд м, 11H), 3,20-4,42 (ряд м, 8H), 3,64-3,69 (м, 3H), 5,15-5,35 (м, 1H), 6,95 (т, J=7,8 Гц, 1H), 7,12 (т, J=8,1 Гц, 1H), 7,31-7,57 (м, 3H), 7,95 (д, J=9,0 Гц, 1H), 8,52 (д, J=8,3 Гц, 2H).
МС (ESI) m/z, 588 (M+), 590 (M++2).
(Стадия 4) Синтез 4-(1-(2-(2-бромфениламино)-6-бензоксазолилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоновой кислоты, изомера А и изомера В
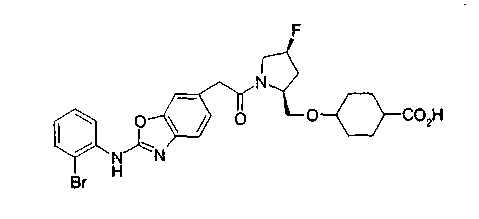
Метил-4-(1-(2-(2-бромфениламино)-6-бензоксазолилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилат (562 мг, 0,96 ммоль), смесь двух диастереомеров, растворяют в смеси метанол-ТГФ (15:2, 17 мл). К образовавшемуся раствору добавляют 0,25 М NaOH (7,64 мл, 1,191 ммоль) и смесь перемешивают на протяжении ночи при комнатной температуре. Реакционную смесь выливают в 1 н. HCl (10 мл) с последующей экстракцией смесью хлороформ-метанол. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, в результате чего из элюатных фракций этилацетата 4-(1-(2-(2-бромфениламино)-6-бензоксазолилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоновую кислоту (345 мг, 63%), смесь двух диастереомеров, получают в виде бесцветного аморфного вещества. Смесь двух диастереомеров можно разделить ВЭЖХ (Shimpack PRC-ODS-30 мм×250 мм, ацетонитрил: 0,02 н.буфер ацетат натрия=1:1, 20 мл/мин), так что получили изомер А (полярная фракция) и изомер В (менее полярная фракция), каждый в виде бесцветного аморфного вещества.
Изомер A:
1H-ЯМР (CDCl3), смесь ротамеров, δ: 1,23-1,35 (м, 2H), 1,43-1,53 (м, 2H), 2,01-2,48 (ряд м, 6H), 3,28-3,53 (ряд м, 2H), 3,63-3,92 (ряд м, 6H), 4,01 (д, J=15,2 Гц, 1H), 4,22-4,42 (м, 1H), 5,17-5,33 (м, 1H), 6,98 (т, J=7,6 Гц, 1H), 7,12-7,14 (м, 1H), 7,27 (с, 1H), 7,34 (д, J=6,8 Гц, 1H), 7,40-7,47 (м, 2H), 7,58 (д, J=8,0 Гц, 1H), 8,47 (д, J=8,4 Гц, 1H).
МС (ESI) m/z 574 (M+), 576 (M++2).
Изомер В:
1H-ЯМР (CDCl3), смесь ротамеров, δ: 1,26-1,55 (м, 2H), 1,67-1,75 (м, 2H), 1,81-1,93 (м, 4H), 2,00-2,53 (ряд м, 3H), 3,34-4,09 (ряд м, 7H), 4,22-4,43 (ряд м, 1H), 5,17-5,32 (м, 1H), 6,95-6,99 (м, 1H), 7,13 (т, J=8,0 Гц, 1H), 7,26 (с, 1H), 7,34 (д, J=11,6 Гц, 1H), 7,39-7,46 (м, 2H), 7,58 (д, J=8,0 Гц, 1H), 8,47 (т, J=6,8 Гц, 1H).
МС (ESI) m/z, 574 (M+), 576 (M++2).
Пример 26
4-(1-(7-Фтор-2-(2-метилфениламино)-6-бензоксазолилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоновая кислота, изомер А и изомер В:
(Стадия 1) Синтез метил-4-(1-(7-Фтор-2-(2-метилфениламино)- 6-бензоксазолилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилата
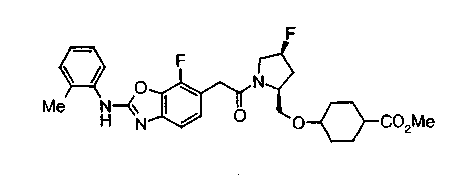
В ДМФ (5 мл) смесь 7-фтор-2-(2-метилфениламино)-6-бензоксазолилуксусной кислоты (240 мг, 0,8 ммоль), метил-4-((4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилата (207 мг, 0,8 ммоль, смесь цис- и транс-форм), EDC·HCl (230 мг, 1,2 ммоль), HOBt (162 мг, 1,2 ммоль) и триэтиламина (0,56 мл, 4,0 ммоль) перемешивают при комнатной температуре в течение 22 часов. Реакционную смесь выливают в ледяную воду (30 мл) и смесь экстрагируют этилацетатом. Экстракт промывают ледяной водой и насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем (силикагель: 40 г), посредством чего из элюатных фракций смеси хлороформ/ацетон (10/1) указанное в заголовке соединение (710 мг, 100%), смесь диастереомеров, получают в виде бесцветного аморфного вещества (это соединение применяют для следующей реакции без дополнительной очистки).
(Стадия 2) Синтез 4-(1-(7-фтор-2-(2-метилфениламино)-6-бензоксазолилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоновой кислоты, изомера А и изомера В

К раствору метил-4-(1-(7-фтор-2-(2-метилфениламино)-6-бензоксазолилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилата (710 мг, 0,80 ммоль) в ТГФ (40 мл) добавляют 0,25 н. NaOH (40 мл). Образовавшуюся смесь перемешивают при комнатной температуре в течение 16 часов. Реакционную смесь концентрируют при пониженном давлении. Концентрат подкисляют 1 н. HCl с последующей экстракцией смесью хлороформ/метанол (10/1). Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Из остатка два диастереомера выделяют и очищают ВЭЖХ (С18, 30×300 мм, 0,02 М буфер ацетат натрия/ацетонитрил (1/1), 20 мл/мин). Их фракции перегоняют при пониженном давлении для удаления растворителя. Остаток подкисляют 1 н. HCl с последующей экстракцией смесью хлороформ/метанол (10/1). Экстракты промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя, в результате чего указанное в заголовке соединение (изомер А) (68 мг, 16% (2 стадии)) получают в виде бесцветного твердого вещества, тогда как указанное в заголовке соединение (изомер В) (206 мг, 49% (2 стадии), включающий 5% изомера А) получают в виде бесцветного твердого вещества.
Изомер A: ИК (ATR) 2937, 2864, 2330, 1637, 1579 см-1;
1H-ЯМР (ДМСО-d6) δ: 0,86 (т, J=5,4 Гц, 1H), 1,17-1,40 (м, 5H), 1,85-2,22 (м, 6H), 2,30 (с, 3H), 3,19 (т, J=8,3 Гц, 1H), 3,38-4,37 (м, 6H), 5,25-5,47 (м, 1H), 6,99-7,13 (м, 3H), 7,25 (д, J=6,8 Гц, 2H), 7,80 (д, J=8,6 Гц, 1H), 9,87 (ушир., 1H), 12,05 (ушир., 1H).
МС (ESI), m/z 528 (M++1).
Изомер B:
ИК (ATR) 2939, 2870, 1722, 1699, 1639, 1579, 1454 см-1;
1H-ЯМР (ДМСО-d6) δ: 0,86 (с, 1H), 1,18 (с, 1H), 1,24 (с, 1H), 1,40-1,82 (м, 6H), 1,91 и 1,99 (каждый с, общий 1H, амидные изомеры), 2,10-2,29 (м, 2H), 2,37 (с, 3H), 3,17 (т, J=7,6 Гц, 1H), 3,44-4,50 (м, 6H), 5,33 и 5,41 (каждый д, J=54,8 и 53,6 Гц соответственно, общий 1H, амидные изомеры), 7,04 (м, 1H), 7,11 (с, 2H), 7,25 (с, 3H), 7,80 (д, J=7,3 Гц, 1H), 9,88 (ушир., 1H), 12,01 (ушир., 1H).
МС (ESI), m/z 528 (M++1).
Пример 27
4-((2S,4S)-4-Фтор-1-(2-(2-метилфениламино)-6-бензоксазолилацетил)-2-пирролидинилметокси)-н-масляная кислота:
(Стадия 1) Синтез метил-4-((2S,4S)-4-Фтор-1-(2-(2-метилфениламино)-6-бензоксазолилацетил)-2-пирролидинилметокси)-н-бутирата
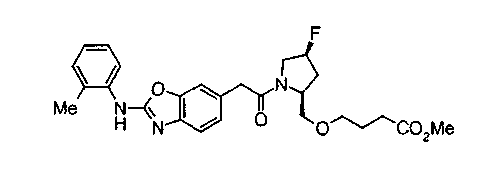
В ДМФ (4 мл) 2-(2-метилфениламино)-6-бензоксазолил-N-уксусную кислоту (282 мг, 1,0 ммоль), метил-4-((4S)-фтор-(2S)-пирролидинилметокси)-н-бутират (219 мг, 1,0 ммоль, EDC·HCl (288 мг, 1,5 ммоль), HOBt (203 мг, 1,5 ммоль) и триэтиламин (5,0 мл, 0,70 ммоль) перемешивают при комнатной температуре в течение 23 часов. Реакционную смесь выливают в ледяную воду с последующей экстракцией этилацетатом. Экстракт промывают ледяной водой и насыщенным раствором соли. Органический слой сушат над безводным сульфатом натрия и затем перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем (силикагель: 50 г, хлороформ/ацетон (10/1)) с последующим дальнейшим разделением и очисткой тонкослойной колоночной хроматографией (ТСХ) на силикагеле (хлороформ/ацетон (10/1)), посредством чего указанное в заголовке соединение (378 мг, 78%) получают в виде желтого масла.
1H-ЯМР (CDCl3) δ: 1,22 (т, J=6,9 Гц, 2H), 1,88-2,30 (м, 3H), 2,35 (с, 3H), 2,37-2,45 (м, 3H), 3,28-4,00 (м, 9H), 4,12-4,48 (м, 1H), 7,07 (м, 2H), 7,22 (д, J=7,3 Гц, 1H), 7,29-7,32 (м, 3H), 7,38 (дд, J=8,1,4-9 Гц, 1H), 8,05 (д, J=8,1 Гц, 1H).
МС (ESI) m/z 484 (M++1).
(Стадия 2) Синтез 4-((2S,4S)-4-Фтор-1-(2-(2-метилфениламино)-6-бензоксазолилацетил)-2-пирролидинилметокси)-н-масляной кислоты
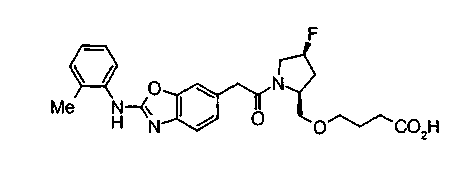
Метил-4-((2S,4S)-4-Фтор-1-(2-(2-метилфениламино)-6-бензоксазолилацетил)-2-пирролидинилметокси)-н-бутират (378 мг, 0,782 ммоль) растворяют в ТГФ (20 мл). К образовавшемуся раствору добавляют 0,25 н. NaOH (20 мл) и смесь перемешивают при 50°С в течение 18 часов. Реакционную смесь концентрируют при пониженном давлении. Остаток подкисляют 1 н. HCl с последующей экстракцией смесью хлороформ/метанол (10/1). Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток затем очищают тонкослойной колоночной хроматографией (ТСХ) на силикагеле, посредством чего из элюатных фракций смеси хлороформ/метанол (10/1) 4-((2S,4S)-4-Фтор-1-(2-(2-метилфениламино)-6-бензоксазолилацетил)-2-пирролидинилметокси)-н-масляную кислоту (99 мг, 27%) получают в виде желтого масла. К образовавшейся 4-((2S,4S)-4-Фтор-1-(2-(2-метилфениламино)-6-бензоксазолилацетил)-2-пирролидинилметокси)-н-масляной кислоте (99 мг, 0,211 ммоль) добавляют этанол (3 мл) и 1 н. NaOH (211 мкл, 0,211 ммоль) при перемешивании для растворения первого в последнем. Образовавшийся раствор концентрируют досуха. Эфир добавляют для кристаллизации остатка, в результате чего 4-((2S,4S)-4-Фтор-1-(2-(2-метилфениламино)-6-бензоксазолилацетил)-2-пирролидинилметокси)-н-бутират натрия (81 мг) получают в виде твердого вещества.
Натриевая соль ИК (KBr) 3410, 3251, 2964, 2870, 1641, 1574, 1439 см-1;
1H-ЯМР (ДМСО-d6) δ: 1,68-2,30 (м, 5H), 2,24 (с, 3H), 2,42 (м, 2H), 3,30-4,00 (м, 7H), 4,26 и 4,40 (кв. и м, J=6,8 Гц соответственно, общий 1H, амидные изомеры), 5,21 (дд, J=53,6,3,9 Гц, 1H), 7,07 (д, J=6,6 Гц, 2H), 7,14-7,26 (м, 4H), 7,30 (д, J=7,6 Гц, 1H), 7,72 (м, 1H).
МС (ESI) m/z 470 (M++1);
Анал. Вычисл. для С25Н27FN3O5 (Na·3H2О: C, 55,04; H, 6,10; N, 7,70.
Найдено: C, 55,26; H, 5,95; N, 7,38.
Пример 28
5-((2S,4S)-4-Фтор-1-(2-(2-метилфениламино)-6-бензоксазолилацетил)-2-пирролидинил)метоксипентановая кислота:
(Стадия 1) Синтез метил-3-(1-трет-бутоксикарбонил-(4S)-фтор-(2S)-пирролидинилметокси)пропионата
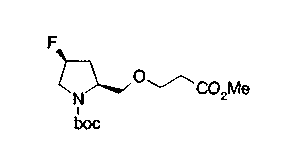
Гидрид натрия (60% в масле, 365 мг, 9,12 ммоль) суспендируют в ТГФ (20 мл). К образовавшейся суспензии при перемешивании при -50°С добавляют раствор (2S,4S)-1-(трет-бутоксикарбонил)-4-фтор-2-пролинола (1,00 г, 4,56 ммоль) в ТГФ (15 мл) и смесь перемешивают при такой же температуре в течение 5 минут. К реакционной смеси добавляют метилакрилат (0,95 мл, 10,5 ммоль) при такой же температуре. Реакционную смесь перемешивают в течение 15 минут при такой же температуре с последующим перемешиванием в течение дополнительных 14 часов при -40°С. Реакционную смесь подкисляют уксусной кислотой (1 мл). После добавления воды (20 мл) смесь экстрагируют этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем (силикагель: 50 г), посредством чего из элюатных фракций смеси гексан/этилацетат (2/1) указанное в заголовке соединение (670 мг, 48%) получают в виде бесцветного масла.
1H-ЯМР (CDCl3) δ: 1,47 (с, 9H), 1,98-2,15 (м, 1H), 2,36 (дд, J=20,5, 5,6 Гц, 1H), 2,58 (т, J=6,6 Гц, 1H), 3,35 (т, J=9,0 Гц, 1H), 3,48-3,80 (м, 7H), 3,94-4,17 (м, 1H), 5,19 (д, J=53,1 Гц, 1H).
МС (ESI) m/z 306 (M++1).
(Стадия 2) Синтез метил-3-((4S)-фтор-(2S)-пирролидинилметокси)пропионата
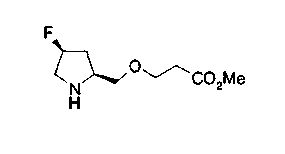
В метиленхлориде (20 мл) трифторуксусную кислоту (10 мл) добавляют к метил-3-(1-трет-бутоксикарбонил-(4S)-фтор-(2S)-пирролидинилметокси)пропионату (670 мг, 2,19 ммоль) и смесь перемешивают при комнатной температуре в течение 7 дней. Реакционную смесь концентрируют при пониженном давлении. При охлаждении льдом остаток подщелачивают 1 н. NaOH с последующей экстракцией метиленхлоридом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя, в результате чего указанное в заголовке соединение (480 мг, 100%) получают в виде желтого масла (это соединение применяют для следующей реакции без дополнительной очистки).
1H-ЯМР (CDCl3) δ: 1,79 (м, 1H), 2,02 (ушир., 1H), 2,04-2,21 (м, 1H), 2,60 (т, J=6,3 Гц, 2H), 2,90 (м, 1H), 3,31 (м, 1H), 3,49 (дд, J=9,5, 6,6 Гц, 1H), 3,56 (дд, J=9,5, 4,6 Гц, 1Н), 3,69 (с, 3H), 3,75 (дт, J=6,6, 2,2 Гц, 2H), 5,18 (дт, J=54,8, 3,7 Гц, 1H).
(Стадия 3) Синтез 3-((2S,4S)-1-(трет-бутоксикарбонил)-4-фтор-2-пирролидинилметокси)пропионовой кислоты
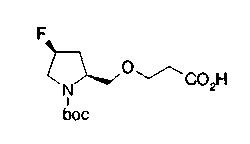
Метил-3-((2S,4S)-1-(трет-бутоксикарбонил)-4-фтор-2-пирролидинилметокси)пропионат (2,84 г, 9,30 ммоль) растворяют в ТГФ (40 мл). К образовавшемуся раствору добавляют 0,25 н. NaOH (40 мл) и смесь перемешивают при комнатной температуре в течение 19 часов. Растворитель отгоняют при пониженном давлении. После подкисления остатка 1 н. HCl проводят экстракцию этилацетатом. Экстракт промывают ледяной водой и насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя, в результате чего указанное в заголовке соединение (2,48 г, 92%) получают в виде бесцветного масла (это соединение применяют для следующей реакции без дополнительной очистки).
(Стадия 4) Синтез 3-((2S,4S)-1-(трет-бутоксикарбонил)-4-фтор-2-пирролидинилметокси)пропанола

В ТГФ (100 мл) растворяют 3-((2S,4S)-1-(трет-бутоксикарбонил)-4-фтор-2-пирролидинилметокси)пропионовую кислоту (2,48 г, 8,51 ммоль). При комнатной температуре добавляют 10,0 М раствор комплекса боран-диметилсульфид (2,79 мл, 27,9 ммоль) и смесь перемешивают при комнатной температуре в течение 3,5 часа и затем при 60°С в течение 30 минут. После охлаждения до комнатной температуры реакционную смесь выливают в ледяную воду (100 мл) с последующей экстракцией этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем (силикагель: 50 г), посредством чего из элюатных фракций смеси хлороформ/метанол (20/1) указанное в заголовке соединение (2,84 г, 100%) получают в виде бесцветного масла.
1H-ЯМР (CDCl3) δ: 1,47 (с, 9H), 1,64-1,73 (м, 1H), 1,83 (ушир., 2H), 2,00-2,41 (м, 2H), 3,37 (т, J=9,1 Гц, 1H), 3,50-4,23 (м, 7H), 5,11 (д, J=53,1 Гц, 1H).
МС (ESI), m/z 278 (M++1).
(Стадия 5) Синтез 3-((2S,4S)-1-(трет-бутоксикарбонил)-4-фтор-2-пирролидинилметокси)пропиональдегида
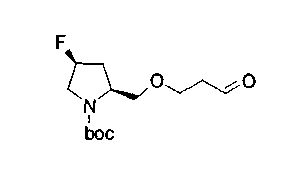
В метиленхлориде (43 мл) растворяют 3-((2S,4S)-1-(трет-бутоксикарбонил)-4-фтор-2-пирролидинилметокси)пропанол (2,84 г, 9,30 ммоль), триэтиламин (7,78 мл, 55,8 ммоль) и ДМСО (6,61 мл, 97,3 ммоль). К образовавшемуся раствору при перемешивании при 0°С по каплям добавляют комплекс пиридин-триоксид серы (4,44 г, 27,9 ммоль). После завершения добавления по каплям реакционную смесь перемешивают при комнатной температуре в течение 2 часов. К остатку, полученному отгонкой растворителя при пониженном давлении, добавляют воду (50 мл) с последующей экстракцией этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем (силикагель: 50 г), посредством чего из элюатных фракций смеси гексан/этилацетат (4:1) указанное в заголовке соединение (1,35 г, 53%) получают в виде бесцветного масла.
1H-ЯМР (CDCl3) δ: 1,47 (с, 9H), 1,95-2,16 (м, 1H), 2,34 (т, J=17,1 Гц, 1H), 2,65 (ушир., 2H), 3,36 (т, J=9,8 Гц, 1H), 3,46-4,19 (м, 6H), 5,20 (д, J=53,7 Гц, 1H), 9,79 (с, 1H).
МС (ESI), m/z 278 (M++1).
(Стадия 6) Синтез метил-(Е)-5-((2S,4S)-1-(трет-бутоксикарбонил)-4-фтор-2-пирролидинилметокси)-2-пентеноата
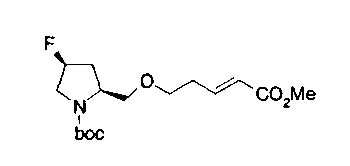
Триметилфосфоноацетат (0,95 мл, 5,88 ммоль) растворяют в ТГФ (40 мл). К образовавшемуся раствору при перемешивании при 0°С добавляют по частям в потоке газообразного азота гидрид натрия (60% в масле, 235 мг, 5,88 ммоль). После перемешивания реакционной смеси при такой же температуре в течение 10 минут по каплям при 0°С добавляют раствор 3-((2S,4S)-1-(трет-бутоксикарбонил)-4-фтор-2-пирролидинилметокси)пропиональдегида (1,35 г, 4,90 ммоль) в ТГФ (40 мл). Реакционную смесь далее перемешивают в течение 2 часов при 0°С и выливают в ледяную воду (50 мл) с последующей экстракцией этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем (силикагель: 50 г), посредством чего из элюатных фракций смеси хлороформ/ацетон (10/1) указанное в заголовке соединение (1,40 г, 86%) получают в виде бесцветного масла.
1H-ЯМР (CDCl3) δ: 1,47 (с, 9H), 2,02-2,221 (м, 1H), 2,30-2,58 (м, 3H), 3,34 (т, J=10,0 Гц, 1H), 3,45-3,71 (м, 7H), 3,73 (с, 3H), 5,21 (д, J=55,3 Гц, 1H), 5,89 (д, J=15,9 Гц, 1H), 6,95 (дт, J=15,9, 7,1 Гц, 1H).
(Стадия 7) Синтез метил-5-((2S,4S)-1-(трет-бутоксикарбонил)-4-фтор-2-пирролидинилметокси)-2-пентаноата

Метил-5-((2S,4S)-1-(трет-бутоксикарбонил)-4-фтор-2-пирролидинилметокси)-2-пентеноат (1,40 г, 4,22 ммоль) и катализатор 5% палладий/уголь (влажный) (700 мг) суспендируют в метаноле (50 мл). При перемешивании при комнатной температуре образовавшуюся суспензию подвергают каталитическому гидрированию при нормальном давлении в течение 20 часов. Катализатор отфильтровывают и фильтрат перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем (силикагель: 20 г), посредством чего из элюатных фракций смеси гексан/этилацетат (4/1) указанное в заголовке соединение (1,09 г, 78%) получают в виде бесцветного масла.
1H-ЯМР (CDCl3) δ: 1,47 (с, 9H), 1,61-1,74 (м, 3H), 1,98-2,18 (м, 2H), 2,31-2,42 (м, 3H), 3,31 (дт, J=7,9, 1,5 Гц, 1H), 3,40-3,66 (м, 4H), 3,67 (с, 3H), 3,73 (м, 1H), 4,09 (ушир., 1H), 5,20 (д, J=52,7 Гц, 1H).
(Стадия 8) Синтез метил-5-((2S,4S)-4-фтор-2-пирролидинилметокси)пентаноата
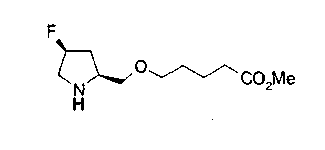
Метил-5-((2S,4S)-1-(трет-бутоксикарбонил)-4-фтор-2-пирролидинилметокси)пентаноат (1,09 г, 3,27 ммоль) растворяют в метиленхлориде (50 мл). К образовавшемуся раствору при комнатной температуре добавляют трифторуксусную кислоту (10 мл). Смесь перемешивают при такой же температуре в течение 3,5 часа. Остаток, полученный отгонкой растворителя при пониженном давлении, разбавляют метиленхлоридом (50 мл). Раствор подщелачивают 1 н. NaOH с последующей экстракцией метиленхлоридом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя, в результате чего указанное в заголовке соединение (590 мг, 77%) получают в виде желтого масла (это соединение применяют для следующей реакции без дополнительной очистки).
1H-ЯМР (CDCl3) δ: 1,59-1,96 (м, 5H), 2,15 (м, 1H), 2,34 (т, J=7,1 Гц, 2H), 2,86 (ддд, J=35,7, 13,2, 3,9 Гц, 1H), 3,27-3,35 (м, 2H), 3,42-3,53 (м, 4H), 3,67 (с, 3H), 5,18 (м, 1H).
МС (ESI), m/z 234 (M++1).
(Стадия 9) Синтез метил-5-((2S,4S)-4-Фтор-1-(2-(2-метилфениламино)-6-бензоксазолилацетил)-2-пирролидинилметокси)пентаноата
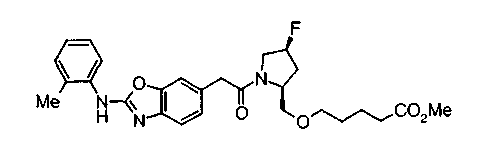
В ДМФ (5 мл) смесь 2-(2-метилфениламино)-6-бензоксазолилуксусной кислоты (357 мг, 1,26 ммоль), метил-5-((2S,4S)-4-Фтор-2-пирролидинилметокси)пентаноата (295 мг, 1,26 ммоль), EDC·HCl (362 мг, 1,89 ммоль), HOBt (255 мг, 1,89 ммоль) и триэтиламина (0,88 мл, 6,30 ммоль) перемешивают при комнатной температуре в течение 1 часа. Реакционную смесь выливают в ледяную воду (50 мл) с последующей экстракцией этилацетатом. Экстракт промывают ледяной водой и насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем (силикагель: 70 г), посредством чего из элюатных фракций смеси хлороформ/ацетон (10/1) указанное в заголовке соединение (1,05 г, 100%) получают в виде бесцветного масла.
1H-ЯМР (CDCl3) δ: 1,55-1,72 (м, 4H), 1,98-2,34 (м, 2H), 2,36 (с, 3H), 2,37-2,51 (м, 1H), 3,29-3,59 (м, 3H), 3,65 (с, 3Н), 3,66-4,01 (м, 6H), 4,23-4,46 (м, 1H), 5,13-5,33 (м, 1H), 7,06 (т, J=7,1 Гц, 2H), 7,21 (д, J=7,3 Гц, 1H), 7,24-7,35 (м, 4H), 7,96 (м, 3H).
МС (ESI), m/z 497 (M++1).
(Стадия 10) Синтез 5-((2S,4S)-4-Фтор-1-(2-(2-метилфениламино)-6-бензоксазолилацетил)-2-пирролидинилметокси)пентановой кислоты
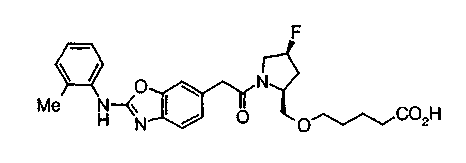
Метил-5-((2S,4S)-4-Фтор-1-((2-(2-метилфениламино)-6-бензоксазолилацетил)-2-пирролидинилметокси)пентаноат (1,26 ммоль) растворяют в ТГФ (40 мл). После добавления 0,25 н. NaOH (40 мл) смесь перемешивают при комнатной температуре в течение 14 часов. Реакционную смесь перегоняют при пониженном давлении для удаления растворителя. Остаток подкисляют 1 н. HCl с последующей экстракцией смесью хлороформ/метанол (10/1). Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя, в результате чего 5-((2S,4S)-4-Фтор-1-((2-(2-метилфениламино)-6-бензоксазолилацетил)-2-пирролидинилметокси)пентановую кислоту (390 мг, 60%) получают в виде коричневого масла. К 5-((2S,4S)-4-Фтор-1-(2-(2-метилфениламино)-6-бензоксазолилацетил)-2-пирролидинилметокси)пентановой кислоте (390 мг, 0,750 ммоль) добавляют этанол (10 мл) и 1 н. NaOH (0,750 мл, 0,750 ммоль). После перемешивания в течение 15 минут к остатку, который получают отгонкой растворителя при пониженном давлении, добавляют эфир для отверждения продукта, в результате чего получают 5-((2S,4S)-4-Фтор-1-((2-(2-метилфениламино)-6-бензоксазолилацетил)-2-пирролидинилметокси)пентаноат натрия (283 мг).
ИК (KBr) 3425, 3251, 2939, 2868, 1643, 1574, 1439 см-1;
1H-ЯМР (ДМСО-d6) δ: 1,01-1,30 (м, 3H), 1,45 (м, 4H), 1,86 (м, 2H), 2,03-2,23 (м, 2H), 2,28 (с, 3H), 3,15-4,43 (м, 6H), 5,23-5,41 (м, 1H), 6,99 (м, 2H), 7,19 (м, 5H), 7,85 (м, 1H).
МС (ESI), m/z 484 (M++1).
Пример 29
6-((2S,4S)-4-Фтор-1-(2-(2-метилфениламино)-6-бензоксазолилацетил)-2-пирролидинилметокси)гексаноат натрия:
(Стадия 1) Синтез (Z)-4-бензилокси-1-бром-2-бутена
К раствору (Z)-4-бензилокси-2-бутен-1-ола (2,0 г, 11,2 ммоль) в метиленхлориде (40 мл) добавляют тетрабромид углерода (4,46 г, 13,4 ммоль) и трифенилфосфин (3,51 г, 13,4 ммоль) при 0°С при перемешивании в потоке газообразного азота. После перемешивания при комнатной температуре в течение 1,5 часа реакционную смесь концентрируют при пониженном давлении. Остаток очищают хроматографией на колонке с силикагелем (силикагель: 50 г), посредством чего из элюатных фракций смеси гексан/этилацетат (4/1) указанное в заголовке соединение (2,76 г, 100%) получают в виде бесцветного масла.
1H-ЯМР (CDCl3) δ: 3,98 (д, J=8,3 Гц, 2H), 4,15 (д, J=6,1 Гц, 2H), 4,53 (с, 2H), 5,77 (м, 1H), 5,90 (м, 1H), 7,28-7,36 (м, 5H).
(Стадия 2) Синтез (Z)-(2S,4S)-2-(4-бензилокси-2-бутенилоксиметил)-1-(трет-бутоксикарбонил)-4-фторпирролидина
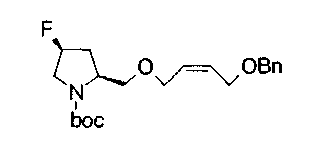
К раствору (2S,4S)-1-(трет-бутоксикарбонил)-4-фтор-2-пирролидинилметанола (2,46 г, 11,2 ммоль) в ТГФ (100 мл) при перемешивании при 0°С в потоке газообразного азота по порциям добавляют гидрид натрия (60% в масле; 896 мг, 22,4 ммоль). После перемешивания при такой же температуре в течение 20 минут добавляют (Z)-4-бензилокси-1-бром-2-бутен (2,76 г, 11,2 ммоль) в ТГФ (100 мл). Реакционную смесь перемешивают в течение 5 минут. К реакционной смеси добавляют иодид тетра-н-бутиламмония (100 мг, 0,27 ммоль) при 0°С и смесь перемешивают в течение 15 минут. Реакционную смесь перемешивают далее при комнатной температуре в течение 19 часов. При перемешивании реакционной смеси при охлаждении льдом добавляют воду (50 мл) с последующей экстракцией этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем (силикагель: 120 г), посредством чего из элюатных фракций смеси гексан/этилацетат (4/1) указанное в заголовке соединение (3,30 г, 78%) получают в виде бесцветного масла.
1H-ЯМР (CDCl3) δ: 1,47 (с, 9H), 1,98-2,25 (м, 1H), 2,39 (дд, J=20,6, 14,9 Гц, 1H), 3,31 (т, J=9,3 Гц, 1H), 3,48-3,81 (м, 3H), 3,95-4,18 (м, 5H), 4,51 (с, 2H), 5,20 (м, 1H), 5,70-5,84 (м, 2H), 7,27-7,53 (м, 5H).
МС (ESI) m/z 380 (M++1).
(Стадия 3) Синтез 4-((2S,4S)-1-(трет-бутоксикарбонил)-4-фтор-2-пирролидинилметокси)-1-бутанола
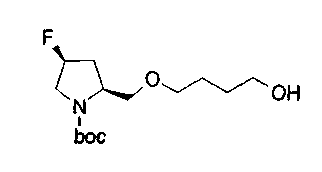
В этаноле (200 мл) суспендируют (Z)-(2S,4S)-2-(4-бензилокси-2-бутенилоксиметил)-1-(трет-бутоксикарбонил)-4-фторпирролидин (4,58 г, 12,1 ммоль) и 20% гидроксид палладия (4,0 г). Образовавшуюся суспензию подвергают каталитическому гидрированию при комнатной температуре при нормальном давлении в течение 14 часов. Катализатор затем отфильтровывают и фильтрат перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем (силикагель: 100 г), посредством чего из элюатных фракций смеси хлороформ/ацетон (10/1) указанное в заголовке соединение (2,42 г, 67%) получают в виде бесцветного масла.
1H-ЯМР (CDCl3) δ: 1,47 (с, 9H), 1,6 (с, 2H), 1,98-2,23 (м, 2H), 2,38 (м, 1H), 3,36 (дт, J=10,5, 1,7 Гц, 1H), 3,52-3,82 (м, 8H), 4,01 и 4,13 (каждый ушир., общий 1H, амидные изомеры), 5,21 (д, J=53,3 Гц, 1H).
(Стадия 4) Синтез 4-((2S,4S)-1-(трет-бутоксикарбонил)-4-фтор-2-пирролидинилметокси)бутилальдегида
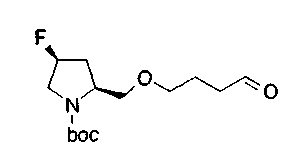
В метиленхлориде (40 мл) растворяют 4-((2S,4S)-1-(трет-бутоксикарбонил)-4-фтор-2-пирролидинилметокси)-1-бутанол (2,42 г, 8,31 ммоль), триэтиламин (6,95 мл, 49,9 ммоль) и ДМСО (5,90 мл, 83,1 ммоль). При перемешивании при 0°С добавляют комплекс пиридин-триоксид серы (3,97 г, 24,9 ммоль). Образовавшуюся смесь перемешивают в течение 4 часов. Реакционную смесь перегоняют при пониженном давлении для удаления растворителя. К остатку добавляют воду (50 мл) с последующей экстракцией этилацетатом. Экстракт промывают 1 н. HCl и насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем (силикагель: 30 г), посредством чего из элюатных фракций смеси гексан/этилацетат (2/1) указанное в заголовке соединение (1,72 г, 72%) получают в виде бесцветного масла.
1H-ЯМР (CDCl3) δ: 1,47 (с, 9H), 1,91 (т, J=6,6 Гц, 2H), 1,96-2,17 (м, 1H), 2,36 (т, J=15,4 Гц, 1H), 2,52 (т, J=7,1 Гц, 2H), 3,32 (т, J=9,8 Гц, 1H), 3,49-4,14 (м, 5H), 5,20 (д, J=53,5 Гц, 1H), 9,77 (с, 1H).
(Стадия 5) Синтез метил-(Е)-6-((2S,4S)-1-(трет-бутоксикарбонил)-4-фтор-2-пирролидинилметокси)-2-гексеноата
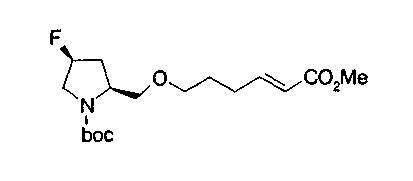
Триметилфосфоноацетат (1,15 мл, 7,13 ммоль) растворяют в ТГФ (50 мл). К образовавшемуся раствору в потоке газообразного азота добавляют по частям при перемешивании при 0°С гидрид натрия (60% в масле, 285 мг, 7,13 ммоль). После перемешивания при такой же температуре в течение 20 минут по каплям добавляют раствор 4-((2S,4S)-1-(трет-бутоксикарбонил)-4-фтор-2-пирролидинилметокси)бутилальдегида (1,72 г, 5,94 ммоль) в ТГФ (20 мл). После завершения добавления реакционную смесь далее перемешивают при такой же температуре в течение 2,5 часа. Реакционную смесь выливают в ледяную воду (50 мл) с последующей экстракцией этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем (силикагель: 100 г), посредством чего из элюатных фракций смеси гексан/этилацетат (4/1) указанное в заголовке соединение (1,90 г, 93%) получают в виде бесцветного масла.
1H-ЯМР (CDCl3) δ: 1,47 (с, 9H), 1,73 (ушир., 1H), 1,99-2,51 (м, 4H), 3,32 (дт, J=10,0,1,7 Гц, 1H), 3,41-3,71 (м, 6H), 3,73 (с, 3H), 3,97-4,20 (м, 1H), 5,21 (д, J=53,1 Гц, 1H), 5,83 (д, J=15,4 Гц, 1H), 6,97 (дт, J=15,4, 6,8 Гц, 1H).
(Стадия 6) Синтез метил-6-((2S,4S)-1-(трет-бутоксикарбонил)-4-фтор-2-пирролидинилметокси)гексеноата
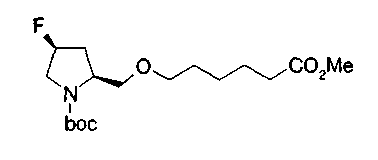
Метил-(Е)-((2S,4S)-1-(трет-бутоксикарбонил)-4-фтор-2-пирролидинилметокси)-2-гексеноат (1,90 г, 5,50 ммоль) и катализатор 5% палладий/уголь (1,0 г) суспендируют в метаноле (80 мл). Образовавшуюся суспензию подвергают каталитическому гидрированию при нормальной давлении в течение 19 часов при перемешивании при комнатной температуре. Катализатор отфильтровывают и фильтрат перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем (силикагель: 3 г), посредством чего из элюатных фракций этилацетата указанное в заголовке соединение (1,92 г, 100%) получают в виде бесцветного масла.
1H-ЯМР (CDCl3) δ: 1,38 (кв., J=6,6 Гц, 2H), 1,48 (с, 9H), 1,57-1,70 (м, 4H), 1,98-2,18 (м, 1H), 2,31 (т, J=7,3 Гц, 3H), 2,39 (дд, J=20,7, 15,1 Гц, 1H), 3,31 (т, J=8,8 Гц, 1H), 3,41-3,60 (м, 3H), 3,67 (с, 3H), 3,68-4,18 (м, 2H), 5,20 (д, J=53,0 Гц, 1H).
(Стадия 7) Синтез метил-6-(2S,4S)-4-фтор-2-пирролидинилметокси)-2-гексаноата
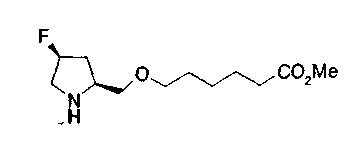
Метил-6-(2S,4S)-1-(трет-бутоксикарбонил)-4-фтор-2-пирролидинилметокси)гексаноат (1,92 г, 5,50 ммоль) растворяют в метиленхлориде (100 мл). При комнатной температуре добавляют трифторуксусную кислоту (10 мл) и смесь перемешивают в течение 1 часа. Реакционную смесь перегоняют при пониженном давлении для удаления растворителя. Остаток подщелачивают 1 н. NaOH с последующей экстракцией метиленхлоридом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя, в результате чего указанное в заголовке соединение (1,15 мг, 85%) получают в виде светло-желтого масла (это соединения используют для следующей реакции без дальнейшей очистки).
1H-ЯМР (CDCl3) δ: 1,38-1,70 (м, 6H), 2,21-2,30 (м, 1H), 2,34 (т, J=6,8 Гц, 2H), 2,46-2,61 (м, 1H), 3,50-3,74 (м, 9H), 4,15 (м, 1H), 5,30-5,45 (м, 1H).
МС (ESI), m/z 248 (M++1).
(Стадия 8) Синтез метил-6-((2S,4S)-4-фтор-1-(2-(2-метилфениламино)-6-бензоксазолилацетил)-2-пирролидинилметокси)гексаноата
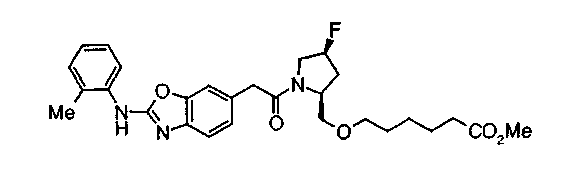
В ДМФ (10 мл) 2-(2-метилфениламино)-6-бензоксазолилуксусную кислоту (282 мг, 1,00 ммоль), 6-((2S,4S)-4-фтор-2-пирролидинилметокси)гексаноат (247 мг, 1,00 ммоль), EDC·HCl (288 мг, 1,50 ммоль), HOBt (203 мг, 1,50 ммоль) и триэтиламин (0,70 мл, 5,00 ммоль) перемешивают при комнатной температуре в течение 22 часов. Реакционную смесь выливают в ледяную воду (50 мл) с последующей экстракцией этилацетатом. Экстракт промывают ледяной водой и насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Полученный таким образом остаток очищают тонкослойной хроматографией на силикагеле с последующим разделением с использованием смеси хлороформ/ацетон (10/1), в результате чего указанное в заголовке соединение (330 мг, 65%) получают в виде желтого масла.
1H-ЯМР (CDCl3) δ: 1,35-1,47 (м, 2H), 1,53-1,74 (м, 4H), 1,90-2,32 (м, 4H), 2,35 (с, 3H), 3,29-3,50 (м, 3H), 3,57-4,48 (м, 9H), 5,12-5,29 (м, 1H), 7,07 (дт, J=8,3, 1,2 Гц, 2H), 7,21 (д, J=7,3 Гц, 1H), 7,29 (д, J=8,3 Гц, 2H), 7,36 (дд, J=7,8,3,4 Гц, 2H), 8,01 (т, J=7,1 Гц, 1H).
МС (ESI), m/z 512 (M++1).
(Стадия 9) Синтез 6-((2S,4S)-4-фтор-1-(2-(2-метилфениламино)-6-бензоксазолилацетил)-2-пирролидинилметокси)гексаноата натрия
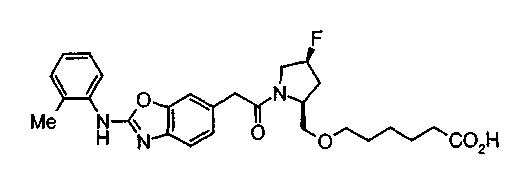
Метил-6-((2S,4S)-4-фтор-1-(2-(2-метилфениламино)-6-бензоксазолилацетил)-2-пирролидинилметокси)гексаноат (330 мг, 0,645 ммоль) растворяют в ТГФ (30 мл). При комнатной температуре добавляют 0,25 н. NaOH (30 мл) и смесь перемешивают в течение 24 часов. Реакционную смесь перегоняют при пониженном давлении для удаления растворителя. Остаток подкисляют 1 н. HCl с последующей экстракцией смесью хлороформ/метанол (10/1). Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают тонкослойной хроматографией на силикагеле с последующим разделением посредством использования смеси хлороформ/метанол (20/1), в результате чего указанное в заголовке соединение (238 мг, 74%) получают в виде желтого масла. К образовавшемуся производному карбоновой кислоты (238 мг, 0,478 ммоль) добавляют этанол (10 мл) и 1 н. NaOH (0,478 мл, 0,478 ммоль). После перемешивания в течение 10 минут для кристаллизации остатка, который получают отгонкой растворителя при пониженном давлении, добавляют эфир, в результате чего получают 6-((2S,4S)-4-фтор-1-(2-(2-метилфениламино)-6-бензоксазолилацетил)-2-пирролидинилметокси)гексаноат натрия (199 мг). ИК (KBr) 3423, 3211, 2937, 2864, 1681, 1643, 1574, 1485, 1574 см-1;
1H-ЯМР (ДМСО-d6) δ: 1,36-1,72 (м, 6H), 1,92-2,28 (м, 4H), 2,34 (с, 3H), 3,26-4,00 (м, 8H), 4,20-4,43 (м, 1H), 5,21 (дт, J=54,0, 4,6 Гц, 1H), 7,04-7,11 (м, 2H), 7,21-7,34 (м, 5H), 7,76 (т, J=7,3 Гц, 1H).
МС (ESI), m/z 498 (M++1);
Анал. Вычисл. для С27Н32FN3O5·1,0H2О: C, 60,21; H, 6,36; F, 3,53; N, 7,80.
Найдено: С, 60,11; H, 6,19; F, 3,28; N, 7,41.
Пример 30
4-((4S)-Фтор-1-(2-(2-метилфениламино)-6-бензоксазолилацетил)-(2S)-пирролидинилкарбонил)-1-пиперазинилуксусная кислота:
(Стадия 1) Синтез этил-4-((4S)-Фтор-1-(2-(2-метилфениламино)-6-бензоксазолилацетил)-(2S)-пирролидинилкарбонил)-1-пиперазинилацетата
Этил-4-((4S)-фтор-(2S)-пирролидинилкарбонил)-1-пиразинилацетат (300 мг, 1,04 ммоль) растворяют в ДМФ (10 мл). При комнатной температуре к образовавшемуся раствору последовательно добавляют 2-(2-метилфениламино)-6-бензоксазолилуксусную кислоту (294 мг, 1,04 ммоль), EDC·HCl (299 мг, 1,56 ммоль), DMAP (катал.) и HOBt (катал.). Смесь перемешивают в течение 15 часов. К реакционной смеси добавляют насыщенный раствор соли (100 мл) с последующей экстракцией этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Таким образом полученный остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси хлороформ-метанол (20:1) указанное в заголовке соединение (107 мг, 19%) получают в виде желтого масла.
(Стадия 2) Синтез 4-((4S)-фтор-1-(2-(2-метилфениламино)-6-бензоксазолилацетил)-(2S)-пирролидинилкарбонил)-1-пиперазинилуксусной кислоты

Этил-4-((4S)-фтор-1-(2-(2-метилфениламино)-6-бензоксазолилацетил)-(2S)-пирролидинилкарбонил)-1-пиперазинилацетат (107 мг, 0,194 ммоль) растворяют в ТГФ (4 мл). После добавления 0,25 н. NaOH (1,6 мл, 0,388 ммоль) смесь перемешивают при комнатной температуре в течение 15 часов. Реакционную смесь нейтрализуют 1 н. HCl и затем концентрируют при пониженном давлении. Остаток очищают с использованием ионообменной смолы (НР20) и элюируют водой и метанолом, в результате чего указанное в заголовке соединение (61 мг, 60%) получают в виде желтого аморфного вещества.
1H-ЯМР (ДМСО-d6) δ: 1,75-2,61 (ряд м, 9H, с, включая 3H при (2,30), 2,80-4,00 (ряд м, 10H), 4,82-6,02 (ряд м, 2H), 6,98-7,46 (ряд м, 6H), 7,82-7,94 (м, 1H).
МС (FAB) m/z, 524 (M++1).
Пример 31
1-((4S)-Фтор-1-(2-(2-метилфениламино)-6-бензоксазолилацетил)-(2S)-пирролидинилкарбонил)-4-пиперидинилуксусная кислота:
(Стадия 1) Синтез этил-4-пиперидинилацетата
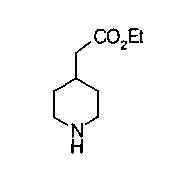
Этил-4-(1-(трет-бутоксикарбонил))пиперидинилацетат (2,93 г, 10,8 ммоль) растворяют в метиленхлориде (20 мл). После добавления трифторуксусной кислоты (8 мл) при 0°С смесь перемешивают при комнатной температуре в течение 3 часов. Остаток, который получают перегонкой реакционной смеси при пониженном давлении для удаления растворителя, нейтрализуют насыщенным водным раствором бикарбоната натрия с последующей экстракцией смесью хлороформ-метанол (5:1, об./об.). Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом магния и перегоняют при пониженном давлении для удаления растворителя, в результате чего этил-4-пиперидинилацетат (1,48 г, 80%) получают в виде белого твердого вещества.
1H-ЯМР (CDCl3) δ: 1,25 (т, J=7,2 Гц, 3H), 1,30 (м, 2H), 1,76 (д, J=13,2 Гц, 2H), 1,90 (м, 1H), 2,24 (д, J=7,2 Гц, 2H), 2,63 (дт, J=1,6,13,1 Гц, 1H), 2,85 (ушир., 1H), 3,16 (д, J=12,4 Гц, 2H), 4,13 (кв., J=7,5 Гц, 2H).
(Стадия 2) Синтез этил-1-(1-(трет-бутоксикарбонил)-(4S)-фтор-(2S)-пирролидинилкарбонил)-4-пиперидинилацетата
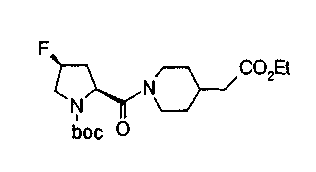
Этил-4-пиперидинилацетат (1,48 г, 8,64 ммоль) и 1-(трет-бутоксикарбонил)-(4S)-фтор-(2S)-пирролидинкарбоновую кислоту (2,02 мг, 8,66 ммоль) растворяют в ДМФ (30 мл). К образовавшемуся раствору добавляют EDC·HCl (2,49 г, 2,61 ммоль), HOBt и DMAP и смесь перемешивают на протяжении ночи при комнатной температуре. К реакционной смеси добавляют воду (50 мл) с последующей экстракцией этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси хлороформ-метанол (15:1, об./об.) этил-1-(1-(трет-бутоксикарбонил)-(4S)-фтор-(2S)-пирролидинилкарбонил)-4-пиперидинилацетат (1,05 г, 32%) получают в виде коричневого масла.
1H-ЯМР (CDCl3) δ: 1,17 (дт, J=4,0,12,O Гц, 1H), 1,26 (т, J=7,2 Гц, 3H), 1,47 (с, 9H), 1,70 (с, 2H), 1,75 (м, 2H), 2,03 (м, 1H), 2,20 (ушир., 1H), 2,24 (дд, J=4,4, 7,2 Гц, 2H), 2,43 (м, 1H), 2,57 (м, 1H), 3,02 (м, 1H), 3,77 (м, 2H), 4,14 (кв., J=7,2 Гц, 2H), 4,60 (д, J=9,6 Гц, 1H), 5,20 (д, J=53,9 Гц, 1H).
(Стадия 3) Синтез этил-1-((4S)-фтор-(2S)-пирролидинилкарбонил)-4-пиперидинилацетата

Этил-1-(1-(трет-бутоксикарбонил)-(4S)-фтор-(2S)-пирролидинилкарбонил)-4-пиперидинилацетат (1,05 г, 2,74 ммоль) растворяют в метиленхлориде (10 мл). После добавления трифторуксусной кислоты (4 мл) к образовавшемуся раствору при 0°С реакционную смесь перемешивают при 50°С в течение 3 часов. Реакционную смесь перегоняют при пониженном давлении для удаления растворителя. Остаток нейтрализуют насыщенным водным раствором бикарбоната натрия с последующей экстракцией смесью хлороформ-метанол (5:1, об./об.). Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя, в результате чего этил-1-((4S)-фтор-(2S)-пирролидинилкарбонил)-4-пиперидинилацетат (768 мг, 100%) получают в виде желтого масла.
1H-ЯМР (CDCl3) δ: 1,17 (дт, J=4,0, 12,0 Гц, 1H), 1,26 (т, J=7,2 Гц, 3Н), 1,79 (м, 2H), 2,02 (м, 3Н), 2,24 (м, 2H), 2,38 (м, 1H), 2,66 (ряд м, общий 1H), 2,78 (ддд, J=2,8, 13,6, 37,5 Гц, 1H), 3,03 (ддд, J=2,4, 13,6, 18,8 Гц, 1H), 3,77 (м, 1H), 3,90 (м, 1H), 4,14 (кв., J=7,2 Гц, 2H), 4,61 (ушир., 1H), 5,17 (д, J=53,9 Гц, 1H).
(Стадия 4) Синтез этил-1-((4S)-Фтор-1-(2-(2-метилфениламино)-6-бензоксазолилацетил)-(2S)-пирролидинилкарбонил)-4-пиперидинилацетата
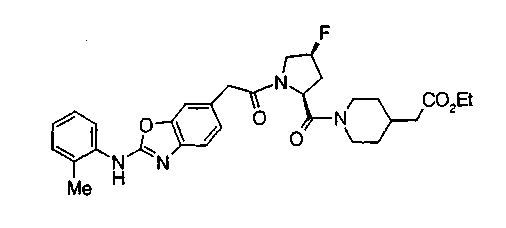
В ДМФ (9 мл) растворяют 2-(2-метилфениламино)-6-бензоксазолилуксусную кислоту (350 мг, 1,24 ммоль) и этил-1-((4S)-фтор-(2S)-пирролидинилкарбонил)-4-пиперидинилацетат (357 мг, 1,24 ммоль). К образовавшемуся раствору добавляют EDC·HCl (356 мг, 1,86 ммоль), HOBt и DMAP. Смесь перемешивают на протяжении ночи при комнатной температуре. К реакционной смеси добавляют воду (30 мл) с последующей экстракцией этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси хлороформ-метанол (10:1, об./об.) этил-1-((4S)-Фтор-1-(2-(2-метилфениламино)-6-бензоксазолилацетил)-(2S)-пирролидинилкарбонил)-4-пиперидинилацетат (525 мг, 77%) получают в виде коричневого масла.
ИК (ATR) 1726, 1637, 1573, 1440 см-1;
1H-ЯМР (CDCl3) δ: 1,15 (дт, J=4,0,12,O Гц, 1H), 1,26 (м, 3H), 1,78 (м, 2H), 2,03 (м, 1H), 2,29 (м, 3H), 2,35 (с, 3H), 2,44 (ушир., 1H), 2,56 (м, 1H), 3,02 (м, 1H), 3,79 (ряд м, общий 3H), 3,95 (м, 1H), 4,14 (м, 2H), 4,60 (м, 1), 5,01 (м, 1H), 5,25 (ряд д, J=53,5 Гц, общий 1H), 6,88 (ушир., 1H), 7,06 (д, J=8,0 Гц, 1H), 7,11 (д, J=8,0 Гц, 1H), 7,22 (д, J=8,0 Гц, 1H), 7,30 (т, J=8,0 Гц, 2H), 7,39 (м, 2H), 8,08 (д, J=8,0 Гц, 1H).
МС (ESI) m/z 551 (M+H)+.
(Стадия 5) Синтез 1-((4S)-Фтор-1-(2-(2-метилфениламино)-6-бензоксазолилацетил)-(2S)-пирролидинилкарбонил)-4-пиперидинилуксусной кислоты
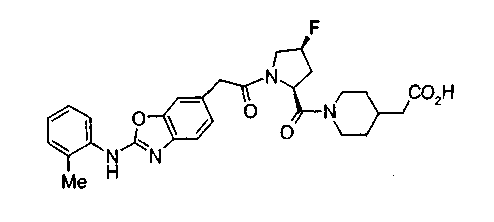
Этил-1-((4S)-Фтор-1-(2-(2-метилфениламино)-6-бензоксазолилацетил)-(2S)-пирролидинилкарбонил)-4-пиперидинилацетат (550 мг, 0,95 ммоль) растворяют в ТГФ (6 мл). К образовавшемуся раствору добавляют 0,25 н. NaOH (2 экв.) и смесь перемешивают на протяжении ночи при комнатной температуре. К реакционной смеси добавляют воду (30 мл) с последующей экстракцией смесью хлороформ-метанол (5:1, об./об.). Экстракт промывают 1 н. HCl, сушат над безводным сульфатом магния и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси хлороформ-метанол (20:1, об./об.) 1-((4S)-Фтор-1-(2-(2-метилфениламино)-6-бензоксазолилацетил)-(2S)-пирролидинилкарбонил)-4-пиперидинилуксусную кислоту (258 мг 52%) получают в виде белого кристаллического порошка.
ИК (ATR) 1712, 1639, 1573 см-1;
1H-ЯМР (CDCl3) δ: 1,26 (м, 2H), 1,80 (м, 2H), 2,04 (м, 1H), 2,29 (м, 3H), 2,35 (с, 3H), 2,44 (ушир., 1H), 2,61 (м, 1H), 3,06 (м, 1H), 3,77 (м, общий 3H), 3,92 (м, 1H), 4,59 (ушир., 1H), 5,02 (т, J=8,0 Гц, 1H), 5,24 (м, 1H), 7,10 (м, 2H), 7,22 (д, J=7,6 Гц, 2H), 7,29 (м, 2H), 7,33 (м, 2H), 7,88 (д, J=8,8 Гц, 1H).
МС (ESI) m/z 523 (M+H)+.
Пример 32
цис-4-((4S)-Фтор-1-(2-(2-метилфениламино)-6-бензоксазолилацетил)-(2S)-пирролидинилкарбониламино)-циклогексанкарбоновая кислота:
(Стадия 1) Синтез метил-цис-4-(1-(трет-бутоксикарбонил)-(4S)-фтор-(2S)-пирролидинилкарбониламино)циклогексанкарбоксилата

В смеси ацетонитрил-вода (1:1, об./об., 60 мл) растворяют цис-4-аминоциклогексанкарбоновую кислоту (1,32 г, 9,22 ммоль). К образовавшемуся раствору добавляют ди-трет-бутилдикарбонат (2,05 г, 9,39 ммоль) и триэтиламин (2,39 мл, 9,07 ммоль) и смесь перемешивают при комнатной температуре в течение 4 часов. Реакционную смесь концентрируют при пониженном давлении. Остаток подкисляют 1 н. HCl с последующей экстракцией смесью хлороформ-метанол (5:1, об./об.). Экстракт сушат над безводным сульфатом магния и перегоняют при пониженном давлении для удаления растворителя, в результате чего цис-4-((трет-бутоксикарбонил)амино)циклогексанкарбоновую кислоту (2,30 г, 97%) получают в виде белого кристаллического порошка. цис-4-((трет-Бутоксикарбонил)амино)циклогексанкарбоновую кислоту (2,30 г, 8,94 ммоль) растворяют в смеси метанол-бензол (5:1, об./об., 100 мл). К образовавшемуся раствору при перемешивании при комнатной температуре добавляют по каплям триметилсилилдиазометан (2 М раствор в гексане, 9 мл). После завершения добавления реакционную смесь перемешивают при комнатной температуре в течение 1 часа. Остаток, который получают перегонкой реакционной смеси при пониженном давлении для удаления растворителя, очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси гексан-этилацетат (3:1, об./об.) метил-цис-4-((трет-бутоксикарбонил)амино)циклогексанкарбоксилат (2,30 г, 100%) получают в виде бесцветного масла. Образовавшийся метил-цис-4-((трет-бутоксикарбонил)амино)циклогексанкарбоксилат (2,30 г, 8,93 ммоль) растворяют в метиленхлориде (18 мл). После добавления трифторуксусной кислоты (7 мл) к образовавшемуся раствору при 0°С реакционную смесь перемешивают при комнатной температуре в течение 1,5 часа. Остаток, который получают перегонкой реакционной смеси при пониженном давлении для удаления растворителя, нейтрализуют насыщенным водным раствором бикарбоната натрия с последующей экстракцией смесью хлороформ-метанол (5:1, об./об.). Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом магния и перегоняют при пониженном давлении для удаления растворителя, в результате чего метил-цис-4-аминоциклогексанкарбоксилат (1,39 г, 99%) получают в виде бесцветного масла. Образовавшийся метил-цис-4-аминоциклогексанкарбоксилат (1,39 г, 8,87 ммоль) и 1-(трет-бутоксикарбонил)-(4S)-фтор-(2S)-пирролидинкарбоновую кислоту (2,07 г, 8,87 ммоль) растворяют в ДМФ (40 мл). К образовавшемуся раствору добавляют EDC·HCl (2,56 г, 13,3 ммоль), HOBt (5,0 мг, 0,04 ммоль) и DMAP (5,0 мг, 0,04 ммоль) и смесь перемешивают на протяжении ночи при комнатной температуре. Насыщенный раствор соли выливают в реакционную смесь с последующей экстракцией этилацетатом. Экстракт сушат над безводным сульфатом магния и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси хлороформ-метанол (20:1, об./об.) метил-цис-4-(1-(трет-бутоксикарбонил)-(4S)-фтор-(2S)-пирролидинилкарбониламино)циклогексанкарбоксилат (2,96 г, 90%) получают в виде светло-желтого твердого вещества.
1H-ЯМР (CDCl3) δ: 1,47 (с, 9H), 1,56 (ушир., 2H), 1,72 (ушир., 4H), 1,88 (ушир., 2H), 2,27 (ушир., 1H), 2,49 (ушир., 2H), 2,56 (м, 1H), 3,68 (с, 3H), 3,78 (ушир., 1H), 3,95 (ушир., 1H), 5,13 (д, J=51,6 Гц, 1H), 7,72 (ушир., 1H).
(Стадия 2) Синтез метил-цис-4-((4S)-фтор-(2S)-пирролидинилкарбониламино)циклогексанкарбоксилата
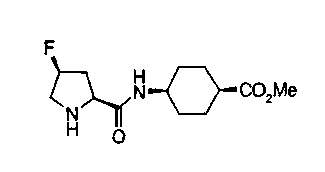
Метил-цис-4-(1-(трет-бутоксикарбонил)-(4S)-фтор-(2S)-пирролидинилкарбониламино)циклогексанкарбоксилат (440 мг, 1,18 ммоль) растворяют в метиленхлориде (7 мл). К образовавшемуся раствору добавляют трифторуксусную кислоту (3 мл) при 0°С.Реакционную смесь затем перемешивают при комнатной температуре в течение 2 часов. Из реакционной смеси растворитель отгоняют при пониженном давлении. Остаток нейтрализуют насыщенным водным раствором бикарбоната натрия с последующей экстракцией смесью хлороформ-метанол (5:1, об./об.). Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом магния и перегоняют при пониженном давлении для удаления растворителя, в результате чего метил-цис-4-((4S)-фтор-(2S)-пирролидинилкарбониламино)циклогексанкарбоксилат (270 мг, 84%) получают в виде бесцветного масла.
1H-ЯМР (CDCl3) δ: 1,58 (м, 2H), 1,71 (м, 4H), 1,86 (м, 2H), 2,28 (м, 2H), 2,47 (м, 2H), 2,63 (ряд дд, J=3,6, 35,5 Гц, общий 1H), 3,31 (ряд д, J=35,5 Гц, общий 1H), 3,69 (с, 3H), 3,81 (дд, J=2,8, 10,4 Гц, 1H), 3,90 (ушир., 1H), 5,16 (д, J=53,1 Гц, 1H), 7,72 (ушир., 1H).
(Стадия 3) Синтез метил-цис-4-((4S)-фтор-1-(2-(2-метилфениламино)-6-бензоксазолилацетил)-(2S)-пирролидинилкарбониламино)циклогексанкарбоксилата
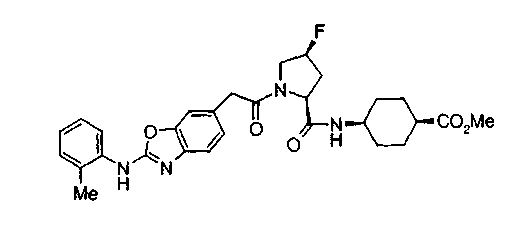
В ДМФ (5 мл) растворяют 2-(2-метилфениламино)-6-бензоксазолилуксусную кислоту (147 мг, 0,52 ммоль) и метил-цис-4-((4S)-фтор-(2S)-пирролидинилкарбониламино)циклогексанкарбоксилат (142 мг, 0,52 ммоль). К образовавшемуся раствору добавляют EDC·HCl (151 мг, 0,78 ммоль), HOBt (5,0 мг, 0,04 ммоль) и DMAP (5,0 мг, 0,04 ммоль). Смесь перемешивают на протяжении ночи при комнатной температуре. После разбавления этилацетатом (50 мл) смесь промывают насыщенным раствором соли, сушат над безводным сульфатом магния и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси хлороформ-метанол (10:1, об./об.) метил-цис-4-((4S)-фтор-1-(2-(2-метилфениламино)-6-бензоксазолилацетил)-(2S)-пирролидинилкарбониламино)циклогексанкарбоксилат (299 мг, 100%) получают в виде коричневого масла.
ИК (ATR) 1726, 1637, 1531, 1437 см-1;
1H-ЯМР (CDCl3) δ: 1,46 (м, 2H), 1,63 (м, 3H), 1,78 (м, 3H), 1,78 (м, 1H), 1,90 (м, 2H), 2,39 (с, 3H), 2,49 (м, 1H), 2,9 (ряд м, общий 2H), 3,70 (с, 3H), 3,76 (м, 1H), 3,82 (м, 1H), 5,21 (м, 1H), 7,08 (м, 2H), 7,22 (м, 1H), 7,28 (м, 1H), 7,44 (д, J=7,6 Гц, 1H), 8,01 (с, 2H), 8,15 (д, J=7,6 Гц, 1H).
МС (ESI) m/z 537 (M+H)+;
Анал. Вычисл. для С29Н33FN4O5·1,5H2О: C, 61,80; H, 6,44; N, 9,94.
Найдено: C, 62,21; H, 6,30; N, 9,02.
(Стадия 4) Синтез цис-4-((4S)-фтор-1-(2-(2-метилфениламино)- 6-бензоксазолилацетил)-(2S)-пирролидинилкарбониламино)циклогексанкарбоновой кислоты
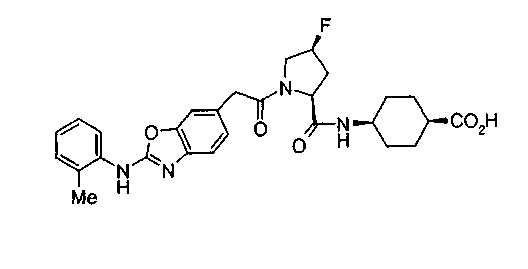
Метил-цис-4-((4S)-фтор-1-(2-(2-метилфениламино)-6-бензоксазолилацетил)-(2S)-пирролидинилкарбониламино)циклогексанкарбоксилат (299 мг, 0,55 ммоль) растворяют в ТГФ (5 мл). К образовавшемуся раствору добавляют 0,25 н. NaOH (2 экв.) и смесь перемешивают на протяжении ночи при комнатной температуре. После разбавления смесью хлороформ-метанол (5:1, об./об., 50 мл) смесь промывают 1 н. HCl, сушат над безводным сульфатом магния и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси хлороформ-метанол (10:1, об./об.) цис-4-((4S)-фтор-1-(2-(2-метилфениламино)-6-бензоксазолилацетил)-(2S)-пирролидинилкарбониламино)циклогексанкарбоновую кислоту (248 мг, 86%) получают в виде белого кристаллического твердого вещества.
ИК (ATR) 1639, 1573, 1428 см-1;
1H-ЯМР (CDCl3) δ: 1,24 (ушир., 2H), 1,54 (ушир., 1H), 1,66 (ушир., 4H), 1,76 (ушир., 2H), 1,99 (ушир., 1H), 2,17 (м, 1H), 2,31 (с, 3H), 2,44 (ушир., 1H), 2,83 (ряд т, J=16,0 Гц, общий 1H), 3,61-3,82 (ряд м, общий 4H), 3,86 (ушир., 2H), 5,24 (д, J=52,4 Гц, 1H), 7,10 (м, 2H), 7,20 (м, 1H), 7,25 (м, 2H), 7,32 (м, 2H), 7,80 (м, 1H).
МС (ESI) m/z 523 (M+H)+;
Анал. Вычисл. для С28Н31FN4O5·H2О: C, 62,21; H, 6,15; N, 10,36.
Найдено: C, 63,06; H, 6,23; N, 9,07.
Пример 33
4-(1-(2-(2-Метилфениламино)-6-бензоксазолилацетил)-(4S)-фтор-(2S)-пирролидинилметиламино)бензойная кислота:
(Стадия 1) Синтез N-трет-бутоксикарбонил-(4S)-фтор-(2S)-пролиналя
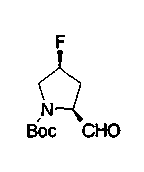
В метиленхлориде (50 мл) растворяют N-трет-бутоксикарбонил-(4S)-фтор-(2S)-пирролидинилметанол (1,22 г, 5,57 ммоль). При перемешивании при комнатной температуре к образовавшемуся раствору по частям добавляют 1,1,1-триацетокси-1,1-дигидро-1,2-бензодиоксол-3(1Н)-он (Dess-Martin Periodinat, 2,84 г, 6,69 ммоль). После завершения добавления реакционную смесь перемешивают дополнительно в течение 2 часов при комнатной температуре. Нерастворимое вещество отфильтровывают при пониженном давлении и затем фильтрат перегоняют при пониженном давлении для удаления растворителя. К остатку добавляют эфир. После отделения нерастворимого вещества фильтрованием фильтрат перегоняют при пониженном давлении. Вышеуказанную операцию повторяют еще три раза, чтобы отфильтровать нерастворимое вещество при пониженном давлении, в результате чего N-трет-бутоксикарбонил-(4S)-фтор-(2S)-пролиналь (1,20 г, 99%) получают в виде коричневого твердого вещества.
1H-ЯМР (CDCl3) δ: 1,63 и 1,68 (с, общий 9H), 2,38-2,69 (м, 1H), 3,68-3,84 (м, 1H), 3,95-4,14 (м, 1H), 4,36-4,51 (м, 1H), 5,40 (ушир.д, J=51,2 Гц, 1H), 9,78 (д, J=18,4 Гц, 1H).
МС (ESI) m/z, 218 (M++H).
(Стадия 2) Синтез метил-4-((4S)-фтор-(2S)-пирролидинилметиламино)бензоата
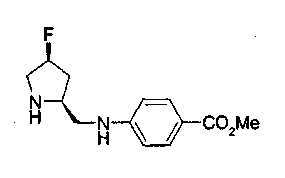
Метил-4-аминобензоат (728 мг, 4,82 ммоль), уксусную кислоту (290 мл, 4,82 ммоль) и N-трет-бутоксикарбонил-(4S)-фтор-(2S)-пролиналь (6,97 мг, 3,21 ммоль) растворяют в метаноле (15 мл). При перемешивании при 0°С к образовавшемуся раствору добавляют цианоборогидрид натрия (95%, 320 мг, 4,82 ммоль). Смесь перемешивают на протяжении ночи при комнатной температуре. К реакционной смеси добавляют воду с последующей экстракцией этилацетатом. Экстракт сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Таким образом полученный остаток растворяют в метиленхлориде (10 мл). К образовавшемуся раствору добавляют трифторуксусную кислоту (7 мл) и смесь перемешивают при комнатной температуре в течение 30 минут. Реакционную смесь перегоняют при пониженном давлении. После добавления насыщенного водного раствора бикарбоната натрия к остатку образовавшуюся смесь экстрагируют хлороформом. Экстракт сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси хлороформ-метанол (10:1) метил-4-((4S)-фтор-(2S)-пирролидинилметиламино)бензоат (458 мг, 57%) получают в виде бесцветного твердого вещества.
1H-ЯМР (CDCl3) δ: 1,80-1,92 (м, 1H), 2,15-2,31 (м, 1H), 2,90-3,03 (м, 1H), 3,18-3,23 (м, 1H), 3,28-3,37 (м, 2H), 3,45-3,51 (м, 1H), 3,84 (с, 3H), 4,63 (ушир.с, 1H), 5,14-5,30 (м, 1H), 6,57 (д, J=6,8 Гц, 2H), 7,85 (д, J=7,2 Гц, 2H).
(Стадия 3) Синтез метил-4-(1-(2-(2-метилфениламино)-6-бензоксазолилацетил)-(4S)-фтор-(2S)-пирролидинилметиламино)бензоата
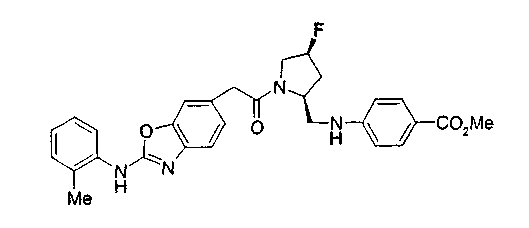
EDC·HCl (232 мг, 1,21 ммоль) в ДМФ (10 мл) добавляют к метил-4-((4S)-фтор-(2S)-пирролидинилметиламино)бензоату (277 мг, 1,10 ммоль), 2-(2-метилфениламино)-6-бензоксазолилуксусной кислоте (310 мг, 1,10 ммоль) и DMAP (148 мг, 1,21 ммоль) при комнатной температуре. Смесь перемешивают на протяжении ночи при комнатной температуре. К реакционной смеси добавляют воду с последующей экстракцией этилацетатом. Экстракт промывают насыщенным раствором соли (три раза), сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси гексан-этилацетат (1:4) метил-4-(1-(2-(2-метилфениламино)-6-бензоксазолилацетил)-(4S)-фтор-(2S)-пирролидинилметиламино)бензоат (580 мг, 100%) получают в виде бесцветного аморфного вещества.
1H-ЯМР (CDCl3) δ: 1,70 (ушир.с, 1H), 2,07-2,23 (м, 2H), 2,37 (с, 3H), 3,24-3,28 (м, 1H), 3,57-3,75 (м, 1H), 3,61-3,85 (м, 2H), 3,83 (с, 3H), 4,54 (ушир.д, J=6,8 Гц, 1H), 5,22-5,40 (м, 2H), 6,61 (д, J=8,8 Гц, 2H), 7,03-7,09 (м, 2H), 7,14 (с, 1H), 7,22 (д, J=7,2 Гц, 1H), 7,30 (т, J=8,0 Гц, 1H), 7,38 (д, J=8,0 Гц, 1H), 7,85 (д, J=8,8 Гц, 2H), 8,05 (д, J=8,0 Гц, 1H).
МС (ESI) m/z, 517 (M++H).
(Стадия 4) Синтез 4-(1-(2-(2-метилфениламино)-6-бензоксазолилацетил)-(4S)-фтор-(2S)-пирролидинилметиламино)бензойной кислоты
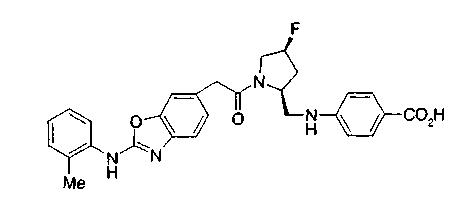
Метил-4-(1-(2-(2-метилфениламино)-6-бензоксазолилацетил)-(4S)-фтор-(2S)-пирролидинилметиламино)бензоат (568 мг, 1,10 ммоль) растворяют в смеси метанол-ТГФ (1:1, 10 мл). После добавления 1,0 М NaOH (5,50 мл, 5,50 ммоль) при комнатной температуре образовавшуюся смесь перемешивают при 60°С в течение 3 часов. Реакционную смесь выливают в 1 н. HCl (10 мл) с последующей экстракцией смесью хлороформ-метанол. Экстракт сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси хлороформ-метанол (10:1) 4-(1-(2-(2-метилфениламино)-6-бензоксазолилацетил)-(4S)-фтор-(2S)-пирролидинилметиламино)бензойную кислоту (409 мг, 74%) получают в виде бесцветного аморфного вещества.
1H-ЯМР (ДМСО-d6), смесь ротамеров, δ: 2,02-2,26 (м, 2H), 2,29 и 2,30 (с, общий 3H), 2,93-2,99 (м, 1Н), 3,58-4,33 (ряд м, 6H), 5,38-5,47 (м, 1H), 6,64-7,83 (ряд м, 12H). МС (ESI) m/z, 503 (M++H).
Пример 34
4-(1-(2-(2-Метилфениламино)-6-бензоксазолилацетил)-(3R)-пирролидинилокси)бензойная кислота:
(Стадия 1) Синтез метил-4-(1-(2-(2-метилфениламино)-6-бензоксазолилацетил)-(3R)-пирролидинилокси)бензоата

Метил-4-(3R-пирролидинил)оксибензоат (221 мг, 1,0 ммоль), 2-(2-метилфениламино)-6-бензоксазолилуксусную кислоту (282 мг, 1,0 ммоль), HOBt (135 мг, 1,0 ммоль) и триэтиламин (417 мкл, 3,0 ммоль) растворяют в метиленхлориде (15 мл). При 0°С добавляют EDC·HCl (288 мг, 1,5 ммоль) и смесь перемешивают при комнатной температуре в течение 16 часов. К реакционной смеси добавляют ледяную воду с последующей экстракцией этилацетатом. Экстракт промывают последовательно насыщенным водным раствором бикарбоната натрия, 2 М водным раствором лимонной кислоты и насыщенным водным раствором бикарбоната натрия, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси гексан-этилацетат (1:5, об./об.) указанное в заголовке соединение (320 мг, 66%) получают в виде бесцветного масла.
1H-ЯМР (CDCl3) δ: 2,20-2,40 (м, 5H), 3,60-4,00 (м, 6H), 4,95-5,05 (м, 1H), 6,80-7,41 (м, 9H), 7,94-8,09 (м, 3H).
(Стадия 2) Синтез 4-(1-(2-(2-метилфениламино)-6-бензоксазолилацетил)-(3R)-пирролидинил)бензойной кислоты
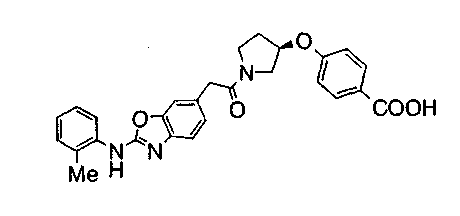
Метил-4-(1-(2-(2-метилфениламино)-6-бензоксазолилацетил)-(3R)-пирролидинилокси)бензоат (320 мг, 0,65 ммоль) растворяют в ТГФ (5,0 мл) и метаноле (3,0 мл). После добавления 1 н. NaOH (1,0 мл, 1,0 ммоль) при комнатной температуре реакционную смесь перемешивают в течение 18 часов при 70°С. Из реакционной смеси растворитель отгоняют при пониженном давлении. Остаток слабо подкисляют водой (5 мл) и 1 н. HCl. Образовавшиеся кристаллы собирают фильтрованием при пониженном давлении, промывают водой и затем сушат при пониженном давлении, в результате чего указанное в заголовке соединение (240 мг, 77%) получают в виде белого кристаллического твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 2,01-2,20 (м, 2H), 2,30 (с, 3H), 3,55-3,90 (м, 6H), 5,11-5,20 (м, 1H), 7,01-7,09 (м, 4H), 7,23-7,32 (м, 4H), 7,81-7,89 (м, 3H).
МС (FAB) m/z 472 (M+H)+;
Анал. Вычисл. для С27Н25N3O5 (0,5H2O: C, 67,49; H, 5,45; N, 8,74.
Найдено: C, 67,33; H, 5,35; N, 8,57.
Пример 35
4-(N-(3-Пропинил)-(2-(2-метилфениламино)-6-бензоксазолилацетамидо)метил)коричная кислота:
(Стадия 1) Синтез метил-4-(N-(3-пропинил)-(2-(2-метилфениламино)-6-бензоксазолилацетамидо)метил)циннамата
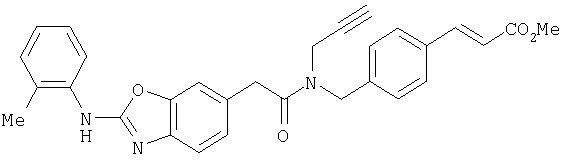
EDC·HCl (183 мг, 0,96 ммоль) добавляют к раствору в ДМФ (6 мл) 2-(2-метилфениламино)-6-бензоксазолилуксусной кислоты (180 мг, 0,64 ммоль), 4-(N-(3-пропинил)аминометил)циннамата (146 мг, 0,64 ммоль) HOBt (17,0 мг, 0,13 ммоль) и триэтиламина (0,13 мл, 0,96 ммоль). Образовавшуюся смесь перемешивают на протяжении ночи при комнатной температуре. К реакционной смеси добавляют воду (20 мл) с последующей экстракцией этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций этилацетата указанное в заголовке соединение (313 мг, 99%) получают в виде красного аморфного вещества.
1H-ЯМР (CDCl3) δ: 2,23, 2,33 (каждый с, общий 1H), 2,38 (с, 3H), 3,82 (с, 3H), 3,83, 3,96 (каждый с, общий 2H), 4,27 (с, 2H), 4,72, 4,74 (каждый с, общий 2H), 6,44 (м, 1H), 6,95-7,56 (м, 10Н), 7,68 (м, 1H), 8,08 (м, 1H).
(Стадия 2) Синтез 4-(N-(3-пропинил)-(2-(2-метилфениламино)-6-бензоксазолилацетамидо)метил)коричной кислоты
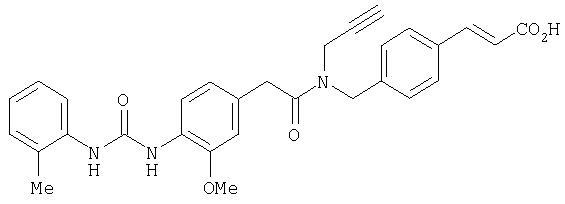
При перемешивании при комнатной температуре 0,25 н. NaOH (4,70 мл, 1,17 ммоль) добавляют к раствору метил-4-(N-(3-пропионил)-(2-(2-метилфениламино)-6-бензоксазолилацетамидо)метил)циннамата (313 мг, 0,63 ммоль) в ТГФ (8 мл). Реакционную смесь затем перемешивают при 70°С в течение 2 часов. При перемешивании при 0°С реакционную смесь выливают в 1 н. HCl (5 мл). Таким образом полученные кристаллы собирают фильтрованием, промывают водой и сушат при пониженном давлении, в результате чего указанное в заголовке соединение (609 мг, 82%) получают в виде светло-желтого твердого вещества.
ИК (KBr) 3353, 3288, 2960, 2127, 2119, 1687, 1629, 1600, 1533, 1454, 1417 см-1;
1H-ЯМР (ДМСО-d6) δ: 2,17 (с, 1H), 2,30 (с, 3H), 3,80, 3,92 (каждый с, общий 2H), 4,12, 4,23 (каждый с, общий 2H), 4,61, 4,76 (каждый с, общий 2H), 6,50 (м, 1H), 7,00 (д, J=8,1 Гц, 1H), 7,08 (д, J=7,6 Гц, 2H), 7,23-7,29 (м, 6H), 7,52-7,67 (м, 3H), 7,81 (м, 1H), 9,64 (ушир.с, 1H).
ESI-МС 512 (M++1);
Анал. Вычисл. для С30Н29N3O5·0,75H2О: C, 68,62; H, 5,85; N, 8,00.
Найдено: C, 68,76; H, 6,18; N, 7,16.
Пример 36
4-(1-(3-Хлор-4-(1-индолинилкарбониламино)фенилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоновая кислота:
(Стадия 1) Синтез этил-3-хлор-4-(1-индолинилкарбониламино)фенилацетата
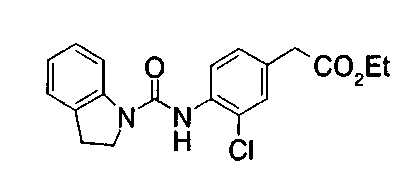
В метиленхлориде (50 мл) трифосген (926 мг, 3,12 ммоль) и затем пиридин (5 мл) добавляют к этил-4-амино-3-хлорфенилацетату (2,00 г, 9,36 ммоль) при перемешивании при 0°С. После перемешивания при такой же температуре в течение 15 минут добавляют индолин (1,05 мл, 9,36 ммоль). Реакционную смесь далее перемешивают в течение 15 минут при комнатной температуре. К реакционной смеси добавляют воду (50 мл) с последующей экстракцией этилацетатом (300 мл). Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом магния и перегоняют при пониженном давлении для удаления растворителя, в результате чего этил-3-хлор-4-(1-индолинилкарбониламино)фенилацетат (3,07 г, 91%) получают в виде светло-розового кристаллического порошка.
1H-ЯМР (CDCl3) δ: 1,25 (т, J=7,3 Гц, 3H), 3,20-3,26 (м, 2H), 3,54 (д, J=2,7 Гц, 2H), 4,08-4,18 (м, 4H), 6,93-6,98 (м, 1H), 7,09-7,31 (м, 5H), 7,94 (д, J=8,1 Гц, 1H), 8,28 (д, J=8,1 Гц, 1H);
МС (ESI) m/z 359 (M++1).
(Стадия 2) Синтез 3-хлор-4-(1-индолинилкарбониламино)фенилуксусной кислоты
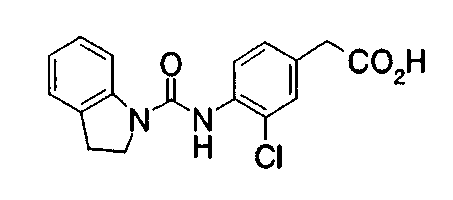
К этил-3-хлор-4-(1-индолинилкарбониламино)фенилацетату (3,07 г, 8,56 ммоль) добавляют 0,25 н. NaOH (68,4 мл, 17,1 ммоль) и ТГФ (70 мл). Смесь нагревают и кипятят с обратным холодильником в течение 4 часов. После охлаждения реакционную смесь выливают в 1 н.хлористоводородную кислоту (50 мл). Таким образом осажденные кристаллы собирают фильтрованием и сушат при пониженном давлении в течение 12 часов, в результате чего 3-хлор-4-(1-индолинилкарбониламино)фенилуксусную кислоту (1,71 г, 60%) получают в виде бесцветного кристаллического порошка.
1H-ЯМР (ДМСО-d6) δ: 3,19 (т, J=8,8 Гц, 2H), 3,61 (с, 2H), 4,13 (т, J=8,8 Гц, 2H), 6,90 (т, J=7,3 Гц, 1H), 7,11 (т, J=7,8 Гц, 1H), 7,19-7,23 (м, 2H), 7,41 (д, J=2,0 Гц, 1H), 7,54-7,58 (м, 1H), 7,82 (д, J=8,3 Гц, 1H), 8,21 (с, 1H);
МС (ESI) m/z 331 (M++1).
(Стадия 3) Синтез метил-4-(1-(3-хлор-4-(1-индолинилкарбониламино)фенилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилата
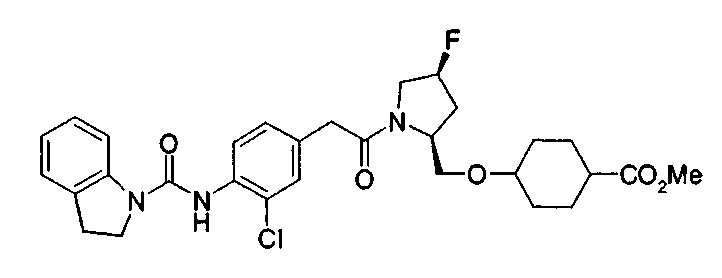
В ДМФ (10 мл) метил-((4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилат (соединение, синтезированное в (стадии 3) примера 21) (143 мг, 0,55 ммоль), 3-хлор-4-(1-индолинилкарбониламино)фенилуксусную кислоту (182 мг, 0,55 ммоль), EDC·HCl (116 мг, 0,61 ммоль) и HOBt (15 мг, 0,11 ммоль) перемешивают на протяжении ночи при комнатной температуре. В реакционную смесь выливают воду (20 мл) с последующей экстракцией этилацетатом. Экстракт промывают насыщенным раствором соли. Остаток очищают тонкослойной колоночной хроматографией при использовании смеси гексан/этилацетат (1/10) в качестве проявляющего растворителя, в результате чего метил-4-(1-(3-хлор-4-(1-индолинилкарбониламино)фенилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилат (259 мг, 82%) получают в виде бесцветного аморфного вещества.
1H-ЯМР (CDCl3), смесь амидных изомеров, δ: 1,21-1,32 (м, 2H), 1,40-1,53 (м, 2H), 1,98-2,51 (ряд м, 8H), 3,27 (т, J=8,4 Гц, 2H), 3,22-3,34 (м, 2H), 3,50-4,01 (ряд м, 4H), 3,66 и 3,67 (с, общий 3H), 4,14 (т, J=8,8 Гц, 2H), 4,10-4,38 (м, 1H), 5,16-5,33 (м, 1H), 6,98 (т, J=7,6 Гц, 1Н), 7,12-7,24 (ряд м, 4H), 7,34 (ушир.с, 1H), 7,95 (д, J=8,0 Гц, 1H), 8,27 (т, J=8,4 Гц, 1H);
МС (ESI) m/z 572 (M++1).
(Стадия 4) Синтез 4-(1-(3-хлор-4-(1-индолинилкарбониламино)фенилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоновой кислоты
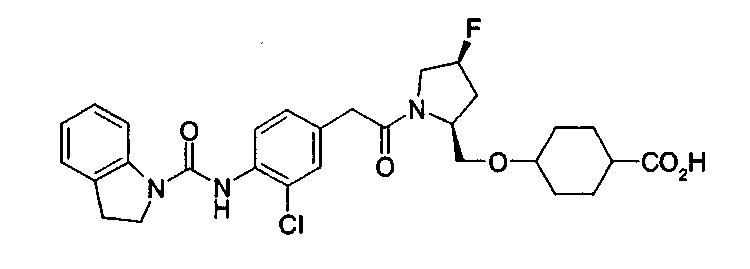
К метил-4-(1-(3-хлор-4-(1-индолинилкарбониламино)фенилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилату (224 мг, 0,39 ммоль) добавляют 0,5 н. NaOH (4,7 мл), метанол (5 мл) и ТГФ (5 мл). Смесь перемешивают на протяжении ночи при комнатной температуре. Реакционную смесь выливают в 1 н.хлористоводородную кислоту (10 мл) с последующей экстракцией смесью хлороформ-метанол (10:1). Экстракт сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси хлороформ-метанол (10/1) указанное в заголовке соединение (221 мг, 100%) получают в виде бесцветного аморфного вещества.
1H-ЯМР (CDCl3), смесь амидных изомеров, δ: 1,21-1,33 (м, 2H), 1,42-1,54 (м, 2H), 2,00-2,50 (ряд м, 8H), 3,26 (т, J=8,8 Гц, 2H), 3,24-3,36 (м, 2H), 3,48-4,00 (ряд м, 4H), 4,14 (т, J=8,8 Гц, 2H), 4,16-4,37 (м, 1H), 5,17-5,32 (м, 1H), 6,97 (т, J=7,6 Гц, 1H), 7,11-7,24 (ряд м, 4H), 7,33 (с, 1H), 7,93 (д, J=8,0 Гц, 1H), 8,25 (т, J=9,2 Гц, 1H);
МС (ESI) m/z 558 (M++1).
Пример 37
4-(1-(2-(2-Хлорфенил)амино-7-фтор-6-бензоксазолилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоновая кислота:
(Стадия 1) Синтез метил-2-(2-хлорфенил)амино-7-фтор-6-бензоксазолилацетата
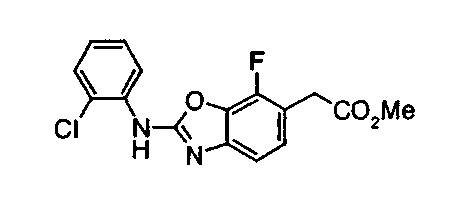
В метаноле (50 мл) растворяют 4-амино-2-фтор-3-гидроксифенилуксусную кислоту (2,52 г, 12,7 ммоль). К образовавшемуся раствору добавляют при комнатной температуре 2-хлорфенилизотиоцианат (1,99 мл, 12,7 ммоль). После перемешивания образовавшейся смеси при комнатной температуре в течение 2,5 часа к ней добавляют оксид ртути(II) (желтый) (3,29 г, 15,2 ммоль). Смесь перемешивают далее в течение 14 часов при 70°С.Реакционной смеси дают возможность охладиться до комнатной температуры. Нерастворимое вещество отфильтровывают через целит при пониженном давлении с последующим промыванием метанолом. Из фильтрата растворитель отгоняют при пониженном давлении. Остаток очищают хроматографией на колонке с силикагелем (силикагель: 100 г, смесь хлороформ/этилацетат (30/1)), посредством чего из элюатных фракций метил-2-(2-хлорфенил)амино-7-фтор-6-бензоксазолилацетат (2,12 г, 50%) получают в виде светло-розового твердого вещества.
1H-ЯМР (CDCl3) δ: 3,73 (с, 3H), 3,77 (с, 2H), 7,05 (тт, J=7,3,1, Гц, 1H), 7,12 (т, J=7,1 Гц, 1H), 7,28 (с, 1H), 7,38 (дт, J=7,3,0,7 Гц, 1H), 7,42 (д, J=8,0 Гц, 1H), 7,60 (ушир., 1H), 8,53 (д, J=8,3 Гц, 1H);
МС (ESI) m/z 335(M++1), 337 (M++3).
(Стадия 2) Синтез 2-(2-хлорфенил)амино-7-фтор-6-бензоксазолилуксусной кислоты
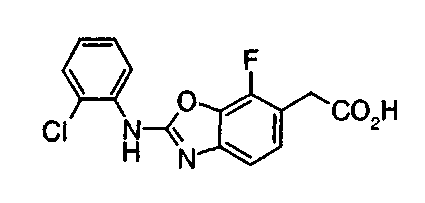
Метил-2-(2-хлорфенил)амино-7-фтор-6-бензоксазолилацетат (2,12 г, 6,33 ммоль) растворяют в смеси ТГФ/метанол (2:1, 90 мл). К образовавшемуся раствору добавляют 1 н. NaOH (30 мл) и смесь перемешивают при комнатной температуре в течение 3,5 часа. Растворитель отгоняют при пониженном давлении. Остаток подкисляют 1 н.хлористоводородной кислотой. Таким образом осажденные кристаллы собирают фильтрованием, промывают водой и сушат при пониженном давлении, в результате чего 2-(2-хлорфенил)амино-7-фтор-6-бензоксазолилуксусную кислоту (1,83 г, 90%) получают в виде бесцветного твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 3,71 (с, 2H), 7,12-7,19 (м, 3H), 7,23 (дт, J=7,6, l,7 Гц, 1H), 7,43 (дт, J=7,6, 1,5 Гц, 1H), 7,55 (дд, J=8,1, l,5 Гц, 1H), 8,04 (д, J=8,3 Гц, 1H), 12,27 (ушир., 1H).
(Стадия 3) Синтез метил-4-(1-(2-(2-хлорфенил)амино-7-фтор-6-бензоксазолилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилата:
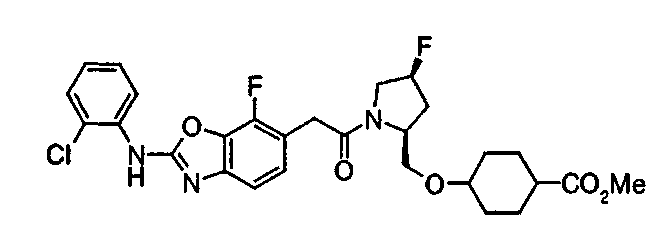
В ДМФ (4 мл) метил-4-((4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилат (соединение, синтезированное в стадии 3 примера 21) (210 мг, 0,81 ммоль), 2-(2-хлорфенил)амино-7-фтор-6-бензоксазолилуксусную кислоту (260 мг, 0,81 ммоль), EDC·HCl (233 мг, 1,22 ммоль), HOBt (165 мг, 1,22 ммоль) и триэтиламин (0,56 мл, 4,05 ммоль) перемешивают при комнатной температуре в течение 15 часов. Реакционную смесь выливают в ледяную воду (30 мл) с последующей экстракцией этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем (силикагель: 50 г, хлороформ/ацетон (20/1)), в результате чего из элюатных фракций метил-4-(1-(2-(2-хлорфенил)амино-7-фтор-6-бензоксазолилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилат (420 мг, 92%) получают в виде бесцветного аморфного вещества.
1H-ЯМР (CDCl3) δ: 1,17-1,54 (м, 5H), 1,92-2,53 (м, 7H), 3,28 (м, 1H), 3,35 и 3,54 (каждый м, общий 1H, амидные изомеры), 3,64 и 3,67 (каждый с, общий 3H, амидные изомеры), 3,70 (с, 1H), 3,72-4,04 (м, 3H), 4,31 и 4,38 (каждый м, общий 1H, амидные изомеры), 5,26 и 5,30 (каждый м, общий 1H, амидные изомеры), 7,04 (т, J=7,8 Гц, 1H), 7,13 (кв., J=8,8 Гц, 1H), 7,26 (т, J=7,3 Гц, 1H), 7,37 (д, J=8,0 Гц, 1H), 7,41 (д, J=7,8 Гц, 1H), 7,62 (с, 1H), 8,52 (д, J=8,3 Гц, 1H);
МС (ESI) m/z 562 (M++1), 564 (M++3).
(Стадия 4) Синтез 4-(1-(2-(2-хлорфенил)амино-7-фтор-6-бензоксазолилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоновой кислоты
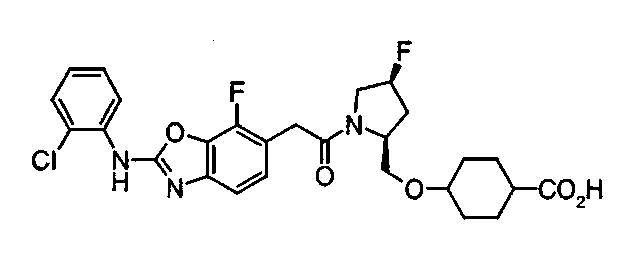
В смеси ТГФ/метанол (2:1, 15 мл) и 1 н. NaOH (5 мл) метил-4-(1-(2-(2-хлорфенил)амино-7-фтор-6-бензоксазолилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилат (420 мг, 0,747 ммоль) перемешивают при комнатной температуре в течение 17 часов. Растворитель отгоняют при пониженном давлении. Остаток подкисляют 1 н.хлористоводородной кислотой. Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при пониженном давлении, в результате чего указанное в заголовке соединение (336 мг, 82%) получают в виде светло-коричневого твердого вещества. ИК (ATR) 3199, 2935, 2863, 1703, 1636, 1593, 1574, 1448 см-1.
1H-ЯМР (ДМСО-d6) δ: 1,13-1,43 (м, 5H), 1,76-2,24 (м, 7H), 3,20 (т, J=8,8 Гц, 2H), 3,59-4,41 (м, 5H), 5,24-5,49 (м, 1H), 7,02-7,10 (м, 1H), 7,16 (д, J=8,1 Гц, 1H), 7,22 (т, J=7,6 Гц, 1H), 7,43 (т, J=7,6 Гц, 1H), 7,54 (д, J=7,8 Гц, 1H), 8,04 (д, J=8,1 Гц, 1H);
МС (ESI) m/z 548 (M++1), 550 (M++3);
Анал. Вычисл. для С27Н28ClF2N3O5·0,5H2O: C, 58,22; H, 5,25; N, 7,57; Cl, 6,37; F, 6,82.
Найдено: C, 58,44; H, 5,17; N, 7,45; Cl, 6,55; F, 6,64.
Пример 38
4-(1-(3-Хлор-4-(3-индолилкарбониламино)фенилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоновая кислота:
(Стадия 1) Синтез метил-4-(1-(3-хлор-4-(3-индолилкарбониламино)фенилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилата
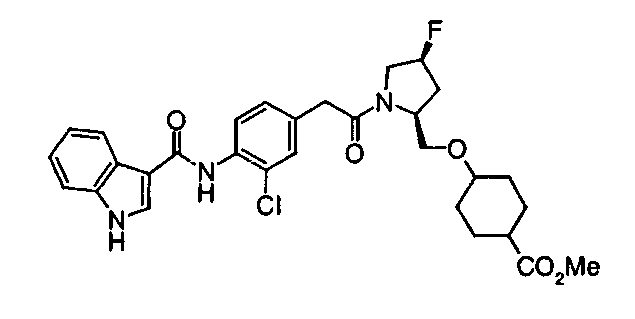
EDC·HCl (168 мг, 0,87 ммоль) добавляют к раствору 3-хлор-4-(3-индолилкарбониламино)фенилуксусной кислоты (240 мг, 0,67 ммоль), метил-4-((4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилата (соединение, синтезированное в (стадии 3) примера 21) (174 мг, 0,67 ммоль), HOBt (18,0 мг, 0,13 ммоль) и DMAP (16,0 мг, 0,13 ммоль) в ДМФ (5,0 мл) с последующим перемешиванием при комнатной температуре в течение 4 часов. К реакционной смеси добавляют воду (10 мл). Осадок собирают фильтрованием, промывают Et2O и сушат при пониженном давлении, в результате чего метил-4-(1-(3-хлор-4-(3-индолилкарбониламино)фенилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилат (320 мг, 84%) получают в виде бесцветного твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 1,15-1,28 (м, 2H), 1,32-1,44 (м, 2H), 1,87-2,07 (м, 4H), 2,10-2,33 (м, 3H), 3,21 (м, 1H), 3,30 и 3,45 (каждый м, общий 1H), 3,57 (с, 3H), 3,60-3,93 (м, 5H), 4,15 и 4,33 (каждый м, общий 1H), 5,31 и 5,38 (каждый м, общий 1H), 7,12-7,21 (м, 3H), 7,37 и 7,39 (каждый д, J=1,4 Гц, общий 1H), 7,46 (д, J=7,8 Гц, 1H), 7,65 и 7,66 (каждый д, J=8,3 Гц, общий 1H), 8,13 (д, J=7,8 Гц, 1H), 8,28 (с, 1H), 9,28 (с, 1H), 11,73 (ушир.с, 1H);
МС (ESI) m/z 570 (M++1), 572 (M++3).
(Стадия 2) Синтез 4-(1-(3-хлор-4-(3-индолилкарбониламино)фенилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоновой кислоты
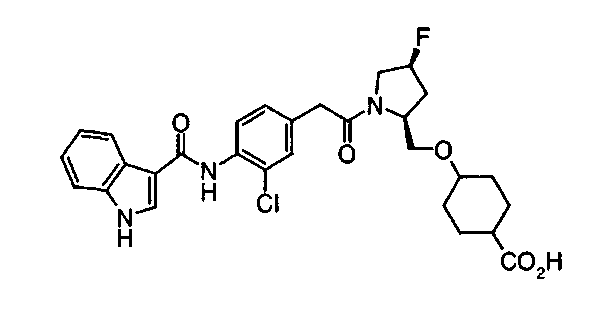
К суспензии метил-4-(1-(3-хлор-4-(3-индолилкарбониламино)фенилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилата (320 мг, 0,56 ммоль) в ТГФ (14 мл) добавляют 0,25 н. NaOH (8,20 мл, 2,05 ммоль). Смесь перемешивают при комнатной температуре в течение 5 часов. Реакционную смесь выливают в 1 н. HCl при охлаждении льдом. Таким образом осажденные кристаллы собирают фильтрованием, промывают водой и сушат при пониженном давлении, в результате чего указанное в заголовке соединение (295 мг, 88%) получают в виде бесцветного твердого вещества.
ИК (ATR) ν 3423, 3210, 2940, 2863, 1697, 1627, 1513, 1432 см-1;
1H-ЯМР (ДМСО-d6) δ: 1,15-1,28 (м, 2H), 1,32-1,44 (м, 2H), 1,87-2,07 (м, 4H), 2,10-2,33 (м, 3H), 3,21 (м, 1H), 3,30 и 3,45 (каждый м, общий 1H), 3,57 (с, 3H), 3,60-3,93 (м, 5H), 4,15 и 4,33 (каждый м, общий 1H), 5,31 и 5,38 (каждый м, общий 1H), 7,12-7,21 (м, 3H), 7,37 и 7,39 (каждый д, J=1,4 Гц, общий 1H), 7,46 (д, J=7,8 Гц, 1H), 7,65 и 7,66 (каждый д, J=8,3 Гц, общий 1H), 8,13 (д, J=7,8 Гц, 1H), 8,28 (с, 1H), 9,28 (с, 1H), 11,73 (ушир.с, 1H);
МС (ESI) m/z 556 (M++1), 558 (M++3);
Анал. Вычисл. для С29Н31ClFN3O5·H2O: C, 60,68; H, 5,79; N, 7,32, Найдено: C, 60,90; H, 5,29; N, 7,32.
Пример 39
4-(1-(3-Хлор-4-(1-метил-3-индолилкарбониламино)фенилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоновая кислота:
(Стадия 1) Синтез этил-3-хлор-4-(1-метил-3-индолилкарбониламино)фенилацетата

EDC·HCl (1,44 г, 7,49 ммоль) добавляют к раствору 1-метилиндол-3-карбоновой кислоты (1,01 г, 5,71 ммоль), этил-4-амино-3-хлорфенилацетата (1,22 г, 5,71 ммоль), HOBt (0,86 г, 6,34 ммоль) и DMAP (0,14 г, 1,15 ммоль) в ДМФ (20 мл) с последующим перемешиванием при 70°С в течение 18 часов. После охлаждения до комнатной температуры к реакционной смеси добавляют воду (30 мл) с последующей экстракцией этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси гексан-этилацетат (1:1, об./об.) этил-3-хлор-4-(1-метил-3-индолилкарбониламино)фенилацетат (639 мг, 30%) получают в виде желтого твердого вещества.
1H-ЯМР (CDCl3) δ: 1,27 (т, J=7,1 Гц, 3H), 3,58 (с, 2H), 3,89 (с, 3H), 4,17 (кв., J=7,1 Гц, 2H), 7,24 (дд, J=8,3, 2,0 Гц, 1H), 7,32-7,43 (м, 4H), 7,81 (с, 1H), 8,16 (м, 1H), 8,28 (ушир.с, 1H), 8,59 (д, J=8,3 Гц, 1H);
МС (ESI) m/z 371 (M++1), 373 (M++3).
(Стадия 2) Синтез 3-хлор-4-(1-метил-3-индолилкарбониламино)фенилуксусной кислоты
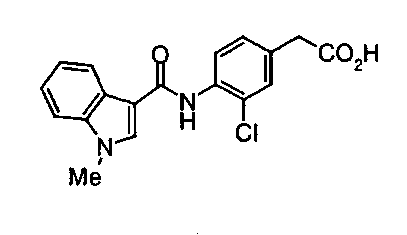
К раствору этил-3-хлор-4-(1-метил-3-индолилкарбониламино)фенилацетата (639 мг, 1,72 ммоль) в ТГФ (17,5 мл) добавляют 0,25 н. NaOH (10,3 мл, 2,58 ммоль). Образовавшуюся смесь перемешивают при комнатной температуре в течение 4 часов. При охлаждении льдом реакционную смесь выливают в 1 н. HCl (15 мл). Таким образом осажденные кристаллы собирают фильтрованием, промывают водой и сушат при пониженном давлении, в результате чего 3-хлор-4-(1-метил-3-индолилкарбониламино)фенилуксусную кислоту (549 мг, 93%) получают в виде бесцветного твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 3,61 (с, 2H), 3,89 (с, 3H), 7,17-7,28 (м, 3H), 7,43 (д, J=1,7 Гц, 1H), 7,53 (д, J=8,3 Гц, 1H), 7,69 (д, J=8,3 Гц, 1H), 8,14 (д, J=7,8 Гц, 1H), 8,26 (с, 1H), 9,26 (с, 1H).
(Стадия 3) Синтез метил-4-(1-(3-хлор-4-(1-метил-3-индолилкарбониламино)фенилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилата
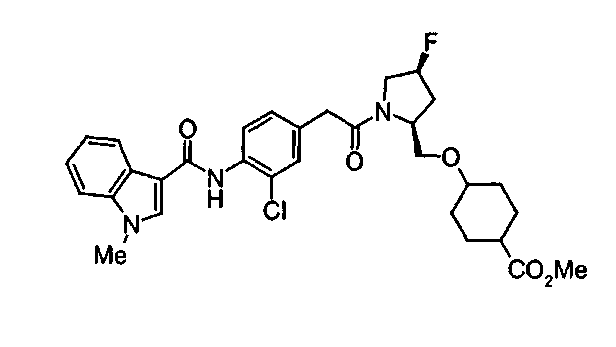
После добавления EDC·HCl (60,0 мг, 0,31 ммоль) к раствору 3-хлор-4-(1-метил-3-индолилкарбониламино)фенилуксусной кислоты (82,0 мг, 0,24 ммоль), метил-((4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилата (соединение, синтезированное в (стадии 3) примера 21) (62,0 мг, 0,24 ммоль), HOBt (6,0 мг, 0,05 ммоль) и DMAP (6,0 мг, 0,05 ммоль) в ДМФ (2,0 мл) смесь перемешивают при комнатной температуре в течение 6 часов. Реакционную смесь выливают в воду (10 мл) с последующей экстракцией этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из этилацетатных элюатных фракций метил-4-(1-(3-хлор-4-(1-метил-3-индолилкарбониламино)фенилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилат (115 мг, 82%) получают в виде желтого аморфного вещества.
1H-ЯМР (CDCl3) δ: 1,21-1,32 (м, 2Н), 1,40-1,53 (м, 2Н), 1,97-2,50 (м, 7H), 3,26 (м, 1H), 3,33 и 3,50 (каждый м, общий 1H), 3,57-4,01 (м, 11H (3,64 и 3,66 (каждый с, общий 3H), 3,88 (с, 3H)), 4,21 и 4,38 (каждый м, общий 1H), 5,24 (м, 1H), 7,18 (м, 1H), 7,31-7,42 (м, 4H), 7,79 (с, 1H), 8,14 (м, 1H), 8,26 (ушир.с, 1H), 8,57 (д, J=8,3 Гц, 1H);
МС (ESI) m/z 584 (M++1), 586 (M++3).
(Стадия 4) Синтез 4-(1-(3-хлор-4-(1-метил-3-индолилкарбониламино)фенилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоновой кислоты
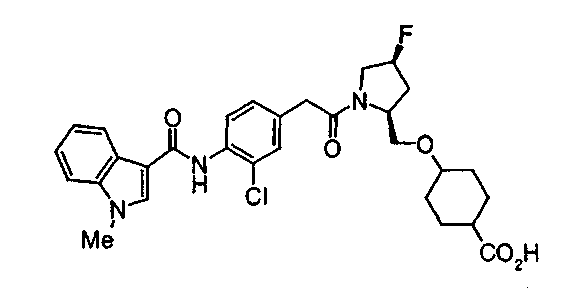
После добавления 0,25 н. NaOH (1,50 мл, 0,38 ммоль) к раствору метил-4-(1-(3-хлор-4-(1-метил-3-индолилкарбониламино)фенилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилата (115 мг, 0,20 ммоль) в ТГФ (2,5 мл) смесь перемешивают при комнатной температуре в течение 5 часов. При охлаждении льдом реакционную смесь выливают в 1 н. HCl (3,0 мл). Таким образом осажденные кристаллы собирают фильтрованием, промывают водой и сушат при пониженном давлении, в результате чего указанное в заголовке соединение (94 мг, 88%) получают в виде бесцветного твердого вещества.
ИК (ATR) 2938, 2863, 1724, 1646, 1577, 1511, 1465 см-1;
1H-ЯМР (ДМСО-d6) δ: 1,19-1,39 (м, 4H), 1,90-2,11 (м, 4H), 2,14-2,27 (м, 3H), 3,20 (м, 1H), 3,43-3,87 (м, 6H), 3,89 (с, 3H), 4,16 и 4,34 (каждый м, общий 1H), 5,31 и 5,38 (каждый м, общий 1H), 7,18-7,28 (м, 3H), 7,37 и 7,39 (каждый с, общий 1H), 7,52 (д, J=8,1 Гц, 1H), 7,70 и 7,71 (каждый д, J=8,1 Гц, общий 1H), 8,15 (д, J=7,8 Гц, 1H), 8,27 (д, J=7,8 Гц, 1H), 9,23 (с, 1H), 11,95 (ушир.с, 1H);
МС (ESI) m/z 570 (M++1), 572 (M++3);
Анал. Вычисл. для С30Н33ClFN3O5 ·0,75H2О: C, 61,75; H, 5,96; N, 7,20.
Найдено: C, 61,85; H, 5,92; N, 6,83.
Пример 40
4-((4S)-Фтор-1-(2-(1-метил-3-индолил)-6-бензоксазолилацетил)-(2S)-пирролидинилметокси)циклогексанкарбоновая кислота:
(Стадия 1) Синтез метил-2-(1-метил-3-индолил)-6-бензоксазолилацетата
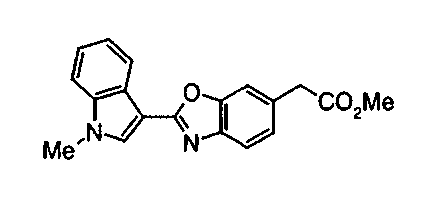
В ксилоле (20 мл) смесь 1-метил-3-индолкарбоновой кислоты (1,00 г, 5,71 ммоль), метил-4-амино-3-гидроксифенилацетата (1,03 г, 5,71 ммоль) и борной кислоты (1,05 г, 17,1 ммоль) нагревают и кипятят с обратным холодильником в течение 24 часов с использованием ловушки Дина-Старка. После охлаждения реакционной смеси до комнатной температуры растворитель отгоняют при пониженном давлении. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси хлороформ-этилацетат (4:1, об./об.) метил-2-(1-метил-2-индолил)-6-бензоксазолилацетат (0,20 г, 11%) получают в виде желтого масла.
1H-ЯМР (CDCl3) δ: 3,72 (с, 3H), 3,76 (с, 2H), 3,88 (с, 3H), 7,21 (дд, J=8,1, l,5 Гц, 1H), 7,32-7,40 (м, 3H), 7,49 (с, 1H), 7,65 (д, J=8,1 Гц, 1H), 7,91 (с, 1H), 8,45 (м, 1H);
МС (ESI) m/z 321 (M++1).
(Стадия 2) Синтез 2-(1-метил-3-индолил)-6-бензоксазолилуксусной кислоты
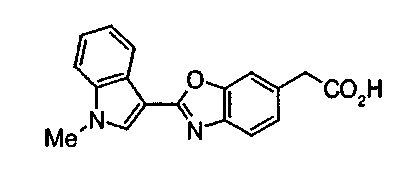
После добавления 0,25 н. NaOH (3,75 мл, 0,93 ммоль) к раствору метил-2-(1-метил-3-индолил)-6-бензоксазолилацетата (200 мг, 0,62 ммоль) в ТГФ (6,5 мл) смесь перемешивают при комнатной температуре в течение 2 часов. При охлаждении льдом реакционную смесь выливают в 1 н. HCl (10 мл). Таким образом осажденные кристаллы собирают фильтрованием, промывают водой и сушат при пониженном давлении, в результате чего 2-(1-метил-3-индолил)-6-бензоксазолилуксусную кислоту (189 мг, 99%) получают в виде бесцветного твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 3,73 (с, 2H), 3,94 (с, 3H), 7,24 (дд, J=7,8,l-5 Гц, 1H), 7,31 (тд, J=7,8,l-5 Гц, 1H), 7,35 (тд, J=7,8,1,5 Гц, 1H), 7,60-7,64 (м, 3H), 8,32 (дд, J=8,1,1,5 Гц, 1H), 8,34 (с, 1H), 12,37 (ушир.с, 1H);
МС (ESI) m/z 307 (M++1).
(Стадия 3) Синтез метил-4-((4S)-фтор-1-(2-(1-метил-3-индолил)-6-бензоксазолилацетил)-(2S)-пирролидинилметокси) циклогексанкарбоксилата
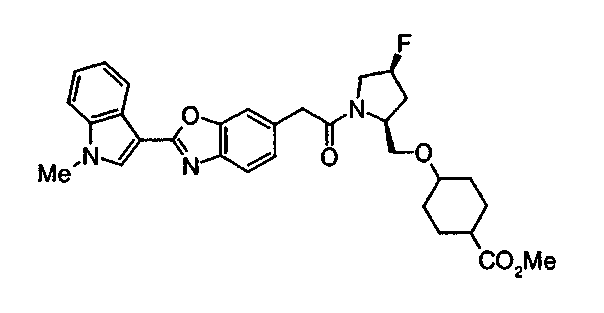
После добавления EDC·HCl (204 мг, 1,07 ммоль) к раствору 2-(1-метил-3-индолил)-6-бензоксазолилуксусной кислоты (251 мг, 0,82 ммоль), метил-((4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилата (соединение, синтезированное в (стадии 3) примера 21) (212 мг, 0,82 ммоль), HOBt (22,0 мг, 0,16 ммоль) и DMAP (20,0 мг, 0,16 ммоль) в ДМФ (5,0 мл) образовавшуюся смесь перемешивают при комнатной температуре в течение 4 часов. Реакционную смесь выливают в воду (10 мл) с последующей экстракцией этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, в результате чего из этилацетатных фракций метил-4-((4S)-Фтор-1-(2-(1-метил-3-индолил)-6-бензоксазолилацетил)-(2S)-пирролидинилметокси)циклогексанкарбоксилат (431 мг, 96%) получают в виде желтого аморфного вещества.
1H-ЯМР (CDCl3) δ: 1,21-1,34 (м, 2H), 1,40-1,53 (м, 2H), 1,96-2,15 (м, 4H), 2,19-2,50 (м, 3H), 3,26 (м, 1H), 3,35 и 3,50 (каждый м, общий 1H), 3,64 и 3,66 (каждый с, общий 3H), 3,69-3,87 (м, 3H), 3,90 (с, 3H), 3,94-4,06 (м, 2H), 4,25 и 4,39 (каждый м, общий 1H), 5,23 (м, 1H), 7,19 (м, 1H), 7,34-7,41 (м, 3H), 7,49 (м, 1H), 7,64 (м, 1H), 7,93 (с, 1H), 8,44 (м, 1H);
МС (ESI) m/z 548 (M++1).
Стадия 4) Синтез 4-((4S)-Фтор-1-(2-(1-метил-3-индолил)-6-бензоксазолилацетил)-(2S)-пирролидинилметокси)циклогексанкарбоновой кислоты
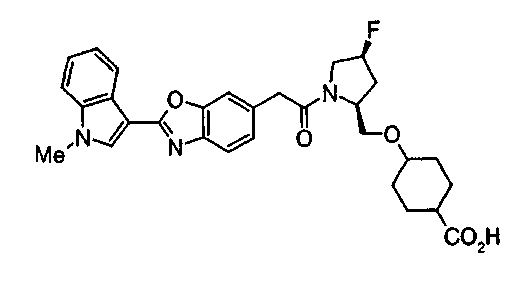
После добавления 0,25 н. NaOH (5,00 мл, 1,25 ммоль) к раствору метил-4-((4S)-Фтор-1-(2-(1-метил-3-индолил)-6-бензоксазолилацетил)-(2S)-пирролидинилметокси)циклогексанкарбоксилата (431 мг, 0,79 ммоль) в ТГФ (8,0 мл) смесь перемешивают при комнатной температуре в течение 5 часов. При охлаждении льдом реакционную смесь выливают в 1 н. HCl (10 мл). Таким образом осажденные кристаллы собирают фильтрованием, промывают водой и сушат при пониженном давлении, в результате чего указанное в заголовке соединение (396 мг, 94%) получают в виде бесцветного твердого вещества.
ИК (KBr) 2938, 2861, 1718, 1644, 1627, 1575, 1523, 1423 см-1;
1H-ЯМР (ДМСО-d6) δ: 1,15-1,27 (м, 2H), 1,32-1,45 (м, 2H), 1,89-2,11 (м, 4H), 2,14-2,29 (м, 3H), 3,23 (м, 1H), 3,55 (м, 1H), 3,75-3,95 (м, 6H), 3,97 (с, 3H), 4,11 и 4,38 (каждый м, общий 1H), 5,35 и 5,40 (каждый м, общий 1H), 7,22 (м, 1H), 7,31-7,39 (м, 2H), 7,55-7,67 (м, 3H), 8,35 (с, 1H), 12,03 (ушир.с, 1H);
МС (ESI) m/z 534 (M++1);
Анал. Вычисл. для С30Н32FN3O5: С, 67,53; H, 6,04; N, 7,87,
Найдено: С, 67,33; H, 6,06; N, 7,70.
Пример 41
транс-4-(1-((2-(5-Фтор-2-метилфениламино)-6-бензоксазолил)ацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоновая кислота:
(Стадия 1) Синтез метил-(2-(5-фтор-2-метилфениламино)-6-бензоксазолил)ацетата
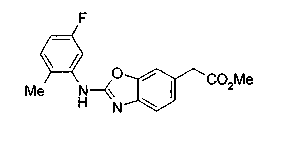
В метаноле (50 мл) 5-фтор-2-метилфенилизотиоцианат (2,00 г, 12,0 ммоль) добавляют к метил-4-амино-3-гидроксифенилацетату (2,17 г, 12,0 ммоль) при комнатной температуре. После перемешивания в течение 27 часов к реакционной смеси добавляют оксид ртути(II) (желтый) (3,12 г, 14,4 ммоль) и образовавшуюся смесь нагревают при 70°С в течение 4 часов. После охлаждения до комнатной температуры реакционную смесь фильтруют через целит. Фильтрат промывают метанолом. Фильтрат перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси хлороформ/этилацетат (10/1) метил-(2-(5-фтор-2-метилфениламино)-6-бензоксазолил)ацетат (1,73 г, 46%) получают в виде светло-коричневого масла.
1H-ЯМР (CDCl3) δ: 2,13 (с, 3H), 3,705 (с, 2H), 3,711 (с, 3H), 6,74 (дт, J=8,3, 2,7 Гц, 1H), 6,81 (ушир., 1H), 7,15 (дд, J=8,1,1,7 Гц, 2H), 7,31 (д, J=1,2 Гц, 1H), 7,44 (д, J=8,1 Гц, 1H), 8,09 (дд, J=11,0,2,7 Гц, 1H).
МС (ESI) m/z 315 (M++1).
(Стадия 2) Синтез (2-(5-фтор-2-метилфениламино)-6-бензоксазолил)уксусной кислоты
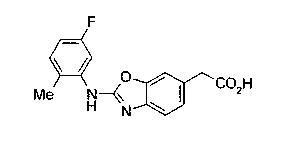
К раствору метил-(2-(5-фтор-2-метилфениламино)-6-бензоксазолил)ацетата (1,73 г, 5,50 ммоль) в смеси ТГФ/метанол (2:1, 30 мл) добавляют 1 н. NaOH (20 мл). После перемешивания при комнатной температуре в течение 3,5 часа смесь перегоняют при пониженном давлении для удаления растворителя. Остаток подкисляют 1 н. HCl. Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при пониженном давлении, получая при этом (2-(5-фтор-2-метилфениламино)-6-бензоксазолил)уксусную кислоту (1,60 г, 97%) в виде бесцветного кристаллического порошка.
1H-ЯМР (ДМСО-d6) δ: 2,49 (с, 3H), 3,64 (д, J=1,7 Гц, 2H), 6,87 (дт, J=8,3,1,5 Гц, 1H), 7,11 (д, J=8,1 Гц, 1H), 7,25 (т, J=7,3 Гц, 1H), 7,37 (д, J=8,1 Гц, 1H), 7,41 (с, 1H), 7,95 и 7,98 (каждый с, общий 1H, амидные изомеры), 9,80 (ушир., 1H). МС (ESI) m/z 301 (M++1).
(Стадия 3) Синтез метил-транс-4-(1-((2-(5-Фтор-2-метилфениламино)-6-бензоксазолил)ацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилата
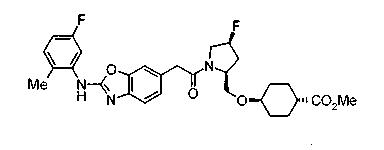
В ДМФ (5 мл) (2-(5-фтор-2-метилфенил)амино-6-бензоксазолил)уксусную кислоту, метил-транс-4-((4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилат (соединение, синтезированное в (стадии 3) примера 21) (259 мг, 1,0 ммоль), EDC·HCl (288 мг, 1,5 ммоль), HOBt (203 мг, 1,5 ммоль) и триэтиламин (0,70 мл, 5,0 ммоль) перемешивают при комнатной температуре в течение 18 часов. Реакционную смесь выливают в ледяную воду с последующей экстракцией этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси гексан/этилацетат (1/4) метил-транс-4-(1-((2-(5-Фтор-2-метилфениламино)-6-бензоксазолил)ацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилат (540 мг, 100%) получают в виде бесцветного аморфного вещества.
1H-ЯМР (CDCl3) δ: 1,20-1,83 (м, 6H), 1,96-2,12 (м, 4H), 2,20-2,51 (м, 5H), 3,24 (м, 1H), 3,34 и 3,50 (т и дд, J=8,8 и 9,0, 6,8 Гц соответственно, общий 1H, амидные изомеры), 3,65 и 3,67 (каждый с, общий 3H, амидные изомеры), 3,72-4,42 (м, 4H), 5,16-5,35 (м, 1H), 6,74 (т, J=7,8 Гц, 1H), 6,97 (ушир., 1H), 7,06-7,17 (м, 2H), 7,32 (д, J=7,3 Гц, 1H), 7,43 (т, J=6,8 Гц, 1H), 8,07 и 8,09 (каждый с, общий 1H, амидные изомеры).
МС (ESI) m/z 542 (M++1).
(Стадия 4) Синтез транс-4-(1-((2-(5-Фтор-2-метилфениламино)-6-бензоксазолил)ацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоновой кислоты
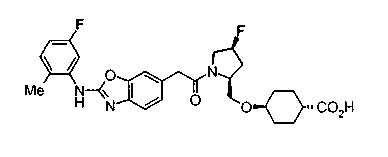
В смеси ТГФ/метанол (20/10 мл) растворяют метил-транс-4-(1-((2-(5-Фтор-2-метилфениламино)-6-бензоксазолил)ацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилат (540 мг, 1,0 ммоль) с последующим добавлением 1 н. NaOH (20 мл). После перемешивания при комнатной температуре в течение 14 часов смесь перегоняют при пониженном давлении для удаления растворителя. Остаток подкисляют 1 н. HCl. Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при пониженном давлении, получая при этом указанное в заголовке соединение (477 мг, 90%) в виде бесцветного кристаллического порошка.
ИК (ATR) ν 2939, 2864, 1701, 1639, 1610, 1576, 1437 см-1;
1H-ЯМР (ДМСО-d6) δ: 1,10-1,41 (м, 4H), 1,82-2,01 (м, 4H), 2,10-2,21 (м, 3H), 2,29 (с, 3H), 3,14-3,57 (м, 3H), 3,62-3,95 (м, 4H), 4,14 и 4,32 (м и кв., J=7,3 Гц, общий 1H, амидные изомеры), 5,31 и 5,37 (каждый д, J=53,4 и 53,4 Гц соответственно, общий 1H, амидные изомеры), 6,87 (дт, J=8,4, 2,7 Гц, 1H), 7,05 и 7,08 (каждый д, каждый J=8,3 Гц, общий 1H, амидные изомеры), 7,24 (т, J=6,8 Гц, 1H), 7,35 (т, J=8,3 Гц, 2H), 7,95 (д, J=11,5 Гц, 1H), 9,77 (ушир., 1H), 12,03 (ушир., 1H).
МС (ESI) m/z 528 (M++1);
Анал. Вычисл. для С28Н31F2N3O5·0,2H2О: C, 63,31; H, 5,96; N, 7,91; F, 7,15.
Найдено: C, 63,13; H, 5,89; N, 7,71; F, 7,15.
Пример 42
транс-4-(1-((2-(2-Хлор-6-метилфениламино)-7-фтор-6-бензоксазолил)ацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоновая кислота:
(Стадия 1) Синтез метил-(2-(2-хлор-6-метилфениламино)-7-фтор-6-бензоксазолил)ацетата
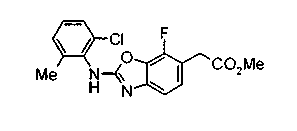
Метил-(4-амино-2-фтор-3-гидроксифенил)ацетат (1,0 г, 5,02 ммоль) растворяют в метаноле (30 мл). К образовавшемуся раствору добавляют 2-хлор-6-метилфенилизотиоцианат (841 мг, 4,58 ммоль) при комнатной температуре. После перемешивания образовавшейся смеси в течение 5 дней к ней добавляют оксид ртути(II) (желтый) (1,14 г, 4,36 ммоль). Смесь перемешивают при 70°С в течение 23 часов. После охлаждения реакционную смесь фильтруют через целит и промывают метанолом. Фильтрат перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси хлороформ/этилацетат (30/1) метил-(2-(2-хлор-6-метилфениламино)-7-фтор-6-бензоксазолил)ацетат (1,45 г, 95%) получают в виде красного аморфного вещества.
1H-ЯМР (CDCl3) δ: 2,38 (с, 3H), 3,71 (с, 2H), 3,74 (с, 3H), 7,05 (т, J=8,0 Гц, 1H), 7,14 (д, J=8,3 Гц, 1H), 7,20 (дд, J=7,6,2,2 Гц, 1H), 7,23 (с, 1H), 7,34 (д, J=7,3 Гц, 1H).
МС (ESI) m/z 349 (M++1), 351 (M++3).
(Стадия 2) Синтез (2-(2-хлор-6-метилфениламино)-7-фтор-6-бензоксазолил)уксусной кислоты
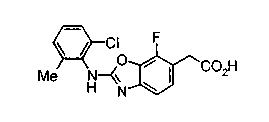
К раствору метил-(2-(2-хлор-6-метилфениламино)-7-фтор-6-бензоксазолил)ацетата (1,45 г, 4,16 ммоль) в смеси ТГФ/метанол (4:1, об./об., 100 мл) добавляют 1 н. NaOH (40 мл). После перемешивания при комнатной температуре в течение 17 часов реакционную смесь перегоняют при пониженном давлении для удаления растворителя. Остаток подкисляют 1 н. HCl. Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при пониженном давлении, получая при этом (2-(2-хлор-6-метилфениламино)-7-фтор-6-бензоксазолил)уксусную кислоту (1,30 г, 93%) в виде бесцветного кристаллического порошка.
1H-ЯМР (ДМСО-d6) δ: 2,28 (с, 3H), 3,36 (с, 2H), 7,01 и 7,03 (каждый с, общий 1H, амидные изомеры), 7,07 (т, J=8,1 Гц, 1H), 7,29 (д, J=7,6 Гц, 1H), 7,32 (д, J=6,4 Гц, 1H), 7,42 (д, J=7,6 Гц, 1H).
МС (ESI) m/z 335 (M++1), 337 (M++3).
(Стадия 3) Синтез метил-транс-4-(1-((2-(2-Хлор-6-метилфениламино)-7-фтор-6-бензоксазолил)ацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилата

В ДМФ (4 мл) (2-(2-хлор-6-метилфениламино)-7-фтор-6-бензоксазолил)уксусную кислоту (167 мг, 0,50 ммоль), метил-транс-4-((4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилат (соединение, синтезированное в (стадии 3) примера 21) (130 мг, 0,50 ммоль), EDC·HCl (144 мг, 0,75 ммоль), HOBT (101 мг, 0,75 ммоль) и триэтиламин (0,35 мл, 2,50 ммоль) перемешивают при комнатной температуре в течение 20 часов. Смесь выливают в ледяную воду с последующей экстракцией этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают тонкослойной хроматографией, посредством чего из элюатных фракций смеси хлороформ/ацетон (5/1) метил-транс-4-(1-((2-(2-хлор-6-метилфениламино)-7-фтор-6-бензоксазолил)ацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилат (238 мг, 83%) получают в виде бесцветного аморфного вещества.
1H-ЯМР (CDCl3) δ: 1,21-1,53 (м, 4H), 1,95-2,31 (м, 7H), 2,43 (с, 3H), 2,49 (м, 1H), 3,27 (м, 1H), 3,33 и 3,54 (т и дд, J=10,0 и 8,8, 6,4 Гц соответственно, общий 1H, амидные изомеры), 3,65 (с, 1H), 3,67 (с, 3H), 3,68-4,04 (м, 3H), 4,30 и 4,36 (кв. и м, J=6,8 Гц, общий 1H, 5,25 и 5,30 (каждый дт, J=54,2, 3,8 и 53,2, 2,7 Гц соответственно, общий 1H, амидные изомеры), 7,00-7,22 (м, 3H), 7,32 (д, J=7,3 Гц, 1H).
МС (ESI) m/z 576 (M++1), 578 (M++3).
(Стадия 4) Синтез транс-4-(1-((2-(2-хлор-6-метилфениламино)-7-фтор-6-бензоксазолил)ацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоновой кислоты

В смеси ТГФ/метанол (8/4, 12 мл) растворяют метил-транс-4-(1-((2-(2-Хлор-6-метилфениламино)-7-фтор-6-бензоксазолил)ацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилат (238 мг, 0,413 ммоль). К образовавшемуся раствору добавляют 1 н. NaOH (4 мл). После перемешивания при комнатной температуре в течение 14 часов реакционную смесь перегоняют при пониженном давлении для удаления растворителя. Остаток подкисляют 1 н. HCl. Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при пониженном давлении, получая при этом указанное в заголовке соединение (191 мг, 82%) в виде бесцветного кристаллического порошка.
ИК (ATR) ν 3743, 3674, 2939, 1704, 1635, 1583, 1504, 1452, см-1;
1H-ЯМР (ДМСО) δ: 1,10-1,42 (м, 5H), 1,81-2,22 (м, 6H), 2,28 (с, 3H), 3,18 (т, J=9,5 Гц, 1H), 3,42-4,02 (м, 6H), 4,11 и 4,35 (м и кв., J=7,1 Гц, общий 1H, амидные изомеры), 5,31 и 5,39 (каждый д, J=55,2 и 54,7 Гц соответственно, общий 1H, амидные изомеры), 6,96-7,03 (м, 2H), 7,28 (т, J=7,6 Гц, 1H), 7,32 (д, J=7,3 Гц, 1H), 7,42 (д, J=7,8 Гц, 1H).
МС (ESI) m/z 562 (M++1), 564 (M++3);
Анал. Вычисл. для С28Н30ClF2N3O5·0,5H2O: C, 58,90; H, 5,47; N, 7,36; Cl, 6,21; F, 6,65.
Найдено: C, 58,85; H, 5,44; N, 7,19; Cl, 6,18; F, 6,47.
Пример 43
транс-4-(1-((2-(5-хлор-2-метилфениламино)-7-фтор-6-бензоксазолил)ацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоновая кислота:
(Стадия 1) Синтез метил-(2-(5-хлор-2-метилфениламино)-7-фтор-6-бензоксазолил)ацетата
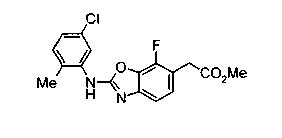
В метаноле (30 мл) растворяют метил-(4-амино-2-фтор-3-гидроксифенил)ацетат (1,0 г, 5,02 ммоль). К образовавшемуся раствору добавляют 5-хлор-2-метилфенилизотиоцианат (0,674 мл, 4,58 ммоль). После перемешивания смеси при комнатной температуре в течение 5 дней к ней добавляют оксид ртути(II) (желтый) (1,14 г, 4,36 ммоль). Образовавшуюся смесь перемешивают при 70°С в течение 6 часов. После охлаждения до комнатной температуры реакционную смесь фильтруют через целит и промывают метанолом. Фильтрат перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси хлороформ/этилацетат (30/1, об./об.) метил-(2-(5-хлор-2-метилфениламино)-7-фтор-6-бензоксазолил)ацетат (1,67 г, 100%) получают в виде коричневого твердого вещества.
1H-ЯМР (CDCl3) δ: 2,32 (с, 3H), 3,73 (с, 3H), 3,76 (с, 2H), 7,04 (дд, J=8,1, 2,2 Гц, 1H), 7,10 (дд, J=7,8, 2,2 Гц, 1H), 7,13 (т, J=8,1 Гц, 2H), 8,30 (д, J=2,2 Гц, 1H).
МС (ESI) m/z 349 (M++1), 351 (M++3).
(Стадия 2) Синтез (2-(5-хлор-2-метилфениламино)-7-фтор-6-бензоксазолил)уксусной кислоты
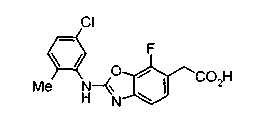
В смеси ТГФ/метанол (4/1, об./об., 100 мл) растворяют метил-(2-(5-хлор-2-метилфениламино)-7-фтор-6-бензоксазолил)ацетат (1,67 г, 4,79 ммоль). К образовавшемуся раствору добавляют 1 н. NaOH (40 мл). После перемешивания при комнатной температуре в течение 12 часов реакционную смесь перегоняют при пониженном давлении для удаления растворителя. Остаток подкисляют 1 н. HCl. Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при пониженном давлении, получая при этом (2-(5-хлор-2-метилфениламино)-7-фтор-6-бензоксазолил)уксусную кислоту (1,39 г, 87%) в виде бесцветного кристаллического порошка.
1H-ЯМР (ДМСО-d6) δ: 2,30 (с, 3H), 3,71 (с, 2H), 7,12 (дд, J=8,1, 2,0 Гц, 1H), 7,15 (д, J=7,3 Гц, 1H), 7,23 (д, J=8,1 Гц, 1Н), 7,26 (д, J=8,1 Гц, 1H), 8,09 (с, 1H), 10,06 (с, 1H), 12,46 (ушир., 1H). МС (ESI) m/z 335 (M++1), 337 (M++3).
(Стадия 3) Синтез метил-транс-4-(1-((2-(5-хлор-2-метилфениламино)-7-фтор-6-бензоксазолил)ацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилата

В ДМФ (4 мл) (2-(5-хлор-2-метилфениламино)-7-фтор-6-бензоксазолил)уксусную кислоту (167 мг, 0,50 ммоль), метил-транс-4-((4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилат (соединение, синтезированное в (стадии 3) примера 21) (130 мг, 0,50 ммоль), EDC·HCl (144 мг, 0,75 ммоль), HOBT (101 мг, 0,75 ммоль) и триэтиламин (0,35 мл, 2,50 ммоль) перемешивают при комнатной температуре в течение 19 часов. Смесь выливают в ледяную воду с последующей экстракцией этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией с использованием тонкослойной пластины, посредством чего из элюатных фракций смеси хлороформ/ацетон (5/1, об./об,) метил-транс-4-(1-((2-(5-хлор-2-метилфениламино)-7-фтор-6-бензоксазолил)ацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилат (261 мг, 91%) получают в виде бесцветного аморфного вещества.
1H-ЯМР (CDCl3) δ: 1,22-1,56 (м, 5H), 1,95-2,29 (м, 7H), 2,30 (с, 3H), 2,50 (м, 1H), 3,21-3,60 (м, 2H), 3,65 и 3,67 (каждый с, общий 3H, амидные изомеры), 3,70 (с, 1H), 3,17-4,05 (м, 3H), 4,31-4,43 (м, 1H), 5,27 и 5,31(каждый дт, J=53,7, 4,4 и 52,7, 3,8 Гц соответственно, общий 1H, амидные изомеры), 7,02-7,14 (м, 4H), 7,22 (д, J=8,8 Гц, 1H), 8,26 (с, 1H).
МС (ESI) m/z 576 (M++1), 578 (M++3).
(Стадия 4) Синтез транс-4-(1-((2-(5-хлор-2-метилфениламино)-7-фтор-6-бензоксазолил)ацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоновой кислоты
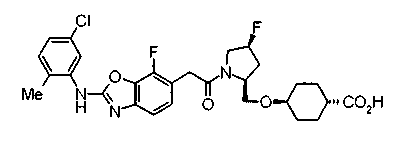
В смеси ТГФ/метанол (4:1, об./об., 12 мл) растворяют метил-транс-4-(1-((2-(5-хлор-2-метилфениламино)-7-фтор-6-бензоксазолил)ацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилат (202 мг, 0,359 ммоль). К образовавшемуся раствору добавляют 1 н. NaOH (4 мл). После перемешивания при комнатной температуре в течение 14 часов реакционную смесь перегоняют при пониженном давлении для удаления растворителя. Остаток подкисляют 1 н. HCl. Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при пониженном давлении, получая при этом указанное в заголовке соединение (202 мг, 79%) в виде бесцветного кристаллического порошка.
ИК (ATR) ν 3168, 2937, 1702, 1639, 1577, 1450 см-1;
1H-ЯМР (ДМСО-d6) δ: 1,09-1,41 (м, 5H), 1,83-2,22 (м, 6H), 2,30 (с, 3H), 3,19 (т, J=9,8 Гц, 1H), 3,44-4,41 (м, 7H), 5,32 и 5,43 (каждый д, каждый J=54,4 Гц, общий 1H, амидные изомеры), 7,05-7,10 (м, 1H), 7,12 (д, J=8,1 Гц, 1H), 7,22 (д, J=6,3 Гц, 1H), 7,27 (д, J=8,1 Гц, 1H), 8,10 (с, 1H), 10,04 (ушир., 1H).
МС (ESI) m/z 562 (M++1), 564 (M++3);
Анал. Вычисл. для С28Н30ClF2N3O5·0,5H2О: C, 58,90; H, 5,47; N, 7,36; Cl, 6,21; F, 6,65.
Найдено: C, 59,13; H, 5,40; N, 7,15; Cl, 6,21; F, 6,48.
Пример 44
транс-4-(1-((2-(5-Фтор-2-метилфениламино)-7-фтор-6-бензоксазолил)ацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоновая кислота:
(Стадия 1) Синтез метил-(2-(5-фтор-2-метилфениламино)-7-фтор-6-бензоксазолил)ацетата
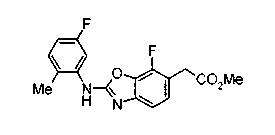
В метаноле (30 мл) растворяют метил-(4-амино-2-фтор-3-гидроксифенил)ацетат (1,0 г, 5,02 ммоль). К образовавшемуся раствору добавляют 5-фтор-2-метилфенилизотиоцианат (1,0 г, 5,98 ммоль). После перемешивания образовавшейся смеси при комнатной температуре в течение 5 дней к ней добавляют оксид ртути(II) (желтый) (1,14 г, 4,36 ммоль). Смесь перемешивают при 70°С в течение 6 часов. После охлаждения до комнатной температуры реакционную смесь фильтруют через целит и промывают метанолом. Фильтрат перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси хлороформ/этилацетат (30/1, об./об.) метил-(2-(5-фтор-2-метилфениламино)-7-фтор-6-бензоксазолил)ацетат (810 мг, 56% (2 стадии) получают в виде розового твердого вещества.
1H-ЯМР (CDCl3) δ: 2,32 (с, 3H), 3,72 (с, 3H), 3,76 (с, 2H), 6,75 (дт, J=8,1, 2,7 Гц, 1H), 6,87 (ушир., 1H), 7,11 (т, J=6,6 Гц, 1H), 7,15 (т, J=6,9 Гц, 1H), 8,11 (дд, J=11,0, 6,7 Гц, 1H).
МС (ESI) m/z 333 (M++1).
(Стадия 2) Синтез (2-(5-фтор-2-метилфениламино)-7-фтор-6-бензоксазолил)уксусной кислоты
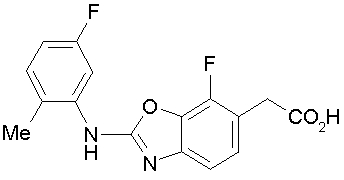
В смеси ТГФ/метанол (2:1, об./об., 90 мл) растворяют метил-(2-(5-фтор-2-метилфениламино)-7-фтор-6-бензоксазолил)ацетат (810 мг, 2,44 ммоль). К образовавшемуся раствору добавляют 1 н. NaOH (30 мл). После перемешивания при комнатной температуре в течение 12 часов реакционную смесь перегоняют при пониженном давлении для удаления растворителя. Остаток подкисляют 1 н. HCl. Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при пониженном давлении, получая при этом (2-(5-фтор-2-метилфениламино)-7-фтор-6-бензоксазолил)уксусную кислоту (700 мг, 90%) в виде светло-коричневого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 2,29 (с, 3H), 3,68 (с, 2H), 6,89 (дт, J=7,0, l,7 Гц, 1H), 7,14 (т, J=6,4 Гц, 1H), 7,20 и 7,22 (каждый с, общий 1H, амидные изомеры), 7,25 (т, J=7,4 Гц, 1H), 7,90 (д, J=11,3 Гц, 1H), 10,06 (ушир., 1H).
МС (ESI) m/z 319 (M++1); (Стадия 3) Синтез метил-транс-4-(1-((2-(5-фтор-2-метилфениламино)-7-фтор-6-бензоксазолил)ацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилата
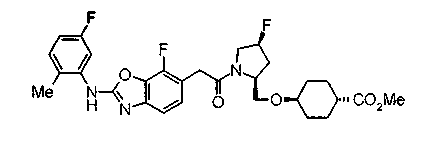
В ДМФ (4 мл) растворяют (2-(5-фтор-2-метилфениламино)-7-фтор-6-бензоксазолил)уксусную кислоту (159 мг, 0,50 ммоль), метил-транс-4-((4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилат (соединение, синтезированное в (стадии 3) примера 21) (130 мг, 0,50 ммоль), EDC·HCl (144 мг, 0,75 ммоль), HOBt (101 мг, 0,75 ммоль) и триэтиламин (0,35 мл, 2,50 ммоль). Образовавшийся раствор перемешивают при комнатной температуре в течение 19 часов. Смесь выливают в ледяную воду с последующей экстракцией этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией с использованием тонкой пластины, посредством чего из элюатных фракций смеси хлороформ/ацетон (5/1) метил-транс-4-(1-((2-(5-фтор-2-метилфениламино)-7-фтор-6-бензоксазолил)ацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилат (243 мг, 87%) получают в виде бесцветного аморфного вещества.
1H-ЯМР (CDCl3) δ: 1,21-1,62 (м, 4H), 1,97-2,29 (м, 6H), 2,31 (с, 3H), 2,51 (м, 1H), 3,22-3,61 (м, 2H), 3,65 (с, 1H), 3,67 (с, 3H), 3,70 (с, 1H), 3,71-4,09 (м, 3H), 4,31-4,44 (м, 1H), 5,18-5,41 (м, 1H), 6,75 (т, J=6,3 Гц, 1H), 7,09-7,18 (м, 3H), 7,21 (д, J=9,5 Гц, 1H), 8,07 (дд, J=10,7, 2,2 Гц, 1H).
МС (ESI) m/z 560 (M++1).
(Стадия 4) Синтез транс-4-(1-((2-(5-фтор-2-метилфениламино)-7-фтор-6-бензоксазолил)ацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоновой кислоты
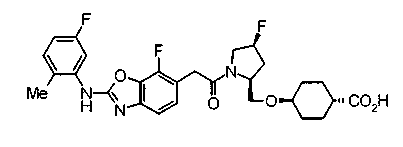
В смеси ТГФ/метанол (8/4) растворяют метил-транс-4-(1-((2-(5-фтор-2-метилфениламино)-7-фтор-6-бензоксазолил)ацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилат (243 мг, 0,434 ммоль). К образовавшемуся раствору добавляют 1 н. NaOH (4 мл). После перемешивания при комнатной температуре в течение 14 часов реакционную смесь перегоняют при пониженном давлении для удаления растворителя. Остаток подкисляют 1 н. HCl. Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при пониженном давлении, получая при этом указанное в заголовке соединение (184 мг, 78%) в виде бесцветного твердого вещества.
ИК (ATR) ν 3224, 2937, 1720, 1703, 1639, 1610, 1579, 1452 см-1;
1H-ЯМР (ДМСО-d6) δ: 1,12-1,43 (м, 4H), 1,82-2,22 (м, 7H), 2,30 (с, 3H), 3,20 (т, J=10,0 Гц, 1H), 3,40-4,08 (м, 6H), 4,13 и 4,36 (м и кв., J=7,1 Гц, общий 1Н, амидные изомеры), 5,32 и 5,40 (дт и д, J=54,4, 4,4 и 53,5 Гц соответственно, общий 1H, амидные изомеры), 6,89 (дт, J=8,3, 2,0 Гц, 1H), 7,05 и 7,08 (каждый т, J=7,1 и 7,3 Гц соответственно, общий 1H, амидные изомеры), 7,21 (дд, J=8,1, 2,4 Гц, 1H), 7,26 (т, J=7,8 Гц, 1H), 7,92 (д, J=11,5 Гц, 1H), 10,04 (ушир., 1H).
МС (ESI) m/z 546 (M++1);
Анал. Вычисл. для С28Н30F3N3O5·0,4H2О: C, 60,84; H, 5,62; N, 7,60; F, 10,31.
Найдено: C, 60,91; H, 5,49; N, 7,41; F, 10,32.
Пример 45
транс-4-(1-((2-(4-Фтор-2-метилфениламино)-7-фтор-6-бензоксазолил)ацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоновая кислота:
(Стадия 1) Синтез метил-(2-(4-фтор-2-метилфениламино)-7-фтор-6-бензоксазолил)ацетата
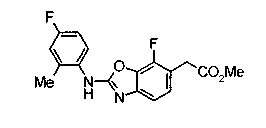
В метаноле (30 мл) растворяют метил-(4-амино-2-фтор-3-гидроксифенил)ацетат (1,0 г, 5,02 ммоль). К образовавшемуся раствору добавляют 4-фтор-2-метилфенилизотиоцианат (0,74 мг, 5,23 ммоль). После перемешивания смеси при комнатной температуре в течение 5 дней к ней добавляют оксид ртути(II) (желтый) (1,14 г, 4,36 ммоль). Смесь перемешивают при 70°С в течение 6 часов. После охлаждения до комнатной температуры реакционную смесь фильтруют через целит и промывают метанолом. Фильтрат перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси хлороформ/этилацетат (30/1) метил-(2-(4-фтор-2-метилфениламино)-7-фтор-6-бензоксазолил)ацетат (1,32 г, 91%) получают в виде бесцветного твердого вещества.
1H-ЯМР (CDCl3) δ: 2,34 (с, 3H), 3,72 (с, 3H), 3,75 (с, 2H), 6,71 (ушир., 1H), 6,92-7,01 (м, 2H), 7,09 (т, J=8,1 Гц, 1H), 7,18 (д, J=8,1 Гц, 1H), 7,93 (дд, J=8,8, 5,4 Гц, 1H).
МС (ESI) m/z 333 (M++1).
(Стадия 2) Синтез (2-(4-фтор-2-метилфениламино)-7-фтор-6-бензоксазолил)уксусной кислоты
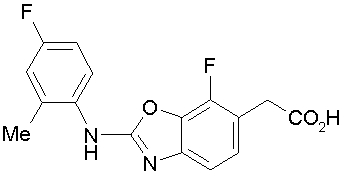
В смеси ТГФ/метанол (2/1, об./об., 120 мл) растворяют метил-(2-(4-фтор-2-метилфениламино)-7-фтор-6-бензоксазолил)ацетат (1,32 г, 3,97 ммоль). К образовавшемуся раствору добавляют 1 н. NaOH (40 мл). После перемешивания при комнатной температуре в течение 12 часов реакционную смесь перегоняют при пониженном давлении для удаления растворителя. Остаток подкисляют 1 н. HCl. Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при пониженном давлении, получая при этом (2-(4-фтор-2-метилфениламино)-7-фтор-6-бензоксазолил)уксусную кислоту (1,38 г, 100%) в виде бесцветного твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 2,26 (с, 3H), 3,68 (с, 2H), 7,06-7,14 (м, 4H), 7,75 (м, 1H), 9,91 (с, 1H).
МС (ESI) m/z 319 (M++1).
(Стадия 3) Синтез метил-транс-4-(1-((2-(4-фтор-2-метилфениламино)-7-фтор-6-бензоксазолил)ацетил)-(4S)-фтор-(2S)- пирролидинилметокси)циклогексанкарбоксилата
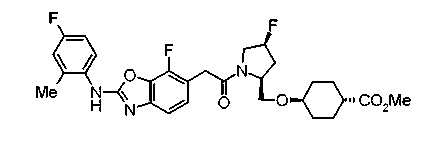
К смеси метил-(2-(4-фтор-2-метилфениламино)-7-фтор-6-бензоксазолил)ацетата (159 мг, 0,50 ммоль), метил-транс-4-((4S)-фтор-(2S)-пирролидинилметоки)циклогексанкарбоксилата (соединение, синтезированное в (стадии 3) примера 21) (130 мг, 0,50 ммоль), EDC·HCl (144 мг, 0,75 ммоль), HOBT (101 мг, 0,75 ммоль) и триэтиламина (0,35 мл, 2,50 ммоль) добавляют ДМФ (4 мл). Образовавшуюся смесь перемешивают при комнатной температуре в течение 19 часов. Реакционную смесь выливают в ледяную воду с последующей экстракцией этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией с использованием тонкослойной пластины силикагеля (ТСХ), посредством чего из элюатных фракций смеси хлороформ/ацетон (5/1) метил-транс-4-(1-((2-(4-фтор-2-метилфениламино)-7-фтор-6-бензоксазолил)ацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилат (245 мг, 88%) получают в виде бесцветного аморфного вещества.
1H-ЯМР (CDCl3) δ: 1,27-1,57 (м, 5H), 1,96-2,28 (м, 7H), 2,32 (с, 3H), 2,45 и 2,51 (каждый д, J=15,7 и 14,9 Гц соответственно, общий 1H, амидные изомеры), 3,24-3,41 (м, 1H), 3,55 (м, 1H), 3,65 и 3,67 (каждый с, общий 3H, амидные изомеры), 3,72-4,06 (м, 3H), 4,31-4,43 (м, 1H), 5,27 и 5,31 (каждый дт, J=54,0, 4,7 и 53,2, 4,3 Гц соответственно, общий 1H, амидные изомеры), 6,92-7,08 (м, 3H), 7,13 (т, J=8,1 Гц, 1H), 7,80 (м, 1H).
МС (ESI) m/z 560 (M++1).
(Стадия 4) Синтез транс-4-(1-((2-(4-фтор-2-метилфениламино)-7-фтор-6-бензоксазолил)ацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоновой кислоты
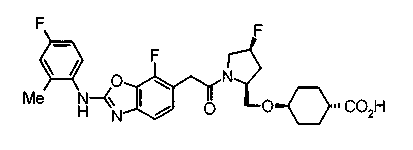
В смеси ТГФ/метанол (2:1, 12 мл)) растворяют метил-транс-4-(1-((2-(4-фтор-2-метилфениламино)-7-фтор-6-бензоксазолил)ацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилат (245 мг, 0,438 ммоль). К образовавшемуся раствору добавляют 1 н. NaOH (4 мл). После перемешивания при комнатной температуре в течение 14 часов реакционную смесь перегоняют при пониженном давлении для удаления растворителя. Остаток подкисляют 1 н. HCl. Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при пониженном давлении, получая при этом указанное в заголовке соединение (199 мг, 83%) в виде бесцветного твердого вещества.
ИК (ATR) ν 3165, 2941, 1699, 1635, 1581, 1496, 1454 см-1;
1H-ЯМР (ДМСО-d6) δ: 1,10-1,27 (м, 2H), 1,34 (т, J=12,4 Гц, 2H), 1,82-2,22 (м, 7H), 2,30 (с, 3H), 3,19 (т, J=8,8 Гц, 1H), 3,40-4,03 (м, 6H), 4,13 и 4,35 (м и кв., J=7,1 Гц, общий 1H, амидные изомеры), 5,32 и 5,40 (д и дт, J=54,9, 4,6 и 53,7 Гц соответственно, общий 1H, амидные изомеры), 6,99-7,16 (м, 4H), 7,76 (дд, J=8,8,5,6 Гц, 1H), 9,89 (ушир., 1H), 12,04 (ушир., 1H).
МС (ESI) m/z 546 (M++1);
Анал. Вычисл. для С28Н30F3N3O5·0,4H2О: C, 60,84; H, 5,62; N, 7,60; F, 10,31.
Найдено: C, 61,15; H, 5,71; N, 7,15; F, 9,97.
Пример 46
транс-4-(1-((2-(3-Фтор-2-метилфениламино)-7-фтор-6-бензоксазолил)ацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоновая кислота:
(Стадия 1) Синтез метил-(2-(3-фтор-2-метилфениламино)-7-фтор-6-бензоксазолил)ацетата
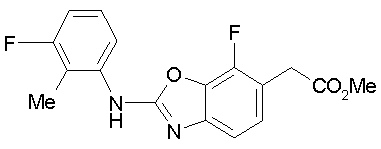
В ТГФ (20 мл) растворяют 3-фтор-2-метиланилин (0,57 мл, 5,0 ммоль). К образовавшемуся раствору добавляют тиофосген (990 мг, 5,0 ммоль) при перемешивании при комнатной температуре. После перемешивания реакционной смеси в течение 4 часов при комнатной температуре к ней добавляют метил-(4-амино-2-фтор-3-гидроксифенил)ацетат (996 мг, 5,0 ммоль). Образовавшуюся смесь перемешивают далее при комнатной температуре в течение 2 дней. Добавляют оксид ртути(II) (желтый) (1,08 г, 5,0 ммоль) и смесь перемешивают при 70°С в течение 4,5 часа. После охлаждения до комнатной температуры реакционную смесь фильтруют через целит и промывают метанолом. Фильтрат перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси н-гексан/этилацетат (4/1) метил-(2-(3-фтор-2-метилфениламино)-7-фтор-6-бензоксазолил)ацетат (1,21 г, 73%) получают в виде бесцветного твердого вещества.
1H-ЯМР (CDCl3) δ: 2,27 (с, 3H), 3,72 (с, 3H), 3,76 (с, 2H), 6,87 (т, J=8,8 Гц, 1H), 7,09 (т, J=6,6 Гц, 1H), 7,22 (д, J=7,8 Гц, 1H), 7,27 (м, 1H), 7,93 (д, J=7,8 Гц, 1H).
МС (ESI) m/z 333 (M++1).
(Стадия 2) Синтез (2-(3-фтор-2-метилфениламино)-7-фтор-6-бензоксазолил)уксусной кислоты
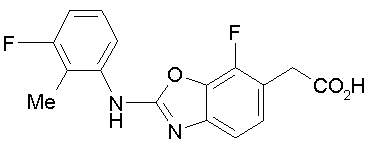
В смеси ТГФ/метанол (2:1, 60 мл) растворяют метил-(2-(3-фтор-2-метилфениламино)-7-фтор-6-бензоксазолил)ацетат (1,21 г, 3,64 ммоль). К образовавшемуся раствору добавляют 1 н. NaOH (20 мл). После перемешивания при комнатной температуре в течение 17 часов реакционную смесь перегоняют при пониженном давлении для удаления растворителя. Остаток подкисляют 1 н. HCl. Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при пониженном давлении, получая при этом (2-(3-фтор-2-метилфениламино)-7-фтор-6-бензоксазолил)уксусную кислоту (1,10 г, 15%) в виде бесцветного твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 2,21 (д, J=2,0 Гц, 3H), 3,66 (с, 2H), 7,00 (т, J=8,8 Гц, 1H), 7,10-7,16 (м, 2H), 7,26 и 7,30 (каждый д, J=7,8 и 8,1 Гц соответственно, общий 1H, амидные изомеры), 7,72 (д, J=7,1 Гц, 1H), 10,10 (ушир., 1H). МС (ESI) m/z 319 (M++1).
(Стадия 3) Синтез метил-транс-4-(1-((2-(3-фтор-2-метилфениламино)-7-фтор-6-бензоксазолил)ацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилата
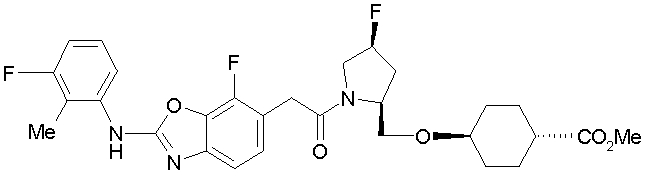
К смеси (2-(3-фтор-2-метилфениламино)-7-фтор-6-бензоксазолил)уксусной кислоты (159 мг, 0,50 ммоль), метил-транс-4-((4S)-фтор-(2S)-пирролидинилметоки)циклогексанкарбоксилата (соединение, синтезированное в (стадии 3) примера 21) (130 мг, 0,50 ммоль), EDC·HCl (144 мг, 0,75 ммоль), HOBT (101 мг, 0,75 ммоль) и триэтиламина (0,35 мл, 2,50 ммоль) добавляют ДМФ (4 мл). Образовавшуюся смесь перемешивают при комнатной температуре в течение 18 часов. Реакционную смесь выливают в ледяную воду с последующей экстракцией этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией с использованием тонкослойной пластины (ТСХ), посредством чего из элюатных фракций смеси хлороформ/ацетон (5/1) метил-транс-4-(1-((2-(3-фтор-2-метилфениламино)-7-фтор-6-бензоксазолил)ацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилат (264 мг, 94%) получают в виде бесцветного аморфного вещества.
1H-ЯМР (CDCl3) δ: 1,91-1,58 (м, 4H), 1,96-2,21 (м, 5H), 2,25 (д, J=1,7 Гц, 3H), 2,27 и 2,48 (каждый м, общий 1H, амидные изомеры), 3,22-3,33 (м, 1H), 3,35 и 3,56 (т и тт, J=8,5 и 9,3, 6,1 Гц соответственно, общий 1H, амидные изомеры), 3,65 и 3,67 (каждый с, общий 3H, амидные изомеры), 3,69 (с, 1H), 3,70-4,02 (м, 5H), 4,33 и 4,39 (кв. и дт, J=7,6 и 7,8, 4,4 Гц, общий 1H, амидные изомеры), 5,27 и 5,31 (каждый дт,=54,0, 4,1 и 53,0, 3,9 Гц, общий 1H, амидные изомеры), 6,86 (т, J=8,3 Гц, 1H), 7,06 и 7,08 (каждый т, J=7,8 и 11,7 Гц соответственно, общий 1H, амидные изомеры), 7,16-7,29 (м, 2H), 7,88 (дд, J=8,1, 2,6 Гц, 1H).
МС (ESI) m/z 560 (M++1).
(Стадия 4) Синтез транс-4-(1-((2-(3-фтор-2-метилфениламино)-7-фтор-6-бензоксазолил)ацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоновой кислоты

В смеси ТГФ/метанол (2:1, 63 мл)) растворяют метил-транс-4-(1-((2-(3-фтор-2-метилфениламино)-7-фтор-6-бензоксазолил)ацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилат (264 мг, 0,472 ммоль). К образовавшемуся раствору добавляют 1 н. NaOH (10 мл). После перемешивания при комнатной температуре в течение 17 часов реакционную смесь перегоняют при пониженном давлении для удаления растворителя. Остаток подкисляют 1 н. HCl. Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при пониженном давлении, получая при этом указанное в заголовке соединение (199 мг, 83%) в виде бесцветного твердого вещества.
ИК (ATR) ν 3167, 2939, 1701, 1641, 1581, 1452 см-1;
1H-ЯМР (ДМСО-d6) δ: 1,09-1,39 (м, 5H), 1,83-2,03 (м, 5H), 2,08-2,17 (м, 2H), 2,50 (д, J=2,0 Гц, 3H), 3,19 (т, J=8,8 Гц, 2H), 3,41-4,06 (м, 4H), 4,12 и 4,36 (м и кв., J=6,8 Гц, общий 1H, амидные изомеры), 5,32 и 5,40 (дт и д, J=54,5, 5,4 и 54,8 Гц соответственно, общий 1H, амидные изомеры), 7,00 (т, J=8,8 Гц, 1H), 7,05 (м, 1H), 7,13 и 7,15 (каждый д, J=2,7 и 2,9 Гц соответственно, общий 1H, амидные изомеры), 7/28 (дд, J=14,9, 8,1 Гц, 1H), 7,72 (д, J=8,1 Гц, 1H).
МС (ESI) m/z 546 (M++1);
Анал. Вычисл. для С28Н25F3N3O5 0,1HCl·1,4H2О: C, 58,55; H, 5,77; N, 7,32; F, 9,92.
Найдено: C, 58,24; H, 5,38; N, 7,09; F, 9,63.
Пример 47
транс-4-(1-((2-(5-Фтор-2-метилфениламино)-4-фтор-6-бензоксазолил)ацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоновая кислота:
(Стадия 1) Синтез 4,6-дифтор-2-гидроксинитробензола
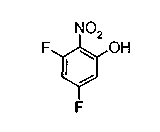
При перемешивании при комнатной температуре 10 н. NaOH (18 мл, 180 ммоль) по каплям добавляют к раствору 2,4,6-трифторнитробензола (15,0 г, 84,7 ммоль) в ДМСО (75 мл). После завершения добавления по каплям реакционную смесь перемешивают при комнатной температуре в течение 18 часов. Реакционную смесь выливают в 1 н. HCl для нейтрализации ее с последующей экстракцией эфиром. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси ацетат/хлороформ (1/10) 4,6-дифтор-2-гидроксинитробензол (12,5 г, 84%) получают в виде желтого твердого вещества.
1H-ЯМР (CDCl3) δ: 6,55-6,60 (м, 1H), 6,68-6,71 (м, 1H), 10,90 (с, 1H).
(Стадия 2) Синтез 2-бензилокси-4,6-дифторнитробензола
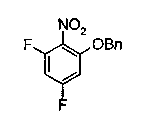
К раствору 4,6-дифтор-2-гидроксинитробензола (12,5 г, 71,1 ммоль) в ДМФ (150 мл) добавляют гидрид натрия (60% в масле, 3,70 г, 92,4 ммоль) при перемешивании при 0°С и реакционную смесь перемешивают в течение 15 минут. При 0°С по каплям добавляют бензилбромид (11,0 мл, 92,4 ммоль). После завершения добавления по каплям реакционную смесь перемешивают при 80°С в течение 18 часов. После охлаждения до комнатной температуры смесь выливают в смесь лед - 1 н. HCl для нейтрализации ее с последующей экстракцией эфиром. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси этилацетат/гексан (1/5) 2-бензилокси-4,6-дифторнитробензол (13,7 г, 73%) получают в виде желтого твердого вещества.
1H-ЯМР (CDCl3) δ: 5,18 (с, 2H), 6,55-6,63 (м, 2H), 7,32-7,46 (м, 5H).
(Стадия 3) Синтез трет-бутилэтил-5-бензилокси-3-фтор-4-нитрофенилмалоната
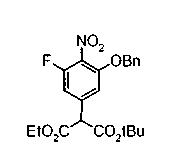
К раствору трет-бутилэтилмалоната (10,0 г, 51,0 ммоль) в ДМФ (200 мл) добавляют гидрид натрия (60% в масле, 2,04 г, 51,0 ммоль) при 0°С при перемешивании. Реакционную смесь перемешивают при такой же температуре в течение 30 минут. К реакционной смеси при 0°С по каплям добавляют раствор 2-бензилокси-4,6-дифторнитробензола (9,02 г, 34,0 ммоль) в ДМФ (60 мл). Реакционную смесь затем перемешивают при 80°С в течение 18 часов. После охлаждения до комнатной температуры реакционную смесь выливают в смесь лед - 1 н. HCl для нейтрализации ее с последующей экстракцией эфиром. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия, затем перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси этилацетат/гексан (1/5) трет-бутилэтил-5-бензилокси-3-фтор-4-нитрофенилмалонат (2,91 г, 17%) получают в виде желтого масла.
1H-ЯМР (CDCl3) δ: 1,24-1,30 (м, 3H), 1,47 (с, 9 H), 4,11-4,28 (м, 2H), 4,47 (с, 1Н), 5,20 (с, 2H), 6,91 (д, J=9,6 Гц, 1H), 7,00 (с, 1H), 7,32-7,39 (м, 5 H).
Стадия (4) Синтез этил-5-бензилокси-3-фтор-4-нитрофенилацетата

В метиленхлориде (30 мл) растворяют трет-бутилэтил-5-бензилокси-3-фтор-4-нитрофенилмалонат (2,89 г, 6,67 ммоль). К образовавшемуся раствору добавляют трифторуксусную кислоту (30 мл). Образовавшуюся смесь перемешивают при комнатной температуре в течение 3,5 часа. Реакционную смесь перегоняют при пониженном давлении для удаления растворителя. Остаток нейтрализуют водным насыщенным раствором бикарбоната натрия с последующей экстракцией этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси этилацетат/гексан (1/5) этил-5-бензилокси-3-фтор-4-нитрофенилацетат (1,57 г, 70%) получают в виде желтого масла.
1H-ЯМР (CDCl3) δ: 1,27 (т, J=7,2 Гц, 3H), 3,60 (с, 2H), 4,17 (кв., J=7,2, 14,4 Гц, 2H), 5,20 (с, 2H), 6,80 (д, J=10,0 Гц, 1H), 6,84 (с, 1H), 7,27-7,40 (м, 5 H).
(Стадия 5) Синтез этил-4-амино-3-фтор-5-гидроксифенилацетата
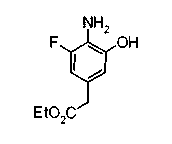
Этил-3-фтор-4-нитро-5-бензилоксифенилацетат (1,54 г, 4,62 ммоль) и катализатор 10% палладий/уголь (122 мг) подвергают каталитическому гидрированию в течение 20 часов при нормальном давлении при перемешивании при комнатной температуре в EtOH (20 мл). Из реакционной смеси катализатор отделяют фильтрованием. Фильтрат перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси этилацетат/гексан (1/2) этил-4-амино-3-фтор-5-гидоксифенилацетат (639 мг, 65%) получают в виде коричневого масла.
1H-ЯМР (CDCl3) δ: 1,25 (т, J=7,2 Гц, 3H), 3,43 (с, 2H), 4,15 (кв., J=7,2, 14,4 Гц, 2H), 6,48 (с, 1H), 6,54 (д, J=10,4 Гц, 1H).
(Стадия 6) Синтез 5-фтор-2-метилфенилизотиоцианата
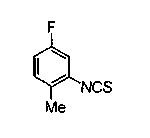
При перемешивании при 0°С раствор 5-хлор-2-метиланилина (1,23 г, 9,84 ммоль) в метиленхлориде (10 мл) добавляют по каплям к смеси карбоната кальция (2,46 г, 24,6 ммоль) и тиофосгена (750 мкл, 9,84 ммоль) в смеси метиленхлорид/вода (1/1, 40 мл). После завершения добавления реакционную смесь перемешивают дополнительно при 0°С в течение 35 минут.Реакционную смесь выливают в смесь лед - 1 н. HCl с последующей экстракцией хлороформом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя, получая при этом 5-фтор-2-метилфенилизотиоцианат (1,45 г, 88%) в виде коричневого масла.
МС (ESI) m/z 167 (M+).
(Стадия 7) Синтез этил-(2-(5-фтор-2-метилфениламино)-4-фтор-6-бензоксазолил)ацетата
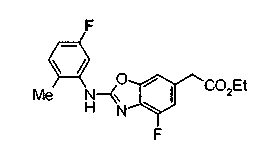
При перемешивании при комнатной температуре этил-4-амино-3-фтор-5-гидроксифенилацетат (233 мг, 1,10 ммоль) добавляют к раствору 5-фтор-2-метилфенилизотиоцианата (184 мг, 1,10 ммоль) в метаноле (20 мл). Образовавшуюся смесь перемешивают при 70°С в течение 1 часа. К реакционной смеси добавляют оксид ртути(II) (желтый) (262 мг, 1,21 ммоль) с последующим перемешиванием в течение дополнительных 30 минут. После охлаждения до комнатной температуры реакционную смесь фильтруют через целит. Фильтрат промывают метанолом и затем перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси хлороформ/метанол (10/1) этил-(2-(5-фтор-2-метилфениламино)-4-фтор-6-бензоксазолил)ацетат (216 мг, 57%) получают в виде светло-желтого твердого вещества.
1H-ЯМР (CDCl3) δ: 1,28 (т, J=7,2 Гц, 3H), 2,32 (с, 3H), 3,67 (с, 2H), 4,18 (кв., J=6,8, 14,4 Гц, 2H), 6,74-6,79 (м, 1H), 6,92-6,97 (м, 2H), 7,14-7,17 (м, 2H), 8,05-8,09 (м, 1H). МС (ESI) m/z 347 (M++1).
(Стадия 8) Синтез (2-(5-фтор-5-метилфениламино)-4-фтор-6-бензоксазолил)уксусной кислоты
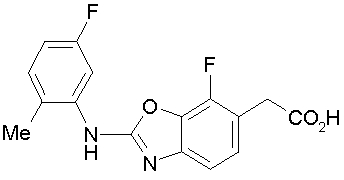
Этил-(2-(5-фтор-2-метилфениламино)-4-фтор-6-бензоксазолил)ацетат (215 мг, 0,62 ммоль) растворяют в смеси ТГФ/метанол (1/1, 20 мл). К образовавшемуся раствору добавляют 0,25 н. NaOH (12,4 мл, 3,10 ммоль). Образовавшуюся смесь перемешивают при комнатной температуре в течение 1 часа. Реакционную смесь выливают в 1 н. HCl для подкисления смеси с последующей экстракцией смесью хлороформ/метанол (10/1). Экстракт сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя, получая при этом (2-(5-фтор-2-метилфениламино)-4-фтор-6-бензоксазолил)уксусную кислоту (165 мг, 83%) в виде светло-коричневого твердого вещества.
1H-ЯМР (CDCl3) δ: 2,28 (с, 3H), 3,66 (с, 2H), 6,87-6,91 (м, 1H), 7,03 (д, J=11,6 Гц, 1H), 7,23-7,29 (м, 3H), 7,84-7,87 (м, 1H), 9,98 (ушир.с, 1H).
МС (ESI) m/z 319 (M++1).
(Стадия 9) Синтез метил-транс-4-(1-((2-(5-фтор-2-метилфениламино)-4-фтор-6-бензоксазолил)ацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилата
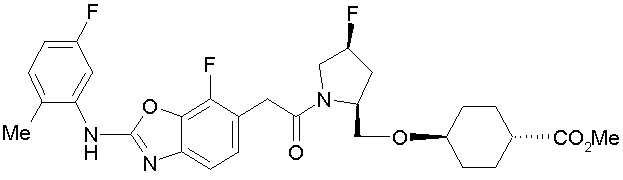
К раствору (2-(5-фтор-2-метилфениламино)-4-фтор-6-бензоксазолил)уксусной кислоты (165 мг, 0,52 ммоль), метил-транс-4-((4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилата (соединение, синтезированное в (стадии 3) примера 21) (134 мг, 0,52 ммоль) и EDC·HCl (119 мг, 0,62 ммоль) в ДМФ (10 мл) добавляют HOBt (14,0 мг, 0,10 ммоль). Образовавшуюся смесь перемешивают при комнатной температуре в течение 18 часов. К реакционной смеси добавляют воду с последующей экстракцией этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией с использованием тонкослойной пластины (ТСХ) силикагеля, посредством чего из элюатных фракций смеси гексан/этилацетат (1/5) метил-транс-4-(1-((2-(5-Фтор-2-метилфениламино)-4-фтор-6-бензоксазолил)ацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилат (251 мг, 87%) получают в виде бесцветного аморфного вещества.
1H-ЯМР (CDCl3), смесь амидных изомеров, δ: 1,24-1,32 (м, 2H), 1,40-1,53 (м, 2H), 1,96-2,52 (ряд м, 7H), 2,31 (с, 3H), 3,22-4,41 (ряд м, 8H), 3,65 и 3,67 (с, общий 3H), 4,28-4,42 (м, 1H), 5,17-5,36 (м, 1H), 6,73-6,77 (м, 1H), 6,89-6,92 (м, 1H), 7,12-7,16 (м, 3H), 8,01-8,05 (м, 1H).
МС (ESI) m/z 561 (M++2).
(Стадия 10) Синтез транс-4-(1-((2-(5-Фтор-2-метилфениламино)-4-фтор-6-бензоксазолил)ацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоновой кислоты
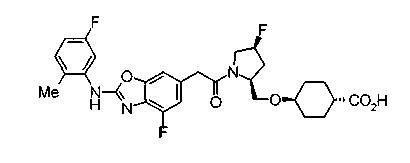
Метил-транс-4-(1-((2-(5-Фтор-2-метилфениламино)-4-фтор-6-бензоксазолил)ацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилат (239 мг, 0,43 ммоль) растворяют в смеси ТГФ/метанол (1/1, 20 мл). К образовавшемуся раствору добавляют водный 0,25 н. NaOH (8,50 мл, 2,14 ммоль). Образовавшуюся смесь перемешивают при комнатной температуре в течение 2 часов. Реакционную смесь подкисляют 1 н. HCl с последующей экстракцией смесью хлороформ/метанол (10/1). Экстракт сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси хлороформ/метанол (15/1) указанное в заголовке соединение (233 мг, 100%) получают в виде бесцветного аморфного вещества.
1H-ЯМР (CDCl3), смесь амидных изомеров, δ: 1,22-1,33 (м, 2H), 1,42-1,52 (м, 2H), 2,02-2,62 (ряд м, 7H), 2,31 (с, 3H), 3,23-4,42 (ряд м, 8H), 4,28-4,42 (м, 1H), 5,17-5,36 (м, 1H), 6,74-6,78 (м, 1H), 6,89-6,92 (м, 1H), 7,11-7,15 (м, 3H), 7,75 (д, J=10,5 Гц, 1H).
МС (ESI) m/z 547 (M++2).
Пример 48
транс-4-(1-((2-(1-Нафтиламино)-7-фтор-6-бензоксазолил)ацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоновая кислота:
(Стадия 1) Синтез метил-(2-(1-нафтиламино)-7-фтор-6-бензоксазолил)ацетата
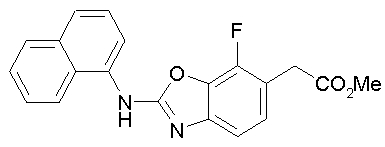
Метил-(4-амино-2-фтор-3-гидроксифенил)ацетат (996 мг, 5,00 ммоль) растворяют в метаноле (50 мл). К образовавшемуся раствору добавляют 1-нафтилизотиоцианат (926 мг, 5,00 ммоль). После перемешивания образовавшейся смеси при комнатной температуре в течение 2 дней к ней добавляют оксид ртути(II) (желтый) (1,08 г, 5,00 ммоль). Смесь перемешивают при 70°С в течение 3,5 часа. После охлаждения до комнатной температуры реакционную смесь фильтруют через целит и промывают метанолом. Фильтрат перегоняют при пониженном давлении для удаления растворителя. Таким образом полученные сырые кристаллы перекристаллизовывают из смеси хлороформ/н-гексан, получая при этом метил-(2-(1-нафтиламино)-7-фтор-6-бензоксазолил)ацетат (1,41 г, 81%) в виде светло-серого кристаллического порошка.
1H-ЯМР (CDCl3) δ: 3,717 и 3,723 (каждый с, общий 3H, амидные изомеры), 3,75 (д, J=1,2 Гц, 2H), 7,05 и 7,07 (каждый д, J=6,6 и 6,3 Гц соответственно, общий 1H, амидные изомеры), 7,53-7,59 (м, 3H), 7,73 (д, J=8,3 Гц, 1H), 7,92 (дд, J=7,1,2,4 Гц, 1H), 8,14 (дд, J=7,8,1,0 Гц, 1H).
МС (ESI) m/z 351 (M++1).
(Стадия 2) Синтез 2-(1-нафтиламино)-7-фтор-6-бензоксазолил)уксусной кислоты

Метил-(2-(1-нафтиламино)-7-фтор-6-бензоксазолил)ацетат (1,41 г, 4,02 ммоль) растворяют в смеси ТГФ/метанол (21, 30 мл). К образовавшемуся раствору добавляют 1 н. NaOH (10 мл). После перемешивания при комнатной температуре в течение 12 часов реакционную смесь перегоняют при пониженном давлении для удаления растворителя. Остаток подкисляют 1 н. HCl. Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при комнатной температуре, получая при этом 2-(1-нафтиламино)-7-фтор-6-бензоксазолил)уксусную кислоту (1,44 г, 100%) в виде коричневого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 3,70 (с, 2H), 7,15 (кв., J=6,3 Гц, 1H), 7,16 (с, 1H), 7,55-7,61 (м, 3H), 7,78 (д, J=7,8 Гц, 1H), 7,97 и 7,98 (д и м, J=5,9 Гц, общий 1H, амидные изомеры), 8,10 (д, J=7,6 Гц, 1H), 8,25-8,30 (м, 1H), 10,64 (ушир., 1H).
МС (ESI) m/z 337 (M++1).
(Стадия 3) Синтез метил-транс-4-(1-((2-(1-нафтиламино)-7-фтор-6-бензоксазолил)ацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилата
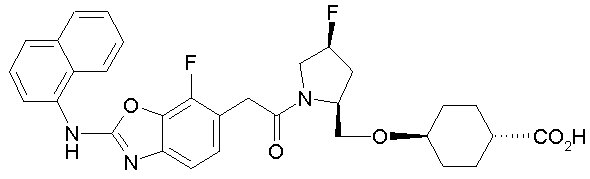
К смеси метил-(2-(1-нафтиламино)-7-фтор-6-бензоксазолил)ацетата (168 мг, 0,50 ммоль), метил-транс-4-((4S)- фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилата (соединение, синтезированное в (стадии 3) примера 21) (130 мг, 0,50 ммоль), EDC·HCl (144 мг, 0,75 ммоль), HOBt (101 мг, 0,75 ммоль) и триэтиламина (0,35 мл, 2,50 ммоль) добавляют ДМФ (5 мл). Образовавшуюся смесь перемешивают при комнатной температуре в течение 3 дней. Реакционную смесь выливают в ледяную воду с последующей экстракцией этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией с использованием тонкослойной пластины (ТСХ), посредством чего из элюатных фракций смеси хлороформ/ацетон (10/1) метил-транс-4-(1-((2-(1-нафтиламино)-7-фтор-6-бензоксазолил)ацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилат (280 мг, 97%) получают в виде светло-коричневого масла.
1H-ЯМР (CDCl3) δ: 1,15-1,57 (м, 5H), 1,95-2,53 (м, 8H), 3,19-3,58 (м, 2H), 3,64 и 3,66 (каждый с, общий 3H, амидные изомеры), 3,71-4,06 (м, 3H), 4,29-,45 (м, 1H), 5,17-5,39 (м, 1H), 6,95-7,11 (м, 2H), 7,51-7,56 (м, 3H), 7,69 (д, J=7,3 Гц, 1Н), 7,89 (м, 1H), 8,07-8,13 (м, 2H), 8,56 (ушир., 1H).
МС (ESI) m/z 578 (M++1).
(Стадия 4) Синтез транс-4-(1-((2-(1-нафтиламино)-7-фтор-6-бензоксазолил)ацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоновой кислоты
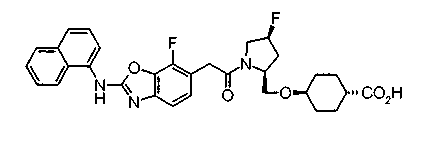
Метил-транс-4-(1-((2-(1-нафтиламино)-7-фтор-6-бензоксазолил)ацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилат (280 мг, 0,485 ммоль) растворяют в смеси ТГФ/метанол (2:1, об./об., 15 мл). К образовавшемуся раствору добавляют 1 н. NaOH (5 мл). После перемешивания при комнатной температуре в течение 3 дней реакционную смесь перегоняют при пониженном давлении для удаления растворителя. Остаток подкисляют 1 н. HCl. Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при пониженном давлении, получая при этом указанное в заголовке соединение (204 мг, 74,6%) в виде светло-розового твердого вещества.
ИК (ATR) ν 3278, 2935, 2864, 1701, 1637, 1572, 1452 см-1;
1H-ЯМР (ДМСО-d6) δ: 1,09-1,41 (м, 4H), 1,82-2,36 (м, 7H), 3,19 (м, 2H), 3,36-4,39 (м, 6H), 5,25-5,50 (м, 1H), 7,01-7,09 (м, 1H), 7,15 и 7,16 (каждый д, J=2,9 и 3,2 Гц соответственно, общий 1H, амидные изомеры), 7,55-7,60 (м, 3H), 7,77 (д, J=8,3 Гц, 1H), 7,97 и 7,98 (каждый д, J=3,2 и 2,2 Гц соответственно, общий 1H, амидные изомеры), 8,11 (д, J=7,8 Гц, 1H), 8,28 и 8,29 (каждый д, J=5,1 и 4,2 Гц соответственно, общий 1H, амидные изомеры), 10,64 (ушир., 1H), 12,04 (ушир., 1H).
МС (ESI) m/z 564 (M++1).
Пример 49
транс-4-(1-(4-(2-Бензоксазолил)амино-3-хлорфенилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоновая кислота:
(Стадия 1) Синтез этил-(4-(2-бензоксазолил)амино-3-хлорфенил)ацетата
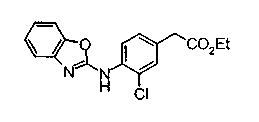
В ксилоле (10 мл) 2-хлорбензоксазол (743 мкл, 6,51 ммоль) и этил-4-амино-3-хлорфенилацетат (1,30 г, 6,51 ммоль) нагревают при кипячении с обратным холодильником в течение 2 часов. После охлаждения до комнатной температуры реакционную смесь разбавляют хлороформом (50 мл). Смесь промывают водой, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси н-гексан/этилацетат (9:1, об./об.) этил-(4-(2-бензоксазолил)амино-3-хлорфенил)ацетат (1,70 г, 79%) получают в виде светло-желтого твердого вещества.
1H-ЯМР (CDCl3) δ: 1,25-1,28 (м, 3H), 3,58 (с, 2H), 4,14-4,19 (м, 2H), 7,15-7,19 (м, 1H), 7,24-7,30 (м, 3H), 7,36-7,38 (м, 2H), 7,52-7,54 (м, 1H), 8,51-8,53 (м, 1H).
МС (ESI) m/z 331 (M++1).
(Стадия 2) Синтез (4-(2-бензоксазолил)амино-3-хлорфенил)уксусной кислоты

Этил-(4-(2-бензоксазолил)амино-3-хлорфенил)ацетат (1,70 г, 5,14 ммоль) растворяют в ТГФ (30 мл). К образовавшемуся раствору добавляют 0,5 н. NaOH (30 мл, 15,0 ммоль) при перемешивании. Образовавшуюся смесь перемешивают при комнатной температуре в течение 20 часов. Смесь концентрируют и остаток подкисляют смесью лед - 1 н. HCl. Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при пониженном давлении, получая при этом (4-(2-бензоксазолил)амино-3-хлорфенил)уксусную кислоту (1,24 г, 80%) в виде светло-желтого кристаллического порошка.
1H-ЯМР (ДМСО-d6) δ: 3,62 (с, 2H), 7,10-7,19 (м, 1H), 7,21-7,28 (м, 1H), 7,30-7,31 (м, 1H), 7,38-7,40 (м, 1H), 7,45-7,49 (м, 3H), 7,94-7,96 (м, 1H).
(Стадия 3) Синтез метил-транс-4-(1-(4-(2-бензоксазолил)амино-3-хлорфенилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилата
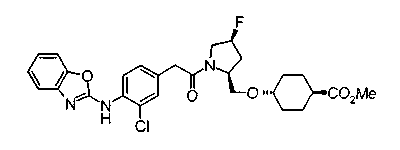
В ДМФ (5 мл), (4-(2-бензоксазолил)амино-3-хлорфенил)уксусную кислоту (247 мг, 0,82 ммоль), метил-транс-4-((4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилат (соединение, синтезированное в (стадии 3) примера 21) (225 мг, 0,87 ммоль), EDC·HCl (235 мг, 1,23 ммоль), HOBt (166 мг, 1,23 ммоль) и триэтиламин (171 мкл, 1,23 ммоль) перемешивают при комнатной температуре в течение 5 часов. К реакционной смеси добавляют воду (20 мл) с последующей экстракцией этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси хлороформ/метанол (60:1, об./об.) метил-транс-4-(1-(4-(2-бензоксазолил)амино-3-хлорфенилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилат (454 мг, 100%) получают в виде светло-желтого аморфного вещества.
1H-ЯМР (CDCl3) δ: 1,18-1,53 (м, 4H), 1,97-2,51 (м, 7Н), 3,23-3,36 и 3,49-3,59 (каждый м, общий 2H), 3,63-4,01 (м, 8H), 4,19-4,24 и 4,35-4,41 (каждый м, общий 1H), 5,17-5,20 и 5,30-5,33 (каждый м, общий 1H), 7,15-7,19 (м, 1H), 7,24-7,27 (м, 2H), 7,36-7,38 (м, 2H), 7,52-7,54 (м, 1H), 8,47-8,53 (м, 1H).
МС (ESI) m/z 544 (M++1).
(Стадия 4) Синтез транс-4-(1-(4-(2-бензоксазолил)амино-3-хлорфенилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоновой кислоты
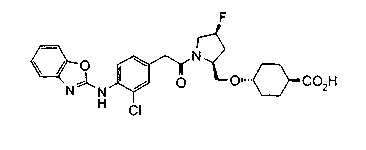
К метил-транс-4-(1-(4-(2-бензоксазолил)амино-3-хлорфенилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилату (454 мг, 0,83 ммоль) добавляют ТГФ (5 мл) и 0,5 н. NaOH (5,0 мл, 2,50 ммоль) с последующим перемешиванием при комнатной температуре в течение 15 часов. Реакционную смесь выливают в смесь лед - 1 н. HCl для подкисления смеси с последующей экстракцией этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси хлороформ/метанол (50:1, об./об.) указанное в заголовке соединение (359 мг, 81%) получают в виде бесцветного аморфного вещества.
1H-ЯМР (CDCl3) δ: 1,21-1,34 (м, 2H), 1,43-1,55 (м, 2H), 2,02-2,51 (м, 7H), 3,24-3,37 и 3,47-3,52 (каждый м, общий 2H), 3,58-4,01 (м, 5H), 4,19-4,25 и 4,35-4,41 (каждый м, общий 1H), 5,16-5,19 и 5,30-5,32 (каждый м, общий 1H), 7,12-7,16 (м, 1H), 7,22-7,25 (м, 2H), 7,33-7,36 (м, 2H), 7,47-7,49 (м, 1H), 8,27-8,32 (м, 1H).
МС (ESI) m/z 530 (M++1);
Анал. Вычисл. для С27Н29ClFN3O5·5/4H2О: C, 58,69; H, 5,75; N, 7,61.
Найдено: C, 58,74; H, 5,17; N, 7,38.
Пример 50
транс-4-(1-(4-(2-Бензоксазолил)амино-3-метилфенилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоновая кислота:
(Стадия 1) Синтез трет-бутил-(4-(2-бензоксазолил)амино-3-метилфенил)ацетата

В ксилоле (20 мл) 2-хлорбензоксазол (845 мкл, 7,40 ммоль) и трет-бутил-4-амино-3-метилфенилацетат (1,26 г, 5,69 ммоль) нагревают при кипячении с обратным холодильником в течение 2 часов. После охлаждения до комнатной температуры реакционную смесь перегоняют при пониженном давлении для удаления растворителя. Остаток растворяют в смеси хлороформ/метанол (9:1, об./об., 100 мл). Образовавшийся раствор промывают водой, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси н-гексан/этилацетат (4:1, об./об.) трет-бутил-(4-(2-бензоксазолил)амино-3-метилфенил)ацетат (1,17 г, 61%) получают в виде желтого аморфного вещества.
1H-ЯМР (CDCl3) δ: 1,46 (с, 9H), 2,30 (с, 3H), 3,49 (с, 2H), 7,05-7,24 (м, 4H), 7,27-7,29 (м, 1H), 7,38-7,40 (м, 1H), 7,86-7,88 (м, 2H).
(Стадия 2) Синтез (4-(2-бензоксазолил)амино-3-метилфенил)уксусной кислоты
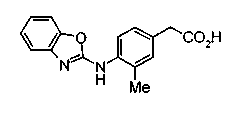
В метиленхлориде (10 мл) растворяют трет-бутил-(4-(2-бензоксазолил)амино-3-метилфенил)ацетат (1,17 г, 3,46 ммоль). К образовавшемуся раствору добавляют трифторуксусную кислоту (10 мл). Образовавшуюся смесь перемешивают при комнатной температуре в течение 20 часов. Реакционную смесь выливают в ледяную воду с последующей экстракцией этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси хлороформ/метанол (от 60:1 до 50:1, об./об.) (4-(2-бензоксазолил)амино-3-метилфенил)уксусную кислоту (924 мг, 95%) получают в виде светло-желтого твердого вещества.
1H-ЯМР (CDCl3) δ: 2,38 (с, 3H), 3,68 (с, 2H), 7,22-7,29 (м, 4H), 7,36-7,42 (м, 3H), 7,48-7,52 (м, 1H).
МС (ESI) m/z 283 (M++1).
(Стадия 3) Синтез метил-транс-4-(1-(4-(2-бензоксазолил)амино-3-метилфенилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилата
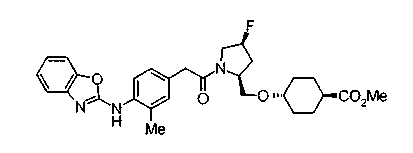
К смеси (4-(2-бензоксазолил)амино-3-метилфенил)уксусной кислоты (220 мг, 0,78 ммоль), метил-транс-4-((4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилата (соединение, синтезированное в (стадии 3) примера 21) (210 мг, 0,80 ммоль), EDC·HCl (224 мг, 1,17 ммоль), HOBt (158 мг, 1,17 ммоль) и триэтиламина (163 мкл, 1,17 ммоль) добавляют ДМФ (5 мл). Образовавшуюся смесь перемешивают при комнатной температуре в течение 15 часов. К реакционной смеси добавляют воду с последующей экстракцией этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси хлороформ/метанол (60:1, об./об.) метил-транс-4-(1-(4-(2-бензоксазолил)амино-3-метилфенилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилат (380 мг, 93%) получают в виде бесцветного аморфного вещества.
1H-ЯМР (CDCl3) δ: 1,26-1,46 (м, 4H), 1,99-2,46 (м, 10H), 3,25-3,89 (м, 10H), 4,23-4,25 и 4,38 (каждый м, общий 1H), 5,19 и 5,32 (каждый м, общий 1H), 7,08-7,21 (м, 4H), 7,28-7,29 (м, 1H), 7,41-7,43 (м, 1H), 7,67 (ушир.с, 1H), 7,87-7,93 (м, 1H).
МС (ESI) m/z 524 (M++1).
(Стадия 4) Синтез транс-4-(1-(4-(2-бензоксазолил)амино-3-метилфенилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоновой кислоты
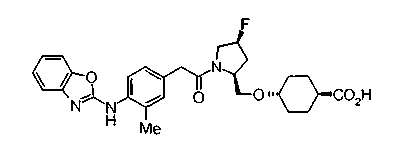
В ТГФ (5 мл) растворяют метил-транс-4-(1-(4-(2-бензоксазолил)амино-3-метилфенилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилат (380 мг, 0,73 ммоль). К образовавшемуся раствору добавляют 0,5 н. NaOH (5,0 мл, 2,50 ммоль). Образовавшуюся смесь перемешивают при комнатной температуре в течение 3 часов. Реакционную смесь выливают в смесь лед - 1 н. HCl с последующей экстракцией этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси хлороформ/метанол (от 60:1 до 50:1, об./об.) указанное в заголовке соединение (155 мг, 42%) получают в виде бесцветного аморфного вещества.
1H-ЯМР (CDCl3) δ: 1,24-1,35 (м, 2H), 1,43-1,54 (м, 2H), 1,99-2,15 (м, 4H), 2,24-2,52 (м, общий 6H), 3,25-4,02 (м, 7H), 4,21-4,27 и 4,37-4,43 (каждый м, общий 1H), 5,17-5,21 и 5,30-5,34 (каждый м, общий 1H), 7,07-7,23 (м, 4H), 7,30-7,40 (м, 2H), 7,69-7,74 (м, 1H).
МС (ESI) m/z 510 (M++1);
Анал. Вычисл. для С28Н32FN3O5·1/2H2О: C, 64,85; H, 6,41; N, 8,10.
Найдено: C, 64,75; H, 6,56; N, 7,65.
Пример 51
транс-4-(1-(3-(2-Бензоксазолил)амино-2-хлор-6-пиридилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоновая кислота:
(Стадия 1) Синтез этил-(3-(2-бензоксазолил)амино-2-хлор-6-пиридил)ацетата
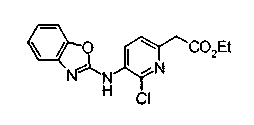
В ксилоле (100 мл) 2-хлорбензоксазол (326 мкл, 2,86 ммоль) и этил-(3-амино-2-хлор-6-пиридил)ацетат (557 мг, 2,59 ммоль) нагревают при кипячении с обратным холодильником в течение 4 часов при перемешивании. После охлаждения реакционной смеси до комнатной температуры растворитель отгоняют при пониженном давлении. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси н-гексан/этилацетат (3:1, об./об.) этил-(3-(2-бензоксазолил)амино-2-хлор-6-пиридил)ацетат (460 мг, 53%) получают в виде бесцветной смолы.
1H-ЯМР (CDCl3) δ: 1,25-1,28 (м, 3H), 3,79 (с, 2H), 4,16-4,21 (м, 2H), 7,14-7,18 (м, 1H), 7,22-7,26 (м, 1H), 7,31-7,36 (м, 3H) 7,49-7,51 (м, 1H), 8,86-8,89 (м, 1H).
МС (ESI) m/z 332 (M++1).
(Стадия 2) Синтез (3-(2-бензоксазолил)амино-2-хлор-6-пиридил)уксусной кислоты

В ТГФ (8 мл) растворяют этил-(3-(2-бензоксазолил)амино-2-хлор-6-пиридил)ацетат (460 мг, 1,39 ммоль). К образовавшемуся раствору добавляют 0,5 н. NaOH (8,0 мл, 4,00 ммоль). Образовавшуюся смесь перемешивают при комнатной температуре в течение 1 часа. Реакционную смесь выливают в смесь лед - 1 н. HCl для подкисления смеси. Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при пониженном давлении, получая при этом (3-(2-бензоксазолил)амино-2-хлор-6-пиридил)уксусную кислоту (332 мг, 79%) в виде белого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 3,30 (с, 2H), 6,68-6,72 (м, 1H), 6,76-6,80 (м, 1H), 6,96-7,06 (м, 3H), 8,00-8,02 (м, 1H).
(Стадия 3) Синтез метил-транс-4-(1-(3-(2-бензоксазолил)амино-2-хлор-6-пиридилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилата

К смеси (3-(2-бензоксазолил)амино-2-хлор-6-пиридил)уксусной кислоты (153 мг, 0,50 ммоль), метил-транс-4-((4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилата (соединение, синтезированное в (стадии 3) примера 21) (131 мг, 0,51 ммоль), EDC·HCl (145 мг, 0,76 ммоль), HOBt (102 мг, 0,75 ммоль) и триэтиламина (105 мкл, 0,75 ммоль) добавляют ДМФ (5 мл). Образовавшуюся смесь перемешивают при комнатной температуре в течение 2 дней. К реакционной смеси добавляют воду с последующей экстракцией этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси н-гексан-этилацетат (1:2, об./об.) метил-транс-4-(1-(3-(2-бензоксазолил)амино-2-хлор-6-пиридилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилат (270 мг, 98%) получают в виде бесцветной густой вязкой жидкости.
1H-ЯМР (CDCl3) δ: 1,24-1,29 (м, 2H), 1,39-1,53 (м, 2H), 1,96-2,52 (м, 7H), 3,22-3,36 и 3,50-3,54 (каждый м, общий 2H), 3,64-4,14 (м, 8H), 4,38 и 4,45-4,47 (каждый м, общий 1H), 5,20-5,23 и 5,34 (каждый м, общий 1H), 7,15-7,27 (м, 2H), 7,35-7,39 (м, 2H), 7,50-7,52 (м, 1H), 7,72 (ушир.с, 1H), 8,83-8,89 (м, 1H).
МС (ESI) m/z 545 (M++1).
(Стадия 4) Синтез транс-4-(1-(3-(2-бензоксазолил)амино-2-хлор-6-пиридилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоновой кислоты

В ТГФ (3,0 мл) растворяют метил-транс-4-(1-(3-(2-бензоксазолил)амино-2-хлор-6-пиридилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилат (270 мг, 0,50 ммоль). К образовавшемуся раствору добавляют 0,5 н. NaOH (3,0 мл, 1,50 ммоль). Образовавшуюся смесь перемешивают при комнатной температуре в течение 1 часа. Реакционную смесь выливают в смесь лед - 1 н. HCl с последующим подкислением смеси. Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении, промывают н-гексаном и сушат при пониженном давлении, получая при этом указанное в заголовке соединение (192 мг, 73%) в виде бледно-желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 1,21-1,36 (м, 4H), 1,83-2,23 (м, 7H), 3,18-4,07 (м, 7H), 4,12 и 4,38 (каждый м, общий 1H), 5,25-5,31 и 5,39-5,45 (каждый м, общий 1H), 7,11-7,15 (м, 1H), 7,19-7,23 (м, 1H), 7,36-7,40 (м, 2H), 7,47-7,49 (м, 1H), 8,42 (м, 1H).
МС (ESI) m/z 531 (M++1);
Анал. Вычисл. для C26H28C1FN4О5·1/2H2О: C, 57,83; H, 5,41; N, 10,38.
Найдено: C, 58,03; H, 5,70; N, 9,62.
Пример 52
транс-4-(1-(3-Хлор-4-(2-(4-метилбензоксазолил)аминофенилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоновая кислота:
(Стадия 1) Синтез 2-амино-3-метилфенола
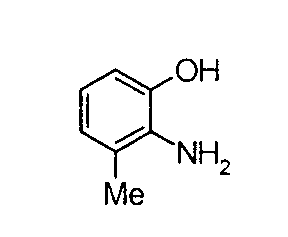
В метаноле (20 мл) катализатор 10% палладий-уголь (0,30 г, 20 мас.%) добавляют к 3-метил-2-нитрофенолу (1,50 г, 9,80 ммоль) и смесь подвергают каталитическому гидрированию в течение 4 дней. Нерастворимое вещество отфильтровывают от реакционной смеси через целит.Фильтрат перегоняют при пониженном давлении для удаления растворителя, получая при этом 2-амино-3-метилфенол (1,19 г, 99%) в виде коричневого масла.
1H-ЯМР (CDCl3) δ: 2,19 (с, 3H), 6,60-6,62 (м, 2H), 6,68-6,71 (м, 1H).
(Стадия 2) Синтез метил-3-хлор-4-изотиоцианатофенилацетата
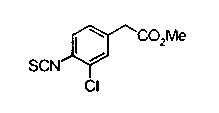
Карбонат кальция (626 мг, 6,25 ммоль) и тиофосген (191 мкл, 2,51 ммоль) суспендируют в смеси метиленхлорид-вода (10 мл, 1:1, об./об.). К образовавшейся суспензии добавляют раствор метил-4-амино-3-хлорфенилацетата (500 мг, 2,50 ммоль) в метиленхлориде (5 мл) при перемешивании при 0°С. Температуру реакционной смеси повышают от 0°С до комнатной температуры на протяжении 1,5 часа. Реакционную смесь подкисляют 1 н. HCl с последующей экстракцией метиленхлоридом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя, получая при этом метил-3-хлор-4-изотиоцианатофенилацетат (652 мг, 100%) в виде желтого масла.
МС (ESI) m/z 241 (M+).
(Стадия 3) Синтез метил-(3-хлор-4-(2-(4-метилбензоксазолил)аминофенил)ацетата
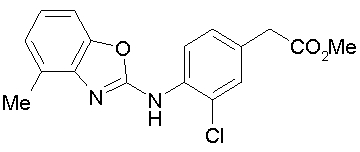
Толуол (15 мл) добавляют к смеси метил-3-хлор-4-изотиоцианатофенилацетата (652 мг, 2,50 ммоль) и 2-амино-3-метилфенола (307 мг, 2,50 ммоль). Образовавшуюся смесь нагревают при кипячении с обратным холодильником в течение 2 часов. Оксид ртути(II) (желтый) (541 мг, 2,50 ммоль) добавляют к реакционной смеси. Образовавшуюся смесь нагревают при кипячении с обратным холодильником в течение 5 часов. После охлаждения до комнатной температуры реакционную смесь фильтруют через целит и промывают метанолом. Фильтрат перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси н-гексан/этилацетат (7:1, об./об.) метил-(3-хлор-4-(2-(4-метилбензоксазолил))аминофенил)ацетат (359 мг, 43%) получают в виде черного масла.
1H-ЯМР (CDCl3) δ: 2,55 (с, 3H), 3,58 (с, 2H), 3,70 (с, 3H), 7,02-7,06 (м, 2H), 7,11-7,19 (м, 1H), 7,25-7,28 (м, 1H), 7,33-7,34 (м, 1H), 7,50 (ушир.с, 1H), 8,54-8,56 (м, 1H).
МС (ESI) m/z 331 (M++1).
(Стадия 4) Синтез (3-хлор-4-(2-(4-метилбензоксазолил))аминофенил)уксусной кислоты
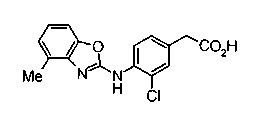
Метил-(3-хлор-4-(2-(4-метилбензоксазолил)аминофенил)ацетат (359 мг, 1,08 ммоль) растворяют в ТГФ (6 мл). К образовавшемуся раствору добавляют 0,5 н. NaOH (6,5 мл, 3,25 ммоль). Образовавшуюся смесь перемешивают при комнатной температуре в течение 4 часов. Реакционную смесь выливают в смесь лед - 1 н. HCl для подкисления смеси с последующей экстракцией этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняли при пониженном давлении для удаления растворителя, получая при этом (3-хлор-4-(2-(4-метилбензоксазолил)аминофенил)уксусную кислоту (281 мг, 82%) в виде коричневого твердого вещества.
1H-ЯМР (CDCl3) δ: 2,55 (с, 3H), 3,57 (с, 2H), 6,72-6,74 (м, 1H), 7,04-7,06 (м, 2H), 7,18-7,20 (м, 2H), 8,46-8,48 (м, 1H).
МС (ESI) m/z 317 (M++1).
(Стадия 5) Синтез метил-транс-4-(1-(3-хлор-4-(2-(4-метилбензоксазолил)аминофенилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилата
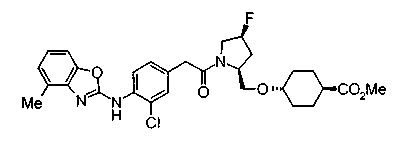
К смеси метил-4-(2-(4-метилбензоксазолил))амино-3-хлорфенил)ацетата (281 мг, 0,89 ммоль), метил-транс-4-((4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилата (соединение, синтезированное в (стадии 3) примера 21) (230 мг, 0,89 ммоль), EDC·HCl (255 мг, 1,33 ммоль), HOBt (180 мг, 1,33 ммоль) и триэтиламина (185 мкл, 1,33 ммоль) добавляют ДМФ (8 мл). Образовавшуюся смесь перемешивают при комнатной температуре в течение 15 часов. К реакционной смеси добавляют воду с последующей экстракцией этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси толуол/ацетон (6:1, об./об.) метил-транс-4-(1-(3-хлор-4-(2-(4-метилбензоксазолил)аминофенилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилат (368 мг, 74%) получают в виде белого аморфного вещества.
1H-ЯМР (CDCl3) δ: 1,20-1,53 (м, 4H), 1,97-2,32 (м, 7H), 2,56 (с, 3H), 3,23-3,36 и 3,49-3,52 (каждый м, общий 2H), 3,57-4,11 (м, 8H), 4,19-4,23 и 4,37 (каждый м, общий 1H), 5,17-5,19 и 5,31-5,32 (каждый м, общий 1H), 7,05-7,06 (м, 2H), 7,16-7,24 (м, 2H), 7,34-7,36 (м, 1H), 7,50 (ушир.с, 1H), 8,52-8,57 (м, 1H).
МС (ESI) m/z 558 (M++1).
(Стадия 6) Синтез транс-4-(1-(3-хлор-4-(2-(4-метилбензоксазолил)аминофенилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоновой кислоты
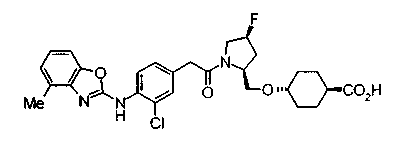
В ТГФ (4 мл) растворяют метил-транс-4-(1-(3-хлор-4-(2-(4-метилбензоксазолил)аминофенилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилат (368 мг, 0,66 ммоль). К образовавшемуся раствору добавляют 0,5 н. NaOH (4,0 мл, 2,00 ммоль). Образовавшуюся смесь перемешивают при комнатной температуре в течение 15 часов. Реакционную смесь выливают в смесь лед - 1 н. HCl для подкисления смеси. Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при пониженном давлении, получая при этом указанное в заголовке соединение (139 мг, 39%) в виде коричневого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 1,15-1,36 (м, 4H), 1,87-2,20 (м, 7H), 2,39 (с, 3H), 3,15-3,87 (м, 7H), 4,13 и 4,32-4,34 (каждый м, общий 1H), 5,24-5,31 и 5,37-5,44 (каждый м, общий 1H), 6,97-7,02 (м, 2H), 7,21-7,26 (м, 2H), 7,37-7,38 (м, 1H), 7,89-7,93 (м, 1H).
МС (ESI) m/z 544 (M++1);
Анал. Вычисл. для С28Н31ClFN3O5·1/4H2О: C, 61,31; H, 5,79; N, 7,66.
Найдено: C, 61,14; H, 6,06; N, 6,97.
Пример 53
транс-4-(1-(3-хлор-4-(2-(7-фторбензоксазолил))аминофенилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоновая кислота:
(Стадия 1) Синтез метил-(3-хлор-4-(2-(7-фторбензоксазолил))аминофенил)ацетата
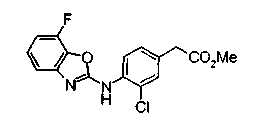
Толуол (15 мл) добавляют к смеси метил-3-хлор-4-изотиоцианатофенилацетата (672 мг, 2,78 ммоль) и 2-амино-6-фторфенола (353 мг, 2,78 ммоль). Образовавшуюся смесь нагревают при кипячении с обратным холодильником в течение 1,5 часа. К реакционной смеси добавляют оксид ртути(II) (желтый) (1,03 г, 4,75 ммоль). Образовавшуюся смесь нагревают при кипячении с обратным холодильником в течение 10 часов. После охлаждения до комнатной температуры реакционную смесь фильтруют через целит. Фильтрат промывают метанолом и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси н-гексан/этилацетат (7:1, об./об.) метил-(3-хлор-4-(2-(7-фторбензоксазолил)аминофенил)ацетат (109 мг, 12%) получают в виде желтого твердого вещества.
1H-ЯМР (CDCl3) δ: 3,60 (с, 2H), 3,71 (с, 3H), 6,91-6,96 (м, 1H), 7,15-7,21 (м, 1H), 7,27-7,32 (м, 2H), 7,37-7,38 (м, 1H), 7,59 (ушир.с, 1H), 8,49 (д, J=8,3 Гц, 1H).
МС (ESI) m/z 335 (M++1).
(Стадия 2) Синтез (3-хлор-4-(2-(7-фторбензоксазолил))аминофенил)уксусной кислоты
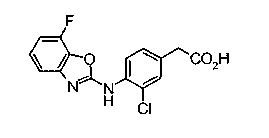
Метил-(3-хлор-4-(2-(7-фторбензоксазолил))аминофенил)ацетат (109 мг, 0,33 ммоль) растворяют в ТГФ (4 мл). К образовавшемуся раствору добавляют 0,25 н. NaOH (4,0 мл, 1,00 ммоль). Образовавшуюся смесь перемешивают при комнатной температуре в течение 1 часа. Реакционную смесь выливают в 1 н. HCl для подкисления смеси. Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при пониженном давлении, получая при этом (3-хлор-4-(2-(7-фторбензоксазолил))аминофенил)уксусную кислоту (95 мг, 91%) в виде коричневого твердого вещества.
МС (ESI), m/z 321 (M++1).
(Стадия 3) Синтез метил-транс-4-(1-(3-хлор-4-(2-(7-фторбензоксазолил))аминофенилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилата
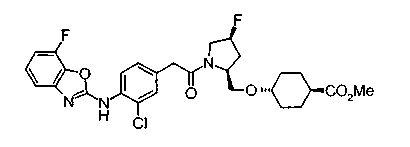
ДМФ (4 мл) добавляют к смеси (3-хлор-4-(2-(7-фторбензоксазолил))аминофенил)уксусной кислоты (95 мг, 0,30 ммоль), метил-транс-4-((4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилата (соединение, синтезированное в (стадии 3) примера 21) (77 мг, 0,30 ммоль), EDC·HCl (85 мг, 0,44 ммоль), HOBt (60 мг, 0,44 ммоль) и триэтиламина (62 мкл, 0,44 ммоль). Образовавшуюся смесь перемешивают при комнатной температуре в течение 7 часов. К реакционной смеси добавляют воду с последующей экстракцией этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси толуол/ацетон (6:1, об./об.) метил-транс-4-(1-(3-хлор-4-(2-(7-фторбензоксазолил))аминофенилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилат (166 мг, 200%) получают в виде светло-желтой густой вязкой жидкости.
1H-ЯМР (CDCl3) δ: 1,18-1,32 (м, 2H), 1,39-1,53 (м, 2H), 1,97-2,08 (м, 4H), 2,19-2,52 (м, 3H), 3,23-3,29 и 3,32-3,54 (каждый м, общий 2H), 3,58-4,01 (м, 8H), 4,19-4,25 и 4,35-4,41 (каждый м, общий 1H), 5,17-5,20 и 5,30-5,34 (каждый м, общий 1H), 6,91-6,96 (м, 1H), 7,15-7,31 (м, 3H), 7,36-7,38 (м, 1H), 7,62 (ушир.с, 1H), 8,44-8,49 (м, 1H).
МС (ESI) m/z 562 (M++1).
(Стадия 4) Синтез транс-4-(1-(3-хлор-4-(2-(7-фторбензоксазолил))аминофенилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоновой кислоты
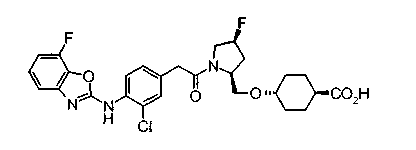
В ТГФ (3,6 мл) растворяют метил-транс-4-(1-(3-хлор-4-(2-(7-фторбензоксазолил))аминофенилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилат (166 мг, 0,30 ммоль). К образовавшемуся раствору добавляют 0,25 н. NaOH (3,6 мл, 0,90 ммоль). Образовавшуюся смесь перемешивают при комнатной температуре в течение 12 часов. Реакционную смесь выливают в 1 н. HCl для подкисления смеси. Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при пониженном давлении, получая при этом указанное в заголовке соединение (101 мг, 62%) в виде коричневого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 1,15-1,39 (м, 4H), 1,84-2,28 (м, 7H), 3,14-3,88 (м, 7H), 4,12 и 4,30-4,34 (каждый м, общий 1H), 5,23-5,30 и 5,37-5,44 (каждый м, общий 1H), 7,00-7,05 (м, 1H), 7,18-7,25 (м, 3H), 7,37-7,39 (м, 1H), 7,87-7,90 (м, 1H).
МС (FAB) m/z 548 (M++1);
Анал. Вычисл. для С27Н28ClF2N3O5·1/4Н2О: C, 58,70; H, 5,20; N, 7,61.
Найдено: C, 58,90; H, 5,59; N, 6,77.
Пример 54
транс-4-(1-(3-хлор-4-(2-(5-фторбензоксазолил))аминофенилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоновая кислота:
(Стадия 1) Синтез 2-амино-4-фторфенола
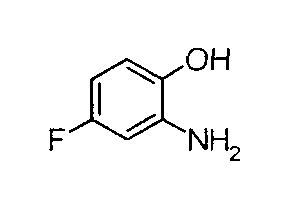
В метаноле (20 мл) растворяют 4-фтор-2-нитрофенол (1,00 г, 6,37 ммоль). К образовавшемуся раствору добавляют катализатор 10% палладий-уголь (0,20 г, 20 мас.%). Образовавшуюся смесь подвергают каталитическому гидрированию при перемешивании в течение 2 дней. После фильтрования реакционной смеси через целит для удаления катализатора фильтрат перегоняют при пониженном давлении для удаления растворителя, получая при этом 2-амино-4-фторфенол (850 мг, 100%) в виде красновато-коричневого твердого вещества.
1H-ЯМР (CDCl3) δ: 3,93 (ушир.с, 2H), 6,30-6,35 (м, 1H), 6,44-6,48 (м, 1H), 6,62-6,65 (м, 1H).
МС (ESI) m/z 169 (M++1+MeCN).
(Стадия 2) Синтез метил-(3-хлор-4-(2-(5-фторбензоксазолил))аминофенил)ацетата
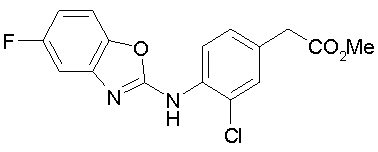
К смеси метил-3-хлор-4-изотиоцианатофенилацетата (950 мг, 3,93 ммоль) и 2-амино-4-фторфенола (500 мг, 3,93 ммоль) добавляют толуол (15 мл) и смесь нагревают при кипячении с обратным холодильником в течение 2 часов. К реакционной смеси затем добавляют оксид ртути(II) (желтый) (1,03 г, 4,75 ммоль). Образовавшуюся смесь нагревают при кипячении с обратным холодильником в течение 2,5 часа. После охлаждения до комнатной температуры реакционную смесь фильтруют через целит.Фильтрат промывают метанолом и затем перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси н-гексан/этилацетат (7:1, об./об.) метил-(3-хлор-4-(2-(5-хлорбензоксазолил))аминофенил)ацетат (107 мг, 8%) получают в виде коричневого твердого вещества.
1H-ЯМР (CDCl3) δ: 3,60 (с, 2H), 3,71 (с, 3H), 6,85-6,90 (м, 1H), 7,20-7,23 (м, 1H), 7,25-7,30 (м, 2H), 7,37-7,38 (м, 1H), 7,52 (ушир.с, 1H), 8,45-8,47 (м, 1H).
МС (ESI) m/z 335 (M++1).
(Стадия 3) Синтез (3-хлор-4-(2-(5-фторбензоксазолил))аминофенил)уксусной кислоты
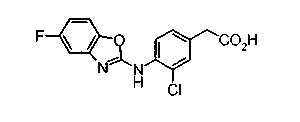
Метил-(3-хлор-4-(2-(5-фторбензоксазолил))аминофенил)ацетат (148 мг, 0,44 ммоль) растворяют в ТГФ (3 мл). К образовавшемуся раствору добавляют 0,5 н. NaOH (3,0 мл, 1,50 ммоль) и смесь перемешивают при комнатной температуре в течение 7 часов. Реакционную смесь выливают в смесь лед - 1 н. HCl для подкисления смеси. Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при пониженном давлении, получая при этом (3-хлор-4-(2-(5-фторбензоксазолил))аминофенилуксусную кислоту (129 мг, 91%) в виде коричневого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 3,62 (с, 2H), 6,89-6,94 (м, 1H), 7,21-7,30 (м, 2H), 7,45-7,49 (м, 2H), 7,85-7,87 (м, 1H), 10,16 (ушир.с, 1H), 12,44 (ушир.с, 1H).
МС (ESI) m/z 321 (M++1).
(Стадия 4) Синтез метил-транс-4-(1-(3-хлор-4-(2-(5-фторбензоксазолил))аминофенилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилата
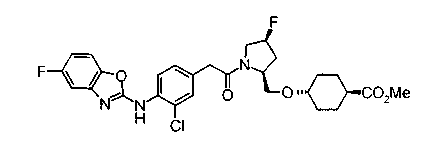
В ДМФ (5 мл) смесь (3-хлор-4-(2-(5-фторбензоксазолил))аминофенил)уксусной кислоты (129 мг, 0,40 ммоль), метил-транс-4-((4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилата (соединение, синтезированное в (стадии 3) примера 21) (104 мг, 0,40 ммоль), EDC·HCl (116 мг, 0,61 ммоль), HOBt (82 мг, 0,61 ммоль) и триэтиламина (84 мкл, 0,60 ммоль) перемешивают при комнатной температуре в течение 20 часов. Реакционную смесь выливают в воду и таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении. Сырые кристаллы растворяют в этилацетате. Раствор промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси толуол/ацетон (6:1, об./об.) метил-транс-4-(1-(3-хлор-4-(2-(5-фторбензоксазолил))аминофенилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилат (222 мг, 98%) получают в виде светло-желтой густой вязкой жидкости.
1H-ЯМР (CDCl3) δ: 1,14-1,32 (м, 2H), 1,39-1,53 (м, 2H), 1,96-2,51 (м, 7H), 3,21-3,37 и 3,49-3,54 (каждый м, общий 2H), 3,58-4,01 (м, 8H), 4,19-4,25 и 4,35-4,40 (каждый м, общий 1H), 5,17-5,20 и 5,30-5,33 (каждый м, общий 1H), 6,83-6,89 (м, 1H), 7,13-7,28 (м, 3H), 7,36-7,37 (м, 1H), 7,52 (ушир.с, 1H), 8,40-8,46 (м, 1H).
МС (ESI) m/z 562 (M++1).
(Стадия 5) Синтез транс-4-(1-(3-хлор-4-(2-(5-фторбензоксазолил))аминофенилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоновой кислоты
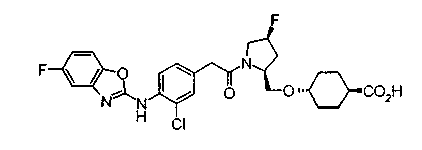
Метил-транс-4-(1-(3-хлор-4-(2-(5-фторбензоксазолил))аминофенилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилат (222 мг, 0,40 ммоль) растворяют в ТГФ (4,5 мл). К образовавшемуся раствору добавляют 0,25 н. NaOH (4,5 мл, 1,13 ммоль). Образовавшуюся смесь перемешивают при комнатной температуре в течение 13 часов. Реакционную смесь выливают в 1 н. HCl для подкисления смеси. Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при пониженном давлении, получая при этом указанное в заголовке соединение (149 мг, 69%) в виде светло-желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 1,16-1,38 (м, 4H), 1,88-1,95 (м, 4H), 2,15-2,21 (м, 3H), 3,16-3,88 (м, 7H), 4,13 и 4,33-4,35 (каждый м, общий 1H), 5,25-5,33 и 5,39-5,46 (каждый м, общий 1Н), 6,89-6,93 (м, 1H), 7,21-7,25 (м, 2H), 7,39-7,40 (м, 1H), 7,46-7,49 (м, 1H), 7,83-7,86 (м, 1H).
МС (FAB) m/z 548 (M++1);
Анал. Вычисл. для С27Н28ClF2N3O5·1/2H2О: С, 58,22; H, 5,25; N, 7,54.
Найдено: С, 58,57; H, 5,49; N, 6,97.
Пример 55
транс-4-(1-(4-(2-Бензоксазолил))амино-5-хлор-2-фторфенилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоновая кислота:
(Стадия 1) Синтез этил-(4-(2-бензоксазолил)амино-5-хлор-2-фторфенил)ацетата
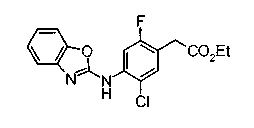
В ксилоле (4 мл) 2-хлорбензоксазол (278 мкл, 2,43 ммоль) и этил-(4-амино-5-хлор-2-фторфенил)ацетат (512 мг, 2,21 ммоль) нагревают при кипячении с обратным холодильником в течение 2 часов. После охлаждения реакционной смеси до комнатной температуры растворитель отгоняют при пониженном давлении. Остаток растворяют в этилацетате. Образовавшийся раствор промывают насыщенным водным раствором бикарбоната натрия, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси н-гексан/этилацетат (7:1, об./об.) этил-(4-(2-бензоксазолил)амино-5-хлор-2-фторфенил)ацетат (570 мг, 74%) получают в виде светло-желтого твердого вещества.
1H-ЯМР (CDCl3) δ: 1,21 (т, J=7,1 Гц, 3H), 3,62 (с, 2H), 4,19 (кв., J=7,1 Гц, 2H), 7,16-7,38 (м, 3H), 7,53-7,56 (м, 2H), 8,47-8,50 (м, 1H).
МС (ESI) m/z 349 (M++1).
(Стадия 2) Синтез (4-(2-бензоксазолил)амино-5-хлор-2-фторфенил)уксусной кислоты
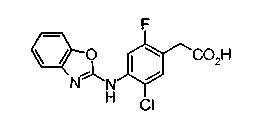
Этил-(4-(2-бензоксазолил)амино-5-хлор-2-фторфенилацетат (570 мг, 1,63 ммоль) растворяют в ТГФ (5 мл). К образовавшемуся раствору добавляют 1 н. NaOH (5,0 мл, 5,00 ммоль) с последующим перемешиванием при комнатной температуре в течение 20 часов. Реакционную смесь выливают в смесь лед - 1 н. HCl для подкисления ее. Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при пониженном давлении, получая при этом (4-(2-бензоксазолил)амино-5-хлор-2-фторфенил)уксусную кислоту (497 мг, 95%) в виде коричневого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 3,64 (с, 2H), 7,14-7,17 (м, 1H), 7,21-7,26 (м, 1H), 7,45-7,55 (м, 3H), 8,07-8,10 (м, 1H).
МС (ESI) m/z 321 (M++1).
(Стадия 3) Синтез метил-транс-4-(1-(4-(2-бензоксазолил)амино-5-хлор-2-фторфенилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилата
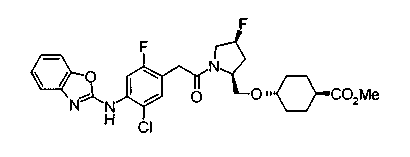
К смеси (4-(2-бензоксазолил)амино-5-хлор-2-фторфенил)уксусной кислоты (140 мг, 0,44 ммоль), метил-транс-4-((4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилата соединение, синтезированное в (стадии 3) примера 21) (104 мг, 0,40 ммоль), EDC·HCl (115 мг, 0,60 ммоль), HOBt (81 мг, 0,60 ммоль) и триэтиламина (84 мкл, 0,60 ммоль) добавляют ДМФ (5 мл). Образовавшуюся смесь перемешивают при комнатной температуре в течение 18 часов. К реакционной смеси добавляют воду. Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при пониженном давлении, получая при этом метил-транс-4-(1-(4-(2-бензоксазолил))амино-5-хлор-2-фторфенилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилат (223 мг, 99%) в виде коричневого твердого вещества.
1H-ЯМР (CDCl3) δ: 1,23-1,46 (м, 4H), 1,97-2,32 (м, 7H), 3,24-3,58 (м, 2H), 3,65-3,98 (м, 8H), 4,30-4,37 (м, 1H), 5,20-5,24 и 5,33-5,37 (каждый м, общий 1H), 7,17-7,21 (м, 1H), 7,25-7,29 (м, 1H), 7,37-7,41 (м, 2H), 7,54-7,56 (м, 1H), 8,44-8,50 (м, 1H).
МС (ESI) m/z 562 (M++1).
(Стадия 4) Синтез транс-4-(1-(4-(2-бензоксазолил))амино-5-хлор-2-фторфенилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоновой кислоты

Метил-транс-4-(1-(4-(2-бензоксазолил))амино-5-хлор-2-фторфенилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилат (223 мг, 0,40 ммоль) растворяют в ТГФ (3,0 мл). К образовавшемуся раствору добавляют 0,5 н. NaOH (2,5 мл, 1,25 ммоль). Образовавшуюся смесь перемешивают при комнатной температуре в течение 1,5 часа. Реакционную смесь выливают в смесь лед - 1 н. HCl для подкисления смеси. Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при пониженном давлении, получая при этом указанное в заголовке соединение (173 мг, 80%) в виде коричневого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 1,17-1,37 (м, 4H), 1,73-2,20 (м, 7H), 3,16-3,97 (м, 7H), 4,12 и 4,33 (каждый м, общий 1H), 5,25-5,33 и 5,38-5,47 (каждый м, общий 1H), 7,12-7,24 (м, 2H), 7,40-7,51 (м, 3H), 8,03 (м, 1H).
МС (ESI) m/z 548 (M++1);
Анал. Вычисл. для С30Н30FN3O5·1/2Н2О: С, 58,22; H, 5,25; N, 7,54.
Найдено: С, 58,55; H, 5,41; N, 7,08.
Пример 56
транс-4-(1-(4-(2-Бензотиазолил))амино-3-хлорфенилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоновая кислота:
(Стадия 1) Синтез метил-(4-(2-бензотиазолил)амино-3-хлорфенил)ацетата

Смесь 2-хлорбензоксазола (489 мг, 2,88 ммоль) и метил-4-амино-3-хлорфенилацетата (567 мг, 2,84 ммоль) и п-толуолсульфоната пиридиния (PPTS) (214 мг, 0,85 ммоль) нагревают при кипячении с обратным холодильником в течение 3 часов в ксилоле (10 мл). После охлаждения реакционной смеси до комнатной температуры растворитель отгоняют при пониженном давлении. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси н-гексан/этилацетат (7:1, об./об.) метил-(4-(2-бензотиазолил)амино-3-хлорфенил)ацетат (296 мг, 32%) получают в виде белого твердого вещества.
1H-ЯМР (CDCl3) δ: 3,58 (с, 2H), 3,71 (с, 3H), 7,16-7,24 (м, 2H), 7,33-7,38 (м, 2H), 7,63-7,69 (м, 2H), 8,33-8,35 (м, 1H).
МС (ESI) m/z 333 (M++1).
(Стадия 2) Синтез (4-(2-бензотиазолил)амино-3-хлорфенил)уксусной кислоты
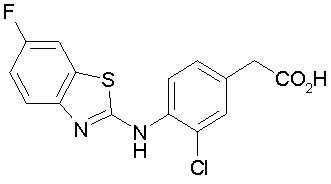
В ТГФ (5 мл) растворяют метил-(4-(2-бензотиазолил)амино-3-хлорфенил)ацетат (296 мг, 0,89 ммоль). К образовавшемуся раствору добавляют 0,5 н. NaOH (5,0 мл, 2,50 ммоль). Образовавшуюся смесь перемешивают при комнатной температуре в течение 15 часов. Реакционную смесь выливают в смесь лед - 1 н. HCl для подкисления смеси. Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при пониженном давлении, получая при этом (4-(2-бензотиазолил)амино-3-хлорфенил)уксусную кислоту (263 мг, 93%) в виде белого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 3,59 (с, 2H), 7,11-7,15 (м, 1H), 7,25-7,31 (м, 2H), 7,42 (д, J=2,0 Гц, 1H), 7,52 (д, J=8,1 Гц, 1H), 7,77 (д, J=8,1 Гц, 1H), 8,11-8,13 (м, 1H).
МС (ESI) m/z 319 (M++1).
(Стадия 3) Синтез метил-транс-4-(1-(4-(2-бензотиазолил)амино-3-хлорфенилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилата
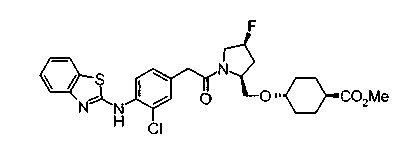
Смесь (4-(2-бензотиазолил)амино-3-хлорфенил)уксусной кислоты (263 мг, 0,83 ммоль), метил-транс-4-((4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилата (соединение, синтезированное в (стадии 3) примера 21) (214 мг, 0,83 ммоль), EDC·HCl (237 мг, 1,24 ммоль), HOBt (167 мг, 1,24 ммоль) и триэтиламин (173 мкл, 1,24 ммоль) перемешивают при комнатной температуре в течение 3 дней в ДМФ (7 мл). Реакционную смесь выливают в воду. Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при пониженном давлении. Образовавшиеся сырые кристаллы очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси хлороформ/метанол (60:1, об./об.) метил-транс-4-(1-(4-(2-бензотиазолил)амино-3-хлорфенилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилат (460 мг, 100%) получают в виде бесцветного аморфного вещества.
1H-ЯМР (CDCl3) δ: 1,18-1,32 (м, 2H), 1,39-1,53 (м, 2H), 1,97-2,51 (м, 7H), 3,21-4,01 (м, 10H), 4,20-4,25 и 4,35-4,40 (каждый м, общий 1H), 5,16-5,20 и 5,30-5,33 (каждый м, общий 1H), 7,17-7,23 (м, 2H), 7,34-7,38 (м, 2H), 7,64-7,69 (м, 2H), 8,29-8,36 (м, 1H).
МС (ESI) m/z 560 (M++1).
(Стадия 4) Синтез транс-4-(1-(4-(2-бензотиазолил))амино-3-хлорфенилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоновой кислоты
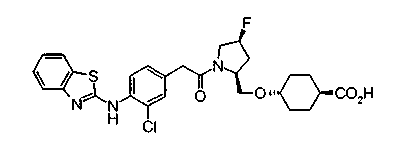
Метил-транс-4-(1-(4-(2-бензотиазолил)амино-3-хлорфенилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилат (460 мг, 0,82 ммоль) растворяют в ТГФ (5 мл). К образовавшемуся раствору добавляют 0,5 н. NaOH (5,0 мл, 2,50 ммоль) с последующим перемешиванием при комнатной температуре в течение 3 часов. Реакционную смесь выливают в смесь лед - 1 н. HCl для подкисления смеси. Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при пониженном давлении, получая при этом указанное в заголовке соединение (314 мг, 70%) в виде светло-желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 1,10-1,39 (м, 4H), 1,84-1,94 (м, 4H), 2,06-2,20 (м, 3H), 3,15-3,87 (м, 7H), 4,12 и 4,30-4,36 (каждый м, общий 1H), 5,24-5,32 и 5,38-5,45 (каждый м, общий 1H), 7,11-7,15 (м, 1H), 7,19-7,23 (м, 1H), 7,27-7,31 (м, 1H), 7,36-7,38 (м, 1H), 7,50-7,52 (м, 1H), 7,77-7,79 (м, 1H), 8,06-8,10 (м, 1H).
МС (ESI) m/z 546 (M++1);
Анал. Вычисл. для С27Н29ClFN3O4S·3/2Н2О: С, 56,59; H, 5,63; N, 7,33.
Найдено: С, 56,73; H, 5,58; N, 6,88.
Пример 57
транс-4-(1-(3-Хлор-4-(6-фтор-2-бензотиазолил)аминофенилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоновая кислота:
(Стадия 1) Синтез 2-бром-6-фторбензотиазола
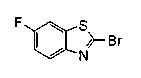
Бромид меди(I) (619 мг, 4,32 ммоль) суспендируют в ацетонитриле (10 мл). К образовавшейся суспензии добавляют трет-бутилнитрит (640 мкл, 5,38 ммоль) с последующим перемешиванием при 60°С в течение 5 минут. К реакционной смеси добавляют 2-амино-6-фторбензотиазол (605 мг, 3,60 ммоль). Образовавшуюся смесь перемешивают при 60°С в течение 10 минут. После охлаждения до комнатной температуры реакционную смесь разбавляют этилацетатом. Раствор в этилацетате промывают 1 н. HCl, насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси н-гексан/этилацетат (5:1, об./об.) 2-бром-6-фторбензотиазол (330 мг, 40%) получают в виде коричневого твердого вещества.
1H-ЯМР (CDCl3) δ: 7,19-7,24 (м, 1H), 7,49-7,52 (м, 1H), 7,92-7,96 (м, 1H).
МС (ESI) m/z 273,8 (M++1+MeCN).
(Стадия 2) Синтез метил-(3-хлор-4-(6-фтор-2-бензотиазолил)аминофенил)ацетата

В ксилоле (8 мл) 2-бром-6-фторбензотиазол (330 мг, 1,42 ммоль), метил-4-амино-3-хлорфенилацетат (284 мг, 1,42 ммоль) и п-толуолсульфонат пиридиния (PPTS) (107 мг, 0,43 ммоль) нагревают при кипячении с обратным холодильником в течение 10 часов. После охлаждения реакционную смесь перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси н-гексан/этилацетат (6:1, об./об.) метил-(3-хлор-4-(6-фтор-2-бензотиазолил)аминофенил)ацетат (158 мг, 32%) получают в виде светло-желтого твердого вещества.
1H-ЯМР (CDCl3) δ: 3,58 (с, 2H), 3,70 (с, 3H), 7,05-7,10 (м, 1H), 7,22-7,25 (м, 1H), 7,34-7,37 (м, 2H), 7,59-7,63 (м, 1H), 8,32-8,34 (м, 1H).
МС (ESI) m/z 351 (M++1).
(Стадия 3) Синтез (3-хлор-4-(6-фтор-2-бензотиазолил)аминофенил)уксусной кислоты
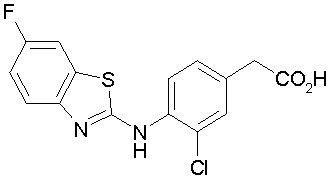
Метил-(3-хлор-4-(6-фтор-2-бензотиазолил)аминофенил)ацетат (158 мг, 0,45 ммоль) растворяют в ТГФ (3 мл). К образовавшемуся раствору добавляют 0,5 н. NaOH (3,0 мл, 1,50 моль) и образовавшуюся смесь перемешивают при комнатной температуре в течение 18 часов. Смесь выливают в смесь лед - 1 н. HCl. Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при пониженном давлении, получая при этом (3-хлор-4-(6-фтор-2-бензотиазолил)аминофенил)уксусную кислоту (127 мг, 84%) в виде светло-желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 3,59 (с, 2H), 7,11-7,15 (м, 1H), 7,25-7,27 (м, 1H), 7,41-7,42 (м, 1H), 7,50-7,53 (м, 1H), 7,70-7,73 (м, 1H), 8,12-8,14 (м, 1H), 9,97 (ушир.с, 1H), 12,42 (ушир.с, 1H).
МС (ESI) m/z 337 (M++1).
(Стадия 4) Синтез метил-транс-4-(1-(3-хлор-4-(6-фтор-2-бензотиазолил)аминофенилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилата

В ДМФ (8 мл) (3-хлор-4-(6-фтор-2-бензотиазолил)аминофенил)уксусную кислоту (127 мг, 0,38 ммоль), метил-транс-4-((4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилат (соединение, синтезированное в (стадии 3) примера 21) (98 мг, 0,38 ммоль), EDC·HCl (108 мг, 0,56 ммоль), HOBt (76 мг, 0,56 ммоль) и триэтиламин (80 мкл, 0,57 ммоль) перемешивают при комнатной температуре в течение 18 часов. Реакционную смесь выливают в воду. Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при пониженном давлении. Сырые кристаллы очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси хлороформ/метанол (60:1, об./об.) метил-транс-4-(1-(3-хлор-4-(6-фтор-2-бензотиазолил)аминофенилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилат (266 мг, 100%) получают в виде светло-желтой густой, вязкой жидкости.
1H-ЯМР (CDCl3) δ: 1,21-1,32 (м, 2H), 1,40-1,53 (м, 2H), 1,97-2,08 (м, 4H), 2,20-2,52 (м, 3H), 3,22-4,02 (м, 10H), 4,20-4,26 и 4,36-4,38 (каждый м, общий 1H), 5,18-5,21 и 5,32-5,34 (каждый м, общий 1H), 7,05-7,11 (м, 1H), 7,20-7,23 (м, 1H), 7,34-7,37 (м, 2H), 7,57-7,63 (м, 2H), 8,28-8,35 (м, 1H).
МС (ESI) m/z 578 (M++1).
(Стадия 5) Синтез транс-4-(1-(3-хлор-4-(6-фтор-2-бензотиазолил)аминофенилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоновой кислоты
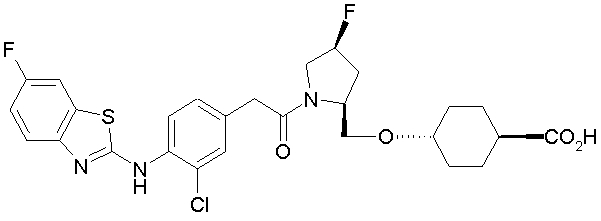
В ТГФ (мл) растворяют метил-транс-4-(1-(3-хлор-4-(6-фтор-2-бензотиазолил)аминофенилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилат (266 мг, 0,46 ммоль). К образовавшемуся раствору добавляют 0,5 н. NaOH (3,0 мл, 1,50 ммоль) с последующим перемешиванием при комнатной температуре в течение 20 часов. Реакционную смесь выливают в смесь лед - 1 н. HCl. Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при пониженном давлении, получая при этом указанное в заголовке соединение (189 мг, 73%) в виде светло-желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 1,17-1,38 (м, 4H), 1,74-2,21 (м, 7H), 3,18-3,87 (м, 7H), 4,14 и 4,33-4,35 (каждый м, общий 1H), 5,25-5,32 и 5,38-5,45 (каждый м, общий 1H), 7,12-7,23 (м, 2H), 7,37-7,38 (м, 1H), 7,51-7,54 (м, 1H), 7,71-7,74 (м, 1H), 8,09-8,13 (м, 1H), 9,94 (ушир.с, 1H).
МС (ESI) m/z 564 (M++1).
Анал. Вычисл. для С27Н28ClF2N3O4S ·1Н2O: С, 55,71; H, 5,19; N, 7,22; S, 5,51.
Найдено: C, 55,88; H, 5,25; N, 6,74; S, 5,26.
Пример 58
транс-4-(1-(3-Хлор-4-(6-метил-2-бензотиазолил)аминофенилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоновая кислота:
(Стадия 1) Синтез 2-бром-6-метилбензотиазола
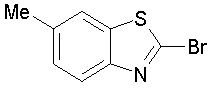
Бромид меди(I) (1,57 г, 10,9 ммоль) суспендируют в ацетонитриле (25 мл). К образовавшейся суспензии добавляют трет-бутилнитрит (1,63 мл, 13,7 ммоль). Образовавшуюся смесь перемешивают при 60°С в течение 10 минут. К реакционной смеси добавляют 2-амино-6-метилбензотиазол (1,50 г, 9,13 ммоль) с посредующим перемешиванием при 60°С в течение 1 часа. После охлаждения реакционную смесь разбавляют этилацетатом. Раствор в этилацетате промывают 1 н. HCl и насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси н-гексан/этилацетат (7:1, об./об.) 2-бром-6-метилбензотиазол (703 мг, 34%) получают в виде коричневого масла.
1H-ЯМР (CDCl3) δ: 2,47 (с, 3H), 7,27-7,29 (м, 1H), 7,58-7,59 (м, 1H), 7,84-7,87 (м, 1H).
(Стадия 2) Синтез метил-(3-хлор-4-(6-метил-2-бензотиазолил)аминофенил)ацетата
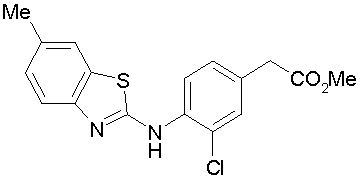
В ксилоле (10 мл) 2-бром-6-метилбензотиазол (703 мг, 3,08 ммоль), метил-4-амино-3-хлорфенилацетат (615 мг, 3,08 ммоль) и п-толуолсульфонат пиридиния (PPTS) (232 мг, 0,92 ммоль) нагревают при кипячении с обратным холодильником в течение 10 часов. После охлаждения реакционную смесь перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси н-гексан/этилацетат (6:1, об./об.) метил-(3-хлор-4-(6-метил-2-бензотиазолил)аминофенил)ацетат (274 мг, 26%) получают в виде светло-желтого твердого вещества.
1H-ЯМР (CDCl3) δ: 2,43 (с, 3H), 3,59 (с, 2H), 3,71 (с, 3H), 7,17-7,19 (м, 1H), 7,23-7,25 (м, 1H), 7,35 (м, 1H), 7,46 (с, 1H), 7,58 (д, J=8,3 Гц, 1H), 8,35 (д, J=8,3 Гц, 1H).
МС (ESI) m/z 347 (M++1).
(Стадия 3) Синтез (3-хлор-4-(6-метил-2-бензотиазолил) аминофенил)уксусной кислоты

Метил-(3-хлор-4-(6-метил-2-бензотиазолил)аминофенил)ацетат (274 мг, 0,79 ммоль) растворяют в ТГФ (5 мл). К образовавшемуся раствору добавляют 0,5 н. NaOH (5,0 мл, 2,50 ммоль) с последующим перемешиванием смеси при комнатной температуре в течение 15 часов. Реакционную смесь выливают в смесь лед - 1 н. HCl. Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при пониженном давлении, получая при этом (3-хлор-4-(6-метил-2-бензотиазолил)аминофенил)уксусную кислоту (202 мг, 77%) в виде светло-желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 2,35 (с, 3H), 3,60 (с, 2H), 7,10-7,13 (м, 1H), 7,25-7,27 (м, 1H), 7,41-7,42 (м, 2H), 7,59 (с, 1H), 8,13-8,15 (м, 1H).
(Стадия 4) Синтез метил-транс-4-(1-(3-хлор-4-(6-метил-2-бензотиазолил)аминофенилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилата
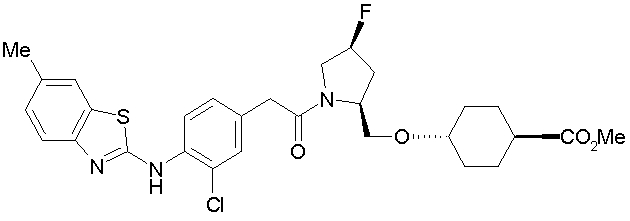
В ДМФ (5 мл) (3-хлор-4-(6-метил-2-бензотиазолил)аминофенил)уксусную кислоту (202 мг, 0,61 ммоль), метил-транс-4-((4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилат (соединение, синтезированное в (стадии 3) примера 21) (157 мг, 0,61 ммоль), EDC·HCl (175 мг, 0,91 ммоль), HOBt (123 мг, 0,91 ммоль) и триэтиламин (130 мкл, 0,93 ммоль) перемешивают при комнатной температуре в течение 24 часов. Реакционную смесь выливают в воду. Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при пониженном давлении. Сырые кристаллы очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси хлороформ/метанол (60:1, об./об.) метил-транс-4-(1-(3-хлор-4-(6-метил-2-бензотиазолил)аминофенилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилат (331 мг, 95%) получают в виде светло-желтого масла.
1H-ЯМР (CDCl3) δ: 1,18-1,32 (м, 2H), 1,39-1,53 (м, 2H), 1,96-2,11 (м, 4H), 2,19-2,51 (м, общий 6H, включая с, 3H, при δ: 2,43), 3,22-3,53 (м, 2H), 3,57-4,01 (м, 8H), 4,19-4,25 и 4,35-4,40 (каждый м, общий 1H), 5,17-5,20 и 5,30-5,33 (каждый м, общий 1H), 7,16-7,23 (м, 2H), 7,33-7,35 (м, 1H), 7,46 (с, 1H), 7,52 (ушир.с, 1H), 7,56-7,59 (м, 1H), 8,30-8,38 (м, 1H).
(Стадия 5) Синтез транс-4-(1-(3-хлор-4-(6-метил-2-бензотиазолил)аминофенилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоновой кислоты
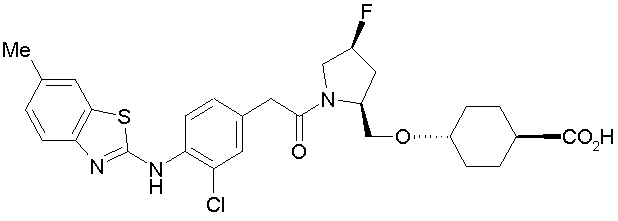
В ТГФ (3,5 мл) растворяют метил-транс-4-(1-(3-хлор-4-(6-фтор-2-бензотиазолил)аминофенилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилат (331 мг, 0,58 ммоль). К образовавшемуся раствору добавляют 0,5 н. NaOH (3,5 мл, 1,75 ммоль) с последующим перемешиванием при комнатной температуре в течение 2 дней. Реакционную смесь выливают в смесь лед - 1 н. HCl. Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при пониженном давлении, получая при этом указанное в заголовке соединение (199 мг, 62%) в виде коричневого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 1,16-1,36 (м, 4H), 1,76-1,94 (м, 4H), 2,14-2,40 (м, общий 6H, включая с, 3H, при (2,34), 3,15-3,86 (м, 7H), 4,12 и 4,32-4,33 (каждый м, общий 1H), 5,24-5,31 и 5,38-5,45 (каждый м, общий 1H), 7,09-7,11 (м, 1H), 7,19-7,22 (м, 1H), 7,35-7,49 (м, 3H), 7,57 (с, 1H), 8,10-8,12 (м, 1H).
МС (ESI) m/z 560 (M++1).
Анал. Вычисл. для С28Н31ClFN3O4S ·3/2Н2O: С, 57,28; H, 5,84; N, 7,16; S, 5,46.
Найдено: C, 57,20; H, 5,66; N, 6,91; S, 5,39.
Пример 59
транс-4-(1-(4-(6-Хлор-2-бензотиазолил)амино-3-хлорфенилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоновая кислота:
(Стадия 1) Синтез 2-бром-6-хлорбензотиазола
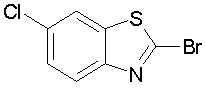
Бромид меди(I) (1,40 г, 9,76 ммоль) суспендируют в ацетонитриле (25 мл). К образовавшейся суспензии добавляют трет-бутилнитрит (1,45 мл, 12,2 ммоль) и смесь перемешивают при 60°С в течение 15 минут. К реакционной смеси добавляют 2-амино-6-хлорбензотиазол (1,50 г, 8,12 ммоль) с посредующим перемешиванием при 60°С в течение 30 минут. После охлаждения реакционную смесь разбавляют этилацетатом. Раствор в этилацетате промывают 1 н. HCl и насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси н-гексан/этилацетат (7:1, об./об.) 2-бром-6-хлорбензотиазол (1,39 г, 69%) получают в виде желтого твердого вещества.
1H-ЯМР (CDCl3) δ: 7,42-7,46 (м, 1H), 7,67-7,90 (м, 2H).
(Стадия 2) Синтез метил-(4-(6-хлор-2-бензотиазолил)амино-3-хлорфенил)ацетата
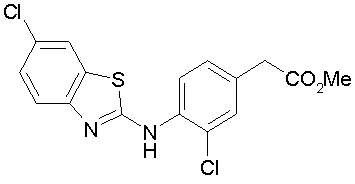
В ксилоле (10 мл) 2-бром-6-хлорбензотиазол (760 мг, 3,06 ммоль), метил-4-амино-3-хлорфенилацетат (610 мг, 3,06 ммоль) и п-толуолсульфонат пиридиния (PPTS) (230 мг, 0,92 ммоль) нагревают при кипячении с обратным холодильником в течение 1 часа. После охлаждения реакционную смесь перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси н-гексан/этилацетат (6:1, об./об.) метил-(4-(6-хлор-2-бензотиазолил)амино-3-хлорфенил)ацетат (271 мг, 24%) получают в виде светло-желтого твердого вещества.
1H-ЯМР (CDCl3) δ: 3,60 (с, 2H), 3,71 (с, 3H), 7,23-7,37 (м, 3H), 7,57-7,62 (м, 3H), 8,31-8,33 (м, 1H). (Стадия 3) Синтез (4-(6-хлор-2-бензотиазолил)амино-3-хлорфенил)уксусной кислоты
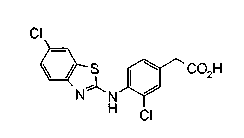
Метил-(4-(6-хлор-2-бензотиазолил)амино-3-хлорфенил)ацетат (271 мг, 0,74 ммоль) растворяют в ТГФ (4,5 мл). К образовавшемуся раствору добавляют 0,5 н. NaOH (4,5 мл, 2,25 ммоль) с последующим перемешиванием при комнатной температуре в течение 15 часов. Реакционную смесь выливают в смесь лед - 1 н. HCl. Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при пониженном давлении, получая при этом (4-(6-хлор-2-бензотиазолил)амино-3-хлорфенил)уксусную кислоту (248 мг, 95%) в виде светло-желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 3,61 (с, 2H), 7,26-7,33 (м, 2H), 7,43-7,44 (м, 1H), 7,50-7,52 (м, 1H), 7,92-7,93 (м, 1H), 8,08-8,10 (м, 1H).
(Стадия 4) Синтез метил-транс-4-(1-(4-(6-хлор-2-бензотиазолил)амино-3-хлорфенилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилата
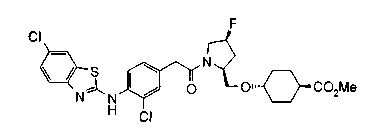
В ДМФ (6 мл) (4-(6-хлор-2-бензотиазолил)амино-3-хлорфенил)уксусную кислоту (248 мг, 0,70 ммоль), метил-транс-4-((4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилат (соединение, синтезированное в (стадии 3) примера 21) (182 мг, 0,70 ммоль), EDC·HCl (202 мг, 1,05 ммоль), HOBt (142 мг, 1,05 ммоль) и триэтиламин (150 мкл, 1,08 ммоль) перемешивают при комнатной температуре в течение 24 часов. Реакционную смесь выливают в воду. Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при пониженном давлении. Сырые кристаллы растворяют в этилацетате. Образовавшийся раствор промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси хлороформ/метанол (60:1, об./об.) метил-транс-4-(1-(4-(6-хлор-2-бензотиазолил)амино-3-хлорфенилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилат (382 мг, 92%) получают в виде бесцветного аморфного вещества.
1H-ЯМР (CDCl3) δ: 1,23-1,50 (м, 4H), 1,97-2,52 (м, 7H), 3,25-4,03 (м, 10H), 4,23-4,24 и 4,39 (каждый м, общий 1H), 5,19-5,22 и 5,33-5,35 (каждый м, общий 1H), 7,21-7,36 (м, 3H), 7,56-7,69 (м, 3H), 8,26-8,34 (м, 1H).
МС (ESI) m/z 594 (M++1).
(Стадия 5) Синтез транс-4-(1-(4-(6-хлор-2-бензотиазолил)амино-3-хлорфенилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоновой кислоты
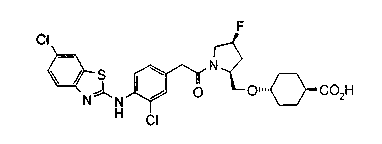
Метил-транс-4-(1-(4-(6-фтор-2-бензотиазолил)амино-3-хлорфенилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилат (382 мг, 0,64 ммоль) растворяют в ТГФ (4 мл). К образовавшемуся раствору добавляют 0,5 н. NaOH (4,0 мл, 2,00 ммоль) с последующим перемешиванием при комнатной температуре в течение 2 дней. Реакционную смесь выливают в смесь лед - 1 н. HCl. Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при пониженном давлении. Сырые кристаллы очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси хлороформ/метанол (от 30:1 до 15:1), об./об.) указанное в заголовке соединение (320 мг, 86%) получают в виде светло-желтого аморфного вещества.
1H-ЯМР (ДМСО-d6) δ: 1,16-1,36 (м, 4H), 1,87-2,20 (м, 7H), 3,15-3,87 (м, 7H), 4,13 и 4,32-4,34 (каждый м, общий 1H), 5,24-5,32 и 5,38-5,45 (каждый м, общий 1H), 7,21-7,23 (м, 1H), 7,29-7,32 (м, 1H), 7,37-7,38 (м, 1H), 7,48-7,51 (м, 1H), 7,92 (с, 1H), 8,05-8,09 (м, 1H).
МС (ESI) m/z 580 (M++1).
Анал. Вычисл. для С27Н28ClFN3O4S ·2H2О: C, 52,60; H, 5,23; N, 6,82; S, 5,20.
Найдено: С, 52,37; H, 4,65; N, 6,62; S, 5,16.
Пример 60
транс-4-(1-(4-(4-Хлор-2-бензотиазолил)амино-3-хлорфенилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоновая кислота:
(Стадия 1) Синтез 2-бром-4-хлорбензотиазола
Бромид меди(I) (1,40 г, 9,76 ммоль) суспендируют в ацетонитриле (25 мл). К образовавшейся суспензии добавляют трет-бутилнитрит (1,45 мл, 12,2 ммоль) и смесь перемешивают при 60°С в течение 10 минут. К реакционной смеси добавляют 2-амино-4-хлорбензотиазол (1,50 г, 8,12 ммоль) с последующим перемешиванием при 60°С в течение 2 часов. После охлаждения реакционную смесь разбавляют этилацетатом. Раствор в этилацетате промывают 1 н. HCl и насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси н-гексан/этилацетат (7:1, об./об.) 2-бром-4-хлорбензотиазол (1,32 г, 65%) получают в виде светло-желтого твердого вещества.
1H-ЯМР (CDCl3) δ: 7,33-7,38 (м, 1H), 7,49-7,53 (м, 1H), 7,67-7,71 (м, 1H).
(Стадия 2) Синтез метил-(4-(4-хлор-2-бензотиазолил)амино-3-хлорфенил)ацетата
В ксилоле (7 мл) 2-бром-4-хлорбензотиазол (647 мг, 2,60 ммоль), метил-4-амино-3-хлорфенилацетат (520 мг, 2,60 ммоль) и п-толуолсульфонат пиридиния (PPTS) (200 мг, 0,80 ммоль) нагревают при кипячении с обратным холодильником в течение 7 часов. После охлаждения реакционную смесь перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси н-гексан/этилацетат (6:1, об./об.) метил-(4-(4-хлор-2-бензотиазолил)амино-3-хлорфенил)ацетат (556 мг, 58%) получают в виде светло-желтого аморфного вещества.
1H-ЯМР (CDCl3) δ: 3,61 (с, 2H), 3,72 (с, 3H), 7,10-7,14 (м, 1H), 7,27-7,29 (м, 1H), 7,39-7,41 (м, 2H), 7,54-7,56 (м, 1H), 7,75 (ушир.с, 1H), 8,25-8,27 (м, 1H).
(Стадия 3) Синтез (4-(4-хлор-2-бензотиазолил)амино-3-хлорфенил)уксусной кислоты
В ТГФ (5 мл) растворяют метил-(4-(4-хлор-2-бензотиазолил)амино-3-хлорфенил)ацетат (556 мг, 1,51 ммоль). К образовавшемуся раствору добавляют 1 н. NaOH (4,5 мл, 4,50 ммоль) с последующим перемешиванием при комнатной температуре в течение 20 часов. Смесь выливают в смесь лед - 1 н. HCl. Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при пониженном давлении, получая при этом (4-(4-хлор-2-бензотиазолил)амино-3-хлорфенил)уксусную кислоту (468 мг, 88%) в виде светло-желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 3,63 (с, 2H), 7,12-7,16 (м, 1H), 7,29-7,31 (м, 1H), 7,38-7,41 (м, 1H), 7,46-7,47 (м, 1H), 7,76-7,78 (м, 1H), 8,18-8,21 (м, 1H), 10,26 (ушир.с, 1H), 12,45 (ушир.с, 1H).
(Стадия 4) Синтез метил-транс-4-(1-(4-(4-хлор-2-бензотиазолил)амино-3-хлорфенилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилата
В ДМФ (7 мл) (4-(4-хлор-2-бензотиазолил)амино-3-хлорфенил)уксусную кислоту (258 мг, 0,73 ммоль), метил-транс-4-((4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилат (соединение, синтезированное в (стадии 3) примера 21) (189 мг, 0,73 ммоль), EDC·HCl (210 мг, 1,10 ммоль), HOBt (148 мг, 1,10 ммоль) и триэтиламин (155 мкл, 1,11 ммоль) перемешивают при комнатной температуре в течение 14 часов. Смесь выливают в воду. Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при пониженном давлении. Сырые кристаллы очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси н-гексан-этилацетат (от 1:1 до 1:2, об./об.) метил-транс-4-(1-(4-(4-хлор-2-бензотиазолил)амино-3-хлорфенилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилат (430 мг, 99%) получают в виде бесцветного аморфного вещества.
1H-ЯМР (CDCl3) δ: 1,24-1,50 (м, 4H), 2,01-2,29 (м, 7H), 3,27-3,89 (м, 10H), 4,23-4,24 и 4,40 (каждый м, общий 1H), 5,20 и 5,35 (каждый м, общий 1H), 7,10-7,24 (м, 2H), 7,37-7,40 (м, 2H), 7,54-7,56 (м, 1H), 7,77 (м, 1H), 8,21-8,29 (м, 1H).
МС (ESI) m/z 594 (M++1). (Стадия 5) Синтез транс-4-(1-(4-(4-хлор-2-бензотиазолил)амино-3-хлорфенилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоновой кислоты
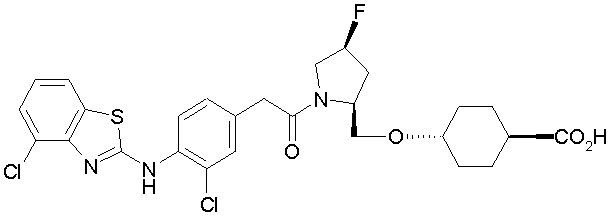
Метил-транс-4-(1-(4-(4-фтор-2-бензотиазолил)амино-3-хлорфенилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилат (430 мг, 0,72 ммоль) растворяют в ТГФ (4 мл). К образовавшемуся раствору добавляют 0,5 н. NaOH (4,2 мл, 2,10 ммоль) с последующим перемешиванием при комнатной температуре в течение 13 часов. Реакционную смесь выливают в смесь лед - 1 н. HCl. Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при пониженном давлении, получая при этом указанное в заголовке соединение (375 мг, 89%) в виде светло-желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 1,13-1,37 (м, 4H), 1,86-1,95 (м, 4H), 2,08-2,33 (м, 3H), 3,16-3,88 (м, 7H), 4,13 и 4,34-4,36 (каждый м, общий 1H), 5,25-5,34 и 5,39-5,46 (каждый м, общий 1H), 7,11-7,15 (м, 1H), 7,23-7,26 (м, 1H), 7,38-7,41 (м, 2H), 7,75-7,77 (м, 1H), 8,14-8,18 (м, 1H), 10,23 (ушир.с, 1H), 12,05 (ушир.с, 1H).
МС (FAB) m/z 580 (M++1).
Анал. Вычисл. для С27Н28Cl2FN3O4S ·1/2Н2O: С, 55,01; H, 4,96; N, 7,13; S, 5,44.
Найдено: C, 54,73; H, 5,00; N, 6,70; S, 5,28.
Пример 61
транс-4-(1-(4-(2-Бензотиазолил)амино-5-хлор-2-фторфенилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоновая кислота:
(Стадия 1) Синтез 2-бромбензотиазола

Бромид меди(I) (1,93 г, 13,5 ммоль) суспендируют в ацетонитриле (30 мл). К образовавшейся суспензии добавляют трет-бутилнитрит (2,00 мл, 16,8 ммоль) и смесь перемешивают при 60°С в течение 15 минут. К реакционной смеси добавляют 2-аминобензотиазол (1,68 г, 11,2 ммоль) и смесь перемешивают при 60°С в течение 1 часа. После охлаждения реакционную смесь выливают в 1 н. HCl с последующей экстракцией этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси н-гексан/этилацетат (7:1, об./об.) 2-бромбензотиазол (1,36 г, 57%) получают в виде коричневого масла.
1H-ЯМР (CDCl3) δ: 7,39-7,51 (м, 2H), 7,77-7,82 (м, 1H), 7,94-8,00 (м, 1H).
(Стадия 2) Синтез метил-(4-(2-бензотиазолил)амино-5-хлор-2-фторфенил)ацетата
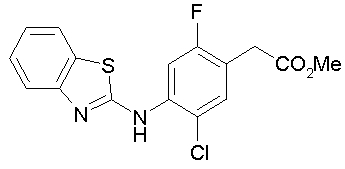
В ксилоле (10 мл) 2-бромбензотиазол (740 мг, 3,46 ммоль), метил-4-амино-3-хлор-2-фторфенилацетат (800 мг, 3,45 ммоль) и п-толуолсульфонат пиридиния (PPTS) (1,13 г, 4,50 ммоль) нагревают при кипячении с обратным холодильником в течение 10 часов. После охлаждения реакционную смесь перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси н-гексан/этилацетат (7:1, об./об.) метил-(4-(2-бензотиазолил)амино-5-хлор-2-фторфенил)ацетат (559 мг, 44%) получают в виде коричневого твердого вещества.
1H-ЯМР (CDCl3) δ: 1,26-1,30 (м, 3H), 3,62 (с, 2H), 4,10 (ушир.с, 1H), 4,15-4,21 (м, 2H), 7,21-7,42 (м, 3H), 7,67-7,76 (м, 2H), 8,47-8,50 (м, 1H).
МС (ESI) m/z 365 (M++1).
(Стадия 3) Синтез (4-(2-бензотиазолил)амино-5-хлор-2-фтор-фенил)уксусной кислоты
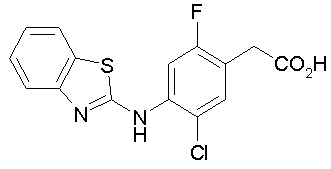
Метил-(4-(2-бензотиазолил)амино-5-хлор-2-фторфенил)ацетат (613 мг, 1,68 ммоль) растворяют в ТГФ (5 мл). К образовавшемуся раствору добавляют 1 н. NaOH (5,0 мл, 5,00 ммоль). Образовавшуюся смесь перемешивают при комнатной температуре в течение 17 часов. К реакционной смеси добавляют воду. Смесь промывают эфиром. Водный слой выливают в смесь лед - 1 н. HCl для подкисления водного слоя. Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при пониженном давлении, получая при этом (4-(2-бензотиазолил)амино-5-хлор-2-фторфенил)уксусную кислоту (464 мг, 82%) в виде светло-желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 3,63 (с, 2H), 7,17-7,21 (м, 1H), 7,32-7,39 (м, 1H), 7,52-7,54 (м, 1H), 7,61-7,63 (м, 1H), 7,82-7,84 (м, 1H), 8,38 (м, 1H), 10,17 (ушир.с, 1H), 12,52 (ушир.с, 1H).
(Стадия 4) Синтез метил-транс-4-(1-(4-(2-бензотиазолил)амино-5-хлор-2-фторфенилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилата
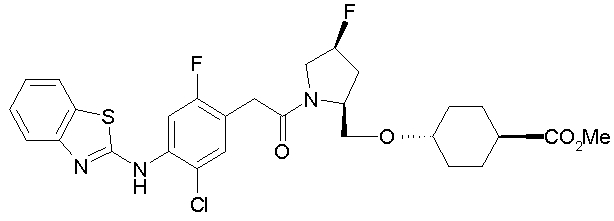
В ДМФ (8 мл) (4-(2-бензотиазолил)амино-5-хлор-2-фторфенил)уксусную кислоту (290 мг, 0,86 ммоль), метил-транс-4-((4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилат (соединение, синтезированное в (стадии 3) примера 21) (223 мг, 0,86 ммоль), EDC·HCl (247 мг, 1,29 ммоль), HOBt (174 мг, 1,29 ммоль) и триэтиламин (180 мкл, 1,29 ммоль) перемешивают при комнатной температуре в течение 15 часов. Реакционную смесь выливают в воду. Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении и промывают водой. Сырые кристаллы растворяют в этилацетате. Раствор промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси н-гексан/этилацетат (1:1, об./об.) метил-транс-4-(1-(4-(2-бензотиазолил)амино-5-хлор-2-фторфенилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилат (362 мг, 73%) получают в виде бесцветного аморфного вещества.
1H-ЯМР (CDCl3) δ: 1,21-1,53 (м, 4H), 1,97-2,54 (м, 1Н), 3,23-4,02 (м, 10H), 4,28-4,41 (м, 1H), 5,20-5,24 и 5,34-5,38 (каждый м, общий 1H), 7,21-7,30 (м, 1H), 7,35-7,44 (м, 2H), 7,63-7,83 (м, 3H), 8,42-8,50 (м, 1H).
МС (ESI) m/z 578 (M++1).
(Стадия 5) Синтез транс-4-(1-(4-(2-бензотиазолил)амино-5-хлор-2-фторфенилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоновой кислоты

В ТГФ (4 мл) растворяют метил-транс-4-(1-(4-(2-бензотиазолил)амино-5-хлор-2-фторфенилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилат (362 мг, 0,63 ммоль). К образовавшемуся раствору добавляют 0,5 н. NaOH (4,0 мл, 2,00 ммоль). Образовавшуюся смесь перемешивают при комнатной температуре в течение 1 часа. Реакционную смесь выливают в смесь лед - 1 н. HCl с последующей экстракцией этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси хлороформ/метанол (от 60:1 до 30:1), об./об.) указанное в заголовке соединение (299 мг, 85%) получают в виде бесцветного аморфного вещества.
1H-ЯМР (ДМСО-d6) δ: 1,16-1,38 (м, 4H), 1,89-2,23 (м, 7H), 3,17-3,93 (м, 7H), 4,13 и 4,34-4,36 (каждый м, общий 1H), 5,26-5,35 и 5,40-5,48 (каждый м, общий 1H), 7,17-7,21 (м, 1H), 7,32-7,36 (м, 1H), 7,40-7,45 (м, 1H), 7,61-7,63 (м, 1H), 7,82-7,84 (м, 1H), 8,32-8,34 (м, 1H).
МС (ESI) m/z 564 (M++1).
Анал. Вычисл. для С27Н28ClF2N3O4S ·2H2О: C, 54,04; H, 5,37; N, 7,00; S, 5,34.
Найдено: C, 53,80; H, 4,63; N, 6,86; S, 5,17.
Пример 62
транс-4-(1-(3-Хлор-4-(5-фтор-2-бензотиазолил)аминофенилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоновая кислота:
(Стадия 1) Синтез 2-бром-5-фторбензотиазола
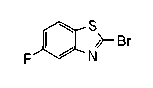
Бромид меди(I) (1,26 г, 7,31 ммоль) суспендируют в ацетонитриле (25 мл). К образовавшейся суспензии добавляют трет-бутилнитрит (1,47 мл, 10,9 ммоль) и смесь перемешивают при 60°С в течение 10 минут. К реакционной смеси добавляют 2-амино-5-фторбензотиазол (1,23 г, 7,31 ммоль) с последующим перемешиванием при 60°С в течение 60 минут.После охлаждения реакционную смесь выливают в 1 н. HCl. Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении. Сырые кристаллы растворяют в этилацетате. Раствор очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси н-гексан/этилацетат (7:1, об./об.) 2-бром-5-фторбензотиазол (1,07 г, 63%) получают в виде желтого твердого вещества.
1H-ЯМР (CDCl3) δ: 7,18-7,23 (м, 1H), 7,64-7,77 (м, 2H).
(Стадия 2) Синтез метил-(3-хлор-4-(5-фтор-2-бензотиазолил)аминофенил)ацетата
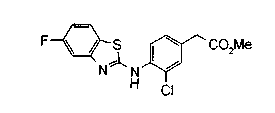
В ксилоле (5 мл) 2-бром-5-фторбензотиазол (516 мг, 2,22 ммоль), метил-4-амино-3-хлорфенилацетат (444 мг, 2,22 ммоль) и п-толуолсульфонат пиридиния (PPTS) (168 мг, 0,67 ммоль) нагревают при кипячении с обратным холодильником в течение 10 часов. После охлаждения реакционную смесь перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси н-гексан/этилацетат (7:1, об./об.) метил-(3-хлор-4-(5-фтор-2-бензотиазолил)аминофенил)ацетат (292 мг, 37%) получают в виде бледно-желтого масла.
1H-ЯМР (CDCl3) δ: 3,61 (с, 2H), 3,72 (с, 3H), 6,93-6,98 (м, 1H), 7,25-7,27 (м, 1H), 7,37-7,41 (м, 2H), 7,55-7,58 (м, 1H), 7,65 (ушир.с, 1H), 8,31-8,33 (м, 1H).
(Стадия 3) Синтез (3-хлор-4-(5-фтор-2-бензотиазолил)аминофенил)уксусной кислоты
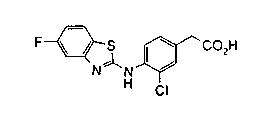
В ТГФ (5 мл) растворяют метил-(3-хлор-4-(5-фтор-2-бензотиазолил)аминофенил)ацетат (292 мг, 0,83 ммоль). К образовавшемуся раствору добавляют 0,5 н. NaOH (5,0 мл, 2,50 ммоль). Образовавшуюся смесь перемешивают при комнатной температуре в течение 2 часов. Реакционную смесь выливают в смесь лед - 1 н. HCl. Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при пониженном давлении, получая при этом (3-хлор-4-(5-фтор-2-бензотиазолил)аминофенил)уксусную кислоту (226 мг, 81%) в виде тусклого твердого вещества.
1H-ЯМР (ДМСО-d6) §: 3,61 (с, 2H), 6,98-7,03 (м, 1H), 7,27 (дд, J=2,0, 8,3 Гц, 1H), 7,34-7,37 (м, 1H), 7,44 (д, J=2,0 Гц, 1H), 7,78-7,82 (м, 1H), 8,05 (д, J=8,3 Гц, 1H).
(Стадия 4) Синтез метил-транс-4-(1-(3-хлор-4-(5-фтор-2-бензотиазолил)аминофенилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилата
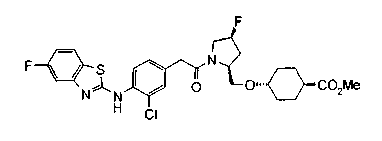
В ДМФ (5 мл) (3-хлор-4-(5-фтор-2-бензотиазолил)амино-фенил)уксусную кислоту (216 мг, 0,64 ммоль), метил-транс-4-((4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилат (соединение, синтезированное в (стадии 3) примера 21) (166 мг, 0,64 ммоль), EDC·HCl (184 мг, 0,96 ммоль), HOBt (130 мг, 0,96 ммоль) и триэтиламин (134 мкл, 0,96 ммоль) перемешивают при комнатной температуре в течение 2 дней. Реакционную смесь выливают в воду. Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении. Сырые кристаллы растворяют в этилацетате. Раствор промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси н-гексан/этилацетат (от 1:1 до 1:2, об./об.) метил-транс-4-(1-(3-хлор-4-(5-фтор-2-бензотиазолил)аминофенилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилат (355 мг, 96%) получают в виде бесцветного аморфного вещества.
1H-ЯМР (CDCl3) δ: 1,18-1,32 (м, 2H), 1,39-1,53 (м, 2H), 1,97-2,52 (м, 7H), 3,22-3,37 и 3,48-3,54 (каждый м, общий 2H), 3,58-4,02 (м, 8H), 4,21-4,26 и 4,35-4,41 (каждый м, общий 1H), 5,18-5,23 и 5,31-5,35 (каждый м, общий 1H), 6,92-6,98 (м, 1H), 7,21-7,25 (м, 1H), 7,36-7,40 (м, 2H), 7,54-7,58 (м, 1H), 7,65 (ушир.с, 1H), 8,26-8,34 (м, 1H).
(Стадия 5) Синтез транс-4-(1-(3-хлор-4-(5-фтор-2-бензотиазолил)аминофенилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоновой кислоты
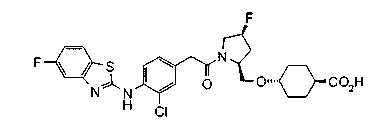
В ТГФ (4 мл) растворяют метил-транс-4-(1-(3-хлор-4-(5-фтор-2-бензотиазолил)аминофенилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилат (355 мг, 0,61 ммоль). К образовавшемуся раствору добавляют 0,5 н. NaOH (4,0 мл, 2,00 ммоль) с последующим перемешиванием при комнатной температуре в течение 20 часов. Реакционную смесь выливают в смесь лед -1 н. HCl. Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при пониженном давлении, получая при этом указанное в заголовке соединение (287 мг, 83%) в виде белого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 1,16-1,38 (м, 4H), 1,78-1,95 (м, 4H), 2,15-2,21 (м, 3H), 3,16-3,88 (м, 7H), 4,13 и 4,34-4,35 (каждый м, общий 1H), 5,26-5,33 и 5,39-5,46 (каждый м, общий 1H), 6,98-7,02 (м, 1H), 7,23-7,24 (м, 1H), 7,34-7,39 (м, 2H), 7,78-7,82 (м, 1H), 8,01-8,05 (м, 1H), 10,11 (ушир.с, 1H), 12,06 (ушир.с, 1H).
МС (LC) m/z 564,4 (M++1).
Анал. Вычисл. для С27Н28ClF2N3O4S ·1H2O: C, 55,71; H, 5,19; N, 7,22; S, 5,51.
Найдено: C, 56,00; H, 4,99; N, 6,89; S, 5,38.
Пример 63
транс-4-(1-(5-Хлор-4-(5-фтор-2-бензотиазолил)амино-2-фторфенилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоновая кислота:
(Стадия 1) Синтез 2-бром-5-фторбензотиазола
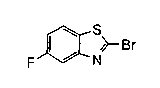
Бромид меди(I) (1,26 г, 7,31 ммоль) суспендируют в ацетонитриле (25 мл). К образовавшейся суспензии добавляют трет-бутилнитрит (1,47 мл, 10,9 ммоль) и смесь перемешивают при 60°С в течение 10 минут. К реакционной смеси добавляют 2-амино-5-фторбензотиазол (1,23 г, 7,31 ммоль) с последующим перемешиванием при 60°С в течение 60 минут. После охлаждения реакционную смесь выливают в 1 н. HCl. Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении. Сырые кристаллы растворяют в этилацетате. Образовавшийся раствор промывают последовательно 1 н. HCl и насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси н-гексан/этилацетат (7:1, об./об.) 2-бром-5-фторбензотиазол (1,07 г, 63%) получают в виде желтого твердого вещества.
1H-ЯМР (CDCl3) δ: 7,18-7,23 (м, 1H), 7,64-7,77 (м, 2H).
(Стадия 2) Синтез этил-(5-хлор-(4-(5-фтор-2-бензотиазолил)амино-2-фторфенил)ацетата
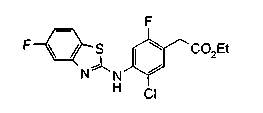
В ксилоле (5 мл) 2-бром-5-фторбензотиазол (548 мг, 2,36 ммоль), этил-4-амино-5-хлор-2-фторфенилацетат (547 мг, 2,36 ммоль) и п-толуолсульфонат пиридиния (PPTS) (178 мг, 0,71 ммоль) нагревают при кипячении с обратным холодильником в течение 3 часов. После охлаждения реакционную смесь перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси н-гексан/этилацетат (7:1, об./об.) этил-(5-хлор-(4-(5-фтор-2-бензотиазолил)амино-2-фторфенил)ацетат (298 мг, 33%) получают в виде бледно-желтого твердого вещества.
1H-ЯМР (CDCl3) δ: 1,28 (т, J=7,1 Гц, 3H), 3,61 (с, 2H), 4,17 (кв., J=7,l Гц, 2H), 6,95-6,98 (м, 1H), 7,28-7,30 (м, 1H), 7,39-7,42 (м, 1H), 7,54-7,57 (м, 1H), 7,69 (ушир.с, 1H), 8,40-8,43 (м, 1H).
(Стадия 3) Синтез (5-хлор-4-(5-фтор-2-бензотиазолил)амино-2-фторфенил)уксусной кислоты
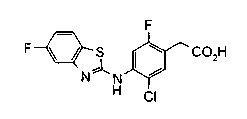
Этил-(5-хлор-(4-(5-фтор-2-бензотиазолил)амино-2-фторфенил)ацетат (298 мг, 0,78 ммоль) растворяют в ТГФ (5 мл). К образовавшемуся раствору добавляют 0,5 н. NaOH (5,0 мл, 2,50 ммоль). Образовавшуюся смесь перемешивают при комнатной температуре в течение 3 часов. Реакционную смесь выливают в смесь лед - 1 н. HCl. Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при пониженном давлении, получая при этом (5-хлор-4-(5-фтор-2-бензотиазолил)амино-2-фторфенил)уксусную кислоту (237 мг, 86%) в виде светло-желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 3,64 (с, 2H), 7,03-7,08 (м, 1H), 7,45-7,55 (м, 2H), 7,83-7,86 (м, 1H), 8,28-8,31 (м, 1H), 10,26 (ушир.с, 1H), 12,56 (ушир.с, 1H).
(Стадия 4) Синтез метил-транс-4-(1-(5-хлор-4-(5-фтор-2-бензотиазолил)амино-5-2-фторфенилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилата
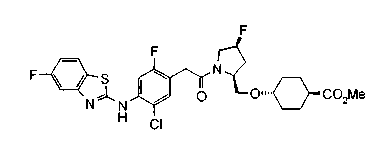
В ДМФ (5 мл) (5-хлор-(4-(5-фтор-2-бензотиазолил)амино-2-фторфенил)уксусную кислоту (233 мг, 0,66 ммоль), метил-транс-4-((4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилат (соединение, синтезированное в (стадии 3) примера 21) (170 мг, 0,66 ммоль), EDC·HCl (189 мг, 0,99 ммоль), HOBt (133 мг, 0,98 ммоль) и триэтиламин (137 мкл, 0,98 ммоль) перемешивают при комнатной температуре в течение 3 часов. Реакционную смесь выливают в воду. Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении. Сырые кристаллы растворяют в этилацетате. Образовавшийся раствор промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси н-гексан/этилацетат (от 1:1 до 1:2, об./об.) метил-транс-4-(1-(5-хлор-4-(5-фтор-2-бензотиазолил)амино-2-фторфенилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилат (368 мг, 94%) получают в виде светло-желтого аморфного вещества.
1H-ЯМР (CDCl3) δ: 1,22-1,33 (м, 2H), 1,39-1,53 (м, 2H), 1,96-2,18 (м, 4H), 2,22-2,53 (м, 3H), 3,23-4,03 (м, 10H), 4,27-4,31 и 4,37 (каждый м, общий 1H), 5,19 и 5,23-5,37 (каждый м, общий 1H), 6,95-6,99 (м, 1H), 7,36-7,44 (м, 2H), 7,56-7,59 (м, 1H), 7,65 (ушир.с, 1H), 8,34-8,43 (м, 1H).
(Стадия 5) Синтез транс-4-(1-(5-хлор-4-(5-фтор-2-бензотиазолил)амино-2-фторфенилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоновой кислоты
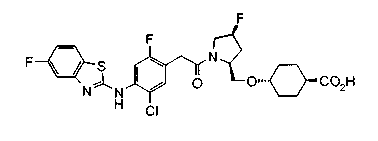
В ТГФ (4 мл) растворяют метил-транс-4-(1-(5-хлор-4-(5-фтор-2-бензотиазолил)амино-2-фторфенилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилат (368 мг, 0,62 ммоль). К образовавшемуся раствору добавляют 0,5 н. NaOH (4,0 мл, 2,00 ммоль) с последующим перемешиванием при комнатной температуре в течение 2 часов. Реакционную смесь выливают в смесь лед - 1 н. HCl. Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при пониженном давлении, получая при этом указанное в заголовке соединение (266 мг, 74%) в виде светло-желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 1,18-1,38 (м, 4H), 1,86-1,99 (м, 4H), 2,10-2,21 (м, 3H), 3,17-4,02 (м, 7H), 4,13 и 4,35-4,36 (каждый м, общий 1H), 5,26-5,35 и 5,40-5,48 (каждый м, общий 1H), 7,03-7,08 (м, 1H), 7,41-7,48 (м, 2H), 7,83-7,87 (м, 1H), 8,25-8,27 (м, 1H).
МС (LC) m/z 582,4 (M++1), 580,4 (M+-1).
Анал. Вычисл. для С27Н27ClF3N3O4S ·1/2Н2О: С, 54,87; H, 4,77; N, 7,11; S, 5,43.
Найдено: C, 54,68; H, 4,62; N, 6,85; S, 5,45.
Пример 64
транс-4-(1-((3-Бром-4-((3-индолилкарбонил)амино)фенил)ацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоновая кислота:
(Стадия 1) Синтез этил-(3-бром-4-((3-индолилкарбонил)аминофенил)ацетата
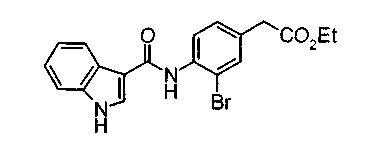
В ДМФ (20 мл) растворяют индол-3-карбоновую кислоту (1,00 г, 6,21 ммоль) и 4-амино-3-бромфенилуксусную кислоту (1,60 г, 6,21 ммоль). К образовавшемуся раствору добавляют EDC·HCl (1,43 г, 7,45 ммоль) при перемешивании при комнатной температуре. После перемешивания реакционной смеси при комнатной температуре в течение 4 часов в нее добавляют воду с последующей экстракцией этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций этилацетата этил-(3-бром-4-((3-индолилкарбонил)амино)фенил)ацетат (664 мг, 27%) получают в виде светло-желтого твердого вещества.
1H-ЯМР (CDCl3) δ: 1,29 (т, J=7,1 Гц, 3H), 3,59 (с, 2H), 4,19 (кв., J=7,1 Гц, 2H), 7,24-7,33 (м, 3H), 7,41-7,51 (м, 2H), 7,82 (д, J=2,7 Гц, 1H), 8,20 (м, 1H), 8,31 (ушир.с, 1H), 8,48 (д, J=8,6 Гц, 1H), 9,35 (ушир.с, 1H).
(Стадия 2) Синтез (3-бром-4-((3-индолилкарбонил)амино)фенил)уксусной кислоты
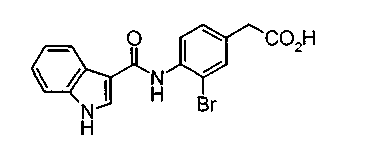
Этил-(3-бром-4-((3-индолилкарбонил)амино)фенил)ацетат (664 мг, 1,65 ммоль) растворяют в ТГФ (17 мл). К образовавшемуся раствору добавляют 0,25 н. NaOH (10,0 мл, 2,48 ммоль). После перемешивания при комнатной температуре в течение 24 часов реакционную смесь выливают в 1 н. HCl для подкисления смеси. Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при пониженном давлении, получая при этом (3-бром-4-((3-индолилкарбонил)амино)фенил)уксусную кислоту (341 мг, 55%) в виде коричневого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 3,62 (с, 2H), 7,13-7,21 (м, 2H), 7,29 (дд, J=8,3, 1,7 Гц, 1H), 7,47 (д, J=8,3 Гц, 1H), 7,60 (д, J=1,7 Гц, 1H), 7,63 (д, J=8,3 Гц, 1H), 8,14 (д, J=7,6 Гц, 1H), 8,27 (д, J=3,2 Гц, 1H), 9,27 (с, 1H).
МС (ESI) m/z 373 (M++1), 375 (M++3).
(Стадия 3) Синтез метил-транс-4-(1-((3-бром-4-((3-индолилкарбонил)амино)фенил)ацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилата
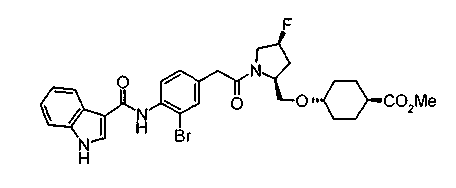
К раствору (3-бром-4-((3-индолилкарбонил)амино)фенил)уксусной кислоты (341 мг, 0,91 ммоль), метил-транс-4- ((4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилата (соединение, синтезированное в (стадии 3) примера 21) (237 мг, 0,91 ммоль), HOBt (25,0 мг, 0,18 ммоль) и DMAP (22,0 мг, 0,13 ммоль) в ДМФ (5,0 мл) добавляют EDC·HCl (228 мг, 1,19 ммоль) при перемешивании при комнатной температуре. После перемешивания реакционной смеси при комнатной температуре в течение 20 часов добавляют в нее воду. Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при пониженном давлении, получая при этом метил-транс-4-(1-((3-бром-4-((3-индолилкарбонил)амино)фенил)ацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилат (500 мг, 89%) в виде бесцветного твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 1,15-1,28 (м, 2H), 1,32-1,45 (м, 2H), 1,87-2,33 (м, 7H), 3,21 (м, 1H), 3,46 (м, 1H), 3,57 (с, 3H), 3,59-3,93 (м, 5H), 4,16 и 4,34 (каждый м, общий 1H), 5,31 и 5,38 (каждый м, общий 1H), 7,12-7,20 (м, 2H), 7,24 (м, 1H), 7,47 (д, J=7,67 Гц, 1H), 7,54 и 7,56 (каждый д, J=1,5 Гц, общий 1H), 7,62 и 7,64 (каждый д, J=8,3 Гц, общий 1H), 8,14 (д, J=7,6 Гц, 1H), 8,26 (с, 1H), 9,24 (с, 1H), 11,73 (ушир.с, 1H).
МС (ESI) m/z 614 (M++1), 616 (M++3).
(Стадия 4) Синтез транс-4-(1-((3-бром-4-((3-индолилкарбонил)амино)фенил)ацетил)-(4S)-фтор-(2S)-пирролидинлметокси)циклогексанкарбоновой кислоты
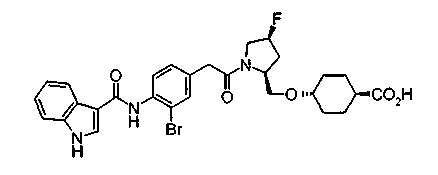
В ТГФ (28 мл) растворяют метил-транс-4-(1-((3-бром-(3-индолилкарбонил)амино)фенил)ацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилат (500 мг, 0,81 ммоль). К образовавшемуся раствору добавляют 0,25 н. NaOH (5,00 мл, 1,25 ммоль) с последующим перемешиванием при комнатной температуре в течение 3 часов. К реакционной смеси добавляют смесь метанол-воду (1:1, об./об.; 10 мл). После перемешивания образовавшейся смеси в течение 1 часа растворитель отгоняют при пониженном давлении. К остатку добавляют воду и затем смесь подкисляют 1 н. HCl (10 мл). Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при пониженном давлении, получая при этом указанное в заголовке соединение (390 мг, 80%) в виде светло-желтого твердого вещества.
ИК (ATR) ν 3411, 3208, 2938, 2861, 1691, 1627, 1509, 1432 см-1;
1H ЯМР (ДМСО-d6) δ: 1,19-1,42 (м, 4H), 1,87-2,28 (м, 7H), 3,19 (м, 1H), 3,42-3,93 (м, 6H), 4,14 и 4,34 (каждый м, общий 1H), 5,32 и 5,38 (каждый м, общий 1H), 7,12-7,21 (м, 2H), 7,24 (м, 1H), 7,47 (д, J=7,5 Гц, 1H), 7,54 и 7,56 (каждый д, J=1,7 Гц, общий 1H), 7,62 и 7,64 (каждый д, J=8,0 Гц, общий 1H), 8,14 (д, J=7,5 Гц, 1H), 8,26 (д, J=2,9 Гц, 1H), 9,24 (с, 1H), 11,73 (ушир.с, 1H), 12,01 (ушир.с, 1H).
МС (ESI) m/z 600 (M++1), 602 (M++3);
Анал. Вычисл. для C29H31BrFN3О5·H2О: C, 56,32; H, 5,38; N, 6,79, Найдено: C, 56,10; H, 5,32; N, 6,68.
Пример 65
транс-4-(1-((5-Хлор-2-фтор-4-((1-метил-3-индолилкарбонил)амино)фенил)ацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоновая кислота:
(Стадия 1) Синтез метил-транс-4-(1-((5-хлор-2-фтор-4-((1-метил-3-индолилкарбонил)амино)фенил)ацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилата
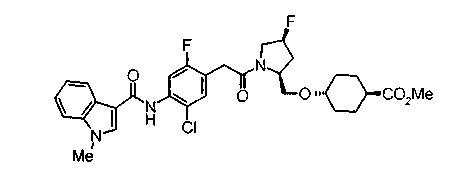
К раствору (5-хлор-2-фтор-4-((1-метил-3-индолилкарбонил)амино)фенил)уксусной кислоты (210 мг, 0,58 ммоль), метил-транс-4-((4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилата (соединение, синтезированное в (стадии 3) примера 21) (151 мг, 0,58 ммоль), HOBt (16,0 мг, 0,12 ммоль) и DMAP (14,0 мг, 0,12 ммоль) в ДМФ (6,0 мл) добавляют EDC·HCl (167 мг, 0,87 ммоль) при перемешивании при комнатной температуре. Реакционную смесь перемешивают далее в течение 13 часов при комнатной температуре. Реакционную смесь разбавляют водой с последующей экстракцией этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, в результате чего метил-транс-4-(1-((5-хлор-2-фтор-4-((1-метил-3-индолилкарбонил)амино)фенил)ацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилат (354 мг, 100%) получают в виде светло-желтого аморфного вещества.
1H-ЯМР (CDCl3) δ: 1,20-1,28 (м, 2H), 1,31-1,52 (м, 2H), 1,96-2,52 (м, 7H), 3,25 (м, 1H), 3,34 и 3,52 (каждый м, общий 1H), 3,57 (м, 1H), 3,64 и 3,66 (каждый с, общий 3H), 3,71-3,99 (м, 7H, включая синглет, 3H, при (3,87), 4,28 и 4,36 (каждый м, общий 1H), 5,25 и 5,29 (каждый м, общий 1H), 7,32-7,35 (м, 2H), 7,38-7, 42 (м, 2H), 7,79 (м, 1H), 8,12 (м, 1H), 8,28 (м, 1H), 8,48 и 8,51 (каждый д, J=8,3 Гц, общий 1H).
МС (ESI) m/z 602 (M++1).
(Стадия 2) Синтез транс-4-(1-((5-хлор-2-фтор-4-((1-метил-3-индолилкарбонил)амино)фенил)ацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоновой кислоты

В ТГФ (6,0 мл) растворяют метил-транс-4-(1-((5-хлор-2-фтор-4-((1-метил-3-индолилкарбонил)амино)фенил)ацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилат (354 мг, 0,59 ммоль). К образовавшемуся раствору добавляют 0,25 н. NaOH (3,53 мл, 0,88 ммоль) с последующим перемешиванием в течение 6 часов при комнатной температуре. Реакционную смесь выливают в 1 н. HCl (10 мл) для подкисления смеси. Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при пониженном давлении, получая при этом указанное в заголовке соединение (298 мг, 86%) в виде бесцветного твердого вещества.
ИК (ATR) ν 2940, 2863, 1718, 1652, 1585, 1521, 1465 см-1;
1H ЯМР (ДМСО-d6) δ: 1,16-1,41 (м, 4H), 1,86-2,32 (м, 7H). 3,17-3,84 (м, 6H), 3,89 (с, 3H), 4,13 и 4,35 (каждый м, общий 1H), 5,32 и 5,40 (каждый м, общий 1H), 7,21 (м, 1H), 7,27 (м, 1H), 7,42 и 7,45 (каждый д, J=7,3 Гц, общий 1H), 7,54 (д, J=8,4 Гц, 1H), 7,70 и 7,72 (каждый д, J=5,6 Гц, общий 1H), 8,15 (д, J=7,6 Гц, 1H), 8,30 (м, 1H), 9,28 (s, 1H), 12,01 (ушир.с, 1H).
МС (ESI) m/z 588 (M++1);
Анал. Вычисл. для С30Н32ClF2N3O5·0,25H2О: C, 60,81; H, 5,53; N, 7,09.
Найдено: C, 61,07; H, 5,65; N, 6,71.
Пример 66
транс-4-(1-(3-Хлор-4-((1-этил-3-индолилкарбонил)амино)фенилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоновая кислота:
(Стадия 1) Синтез метил-1-этилиндол-3-карбоксилата
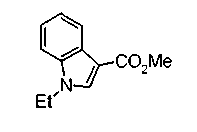
В ДМФ (8,0 мл) суспендируют гидрид натрия (60% в масле, 273,9 мг, 6,846 ммоль). К образовавшейся суспензии добавляют метилиндол-3-карбоксилат (399,8 мг, 2,282 ммоль) при перемешивании при 0°С. Реакционную смесь перемешивают в течение 40 минут при такой же температуре. К смеси добавляют этилиодид (0,27 мл, 3,423 ммоль) при 0°С с последующим перемешиванием при такой же температуре в течение дальнейших 2 часов. К реакционной смеси добавляют воду для окончания реакции. Реакционную смесь экстрагируют этилацетатом. Экстракт промывают последовательно 1 н. HCl и насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя, в результате чего получают 1-этилиндол-3-карбоксилат.Образовавшееся соединение предоставляют для последующей реакции без дальнейшей очистки.
1H-ЯМР (CDCl3) δ: 1,52 (3H, t, J=7,2 Гц), 3,93 (3H, с), 4,20 (2H, кв., J=7,2 Гц), 7,22-7,34 (2H, м), 7,38 (1H, м), 7,86 (1H, с), 8,20 (1H, м),
(Стадия 2) Синтез 1-этилиндол-3-карбоновой кислоты
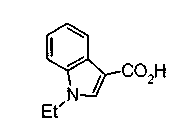
В ТГФ (9,0 мл) растворяют метил-1-этилиндол-3-карбоксилат, полученный в вышеописанной (стадии 1). К образовавшемуся раствору добавляют 0,25 н. NaOH (9,0 мл) при комнатной температуре. После перемешивания реакционной смеси при 50°С в течение 36 часов к ней добавляют 1 н. NaOH (1,0 мл) с последующим перемешиванием при 70°С в течение 9 часов. Реакционную смесь охлаждают до комнатной температуры и затем нейтрализуют 1 н. HCl (4,5 мл). Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при пониженном давлении, получая при этом 1-этилиндол-3-карбоновую кислоту (388,0 мг, 90%, выход 2 стадий) в виде светло-розового аморфного вещества.
1H-ЯМР (ДМСО-d6) δ: 1,38 (3H, t, J=7,2 Гц), 4,26 (2H, кв., J=7,2 Гц), 7,12-7,28 (2H, м), 7,55 (1H, д, J=8,0 Гц), 8,01 (1H, д, J=8,0 Гц), 8,07 (1H, с), 11,93 (1H, ушир.с).
(Стадия 3) Синтез метил-3-хлор-4-((1-этил-3-индолилкарбонил)амино)фенилацетат
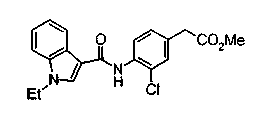
К 1-этилиндол-3-карбоновой кислоте (160,2 мг, 0,847 ммоль) добавляют метиленхлорид (3,5 мл) и оксалилхлорид (108,9 мкл, 1,270 ммоль) при перемешивании при 15°С.Реакционную смесь перемешивают в течение 2,5 часа при комнатной температуре. Растворитель затем отгоняют при пониженном давлении. К остатку добавляют метиленхлорид (3,5 мл). При перемешивании при комнатной температуре добавляют раствор метил-3-хлор-4-аминофенилацетата (177,5 мг, 0,889 ммоль) в метиленхлориде (3,5 мл) и триэтиламин (0,37 мл, 2,667 ммоль) и смесь нагревают при кипячении с обратным холодильником в течение 18 часов. После охлаждения реакционной смеси до комнатной температуры растворитель отгоняют при пониженном давлении. Остаток растворяют в хлороформе. Образовавшийся раствор промывают 1 н. HCl и насыщенным раствором соли и сушат над безводным сульфатом натрия. Растворитель отгоняют при пониженном давлении, получая при этом метил-3-хлор-4-((1-этил-3-индолкарбонил)амино)фенилацетат (277,7 мг, 88%) в виде коричневого аморфного вещества. Образовавшееся соединение предоставляют для последующей реакции без дальнейшей очистки.
1H-ЯМР (CDCl3) δ: 1,54 (3H, т, J=7,6 Гц), 3,59 (2H, с), 3,71 (3H, с), 4,23 (2H, м), 7,15-7,49 (5H, м), 7,78 (1H, с), 8,14 (1H, м), 8,26 (1H, м), 8,59 (1H, д, J=8,4 Гц).
(Стадия 4) Синтез 3-хлор-4-((1-этил-3-индолкарбонил)амино)фенилуксусной кислоты
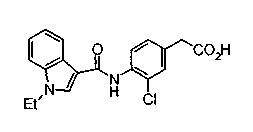
В ТГФ (6,0 мл) растворяют метил-3-хлор-4-((1-этил-3-индолкарбонил)амино)фенилацетат.К образовавшемуся раствору добавляют 0,25 н. NaOH (6,0 мл) при комнатной температуре. После перемешивания при 50°С в течение 18 часов реакционную смесь охлаждают до комнатной температуры и перегоняют при пониженном давлении для удаления растворителя. Остаток подкисляют 1 н. HCl (2,0 мл). Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении, промывают водой и затем сушат при пониженном давлении, получая при этом 3-хлор-4-((1-этил-3-индолкарбонил)амино)фенилуксусную кислоту (250,7 мг, 94%) в виде коричневого аморфного вещества.
1H-ЯМР (ДМСО-d6) δ: 1,43 (3H, м, OCH2Me), 3,62 (2H, с), 4,28 (2H, м, OCH2Me), 7,12-7,30 (2H, м, ArH), 7,44 (1H, м), 7,58 (1H, м), 7,66 (1H, м), 7,91-8,10 (1H, м), 8,15 (1H, м), 8,35 (1H, м), 9,31 (1H, c).
(Стадия 5) Синтез метил-транс-4-(1-((3-хлор-4-((1-этил-3-индолилкарбонил)амино)фенилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилата
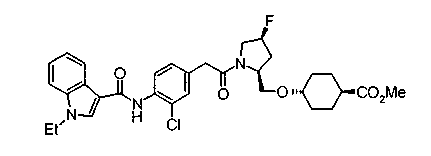
К раствору метил-транс-4-((4S)-фтор-(2S)- пирролидинилметокси)циклогексанкарбоксилата (соединение, синтезированное в (стадии 3) примера 21) (171,2 мг, 0,660 ммоль), 3-хлор-4-((1-этил-3-индолилкарбонил)амино)фенилуксусной кислоты (235,6 мг, 0,660 ммоль) и HOBt (17,8 мг, 0,132 ммоль) в ДМФ (8,0 мл) добавляют EDC·HCl (189,9 мг, 0,990 ммоль) при перемешивании при комнатной температуре. После перемешивания при комнатной температуре в течение 18 часов реакционную смесь выливают в смесь лед - 1 н. HCl с последующей экстракцией этилацетатом. Экстракт промывают насыщенным водным раствором бикарбоната натрия, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси гексан-этилацетат (1:2, об./об.) метил-транс-4-(1-(3-хлор-4-((1-этил-3-индолилкарбонил)амино)фенилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилат (334,1 мг, 85%) получают в виде светло-коричневого аморфного вещества.
1H-ЯМР (CDCl3) δ: 1,15-1,34 (2H, м), 1,36-1,58 (общий 5H, м, включая 3H, т, J=7,2 Гц, при δ: 1,53), 1,92-2,15 (5H, м), 2,16-2,50 (2H, м), 3,19-4,02 (общий 10H, ряд м, включая общий 3H, с при δ: 3,63, 3,65), 4,15-4,40 (общий 3H, м, включая 2H, кв., J=7,2 Гц, при δ: 4,21), 5,24 (1H, м), 7,18 (1Н, м), 7,32 (2H, м), 7,36 (1H, м), 7,42 (1H, м), 7,86 (1H, с), 8,13 (1H, м), 8,27 (1H, м), 8,56 (1H, дд, J=7,2, 8,4 Гц).
(Стадия 6) Синтез транс-4-(1-((3-хлор-4-((1-этил-3-индолилкарбонил)амино)фенил)ацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоновой кислоты

В ТГФ (6,0 мл) растворяют метил-транс-4-(1-((3-хлор-4-((1-этил-3-индолилкарбонил)амино)фенилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилат (334,1 мг, 0,559 ммоль). К образовавшемуся раствору добавляют 0,25 н. NaOH (6,0 мл) с последующим перемешиванием при комнатной температуре в течение 18 часов. Реакционную смесь перегоняют при пониженном давлении для удаления растворителя. Таким образом полученный остаток подкисляют 1 н. HCl (2,0 мл). Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при пониженном давлении, получая при этом указанное в заголовке соединение (293,6 мг, 90%) в виде белого аморфного вещества.
ИК (ATR) ν 2937, 1649, 1511 см-1;
1H-ЯМР (ДМСО-d6) δ: 1,10-1,40 (4H, м), 1,45 (3H, т, J=7,2 Гц, OCH2Me), 1,80-2,04 (4H, м), 2,04-2,36 (3H, м), 3,10-3,97 (общий 7H, ряд м), 4,07-4,39 (общий 3H, м, включая 2H, кв., J=7,2 Гц, при δ: 4,29), 5,32 и 5,39 (общий 1H, д, J=54,4 Гц), 7,10-7,30 (3H, м), 7,38 (1H, д, J=6,8 Гц), 7,59 (1H, д, J=8,0 Гц), 7,65 (1H, м), 8,16 (1H, д, J=8,0 Гц), 8,35 (1H, с), 9,31 (1H, с), 12,05 (1H, ушир.с, CO2H).
МС (ESI) m/z 584 (M++1);
Анал. Вычисл. для С31Н35ClFN3O5·0,25H2О: C, 63,26; H, 6,08; N, 7,14; Cl, 6,02; F, 3,23.
Найдено: C, 63,20; H, 6,08; N, 6,96; Cl, 5,86; F, 3,18.
Пример 67
транс-4-(1-(3-Хлор-4-((1-изопропил-3-индолилкарбонил)амино)фенилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоновая кислота:
(Стадия 1) Синтез метил-1-изопропилиндол-3-карбоксилата
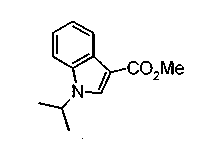
В ДМФ (8,0 мл) суспендируют гидрид натрия (60% в масле, 275,2 мг, 6,881 ммоль). К образовавшейся суспензии добавляют метилиндол-3-карбоксилат (401,8 мг, 2,294 ммоль) при перемешивании при 0°С. После перемешивания в течение дополнительных 45 минут при такой же температуре к смеси добавляют изопропилиодид (0,34 мл, 3,440 ммоль). Перемешивание затем проводят в течение 1,5 часа при 0°С и в течение 7 часов при комнатной температуре. К реакционной смеси добавляют воду для окончания реакции с последующей экстракцией этилацетатом. Экстракт промывают последовательно 1 н. HCl и насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси гексан-этилацетат (3:1, об./об.) метил-1-изопропилиндол-3-карбоксилат (387,6 мг, 78%) получают в виде светло-желтого масла.
1H-ЯМР (CDCl3) δ: 1,56 (6H, д, J=6,8 Гц), 3,91 (3H, c), 4,67 (1H, геп., J=6,8 Гц), 7,28 (2H, м), 7,40 (1H, м), 7,94 (1H, с), 8,19 (1H, м).
(Стадия 2) Синтез 1-изопропилиндол-3-карбоновой кислоты
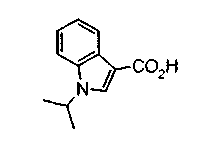
В ТГФ (8,0 мл) растворяют метил-1-изопропилиндол-3-карбоксилат (387,6 мг, 1,784 ммоль). К образовавшемуся раствору добавляют 0,25 н. NaOH (8,0 мл). Образовавшуюся смесь перемешивают при 50°С в течение 18 часов. После охлаждения до комнатной температуры реакционную смесь подкисляют 1 н. HCl (4,5 мл). Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при пониженном давлении, получая при этом 1-изопропилиндол-3-карбоновую кислоту (327,8 мг, 90%) в виде светло-розового аморфного вещества.
1H-ЯМР (ДМСО-d6) δ: 1,38 (6H, д, J=6,4 Гц), 4,78 (1H, м), 7,20 (2H, м), 7,59 (1H, д, J=8,0 Гц), 8,02 (1H, д, J=7,6 Гц), 8,12 (1H, с), 11,96 (1H, ушир.с).
(Стадия 3) Синтез метил-3-хлор-4-(1-изопропил-3-индолилкарбонил)амино)фенилацетата
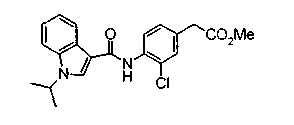
К раствору 1-изопропилиндол-3-карбоновой кислоты (159,6 мг, 0,785 ммоль) в метиленхлориде (3,5 мл) добавляют оксалилхлорид (101,0 мкл, 1,178 ммоль) при перемешивании при -15°С. Реакционную смесь перемешивают в течение 2,5 часа при комнатной температуре и затем перегоняют при пониженном давлении для удаления растворителя. Остаток растворяют в метиленхлориде (3,5 мл) с последующим добавлением раствора метил-3-хлор-4-аминофенилацетата (164,6 мг, 0,824 ммоль) в метиленхлориде (3,5 мл) и триэтиламина (0,35 мл, 2,474 ммоль) при перемешивании при комнатной температуре. Реакционную смесь перемешивают при комнатной температуре в течение 18 часов. Реакционную смесь затем перегоняют при пониженном давлении для удаления растворителя. Остаток растворяют в хлороформе. Образовавшийся раствор промывают последовательно 1 н. HCl и насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя, получая при этом метил-3-хлор-4-((1-изопропил-3-индолилкарбонил)амино)фенилацетат (275,3 мг, 91%) в виде коричневого твердого вещества. Образовавшееся соединение предоставляют для последующей реакции без дальнейшей очистки.
1H-ЯМР (CDCl3) δ: 1,60 (6H, д, J=6,8 Гц), 3,60 (2H, с), 3,71 (3H, с), 4,73 (1H, м), 7,15-7,54 (5H, м), 8,00 (1H, с), 8,11 (1H, м), 8,28 (1H, м), 8,60 (1H, д, J=8,4 Гц).
(Стадия 4) Синтез 3-хлор-4-((1-изопропил-3-индолилкарбонил)амино)фенилуксусной кислоты
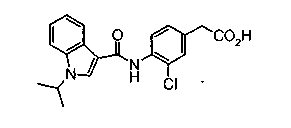
В ТГФ (6,0 мл) растворяют метил-3-хлор-4-((1-изопропил-3-индолилкарбонил)амино)фенилацетат, полученный в вышеописанной (стадии 3). К образовавшемуся раствору добавляют 0,25 н. NaOH (6,0 мл) с последующим перемешиванием при 50°С в течение 18 часов. После охлаждения реакционную смесь перегоняют при пониженном давлении для удаления растворителя. Образовавшийся остаток подкисляют 1 н. HCl (2,0 мл). Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при пониженном давлении, получая при этом 3-хлор-4-((1-изопропил-3-индолилкарбонил)амино)фенилуксусную кислоту (246,2 мг, 93%) в виде коричневого аморфного вещества.
1H-ЯМР (ДМСО-d6) δ: 1,52 (6H, д, J=6,4 Гц), 3,62 (2H, с), 4,84 (1H, геп., J=6,4 Гц), 7,13-7,30 (3H, м), 7,44 (1H, м), 7,62 (2H, м), 8,18 (1H, м), 8,48 (1H, с), 9,36 (1H, с), 12,32 (1H, ушир.с).
(Стадия 5) Синтез метил-транс-4-(1-(3-хлор-4-((1-изопропил-3-индолилкарбонил)амино)фенилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилата
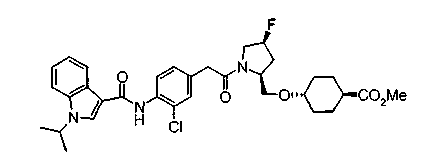
Смесь метил-транс-4-((4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилата (соединение, синтезированное в (стадии 3) примера 21) (163,8 мг, 0,632 ммоль), 3-хлор-4-((1-изопропил-3-индолилкарбонил)амино)фенилуксусной кислоты (234,3 мг, 0,632 ммоль) и HOBt (17,1 мг, 0,126 ммоль) растворяют в ДМФ (8,0 мл). К образовавшемуся раствору добавляют EDC·HCl (181,7 мг, 0,948 ммоль) при перемешивании при комнатной температуре. Реакционную смесь перемешивания при комнатной температуре в течение дополнительных 18 часов. Смесь разбавляют этилацетатом, промывают последовательно 1 н. HCl и насыщенным водным раствором бикарбоната натрия, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси гексан-этилацетат (1:2, об./об.) метил-транс-4-(1-(3-хлор-4-((1-изопропил-3-индолилкарбонил)амино)фенилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилат (322,9 мг, 84%) получают в виде коричневого масла
1H-ЯМР (CDCl3) δ: 1,10-1,33 (2H, м), 1,36-1,55 (2H, м), 1,58 (6H, д, J=6,8 Гц), 1,75 (1H, м), 1,92-2,15 (4H, м), 2,15-2,51 (2H, м), 3,19-4,02 (общий 10H, ряд м), 4,20 и 4,36 (общий 1H, м), 4,72 (1H, геп., J=6,8 Гц), 5,23 (1H, д, J=54,4 Гц), 7,18 (1H, м), 7,28-7,40 (3H, м), 7,45 (1H, м), 7,98 (1H, с), 8,11 (1H, м), 8,29 (1H, с), 8,56 (1H, дд, J=7,2 Гц).
(Стадия 6) Синтез транс-4-(1-((3-хлор-4-((1-изопропил-3-индолилкарбонил)амино)фенилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоновой кислоты
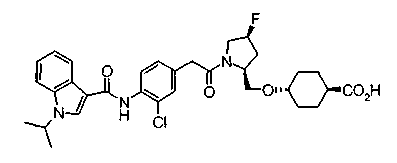
В ТГФ (6,0 мл) растворяют метил-транс-4-(1-(3-хлор-4-((1-изопропил-3-индолилкарбонил)амино)фенилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилат (322,9 мг, 0,528 ммоль). К образовавшемуся раствору добавляют 0,25 н. NaOH (6,0 мл) и смесь перемешивают при комнатной температуре в течение 18 часов. Реакционную смесь перегоняют при пониженном давлении для удаления растворителя. Образовавшийся остаток подкисляют 1 н. HCl (2,0 мл). Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при пониженном давлении, получая при этом указанное в заголовке соединение (283,9 мг, 90%) в виде белого аморфного вещества.
ИК (ATR) ν 2933, 1643, 1511 см-1;
1H-ЯМР (ДМСО-d6) δ: 1,08-1,44 (4H, м), 1,53 (6H, д, J=6,8 Гц), 1,80-2,05 (4H, м), 2,05-2,34 (3H, м), 3,12-4,40 (общий 8H, ряд м), 4,85 (1H, геп., J=6,8 Гц), 5,32 и 5,39 (общий 1H, д, J=54,4 Гц), 7,12-7,28 (3H, м), 7,39 (1H, д, J=6,8 Гц), 7,60 (2H, м), 8,17 (1H, д, J=8,0 Гц), 8,48 (1H, с), 9,35 (1H, с), 12,04 (1H, с).
МС (ESI) m/z 598 (M++1);
Анал. Вычисл. для С31Н35ClFN3O5·0,25H2О: C, 63,78; H, 6,27; N, 6,97; Cl, 5,88; F, 3,15.
Найдено: C, 63,62; H, 6,32; N, 6,77; Cl, 5,72; F, 3,13.
Пример 68
транс-4-(1-(4-((1-Бензил-3-индолилкарбонил)амино)-3-хлорфенилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоновая кислота:
(Стадия 1) Синтез метил-1-бензилиндол-3-карбоксилата
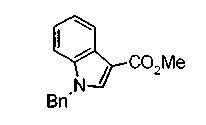
Гидрид натрия (60% в масле, 274,1 мг, 6,853 ммоль) суспендируют в ДМФ (8,0 мл). К образовавшейся суспензии добавляют метилиндол-3-карбоксилат (400,2 мг, 2,284 ммоль) при перемешивании при 0°С с последующим перемешиванием при такой же температуре в течение 30 минут. К реакционной смеси добавляют бензилбромид (0,41 мл, 3,427 ммоль) при 0°С. После перемешивания при комнатной температуре в течение 1 часа в реакционную смесь добавляют воду для окончания реакции. Реакционную смесь затем экстрагируют этилацетатом. Экстракт промывают 1 н. HCl, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси гексан-этилацетат (6:1, об./об,) метил-1-бензилиндол-3-карбоксилат (100%) получают в виде смолы.
1H-ЯМР (CDCl3) δ: 3,90 (3H, с), 5,31 (2H, с), 7,13 (2H, м), 7,18-7,38 (6H, м), 7,83 (1H, с), 8,19 (1H, д, J=8,0 Гц).
(Стадия 2) Синтез 1-бензилиндол-3-карбоновой кислоты
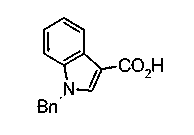
В ТГФ (15 мл) растворяют метил-1-бензилиндол-3-карбоксилат (606,1 мг, 2,284 ммоль). К образовавшемуся раствору добавляют 0,25 н. NaOH (8,0 мл) и смесь перемешивают при 70°С в течение 18 часов. После охлаждения реакционной смеси до комнатной температуры растворитель отгоняют при пониженном давлении. Таким образом полученный остаток подкисляют 1 н. HCl (5,5 мл). Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при пониженном давлении, получая при этом 1-бензилиндол-3-карбоновую кислоту (100%) в виде светло-розового аморфного вещества.
1H-ЯМР (ДМСО-d6) δ: 5,49 (2Н, с), 7,14-7,38 (7Н, м), 7,52 (1Н, м), 8,00 (1H, м), 8,21 (1H, с), 12,01 (1H, ушир.с).
(Стадия 3) Синтез метил-4-((1-бензил-3-индолилкарбонил)амино)-3-хлорфенилацетата
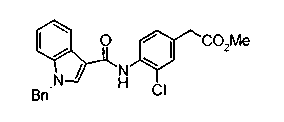
К раствору 1-бензилиндол-3-карбоновой кислоты (201, 3 мг, 0,801 моль) в метиленхлориде (4,0 мл) добавляют оксалилхлорид (103,1 мкл, 1,202 ммоль) при перемешивании при -15°С.Реакционную смесь перемешивают при комнатной температуре в течение 2,5 часа и затем перегоняют при пониженном давлении для удаления растворителя. Остаток растворяют в метиленхлориде (4,0 мл) и к образовавшемуся раствору добавляют раствор метил-3-хлор-4-аминофенилацетата (167,9 мг, 0,841 ммоль) в метиленхлориде (4,0 мл) и триэтиламине (0,35 мл, 2,523 ммоль) при перемешивании при комнатной температуре. Реакционную смесь перемешивают при комнатной температуре в течение 18 часов. Реакционную смесь перегоняют при пониженном давлении для удаления растворителя. Остаток разбавляют хлороформом, промывают 1 н. HCl, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя, в результате чего получают метил-4-((1-бензил-3-индолилкарбонил)амино)-3-хлорфенилацетат (341,3 мг, 98%). Соединение применяют для следующей реакции без дальнейшей очистки.
1H-ЯМР (CDCl3) δ: 3,59 (2H, с), 3,71 (3H, с), 5,38 (2H, с), 7,08-7,42 (10H, м), 7,87 (1H, с), 8,16 (1H, д, J=7,6 Гц), 8,28 (1H, с), 8,58 (1H, д, J=8,0 Гц).
(Стадия 4) Синтез 4-((1-бензил-3-индолилкарбонил)амино)-3-хлорфенилуксусной кислоты
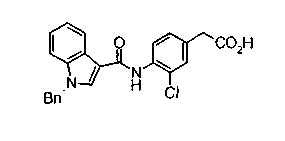
В ТГФ (7,0 мл) растворяют метил-4-((1-бензил-3-индолилкарбонил)амино-3-хлорфенилацетат (341,3 мг, 0,788 ммоль). К образовавшемуся раствору добавляют 0,25 н. NaOH (7,0 мл). Образовавшуюся смесь перемешивают при 50°С в течение 18 часов. После охлаждения реакционной смеси до комнатной температуры растворитель отгоняют при пониженном давлении. Остаток подкисляют 1 н. HCl (2,5 мл). Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при пониженном давлении, получая при этом 4-((1-бензил-3-индолилкарбонил)амино)-3-хлорфенилуксусную кислоту (285,8 мг, 86%) в виде светло-розового аморфного вещества.
1H-ЯМР (ДМСО-d6) δ: 3,57 (2H, с), 5,52 (2H, с), 7,13-7,41 (8H, м), 7,44 (1H, с), 7,56 (1H, д, J=8,0 Гц), 7,64 (1H, д, J=8,0 Гц), 8,16 (1H, д, J=6,4 Гц), 8,43 (1H, с), 9,40 (1H, с).
(Стадия 5) Синтез метил-транс-4-(1-(4-((1-бензил-3-индолилкарбонил)амино)-3-хлорфенилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилата

Смесь метил-транс-4-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилата (соединение, синтезированное в (стадии 3) примера 21) (174,3 мг, 0,672 ммоль), 4-((1-бензил-3-индолилкарбонил)амино)-3-хлорфенилуксусной кислоты (281,5 мг, 0,672 ммоль) и HOBt (18,2 мг, 0,134 ммоль) растворяют в ДМФ (8,0 мл). К образовавшемуся раствору добавляют EDC·HCl (193,2 мг, 1,008 ммоль) с последующим перемешиванием при комнатной температуре в течение 18 часов. Реакционную смесь разбавляют этилацетатом, промывают последовательно 1 н. HCl и насыщенным водным раствором бикарбоната натрия, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси гексан-этилацетат от (1:2, об./об.) до (10:1, об./об.) метил-транс-4-(1-(4-((1-бензил-3-индолилкарбонил)амино)-3-хлорфенилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилат (409,2 мг, 92%) получают в виде коричневого масла.
1H-ЯМР (CDCl3) δ: 1,17-1,36 (2H, м), 1,40-1,56 (2H, м), 1,95-2,16 (5H, м), 2,17-2,54 (2H, м), 3,22-4,43 (общий 11H, ряд м), 5,16-5,38 (1H, м), 5,39 (2H, с), 7,14-7,43 (10H, м), 7,88 (1H, с), 8,17 (1H, д, J=7,2 Гц), 8,30 (1H, м), 8,59 (1H, дд, J=8,0 Гц).
(Стадия 6) Синтез транс-4-(1-(4-((1-бензил-3-индолилкарбонил)амино)-3-хлорфенилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоновой кислоты

В ТГФ (8,0 мл) растворяют метил-транс-4-(1-(4-((1-бензил-3-индолилкарбонил)амино)-3-хлорфенилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилат (409,2 мг, 0,620 ммоль). К образовавшемуся раствору добавляют 0,25 н. NaOH (8,0 мл) и смесь перемешивают при комнатной температуре в течение 18 часов. Реакционную смесь затем перегоняют при пониженном давлении для удаления растворителя. Остаток подкисляют 1 н. HCl (2,5 мл). Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при пониженном давлении, получая при этом указанное в заголовке соединение (355,6 мг, 89%) в виде белого аморфного вещества.
ИК (ATR) ν 2935, 1643, 1511 см-1;
1H-ЯМР (ДМСО-d6) δ: 1,08-1,44 (4H, м), 1,80-2,05 (4H, м), 2,05-2,34 (3H, м), 3,11-3,94 (общий 7H, ряд м), 4,14 и 4,34 (общий 1H, м), 5,32 и 5,46 (общий 1H, д, J=55,2 Гц), 5,23 (2H, с), 7,12-7,45 (общий 9H, ряд м), 7,57 (1H, д, J=7,6 Гц), 7,65 (1H, м), 8,17 (1H, д, J=7,6 Гц), 8,43 (1H, с), 9,40 (1H, с), 12,05 (1Н, с, CO2H).
МС (ESI) m/z 646 (M++1);
Анал. Вычисл. для С36Н37ClFN3O5·0,25H2О: C, 66,45; H, 5,81; N, 6,46; Cl, 5,45; F, 2,92. Найдено: C, 66,34; H, 5,83; N, 6,27; Cl, 5,35; F, 2,88.
Пример 69
транс-4-(1-(2-Хлор-3-((1-метил-3-индолилкарбонил)амино)-6-пиридил)ацетил)-(4S)-фтор-(2S)-циклогексанкарбоновая кислота:
(Стадия 1) Синтез этил-(2-хлор-3-(1-метил-3-индолилкарбонил)амино-6-пиридил))ацетат
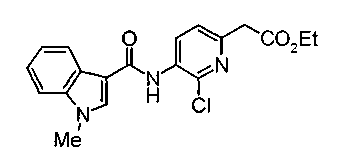
Оксалилхлорид (1,10 мл, 12,5 ммоль) добавляют к раствору 1-метилиндол-3-карбоновой кислоты (2,00 г, 11,4 ммоль) и ДМФ (0,18 мл, 2,28 ммоль) в метиленхлориде (25 мл) и образовавшуюся смесь перемешивают в течение 3 часов при комнатной температуре. Реакционную смесь перегоняют при пониженном давлении для удаления растворителя, получая при этом хлорангидрид 1-метилиндол-3-карбоновой кислоты (2,19 г, 99%) в виде светло-желтого твердого вещества. образовавшийся хлорангидрид 1-метилиндол-3-карбоновой кислоты (752 мг, 3,88 ммоль) добавляют по частям к раствору этил-3-амино-2-хлор-6-пиридилацетата (833 мг, 3,88 ммоль) и триэтиламина (1,08 мл, 7,77 ммоль) в метиленхлориде (20 мл) при перемешивании при 0°С.Реакционную смесь нагревают при кипячении с обратным холодильником в течение 8 часов. После охлаждения до комнатной температуры и добавления воды смесь экстрагируют хлороформом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом магния и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси н-гексан-этилацетат (2:1, об./об.) этил-2-хлор-3-(1-метил-3-индолилкарбонил)амино-6-пиридилацетат (859 мг, 60%) получают в виде желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 1,21 (т, J=7,1 Гц, 3H), 3,85 (с, 2H), 3,90 (с, 3H), 4,12 (кв., J=7,1 Гц, 2H), 7,21 (м, 1H), 7,28 (м, 1H), 7,42 (д, J=8,1 Гц, 1H), 7,55 (д, J=8,1 Гц, 1H), 8,04 (м, 1H), 8,15 (м, 1H), 8,31 (м, 1H), 9,41 (ушир.с, 1H).
МС (ESI) m/z 372 (M++1).
(Стадия 2) Синтез (2-хлор-3-(1-метил-3-индолилкарбонил)амино-6-пиридил)уксусной кислоты
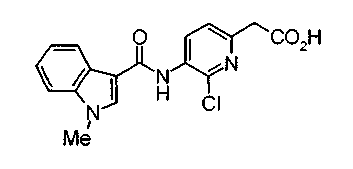
Этил-2-хлор-3-(1-метил-3-индолилкарбонил)амино-6-пиридилацетат (859 мг, 2,31 ммоль) растворяют в ТГФ (25 мл). К образовавшемуся раствору добавляют 0,25 н. NaOH (13,9 мл, 3,47 ммоль) с последующим перемешиванием при комнатной температуре в течение 4 часов. Добавляют смесь метанол-вода (1:1, об./об., 10 мл) и смесь перемешивают при 50°С в течение 2 часов. Реакционную смесь подкисляют 1 н. HCl (5,0 мл). Таким образом осажденные кристаллы собирают фильтрованием, промывают водой и сушат при пониженном давлении, получая при этом 2-хлор-3-(1-метил-3-индолилкарбонил)амино-6-пиридилуксусную кислоту (702 мг, 88%) в виде бесцветного твердого вещества.
1H-ЯМР (CDCl3) δ: 3,76 (с, 2H), 3,89 (с, 3H), 7,21 (т, J=8,3 Гц, 1H), 7,28 (т, J=8,3 Гц, 1H), 7,41 (д, J=8,1 Гц, 1H), 7,55 (д, J=8,3 Гц, 1H), 8,15 (д, J=8,1 Гц, 1H), 8,31 (с, 1H), 9,40 (ушир.с, 1H), 12,50 (ушир.с, 1H).
МС (ESI) m/z 344 (M++1).
(Стадия 3) Синтез метил-транс-4-(1-(2-хлор-3-((1-метил-3-индолилкарбонил)амино)-6-пиридил)ацетил)-(4S)-фтор-(2S)-циклогексанкарбоксилата

К раствору (2-хлор-3-(1-метил-3-индолилкарбонил)амино-6-пиридил)уксусной кислоты (254 мг, 0,74 ммоль), метил-транс-4-((4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилата (соединение, синтезированное (в стадии 3) примера 21) (192 мг, 0,74 ммоль), HOBt (20,0 мг, 0,15 ммоль) и DMAP (18,0 мг, 0,15 ммоль) в ДМФ (8,0 мл) добавляют EDC·HCl (212 мг, 1,11 ммоль). После перемешивания при комнатной температуре в течение 20 часов в реакционную смесь добавляют воду. Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при пониженном давлении, получая при этом метил-транс-4-(1-(2-хлор-3-((1-метил-3-индолилкарбонил)амино)-6-пиридил)ацетил)-(4S)-фтор-(2S)-циклогексанкарбоксилат (377 мг, 887%) в виде светло-желтого твердого вещества.
1H-ЯМР (CDCl3) δ: 1,22-1,33 (м, 2H), 1,41-1,54 (м, 2H), 1,98-2,54 (м, 7H), 3,28 (м, 1H), 3,34 и 3,53 (каждый м, общий 1H), 3,66 и 3,68 (каждый 2, общий 3H), 3,70-3,89 (м, 4H), 3,91 (с, 3H), 3,92-4,12 (м, 2H), 4,39 и 4,46 (каждый м, общий 1H), 5,28 (м, 1H), 7,30-7,39 (м, 2H), 7,44 (м, 1H), 7,83 (м, 1H), 8,13 (м, 1H), 8,24 (м, 1H), 8,92 и 8,95 (каждый д, J=8,3 Гц, общий 1H).
МС (ESI) m/z 585 (M++1).
(Стадия 4) Синтез транс-4-(1-(2-хлор-3-((1-метил-3-индолилкарбонил)амино)-6-пиридил)ацетил)-(4S)-фтор-(2S)-циклогексанкарбоновой кислоты
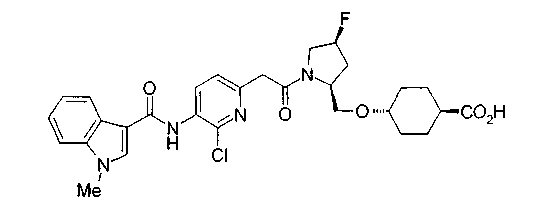
В ТГФ (7,0 мл) растворяют метил-транс-4-(1-(2-хлор-3-((1-метил-3-индолилкарбонил)амино)-6-пиридил)ацетил)-(4S)-фтор-(2S)-циклогексанкарбоксилат (377 мг, 0,64 ммоль). К образовавшемуся раствору добавляют 0,25 н. NaOH (4,00 мл, 1,00 ммоль) с последующим перемешиванием при комнатной температуре в течение 19 часов. Реакционную смесь выливают в 1 н. HCl (1,0 мл). Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при пониженном давлении, получая при этом указанное в заголовке соединение (252 мг, 69%) в виде светло-желтого твердого вещества.
ИК (ATR) ν 2940, 2861, 1710, 1654, 1617, 1581, 1519, 1488 см-1;
1H-ЯМР (ДМСО-d6) δ: 1,17-1,38 (м, 4H), 1,86-2,21 (м, 7H), 3,18-3,87 (м, 6H), 3,90 (с, 3H), 3,93 (м, 1H), 4,14 и 4,40 (каждый м, общий 1H), 5,33 и 5,40 (каждый м, общий 1H), 7,21 (т, J=8,l Гц, 1H), 7,27 (т, J=8,1 Гц, 1H), 7,34 (д, J=8,1 Гц, 1H), 7,55 (д, J=8,3 Гц, 1H), 8,12-8,17 (м, 2H), 8,30 (с, 1H), 9,39 (ушир.с, 1H), 12,00 (ушир.с, 1H).
МС (ESI) m/z 571 (M++1);
Анал. Вычисл. для C29H32C1FN4О5·0,25H2О: C, 60,52; H, 5,69; N, 9,73.
Найдено: C, 60,46; H, 5,76; N, 9,43.
Пример 70
транс-4-(1-(3-Фтор-4-(1-метил-3-индолил)карбониламинофенилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоновая кислота:
(Стадия 1) Синтез метил-транс-4-(1-(3-Фтор-4-(1-метил-3-индолил)карбониламинофенилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилата
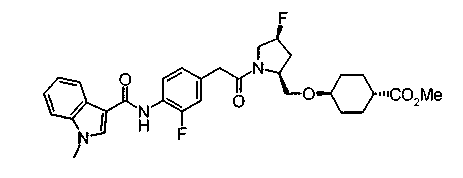
В ТГФ (10 мл) и ацетонитриле (10 мл) растворяют метил-транс-4-((4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилат (соединение, синтезированное в (стадии 3) примера 21) (65 мг, 0,25 ммоль), (3-фтор-4-(1-метил-3-индолил)карбониламинофенил)уксусную кислоту (90 мг, 0,25 ммоль), HOBt (34 мг, 0,25 ммоль) и триэтиламин (104 мкл, 0,75 ммоль). После добавления EDC·HCl (72 мг, 0,37 ммоль) при 0°С смесь перемешивают при комнатной температуре в течение 16 часов. Реакционную смесь перегоняют при пониженном давлении для удаления растворителя. К остатку добавляют воду с последующей экстракцией смеси этилацетатом. Экстракт промывают последовательно насыщенным водным раствором бикарбоната натрия, 2 М водным раствором лимонной кислоты и насыщенным водным раствором бикарбоната натрия, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией с использованием тонкослойной пластины, посредством чего из элюатных фракций смеси н-гексан-этилацетат (1:4, об./об.) метил-транс-4-(1-(3-Фтор-4-(1-метил-3-индолил)карбониламинофенилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилат (130 мг, 90%) получают в виде бесцветного масла.
1H-ЯМР (CDCl3) δ: 1,20-1,50 (м, 4H), 2,00-2,50 (м, 6H), 3,20-4,40 (м, 15H), 5,15-5,35 (м, 1H), 7,07-7,45 (м, 5H), 7,78 (с, 1H), 7,91 (ушир.с, 1H), 8,03-8,06 (м, 1H), 8,45-8,47 (м, 1H).
(Стадия 2) Синтез 4-(1-(3-Фтор-4-(1-метил-3-индолил)карбониламинофенилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоновой кислоты
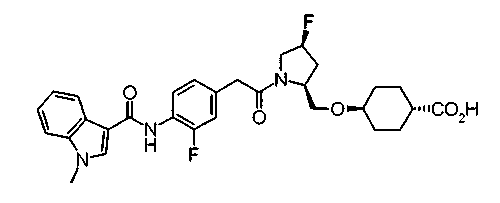
В ТГФ (10 мл) и метаноле (5,0 мл) растворяют метил-транс-4- (1-(3-Фтор-4-(1-метил-3-индолил)карбониламинофенилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилат (130 мг, 0,23 ммоль). К образовавшемуся раствору добавляют 1 н. NaOH (0,8 мл, 0,8 ммоль) с последующим перемешиванием при 70°С в течение 18 часов. Реакционную смесь перегоняют при пониженном давлении для удаления растворителя. Остаток подкисляют 1 н. HCl. Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при пониженном давлении, получая при этом указанное в заголовке соединение (90 мг, 71%) в виде белого твердого вещества.
ИК (ATR) ν 2933, 1639, 1627, 1521, 1427, 1099 см-1;
1H-ЯМР (ДМСО-d6) δ: 1,16-1,37 (м, 4H), 1,88-2,18 (м, 6H), 3,10-4,30 (м, 12H), 5,22-5,45 (м, 1H), 7,00-7,27 (м, 4H), 7,53 (д, J=8,3 Гц, 1H), 7,60-7,63 (м, 1H), 8,14 (д, J=7,8 Гц, 1H), 8,25 (с, 1H), 9,46 (с, 1H).
МС (FAB) m/z 553 (M+H)+;
Анал. Вычисл. для C30H33CFN3О5·0,4H2О: C, 64,25; H, 6,07; N, 7,49.
Найдено: C, 64,38; H, 6,16; N, 7,38.
Пример 71
транс-4-(1-(2,5-Дифтор-4-((1-метил-1Н-3-индолилкарбонил)амино)фенилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоновая кислота:
(Стадия 1) Синтез (2,5-дифтор-4-((1-метил-1Н-индолилкарбонил)амино)фенил)уксусной кислоты
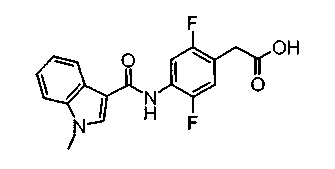
В метиленхлориде (20 мл) растворяют 1-метил-1Н-индол-3-карбоновую кислоту (814 мг, 4,65 ммоль), триэтиламин (2,6 мл, 18,6 ммоль) и хлорангидрид дифенилфосфиновой кислоты (1,72 мл, 9,3 ммоль). Образовавшийся раствор перемешивают в течение 3 дней при комнатной температуре. Реакционную смесь выливают в 1 М HCl с последующей экстракцией хлороформом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом магния и перегоняют при пониженном давлении для удаления растворителя. К остатку добавляют ТГФ (10 мл) и 0,25 М NaOH (8 мл, 2 ммоль) и смесь перемешивают при комнатной температуре в течение 4 часов. Реакционную смесь выливают в воду и подкисляют 1 н. HCl. Кислотный раствор экстрагируют смесью хлороформ/метанол. Экстракт сушат над безводным сульфатом магния и перегоняют при пониженном давлении для удаления растворителя, получая при этом 2,5-дифтор-4-((1-метил-1Н-3-индолилкарбонил)амино)фенил)уксусную кислоту (483 мг, 30%) в виде бесцветного твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 3,62 (с, 2H), 3,90 (с, 3H), 7,20 (т, J=7,5 Гц, 1H), 7,29 (т, J=7,5 Гц, 1H), 7,55 (д, J=8,1 Гц, 1H), 7,70 (дд, J=6,5, 8,8 Гц, 1H), 8,15 (д, J=7,5 Гц, 1H), 8,32 (с, 1H), 9,57 (с, 1H), 12,52 (ушир., 1H).
МС (ESI) m/z 345 (M+1)+.
(Стадия 2) Синтез транс-4-(1-(2,5-дифтор-4-((1-метил-1Н-3-индолилкарбонил)амино)фенилацетил)-(4S)-фтор-(2S)- пирролидинилметокси)циклогексанкарбоновой кислоты
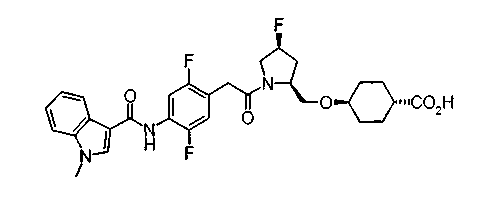
В ДМФ (10 мл) растворяют 2,5-дифтор-4-((1-метил-1Н-3-индолилкарбонил)амино)фенил)уксусную кислоту (480 мг, 1,39 ммоль), метил-транс-4-((4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилат (соединение, синтезированное в стадии (3) примера 21) (301 мг, 1,16 ммоль), HOBt (357 мг, 2,64 ммоль), DMAP (каталитическое количество) и EDC·HCl (400 мг, 2,09 ммоль). Образовавшийся раствор перемешивают при комнатной температуре в течение 18 часов. Реакционную смесь выливают в 1 М HCl с последующей экстракцией этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом магния и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем (Yamazen, среднее давление, линейный градиент хлороформа и метанола от 100:0 до 95:5, 12 мл/мин, (37 мм×300 мм), в результате чего получают конденсат. К образовавшемуся соединению добавляют ТГФ (14 мл) и 0,25 М NaOH (7 мл, 1,7 ммоль) с последующим перемешиванием при комнатной температуре в течение 18 часов. Реакционную смесь подкисляют 1 М HCl. Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении. Таким образом полученные сырые кристаллы перекристаллизовывают из смеси хлороформ/н-гексан/ацетон, получая при этом указанное в заголовке соединение (329 мг, 50%) в виде бесцветного твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 1,20 (м, 2H), 1,33 (м, 2H), 1,90 (м, 4H), 2,18 (м, 2H), 3,18 (т, J=9,5 Гц, 1H), 3,50 (м, 1H), 3,62 (м, 1H), 3,70 (м, 1H), 3,90 (с, 3H), 3,80-4,00 (м, 2H), 4,12 и 4,32 (2 м, общий 1H), 5,40 (м, 1H), 7,20 (м, 3H), 7,52 (д, J=8,1 Гц, 1H), 7,65 (м, 1H), 8,14 (д, J=7,8 Гц, 1H), 8,30 (с, 1H), 9,55 (с, 1H), 12,04 (ушир., 1H).
МС (ESI) m/z 572 (M+1)+;
Анал. Вычисл. для С30Н32F3N3O5 ·1,0 H2О: C, 61,11; H, 5,81; N, 7,13.
Найдено: C, 60,92; H, 5,55; N, 6,97.
Пример 72
транс-4-(1-(2,5-Дихлор-4-((1-метил-1Н-3-индолилкарбонил)амино)фенилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоновая кислота:
(Стадия 1) Синтез 2,5-дихлор-4-((1-метил-1Н-3-индолилкарбонил)амино)фенил)уксусной кислоты
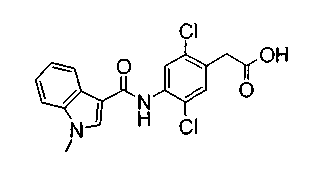
В метиленхлориде (25 мл) растворяют 1-метил-1Н-индол-3-карбоновую кислоту (794 мг, 4,53 ммоль) К раствору при перемешивании при 0°С добавляют оксалилхлорид (0,79 мл, 9,1 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 1 часа и затем перегоняют при пониженном давлении для удаления растворителя. Остаток растворяют в метиленхлориде (25 мл). Образовавшийся раствор добавляют к раствору триэтиламина (0,84 мл, 9,0 ммоль) и этил-4-амино-2,5-дихлорфенилацетата (750 мг, 3,02 ммоль) при 0°С. Реакционную смесь нагревают при кипячении с обратным холодильником в течение 18 часов. После охлаждения до комнатной температуры реакционную смесь выливают в воду с последующей экстракцией хлороформом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом магния и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем (Yamazen, среднее давление, линейный градиент хлороформа и метанола от 100:0 до 95:5, 12 мл/мин, (37 мм×300 мм), в результате чего получают очищенный сложный эфир. К очищенному эфиру добавляют ТГФ (45 мл) и 0,25 М NaOH (18 мл, 4,5 ммоль) с последующим перемешиванием при комнатной температуре в течение 4 часов. Воду и 1 М HCl добавляют для подкисления реакционной смеси. Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении. Сырые кристаллы перекристаллизовывают из смеси хлороформ/н-гексан, получая при этом 2,5-дихлор-4-((1-метил-1Н-3-индолилкарбонил)амино)фенил)уксусную кислоту (807 мг, 71%) в виде бесцветного твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 3,72 (с, 2H), 3,90 (с, 3H), 7,22 (т, J=8,l Гц, 1H), 7,28 (т, J=8,1 Гц, 1H), 7,56 (д, J=8,3 Гц, 1H), 7,64 (с, 1H), 7,92 (с, 1H), 8,15 (д, J=7,8 Гц, 1H), 8,31 (с, 1H), 9,39 (с, 1H).
МС (ESI) m/z 378 (M+1)+.
(Стадия 2) Синтез транс-4-(1-(2,5-дихлор-4-((1-метил-1Н-3-индолилкарбонил)амино)фенилацетил)-(4S)-фтор-(2S)- пирролидинилметокси)циклогексанкарбоновая кислота
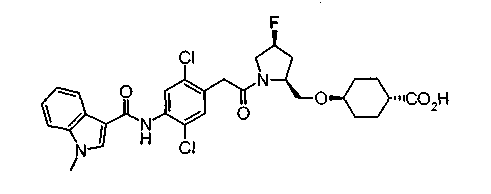
В ДМФ (10 мл) растворяют (2,5-дихлор-4-((1-метил-1Н-3-индолилкарбонил)амино)фенил)уксусную кислоту (438 мг, 1,16 ммоль), метил-транс-4-((4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилат (соединение, синтезированное в стадии (3) примера 21) (301 мг, 1,16 ммоль), HOBt (357 мг, 2,64 ммоль), DMAP (каталитическое количество) и соль EDC·HCl (400 мг, 2,09 ммоль). Образовавшуюся смесь перемешивают при комнатной температуре в течение 18 часов. Реакционную смесь выливают в 1 М HCl с последующей экстракцией этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом магния и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем (Yamazen, среднее давление, линейный градиент хлороформа и метанола от 100:0 до 95:5, 12 мл/мин, (37 мм×300 мм). Очищенный сложный эфир растворяют в ТГФ (14 мл) и 0,25 М NaOH (7 мл, 1,7 ммоль). Образовавшуюся смесь перемешивают в течение 18 часов при комнатной температуре и выливают в воду. Раствор подкисляют 1 М HCl. Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении. Сырые кристаллы перекристаллизовывают из смеси хлороформ/н-гексан/ацетон, получая при этом указанное в заголовке соединение (528 мг, 75%) в виде бесцветного кристаллического вещества.
1H-ЯМР (ДМСО-d6) δ: 1,20 (м, 2H), 1,32 (м, 2H), 1,90 (м, 4H), 2,20 (м, 2H), 3,21 (м, 1H), 3,49 (м, 1H), 3,65-4,00 (м, 4H), 3,90 (с, 3H), 4,12 и 4,40 (2 м, общий 1H), 5,40 (м, 1Н), 7,21 (т, J=7,4 Гц, 1H), 7,28 (т, J=7,4 Гц, 1H), 7,50 (д, J=15,7 Гц, 1H), 7,55 (д, J=8,1 Гц, 1H), 7,88 (д, J=3,4 Гц, 1H), 8,14 (д, J=7,8 Гц, 1H), 8,30 (с, 1H), 9,38 (с, 1H), 12,04 (с, 1H).
МС (ESI) m/z 605 (M+1)+.
Анал. Вычисл. для С30Н32Cl2FN3O5·0,25 H2О: C, 59,17; H, 5,38; N, 6,90.
Найдено: C, 59,18; H, 5,38; N, 6,71.
Пример 73
транс-4-(1-((5-Хлор-2-фтор-4-((6-фтор-1-метил-3-индолилкарбонил)амино)фенил)ацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоновая кислота:
(Стадия 1) Синтез 6-фтор-1-метилиндол-3-карбоновой кислоты

В ацетоне (200 мл) растворяют 6-фтор-1-метилиндол-3-карбальдегид (3,10 г, 17,5 ммоль). К образовавшемуся раствору в виде порций добавляют перманганат калия (0,2 М водный раствор, 175 мл, 35,0 ммоль) при перемешивании при комнатной температуре. После перемешивания при комнатной температуре в течение 10 часов реакционную смесь фильтруют через целит.После перегонки фильтрата при пониженном давлении остаток подкисляют 1 н. HCl. Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при пониженном давлении, получая при этом 6-фтор-1-метилиндол-3-карбоновую кислоту (2,37 г, 70%) в виде коричневого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 3,82 (с, 3H), 7,05 (м, 1H), 7,41 (д, J=9,8 Гц, 1H), 7,98 (дд, J=8,6, 5,6 Гц, 1H), 8,04 (с, 1H), 12,03 (с, 1H).
МС (ESI) m/z 194 (M++1).
(Стадия 2) Синтез этил-(5-хлор-2-фтор-4-((6-фтор-1-метил-3-индолилкарбонил)амино)фенил)ацетата.
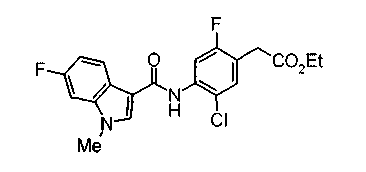
К суспензии 6-фтор-1-метилиндол-3-карбоновой кислоты (500 мг, 2,59 ммоль) и ДМФ (0,02 мл, 0,26 ммоль) в метиленхлориде (15 мл) по каплям добавляют оксалилхлорид (0,25 мл, 2,85 ммоль) при перемешивании при комнатной температуре. После завершения добавления реакционную смесь перемешивают при комнатной температуре в течение 1 часа. Реакционную смесь затем перегоняют при пониженном давлении для удаления растворителя. Остаток растворяют в метиленхлориде (10,0 мл) с последующим добавлением по каплям к раствору этил-(4-амино-5-хлор-2-фторфенил)ацетата (600 мг, 2,59 ммоль) и триэтиламина (1,08 мл, 7,77 ммоль) в метиленхлориде (5,0 мл). После завершения прикапывания реакционную смесь нагревают при кипячении с обратным холодильником в течение 10 часов. После охлаждения реакционной смеси до комнатной температуры осажденные кристаллы удаляют при пониженном давлении. Фильтрат перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси н-гексан:этилацетат (2:1, об./об.) этил-(5-хлор-2-фтор-4-((6-фтор-1-метил-3-индолилкарбонил)амино)фенил)ацетат (665 мг, 63%) получают в виде желтого твердого вещества.
1H-ЯМР (CDCl3) δ: 1,28 (т, J=7,1 Гц, 3H), 3,62 (с, 2H), 3,84 (с, 3H), 4,19 (кв., J=7,1 Гц, 2H), 7,07-7,12 (м, 2H), 7,34 (д, J=7,3 Гц, 1H), 7,74 (с, 1H), 8,10 (дд, J=9,1, 5,2 Гц, 1H), 8,19 (ушир.с, 1H), 8,49 (д, J=12,0 Гц, 1H).
МС (ESI) m/z 407 (M++1).
(Стадия 3) Синтез (5-хлор-2-фтор-4-((6-фтор-1-метил-3-индолилкарбонил)амино)фенил)уксусной кислоты
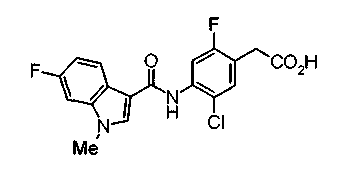
В ТГФ (17 мл) растворяют этил-(5-хлор-2-фтор-4-((6-фтор-1-метил-3-индолилкарбонил)амино)фенил)ацетат (665 мг, 1,63 ммоль). К образовавшемуся раствору добавляют 0,25 н. NaOH (9,81 мл, 2,45 ммоль) и смесь перемешивают при комнатной температуре в течение 14 часов. Реакционную смесь выливают в 1 н. HCl (3,0 мл). Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при пониженном давлении, получая при этом (5-хлор-2-фтор-4-((6-фтор-1-метил-3-
индолилкарбонил)амино)фенил)уксусную кислоту (600 мг, 97%) в виде коричневого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 3,65 (с, 2H), 3,86 (с, 3H), 7,06 (м, 1H), 7,44 (дд, J=10,3, 2,5 Гц, 1H), 7,54 (д, J=7,6 Гц, 1H), 7,69 (д, J=11,2 Гц, 1H), 8,12 (дд, J=8,8, 5,6 Гц, 1H), 8,32 (с, 1H), 9,38 (с, 1H), 12,58 (ушир.с, 1H).
МС (ESI) m/z 379 (M++1).
(Стадия 4) Синтез метил-транс-4-(1-((5-хлор-2-фтор-4-((6-фтор-1-метил-3-индолилкарбонил)амино)фенил)ацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилата
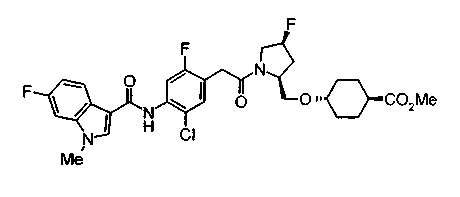
К раствору (5-хлор-2-фтор-4-((6-фтор-1-метил-3-индолилкарбонил)амино)фенил)уксусной кислоты (200 мг, 0,53 ммоль), метил-транс-4-((4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилата (соединение, синтезированное в стадии (3) примера 21), HOBt (14,0 мг, 0,11 ммоль) и DMAP (13,0 мг, 0,11 ммоль) в ДМФ (5,0 мл) добавляют EDC·HCl (152 мг, 0,79 ммоль). После перемешивания при комнатной температуре в течение 18 часов реакционную смесь разбавляют водой с последующей экстракцией этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций этилацетата метил-транс-4-(1-((5-хлор-2-фтор-4-((6-фтор-1-метил-3-индолилкарбонил)амино)фенил)ацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилат (303 мг, 92%) получают в виде желтого масла.
1H-ЯМР (CDCl3) δ: 1,18-1,53 (м, 4H), 1,93-2,53 (м, 7H), 3,23-3,98 (м, 13H), 4,30 и 4,37 (каждый м, общий 1H), 5,26 и 5,28 (каждый м, общий 1H), 7,06-7,11 (м, 2H), 7,39 и 7,40 (каждый д, J=7,1 Гц, общий 1H), 7,73 (с, 1H), 8,10 (дд, J=9,0,4,9 Гц, 1H), 8,18 (м, 1H), 8,45 и 8,46 (каждый д, J=12,0 Гц, общий 1H)
МС (ESI) m/z 620 (M++1).
(Стадия 5) Синтез транс-4-(1-((5-хлор-2-фтор-4-((6-фтор-1-метил-3-индолилкарбонил)амино)фенил)ацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоновой кислоты
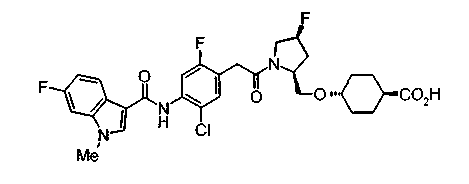
В ТГФ (49 мл) растворяют метил-транс-4-(1-((5-хлор-2-фтор-4-((6-фтор-1-метил-3-индолилкарбонил)амино)фенил)ацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилат (303 мг, 0,49 ммоль). К образовавшемуся раствору добавляют 0,25 н. NaOH (3,00 мл, 0,75 ммоль) и смесь перемешивают при комнатной температуре в течение 17 часов. Реакционную смесь выливают в 1 н. HCl (1,0 мл). Таким образом осажденные кристаллы собирают фильтрованием, промывают водой и сушат при пониженном давлении, получая при этом указанное в заголовке соединение (236 мг, 79%) в виде бесцветного твердого вещества.
ИК (ATR) ν 3417, 2940, 2865, 1708, 1619, 1646, 1585, 1517, 1467 см-1;
1H-ЯМР (ДМСО-d6) δ: 1,18-1,41 (м, 4H), 1,86-2,33 (м, 7H), 3,17-3,98 (м, 10H), 4,13 и 4,35 (каждый м, общий 1H), 5,32 и 5,41 (каждый м, общий 1H), 7,06 (м, 1H), 7,42-7,46 (м, 2H), 7,65 и 7,66 (каждый д, J=11,2 Гц, общий 1H), 8,12 (дд, J=8,6, 5,9 Гц, 1H), 8,31 (с, 1H), 9,37 (с, 1H), 12,03 (ушир. с, 1H).
МС (ESI) m/z 606 (M++1);
Анал. Вычисл. для С30Н31ClF3N3O5 ·0,75H2О: C, 58,16; H, 5,29; N, 6,78.
Найдено: C, 58,35; H, 5,23; N, 6,39.
Пример 74
транс-4-(1-((5-хлор-2-фтор-4-(((5-фтор-1-метил-3-индолил)карбонил)амино)фенил)ацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоновая кислота:
(Стадия 1) Синтез (5-фтор-1-метилиндол)-3-карбальдегида

В ДМФ (100 мл) растворяют 5-фториндол-3-карбальдегид (5,17 г, 36,7 ммоль). К образовавшемуся раствору добавляют по частям гидрид натрия (60% в масле, 1,39 г, 34,9 ммоль) при перемешивании при 0°С. После перемешивания реакционной смеси при такой же температуре в течение 1 часа, к ней добавляют метилиодид (4,57 мл, 73,4 ммоль) при 0°С. Образовавшуюся смесь перемешивают при комнатной температуре в течение 18 часов. Реакционную смесь выливают в 1 н. HCl с последующей экстракцией эфиром. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток кристаллизуют добавлением к нему смеси хлороформ/гексан. Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении и сушат при пониженном давлении, получая при этом 5-фтор-1-метилиндол-3-карбальдегида (2,53 г, 39%) в виде белого кристаллического порошка.
1H-ЯМР (CDCl3) δ: 3,86 (с, 3H), 7,08 (ушир.т, J=9,2 Гц, 1H), 7,27 (дд, J=4,4,8,8 Гц, 1H), 7,68 (с, 1H), 7,95 (ушир.д, J=9,6 Гц, 1H).
(Стадия 2) Синтез 5-фтор-1-метилиндол-3-карбоновой кислоты
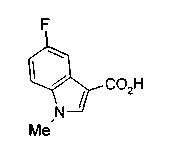
В ацетоне (50 мл) растворяют 5-фтор-1-метилиндол-3-карбальдегид (1,33 г, 7,52 ммоль). К образовавшемуся раствору добавляют по каплям 1 н.водный раствор перманганата калия (7,15 мл, 7,15 ммоль) при перемешивании при 0°С.После перемешивания при комнатной температуре в течение 18 часов добавляют еще 1 н.водный раствор перманганата калия (4,0 мл, 4,0 ммоль) и смесь перемешивают при комнатной температуре в течение 18 часов. Смесь фильтруют через целит.После промывания водой к фильтрату добавляют 1 н. HCl. Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при пониженном давлении, получая при этом 5-фтор-1-метилиндол-3-карбоновую кислоту (885 мг, 61%) в виде белого кристаллического порошка.
1H-ЯМР (ДМСО-d6) δ: 3,86 (с, 3H), 7,06-7,11 (м, 1H), 7,53 (дд, J=4,8,9,2 Гц, 1H), 7,67 (ушир.д, J=10,0 Гц, 1H), 8,08 (с, 1H), 12,00 (ушир.с, 1Н).
(Стадия 3) Синтез этил-(5-хлор-2-фтор-4-(((5-фтор-1-метил-3-индолил)карбонил)амино)фенил)ацетата
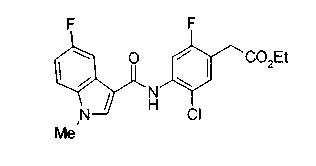
В метиленхлориде (30 мл) растворяют 5-фтор-1-метилиндол-3-карбоновую кислоту (885 мг, 4,58 ммоль). К образовавшемуся раствору добавляют оксалилхлорид (600 мкл, 6,87 ммоль) при перемешивании при 0°С и образовавшуюся смесь перемешивают при комнатной температуре в течение 1 часа. Из реакционной смеси растворитель отгоняют при пониженном давлении. Остаток растворяют в метиленхлориде (50 мл). Образовавшийся раствор добавляют по каплям к раствору этил-(4-амино-5-хлор-2-фторфенил)ацетата (1,06 г, 4,58 ммоль) в метиленхлориде (20 мл) с последующим нагреванием при кипячении с обратным холодильником в течение 15 минут.Реакционную смесь охлаждают и к ней добавляют триэтиламин (3,19 мл, 22,9 ммоль). Образовавшуюся смесь нагревают при кипячении с обратным холодильником в течение 18 часов. Реакционную смесь охлаждают и выливают в 1 н. HCl с последующей экстракцией этилацетатом. Экстракт сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси гексан/этилацетат (2/1) этил-(5-хлор-2-фтор-4-(((5-фтор-1-метил-3-индолил)карбонил)амино)фенил)ацетат (868 мг, 47%) получают в виде белого твердого вещества.
1H-ЯМР (CDCl3) δ: 1,27 (т, J=7,2 Гц, 3H), 3,61 (с, 2H), 3,87 (с, 3H), 4,18 (дд, J=7,2, 14,0 Гц, 2H), 7,08 (дт, J=2,0, 8,8 Гц, 1H), 7,29-7,34 (м, 2H), 7,5 (с, 1H), 7,83 (дд, J=2,4, 9,6 Гц, 1H), 8,11 (ушир.с, 1H), 8,80 (д, J=12 Гц, 1H).
МС (ESI) m/z 407 (M++1).
(Стадия 4) Синтез (5-хлор-2-фтор-4-(((5-фтор-1-метил-3-индолил)карбонил)амино)фенил)уксусной кислоты
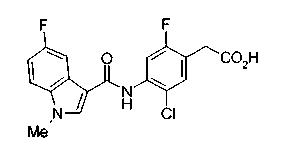
Смесь ТГФ/метанол (1/1, 60 мл) и 0,25 н. NaOH (43 мл, 10,6 ммоль) добавляют к этил-(5-хлор-2-фтор-4-(((5-фтор-1-метил-3-индолил)карбонил)амино)фенил)ацетату (865 ммоль, 2,13 ммоль) и смесь перемешивают при комнатной температуре в течение 3 часов. Реакционную смесь выливают в 1 н. HCl с последующей экстракцией смесью хлороформ/метанол (10/1). Экстракт сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток отверждается при добавлении смеси метанол/хлороформ/гексан. Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении и сушат при пониженном давлении, получая при этом (5-хлор-2-фтор-4-(((5-фтор-1-метил-3-индолил)карбонил)амино)фенил)уксусную кислоту (736 мг, 91%) в виде белого кристаллического порошка.
1H-ЯМР (ДМСО-d6) δ: 3,72 (с, 2H), 3,90 (с, 3H), 7,11 (дт, J=2,8, 9,2 Гц, 1H), 7,53-7,58 (м, 2H), 7,83 (дд, J=2,4, 9,6 Гц, 1H), 8,37.
МС (ESI) m/z 379 (M++1).
(Стадия 5) Синтез метил-транс-4-(1-((5-хлор-2-фтор-4-(((5-фтор-1-метил-3-индолил)карбонил)амино)фенил)ацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилата
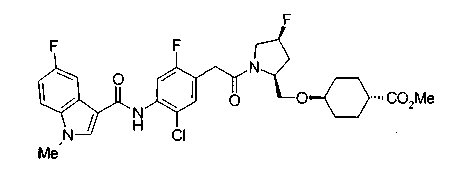
В ДМФ (20 мл) растворяют (5-хлор-2-фтор-4-(((5-фтор-1-метил-3-индолил)карбонил)амино)фенил)уксусную кислоту (483 мг, 1,28 ммоль), метил-транс-4-((4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилат (соединение, синтезированное в стадии (3) примера 21) (331 мг, 1,28 ммоль) и EDC·HCl (294 мг, 1,53 ммоль). К образовавшемуся раствору добавляют HOBt (35,0 мг, 0,26 ммоль) и образовавшуюся смесь перемешивают при комнатной температуре в течение 18 часов. Реакционную смесь выливают в воду с последующей экстракцией этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси гексан/этилацетат (1/2) метил-транс-4-(1-((5-хлор-2-фтор-4-(((5-фтор-1-метил-3-индолил)карбонил)амино)фенил)ацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилат (718 мг, 91%) получают в виде бесцветного аморфного вещества.
1H-ЯМР (CDCl3), смесь ротамеров, δ: 1,23-1,31 (м, 2H), 1,40-1,52 (м, 2H), 1,96-2,52 (ряд м, 7H), 3,20-4,00 (ряд м, 7H), 3,65 и 3,67 (с, общий 3H), 3,78 (с, 3H), 4,28-4,42 (м, 1H), 5,18-5,38 (м, 1H), 7,08 (ушир.т, J=9,2 Гц, 1H), 7,31 (дд, J=4,4, 9,2 Гц, 1H), 7,39 (дд, J=4,4, 7,6 Гц, 1H), 7,75 (д, J=2,8 Гц, 1H), 7,84 (дд, J=2,8, 9,6 Гц, 1H), 8,11 (д, J=5,2 Гц, 1H), 8,43 и 8,46 (д, J=9,2 Гц, общий 1H).
МС (ESI) m/z 621 (M++2).
(Стадия 6) Синтез транс-4-(1-((5-хлор-2-фтор-4-(((5-фтор-1-метил-3-индолил)карбонил)амино)фенил)ацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоновой кислоты
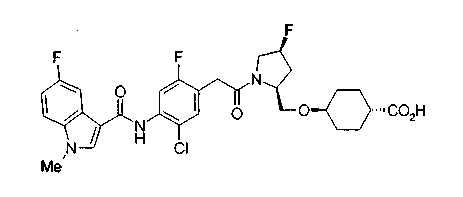
К метиловому эфиру (678 мг, 1,11 ммоль) добавляют смесь ТГФ/метанол (1/1, 40 мл) и 0,25 н. NaOH (22 мл, 5,54 ммоль) и образовавшуюся смесь перемешивают при комнатной температуре в течение 3,5 часа. Реакционную смесь выливают в 1 н. HCl с последующей экстракцией смесью хлороформ/метанол (10/1). Экстракт сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси хлороформ/метанол (10/1) указанное в заголовке соединение (694 мг, 100%) получают в виде бесцветного аморфного вещества.
1H-ЯМР (ДМСО-d6), смесь ротамеров, δ: 1,18-1,39 (ряд м, 4H), 1,87-2,51 (ряд м, 7H), 3,16-4,40 (ряд м, 8H), 3,90 (с, 3H), 5,23-5,55 (м, 1H), 7,08 (дт, J=2,8, 9,2 Гц, 1H), 7,41 и 7,44 (д, J=7,6 Гц, общий 1H), 7,55 и 7,58 (д, J=4,4 Гц, общий 1H), 7,66 и 7,69 (д, J=6,0 Гц, общий 1H), 7,83 (дд, J=2,4, 10,0 Гц, 1H), 8,38 (с, 1H), 9,33 (с, 1H).
МС (ESI) m/z 607 (M++1).
Пример 75
транс-4-(1-(5-хлор-2-фтор-4-((4-фтор-1-метил-3-индолилкарбонил)амино)фенил)ацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоновая кислота:
(Стадия 1) Синтез 4-фтор-1-метилиндола
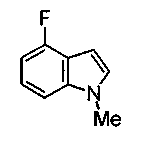
В ДМФ (40 мл) растворяют 4-фториндол (2,00 г, 14,8 ммоль). К образовавшемуся раствору добавляют по частям гидрид натрия (60% в масле, 0,71 г, 17,8 ммоль) при перемешивании при 0°С. После перемешивания реакционной смеси в течение 40 минут при такой же температуре метилиодид (1,11 мл, 17,8 ммоль) добавляют при 0°С. Реакционную смесь перемешивают далее при такой же температуре в течение 4 часов. Для окончания реакции добавляют насыщенный водный раствор хлорида аммония. Реакционную смесь экстрагируют эфиром и экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси н-гексан-этилацетат (5:1, об./об.) 4-фтор-1-метилиндол (2,20 г, 100%) получают в виде желтого масла.
1H-ЯМР (CDCl3) δ: 3,78 (с, 3H), 6,55 (м, 1H), 6,77 (м, 1H), 7,01 (д, J=3,2 Гц, 1H), 7,08-7,15 (м, 2H).
МС (ESI) m/z 150 (M++1).
(Стадия 2) Синтез 4-фтор-1-метилиндол-3-карбальдегида
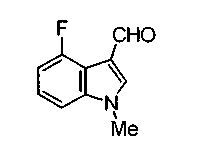
При перемешивании при 0°С по каплям к ДМФ (30 мл) добавляют фосфорилхлорид (2,07 мл, 22,1 ммоль). После завершения добавления по каплям добавляют раствор 4-фтор-1-метилиндола (2,20 г, 14,7 ммоль) в ДМФ (15 мл) и реакционную смесь перемешивают при комнатной температуре в течение 4 часов. Реакционную смесь выливают в 1 н. NaOH (120 мл) с последующей экстракцией этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси н-гексан-этилацетат (1:1, об./об.) 4-фтор-1-метилиндол-3-карбальдегид (1,43 г, 55%) получают в виде красного твердого вещества.
1H-ЯМР (CDCl3) δ: 3,88 (с, 3H), 7,17 (д, J=7,1 Гц, 1H), 7,23-7,28 (м, 2H), 7,81 (с, 1H), 10,21 (с, 1H).
МС (ESI) m/z 178 (M++1).
(Стадия 3) Синтез 4-фтор-1-метилиндол-3-карбоновой кислоты
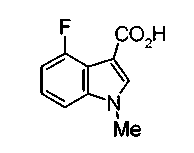
В ацетоне (95 мл) растворяют 4-фтор-1-метилиндол-3-карбальдегид (1,43 г, 8,08 ммоль) с последующим добавлением перманганата калия (0,2 М водный раствор, 62,0 мл, 12,4 ммоль) по частям при комнатной температуре. После перемешивания реакционной смеси при комнатной температуре в течение 16 часов осадок отфильтровывают через целит. Фильтрат перегоняют при пониженном давлении для удаления растворителя. Остаток подкисляют 1 н. HCl. Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при пониженном давлении, получая при этом 4-фтор-1-метилиндол-3-карбоновую кислоту (0,91 г, 58%) в виде коричневого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 3,85 (с, 3H), 6,93 (дд, J=11,5, 7, 8 Гц, 1H), 7,23 (м, 1H), 7,35 (д, J=8,3 Гц, 1H), 8,08 (с, 1H), 11,88 (ушир.с, 1H).
МС (ESI) m/z 194 (M++1).
(Стадия 4) Синтез этил-(5-хлор-2-фтор-4-((4-фтор-1-метил-3-индолилкарбонил)амино)фенил)ацетата
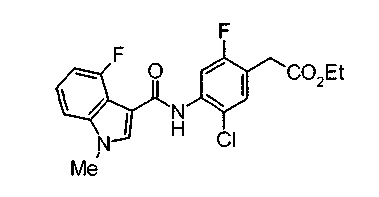
К суспензии 4-фтор-1-метилиндол-3-карбоновой кислоты (700 мг, 3,62 ммоль) и ДМФ (28,0 мкл, 0,36 ммоль) в метиленхлориде (20 мл) по частям добавляют оксалилхлорид (0,35 мл, 3,99 ммоль) при перемешивании при комнатной температуре. После перемешивания реакционной смеси при комнатной температуре в течение 50 минут добавляют оксалилхлорид (30 мкл) и смесь перемешивают в течение следующих 40 минут. К реакционной смеси добавляют раствор этил-(4-амино-5-хлор-2-фторфенил)ацетата (839 мг, 3,62 ммоль) и триэтиламина (1,52 мл, 10,9 ммоль) в метиленхлориде (5 мл) и смесь нагревают при кипячении с обратным холодильником в течение 4 часов. После охлаждения до комнатной температуры в реакционную смесь добавляют воду с последующей экстракцией хлороформом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси н-гексан-этилацетат (2:1, об./об.) этил-(5-хлор-2-фтор-4-((4-фтор-1-метил-3-индолилкарбонил)амино)фенил)ацетат (762 мг, 52%) получают в виде желтого твердого вещества.
1H-ЯМР (CDCl3) δ: 1,27 (т, J=7,3 Гц, 3H), 3,61 (с, 2H), 3,87 (с, 3H), 4,18 (кв., J=7,3 Гц, 2H), 7,02 (дд, J=12,2, 8,1 Гц, 1H), 7,20 (д, J=8,1 Гц, 1H), 7,27 (м, 1H), 7,32 (д, J=7,3 Гц, 1H), 8,02 (с, 1H), 8,48 (д, J=12,2 Гц, 1H), 9,26 (м, 1H).
МС (ESI) m/z 407 (M++1).
(Стадия 5) Синтез (5-хлор-2-фтор-4-((4-фтор-1-метил-3-индолилкарбонил)амино)фенил)уксусной кислоты
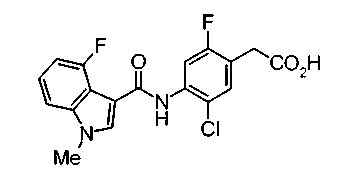
В ТГФ (19 мл) растворяют этил-(5-хлор-2-фтор-4-((4-фтор-1-метил-3-индолилкарбонил)амино)фенил)ацетат (762 мг, 1,87 ммоль). К образовавшемуся раствору добавляют 0,25 н. NaOH (11,2 мл, 2,81 ммоль) и смесь перемешивают при комнатной температуре в течение 3 часов. Реакционную смесь выливают в 1 н. HCl (3,0 мл). Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при пониженном давлении, получая при этом (5-хлор-2-фтор-4-((4-фтор-1-метил-3-индолилкарбонил)амино)фенил)уксусную кислоту (698 мг, 99%) в виде пурпурного твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 3,64 (с, 2H), 3,90 (с, 3H), 7,07 (дд, J=12,5, 7,8 Гц, 1H), 7,29 (м, 1H), 7,44 (д, J=8,4 Гц, 1H), 7,55 (д, J=7,8 Гц, 1H), 8,11 (д, J=11,7 Гц, 1H), 8,25 (с, 1H), 9,30 (д, J=10,3 Гц, 1H), 12,54 (ушир.с, 1H).
МС (LCMS) m/z 379 (M++1).
(Стадия 6) Синтез метил-транс-4-(1-(5-хлор-2-фтор-4-((4-фтор-1-метил-3-индолилкарбонил)амино)фенил)ацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилата

К раствору (5-хлор-2-фтор-4-((4-фтор-1-метил-3-индолилкарбонил)амино)фенил)уксусной кислоты (200 мг, 0,53 ммоль), метил-транс-4-((4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилата (соединение, синтезированное в стадии (3) примера 21) (137 мг, 0,53 ммоль), HOBt (14,0 мг, 0,11 ммоль) и DMAP (13,0 мг, 0,11 ммоль) в ДМФ (5,0 мл) добавляют EDC·HCl (152 мг, 0,79 ммоль). После перемешивания при комнатной температуре в течение 23 часов в реакционную смесь добавляют воду с последующей экстракцией этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций этилацетата метил-транс-4-(1-(5-хлор-2-фтор-4-((4-фтор-1-метил-3-индолилкарбонил)амино)фенил)ацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилат (332 мг, 100%) получают в виде желтого твердого вещества.
1H-ЯМР (CDCl3) δ: 1,22-1,33 (м, 2H), 1,41-1,54 (м, 2H), 1,98-2,18 (м, 4H), 2,23-2,54 (м, 3H), 3,25-4,03 (м, 13H), 4,30 и 4,39 (каждый м, общий 1H), 5,27 и 5,31 (каждый м, общий 1H), 7,03 (дд, J=12,2, 7,8 Гц, 1H), 7,21-7,31 (м, 2H), 7,38 и 7,39 (каждый д, J=7,3 Гц, общий 1H), 8,03 (с, 1Н), 8,46 и 8,48 (каждый д, J=12,2 Гц, общий 1H), 9,26 (м, 1H).
МС (LCMC) m/z 620 (M++1).
(Стадия 7) Синтез транс-4-(1-(5-хлор-2-фтор-4-((4-фтор-1-метил-3-индолилкарбонил)амино)фенил)ацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоновой кислоты
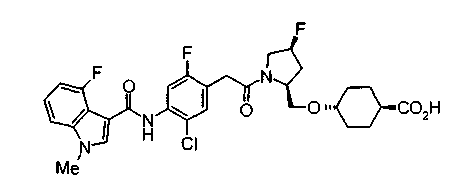
В ТГФ (5,5 мл) растворяют метил-транс-4-(1-(5-хлор-2-фтор-4-((4-фтор-1-метил-3-индолилкарбонил)амино)фенил)ацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилат (323 мг, 0,52 ммоль). К образовавшемуся раствору добавляют 0,25 н. NaOH (3,13 мл, 0,78 ммоль). Образовавшуюся смесь перемешивают при комнатной температуре в течение 16 часов. Реакционную смесь выливают в 1 н. HCl (1,0 мл). Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при пониженном давлении, получая при этом указанное в заголовке соединение (266 мг, 84%) в виде желтого твердого вещества.
ИК (ATR) ν 3399, 2937, 2863, 1724, 1648, 1621, 1587, 1521, 1450 см-1;
1H-ЯМР (ДМСО-d6) δ: 1,16-1,41 (м, 4H), 1,86-2,00 (м, 4H), 2,10-2,32 (м, 3H), 3,17-3,88 (м, 7H), 3,90 (с, 3H), 4,13 и 4,35 (каждый м, общий 1H), 5,32 и 5,40 (каждый м, общий 1H), 7,07 (дд J=12,5, 8,1 Гц, 1H), 7,29 (м, 1H), 7,42-7,45 (м, 2H), 8,10 (д, J=11,7 Гц, 1H), 8,26 (с, 1H), 9,28 (д, J=8,5 Гц, 1H), 12,03 (ушир.с, 1H).
МС (LCMC) m/z 606 (M++1);
Анал. Вычисл. для С30Н31ClF3N3O5·0,5H2О: C, 58,59; H, 5,24; N, 6,83.
Найдено: C, 58,65; H, 5,27; N, 6,55.
Пример 76
транс-4-((4S)-Фтор-1-(2-фтор-5-метокси-4-((1-метил-1Н-3-индолилкарбонил)амино)фенилацетил)-(2S)-пирролидинилметокси)циклогексанкарбоновая кислота:
(Стадия 1) Синтез этил-(4-амино-2-фтор-5-метоксифенил)ацетата
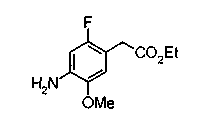
К 1,2-дифтор-4-метоксибензолу (5 г, 34,7 ммоль) добавляют концентрированную H2SO4 (9,25 мл, 174 ммоль). При перемешивании при 0°С по каплям добавляют концентрированную HNO3 (2,64 мл, 34,7 ммоль). После перемешивания в течение 3 часов при комнатной температуре реакционную смесь выливают в ледяную воду с последующей экстракцией этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток растворяют в ДМФ (100 мл). При перемешивании при 0°С по частям добавляют гидрид натрия (4,16 г, 104 ммоль). После перемешивания реакционной смеси при такой же температуре в течение 15 минут к ней частями добавляют раствор этил-трет-бутилэтилмалоната (6,57 мл, 34,7 ммоль) в ДМФ (50 мл). После завершения добавления перемешивание проводят при комнатной температуре в течение 18 часов. Реакционную смесь выливают в смесь ледяная вода-водный раствор хлорида аммония с последующей экстракцией этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. К остатку добавляют смесь метиленхлорид-трифторуксусная кислота (100 мл, 1:1, об./об.) с последующим нагреванием при кипячении с обратным холодильником в течение 18 часов. После охлаждения до комнатной температуры реакционную смесь перегоняют при пониженном давлении для удаления растворителя. К остатку добавляют железный порошок (6,2 г, 0,11 моль) и смесь обрабатывают ультразвуком в течение 5 минут. К реакционной смеси добавляют смесь метанол/вода (175 мл, 1:4), ацетат натрия (4,7 г, 35 ммоль) и уксусную кислоту (13,5 мл, 230 ммоль) с последующим нагреванием при кипячении с обратным холодильником в течение 3 часов(без использования мешалки). После охлаждения до комнатной температуры реакционную смесь фильтруют через целит при пониженном давлении и фильтрат промывают метанолом. Фильтрат перегоняют при пониженном давлении для удаления растворителя. Остаток растворяют в этилацетате. Раствор в этилацетате промывают насыщенным раствором соли, сушат над безводным сульфатом магния и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают колоночной хроматографией на силикагеле (система YAMAZEN YFLC-5404 хроматографии при среднем давлении, гексан/этилацетат, 9:1, (50 мм×500 мм, 15 мл/мин), получая при этом этил-4-амино-2-фтор-5-метоксифенилацетат (1,75 г, 22%) в виде бесцветного масла.
1H-ЯМР (CDCl3) (1,28 (т, J=7,1 Гц), 1,60 (ушир.с), 3,52 (с, 2H), 3,80 (с, 3H), 3,92 (ушир.с, 1H), 4,15 (кв., J=7,1 Гц), 6,42 (д, J=10,5 Гц), 6,62 (д, J=6,8 Гц).
МС (ESI) m/z 228 (M+1)+. (Стадия 2) Синтез 2-фтор-5-метокси-4-((1-метил-1Н-3-индолилкарбонил)амино)фенилуксусной кислоты
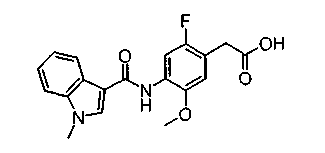
1-метил-1Н-индол-3-карбоновую кислоту (700 мг, 4,0 ммоль) растворяют в метиленхлориде (8 мл). К раствору при перемешивании при 0°С по каплям добавляют оксалилхлорид (0,53 мл, 6,1 ммоль). После окончания добавления реакционную смесь перемешивают при комнатной температуре в течение 1 часа и перегоняют при пониженном давлении для удаления растворителя. Остаток растворяют в метиленхлориде (6 мл). Образовавшийся раствор добавляют к раствору триэтиламина (0,84 мл, 6,0 ммоль) и этил-4-амино-2-фтор-5-метоксифенилацетата (909 мг, 4,0 ммоль) в метиленхлориде (3 мл) при перемешивании при 0°С.Реакционную смесь нагревают при кипячении с обратным холодильником в течение 18 часов. После охлаждения до комнатной температуры реакционную смесь выливают в ледяную воду с последующей экстракцией хлороформом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом магния и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают колоночной хроматографией на силикагеле (система Yamazen хроматографии при среднем давлении, линейный градиент смеси н-гексан/этилацетат, от 9:1 до 7:3, 12 мл/мин, (50 мм×300 мм, загрузка силикагеля сухим способом). В очищенный сложный эфир добавляют ТГФ (45 мл) и 0,25 М NaOH (18 мл, 4,5 ммоль) с последующим перемешиванием при комнатной температуре в течение 4 часов. Реакционную смесь выливают в воду и к образовавшейся смеси добавляют 1 М HCl, чтобы сделать ее кислотной. Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при пониженном давлении, получая при этом 2-фтор-5-метокси-4-((1-метил-1Н-3-индолилкарбонил)амино)фенилуксусную кислоту (1,01 г, 71%) в виде бесцветного твердого вещества.
1H-ЯМР (CDCl3) δ: 3,60 (с, 2H), 3,90 (с, 6H), 7,05 (д, J=6,8 Гц, 1H), 7,22 (т, J=7,5 Гц, 1H), 7,30 (т, J=7,5 Гц, 1H), 7,58 (д, J=7,6 Гц, 1H), 7,95 (д, J=11,5 Гц, 1H), 8,12 (д, J=7,3 Гц, 1H), 8,31 (с, 1H), 8,80 (с, 1H).
МС (ESI) m/z 357 (M+1)+.
(Стадия 3) Синтез транс-4-((4S)-Фтор-1-(2-фтор-5-метокси-4-((1-метил-1Н-3-индолилкарбонил)амино)фенилацетил)-(2S)-пирролидинилметокси)циклогексанкарбоновой кислоты
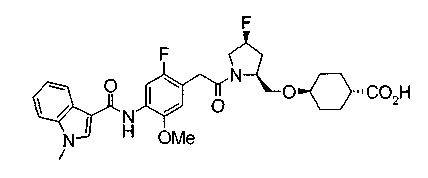
В ДМФ (5 мл) растворяют 2-фтор-5-метокси-4-((1-метил-1Н-3-индолилкарбонил)амино)фенилуксусную кислоту (214 мг, 0,6 ммоль), метил-транс-4-((4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилат (соединение, синтезированное в стадии (3) примера 21) (155 мг, 0,6 ммоль), HOBt (154 мг, 1,14 ммоль), DMAP (каталитическое количество) и EDC·HCl (173 мг, 0,9 ммоль). Образовавшийся раствор перемешивают при комнатной температуре в течение 18 часов. Реакционную смесь выливают в 1 М HCl для подкисления смеси с последующей экстракцией этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом магния и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают колоночной хроматографией на силикагеле (система Yamazen среднего давления, хлороформ, 10 мл/мин, (15 мм×300 мм). К очищенному эфиру добавляют ТГФ (6 мл) и 0,25 М NaOH (3,6 мл, 0,9 ммоль) и смесь перемешивают в течение 18 часов при комнатной температуре. Воду выливают в реакционную смесь и раствор подкисляют 1 н. HCl. Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при пониженном давлении, получая при этом указанное в заголовке соединение (160 мг, 46%) в виде бесцветного твердого вещества.
1H-ЯМР (ДМСО) δ: 1,10-1,40 (м, 4H), 1,85-2,25 (м, 6H), 3,20 (т, J=8,5 Гц, 1H), 3,42-3,80 (м, 7H), 3,88 (с, 3H), 3,90 (с, 3H), 4,15 и 4,33 (2 м, общий 1H), 3,35 (м, 1H), 6,95 (дд, J=6,9,14,7 ГЦ, 1H), 7,23 (т, J=7,5 Гц, 1H), 7,28 (т, J=7,5 Гц, 1H), 7,55 (д, J=7,8 Гц, 1H), 7,92 (дд, J=5,3,7,3 Гц, 1H), 8,12 (д, J=7,5 Гц, 1H), 8,30 (с, 1H), 8,88 (с, 1H).
МС (ESI) m/z 584 (M+1)+.
Анал. Вычисл. для С31Н35F2N3O6 ·0,25 H2О: C, 63,31; H, 6,08; N, 7,14.
Найдено: C, 63,07; H, 6,10; N, 7,05.
Пример 77
транс-4-(1-(5-Хлор-2-фтор-4-(1,2-диметил-1Н-3-индолилкарбонил)амино)фенилацетил)-(4S)-фтор-(2S)-
пирролидинилметокси)циклогексанкарбоновая кислота:
(Стадия 1) Синтез 1,2-диметил-1Н-индол-3-карбоновой кислоты

Диизопропиламин (2,83 мл, 20,0 ммоль) растворяют в ТГФ (35 мл). При перемешивании при -78°С к образовавшемуся раствору добавляют н-бутиллитий (12,7 мл, 20,0 ммоль, 1,57 М раствор в гексане). После перемешивания при 0°С в течение 15 минут реакционную смесь снова охлаждают до -78°С.При перемешивании добавляют раствор 1-метил-1Н-индол-3-карбоновой кислоты (1,75 г, 10,0 ммоль) в ТГФ (5 мл). После перемешивания реакционной смеси при такой же температуре в течение 30 минут добавляют метилиодид (3,42 мл, 55,0 ммоль). Реакционной смеси дают возможность нагреться снова до комнатной температуры на протяжении 30 минут. Реакционную смесь выливают в воду и смесь перемешивают в течение 18 часов при комнатной температуре. Реакционную смесь промывают эфиром. Водный слой подкисляют 1 М HCl с последующей экстракцией эфиром. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на силикагеле (среднее давление, линейный градиент смеси хлороформ/метанол от 10:0 до 20:1, 20 мл/мин, (50×300 мм), получая при этом 1,2-диметил-1Н-индол-3-карбоновую кислоту (180 мг, 10%) в виде бесцветного твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 2,72 (с, 3H), 3,72 (с, 3H), 7,12 (т, J=7,8 Гц, 1H), 2,75 (т, J=8,3 Гц, 1H), 7,48 (д, J=7,8 Гц, 1H), 7,97 (д, J=7,1 Гц, 1H).
МС (ESI) m/z 190 (M+1)+.
(Стадия 2) Синтез (5-хлор-2-фтор-4-((1,2-диметил-1Н-3-индолилкарбонил)амино)фенил)уксусной кислоты
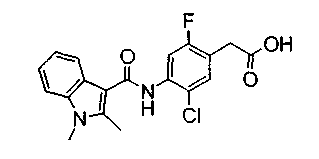
В метиленхлориде (8 мл) растворяют 1,2-диметил-1Н-индол-3-карбоновую кислоту (270 мг, 1,43 ммоль). К раствору при перемешивании при 0°С добавляют оксалилхлорид (0,19 мл, 2,1 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 1 часа и перегоняют при пониженном давлении для удаления растворителя. Остаток растворяют в метиленхлориде (6 мл) и образовавшийся раствор добавляют к раствору триэтиламина (0,56 мл, 4,3 ммоль) и этил-(4-амино-3-хлор-6-фторфенил)ацетата (331 мг, 1,4 ммоль) в метиленхлориде (3 мл) при перемешивании при 0°С.Реакционную смесь нагревают при кипячении с обратным холодильником в течение 18 часов. К реакционной смеси добавляют HOBt (каталитическое количество) и смесь нагревают при кипячении с обратным холодильником в течение 48 часов. После охлаждения в реакционную смесь добавляют хлороформ и насыщенный водный раствор лимонной кислоты. Смесь экстрагируют хлороформом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают колоночной хроматографией на силикагеле (система YAMAZEN при среднем давлении, линейный градиент смеси н-гексан/этилацетат от 9:1 до 7:3, 20 мл/мин, (50 мм×150 мм, способ адсорбции на сухом силикагеле). Очищенный продукт растворяют в ТГФ (15 мл) и к образовавшемуся раствору добавляют 0,25 М NaOH (8,6 мл, 2,2 ммоль). Смесь перемешивают при комнатной температуре в течение 18 часов. Реакционную смесь выливают в 1 М HCl для подкисления ее. Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при пониженном давлении, получая при этом (5-хлор-2-фтор-4-((1,2-диметил-1Н-3-индолилкарбонил)амино)фенил)уксусную кислоту (264 мг, 49%) в виде бесцветного твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 2,70 (с, 3H), 3,65 (с, 2H), 3,77 (с, 3H), 7,21 (м, 2H), 7,58 (д, J=7,3 Гц, 1H), 7,93 (м, 1H), 7,99 (д, J=11,8 Гц, 1H), 9,06 (с, 1H).
МС (ESI) m/z 375 (M+1)+.
(Стадия 3) Синтез транс-4-(1-(5-хлор-2-фтор-4-((1,2-диметил-1Н-3-индолилкарбонил)амино)фенилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоновой кислоты
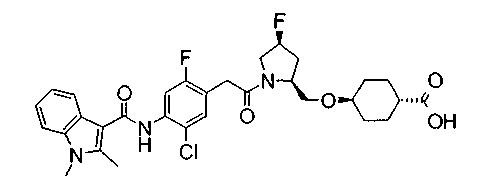
(5-Хлор-2-фтор-4-((1,2-диметил-1Н-3-индолилкарбонил)амино)фенил)уксусную кислоту (191 мг, 0,51 ммоль), метил-транс-4-((4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилат (соединение, синтезированное в стадии (3) примера 21) (132 мг, 0,51 ммоль), HOBt (131 мг, 0,97 ммоль), DMAP (каталитическое количество) и соль EDC·HCl (147 мг, 0,77 ммоль) растворяют в ДМФ (2,5 мл). Образовавшийся раствор перемешивают при комнатной температуре в течение 18 часов. Реакционную смесь выливают в 1 М HCl с последующей экстракцией этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом магния и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают колоночной хроматографией на силикагеле (система Yamazen среднего давления, линейный градиент смеси хлороформ/метанол от 10:0 до 20:1, 20 мл/мин, (50 мм×150 мм). Остаток растворяют в ТГФ (5 мл) и к образовавшемуся раствору добавляют 0,25 М NaOH (3,1 мл, 0,77 ммоль). Образовавшуюся смесь перемешивают в течение 18 часов при комнатной температуре. Реакционную смесь добавляют к 1 М HCl. Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при пониженном давлении, получая при этом указанное в заголовке соединение (227 мг, 74%) в виде бесцветного твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 1,20-1,40 (м, 6H), 1,90 (м, 4H), 2,20 (м, 2H), 2,72 (с, 3H), 3,20 (т, J=10,0 Гц, 1H), 3,50 (м, 1H), 3,60-4,00 (м, 3H), 3,75 (с, 3H), 4,12 и 4,35 (2 м, общий 1H), 5,38 (дд, J=35,55 Гц, 1H), 7,20 (м, 2H), 7,48 (дд, J=7,3,11,8 Гц, 1H), 7,55 (д, J=8,6 Гц, 1H), 7,92 (д, J=8,3 Гц, 1H), 7,95 (д, J=5,6 Гц, 1H), 9,05 (с, 1H).
МС (ESI) m/z 603 (M+1)+;
Анал. Вычисл. для С31Н34ClF2N3O5 ·0,5H2О: C, 60,93; H, 5,77; N, 6,88.
Найдено: C, 61,12; H, 5,75; N, 6,84.
Пример 78
транс-4-(1-((4-((2-Индолилкарбонил)амино)-3-метоксифенил)ацетил)-(4S)-фтор-(2S)-пирролидинилметокси)-циклогексанкарбоновая кислота:
(Стадия 1) Синтез трет-бутил-(4-((2-индолилкарбонил)амино)-3-метоксифенил)ацетата
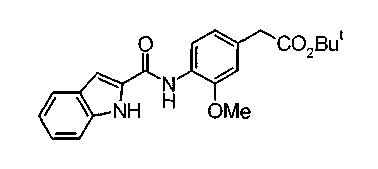
В ДМФ (10 мл) EDC·HCl (1,43 г, 7,45 ммоль) добавляют к индол-2-карбоновой кислоте (1,00 г, 6,21 ммоль), трет-бутил-4-амино-3-метоксифенилацетату (1,47 г, 6,21 ммоль), HOBt (0,42 г, 3,10 ммоль) и DMAP (0,38 г, 3,10 ммоль). Образовавшуюся смесь перемешивают при 60°C в течение 16 часов. К реакционной смеси добавляют воду с последующей экстракцией этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси н-гексан-этилацетат (1:1, об./об.) трет-бутил-(4-((2-индолилкарбонил)амино)-3-метоксифенил)ацетат (1,31 г, 55%) получают в виде коричневого твердого вещества.
1H-ЯМР (CDCl3) δ: 1,45 (с, 9H), 3,51 (с, 2H), 3,97 (с, 3H), 6,89 (ушир.с, 1H), 6,91 (д, J=8,1 Гц, 1H), 7,00 (ушир.с, 1H), 7,16 (т, J=8,1 Гц, 1H), 7,31 (т, J=8,1 Гц, 1H), 7,46 (д, J=8,3 Гц, 1H), 7,69 (д, J=8,1 Гц, 1H), 8,42 (д, J=8,3 Гц, 1H), 8,54 (ушир.с, 1H), 9,31 (ушир.с, 1H).
МС (ESI) m/z 381 (M++1).
(Стадия 2) Синтез (4-((2-индолилкарбонил)амино)-3-метоксифенил)уксусной кислоты

В метиленхлориде (20 мл) растворяют трет-бутил-(4-((2-индолилкарбонил)амино)-3-метоксифенил)ацетат (1,31 г, 3,44 ммоль). К образовавшемуся раствору добавляют ТФУ (10 мл) при 0°С.После перемешивания реакционной смеси при комнатной температуре в течение 1 часа реакционную смесь перегоняют при пониженном давлении для удаления растворителя, в результате чего (4-((2-индолилкарбонил)амино)-3-метоксифенил)уксусную кислоту (1,11 г, 99%) получают в виде коричневого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 3,57 (с, 2H), 3,86 (с, 3H), 6,87 (д, J=8,1 Гц, 1H), 7,01 (с, 1H), 7,06 (т, J=7,8 Гц, 1H), 7,21 (т, J=7,8 Гц, 1H), 7,32 (с, 1H), 7,45 (д, J=8,1 Гц, 1H), 7,64 (д, J=8,1 Гц, 1H), 7,74 (д, J=8,1 Гц, 1H), 9,32 (с, 1H), 11,72 (ушир.с, 1H).
МС (ESI) m/z 325 (M++1).
(Стадия 3) Синтез метил- транс-4-(1-((4-((2-индолилкарбонил)амино)-3-метоксифенил)ацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилата

В ДМФ (6,0 мл) растворяют (4-((2-индолилкарбонил)амино)-3-метоксифенил)уксусную кислоту (370 мг, 1,14 ммоль), метил-транс-4-((4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилат (соединение, синтезированное в стадии (3) примера 21) (296 мг, 1,14 ммоль), HOBt (31,0 мг, 0,23 ммоль) и DMAP (28,0 мг, 0,23 ммоль). К образовавшемуся раствору добавляют EDC·HCl (284 мг, 1,48 ммоль) с последующим перемешиванием при комнатной температуре в течение 21 часа. К реакционной смеси добавляют воду с последующей экстракцией этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из этилацетатных элюатных фракций метил-транс-4-(1-((4-((2-индолилкарбонил)амино)-3-метоксифенил)ацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилат (514 мг, 80%) получают в виде желтого аморфного вещества.
1H-ЯМР (CDCl3) δ: 1,17-1,33 (м, 2H), 1,39-1,56 (м, 2H), 1,97-2,50 (м, 7H), 3,25 (м, 1H), 3,33 и 3,50 (каждый м, 1H), 3,62-3,91(м, 8H), 3,96 (с, 3H), 4,25 и 4,38 (каждый м, общий 1H), 5,24 (м, 1H), 6,86 (д, J=8,1 Гц, 1H), 6,94 (м, 1H), 7,02 (ушир.с, 1H), 7,17 (т, J=7,8 Гц, 1H), 7,31 (т, J=7,8 Гц, 1H), 7,47 (д, J=8,1 Гц, 1H), 7,69 (д, J=8,1 Гц, 1H), 8,42 (м, 1H), 8,55 (ушир.с, 1H), 9,52 (ушир.с, 1H). МС (ESI) m/z 566 (M++1).
(Стадия 4) Синтез транс-4-(1-((4-((2-индолилкарбонил)амино)-3-метоксифенил)ацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоновой кислоты
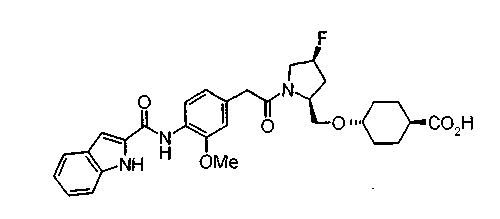
В ТГФ (10 мл) растворяют метил-транс-4-(1-((4-((2-индолилкарбонил)амино)-3-метоксифенил)ацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилат (514 мг, 0,91 ммоль). К образовавшемуся раствору добавляют 0,25 н. NaOH (5,50 мл, 1,36 ммоль) с последующим перемешиванием при комнатной температуре в течение 18 часов. Реакционную смесь выливают в 1 н. HCl (5,0 мл) для подкисления смеси. Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при пониженном давлении, получая при этом указанное в заголовке соединение (479 мг, 95%) в виде бесцветного твердого вещества.
ИК (ATR) ν 3662, 3415, 3278, 2987, 2942, 2900, 1724, 1702, 1658, 1600, 1536, 1486, 1450, 1413 см-1;
1H-ЯМР (ДМСО-d6) δ: 1,12-1,38 (м, 4H), 1,86-2,26 (м, 7H), 3,18 (м, 1H), 3,43-3,91 (м, 9H), 4,15 и 4,32 (каждый м, общий 1H), 5,31 и 5,37 (каждый м, общий 1H), 6,83 (м, 1H), 6,94 и 6,97 (каждый д, J=1,5 Гц, общий 1H), 7,06 (т, J=7,8 Гц, 1H), 7,21 (т, J=7,8 Гц, 1H), 7,32 (д, J=1,5 Гц, 1H), 7,45 (д, J=8,1 Гц, 1H), 7,64 (д, J=8,1 Гц, 1H), 7,71 и 7,72 (каждый д, J=8,1 Гц, общий 1H), 9,34 (с, 1H), 11,74 (ушир.с, 1H), 12,02 (ушир.с, 1H).
МС (ESI) m/z 552 (M++1);
Анал. Вычисл. для С30Н34FN3O6·0,25H2О: C, 64,79; H, 6,25; N, 7,56.
Найдено: C, 64,77; H, 6,23; N, 7,40.
Пример 79
транс-4-(1-((3-Бром-4-((1-изохинолинилкарбонил)амино)фенил)ацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоновая кислота:
(Стадия 1) Синтез этил-(3-бром-4-((1-изохинолинилкарбонил)амино)фенил)ацетат
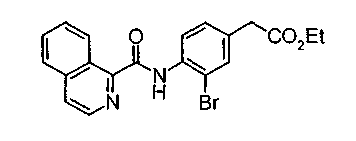
В ДМФ (15 мл) растворяют 1-изохинолинкарбоновую кислоту (1,00 г, 5,77 ммоль), этил-4-амино-3-бромфенилацетат (1,49 г, 5,77 ммоль), HOBt (0,39 г, 2,89 ммоль) и DMAP (0,14 г, 1,15 ммоль). К образовавшемуся раствору добавляют EDC·HCl (1,33 мг, 6,93 ммоль). После перемешивания при 60°С в течение 5 часов реакционную смесь охлаждают до комнатной температуры. Добавляют воду с последующей экстракцией этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси н-гексан-этилацетат (4:1, об./об.) этил-(3-бром-4-((1-изохинолинилкарбонил)амино) фенил)ацетат (1,64 г, 69%) получают в виде желтого твердого вещества.
1H-ЯМР (CDCl3) δ: 1,28 (т, J=7,l Гц, 3H), 3,60 (с, 2H), 4,17 (кв., J=7,1 Гц, 2H), 7,32 (дд, J=8,5,2,0 Гц, 1H), 7,57 (д, J=2,0 Гц, 1H), 7,71-7,78 (м, 2H), 7,88-7,91 (м, 2H), 8,59 (д, J=5,6 Гц, 1H), 8,63 (д, J=8,5 Гц, 1H), 9,71 (м, 1H), 11,01 (ушир.с, 1H).
МС (ESI) m/z 413 (M++1), 415 (M++3).
(Стадия 2) Синтез (3-бром-4-((1-изохинолинилкарбонил)амино)фенил)уксусной кислоты

Этил-(3-бром-4-((1-изохинолинилкарбонил)амино)фенил)ацетат (1,64 г, 3,97 ммоль) растворяют в ТГФ (40 мл). К образовавшемуся раствору добавляют 0,25 н. NaOH (24,0 мл, 5,95 ммоль) и смесь перемешивают при комнатной температуре в течение 8 часов. Реакционную смесь выливают в 1 н. HCl (50 мл) для подкисления смеси. Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при пониженном давлении, получая при этом (3-бром-4-((1-изохинолинилкарбонил)амино)фенил)уксусную кислоту (1,50 г, 98%) в виде светло-желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 3,63 (с, 2H), 7,36 (д, J=8,5 Гц, 1H), 7,66 (с, 1H), 7,81 (м, 1H), 7,88 (м, 1H), 8,12 (д, J=8,3 Гц, 1Н), 8,17 (д, J=5,4 Гц, 1H), 8,21 (д, J=8,5 Гц, 1H), 8,66 (д, J=5,4 Гц, 1H), 9,36 (д, J=8,5 Гц, 1H), 10,84 (с, 1H). МС (ESI) m/z 385 (M++1), 387 (M++3).
(Стадия 3) Синтез метил-транс-4-(1-((3-бром-4-((1-изохинолинилкарбонил)амино)фенил)ацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилата
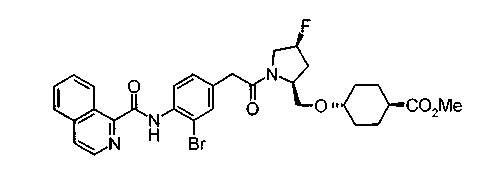
В ДМФ (5,0) растворяют (3-бром-4-((1-изохинолинилкарбонил)амино)фенил)уксусную кислоту (350 мг, 0,91 ммоль), метил-транс-4-((4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилат (соединение, синтезированное в стадии (3) примера 21) (236 мг, 0,91 ммоль), HOBt (25,0 мг, 0,18 ммоль) и DMAP (22,0 мг, 0,18 ммоль). К образовавшемуся раствору добавляют EDC·HCl (226 мг, 1,18 ммоль) и смесь перемешивают при комнатной температуре в течение 22 часов. К реакционной смеси добавляют воду с последующей экстракцией этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из этилацетатных элюатных фракций метил-транс-4-(1-((3-бром-4-((1-изохинолинилкарбонил)амино)фенил)ацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилат (575 мг, 100%) получают в виде желтого твердого вещества.
1H-ЯМР (CDCl3) δ: 1,19-1,34 (м, 2H), 1,41-1,53 (м, 2H), 1,97-2,52 (м, 7H), 3,27 (м, 1H), 3,35 и 3,51 (каждый м, общий 1H), 3,60-4,03 (м, 8H), 4,22 и 4,39 (каждый м, общий 1H), 5,25 (м, 1H), 7,29 (м, 1H), 7,57 (м, 1H), 7,71-7,78 (м, 2H), 7,88-7,91 (м, 2H), 8,59-8,64 (м, 2H), 9,71 (м, 1H), 11,00 (м, 1H).
МС (ESI) m/z 626 (M++1), 628 (M++3).
(Стадия 4) Синтез транс-4-(1-((3-бром-4-((1-изохинолинилкарбонил)амино)фенил)ацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоновой кислоты
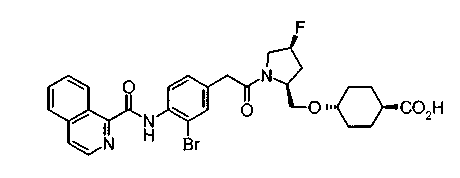
Метил-транс-4-(1-((3-бром-4-((1-изохинолинилкарбонил)амино)фенил)ацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилат (575 мг, 0,92 ммоль) растворяют в ТГФ (10 мл) с последующим добавлением 0,25 н. NaOH (5,50 мл, 1,36 ммоль). Образовавшуюся смесь перемешивают при комнатной температуре в течение 24 часов. Реакционную смесь выливают в 1 н. HCl (5,0 мл) для подкисления смеси. Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при пониженном давлении, получая при этом указанное в заголовке соединение (529 мг, 94%) в виде желтого твердого вещества.
ИК (ATR) ν 2938, 2857, 1720, 1687, 1596, 1513, 1450 см-1;
1H-ЯМР (ДМСО-d6) δ: 1,14-1,42 (м, 4H), 1,86-2,27 (м, 7H), 3,17-3,92 (м, 7H), 4,15 и 4,34 (каждый м, общий 1H), 5,31 и 5,38 (каждый м, общий 1H), 7,32 (м, 1H), 7,58 и 7,60 (каждый д, J=1,2 Гц, общий 1H), 7,80 (тд, J=8,5, 1,2 Гц, 1H), 7,87 (тд, J=8,5,1,2 Гц, 1H), 8,10 (д, J=8,3 Гц, 1H), 8,15 (д, J=5,6 Гц, 1H), 8,23 и 8,24 (каждый д, J=8,3 Гц, 1H), 8,65 (д, J=5,6 Гц, 1H), 9,39 (д, J=8,5 Гц, 1H), 10,84 (с, 1H), 12,00 (с, 1H).
МС (ESI) m/z 612 (M++1), 614 (M++3);
Анал. Вычисл. для C30H31BrFN3О5:C, 58,83; H, 5,10; N, 6,86,
Найдено: C, 58,85; H, 5,27; N, 6,45.
Пример 80
транс-4-(1-((3-Хлор-4-((1-изохинолинилкарбонил)амино)фенил)ацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоновая кислота:
(Стадия 1) Синтез метил-(3-хлор-4-((1-изохинолинилкарбонил)амино)фенил)ацетата

В ДМФ (15 мл) растворяют 1-изохинолинкарбоновую кислоту (1,00 г, 5,77 ммоль), метил-3-хлорфенилацетат (1,23 г, 6,16 ммоль), HOBt (0,16 г, 1,15 ммоль) и DMAP (0,14 г, 1,15 ммоль). К образовавшемуся раствору добавляют EDC·HCl (1,33 мг, 6,93 ммоль) с последующим перемешиванием при комнатной температуре в течение 14 часов. Реакционную смесь выливают в воду (40 мл). Осажденные кристаллы собирают фильтрованием при пониженном давлении, промывают водой и эфиром, сушат при пониженном давлении, получая при этом метил-(3-хлор-4-((1-изохинолинилкарбонил)амино)фенил)ацетат (1,14 г, 56%) в виде коричневого твердого вещества.
1H-ЯМР (CDCl3) δ: 3,62 (с, 2H), 3,72 (с, 3H), 7,29 (м, 1H), 7,40 (д, J=1,9 Гц, 1H), 7,71-7,78 (м, 2H), 7,88-7,91 (м, 2H), 8,58 (д, J=5,4 Гц, 1H), 8,65 (д, J=8,3 Гц, 1H), 9,71 (м, 1H), 11,02 (м, 1H).
МС (ESI) m/z 355 (M++1).
(Стадия 2) Синтез (3-хлор-4-((1-изохинолинилкарбонил)амино)фенил)уксусной кислоты
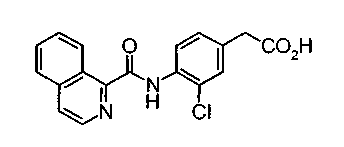
Метил-(3-хлор-4-((1-изохинолинилкарбонил)амино)фенил)ацетат (1,14 г, 3,21 ммоль) растворяют в ТГФ (33 мл). К образовавшемуся раствору добавляют 0,25 н. NaOH (19,3 мл, 4,82 ммоль) и смесь перемешивают при комнатной температуре в течение 14 часов. Реакционную смесь выливают в 1 н. HCl (5,0 мл). Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при пониженном давлении, получая при этом (3-хлор-4-((1-изохинолинилкарбонил)амино)фенил)уксусную кислоту (1,07 г, 98%) коричневого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 3,63 (с, 2H), 7,33 (дд, J=8,3, 1,7 Гц, 1H), 7,51 (д, J=1,7 Гц, 1H), 7,81 (тд, J=8,3,1,7 Гц, 1H), 7,88 (тд, J=8,3,l-7 Гц, 1H), 8,12 (д, J=8,1 Гц, 1H), 8,16 (д, J=5,6 Гц, 1H), 8,24 (д, J=8,3 Гц, 1H), 8,67 (д, J=5,6 Гц, 1H), 9,34 (д, J=8,3 Гц, 1H), 10,85 (с, 1H), 12,48 (ушир.с, 1H).
МС (ESI) m/z 341 (M++1).
(Стадия 3) Синтез метил-транс-4-(1-((3-хлор-4-((1-изохинолинилкарбонил)амино)фенил)ацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилата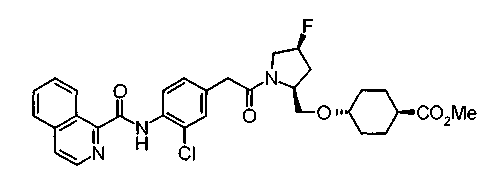
В ДМФ (7,5 мл) растворяют (3-хлор-4-((1-изохинолинилкарбонил)амино)фенил)уксусную кислоту (250 мг, 0,73 ммоль), метил-транс-4-((4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилат (соединение, синтезированное в стадии (3) примера 21) (190 мг, 0,73 ммоль), HOBt (20,0 мг, 0,15 ммоль) и DMAP (18,0 мг, 0,15 ммоль). К образовавшемуся раствору добавляют EDC·HCl (211 мг, 1,10 ммоль) с последующим перемешиванием при комнатной температуре в течение 19 часов. К реакционной смеси добавляют воду с последующей экстракцией этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из этилацетатных элюатных фракций метил-транс-4-(1-((3-хлор-4-((1-изохинолинилкарбонил)амино)фенил)ацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилат (399 мг, 94%) получают в виде желтого аморфного вещества.
1H-ЯМР (CDCl3) 5 1,21-1,30 (м, 2H), 1,44-1,50 (м, 2H), 1,98-2,48 (м, 7H), 3,27 (м, 1H), 3,35 и 3,52 (каждый м, общий 1H), 3,60-3,93 (м, 8H, включая каждый синглет, общий 3H, при δ: 3,65 и 3,67), 4,23 и 4,39 (каждый м, общий 1H), 5,26 (м, 1H), 7,24 (м, 1H), 7,40 (м, 1H), 7,71-7,78 (м, 2H), 7,88-7,91 (м, 2H), 8,59 (д, J=5,4 Гц, 1H), 8,64 (м, 1H), 9,71 (м, 1H), 11,02 (м, 1H).
МС (ESI) m/z 582 (M++1).
(Стадия 4) Синтез транс-4-(1-((3-хлор-4-((1-изохинолинилкарбонил)амино)фенил)ацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоновой кислоты
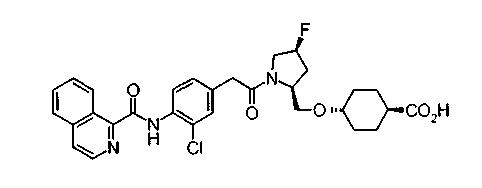
Метил-транс-4-(1-((3-хлор-4-((1-изохинолинилкарбонил)амино)фенил)ацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилат (399 мг, 0,69 ммоль) растворяют в ТГФ (7,0 мл). К образовавшемуся раствору добавляют 0,25 н. NaOH (4,11 мл, 1,03 ммоль) с последующим перемешиванием при комнатной температуре в течение 18 часов. Реакционную смесь выливают в 1 н. HCl (1,1 мл). Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при пониженном давлении, получая при этом указанное в заголовке соединение (347 мг, 89%) в виде желтого твердого вещества.
ИК (ATR) ν 2935, 2861, 1716, 1596, 1527, 1442 см-1;
1H-ЯМР (ДМСО-d6) δ: 1,13-1,41 (м, 4H), 1,85-2,25 (м, 7H), 3,17-3,89 (м, 7H), 4,14 и 4,34 (каждый м, общий 1H), 5,32 и 5,39 (каждый м, общий 1H), 7,28 (м, 1H), 7,44 и 7,45 (м, общий 1H), 7,81 (т, J=7,1 Гц, 1H), 7,88 (т, J=7,1 Гц, 1H), 8,12 (д, J=8,1 Гц, 1H), 8,16 (д, J=5,6 Гц, 1H), 8,22 (м, 1H), 8,67 (д, J=5,6 Гц, 1H), 9,31 (д, J=8,5 Гц, 1H), 10,84 (с, 1H), 12,02 (ушир.с, 1H).
МС (ESI) m/z 568 (M++1);
Анал. Вычисл. для C30H31ClFN3О5: С, 63,43; H, 5,50; N, 7,40,
Найдено: С, 63,40; H, 5,62; N, 7,40.
Пример 81
транс-4-(1-((5-Хлор-2-фтор-4-((1-изохинолинилкарбонил)амино)фенил)ацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоновая кислота:
(Стадия 1) Синтез этил-(5-хлор-2-фтор-4-((1-изохинолинилкарбонил)амино)фенил)ацетата
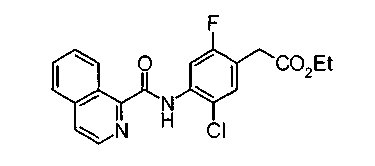
В метиленхлориде (15 мл) хлорангидрид дифенилфосфиновой кислоты (0,99 мл, 5,19 ммоль) добавляют к 1-изохинолинкарбоновой кислоте (375 мг, 2,17 ммоль), этил-4-амино-3-хлорфенилацетату (501 мг, 2,17 ммоль) и триэтиламину (1,32 мл, 9,53 ммоль) с последующим перемешиванием при комнатной температуре в течение 24 часов. К реакционной смеси добавляют воду для отделения от нее органического слоя. Слой метиленхлорида промывают водой, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси н-гексан-этилацетат (3:1, об./об.) этил-(5-хлор-2-фтор-4-((1-изохинолинилкарбонил)амино)фенил)ацетат (690 мг, 82%) получают в виде желтого твердого вещества.
1H-ЯМР (CDCl3) δ: 1,28 (т, J=7,1 Гц, 3H), 3,64 (с, 2H), 4,19 (кв., J=7,1 Гц, 2H), 7,36 (д, J=7,2 Гц, 1H), 7,72-7,78 (м, 2H), 7,88-7,91 (м, 2H), 8,57- 8,60 (м, 2H), 9,68 (м, 1H), 11,11 (ушир.с, 1H).
МС (ESI) m/z 387 (M++1).
(Стадия 2) Синтез (5-хлор-2-фтор-4-((1-изохинолинилкарбонил)амино)фенил)уксусной кислоты
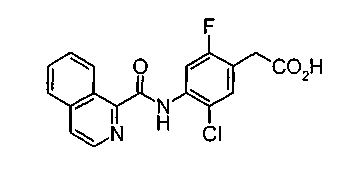
Этил-(5-хлор-2-фтор-4-((1-изохинолинилкарбонил)амино)фенил)ацетат (690 мг, 1,78 ммоль) растворяют в ТГФ (18 мл). К образовавшемуся раствору добавляют 0,25 н. NaOH (10,7 мл, 2,68 ммоль) и образовавшуюся смесь перемешивают при комнатной температуре в течение 7 часов. Реакционную смесь выливают в 1 н. HCl (3,0 мл). Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при пониженном давлении, получая при этом (5-хлор-2-фтор-4-((1-изохинолинилкарбонил)амино)фенил)уксусную кислоту (583 мг, 91%) в виде светло-желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 3,66 (с, 2H), 7,62 (д, J=7,5 Гц, 1H), 7,82 (м, 1H), 7,88 (м, 1H), 8,12 (д, J=8,5 Гц, 1H), 8,18 (д, J=5,6 Гц, 1H), 8,23 (д, J=11,5 Гц, 1H), 8,67 (д, J=5,6 Гц, 1H), 9,38 (д, J=8,5 Гц, 1H), 10,98 (ушир.с, 1H), 12,59 (ушир.с, 1H).
МС (ESI) m/z 359 (M++1).
(Стадия 3) Синтез метил-транс-4-(1-((5-хлор-2-фтор-4-((1-изохинолинилкарбонил)амино)фенил)ацетил)-(4S)-фтор-(2S)- пирролидинилметокси)циклогексанкарбоксилат
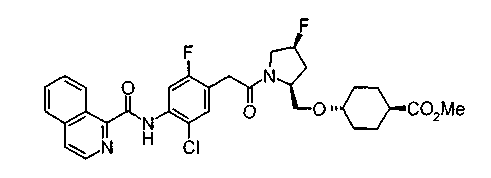
В ДМФ (5,5 мл) растворяют (5-хлор-2-фтор-4-((1-изохинолинилкарбонил)амино)фенил)уксусную кислоту (200 мг, 0,56 ммоль) метил-транс-4-((4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилат (соединение, синтезированное в стадии (3) примера 21) (145 мг, 0,56 ммоль), HOBt (15,0 мг, 0,11 ммоль) и DMAP (14,0 мг, 0,11 ммоль). К образовавшемуся раствору добавляют EDC·HCl (160 мг, 0,84 ммоль) с последующим перемешиванием при комнатной температуре в течение 21 часа. К реакционной смеси добавляют воду с последующей экстракцией этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из этилацетатных элюатных фракций метил-транс-4-(1-((5-хлор-2-фтор-4-((1-изохинолинилкарбонил)амино)фенил)ацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилат (341 мг, 100%) получают в виде желтого аморфного вещества.
1H-ЯМР (CDCl3) δ: 1,18-1,33 (м, 2H), 1,40-1,54 (м, 2H), 1,97-2,54 (м, 7H), 3,28 (м, 1H), 3,36 и 3,53 (каждый м, общий 1H), 3,64 и 3,66 (каждый с, общий 3H), 3,66-4,03 (м, 5H), 4,31 и 4,37 (каждый м, общий 1H), 5,27 и 5,29 (каждый м, общий 1H), 7,41 и 7,43 (каждый д, J=7,3 Гц, общий 1H), 7,72-7,78 (м, 2H), 7,88-7,91 (м, 2H), 8,54 и 8,58 (каждый д, J=9,7 Гц, общий 1H), 8,56 (д, J=5,6 Гц, 1H), 9,68 (м, 1H), 11,09 (д, J=8,1 Гц, 1H).
МС (ESI) m/z 600 (M++1).
(Стадия 4) Синтез транс-4-(1-((5-хлор-2-фтор-4-((1-изохинолинилкарбонил)амино)фенил)ацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоновой кислоты
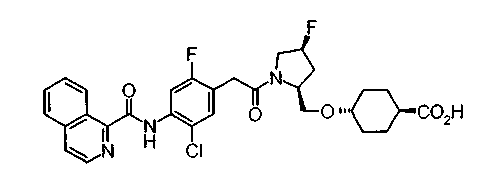
К метил-транс-4-(1-((5-хлор-2-фтор-4-((1-изохинолинилкарбонил)амино)фенил)ацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилату (341 мг, 0,57 ммоль) добавляют ТГФ (5,8 мл), затем добавляют 0,25 н. NaOH (3,40 мл, 0,85 ммоль) с последующим перемешиванием при комнатной температуре в течение 14 часов. Реакционную смесь выливают в 1 н. HCl (1,0 мл). Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при пониженном давлении, получая при этом указанное в заголовке соединение (291 мг, 87%) в виде желтого твердого вещества.
ИК (ATR) ν 3282, 2940, 2863, 1722, 1693, 1650, 1619, 1581, 1517 см-1;
1H-ЯМР (ДМСО-d6) δ: 1,15-1,41 (м, 4H), 1,86-2,33 (м, 7H), 3,17-4,00 (м, 7H), 4,13 и 4,36 (каждый м, общий 1H), 5,32 и 5,41 (каждый м, общий 1H), 7,49 и 7,53 (каждый д, J=7,3 Гц, общий 1H), 7,82 (т, J=7,3 Гц, 1H), 7,88 (т, J=7,3 Гц, 1H), 8,12 (д, J=8,1 Гц, 1H), 8,18-8,23 (м, 2H), 8,67 (д, J=5,6 Гц, 1H), 9,38 (д, J=8,8 Гц, 1H), 10,95 (м, 1H), 12,02 (ушир.с, 1H).
МС (ESI) m/z 586 (M++1);
Анал. Вычисл. для С30Н30ClF2N3O5·0,25H2О: C, 61,02; H, 5,21; N, 7,12.
Найдено: C, 61,01; H, 5,17; N, 7,00.
Пример 82
транс-4-(1-((3-Хлор-4-((7-фтор-1-изохинолинилкарбонил)амино)фенил)ацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоновая кислота:
(Стадия 1) Синтез метил-(3-хлор-4-((7-фтор-1-изохинолинилкарбонил)амино)фенил)ацетата
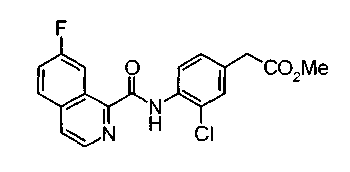
В ДМФ (5 мл) растворяют 7-фтор-1-изохинолинкарбоновую кислоту (250 мг, 1,31 ммоль), метил-4-амино-3-хлорфенилацетат (262 мг, 1,31 ммоль), HOBt (каталитическое количество) и DMAP (192 мг, 1,57 ммоль). К образовавшемуся раствору добавляют EDC·HCl (290 мг, 6,93 ммоль) с последующим перемешиванием при комнатной температуре в течение 14 часов. Реакционную смесь выливают в воду (20 мл). Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении, промывают эфиром и затем сушат при пониженном давлении, получая при этом метил-(3-хлор-4-((7-фтор-1-изохинолинилкарбонил)амино)фенил)ацетат (250 мг, 51%) в виде бесцветного кристаллического порошка.
1H-ЯМР (CDCl3) δ: 3,62 (с, 2H), 3,72 (с, 3Н), 7,25 9,45 (ряд м, 9H).
МС (ESI) m/z 323 (M++1).
(Стадия 2) Синтез (3-хлор-4-((7-фтор-1-изохинолинилкарбонил)амино)фенил)уксусной кислоты
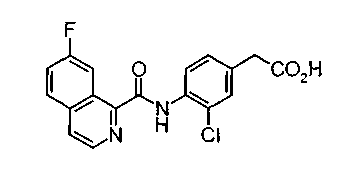
В ТГФ (5 мл) 0,25 н. NaOH (4 мл, 4,82 ммоль) добавляют к метил-(3-хлор-4-((7-фтор-1-изохинолинилкарбонил)амино)фенил)ацетату (100 мг, 0,27 ммоль) и образовавшуюся смесь перемешивают при комнатной температуре в течение 18 часов. Реакционную смесь выливают в 1 н. HCl (2,0 мл). Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при пониженном давлении, получая при этом (3-хлор-4-((7-фтор-1-изохинолинилкарбонил)амино)фенил)уксусную кислоту (75 мг, 78%) в виде бесцветного твердого вещества.
МС (ESI) m/z 359 (M++1).
(Стадия 3) Синтез метил-транс-4-(1-((3-хлор-4-((7-фтор-1-изохинолинилкарбонил)амино)фенил)ацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилата
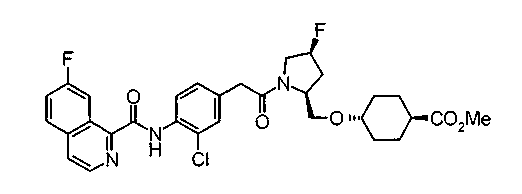
В ДМФ (5 мл) суспендируют (3-хлор-4-((7-фтор-1-изохинолинилкарбонил)амино)фенил)уксусную кислоту (57 мг, 0,159 ммоль), метил-транс-4-((4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилат (соединение, синтезированное в стадии (3) примера 21) (42 мг, 0,159 ммоль), HOBt (каталитическое количество) и DMAP (24 мг, 0,191 ммоль). К образовавшейся суспензии добавляют EDC·HCl (37 мг, 0,191 ммоль) с последующим перемешиванием при комнатной температуре в течение 20 часов. Реакционную смесь выливают в воду с последующей экстракцией этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из этилацетатных элюатных фракций метил-транс-4-(1-((3-хлор-4-((7-фтор-1-изохинолинилкарбонил)амино)фенил)ацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилат (105 мг, 100%) получают в виде бесцветного аморфного вещества.
1H-ЯМР (CDCl3) 5 1,21-1,31 (м, 2H), 1,44-1,51 (м, 2H), 1,98-2,49 (м, 7H), 3,27 (м, 1H), 3,35 и 3,52 (каждый м, общий 1H), 3,60-3,93 (м, 8H), 4,23 и 4,39 (каждый м, общий 1H), 5,26 (м, 1H), 7,26 (м, 1H), 7,41 (м, 1H), 7,56 (м, 1H), 7,90 и 7,92 (каждый м, 2H), 8,59 и 8,63 (каждый м, 2H), 9,46 (м, 1H), 11,01 (ушир.д, 1H).
МС (ESI) m/z 560 (M++1).
(Стадия 4) Синтез транс-4-(1-((3-хлор-4-((7-фтор-1-изохинолинилкарбонил)амино)фенил)ацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоновой кислоты

В ТГФ (5 мл) 0,25 н. NaOH (1,9 мл) добавляют к метил-транс-4-(1-((3-хлор-4-((7-фтор-1-изохинолинилкарбонил)амино)фенил)ацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилату (95 мг, 0,15 ммоль) с последующим перемешиванием при комнатной температуре в течение 18 часов. Реакционную смесь выливают в 1 н. HCl (2 мл). Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при пониженном давлении, получая при этом указанное в заголовке соединение (65 мг, 71%) в виде бесцветного кристаллического порошка.
1H-ЯМР (CDCl3) δ: 1,13-1,40 (м, 4H), 1,80-2,30 (м, 7H), 3,15-3,90 (м, 7H), 4,10 и 4,35 (каждый м, общий 1H), 5,30 и 5,40 (каждый м, общий 1H), 7,25 (м, 1H), 7,41 (м, 1H), 7,54 (м, 1H), 7,89 (м, 1H), 7,92 (м, 1H), 8,59 (м, 1H), 8,62 (м, 1H), 9,45 (м, 1H), 11,01 (ушир.д, 1H).
МС (ESI) m/z 586 (M++1).
Пример 83
транс-4-(1-(3-Хлор-4-((3-бензо(d)изотиазолилкарбонил)амино)фенилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоновая кислота:
(Стадия 1) Синтез 3-хлор-4-((3-бензо(d)изотиазолилкарбонил)амино)фенилуксусной кислоты
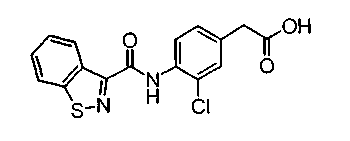
Метил-4-амино-3-хлорфенилацетат (50 мг, 0,25 ммоль), 3-бензо(d)изотиазол-3-карбоновую кислоту (45 мг, 0,25 ммоль), HOBt (64 мг, 0,475 ммоль), EDC (72 мг, 0,38 ммоль) и DMAP (каталитическое количество) растворяют в ДМФ (2 мл). Образовавшийся раствор перемешивают в течение 8 часов. Реакционную смесь выливают в 1 М HCl с последующей экстракцией этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом магния и перегоняют при пониженном давлении для удаления растворителя. К остатку добавляют смесь ТГФ/метанол (4 мл, 3:1) и 1 М NaOH (1 мл) и образовавшуюся смесь перемешивают в течение 18 часов при комнатной температуре. Реакционную смесь перегоняют при пониженном давлении для удаления растворителя. Остаток подкисляют 1 М HCl. Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при пониженном давлении, получая при этом 3-хлор-4-((3-бензо(d)изотиазолилкарбонил)амино)фенилуксусную кислоту (80 мг, 92%) в виде бесцветного твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 3,62 (с, 2H), 7,30 (д, J=8,1 Гц, 1H), 7,50 (с, 1H), 7,64 (д, J=8,1 Гц, 1H), 7,70 (д, J=8,1 Гц, 1H), 7,95 (д, J=8,3 Гц, 1H), 8,36 (д, J=8,1 Гц, 1H), 8,80 (д, J=8,1 Гц, 1H), 10,27 (с, 1H).
МС (ESI) m/z 347 (M+1)+.
(Стадия 2) Синтез транс-4-(1-(3-хлор-4-((3-бензо(d)изотиазолилкарбонил)амино)фенилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоновой кислоты
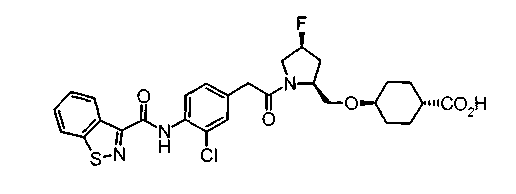
В ДМФ (1,2 мл) растворяют 3-хлор-4-((3-бензо(d)изотиазолилкарбонил)амино)фенилуксусную кислоту (80 мг, 0,23 ммоль), метил-транс-4-((4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилат (соединение, синтезированное в стадии (3) примера 21) (60 мг, 0,23 ммоль), HOBt (59 мг, 0,44 ммоль), DMAP (каталитическое количество) и EDC·HCl (66 мг, 0,35 ммоль). Образовавшийся раствор перемешивают при комнатной температуре в течение 18 часов. Реакционную смесь выливают в 1 М HCl с последующей экстракцией этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом магния и перегоняют при пониженном давлении для удаления растворителя. К остатку добавляют ТГФ (2,1 мл) и 0,25 М NaOH (1,26 мл, 0,32 ммоль) и смесь перемешивают при комнатной температуре в течение 18 часов. Реакционную смесь выливают в ледяную воду подкисляют 1 М HCl. Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при пониженном давлении. Таким образом полученные сырые кристаллы перекристаллизовывают из смеси хлороформ/н-гексан, получая при этом указанное в заголовке соединение (85 мг, 64%) в виде бесцветного твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 1,10-1,40 (м, 6H), 1,82-2,20 (м, 6H), 3,20 (м, 1H), 3,50-4,40 (м, 6H), 5,36 (м, 1H), 7,26 (т, J=7,7 Гц, 1H), 7,64 (т, J=7,4 Гц, 1H), 7,71 (т, J=7,4 Гц, 1H), 7,94 (дд, J=4,9,8,3 Гц, 1H), 8,36 (д, J=8,3 Гц, 1H), 8,80 (д, J=8,3 Гц, 1H), 10,27 (с, 1H).
МС (ESI) m/z 575 (M+1)+.
Анал. Вычисл. для С28Н29ClFN3O5S: C, 58,58; H, 5,13; N, 7,02.
Найдено: C, 58,58; H, 5,13; N, 7,02.
Пример 84
транс-4-(1-(5-Хлор-2-фтор-4-((4-фтор-3-бензо(d)изотиазолилкарбонил)амино)фенилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоновая кислота:
(Стадия 1) Синтез 4-фторбензо(d)изотиазол-3-карбоновой кислоты
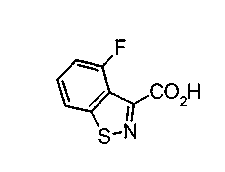
3-Фторбензолтиол (5,0 г, 39,0 ммоль) растворяют в метиленхлориде (200 мл) и к раствору при перемешивании при 0°С добавляют оксалилхлорид (3,57 мл, 41,0 ммоль) и триэтиламин (5,71 мл, 41,0 ммоль). Реакционную смесь перемешивают 24 часа при комнатной температуре. Реакционную смесь перегоняют при пониженном давлении для удаления растворителя. Остаток суспендируют в метиленхлориде (100 мл). После добавления к реакционной смеси при охлаждении при 0°С хлорида алюминия (7,8 г, 58,5 ммоль) реакционную смесь перемешивают при комнатной температуре в течение 4 часов. Реакционную смесь выливают в ледяную воду с последующей экстракцией хлороформом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом магния и перегоняют при пониженном давлении для удаления растворителя. К остатку добавляют концентрированный водный аммиак (28%, 50 мл) и пероксид водорода (35% в воде, 50 мл) и смесь перемешивают при комнатной температуре в течение 24 часов. Таким образом осажденные кристаллы собирают фильтрованием и к кристаллам добавляют ТГФ (100 мл) и 0,25 М NaOH (60 мл, 15 ммоль). Образовавшуюся смесь нагревают при кипячении с обратным холодильником в течение 24 часов. Реакционную смесь охлаждают до комнатной температуры и выливают в 1 М HCl. Смесь концентрируют досуха при пониженном давлении. Остаток очищают хроматографией на колонке с силикагелем (хроматографическая система Yamazen со средним давлением, колонка С-18, линейный градиент Н2О (0,1% НСООН) и метанола (0,1% НСООН) от 10% до 90%, 10 мл/мин), получая при этом 4-фторбензо(d)изотиазол-3-карбоновую кислоту (590 мг, 8%) в виде бесцветного твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 7,51 (дт, J=2,5, 9,1 Гц, 1H), 8,19 (дд, J=2,5, 8,8 Гц, 1H), 8,66 (дд, J=5,1, 9,1 Гц, 1H).
МС (ESI) m/z 198 (M+1)+.
(Стадия 2) Синтез (5-хлор-2-фтор-4-((4-фтор-3-бензо(d)изотиазолилкарбонил)амино)фенил)уксусной кислоты
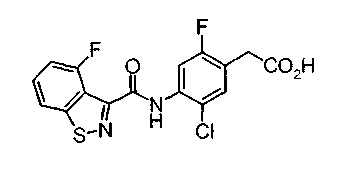
В ДМФ (10 мл) растворяют 4-фторбензо(d)изотиазол-3-карбоновую кислоту (240 мг, 1,22 ммоль), этил-4-амино-5-хлор-2-фторфенилацетат (282 мг, 1,22 ммоль), HOBt (313 мг, 2,32 ммоль), EDC·HCl (351 мг, 1,83 ммоль) и DMAP (каталитическое количество). Образовавшийся раствор перемешивают в течение 4 дней при комнатной температуре. Реакционную смесь выливают в 1 М HCl с последующей экстракцией этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом магния и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают колоночной хроматографией на силикагеле (хроматографическая система от Yamazen со средним давлением, хлороформ, 8 мл/мин, (15 мм×300 мм). К образовавшемуся сложному эфиру добавляют ТГФ (12 мл) и 0,25 NaOH (7,32 мл, 1,83 ммоль) с последующим перемешиванием при комнатной температуре в течение 4 часов. Реакционную смесь выливают в 1 М HCl для подкисления смеси. Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при пониженном давлении, получая при этом (5-хлор-2-фтор-4-((4-фтор-3-бензо(d)изотиазолилкарбонил)амино)фенил)уксусную кислоту (105 мг, 22%) в виде бесцветного твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 1,28 (т, J=7,2 Гц, 3H), 3,64 (с, 2H), 4,19 (кв., J=7,2 Гц, 2H), 7,34 (дт, J=2,2,9,1 Гц, 1H), 7,37 (д, J=7,1 Гц, 1H), 7,64 (дд, J=2,2, 8,3 Гц, 1H), 8,48 (д, J=11,5 Гц, 1H), 9,00 (дд, J=5,1, 9,0 Гц, 1H), 9,92 (с, 1Н).
(Стадия 3) Синтез транс-4-(1-(5-хлор-2-фтор-4-((4-фтор-3-бензо(d)изотиазолилкарбонил)амино)фенилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоновой кислоты
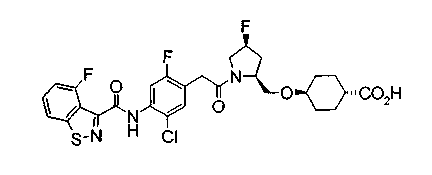
В ДМФ (3 мл) растворяют (5-хлор-2-фтор-4-((4-фтор-3-бензо(d)изотиазолилкарбонил)амино)фенил)уксусную кислоту (105 мг, 0,27 ммоль), метил-транс-4-((4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилат (соединение, синтезированное в стадии (3) примера 21) (71 мг, 0,27 ммоль), HOBt (70 мг, 0,52 ммоль), DMAP (каталитическое количество) и соль EDC·HCl (79 мг, 0,41 ммоль). Образовавшийся раствор перемешивают при комнатной температуре в течение 18 часов. Реакционную смесь выливают в 1 М HCl с последующей экстракцией этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом магния и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают колоночной хроматографией на силикагеле, посредством чего получают сырой сложный эфир. К сырому эфиру добавляют ТГФ (3,0 мл) и 0,25 М NaOH (1,6 мл, 0,4 ммоль) и смесь перемешивают при комнатной температуре в течение 18 часов. Реакционную смесь выливают в 1 М HCl. Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении. Сырые кристаллы очищают хроматографией на колонке С-18 (хроматография со средним давлением, линейный градиент смеси вода/метанол, 10%-90%), получая при этом указанное в заголовке соединение(69 мг, 41%) в виде бесцветного твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 1,20 (м, 4H), 1,95 (м, 4H), 2,05 (м, 2H), 3,50-4,00 (м, 6H), 4,05 и 4,20 (2 м, общий 1H), 5,40 (м, 1H), 7,53 (м, 3H), 7,93 (м, 1H), 8,25 (дд, J=2,2, 8,6 Гц, 1H), 8,81 (дд, J=5,6, 9,2 Гц, 1H), 10,30 (м, 1H).
МС (ESI) m/z 611 (M+1)+.
Анал. Вычисл. для С28Н27ClF3N3O5·1,0 H2О: C, 53,55; H, 4,65; N, 6,69.
Найдено: C, 53,3; H, 4,35; N, 6,68.
Пример 85
транс-4-(1-(5-хлор-2-фтор-4-((3-бензо(d)изотиазолилкарбонил)амино)фенил)ацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоновая кислота:
Стадия 1) Синтез (5-хлор-2-фтор-4-((3-бензо(d)изотиазолилкарбонил)амино)фенил)уксусной кислоты
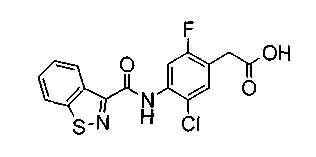
Метил-4-амино-5-хлор-2-фторфенилацетат (753 мг, 3,25 ммоль), бензо(d)изотиазол-3-карбоновую кислоту (583 мг, 3,25 ммоль), HOBt (834 мг, 6,18 ммоль), EDC·HCl (934 мг, 4,88 ммоль) и DMAP (каталитическое количество) растворяют в ДМФ (16 мл). Образовавшийся раствор перемешивают в течение 10 часов при 80°С. После охлаждения реакционную смесь выливают в 1 М HCl с последующей экстракцией этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом магния и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают колоночной хроматографией на силикагеле (среднее давление, н-гексан/этилацетат, 9:1, 15 мл/мин, (50×300 мм), получая при этом этил-(5-хлор-2-фтор-4-((3-бензо(d)изотиазолилкарбонил)амино)фенил)ацетат. Образовавшийся сложный эфир растворяют в смеси ТГФ/метанол (4 мл, 3:1) и к образовавшемуся раствору добавляют 1 М NaOH (1 мл). Смесь перемешивают в течение 18 часов при комнатной температуре. Растворитель отгоняют при пониженном давлении и остаток выливают в 1 М HCl. Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при пониженном давлении, получая при этом (5-хлор-2-фтор-4-((3-бензо(d)изотиазолилкарбонил)амино)фенил)уксусную кислоту (354 мг, 30%) в виде бесцветного твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 3,68 (с, 2H), 7,65 (д, J=7,3 Гц, 1H), 7,66 (т, J=7,5 Гц, 1H), 7,73 (т, J=7,5 Гц, 1H), 7,99 (д, J=11,2 Гц, 1H), 8,38 (д, J=8,3 Гц, 1H), 8,81 (д, J=7,8 Гц, 1H), 10,30 (с, 1H).
МС (ESI) m/z 365 (M+1)+.
(Стадия 2) Синтез транс-4-(1-(5-хлор-2-фтор-4-((3-бензо(d)изотиазолилкарбонил)амино)фенил)ацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоновой кислоты

В ДМФ (1,2 мл) растворяют (5-хлор-2-фтор-4-((3-бензо(d)изотиазолилкарбонил)амино)фенил)уксусную кислоту (80 мг, 0,23 ммоль), метил-транс-4-((4S)-фтор-(2S)-пирролидинилметокси) циклогексанкарбоксилат (соединение, синтезированное в стадии (3) примера 21) (60 мг, 0,23 ммоль), HOBt (59 мг, 0,44 ммоль), DMAP (каталитическое количество) и EDC·HCl (66 мг, 0,35 ммоль). Образовавшийся раствор перемешивают при комнатной температуре в течение 18 часов. Реакционную смесь выливают в 1 н. HCl с последующей экстракцией этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом магния и перегоняют при пониженном давлении для удаления растворителя. Остаток растворяют в ТГФ (2,1 мл) и к образовавшемуся раствору добавляют 0,25 М NaOH (1,26 мл, 0,32 ммоль). Смесь перемешивают в течение 18 часов при комнатной температуре. Реакционную смесь выливают в ледяную воду и подкисляют 1 М HCl. Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при пониженном давлении. Таким образом осажденные кристаллы перекристаллизовывают из смеси хлороформ/н-гексан, получая при этом указанное в заголовке соединение (85 мг, 64%) в виде бесцветного твердого вещества.
1H-ЯМР (ДМСО-d6) (1,10-1,40 (м, 6H), 1,82-2,20 (м, 6H), 3,20 (м, 1H), 3,50-4,40 (м, 6H), 5,36 (м, 1H), 7,26 (т, J=7,7 Гц, 1H), 7,64 (т, J=7,4 Гц, 1H), 7,71 (т, J=7,4 Гц, 1H), 7,94 (дд, J=4,9, 8,3 Гц, 1H), 8,36 (д, J=8,3 Гц, 1H), 8,80 (д, J=8,3 Гц, 1H), 10,27 (с, 1H).
МС (ESI) m/z 575 (M+1)+;
Анал. Вычисл. для С28Н29ClFN3O5S: С, 58,58; H, 5,13; N, 7,02.
Найдено: С, 58,58; H, 5,13; N, 7,02.
Пример 86
транс-4-(1-(4-((Бензо(d)изоксазол-3-карбонил)амино)-5-хлор-2-фторфенилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоновая кислота:
(Стадия 1) Синтез этил-(2-нитрофенил)ацетата
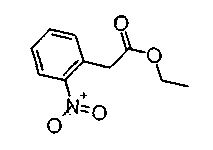
В этаноле (250 мл) растворяют (2-нитрофенил)уксусную кислоту (18,5 г, 0,102 ммоль) и к образовавшемуся раствору добавляют концентрированную H2SO4 (0,1 мл). Смесь нагревают при кипячении с обратным холодильником в течение 24 часов. Реакционную смесь охлаждают до комнатной температуры и затем разбавляют этилацетатом. Разбавленный раствор промывают насыщенным водным раствором бикарбоната натрия и насыщенным раствором соли, сушат над безводным сульфатом магния и перегоняют при пониженном давлении для удаления растворителя, в результате чего этил-(2-нитрофенил)ацетат (17,4 г, 82%) получают в виде бесцветного твердого вещества.
1H-ЯМР (CDCl3) (1,25 (т, J=7,l Гц, 3H), 4,02 (с, 2H), 4,17 (кв., J=7,1 Гц, 2H), 7,35 (д, J=7,6 Гц, 1H), 7,47 (дт, J=1,5, 8,0 Гц, 1H), 7,59 (дт, J=1,5, 7,6 Гц, 1H), 8,10 (дд, J=l,2, 8,1 Гц, 1H).
МС (ESI) m/z 208 (M-1)+.
(Стадия 2) Синтез этилбензо(d)изоксазол-3-карбоксилата
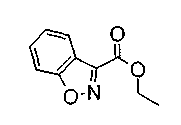
Этил-2-нитрофенилацетат (12,3 г, 58,6 ммоль) и изоамилнитрат (8,92 г, 76,1 ммоль) растворяют в этаноле (100 мл). Добавляют метоксид натрия (19,9 мл, 58,6 ммоль, 20% раствор в этаноле) с последующим перемешиванием при 50°С в течение 1,5 часа. Реакционную смесь охлаждают до комнатной температуры и нейтрализуют 1 М HCl (30 мл) с последующей экстракцией эфиром. Экстракт сушат над безводным сульфатом магния и перегоняют при пониженном давлении для удаления растворителя. Остаток кристаллизуют добавлением смеси хлороформ/н-гексан и кристаллы сушат при пониженном давлении в течение 18 часов. Таким образом полученные кристаллы растворяют в 1,2-диметоксиэтане (100 мл) и к образовавшемуся раствору по частям добавляют раствор гидрида натрия (2,81 г, 70,3 ммоль) в 1,2-диметоксиэтане (100 мл). Реакционную смесь перемешивают при 150°С в течение 8 часов. При охлаждении реакционную смесь наливают к насыщенному водному раствору бикарбоната натрия с последующей экстракцией этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом магния и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают колоночной хроматографией на силикагеле (хроматографическая система Yamazen, н-гексан/этилацетат, 9:1, 20 мл/мин, (80×300), получая при этом этилбензо(d)изоксазол-3-карбоксилат (5,75 г, 51%) в виде коричневого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 1,50 (м, 3H), 4,56 (м, 2H), 7,45 (дт, J=1,2, 6,8 Гц, 1H), 7,62 (дт, J=1,2, 8,5 Гц, 1H), 7,66 (дт, J=1,0, 8,5 Гц, 1H), 8,14 (дд, J=1,0, 8,0 Гц, 1H).
МС (ESI) m/z 192 (M+1)+.
(Стадия 3) Синтез бензо(d)изоксазол-3-карбоновой кислоты
К этилбензо(d)изоксазол-3-карбоксилату (2,0 г, 10,5 ммоль) добавляют 50 мл 70% H2SO4. Смесь нагревают при 80°С в течение 4 часов. Реакционную смесь выливают в лед с последующей экстракцией эфиром. Экстракт сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя, в результате чего бензо(d)изоксазол-3-карбоновую кислоту (980 мг, 57%) получают в виде бесцветного твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 7,53 (дт, J=1,0, 7,1 Гц, 1H), 7,74 (дт, J=1,2, 7,1 Гц, 1H), 7,89 (дд, J=1,0, 8,5 Гц, 1H), 8,10 (дт, J=1,0, 8,1 Гц, 1H).
(Стадия 4) Синтез (4-((бензо(d)изоксазол-3-карбонил)амино)-5-хлор-2-фторфенилуксусной кислоты
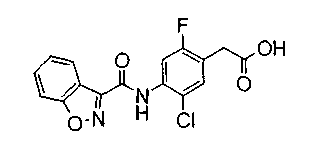
Бензо(d)изоксазол-3-карбоновую кислоту (475 мг, 2,91 ммоль) этил-4-амино-5-хлор-2-фторфенилацетата (675 мг, 2,91 ммоль), HOBt (747 мг, 5,53 ммоль), EDC. HCl (837 мг, 4,37 ммоль) и DMAP (каталитическое количество) растворяют в ДМФ (15 мл). Образовавшийся раствор перемешивают в течение 24 часов при комнатной температуре. Реакционную смесь выливают в 1 М HCl с последующей экстракцией этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом магния и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем (хроматографическая система от Yamazen при среднем давлении, хлороформ, 8 мл/мин, (15 мм×300 мм). К полученному таким образом эфиру добавляют ТГФ (30 мл) и 0,25 М NaOH (17,5 мл, 4,37 ммоль) с последующим перемешиванием при комнатной температуре в течение 18 часов. Реакционную смесь выливают в 1 М HCl для подкисления смеси. Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при пониженном давлении, получая при этом (4-((бензо(d)изоксазол-3-карбонил)амино)-5-хлор-2-фторфенилуксусную кислоту (100 мг, 10%) в виде белого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 3,66 (с, 2H), 7,58 (т, J=8,0 Гц, 1H), 7,62 (д, J=7,1 Гц, 1H), 7,68 (д, J=11,4 Гц, 1H), 7,79 (д, J=9,0 Гц, 1H), 8,15 (д, J=8,8 Гц, 1H), 10,61 (д, J=4,2 Гц, 1H).
МС (ESI) m/z 349 (M+1)+.
(Стадия 5) Синтез транс-4-(1-(4-((бензо(d)изоксазол-3-карбонил)амино)-5-хлор-2-фторфенилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоновой кислоты
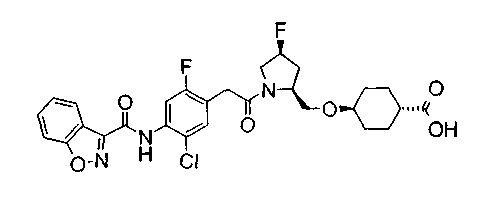
В ДМФ (3 мл) растворяют (4-((бензо(d)изоксазол-3-карбонил)амино)-5-хлор-2-фторфенилуксусную кислоту (100 мг, 0,29 ммоль), метил-транс-4-((4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилат (соединение, синтезированное в стадии (3) примера 21) (74 мг, 0,29 ммоль), HOBt (74 мг, 0,55 ммоль), DMAP (каталитическое количество) и соль EDC·HCl (83 мг, 0,43 ммоль). Образовавшийся раствор перемешивают при комнатной температуре в течение 18 часов. Реакционную смесь выливают в 1 М HCl с последующей экстракцией этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом магния и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают колоночной хроматографией на силикагеле. К полученному таким образом эфиру добавляют ТГФ (3,0 мл) и 0,25 М NaOH (1,7 мл, 0,43 ммоль) с последующим перемешиванием в течение 18 часов при комнатной температуре. Реакционную смесь выливают в ледяную воду. Раствор подкисляют 1 М HCl. Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при пониженном давлении, получая при этом указанное в заголовке соединение (100 мг, 61%) в виде бесцветного твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 1,05-1,50 (м, 4H), 1,95 (м, 4H), 2,04 (м, 2H), 3,50-4,00 (м, 6H), 4,05 и 4,08 (2 м, общий 1H), 5,40 (м, 1H), 7,52 (м, 2H), 7,63 (м, 1H), 7,79 (т, J=7,8 Гц, 1H), 7,94 (д, J=8,3 Гц, 1H), 8,16 (д, J=8,1 Гц, 1H), 10,65 (ушир., 1H), 12,05 (ушир., 1H).
МС (ESI) m/z 576 (M+1)+.
Анал. Вычисл. для C28H28ClF2N3О6: С, С, 58,39; H, 4,90; N, 7,30.
Найдено: С, 58,19; H, 4,87; N, 7,18.
Пример 87
транс-4-(1-((5-Хлор-2-фтор-4-((1-метил-3-индазолилкарбонил)амино)фенил)ацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоновая кислота:
(Стадия 1) Синтез метил-(2-нитрофенил)ацетата
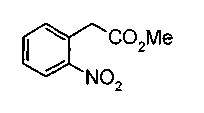
К (2-нитрофенил)уксусной кислоте (25,0 г, 0,14 моль) добавляют метанол (100 мл) и концентрированную серную кислоту (3,0 мл). Образовавшуюся смесь нагревают при кипячении с обратным холодильником в течение 10 часов. Реакционную смесь охлаждают до комнатной температуры и затем перегоняют при пониженном давлении для удаления растворителя. Остаток растворяют в хлороформе. Образовавшийся раствор промывают насыщенным водным раствором бикарбоната натрия, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси н-гексан-этилацетат (2:1, об./об.) метил-(2-нитрофенил)ацетат (26,6 г, 97%) получают в виде желтого масла.
1H-ЯМР (CDCl3) δ: 3,72 (с, 3H), 4,03 (с, 2H), 7,36 (дд, J=7,3, 1,2 Гц, 1H), 7,45 (м, 1H), 7,60 (м, 1H), 8,11 (дд, J=8,1, 1,2 Гц, 1H).
(Стадия 2) Синтез метил-(2-ацетамидофенил)ацетата
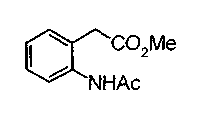
Метил-(2-нитрофенил)ацетат (26,6 г, 0,14 моль) и уксусный ангидрид (51,5 мл, 0,55 моль) подвергают каталитическому гидрированию в течение 15 часов в толуоле (150 мл) в присутствии 10% Pd/C (53,2% (влажн.), 4,5 г). Реакционную смесь фильтруют для удаления из нее катализатора с последующим промыванием толуолом. Фильтрат перегоняют при пониженном давлении для удаления растворителя. Остаток кристаллизуют добавлением к нему н-гексана и диизопропилового эфира. Таким образом осажденные кристаллы собирают фильтрованием, промывают н-гексаном и сушат при пониженном давлении, получая при этом метил-(2-ацетамидофенил)ацетат (24,3 г, 84%) в виде светло-желтого твердого вещества.
1H-ЯМР (CDCl3) δ: 2,21 (с, 3H), 3,63 (с, 2H), 3,72 (с, 3H), 7,11 (м, 1H), 7,20 (д, J=7,3, Гц, 1H), 7,30 (м, 1H), 7,83 (д, J=8,1, Гц, 1H), 8,68 (ушир.с, 1H).
(Стадия 3) Синтез метил-1-ацетилиндазол-3-карбоксилата

Метил-(2-ацетамидофенил)ацетат (24,3 г, 0,12 моль) и уксусный ангидрид (24,3 мл, 0,26 ммоль) растворяют в уксусной кислоте (60 мл). К образовавшемуся раствору по каплям добавляют трет-бутилнитрит (90% чистота, 18,6 мл, 0,14 моль) на протяжении 20 минут при перемешивании при 90°С.После завершения добавления реакционную смесь перемешивают при 90°С в течение дополнительного 1 часа. Реакционную смесь охлаждают до комнатной температуры и затем выливают в воду (500 мл) с последующим перемешиванием в течение 1 часа. Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении и растворяют в хлороформе. Раствор в хлороформе промывают насыщенным водным раствором бикарбоната натрия и насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя, в результате чего метил-1-ацетилиндазол-3-карбоксилат (22,3 г, 85%) получают в виде желтого твердого вещества.
1H-ЯМР (CDCl3) δ: 2,88 (с, 3H), 4,09 (с, 3H), 7,46 (м, 1H), 7,61 (м, 1H), 8,22 (дд, J=8,1,1,0 Гц, 1H), 8,46 (дд, J=8,6, 1,0 Гц, 1H).
(Стадия 4) Синтез индазол-3-карбоновой кислоты
К метил-1-ацетилиндазол-3-карбоксилату (22,3 г, 0,10 моль) добавляют гидроксид натрия (8,18 г, 0,20 моль) и воду (640 мл) и образовавшуюся смесь перемешивают при температуре от 60 до 70°С в течение 6,5 часа. Реакционную смесь выливают в концентрированную HCl (30 мл). Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при пониженном давлении, получая при этом индазол-3-карбоновую кислоту (17,6 г, 100%) в виде светло-желтого твердого вещества.
1H-ЯМР (CDCl3) δ: 7,29 (м, 1H), 7,44 (м, 1H), 7,65 (д, J=8,6, Гц, 1H), 8,10 (д, J=8,1, Гц, 1H), 12,96 (ушир.с, 1H), 13,77 (ушир.с, 1H).
(Стадия 5) Синтез метилиндазол-3-карбоксилата
Индазол-3-карбоновую кислоту (5,00 г, 30,8 ммоль) растворяют в ТГФ (200 мл) и метаноле (15 мл). К образовавшемуся раствору добавляют (триметилсилил)диазометан (2,0 М раствор в н-гексане, 20 мл, 40,1 ммоль) при перемешивании при 0°С. После перемешивания при в течение 3 часов реакционную смесь перегоняют при пониженном давлении для удаления растворителя. Остаток кристаллизуют добавлением н-гексана и таким образом полученные кристаллы собирают фильтрованием и сушат при пониженном давлении, получая при этом метилиндазол-3-карбоксилат (3,71 г, 68%) в виде бесцветного твердого вещества.
1H-ЯМР (CDCl3) δ: 4,07 (с, 3H), 7,34 (м, 1Н), 7,47 (м, 1H), 7,70 (д, J=8,3 Гц, 1H), 8,24 (д, J=8,3 Гц, 1H), 11,83 (ушир.с, 1H).
МС (ESI) m/z 177 (M++1).
(Стадия 6) Синтез метил-1-метилиндазол-3-карбоксилата и метил-2-метилиндазол-3-карбоксилата
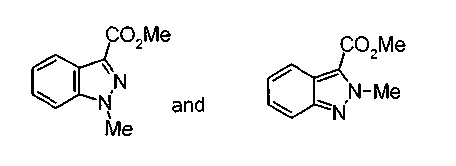
Метилиндазол-3-карбоксилат (3,71 г, 21,1 ммоль) растворяют в ДМФ (40 мл). К образовавшемуся раствору добавляют по частям гидрид натрия (60% в масле, 1,01 г, 25,3 ммоль) при перемешивании при 0°С. Реакционную смесь перемешивают при такой же температуре в течение 30 минут. К смеси добавляют метилиодид (1,57 мл, 25,3 ммоль). Образовавшуюся смесь перемешивают при такой же температуре в течение 30 минут. Добавляют насыщенный водный раствор хлорида аммония и смесь экстрагируют этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом магния и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси н-гексан-этилацетат (3:1, об./об.) метил-2-метилиндазол-3-карбоксилат (1,62 г, 26%) получают в виде светло-желтого твердого вещества.
1H-ЯМР (CDCl3) δ: 4,03 (с, 3H), 4,52 (с, 3H), 7,28 (м, 1H), 7,35 (м, 1H), 7,76 (д, J=8,3 Гц, 1H), 8,00 (д, J=8,3 Гц, 1H).
МС (ESI) m/z 191 (M++1).
Из элюатных фракций смеси н-гексан-этилацетат (1:1, об./об.) получают 1-метилиндазол-3-карбоксилат (4,52 г, 73%) в виде желтого твердого вещества.
1H-ЯМР (CDCl3) δ: 4,04 (с, 3H), 4,17 (с, 3H), 7,31-7,35 (м, 2H), 7,46 (д, J=4,4 Гц, 1H), 8,22 (д, J=8,l Гц, 1H).
МС (ESI) m/z 191 (M++1).
(Стадия 7) Синтез 1-метилиндазол-3-карбоновой кислоты
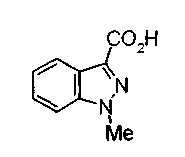
В ТГФ (250 мл) растворяют метил-1-метилиндазол-3-карбоксилат (4,49 г, 23,6 ммоль). К образовавшемуся раствору добавляют 0,25 н. NaOH (145 мл, 35,4 ммоль) с последующим перемешиванием при комнатной температуре в течение 24 часов. Реакционную смесь перегоняют при пониженном давлении для удаления растворителя. К остатку добавляют 1 н. HCl (145 мл). Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при пониженном давлении, получая при этом 1-метилиндазол-3-карбоновую кислоту (2,81 г, 68%) в виде светло-желтого твердого вещества.
1H-ЯМР (ДМСО-de) δ: 4,15 (с, 3H), 7,32 (м, 1H), 7,48 (м, 1H), 7,75 (д, J=8,1 Гц, 1H), 8,08 (д, J=8,1 Гц, 1H), 12,96 (ушир.с, 1H).
МС (ESI) m/z 177 (M++1).
(Стадия 8) Синтез этил-(5-хлор-2-фтор-4-((1-метил-3-индазолилкарбонил)амино)фенил)ацетата
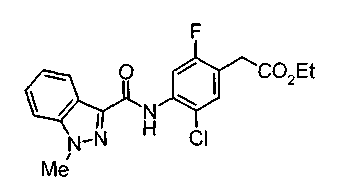
Оксалилхлорид (0,54 мл, 6,24 ммоль) в бензоле (30 мл) добавляют по каплям к 1-метилиндазолил-3-карбоновой кислоте (1,00 г, 5,68 ммоль) и ДМФ (44,0 мкл, 0,57 ммоль) при перемешивании при комнатной температуре. После завершения добавления реакционную смесь перемешивают при комнатной температуре в течение 1 часа. К реакционной смеси добавляют раствор этил-(4-амино-5-хлор-2-фторфенил)ацетата (1,31 г, 5,68 ммоль) и триэтиламина (4,74 мл, 34,0 ммоль) в бензоле (5,0 мл), который получают заранее. Образовавшуюся смесь нагревают при кипячении с обратным холодильником в течение 4 часов. Реакционную смесь охлаждают до комнатной температуры с последующей экстракцией этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси н-гексан-этилацетат (3:1, об./об.) этил-(5-хлор-2-фтор-4-((1-метил-3-индазолилкарбонил)амино)фенил)ацетат (1,40 г, 63%) получают в виде бесцветного твердого вещества.
1H-ЯМР (CDCl3) δ: 1,28 (т, J=7,1 Гц, 3H), 3,62 (с, 2H), 4,17 (с, 3H), 4,18 (кв., J=7,1 Гц, 2H), 7,33-7,39 (м, 2H), 7,44-7,50 (м, 2H), 8,38 (д, J=8,3 Гц, 1H), 8,53 (д, J=11,9 Гц, 1H), 9,50 (ушир.с, 1H).
МС (ESI) m/z 390 (M++1).
(Стадия 9) Синтез (5-хлор-2-фтор-4-((1-метил-3-индазолилкарбонил)амино)фенил)уксусной кислоты
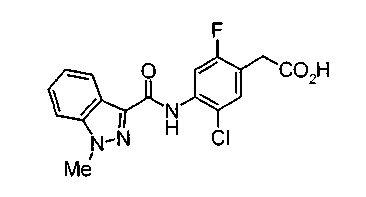
К этил-(5-хлор-2-фтор-4-((1-метил-3-индазолилкарбонил)амино)фенил)ацетату (1,40 г, 3,59 ммоль) добавляют ТГФ (36 мл) и 0,25 н. NaOH (21,5 мл, 5,39 ммоль). Образовавшуюся смесь перемешивают при комнатной температуре в течение 6 часов. Реакционную смесь выливают в 1 н. HCl (6,0 мл). Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при пониженном давлении, получая при этом (5-хлор-2-фтор-4-((1-метил-3-индазолилкарбонил)амино)фенил)уксусную кислоту (1,23 г, 95%) в виде бесцветного твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 3,65 (с, 2H), 4,21 (с, 3H), 7,37 (м, 1H), 7,53 (м, 1H), 7,59 (д, J=7,3 Гц, 1H), 7,80 (д, J=8,6 Гц, 1H), 8,13 (д, J=11,4 Гц, 1H), 8,21 (д, J=8,1 Гц, 1H), 9,68 (с, 1H), 12,58 (ушир.с, 1H).
МС (ESI) m/z 362 (M++1).
(Стадия 10) Синтез метил-транс-4-(1-((5-хлор-2-фтор-4-((1-метил-3-индазолилкарбонил)амино)фенил)ацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилата
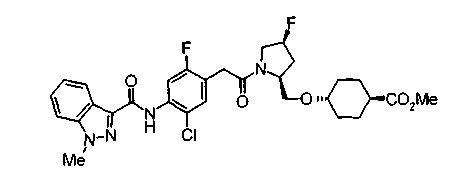
К (5-хлор-2-фтор-4-((1-метил-3-индазолилкарбонил)амино)фенил)уксусной кислоте (200 мг, 0,55 ммоль), метил-транс-4-((4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилату (соединение, синтезированное в стадии (3) примера 21) (143 мг, 0,55 ммоль), HOBt (15,0 мг, 0,11 ммоль) и DMAP (14,0 мг, 0,11 ммоль) добавляют ДМФ (5,0 мл) и EDC·HCl (159 мг, 0,83 ммоль). Образовавшуюся смесь перемешивают при комнатной температуре в течение 6 часов. К реакционной смеси добавляют воду с последующей экстракцией этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных этилацетатных фракций метил-транс-4-(1-((5-хлор-2-фтор-4-((1-метил-3-индазолилкарбонил)амино)фенил)ацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилат (332 мг, 100%) получают в виде желтого аморфного вещества.
1H-ЯМР (CDCl3) δ: 1,24-1,33 (м, 2H), 1,40-1,53 (м, 2H), 1,98-2,53 (м, 7H), 3,26-4,14 (м, 10H), 4,17 (с, 3H), 4,31 и 4,38 (каждый м, общий 1H), 5,26 и 5,31 (каждый м, общий 1H), 7,29-7,53 (м, 4H), 8,39 (д, J=8,3 Гц, 1H), 8,51 (м, 1H), 9,50 (ушир.с, 1H).
МС (ESI) m/z 604 (M++1).
(Стадия 11) Синтез транс-4-(1-((5-хлор-2-фтор-4-((1-метил-3-индазолилкарбонил)амино)фенил)ацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоновой кислоты
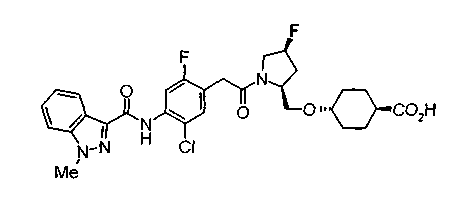
К метил-транс-4-(1-((5-хлор-2-фтор-4-((1-метил-3-индазолилкарбонил)амино)фенил)ацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилату (332 мг, 0,55 ммоль) добавляют ТГФ (5,5 мл) и 0,25 н. NaOH (3,30 мл, 0,82 ммоль) и образовавшуюся смесь перемешивают при комнатной температуре в течение 18 часов. Реакционную смесь выливают в 1 н. HCl (1,1 мл). Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при пониженном давлении, получая при этом указанное в заголовке соединение (300 мг, 93%) в виде бесцветного твердого вещества.
ИК (ATR) ν 3363, 2938, 2863, 1725, 1687, 1648, 1621, 1585, 1525, 1481 см-1;
1H-ЯМР (ДМСО-d6) δ: 1,18-1,38 (м, 4H), 1,86-2,33 (м, 7H), 3,18-3,99 (м, 7H), 4,13 и 4,35 (каждый м, общий 1H), 4,22 (с, 3H), 5,33 и 5,42 (каждый м, общий 1H), 7,37 (м, 1H), 7,45-7,56 (м, 2H), 7,82 (д, J=8,3 Гц, 1H), 8,08 и 8,10 (каждый д, J=11,4 Гц, общий 1H), 8,21 (д, J=8,3 Гц, 1H), 9,71 (ушир.с, 1H), 12,06 (ушир.с, 1H).
МС (ESI) m/z 589 (M++1);
Анал. Вычисл. для С29Н31ClF2N4O5 ·0,25H2О: C, 58,68; H, 5,35; N, 9,44.
Найдено: C, 58,46; H, 5,31; N, 9,25.
Пример 88
транс-4-(1-((5-Хлор-2-фтор-4-((2-метил-3-индазолилкарбонил)амино)фенил)ацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоновая кислота:
(Стадия 1) Синтез 2-метилиндазол-3-карбоновой кислоты
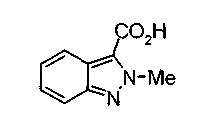
К метил-2-метилиндазол-3-карбоксилату (1,59 г, 8,36 ммоль) добавляют ТГФ (85 мл) и 0,25 н. NaOH (50 мл, 12,5 ммоль) и образовавшуюся смесь перемешивают при комнатной температуре в течение 24 часов. Реакционную смесь перегоняют при пониженном давлении для удаления растворителя. К остатку добавляют воду с последующим добавлением 1 н. HCl (50 мл). Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при пониженном давлении, получая при этом 2-метилиндазол-3-карбоновую кислоту (1,34 г, 91%) в виде бесцветного твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 4,43 (с, 3H), 7,29 (м, 1H), 7,35 (м, 1H), 7,74 (дд, J=8,1, 1,0 Гц, 1H), 7,98 (д, J=8,5 Гц, 1H), 13,59 (ушир.с, 1H).
МС (ESI) m/z 177 (M++1);
(Стадия 2) Синтез этил-(5-хлор-2-фтор-4-((2-метил-3-индазолилкарбонил)амино)фенил)ацетата
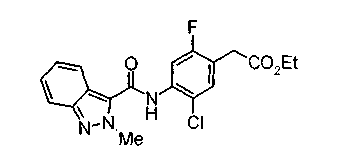
К 2-метилиндазол-3-карбоновой кислоте (650 мг, 3,69 ммоль) и ДМФ (29,0 мкл, 0,37 ммоль) добавляют бензол (20 мл). К образовавшейся смеси по каплям добавляют оксалилхлорид (0,39 мл, 4,34 ммоль) при перемешивают при комнатной температуре. После завершения добавления по каплям реакционную смесь перемешивают в течение дополнительного 1 часа при комнатной температуре. К реакционной смеси по каплям добавляют раствор этил-(4-амино-5-хлор-2-фторфенил)ацетата (855 мг, 3,69 ммоль) и триэтиламина (3,09 мл, 22,1 ммоль) в бензоле (3,0 мл), который получают заранее, и смесь нагревают при кипячении с обратным холодильником в течение 16 часов. Реакционную смесь затем охлаждают до комнатной температуры с последующей экстракцией этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси н-гексан-этилацетат (5:1, об./об.) этил-(5-хлор-2-фтор-4-((2-метил-3-индазолилкарбонил)амино)фенил)ацетат (390 мг, 27%) получают в виде светло-желтого твердого вещества.
1H-ЯМР (CDCl3) δ: 1,29 (т, J=7,1 Гц, 3H), 3,65 (с, 2H), 4,20 (кв., J=7,1 Гц, 2H), 4,55 (с, 3H), 7,35-7,42 (м, 3H), 7,84 (д, J=8,3 Гц, 1H), 7,97 (д, J=8,1 Гц, 1H), 8,49 (д, J=11,5 Гц, 1H), 8,54 (ушир.с, 1H).
МС (ESI) m/z 390 (M++1).
(Стадия 3) Синтез (5-хлор-2-фтор-4-((2-метил-3-индазолилкарбонил)амино)фенил)уксусной кислоты
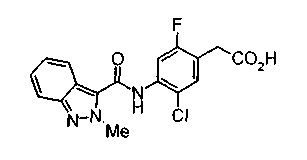
К этил-(5-хлор-2-фтор-4-((2-метил-3-индазолилкарбонил)амино)фенил)ацетату (390 мг, 1,00 ммоль) добавляют ТГФ (10 мл) и 0,25 н. NaOH (6,00 мл, 1,50 ммоль). Образовавшуюся смесь перемешивают при комнатной температуре в течение 16 часов. Реакционную смесь выливают в 1 н. HCl (1,5 мл). Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при пониженном давлении, получая при этом (5-хлор-2-фтор-4-((2-метил-3-индазолилкарбонил)амино)фенил)уксусную кислоту (1,23 г, 95%) в виде коричневого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 3,68 (с, 2H), 4,39 (с, 3H), 7,30 (м, 1H), 7,38 (м, 1H), 7,62 (д, J=7,6 Гц, 1H), 7,74-7,80 (м, 2H), 8,03 (д, J=8,3 Гц, 1H), 10,25 (ушир.с, 1H), 12,62 (ушир.с, 1H).
МС (ESI) m/z 362 (M++1).
(Стадия 4) Синтез метил-транс-4-(1-((5-хлор-2-фтор-4-((2-метил-3-индазолилкарбонил)амино)фенил)ацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилата

К (5-хлор-2-фтор-4-((2-метил-3-индазолилкарбонил)амино)фенил)уксусной кислоте (200 мг, 0,55 ммоль), метил-транс-4-((4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилату (соединение, синтезированное в стадии (3) примера 21) (143 мг, 0,55 ммоль), HOBt (15,0 мг, 0,11 ммоль) и DMAP (14,0 мг, 0,11 ммоль) добавляют ДМФ (5,0 мл) и EDC·HCl (159 мг, 0,83 ммоль). Образовавшуюся смесь перемешивают при комнатной температуре в течение 6 часов. К реакционной смеси добавляют воду с последующей экстракцией этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из этилацетатных элюатных фракций метил-транс-4-(1-((5-хлор-2-фтор-4-((2-метил-3-индазолилкарбонил)амино)фенил)ацетил)-(4S)-фтор-(2S)- пирролидинилметокси)циклогексанкарбоксилат (313 мг, 94%) получают в виде желтого аморфного вещества.
1H-ЯМР (CDCl3) δ: 1,24-1,29 (м, 2H), 1,32-1,58 (м, 2H), 1,97-2,54 (м, 7H), 3,23-4,02 (м, 10H), 4,31 и 4,38 (каждый м, общий 1H), 4,54 (с, 3H), 5,27 и 5,32 (каждый м, общий 1H), 7,31-7,47 (м, 3H), 7,84 (д, J=7,6 Гц, 1H), 7,96 (д, J=8,3 Гц, 1H), 8,47 (м, 1H), 8,54 (ушир.с, 1Н).
МС (ESI) m/z 604 (M++1).
(Стадия 5) Синтез транс-4-(1-((5-Хлор-2-фтор-4-((2-метил-3-индазолилкарбонил)амино)фенил)ацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоновой кислоты
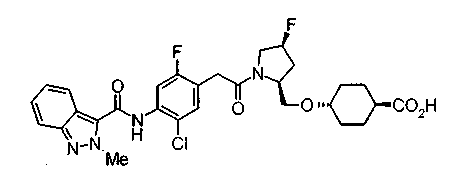
К метил-транс-4-(1-((5-Хлор-2-фтор-4-((2-метил-3-индазолилкарбонил)амино)фенил)ацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилату (313 мг, 0,52 ммоль) добавляют ТГФ (5,0 мл) и 0,25 н. NaOH (3,11 мл, 0,78 ммоль). Образовавшуюся смесь перемешивают при комнатной температуре в течение 18 часов. К реакционной смеси добавляют 1 н. HCl (0,85 мл). Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при пониженном давлении, получая при этом указанное в заголовке соединение (253 мг, 83%) в виде бесцветного твердого вещества.
ИК (ATR) ν 3409, 2942, 2861, 1725, 1681, 1646, 1621, 1587, 1521, 1454 см-1;. 1H-ЯМР (ДМСО-d6) δ: 1,16-1,42 (м, 4H), 1,86-2,33 (м, 7H), 3,19-4,36 (м, 8H), 4,39 (с, 3H), 5,33 и 5,42 (каждый м, общий 1H), 7,31 (м, 1H), 7,38 (м, 1H), 7,49 и 7,51 (каждый д, J=7,1 Гц, общий 1H), 7,74-7,77 (м, 2H), 8,04 (д, J=8,3 Гц, 1H), 10,27 (ушир.с, 1H), 12,03 (ушир.с, 1H).
МС (ESI) m/z 589 (M++1);
Анал. Вычисл. для С29Н31ClF2N4O5·0,25H2О: C, 58,68; H, 5,35; N, 9,44.
Найдено: C, 58,68; H, 5,38; N, 9,32.
Пример 89
транс-4-(1-((3-Хлор-4-((1-метил-3-индазолилкарбонил)амино)фенил)ацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоновая кислота:
(Стадия 1) Синтез метил-(3-хлор-4-((1-метил-3-индазолилкарбонил)амино)фенил)ацетат
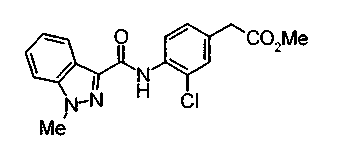
К 1-метилиндазол-3-карбоновой кислоте (600 мг, 3,41 ммоль) и ДМФ (27,0 мкл, 0,34 ммоль) добавляют метиленхлорид (20 мл). К образовавшейся смеси при перемешивании при комнатной температуре по каплям добавляют оксалилхлорид (0,36 мл, 4,09 ммоль). После завершения добавления по каплям реакционную смесь перемешивают при комнатной температуре в течение 50 часов и растворитель отгоняют при пониженном давлении. Остаток растворяют метиленхлориде (5 мл). Образовавшийся раствор добавляют к раствору метил-4-амино-3-хлорфенилацетата (680 мг, 3,41 ммоль) и триэтиламина (1,42 мл, 10,2 ммоль) в метиленхлориде (5 мл) при перемешивании при комнатной температуре. Реакционную смесь нагревают при кипячении с обратным холодильником в течение 7 часов. После охлаждения реакционной смеси до комнатной температуры к ней добавляют воду с последующей экстракцией хлороформом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси н-гексан-этилацетат (2:1, об./об.) метил-(3-хлор-4-((1-метил-3-индазолилкарбонил)амино)фенил)ацетат (1,08 г, 89%) получают в виде желтого твердого вещества.
1H-ЯМР (CDCl3) δ: 3,61 (с, 2H), 3,72 (с, 3H), 4,18 (с, 3H), 7,24 (дд, J=8,6, 2,0 Гц, 1H), 7,34 (м, 1H), 7,38 (д, J=2,0 Гц, 1H), 7,45-7,50 (м, 2H), 8,41 (д, J=8,0 Гц, 1H), 8,61 (д, J=8,6 Гц, 1H), 9,47 (ушир.с, 1H).
МС (LCMC) m/z 358 (M++1).
(Стадия 2) Синтез (3-хлор-4-((1-метил-3-индазолилкарбонил)амино)фенил)уксусной кислоты

К метил-(3-хлор-4-(1-метил-3-индазолилкарбонил)амино)фенил)ацетату (1,08 г, 3,02 ммоль)добавляют ТГФ (30 мл) и 0,25 н. NaOH (18,1 мл, 4,53 ммоль) и образовавшуюся смесь перемешивают при комнатной температуре в течение 16 часов. Реакционную смесь выливают в 1 н. HCl (5,0 мл). Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при пониженном давлении, получая при этом (3-хлор-4-((1-метил-3-индазолилкарбонил)амино)фенил)уксусную кислоту (0,99 г, 95%) в виде коричневого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 3,62 (с, 2H), 4,21 (с, 3H), 7,28 (дд, J=8,3, 1,7 Гц, 1H), 7,35 (м, 1H), 7,47 (д, J=1,7 Гц, 1H), 7,53 (м, 1H), 7,80 (д, J=8,5 Гц, 1H), 8,11 (д, J=8,3 Гц, 1H), 8,21 (д, J=8,l Гц, 1H), 9,69 (с, 1H), 12,49 (ушир.с, 1H).
МС (LCMC) m/z 344 (M++1).
(Стадия 3) Синтез метил-транс-4-(1-((3-хлор-4-((1-метил-3-индазолилкарбонил)амино)фенил)ацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилата
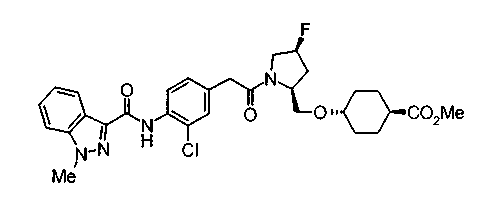
К (3-хлор-4-((1-метил-3-индазолилкарбонил)амино)фенил)уксусной кислоте (250 мг, 0,73 ммоль), метил-транс-4-((4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилату (соединение, синтезированное в стадии (3) примера 21) (189 мг, 0,73 ммоль), HOBt (20,0 мг, 0,15 ммоль) и DMAP (18,0 мг, 0,15 ммоль) добавляют ДМФ (5,0 мл) и EDC·HCl (209 мг, 1,09 ммоль). Образовавшуюся смесь перемешивают при комнатной температуре в течение 17 часов. К реакционной смеси добавляют воду с последующей экстракцией этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси н-гексан-этилацетат (1:2, об./об.) метил-транс-4-(1-((3-хлор-4-((1-метил-3-индазолилкарбонил)амино)фенил)ацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилат (414 мг, 97%) получают в виде желтого аморфного вещества.
1H-ЯМР (CDCl3) δ: 1,21-1,29 (м, 2H), 1,33-1,53 (м, 2H), 1,97-2,50 (м, 7H), 3,24-4,09 (м, 10H), 4,15 (с, 3H), 4,21 и 4,37 (каждый м, общий 1H), 5,25 (м, 1H), 7,20 (м, 1H), 7,30-7,38 (м, 2H), 7,40-7,47 (м, 2H), 8,38 (д, J=8,1 Гц, 1H), 8,57 и 8,59 (каждый д, J=7,3 Гц, общий 1H), 9,44 (ушир.с, 1H).
МС (ESI) m/z 586 (M++1).
(Стадия 4) Синтез транс-4-(1-((3-хлор-4-((1-метил-3-индазолилкарбонил)амино)фенил)ацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоновой кислоты
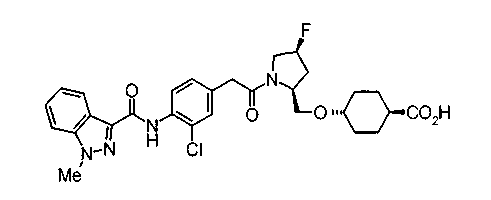
К метил-транс-4-(1-((3-хлор-4-((1-метил-3-индазолилкарбонил)амино)фенил)ацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилату (414 мг, 0,71 ммоль) добавляют ТГФ (7,0 мл) и 0,25 н. NaOH (4,25 мл, 1,06 ммоль). Образовавшуюся смесь перемешивают при комнатной температуре в течение 20 часов. К реакционной смеси добавляют 1 н. HCl (1,5 мл). Таким образом осажденные кристаллы собирают фильтрованием, промывают водой и сушат при пониженном давлении, получая при этом указанное в заголовке соединение (353 мг, 87%)в виде бесцветного твердого вещества.
ИК (ATR) ν 3316, 2937, 2859, 1720, 1685, 1600, 1521, 1484 см-1;
1H-ЯМР (ДМСО-d6) δ: 1,14-1,41 (м, 4H), 1,85-1,99 (м, 4H), 2,08-2,26 (м, 3H), 3,16-3,88 (м, 7H), 4,14 и 4,34 (каждый м, общий 1H), 4,21 (с, 3H), 5,32 и 5,39 (каждый м, общий 1H), 7,24 (м, 1H), 7,35 (м, 1H), 7,42 (d J=7,6 Гц, 1H), 7,53 (м, 1H), 7,80 (д, J=8,1 Гц, 1H), 8,10 (м, 1H), 8,21 (д, J=8,1 Гц, 1H), 9,69 (с, 1H), 12,06 (ушир.с, 1H).
МС (ESI) m/z 572 (M++1);
Анал. Вычисл. для С29Н32ClFN4O5·0,25H2О: C, 60,52; H, 5,69; N, 9,73.
Найдено: С, 60,57; H, 5,64; N, 9,50.
Пример 90
транс-4-(1-(3-Хлор-4-((3-оксо-3,4-дигидро-2Н-бензо(1,4)тиазин-5-илкарбонил)амино)фенилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоновая кислота:
(Стадия 1) Синтез транс-4-(1-(3-хлор-4-((3-оксо-3,4-дигидро-2Н-бензо(1,4)тиазин-5-илкарбонил)амино)фенилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоновой кислоты
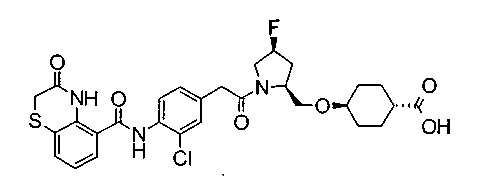
Смесь транс-4-(1-((4-амино-3-хлорфенил)ацетил)-(4S)-фтор- (2S)-пирролидинилметокси)циклогексанкарбоновой кислоты (500 мкл 1,0 М раствор в ДМФ, 0,50 ммоль), 3-оксо-3,4-дигидро-2Н-бензо(1,4)тиазин-5-карбоновой кислоты (105 мг, 0,5 ммоль), HOBt (0,95 мл 1,0 М раствор в ДМФ, 0,95 ммоль), EDC·HCl (1,5 мл 0,5 М раствор в смеси ДМФ/метиленхлорид, 0,75 ммоль) и DMAP (каталитическое количество) перемешивают в сосуде с завинчивающейся крышкой в течение 18 часов при комнатной температуре. Реакционную смесь разбавляют хлороформом (3 мл) и разбавленный раствор выливают в подогнанный шприц, в который предварительно загружают кислотную гидроматрицу. Шприц промывают хлороформом. Растворитель отгоняют и к остатку добавляют смесь ТГФ/метанол (4 мл, 3:1) и 1 М NaOH. Образовавшуюся смесь перемешивают при комнатной температуре в течение 18 часов. Реакционную смесь перегоняют и остаток очищают высокоэффективной жидкостной хроматографией (система ARW), получая при этом указанное в заголовке соединение (15 мг, 5%) в виде бесцветного твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 1,10-1,40 (м, 4H), 1,90 (м, 4H), 2,12 (м, 4H), 3,20 (м, 1H), 3,40 (м, 1H), 3,56 (с, 2H), 3,65-3,90 (м, 4H), 4,11 и 4,32 (2 м, общий 1H), 5,32 (м, 1H), 7,14 (т, J=7,8 Гц, 1H), 7,22 (м, 1H), 7,40 (д, J=6,0 Гц, 1H), 7,51 (м, 1H), 7,59 (д, J=7,8 Гц, 1H), 7,80 (д, J=8,1 Гц, 1H).
МС (ESI) m/z 605 (M+1)+.
Анал. Вычисл. для С29Н31ClFN3O6S·1,0H2О: C, 55,99; H, 5,35; N, 6,75.
Найдено: C, 55,85; H, 5,12; N, 6,51.
Пример 91
транс-4-(1-(5-Хлор-2-фтор-4-(1-индолинил)карбониламино)фенилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоновая кислота:
(Стадия 1) Синтез метил-транс-4-(1-(5-хлор-2-фтор-4-(1-индолинил)карбониламино)фенилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилата

К метил-транс-4-((4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилату (соединение, синтезированное в (стадии 3) примера 21) (233 мг, 0,90 ммоль), 5-хлор-2-фтор-4-(1-индолинилкарбониламино)фенилуксусной кислоте (314 мг, 0,90 ммоль) и EDC·HCl (190 мг, 0,99 ммоль) добавляют ДМФ (10 мл) и HOBt (24 мг, 0,18 ммоль). Образовавшуюся смесь перемешивают при комнатной температуре в течение 18 часов. К реакционной смеси добавляют воду с последующей экстракцией этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси этилацетат/гексан (4/1) метил-транс-4-(1-(5-Хлор-2-фтор-4-(1-индолинил)карбониламино)фенилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилат (421 мг, 79%) получают в виде бесцветного аморфного вещества.
1H-ЯМР (CDCl3), смесь ротамеров, δ: 1,15-1,30 (м, 2H), 1,39-1,42 (м, 2H), 1,96-2,15 (м, 5H), 2,21-2,53 (ряд м, 2H), 3,20-3,37 (м, перекрывание, 1H), 3,26 (т, J=8,8 Гц, 1H), 3,50-3,60 (м, 2H), 3,64-4,00 (ряд м, перекрывание, 4H), 3,64 и 3,66 (с, общий 3H), 4,13 (т, J=8,4 Гц, 1H), 4,27-4,40 (м, 1H), 5,18-5,36 (м, 1H), 6,98 (т, J=7,6 Гц, 1H), 7,17-7,23 (м, 3H), 7,35 (дд, J=7,2,4-O Гц, 1H), 7,93 (д, J=8,0 Гц, 1H), 8,22 (т, J=2,4 Гц, 1H).
МС (ESI) m/z 590 (M++1).
(Стадия 2) Синтез транс-4-(1-(5-хлор-2-фтор-4-(1-индолинил)карбониламино)фенилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоновой кислоты
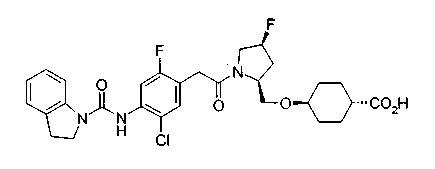
К метил-транс-4-(1-(5-Хлор-2-фтор-4-(1-индолинил)карбониламино)фенилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилату (394 мг, 0,67 ммоль) добавляют смесь метанол-ТГФ (1:1, 20 мл) и 0,25 н. NaOH (13,4 мл, 3,34 ммоль). Образовавшуюся смесь перемешивают при комнатной температуре в течение 18 часов. К реакционной смеси добавляют 1 н. HCl для подкисления смеси с последующей экстракцией смесью хлороформ/метанол (10/1, об./об.). Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия, затем перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси хлороформ/метанол (10/1) указанное в заголовке соединение (419 мг, 100%) получают в виде бесцветного аморфного вещества.
1H-ЯМР (CDCl3), смесь ротамеров, δ: 1,20-1,33 (м, 2H), 1,41-1,54 (м, 2H), 2,50-2,55 (ряд м, 8H), 3,27 (т, J=8,0 Гц, 2H), 3,33-4,38 (ряд м, 7H), 4,14 (т, J=8,8 Гц, 2H), 6,99 (т, J=7,6 Гц, 1H), 7,19-7,24 (м, 3H), 7,34-7,37 (м, 1H), 7,93 (д, J=8,4 Гц, 1H), 8,22 (т, J=11,6 Гц, 1H).
МС (ESI) m/z 576 (M++1).
Пример 92
транс-4-(3-Хлор-4-(1-(6-фториндолинил)карбониламино)фенилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоновая кислота:
(Стадия 1) Синтез этил-3-хлор-4-(1-(6-фториндолинил)карбониламино)фенилацетат
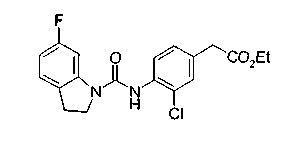
Этил-4-амино-3-хлорфенилацетат (520 мг, 2,43 ммоль) растворяют в ТГФ (50 мл). При перемешивании при комнатной температуре добавляют трифосген (240 мг, 0,81 ммоль). Образовавшуюся смесь перемешивают при комнатной температуре в течение 1 часа. К реакционной смеси добавляют триэтиламин (0,75 мл, 5,34 ммоль) с последующим добавлением раствора 6-фториндолина (333 мг, 2,43 ммоль) в ТГФ (5 мл). После перемешивания при комнатной температуре в течение 25 минут реакционную смесь выливают в воду с последующей экстракцией этилацетатом. Экстракт сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Твердое вещество, полученное таким образом, перекристаллизовывают из смеси гексан/этилацетат, получая при этом этил-3-хлор-4-(1-(6-фториндолинил)карбониламино)фенилацетат (499 мг, 55%) в виде бесцветного кристаллического порошка.
МС (ESI) m/z 376 (M++1).
(Стадия 2) Синтез 3-хлор-4-(1-(6-фториндолинил)карбониламино)фенилуксусной кислоты
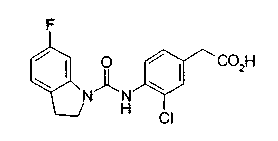
Этил-3-хлор-4-(1-(6-фториндолинил)карбониламино)фенилацетат (499 мг, 1,32 ммоль) растворяют в смеси ТГФ/метанол (1/1, 20 мл). К образовавшемуся раствору добавляют 0,25 н. NaOH (10,1 мл, 2,65 ммоль) с последующим перемешиванием при комнатной температуре в течение 2 часов. Реакционную смесь выливают в водный 1 н. HCl и экстрагируют смесью хлороформ/метанол (10/1). Экстракт сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Образовавшееся твердое вещество перекристаллизовывают из смеси гексан/хлороформ, получая при этом 3-хлор-4-(1-(6-фториндолинил)карбониламино)фенилуксусную кислоту (358 мг, 78%) в виде бесцветного кристаллического порошка.
1H-ЯМР (ДМСО-d6) δ: 3,16 (т, J=8,8 Гц, 2H), 3,59 (с, 2H), 4,18 (т, J=8,8 Гц, 2H), 6,67 (ушир.т, J=9,2 Гц, 1H), 7,17 (ушир.т.J=6,4 Гц, 1H), 7,21 (д, J=8,0 Гц, 1H), 7,40 (с, 1H), 7,50 (д, J=8,0 Гц, 1H), 7,56 (дд, J=2,0, 11,2 Гц, 1H), 8,32 (с, 1H).
МС (ESI) m/z 349 (M++1).
(Стадия 3) Синтез метил-транс-4-(3-хлор-4-(1-(6-фториндолинил)карбониламино)фенилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилата
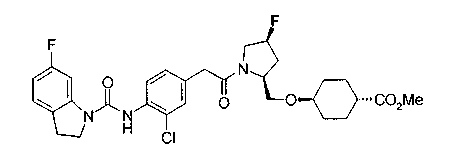
HOBt (28,0 мг, 0,23 ммоль) в ДМФ (12 мл) добавляют к 3-хлор-4-(1-(6-фториндолинил)карбониламино)фенилуксусной кислоте (358 мг, 1,03 ммоль), метил-транс-((4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилату (соединение, синтезированное в (стадии 3) примера 21) (266 мг, 1,03 ммоль) и EDC·HCl (216 мг, 1,13 ммоль) и образовавшуюся смесь перемешивают при комнатной температуре в течение 18 часов. Реакционную смесь выливают в воду с последующей экстракцией этилацетатом. Экстракт промывают водой, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси гексан/этилацетат (1/5) метил-транс-4-(3-хлор-4-(1-(6-фториндолинил)карбониламино)фенилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилат (599 мг, 99%) получают в виде бесцветного аморфного вещества.
1H-ЯМР (CDCl3), смесь ротамеров, δ: 1,20-1,31 (м, 2H), 1,42-1,53 (м, 2H), 1,97-2,10 (м, 5H), 2,22-2,61 (ряд м, 2H), 3,24 (т, J=8,0 Гц, 2H), 3,22-4,40 (ряд м, 8H), 3,67 и 3,71 (с, общий 3H), 4,20 (т, J=8,0 Гц, 2H), 5,15-5,34 (м, 1H), 6,63-6,68 (м, 1H), 7,03-7,10 (м, 2H), 7,16 (д, J=8,4 Гц, 1H), 7,34 (ушир.с, 1H), 7,76 (дд, J=2,0, 10,4 Гц, 1H), 8,23 (т, J=8,8 Гц, 1H).
МС (ESI) m/z 590 (M++1).
(Стадия 4) Синтез транс-4-(3-хлор-4-(1-(6-фториндолинил)карбониламино)фенилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоновой кислоты
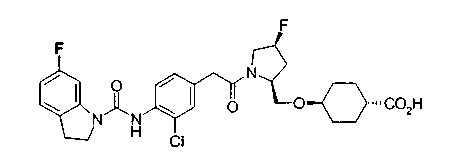
Метил-транс-4-(3-хлор-4-(1-(6-фториндолинил)карбониламино)фенилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилат (575 мг, 0,98 ммоль) растворяют в смеси ТГФ/метанол (1/1, 20 мл). К образовавшемуся раствору добавляют 0,25 н. NaOH (11,7 мл, 2,92 ммоль). Образовавшуюся смесь перемешивают при комнатной температуре в течение 18 часов. Реакционную смесь выливают в 1 н. HCl с последующей экстракцией смесью хлороформ/метанол (10/1). Экстракт сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси хлороформ/метанол (10/1) указанное в заголовке соединение (625 мг, 100%) получают в виде бесцветного аморфного вещества.
1H-ЯМР (ДМСО-d6), смесь ротамеров, δ: 1,44-1,55 (м, 2H), 1,59-1,72 (м, 2H), 2,19-2,56 (ряд м, 7H), 3,46 (т, J=8,0 Гц, 2H), 3,44-4,63 (ряд м, 8H), 4,49 (т, J=8,4 Гц, 2H), 5,51-5,73 (м, 1H), 6,93-6,98 (м, 1H), 7,44-7,49 (м, 2H), 7,64-7,66 (м, 1H), 7,81-7,89 (м, 2H), 8,55 и 8,56 (с, общий 2H) (д, J=8,4 Гц, 1H), 7,34 (ушир.с, 1H), 7,76 (дд, J=2,0, 10,4 Гц, 1H), 8,23 (т, J=8,8 Гц, 1H)
МС (ESI) m/z 576 (M++1).
Пример 93
транс-4-(1-(2-(3-Пиридил)-6-бензоксазолилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоновая кислота:
(Стадия 1) Синтез метил-(2-(3-пиридил)-6-бензоксазолил)ацетата
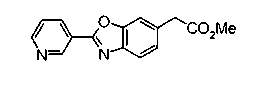
В EtOH (15 мл) пиридин-3-альдегид (0,63 г, 5,89 ммоль) и метил-4-амино-3-гидроксифенилацетат (1,06 г, 5,85 ммоль) перемешивают при комнатной температуре в течение 20 часов. К реакционной смеси добавляют иодбензолдиацетат (2,26 г, 7,02 ммоль) с последующим перемешиванием при комнатной температуре в течение 20 минут. Реакционную смесь перегоняют при пониженном давлении для удаления растворителя и остаток растворяют в этилацетате. Раствор в этилацетате промывают насыщенным водным раствором бикарбоната натрия, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси н-гексан-этилацетат (1:1, об./об.) метил-(2-(3-пиридил)-6-бензоксазолил)ацетат (360 мг, 23%) получают в виде светло-желтого твердого вещества.
1H-ЯМР (CDCl3) δ: 3,73 (с, 3H), 3,78 (с, 2H), 7,29 (с, 1H), 7,44-7,50 (м, 1H), 7,56-7,57 (м, 1H), 7,72-7,73 (м, 1H), 8,47-8,50 (м, 1H), 8,75-8,77 (м, 1H), 9,45-9,46 (м, 1H).
(Стадия 2) Синтез (2-(3-пиридил)-6-бензоксазолил)уксусной кислоты
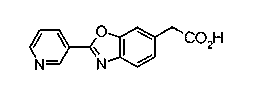
К метил-(2-(3-пиридил)-6-бензоксазолил)ацетату (360 мг, 1,34 ммоль) добавляют ТГФ (8 мл) и 0,5 н. NaOH (8,0 мл, 4,00 ммоль). Образовавшуюся смесь перемешивают при комнатной температуре в течение 20 часов. К реакционной смеси добавляют воду и 1 н. HCl (5,0 мл, 5 ммоль) для подкисления смеси с последующей экстракцией этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя, получая при этом (2-(3-пиридил)-6-бензоксазолил)уксусную кислоту (179 мг, 52%) в виде желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 3,78 (с, 2H), 7,34-7,36 (м, 1H), 7,62-7,79 (м, 3H), 8,52-8,55 (м, 1H), 8,80-8,82 (м, 1H), 9,35-9,36 (м, 1H).
(Стадия 3) Синтез метил-транс-4-(1-(2-(3-пиридил)-6-бензоксазолилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилата
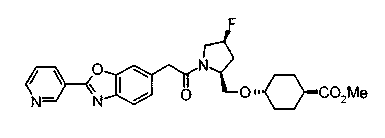
В ДМФ (5 мл) (2-(3-пиридил)-6-бензоксазолил)уксусную кислоту (179 мг, 0,70 ммоль), метил-транс-4-((4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилат (соединение, синтезированное в стадии (3) примера 21) (182 мг, 0,70 ммоль), EDC·HCl (202 мг, 1,05 ммоль), HOBt (143 мг, 1,06 ммоль) и триэтиламин (147 мкл, 1,05 ммоль) перемешивают при комнатной температуре в течение 2 часов. К реакционной смеси добавляют воду с последующей экстракцией этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси хлороформ-метанол (от 100:1 до 30:1, об./об.) метил-транс-4-(1-(2-(3-пиридил)-6-бензоксазолилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилат (304 мг, 87%) получают в виде красновато-коричневой густой вязкой жидкости.
1H-ЯМР (CDCl3) δ: 1,21-1,53 (м, 4H), 1,97-2,52 (м, 7H), 3,23-3,55 (м, 2H), 3,65-4,08 (м, 8H), 4,25-4,30 и 4,40 (каждый м, общий 1H), 5,19-5,22 и 5,32-5,35 (каждый м, общий 1H), 7,29-7,31 (м, 1H), 7,45-7,49 (м, 1H), 7,56-7,57 (м, 1H), 7,71-7,74 (м, 1H), 8,48-8,50 (м, 1H), 8,75-8,76 (м, 1H), 9,45 (с, 1H).
МС (ESI) m/z 496 (M++1).
(Стадия 4) Синтез транс-4-(1-(2-(3-пиридил)-6-бензоксазолилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоновой кислоты
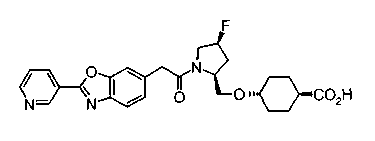
К метил-транс-4-(1-(2-(3-пиридил)-6-бензоксазолилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилату (304 мг, 0,61 ммоль) добавляют ТГФ (4 мл) и 0,5 н. NaOH (3,7 мл, 1,85 ммоль). Образовавшуюся смесь перемешивают при комнатной температуре в течение 2 часов. Реакционную смесь выливают в смесь лед - 1 н. HCl. Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при пониженном давлении, получая при этом указанное в заголовке соединение (156 мг, 53%) в виде светло-желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 1,14-1,35 (м, 4H), 1,92-2,20 (м, 7H), 3,16-3,99 (м, 7H), 4,14 и 4,34-4,36 (каждый м, общий 1H), 5,24-5,30 и 5,38-5,44 (каждый м, общий 1H), 7,26-7,30 (м, 1H), 7,62-7,66 (м, 2H), 7,73-7,76 (м, 1H), 8,49-8,51 (м, 1H), 8,78-8,79 (м, 1H), 9,33 (с, 1H).
МС (ESI) m/z 482 (M++1);
Анал. Вычисл. для C26H28FN3О5: C, 64,85; H, 5,86; N, 8,73.
Найдено: C, 64,65; H, 5,92; N, 8,46.
Пример 94
транс-4-(1-((2-(1-Метил-3-пиррролил)-6-бензоксазолил)ацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоновая кислота:
(Стадия 1) Синтез метил-(2-(1-метил-2-пирролил)-6-бензоксазолил)ацетата
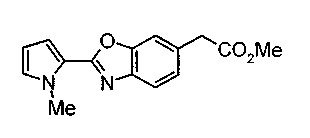
В этаноле (10 мл) 1-метилпиррол-2-карбальдегид (0,33 мл, 3,09 ммоль) и метил-4-амино-3-гидроксифенилацетат (559 мг, 3,09 ммоль) перемешивают в течение 4 часов при комнатной температуре. К реакционной смеси добавляют иодбензолдиацетат (1,19 г, 3,70 ммоль). После перемешивания при комнатной температуре в течение 30 минут реакционную смесь перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси н-гексан-этилацетат (3:1, об./об.) метил-(2-(1-метил-2-пирролил)-6-бензоксазолил)ацетат (228 мг, 27%) получают в виде желтого твердого вещества.
1H-ЯМР (CDCl3) δ: 3,71 (с, 3H), 3,75 (с, 2H), 4,13 (с, 3H), 6,24 (дд, J=3,9,1,7 Гц, 1H), 6,86 (м, 1H), 7,06 (дд, J=3,9, 1,7 Гц, 1H), 7,20 (дд, J=8,1,1,7 Гц, 1H), 7,45 (д, J=1,0 Гц, 1H), 7,61 (д, J=8,3 Гц, 1H).
МС (ESI) m/z 270 (M+).
(Стадия 2) Синтез (2-(1-метил-2-пирролил)-6-бензоксазолил)уксусной кислоты
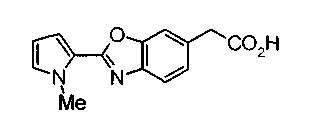
К метил-(2-(1-метил-2-пирролил)-6-бензоксазолил)ацетату (228 мг, 0,84 ммоль) добавляют ТГФ (8,5 мл) и 0,25 н. NaOH (5,10 мл, 1,27 ммоль). Образовавшуюся смесь перемешивают при комнатной температуре в течение 5 часов. Реакционную смесь выливают в 1 н. HCl (10 мл). Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при пониженном давлении, получая при этом (2-(1-метил-2-пирролил)-6-бензоксазолил)уксусную кислоту (144 мг, 67%) в виде светло-желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 3,69 (с, 2H), 4,06 (с, 3H), 6,21 (м, 1H), 6,99 (м, 1H), 7,17 (д, J=2,2 Гц, 1H), 7,22 (д, J=8,1 Гц, 1H), 7,56 (с, 1H), 7,61 (д, J=8,1 Гц, 1H), 12,36 (ушир.с, 1Н).
МС (ESI) m/z 256 (M+).
(Стадия 3) Синтез метил-транс-4-(1-((2-(1-метил-2-пиррролил)-6-бензоксазолил)ацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилата
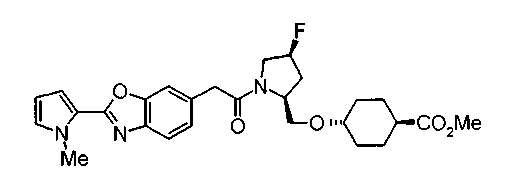
К (2-(1-метил-2-пирролил)-6-бензоксазолил)уксусной кислоте, метил-транс-4-((4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилату (соединение, синтезированное в стадии (3) примера 21) (146 мг, 0,56 ммоль), HOBt (15,0 мг, 0,11 ммоль) и DMAP (14,0 мг, 0,11 ммоль) добавляют ДМФ (6,0 мл) и EDC·HCl (162 мг, 0,83 ммоль). Образовавшуюся смесь перемешивают при комнатной температуре в течение 24 часов. К реакционной смеси добавляют воду с последующей экстракцией этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из этилацетатных элюатных фракций метил-транс-4-(1-((2-(1-метил-2-пиррролил)-6-бензоксазолил)ацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилат (271 мг, 97%) получают в виде светло-желтого твердого вещества.
1H-ЯМР (CDCl3) δ: 1,20-1,33 (м, 2H), 1,39-1,54 (м, 2H), 1,97-2,51 (м, 7H), 3,26 (м, 1H), 3,35 и 3,51 (каждый м, общий 1H), 3,65 и 3,67 (каждый с, общий 3H), 3,69-4,06 (м, 5H), 4,24 и 4,39 (каждый м, общий 1H), 5,24 (м, 1H), 6,24 (м, 1H), 6,86 (м, 1H), 7,06 (м, 1H), 7,18 (м, 1H), 7,44 (м, 1H), 7,60 (м, 1H).
МС (ESI) m/z 498 (M++1).
(Стадия 4) Синтез транс-4-(1-((2-(1-метил-2-пиррролил)-6-бензоксазолил)ацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоновой кислоты
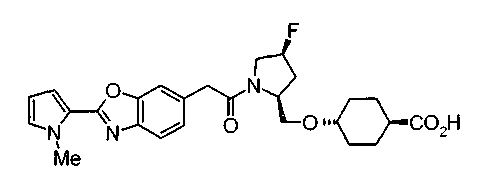
К метил-транс-4-(1-((2-(1-метил-2-пиррролил)-6-бензоксазолил)ацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилату (271 мг, 0,54 ммоль) добавляют ТГФ (5,5 мл) и 0,25 н. NaOH (3,27 мл, 0,82 ммоль). Образовавшуюся смесь перемешивают при комнатной температуре в течение 3 часов. Реакционную смесь выливают в 1 н. HCl (10 мл). Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при пониженном давлении, получая при этом указанное в заголовке соединение (237 мг, 91%) в виде бесцветного твердого вещества.
ИК (ATR) ν 2938, 2861, 1718, 1644, 1627, 1575, 1523, 1423 см-1;
1H-ЯМР (ДМСО-d6) δ: 1,09-1,39 (м, 4H), 1,84-2,27 (м, 7H), 3,15-4,03 (м, 7H), 4,06 (с, 3H), 4,12 и 4,32 (каждый м, общий 1H), 5,30 и 5,36 (каждый м, общий 1H), 6,21 (м, 1H), 6,98 (м, 1H), 7,16-7,20 (м, 2H), 7,49 и 7,51 (каждый м, общий 1H), 7,59 и 7,60 (каждый д, J=8,1 Гц, общий 1H), 12,01 (ушир.с, 1H).
МС (ESI) m/z 484 (M++1);
Анал. Вычисл. для C26H30FN3О5: С, 64,58; H, 6,25; N, 8,69.
Найдено: С, 64,35; H, 6,28; N, 8,49.
Пример 95
транс-4-(1-(2-(1-Нафтил)-6-бензоксазолилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоновая кислота:
(Стадия 1) Синтез метил-(2-(1-нафтил)-6-бензоксазолил)ацетата
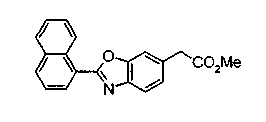
В EtOH (8 мл) 1-нафтальдегид (263 мг, 1,68 ммоль) и метил-4-амино-3-гидроксифенилацетат (305 мг, 1,68 ммоль) перемешивают при комнатной температуре в течение 12 часов. К реакционной смеси добавляют иодбензолдиацетат (651 мг, 2,02 ммоль) с последующим перемешиванием при комнатной температуре в течение 5 минут. После удаления растворителя перегонкой реакционной смеси при пониженном давлении остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси н-гексан/этилацетат (6:1, об./об.) метил-(2-(1-нафтил)-6-бензоксазолил)ацетат (223 мг, 42%) получают в виде светло-желтого твердого вещества.
1H-ЯМР (CDCl3) δ: 3,73 (с, 3H), 3,79 (с, 2H), 7,29-7,31 (м, 1H), 7,56-7,61 (м, 3H), 7,68-7,76 (м, 1H), 7,80-7,82 (м, 1H), 7,91-7,94 (м, 1H), 8,01-8,03 (м, 1H), 8,39-8,41 (м, 1H), 9,42-9,45 (м, 1H).
МС (ESI) m/z 318 (M++1).
(Стадия 2) Синтез (2-(1-нафтил)-6-бензоксазолил)уксусной кислоты
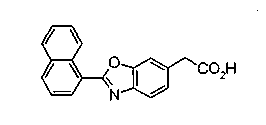
К метил-(2-(1-нафтил)-6-бензоксазолил)ацетату (223 мг, 0,70 ммоль) добавляют ТГФ (4 мл) и 0,5 н. NaOH (4,2 мл, 2,10 ммоль). Образовавшуюся смесь перемешивают при комнатной температуре в течение 2 дней. Реакционную смесь подкисляют смесью лед - 1 н. HCl. Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при пониженном давлении, получая при этом (2-(1-нафтил)-6-бензоксазолил)уксусную кислоту (194 мг, 91%) в виде светло-желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 3,78 (с, 2H), 7,34-7,36 (м, 1H), 7,65-7,78 (м, 4H), 7,84 (д, J=8,1 Гц, 1H), 8,09 (д, J=8,1 Гц, 1H), 8,21-8,23 (м, 1H), 8,43-8,45 (м, 1H), 9,40-9,42 (м, 1H). (Стадия 3) Синтез метил-транс-4-(1-(2-(1-нафтил)-6-бензоксазолилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилата
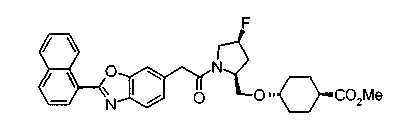
В ДМФ (7 мл) (2-(1-нафтил)-6-бензоксазолил)уксусную кислоту (194 мг, 0,64 ммоль), метил-транс-4-((4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилат (соединение, синтезированное в (стадии 3) примера 21) (166 мг, 0,64 ммоль), EDC·HCl (184 мг, 0,96 ммоль), HOBt (130 мг, 0,96 ммоль) и триэтиламин (134 мкл, 0,96 ммоль) перемешивают при комнатной температуре в течение 13 часов. К реакционной смеси добавляют воду с последующей экстракцией этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем с выделением из элюатных фракций смеси хлороформ-метанол (от 100:1 до 60:1, об./об.) метил-транс-4-(1-(2-(1-нафтил)-6-бензоксазолилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилата (310 мг, 89%), полученного в виде светло-желтого твердого вещества.
1H-ЯМР (CDCl3) δ: 1,21-1,53 (м, 4H), 1,96-2,51 (м, 7H), 3,25-3,54 (м, 2H), 3,63-4,10 (м, 8H), 4,25-4,30 и 4,40 (каждый м, общий 1H), 5,17-5,19 и 5,31-5,32 (каждый м, общий 1H), 7,27-7,29 (м, 1H), 7,56-7,61 (м, 3H), 7,68-7,72 (м, 1H), 7,79-7,82 (м, 1H), 7,93 (д, J=8,1 Гц, 1H), 8,02 (д, J=8,1 Гц, 1H), 8,39-8,41 (м, 1H), 9,43-9,45 (м, 1H).
МС (ESI) m/z 545 (M++1).
(Стадия 4) Синтез транс-4-(1-(2-(1-нафтил)-6-бензоксазолилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоновой кислоты
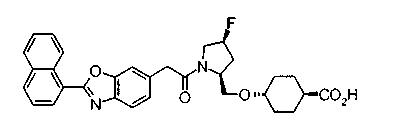
К метил-транс-4-(1-(2-(1-нафтил)-6-бензоксазолилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилату (310 мл, 0,57 ммоль) добавляют ТГФ (3,0 мл) и 0,5 н. NaOH (3,4 мл, 1,70 ммоль). Образовавшуюся смесь перемешивают при комнатной температуре в течение 13 часов. Реакционную смесь подкисляют смесью лед-1 н. HCl. Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при пониженном давлении, получая при этом указанное в заголовке соединение (110 мг, 33%) в виде белого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 1,11-1,36 (м, 4H), 1,83-2,20 (м, 7H), 3,19-4,01 (м, 7H), 4,14 и 4,36-4,38 (каждый м, общий 1H), 5,25-5,31 и 5,38-5,45 (каждый м, общий 1H), 7,28-7,32 (м, 1H), 7,64-7,85 (м, 5H), 8,09 (д, J=8,0 Гц, 1H), 8,21 (д, J=8,0 Гц, 1H), 8,42-8,44 (м, 1H), 9,40-9,42 (м, 1H).
МС (ESI) m/z 531 (M++1);
Анал. Вычисл. для С31Н31FN2O5·1/2H2О: C, 69,00; H, 5,98; N, 5,19.
Найдено: C, 69,11; H, 5,76; N, 5,17.
Пример 96
транс-4-(1-((2-(5-Хлор-1-метил-3-индолил)-6-бензоксазолил)ацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоновая кислота:
(Стадия 1) Синтез 5-хлор-1-метилиндола
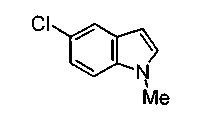
В ДМФ (65 мл) растворяют 5-хлориндол (5,00 г, 33,0 ммоль) с последующим добавлением по частям гидрида натрия (60% в масле, 1,45 г, 36,3 ммоль) при перемешивании при 0°С. После перемешивания реакционной смеси дополнительно в течение 30 минут при такой же температуре добавляют метилиодид (2,46 мл, 39,6 ммоль). Образовавшуюся смесь перемешивают при 0°С в течение 30 минут. К реакционной смеси добавляют ледяную воду с последующей экстракцией этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси н-гексан-этилацетат (3:1, об./об) 5-хлор-1-метилиндол (5,89 г, 100%) получают в виде желтого масла
1H-ЯМР (CDCl3) δ: 3,78 (с, 3H), 6,42 (д, J=3,2 Гц, 1H), 7,06 (д, J=3,2 Гц, 1H), 7,17 (дд, J=8,3 Гц, 1H), 7,23 (д, J=8,3 Гц, 1H), 7,59 (д, J=1,9 Гц, 1H).
(Стадия 2) Синтез 5-хлор-1-метилиндол-3-карбальдегида
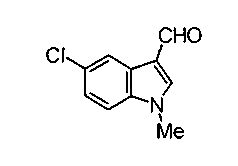
При перемешивании в ДМФ (70 мл) при 0°С по каплям добавляют фосфорилхлорид (4,97 мл, 53,3 ммоль). После завершения добавления реакционную смесь перемешивают далее в течение 10 минут при такой же температуре. Добавляют раствор 5-хлор-1-метилиндол (5,89 г, 35,6 ммоль) в ДМФ (10 мл). Образовавшуюся смесь перемешивают при 60°С в течение 6 часов. Реакционную смесь охлаждают до комнатной температуры и добавляют по частям к насыщенному водному раствору бикарбоната натрия с последующей экстракцией хлороформом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом магния и перегоняют при пониженном давлении для удаления растворителя при пониженном давлении. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из этилацетатных элюатных фракций 5-хлор-1-метилиндол-карбальдегид (5,51 г, 80%) получают в виде бесцветного твердого вещества.
1H-ЯМР (CDCl3) δ: 3,87 (с, 3H), 7,27 (д, J=8,5 Гц, 1H), 7,31 (дд, J=8,5,1,9 Гц, 1H), 7,69 (с, 1H), 8,30 (д, J=1,9 Гц, 1H), 9,96 (с, 1H).
МС (ESI) m/z 193 (M++1).
(Стадия 3) Синтез (2-(5-хлор-1-метил-3-индолил)-6-бензоксазолил)уксусной кислоты
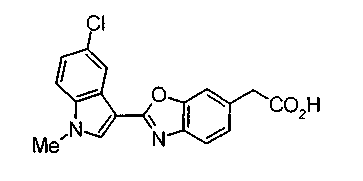
В EtOH (9,0 мл) 5-хлор-1-метилиндол-3-карбальдегид (534 мг, 2,76 ммоль) и метил-4-амино-3-гидроксифенилацетат (500 мг, 2,76 ммоль) перемешивают в течение нескольких часов. После добавления к реакционной смеси иодбензолдиацетата (2,03 г, 6,31 ммоль) и перемешивания смеси при комнатной температуре в течение 1 часа растворитель отгоняют при пониженном давлении. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси н-гексан-этилацетат (1:1, об./об.) получают смесь (594 мг) метил-(2-(5-хлор-1-метил-3-индолил)-6-бензоксазолил)ацетата и 5-хлор-1-метилиндол-3-карбоксальдегида. К образовавшейся смеси добавляют ТГФ (17 мл) и 0,25 н. NaOH (10,0 мл, 2,50 ммоль) и смесь перемешивают при комнатной температуре в течение 23 часов. Реакционную смесь перегоняют при пониженном давлении для удаления растворителя. К остатку добавляют 1 н. HCl (10 мл) с последующей экстракцией смесью хлороформ-метанол (4:1, об./об.). Экстракт сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя, получая при этом (2-(5-хлор-1-метил-3-индолил)-6-бензоксазолил)уксусную кислоту (88 мг, 9%) в виде коричневого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 3,73 (с, 2H), 3,94 (с, 3H), 7,25 (дд, J=8,1, 1,7 Гц, 1H), 7,36 (дд, 1H, J=8,8, l,7 Гц, 1H), 7,62-7,68 (м, 3H), 8,30 (д, J=1,7 Гц, 1H), 8,41 (с, 1H), 12,38 (ушир.с, 1H).
МС (ESI) m/z 341 (M++1).
(Стадия 4) Синтез метил-транс-4-(1-(2-(5-хлор-1-метил-3-индолил)-6-бензоксазолил)ацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилата

К (2-(5-хлор-1-метил-3-индолил)-6-бензоксазолил)уксусной кислоте (88,0 мг, 0,26 ммоль), метил-транс-4-((4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилату (соединение, синтезированное в стадии (3) примера 21) (67,0 мг, 0,26 ммоль), HOBt (10,0 мг, 0,05 ммоль) и DMAP (9,1 мг, 0,05 ммоль) добавляют ДМФ (3,0 мл) и EDC·HCl (74,0 мг, 0,39 ммоль). Образовавшуюся смесь перемешивают при комнатной температуре в течение 14 часов. К реакционной смеси добавляют воду с последующей экстракцией этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом магния и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из этилацетатных элюатных фракций метил-транс-4-(1-((2-(5-хлор-1-метил-3-индолил)-6-бензоксазолил)ацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилат (172 мг, 100%) получают в виде желтого масла.
1H-ЯМР (CDCl3) δ: 1,21-1,34 (м, 2H), 1,40-1,57 (м, 2H), 1,97-2,51 (м, 7H), 3,27 (м, 1H), 3,36 и 3,52 (каждый м, общий 1H), 3,64 и 3,66 (каждый с, общий 3H), 3,67-3,86 (м, 3H), 3,89 (с, 3H), 3,91-4,15 (м, 2H), 4,26 и 4,40 (каждый м, общий 1H), 5,26 (м, 1H), 7,21 (м, 1H), 7,27-7,31 (м, 2H), 7,51 (м, 1H), 7,65 (м, 1H), 7,92 (м, 1H), 8,44 (м, 1H).
МС (ESI) m/z 582 (M++1).
(Стадия 5) Синтез транс-4-(1-((2-(5-хлор-1-метил-3-индолил)-6-бензоксазолил)ацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоновой кислоты
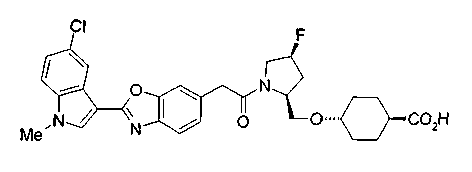
К метил-транс-4-(1-((2-(5-хлор-1-метил-3-индолил)-6-бензоксазолил)ацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилату (172 мг, 0,30 ммоль) добавляют ТГФ (3,0 мл) и 0,25 н. NaOH (1,80 мл, 0,44 ммоль). Образовавшуюся смесь перемешивают при комнатной температуре в течение 3 часов. Реакционную смесь выливают в 1 н. HCl (10 мл). Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при пониженном давлении, получая при этом указанное в заголовке соединение (110 мг, 65%) в виде желтого твердого вещества.
ИК (ATR) ν 2938, 2863, 1720, 1629, 1581, 1434 см-1;
1H-ЯМР (ДМСО-d6) δ: 1,13-1,40 (м, 4H), 1,85-2,07 (м, 4H), 2,11-2,44 (м, 3H), 3,19-3,52 (м, 2H), 3,72-3,90 (м, 6H), 3,94 (с, 3H), 4,07 и 4,35 (каждый м, общий 1H), 5,31 и 5,37 (каждый м, общий 1H), 7,20 (м, 1H), 7,35 (дд, J=8,8, 2,0 Гц, 1H), 7,55 (д, J=8,3 Гц, 1H), 7,64-7,66 (м, 2H), 8,29 (д, J=2,0 Гц, 1H), 8,40 (с, 1H), 12,02 (ушир.с, 1H).
МС (ESI) m/z 568 (M++1);
Анал. Вычисл. для С30Н31ClFN3O5·1,25H2О: C, 61,01; H, 5,72; N, 7,12.
Найдено: C, 61,36; H, 5,74; N, 6,37.
Пример 97
транс-4-(1-((2-(1-Метил-3-(1Н-пирроло(2,3-b)пиридинил))-6-бензоксазолил)ацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоновая кислота:
(Стадия 1) Синтез 1-метил-1Н-пирроло(2,3-b)пиридина

В ДМФ (85 мл) растворяют 1Н-пирроло(2,3-b)пиридин (5,00 г, 42,3 ммоль) с последующим добавлением по частям гидрида натрия (60% в масле, 1,86 г, 46,6 ммоль) при перемешивании при 0°С. После перемешивания при 0°С в течение 30 минут к реакционной смеси добавляют метилиодид (3,16 мл, 50,8 ммоль). Смесь перемешивают при такой же температуре в течение 30 минут. К реакционной смеси добавляют ледяную воду с последующей экстракцией этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси хлороформ-этилацетат (1:1, об./об.) 1-метил-1Н-пирроло(2,3-d)пиридин (4,87 г, 87%) получают в виде бесцветного масла
1H-ЯМР (CDCl3): 3,90 (с, 3H), 6,45 (д, J=3,4 Гц, 1H), 7,05 (дд, J=7,8, 4,6 Гц, 1H), 7,18 (д, J=3,4 Гц, 1H), 7,90 (дд, J=7,8,l-5 Гц, 1H), 8,33 (дд, J=4,6, l,5 Гц, 1h).
(Стадия 2) Синтез 1-метил-1Н-пирроло(2,3-b)пиридин-3-карбальдегида
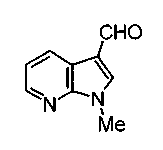
Фосфорилхлорид (5,15 мл, 55,3 ммоль) добавляют по каплям к ДМФ (70 мл) при перемешивании при 0°С.После перемешивания реакционной смеси при 0°С в течение 10 минут добавляют по каплям раствор 1-метил-1Н-пирроло(2,3-b)пиридина (4,87 г, 36,8 ммоль) в ДМФ (5 мл) при такой же температуре. После завершения добавления реакционную смесь перемешивают при 0°С в течение 4 часов и при 60°С в течение 3,5 часа. Реакционную смесь выливают в смесь ледяная вода-насыщенный водный раствор бикарбоната натрия для нейтрализации ею смеси с последующей экстракцией хлороформом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из этилацетатных элюатных фракций 1-метил-1Н-пирроло(2,3-b)пиридин-3-карбальдегид (4,87 г, 83%) получают в виде желтого твердого вещества
1H-ЯМР (CDCl3) δ: 3,98 (с, 3H), 7,28 (дд, J=7,8, 4,7 Гц, 1H), 7,85 (с, 1H), 8,44 (д, J=4,7 Гц, 1H), 8,55 (д, J=7,8 Гц, 1H), 9,97 (с, 1H).
МС (ESI) m/z 160 (M+-H).
(Стадия 3) Синтез (2-(1-метил-3-(1Н-пирроло(2,3-b)пиридинил))-6-бензоксазолил)уксусной кислоты
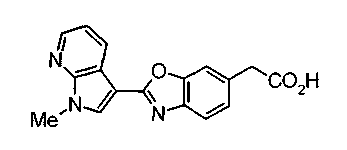
В этаноле (10 мл) 1-метил-1Н-пирроло(2,3-b)пиридин-3-карбальдегид (500 мг, 3,12 ммоль) и метил-4-амино-3-гидроксифенилацетат (566 мг, 3,12 ммоль) перемешивают в течение 20 часов при комнатной температуре. К реакционной смеси добавляют иодбензолдиацетат (1,21 г, 3,75 ммоль) с последующим перемешиванием при комнатной температуре в течение 1 часа. Реакционную смесь перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси н-гексан-этилацетат (1:1, об./об.) получают смесь (1,10 г) метил-(2-(1-метил-3-(1Н-пирроло(2,3-b)пиридинил))-6-бензоксазолил)ацетата и 1-метил-1Н-пирроло(2,3-b)пиридин-3-карбальдегида в виде черного твердого вещества.
1H-ЯМР (CDCl3) δ: 3,74 (с, 3H), 3,79 (с, 2H), 4,02 (с, 3H), 7,25-7,32 (м, 2H), 7,52 (с, 1H), 7,67 (д, J=8,1 Гц, 1H), 8,07 (с, 1H), 8,47 (м, 1H), 8,71 (д, J=7,8 Гц, 1H).
МС (ESI) m/z 322 (M++1).
К смеси (1,10 г) добавляют ТГФ (35 мл) и 0,25 н. NaOH (20,6 мл, 5,15 ммоль) и образовавшуюся смесь перемешивают в течение 2 часов при комнатной температуре. Реакционную смесь выливают в 1 н. HCl (20 мл). Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при пониженном давлении, получая при этом (2-(1-метил-3-(1Н-пирроло(2,3-b)пиридинил))-6-бензоксазолил)уксусную кислоту (578 г, 62%) в виде коричневого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 3,74 (с, 2H), 3,96 (с, 3H), 7,26 (дд, J=8,1,1,5 Гц, 1H), 7,36 (дд, J=7,8, 4,7 Гц, 1Н), 7,62 (д, J=1,5 Гц, 1H), 7,65 (д, J=8,l Гц, 1H), 8,45 (дд, J=4,7, 1,5 Гц, 1Н), 8,53 (с, 1H), 8,62 (дд, J=7,8, l,5 Гц, 1H), 12,37 (ушир. с, 1H).
МС (ESI) m/z 308 (M++1).
(Стадия 4) Синтез метил-транс-4-(1-((2-(1-метил-3-(1Н-пирроло(2,3-b)пиридинил))-6-бензоксазолил)ацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилата
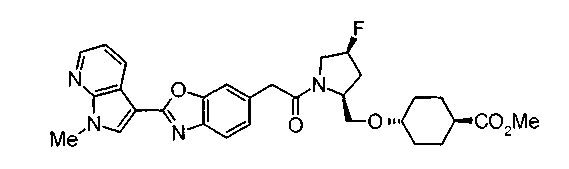
К (2-(1-метил-3-(1Н-пирроло(2,3-b)пиридинил))-6-бензоксазолил)уксусной кислоте (250 мг, 0,81 ммоль), метил-транс-4-((4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилату (соединение, синтезированное в стадии (3) примера 21) (211 мг, 0,81 ммоль), HOBt (22,0 мг, 0,16 ммоль) и DMAP (20,0 мг, 0,16 ммоль) добавляют ДМФ (8,5 мл) и EDC. HCl (234 мг, 1,22 ммол). Образовавшуюся смесь перемешивают при комнатной температуре в течение 14 часов. К реакционной смеси добавляют воду с последующей экстракцией этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом магния и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из этилацетатных элюатных фракций метил-транс-4-(1-((2-(1-метил-3-(1Н-пирроло(2,3-b)пиридинил))-6-бензоксазолил)ацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилат (419 мг, 94%) получают в виде желтого твердого вещества.
1H-ЯМР (CDCl3) δ: 1,18-1,34 (м, 2H), 1,39-1,53 (м, 2H), 1,97-2,51 (м, 7H), 3,27 (м, 1H), 3,36 и 3,51 (каждый м, общий 1H), 3,98-3,64 (м, 8H), 4,01 (с, 3H), 4,26 и 4,40 (каждый м, общий 1H), 5,25 (м, 1H), 7,20 (м, 1H), 7,29 (м, 1H), 7,51 (м, 1H), 7,65 (дд, J=8,1, 5,6 Гц, 1H), 8,05 (д, J=1,8 Гц, 1H), 8,45 (д, J=5,6 Гц, 1H), 8,69 (дд, J=8,1, 1,8 Гц, 1H).
МС (ESI) m/z 549 (M++1).
(Стадия 5) Синтез транс-4-(1-((2-(1-метил-3-(1Н-пирроло(2,3-b)пиридинил))-6-бензоксазолил)ацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоновой кислоты
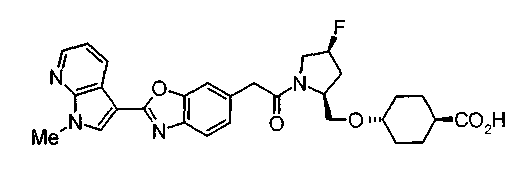
К метил-транс-4-(1-((2-(1-метил-3-(1Н-пирроло(2,3-b)пиридинил))-6-бензоксазолил)ацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилату (411 мг, 0,75 ммоль) добавляют ТГФ (7,5 мл) и 0,25 н. NaOH (4,50 мл, 1,12 ммоль). Образовавшуюся смесь перемешивают при комнатной температуре в течение 19 часов. Добавлением 1 н. HCl рН реакционной смеси регулируют до 6. Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при пониженном давлении, получая при этом указанное в заголовке соединение (281 мг, 70%) в виде желтого твердого вещества.
ИК (ATR) ν 2940, 2861, 1716, 1631, 1569, 1525, 1486, 1442 см-1;
1H-ЯМР (ДМСО-d6) δ: 1,13-1,37 (м, 4H), 1,85-2,09 (м, 4H), 2,11-2,21 (м, 3H), 3,17-3,31 (м, 2H), 3,45 и 3,58 (м, общий 1H), 3,72-3,92 (м, 4H), 3,96 (с, 3H), 4,15 и 4,35 (каждый м, общий 1H), 5,32 и 5,37 (каждый м, общий 1H), 7,21 (м, 1H), 7,35 и 7,36 (каждый д, J=8,1 Гц, общий 1H), 7,55 и 7,57 (каждый с, общий 1H), 7,61 и 7,62 (каждый д, J=8,l Гц, общий 1H), 8,44 (дд, J=4,7, 1,5 Гц, 1H), 8,53 (с, 1H), 8,61 (дд, J=7,8, 1,5 Гц, 1H), 11,99 (ушир.с, 1H).
МС (ESI) m/z 535 (M++1);
Анал. Вычисл. для С30Н32FN3O5 ·0,75H2О: C, 63,55; H, 5,98; N, 10,22.
Найдено: C, 63,67; H, 5,91; N, 10,22.
Пример 98
транс-4-(1-((7-Фтор-2-(1-метил-3-индолил)-6-бензоксазолил)ацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоновая кислота:
(Стадия 1) Синтез метил-(7-фтор-2-(1-метил-3-индолил)-6-бензоксазолил)ацетата
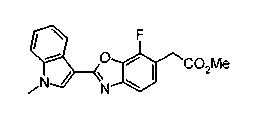
(Способ А)
К 1-метилиндол-3-карбоновой кислоте (917 мг, 5,23 ммоль) добавляют метиленхлорид (20 мл). При перемешивании при 0°С добавляют оксалилхлорид (0,68 мл, 7,85 ммоль) и ДМФ (каталитическое количество). После перемешивания при комнатной температуре в течение 1,5 часа реакционную смесь перегоняют при пониженном давлении для удаления растворителя. К остатку добавляют ксилол (20 мл). К образовавшейся смеси добавляют метил-(4-амино-2-фтор-3-гидроксифенил)ацетат (1,0 г, 5,0 ммоль) и борную кислоту (539 мг, 8,72 ммоль) с последующим перемешиванием при 160°С в течение 3 дней. После охлаждения реакционной смеси до комнатной температуры к ней добавляют ледяную воду с последующей экстракцией этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток подвергают хроматографии на колонке с силикагелем при сборе элюатных фракций смеси хлороформ/этилацетат (10/1) и затем очищают хроматографией с использованием тонкослойной пластины, посредством чего из элюатных фракций смеси хлороформ/ацетон (10/1) метил-7-фтор-2-(1-метил-3-индолил)-6-бензоксазолилацетат (62 мг, 4%) получают в виде светло-коричневого твердого вещества.
1H-ЯМР (CDCl3) δ: 3,73 (с, 3H), 3,81 (с, 2H), 3,88 (с, 3H), 7,15 и 7,17 (каждый д, каждый J=6,4 Гц, общий 1H, амидные изомеры), 7,34-7,40 (м, 3H), 7,44 (д, J=8,1 Гц, 1H), 7,94 (с, 1H), 8,43 (м, 1H).
МС (ESI) m/z 339 (M++1).
(Способ В)
В метаноле (50 мл) 3-формил-1-метилиндол (796 мг, 5,0 ммоль), метил-(4-амино-2-фтор-3-гидроксифенил)ацетат (1,0 г, 5,0 ммоль) и молекулярные сита 4Å (10 г) перемешивают при комнатной температуре в течение 5 часов и затем при 70°С в течение 3 часов. Реакционную смесь охлаждают до комнатной температуры и к ней добавляют иодбензолдиацетат (5,0 ммоль). После перемешивания при комнатной температуре в течение 14 часов реакционную смесь перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси н-гексан-этилацетат (3/1) метил-7-фтор-2-(1-метил-3-индолил)-6-бензоксазолилацетат (860 мг, включая примеси) получают в виде светло-коричневого твердого вещества. Соединение используют для следующей реакции без дополнительной очистки.
(Стадия 2) Синтез (7-фтор-2-(1-метил-3-индолил)-6-бензоксазолил)уксусной кислоты
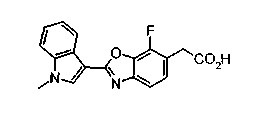
Метил-7-фтор-2-(1-метил-3-индолил)-6-бензоксазолилацетат (860 мг, продукт, полученный способом А стадии 1) растворяют в смеси ТГФ/метанол (20/10 мл). К образовавшемуся раствору добавляют 1 н. NaOH (20 мл) с последующим перемешиванием при комнатной температуре в течение 1,5 часа. Реакционную смесь затем перегоняют при пониженном давлении для удаления растворителя. К полученному таким образом остатку добавляют эфир и 1 н. NaOH для разделения смеси на слои. Водный слой подкисляют 1 н. HCl с последующей экстракцией этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя, в результате чего (7-фтор-2-(1-метил-3-индолил)-6-бензоксазолил)уксусную кислоту (350 мг, 22%) получают в виде темно-зеленого твердого вещества. Соединение используют для следующей реакции без дополнительной очистки.
1H-ЯМР (CDCl3-CD3OD) δ: 3,56 (с, 3H), 3,91 (с, 2H), 7,36 (м, 3H), 7,79 (с, 1H), 8,26 (д, J=6,8 Гц, 1H), 9,93 (с, 1H).
МС (ESI) m/z 325 (M++1).
(Стадия 3) Синтез метил-транс-4-(1-((7-Фтор-2-(1-метил-3-индолил)-6-бензоксазолил)ацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилата
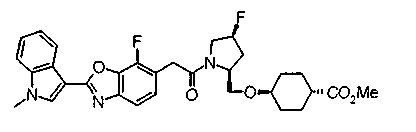
Смесь (7-фтор-2-(1-метил-3-индолил)-6-бензоксазолил)уксусной кислоты (350 мг, 1,08 ммоль), метил-транс-4-((4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилата (соединение, синтезированное в стадии (3) примера 21) (280 мг, 1,08 ммоль), EDC·HCl (311 мг, 1,62 ммоль), HOBt (219 мг, 1,62 ммоль) и триэтиламина (0,75 мл, 5,40 ммоль) перемешивают в течение 7 часов в ДМФ (10 мл). Реакционную смесь выливают в ледяную воду с последующей экстракцией этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси н-гексан/этилацетат (3/1) метил-транс-4-(1-((7-Фтор-2-(1-метил-3-индолил)-6-бензоксазолил)ацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилат (360 мг, 59%) получают в виде коричневого масла.
1H-ЯМР (CDCl3) δ: 1,21-1,65 (м, 4H), 1,95-2,56 (м, 7H), 3,21-3,39 (м, 2H), 3,56 (дд, J=8,8, 6,8 Гц, 1H), 3,64 и 3,67 (каждый с, общий 3H, амидные изомеры), 3,68-3,90 (м, 3H), 3,92 (с, 3H), 4,00 и 4,03 (каждый с, общий 1H), 4,31-4,42 (м, 1H), 5,19-5,39 (м, 1H), 7,20 (кв., J=8,5 Гц, 1H), 7,36-7,48 (м, 4H), 7,98 (с, 1H), 8,45 (м, 1H).
МС (ESI) m/z 566 (M++1).
(Стадия 4) Синтез транс-4-(1-((7-Фтор-2-(1-метил-3-индолил)-6-бензоксазолил)ацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоновой кислоты
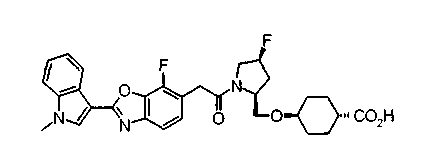
К метил-транс-4-(1-((7-Фтор-2-(1-метил-3-индолил)-6-бензоксазолил)ацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилату (130 мг, 0,23 ммоль) добавляют смесь ТГФ/метанол (10/5 мл) и 1 н. NaOH (4 мл). Образовавшуюся смесь перемешивают при комнатной температуре в течение 13 часов. Реакционную смесь перегоняют при пониженном давлении для удаления растворителя. Остаток затем подкисляют 1 н. HCl. Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при пониженном давлении, получая при этом указанное в заголовке соединение (93 мг, 74%) в виде коричневого твердого вещества.
ИК (ATR) ν 2941, 2864, 1716, 1628, 1583, 1504, 1442, 1369 см-1;
1H-ЯМР (ДМСО) δ: 1,13-1,43 (м, 5H), 1,82-2,36 (м, 7H), 3,24 (м, 1H), 3,46-3,93 (м, 4H), 3,95 (с, 3H), 4,11 и 4,15 (каждый с, общий 1H, амидные изомеры), 4,42 (м, 1H), 5,25-5,50 (м, 1H), 7,22 (м, 1H), 7,35 (м, 2H), 7,48 и 7,50 (каждый т, J=4,4 и 3,6 Гц соответственно, общий 1H, амидные изомеры), 7,63 (д, J=6,6 Гц, 1H), 8,29 (д, J=7,3 Гц, 1H), 8,44 и 8,45 (каждый с, общий 1H, амидные изомеры).
МС (ESI) m/z 522 (M++1);
Анал. Вычисл. для С30Н31F2N3O5·1H2О: C, 63,26; H, 5,84; N, 7,38.
Найдено: С, 63,52; H, 5,77; N, 7,25.
Пример 99
транс-4-(1-((2-(6-Фтор-1-метил-3-индолил)-6-бензоксазолил)ацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоновая кислота:
(Стадия 1) Синтез 6-фтор-1-метилиндола

В ДМФ (65 мл) растворяют 6-фториндол (6,10 г, 45,1 ммоль). При перемешивании при 0°С частями добавляют гидрид натрия (60% в масле, 1,45 г, 36,3 ммоль). После перемешивания при 0°С в течение 30 минут к реакционной смеси добавляют метилиодид (2,46 мл, 39,6 ммоль). Реакционную смесь перемешивают далее при такой же температуре в течение 2,5 часа. Добавляют насыщенный водный раствор хлорида аммония с последующей экстракцией этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси н-гексан-этилацетат (5:1, об./об.) 6-фтор-1-метилиндол (6,71 г, 99%) получают в виде желтого масла.
1H-ЯМР (CDCl3) δ: 3,73 (с, 3H), 6,45 (д, J=3,2 Гц, 1H), 6,86 (ддд, J=9,8, 8,5, 2,2 Гц, 1H), 6,98 (дд, J=9,8, 2,2 Гц, 1H), 7,01 (д, J=3,2 Гц, 1H), 7,51 (дд, J=8,5, 5,3 Гц, 1H).
МС (ESI) m/z 150 (M++1).
(Стадия 2) Синтез 6-фтор-1-метилиндол-3-карбальдегида
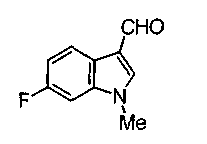
К фосфорилхлориду (5,87 мл, 63,0 ммоль) добавляют частями при перемешивании ДМФ (45 мл) при 0°С. После перемешивания при такой же температуре в течение 20 минут в реакционную смесь добавляют раствор 6-фтор-1-метилиндола (6,71 г, 45,0 ммоль) в ДМФ (45 мл) при 0°С. Реакционную смесь перемешивают в течение дополнительных 5 часов. К реакционной смеси добавляют ледяную воду и 1 н. NaOH для ее нейтрализации с последующей экстракцией этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом магния и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из этилацетатных элюатных фракций 6-фтор-1-метилиндол-3-карбальдегид (4,18 г, 52%) получают в виде бесцветного твердого вещества.
1H-ЯМР (CDCl3) δ: 3,85 (с, 3H), 7,03-7,11 (м, 2H), 7,68 (с, 1H), 8,25 (дд, J=8,8, 5,6 Гц, 1H), 9,97 (с, 1H).
МС (ESI) m/z 219 (M++1+CH3CN).
(Стадия 3) Синтез метил-(2-(6-фтор-1-метил-3-индолил)-6-бензоксазолил)уксусной кислоты
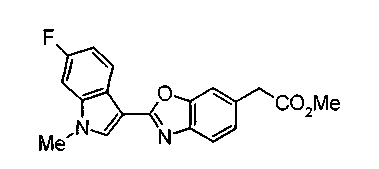
В этаноле (15 мл) 6-фтор-1-метилиндол-3-карбальдегид (500 мг, 2,82 ммоль) и метил-4-амино-3-гидроксифенилацетат (767 мг, 4,23 ммоль) перемешивают при комнатной температуре в течение 2 часов. Добавляют иодбензолдиацетат (1,09 г, 3,38 ммоль) и смесь перемешивают при комнатной температуре в течение 1 часа. Реакционную смесь затем перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси н-гексан-этилацетат (1:1, об./об.) метил-(2-(6-фтор-1-метил-3-индолил)-6-бензоксазолил)ацетат (889 мг, 93%) получают в виде коричневого твердого вещества.
1H-ЯМР (CDCl3) δ: 3,72 (с, 3H), 3,76 (с, 2H), 3,85 (с, 3H) 7,05-7,12 (м, 2H), 7,22 (дд, J=8,1, 1,5 Гц, 1H), 7,49 (д, J=1,5 Гц, 1H), 7,65 (д, J=8,1 Гц, 1H), 7,89 (с, 1H), 8,38 (дд, J=8,9, 5,4 Гц, 1H).
МС (ESI) m/z 339 (M++1).
(Стадия 4) Синтез (2-(6-фтор-1-метил-3-индолил)-6-бензоксазолил)уксусной кислоты
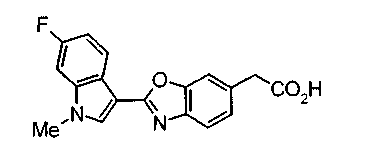
К метил-(2-(6-фтор-1-метил-3-индолил)-6-бензоксазолил)ацетату (889 мг, 2,63 ммоль) добавляют ТГФ (25 мл) и 0,25 н. NaOH (15,8 мл, 3,95 ммоль). Образовавшуюся смесь перемешивают при комнатной температуре в течение 4 часов. Реакционную смесь выливают в 1 н. HCl (30 мл). Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при пониженном давлении, получая при этом (2-(6-фтор-1-метил-3-индолил)-6-бензоксазолил)уксусную кислоту (741 мг, 87%) в виде коричневого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 3,71 (с, 2H), 3,94 (с, 3H), 7,18 (тд, J=9,5, 2,5 Гц, 1H), 7,23 (д, 1H, J=7,8 Гц, 1H), 7,59-7,64 (м, 3H), 7,97 (дд, J=9,5, 2,5 Гц, 1H), 8,39 (с, 1H), 12,35 (ушир.с, 1H).
МС (ESI) m/z 325 (M++1).
(Стадия 5) Синтез метил-транс-4-(1-((2-(6-Фтор-1-метил-3-индолил)-6-бензоксазолил)ацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилата
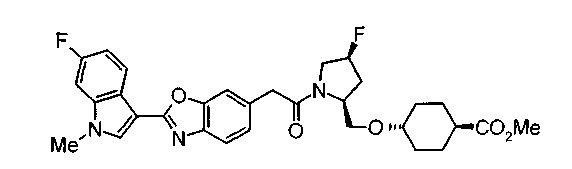
К (2-(6-фтор-1-метил-3-индолил)-6-бензоксазолил)уксусной кислоте (200 мг, 0,62 ммоль), метил-транс-4-((4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилату (соединение, синтезированное в стадии (3) примера 21) (160 мг, 0,62 ммоль), HOBt (17,0 мг, 0,12 ммоль) и DMAP (15,0 мг, 0,12 ммоль) добавляют ДМФ (6,0 мл) и EDC·HCl (142 мг, 0,74 ммоль). Образовавшуюся смесь перемешивают при комнатной температуре в течение 21 часа. К реакционной смеси добавляют воду с последующей экстракцией этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом магния и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из этилацетатных элюатных фракций метил-транс-4-(1-((2-(6-фтор-1-метил-3-индолил)-6-бензоксазолил)ацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилат (355 мг, 99%) получают в виде желтого аморфного вещества.
1H-ЯМР (CDCl3) δ: 1,16-1,32 (м, 2H), 1,38-1,51 (м, 2H), 1,95-2,48 (м, 7H), 3,24 (м, 1H), 3,34 и 3,49 (каждый м, общий 1H), 3,62 и 3,65 (каждый с, общий 3H), 3,83 (с, 3H), 3,90-4,06 (м, 2H), 4,25 и 4,37 (каждый м, общий 1H), 5,23 (м, 1H), 7,04-7,10 (м, 2H), 7,17 и 7,18 (каждый дд, J=7,8, 1,4 Гц, общий 1H), 7,46 и 7,47 (каждый д, J=1,4 Гц, 2H), 7,61 и 7,63 (каждый д, J=7,8 Гц, 1H), 7,87 (с, 1H), 8,35 (дд, J=8,5, 5,3 Гц, 1H).
МС (ESI) m/z 566 (M++1).
(Стадия 6) Синтез транс-4-(1-((2-(6-Фтор-1-метил-3-индолил)-6-бензоксазолил)ацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоновой кислоты
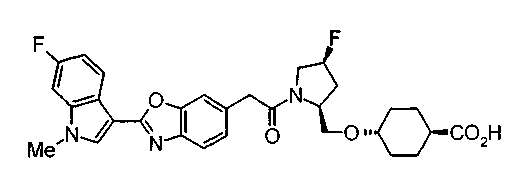
К метил-транс-4-(1-((2-(6-Фтор-1-метил-3-индолил)-6-бензоксазолил)ацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилату (355 мг, 0,63 ммоль) добавляют ТГФ (6,5 мл) и 0,25 н. NaOH (3,77 мл, 0,94 ммоль). Образовавшуюся смесь перемешивают при комнатной температуре в течение 15 часов. Реакционную смесь выливают в 1 н. HCl (10 мл). Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при пониженном давлении, получая при этом указанное в заголовке соединение (294 мг, 85%) в виде желтого твердого вещества.
ИК (ATR) ν 2938, 1712, 1616, 1577, 1434 см-1;
1H-ЯМР (ДМСО-d6) δ: 1,09-1,39 (м, 4H), 1,84-1,93 (м, 4H), 2,06-2,44 (м, 3H), 3,16-3,99 (м, 10H), 4,13 и 4,33 (каждый м, общий 1H), 5,30 и 5,36 (каждый м, общий 1H), 7,12-7,21 (м, 2H), 7,49 (дд, J=9,8, 2,2 Гц, 1H), 7,51 и 7,53 (каждый с, общий 1H), 7,60 и 7,61 (каждый д, J=8,1 Гц, общий 2H), 8,28 (дд, J=8,1, 5,6 Гц, 1H), 8,30 и 8,31 (каждый с, общий 1H), 12,03 (ушир.с, 1H).
МС (ESI) m/z 553 (M++2);
Анал. Вычисл. для С30Н31ClFN3O5·0,5H2О: C, 64,28; H, 5,75; N, 7,50.
Найдено: C, 64,59; H, 5,77; N, 7,44.
Пример 100
транс-4-(1-((2-(5-Фтор-1-метил-3-индолил)-6-бензоксазолил)ацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоновая кислота:
(Стадия 1) Синтез 5-фтор-1-метилиндол-3-карбальдегида
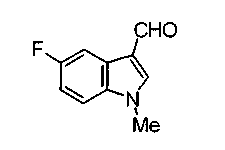
В ДМФ (60 мл) растворяют 5-фториндол-3-карбальдегид (5,00 г, 30,6 ммоль). При перемешивании при 0°С частями добавляют гидрид натрия (60% в масле, 1,35 г, 33,7 ммоль). После перемешивания реакционной смеси при такой же температуре в течение 1 часа к ней добавляют метилиодид (5,72 мл, 91,9 ммоль). Образовавшуюся смесь перемешивают далее при 0°С в течение 2 часов. К реакционной смеси добавляют насыщенный водный раствор хлорида аммония для нейтрализации ее с последующей экстракцией этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из этилацетатных элюатных фракций 5-фтор-1-метилиндол-3-карбальдегид (5,42 г, 100%) получают в виде бесцветного твердого вещества.
1H-ЯМР (CDCl3) δ: 3,88 (с, 3H), 7,09 (м, 1H), 7,29 (д, J=9,3,4,2 Гц, 1H), 7,71 (с, 1H), 7,98 (дд, J=9,3, 2,4 Гц, 1H), 9,96 (с, 1H).
МС (ESI) m/z 178 (M++1).
(Стадия 2) Синтез (2-(5-фтор-1-метил-3-индолил)-6-бензоксазолил)уксусной кислоты
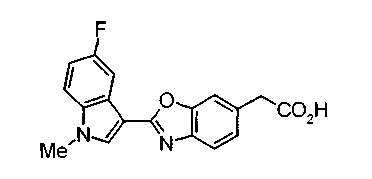
В этаноле (25 мл), 5-фтор-1-метилиндол-3-карбальдегид (989 мг, 5,58 ммоль) и метил-4-амино-3-гидроксифенилацетат (1,27 г, 6,99 ммоль) перемешивают при комнатной температуре в течение 9 часов. Добавляют иодбензолдиацетат (2,16 г, 6,69 ммоль) и смесь перемешивают далее при комнатной температуре в течение 18 часов. Реакционную смесь перегоняют при пониженном давлении для удаления растворителя. Таким образом полученный остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси н-гексан-этилацетат (1:2, об./об.) смесь (933 мг) метил-(2-(5-фтор-1-метил-3-индолил)-6-бензоксазолил)ацетата и 5-фтор-1-метилиндол-3-карбокальдегида получают в виде красного твердого вещества.
1H-ЯМР (CDCl3) δ: 3,73 (с, 3H), 3,77 (с, 2H), 3,89 (с, 3H) 7,10 (м, 1H), 7,22-7,28 (м, 2H), 7,50 (м, 1H), 7,65 (д, J=8,1 Гц, 1H), 7,92 (с, 1H), 8,11 (дд, J=9,3, 2,4 Гц, 1H).
МС (ESI) m/z 339 (M++1).
К смеси (933 мг) добавляют ТГФ (30 мл) и 0,25 н. NaOH (16,6 мл, 4,15 ммоль) и образовавшуюся смесь перемешивают при комнатной температуре в течение 3 часов. Реакционную смесь выливают в 1 н. HCl (30 мл). Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при пониженном давлении, получая при этом (2-(5-фтор-1-метил-3-индолил)-6-бензоксазолил)уксусную кислоту (434 мг, 24%) в виде коричневого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 3,72 (с, 2H), 3,90 (с, 3H), 7,15 (тд, J=9,8, 2,2 Гц, 1H), 7,23 (дд, J=8,1, l,2 Гц, 1H), 7,50 (дд, J=9,8, 2,2 Гц, 1H), 7,59 (д, J=1,2 Гц, 1Н), 1,62 (д, J=8,1 Гц, 1H), 8,29 (дд, J=8,8, 5,4 Гц, 1H), 8,33 (с, 1H), 12,37 (ушир.с, 1H).
МС (ESI) m/z 325 (M++1).
(Стадия 3) Синтез метил-транс-4-(1-((2-(5-Фтор-1-метил-3-индолил)-6-бензоксазолил)ацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилата
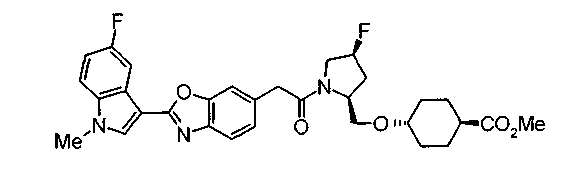
К (2-(5-фтор-1-метил-3-индолил)-6-бензоксазолил)уксусной кислоте (200 мг, 0,62 ммоль), метил-транс-4-((4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилату (соединение, синтезированное в стадии (3) примера 21), (160 мг, 0,62 ммоль), HOBt (17,0 мг, 0,12 ммоль) и DMAP (15,0 мг, 0,12 ммоль) добавляют ДМФ (6,0 мл) и EDC·HCl (142 мг, 0,74 ммоль). Образовавшуюся смесь перемешивают при комнатной температуре в течение 15 часов. К реакционной смеси добавляют воду с последующей экстракцией этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из этилацетатных элюатных фракций метил-транс-4-(1-((2-(5-Фтор-1-метил-3-индолил)-6-бензоксазолил)ацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилат (346 мг, 99%) получают в виде желтого аморфного вещества.
1H-ЯМР (CDCl3) δ: 1,17-1,34 (м, 2H), 1,39-1,53 (м, 2H), 1,97-2,51 (м, 7H), 3,26 (м, 1H), 3,35 и 3,51 (каждый м, общий 1H), 3,64 и 3,67 (каждый с, общий 3H), 3,90 (с, 3H), 3,91-4,13 (м, 2H), 4,26 и 4,40 (каждый м, общий 1H), 5,24 (м, 1H), 7,09 (м, 1H), 7,19 и 7,20 (каждый дд, J=7,8, 1,5 Гц, общий 1H), 7,48 и 7,50 (каждый д, J=1,5 Гц, 2H), 7,63 и 7,65 (каждый д, J=7,8 Гц, 1H), 7,94 (с, 1H), 8,12 (дд, J=9,5, 2,4 Гц, 1H).
МС (ESI) m/z 566 (M++1).
(Стадия 4) Синтез транс-4-(1-((2-(5-Фтор-1-метил-3-индолил)-6-бензоксазолил)ацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоновой кислоты

К метил-транс-4-(1-((2-(5-Фтор-1-метил-3-индолил)-6-бензоксазолил)ацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилату (346 мг, 0,61 ммоль) добавляют ТГФ (6,5 мл) и 0,25 н. NaOH (3,67 мл, 0,92 ммоль). Образовавшуюся смесь перемешивают при комнатной температуре в течение 15 часов. Реакционную смесь выливают в 1 н. HCl (10 мл). Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при пониженном давлении, получая при этом указанное в заголовке соединение (254 мг, 75%) в виде желтого твердого вещества.
ИК (ATR) ν 2938, 1716, 1616, 1631, 1577, 1484, 1434 см-1;
1H-ЯМР (ДМСО-d6) δ: 1,09-1,39 (м, 4H), 1,84-1,97 (м, 4H), 2,03-2,28 (м, 3H), 3,15-4,00 (м, 7H), 3,93 (с, 3H), 4,15 и 4,34 (каждый м, общий 1H), 5,30 и 5,36 (каждый м, общий 1H), 7,16-7,21 (м, 2H), 7,52 и 7,54 (каждый с, общий 1H), 7,61-7,64 (м, 2H), 7,97 (дд, J=9,8, 2,9 Гц, 1H), 8,36 и 8,37 (каждый с, общий 1H), 12,03 (ушир.с, 1H).
МС (ESI) m/z 553 (M++1);
Анал. Вычисл. для С30Н31ClFN3O5·0,5H2О: C, 64,28; H, 5,75; N, 7,50.
Найдено: C, 64,54; H, 5,75; N, 7,44.
Пример 101
транс-4-(1-((2-(5-Фтор-1-метил-3-индолил)-7-фтор-6-бензоксазолил)ацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоновая кислота:
(Стадия 1) Синтез метил-(2-(5-фтор-1-метил-3-индолил)-7-фтор-6-бензоксазолил)ацетата
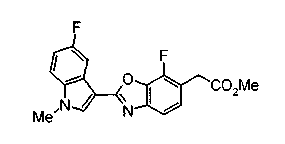
В этаноле (15 мл) молекулярные сита 4Å (1,20 г) добавляют к 5-фтор-1-метилиндолил-3-карбальдегиду (515 мг, 2,91 ммоль) и метил-4-амино-2-фтор-3-гидроксифенилацетату (690 мг, 3,47 ммоль) и образовавшуюся смесь перемешивают при комнатной температуре в течение 18 часов. Затем добавляют иодбензолдиацетат (1,35 г, 4,10 ммоль) и образовавшуюся смесь перемешивают далее при комнатной температуре в течение 1 часа. Реакционную смесь перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси гексан-этилацетат (1/1) метил-(2-(5-фтор-1-метил-3-индолил)-7-фтор-6-бензоксазолил)ацетат (279 мг, 27%) получают в виде коричневого кристаллического порошка.
1H-ЯМР (CDCl3) δ: 3,73 (с, 3H), 3,81 (с, 2H), 3,90 (с, 3H), 7,10 (дт, J=2,4, 8,8 Гц, 1H), 7,17 (дд, J=6,4,8,0 Гц, 1H), 7,31 (дд, J=4,4, 8,8 Гц, 1H), 7,44 (д, J=8,4 Гц, 1H), 7,98 (с, 1H), 8,11 (дд, J=2,4, 9,6 Гц, 1H).
МС (ESI) m/z 357 (M++1).
(Стадия 2) Синтез (2-(5-фтор-1-метил-3-индолил)-7-фтор-6-бензоксазолил)уксусной кислоты
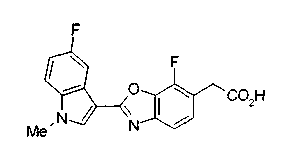
К метил-(2-(5-фтор-1-метил-3-индолил)-7-фтор-6-бензоксазолил)ацетату (279 мг, 0,78 ммоль) добавляют смесь ТГФ/метанол (1/1, 20 мл) и 0,25 н. NaOH (9,4 мл, 2,35 ммоль). Образовавшуюся смесь перемешивают при комнатной температуре в течение 18 часов. Реакционную смесь выливают в 1 н. HCl для подкисления смеси с последующей экстракцией смесью хлороформ/метанол (10/1). Экстракт сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Таким образом полученные кристаллы собирают фильтрованием при пониженном давлении, промывают гексаном и сушат при пониженном давлении, получая при этом (2-(5-фтор-1-метил-3-индолил)-7-фтор-6-бензоксазолил)уксусную кислоту (208 мг, 78%) в виде коричневого кристаллического порошка.
1H-ЯМР (ДМСО-d6) δ: 3,78 (с, 2H), 3,95 (с, 3H), 7,19-7,24 (м, 1H), 7,29 (д, J=8,0 Гц, 1H), 7,50 (д, J=8,4 Гц, 1H), 7,66 (дд, J=4,4, 8,8 Гц, 1H), 7,94 (ушир.д, J=9,6 Гц, 1H), 8,50 (ушир.с, 1H), 12,52 (ушир.с, 1H).
МС (ESI) m/z 342 (M++1).
(Стадия 3) Синтез метил-транс-4-(1-((2-(5-фтор-1-метил-3-индолил)-7-фтор-6-бензоксазолил)ацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилата
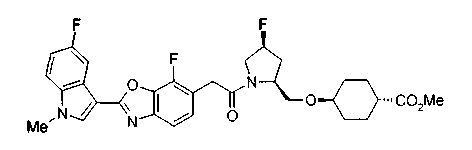
HOBt (16,0 мг, 0,12 ммоль) в ДМФ (15 мл) добавляют к (2-(5-фтор-1-метил-3-индолил)-7-фтор-6-бензоксазолил)уксусной кислоте (202 мг, 0,59 ммоль) метил-транс-4-((4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилату (соединение, синтезированное в стадии (3) примера 21) (153 мг, 0,59 ммоль) и EDC·HCl (124 мг, 0,65 ммоль). Образовавшуюся смесь перемешивают при комнатной температуре в течение 17 часов. К реакционной смеси добавляют воду с последующей экстракцией этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси гексан/этилацетат (1/5) метил-транс-4-(1-((2-(5-фтор-1-метил-3-индолил)-7-фтор-6-бензоксазолил)ацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилат (295 мг, 86%) получают в виде бесцветного аморфного вещества.
1H-ЯМР (CDCl3), смесь ротамеров, δ: 1,20-1,31 (м, 2H), 1,39-1,55 (м, 2H), 1,99-2,55 (ряд м, 8H), 3,22-4,42 (ряд м, 7H), 3,64 и 3,67 (с, общий 3H), 3,90 (с, 3H), 5,19-5,40 (м, 1H), 7,08-7,13 (м, 1H), 7,20 (дд, J=8,8, 15,2 Гц, 1H), 7,32 (дд, J=4,0, 8,8 Гц, 1H), 7,45 (т, J=8,0 Гц, 1H), 7,98 (с, 1H), 8,11 (дд, J=2,4, 9,6 Гц, 1H).
МС (ESI) m/z 584 (M++1).
(Стадия 4) Синтез транс-4-(1-((2-(5-фтор-1-метил-3-индолил)-7-фтор-6-бензоксазолил)ацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоновой кислоты
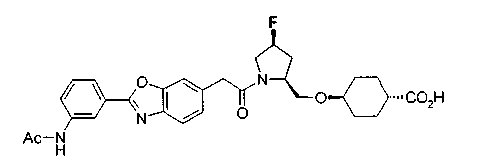
К метил-транс-4-(1-((2-(5-фтор-1-метил-3-индолил)-7-фтор-6-бензоксазолил)ацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилату (288 мг, 0,49 ммоль) добавляют смесь ТГФ/метанол (1/1, 20 мл) и 0,25 н. NaOH (9,9 мл, 2,45 ммоль). Образовавшуюся смесь перемешивают при комнатной температуре в течение 17 часов. Реакционную смесь выливают в 1 н. HCl для подкисления смеси с последующей экстракцией смесью хлороформ/метанол (10/1). Экстракт сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси хлороформ/метанол (10/1) указанное в заголовке соединение (296 мг, 100%) получают в виде бесцветного аморфного вещества.
1H-ЯМР (CDCl3), смесь ротамеров, δ: 1,21-1,36 (м, 2H), 1,42-1,56 (м, 2H), 2,00-2,50 (ряд м, 8H), 2,20 (с, 3H), 3,22-4,45 (ряд м, 7H), 3,89 и 3,93 (с, общий 3H), 5,20-5,40 (м, 1H), 7,10 (т, J=8,8 Гц, 1H), 7,20 (дд, J=8,0, 14,4 Гц, 1H), 7,30-7,32 (м, 1H), 7,46 (т, J=8,0 Гц, 1H), 7,99 (с, 1H), 8,10 (дд, J=2,0, 9,2 Гц, 1H).
МС (ESI) m/z 570 (M++1).
Пример 102
транс-4-(1-(2-(1-Изохинолинил-6-бензоксазолилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоновая кислота:
(Стадия 1) Синтез 1-изохинолинкарбальдегида
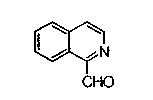
В 1,4-диоксане (20 мл) растворяют 1-метилизохинолин (300 мг, 2,10 ммоль). К образовавшемуся раствору добавляют диоксид селена (323 мг, 2,91 ммоль) с последующим нагреванием при кипячении с обратным холодильником в течение 1,5 часа в потоке газообразного азота. После охлаждения до комнатной температуры реакционную смесь фильтруют через целит.Фильтрат перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси н-гексан/этилацетат (5:1, об./об.) 1-изохинолинкарбальдегид (252 мг, 77%) получают в виде белого твердого вещества.
1H-ЯМР (CDCl3) δ: 7,73-7,79 (м, 2H), 7,88-7,93 (м, 2H), 8,74-8,76 (м, 1H), 9,30-9,33 (м, 1H), 10,39 (с, 1H).
МС (ESI) m/z 158 (M++1).
(Стадия 2) Синтез метил-(2-(1-изохинолинил)-6-бензоксазолил)ацетата
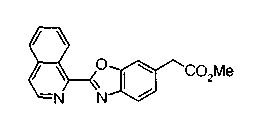
В этаноле (5 мл) 1-изохинолинкарбальдегид (252 мг, 1,60 ммоль) и метил-4-амино-3-гидроксифенилацетат (349 мг, 1,93 ммоль) перемешивают при комнатной температуре в течение 12 часов. Добавляют иодбензолдиацетат (619 мг, 1,92 ммоль) и реакционную смесь перемешивают далее при комнатной температуре в течение 15 минут. Реакционную смесь перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси н-гексан/этилацетат (от 4:1 до 3:1, об./об.) метил-(2-(1-изохинолинил)-6-бензоксазолил)ацетат (166 мг, 33%) получают в виде желтого аморфного вещества.
1H-ЯМР (CDCl3) δ: 3,73 (с, 3H), 3,82 (с, 2H), 7,35-7,38 (м, 1Н), 7,68 (м, 1Н), 7,75-7,95 (м, 5H), 8,77-8,78 (м, 1H), 9,67-9,70 (м, 1H). МС (ESI) m/z 319 (M++1).
(Стадия 3) Синтез (2-(1-изохинолинил)-6-бензоксазолил)уксусной кислоты
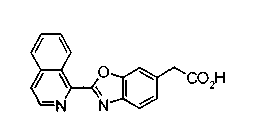
К метил-(2-(1-изохинолинил)-6-бензоксазолил)ацетату (166 мг, 0,52 ммоль) добавляют ТГФ (3 мл) и 0,5 н. NaOH (3,0 мл, 1,50 ммоль). Образовавшуюся смесь перемешивают при комнатной температуре в течение 12 часов. Реакционную смесь выливают в смесь лед - 1 н. HCl для подкисления. Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при пониженном давлении, получая при этом (2-(1-изохинолинил)-6-бензоксазолил)уксусную кислоту (138 мг, 87%) в виде светло-коричневого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 3,82 (с, 2H), 7,41-7,43 (м, 1H), 7,82 (с, 1H), 7,88-7,95 (м, 3H), 8,13-8,17 (м, 2H), 8,76-8,78 (м, 1H), 9,53-9,55 (м, 1H), 12,45 (ушир.с, 1H).
МС (ESI) m/z 305 (M++1).
(Стадия 4) Синтез метил-транс-4-(1-(2-(1-изохинолинил)-6-бензоксазолилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилата
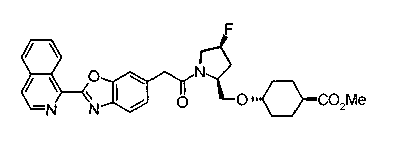
В ДМФ (10 мл) (2-(1-изохинолинил)-6-бензоксазолил)уксусную кислоту (138 мг, 0,45 ммоль, метил-транс-4-((4S)-фтор-(2S)- пирролидинилметокси)циклогексанкарбоксилат (соединение, синтезированное в стадии (3) примера 21) (118 мг, 0,46 ммоль), EDC·HCl (130 мг, 0,68 ммоль), HOBt (92 мг, 0,68 ммоль) и триэтиламин (95 мкл, 0,68 ммоль) перемешивают при комнатной температуре в течение 15 часов. К реакционной смеси добавляют воду с последующей экстракцией этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси толуол-ацетон (4:1, об./об.) метил-транс-4-(1-(2-(1-изохинолинил)-6-бензоксазолилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилат (245 мг, 99%) получают виде светло-желтой густой вязкой жидкости.
1H-ЯМР (CDCl3) δ: 1,21-1,53 (м, 4H), 1,97-2,52 (м, 7H), 3,24-3,37 и 3,50-3,54 (каждый м, общий 2H), 3,64-4,14 (м, 8H), 4,25-4,28 и 4,39-4,41 (каждый м, общий 1H), 5,18-5,19 и 5,31-5,33 (каждый м, общий 1H), 7,15-7,24 (м, 1H), 7,33-7,36 (м, 1H), 7,64-7,93 (м, 5H), 8,75-8,77 (м, 1H), 9,66-9,68 (м, 1H).
МС (ESI) m/z 546,5 (M++1).
(Стадия 5) Синтез транс-4-(1-(2-(1-изохинолинил)-6-бензоксазолилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоновой кислоты
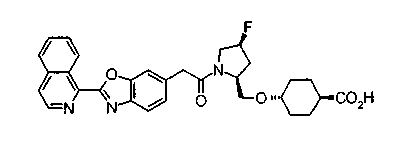
К метил-транс-4-(1-(2-(1-изохинолинил)-6-бензоксазолилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилату (245 мг, 0,45 ммоль) добавляют ТГФ (3,0 мл) и 0,5 н. NaOH (2,7 мл, 1,35 ммоль). Образовавшуюся смесь перемешивают при комнатной температуре в течение 18 часов. Реакционную смесь выливают в смесь лед - 1 н. HCl для подкисления смеси. Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при пониженном давлении, получая при этом указанное в заголовке соединение (175 мг, 73%) в виде светло-желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 1,12-1,37 (м, 4H), 1,84-2,11 (м, 4H), 2,14-2,21 (м, 3H), 3,17-4,04 (м, 7H), 4,15 и 4,37-4,39 (каждый м, общий 1H), 5,25-5,32 и 5,39-5,45 (каждый м, общий 1H), 7,33-7,37 (м, 1H), 7,72-7,74 (м, 1H), 7,86-7,93 (м, 3H), 8,11-8,15 (м, 2H), 8,74-8,76 (м, 1H), 9,51-9,53 (м, 1H), 12,02 (ушир.с, 1H).
МС (ESI) m/z 532,5 (M++1);
Анал. Вычисл. для C30H30FN3О5 ·1H2O: С, 65,56; H, 5,87; N, 7,65.
Найдено: С, 65,39; H, 5,94; N, 7,51.
Пример 103
транс-4-(1-(7-Фтор-2-(1-изохинолинил)-6-бензоксазолилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоновая кислота
(Стадия 1) Синтез метил-(7-фтор-2-(1-изохинолинил)-6-бензоксазолил)ацетата
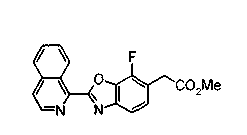
В этаноле (13 мл) изохинолин-1-карбальдегид (500 мг, 3,18 ммоль) и метил-4-амино-2-фтор-3-гидроксифенилацетат (632 мг, 3,17 ммоль) перемешивают при комнатной температуре в течение 2 дней. Добавляют иодбензолдиацетат (1,23 г, 3,82 ммоль) и реакционную смесь перемешивают при комнатной температуре в течение 10 минут. Реакционную смесь перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси н-гексан/этилацетат (3:1, об./об.) метил-(7-фтор-2-(1-изохинолинил)-6-бензоксазолил)ацетат (155 мг, 14%) получают в виде красно-коричневого твердого вещества.
1H-ЯМР (CDCl3) δ: 3,74 (с, 3H), 3,87 (с, 2H), 7,30-7,33 (м, 1H), 7,66-7,94 (м, 5H), 8,78-8,79 (м, 1H), 9,58 (м, 1H).
МС (ESI) m/z 337 (M++1).
(Стадия 2) Синтез (7-фтор-2-(1-изохинолинил)-6-бензоксазолил)уксусной кислоты
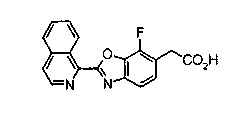
К метил-(7-фтор-2-(1-изохинолиил)-6-бензоксазолил)ацетату (155 мг, 0,46 ммоль) добавляют ТГФ (3 мл) и 0,5 н. NaOH (3,0 мл, 1,50 ммоль). Образовавшуюся смесь перемешивают при комнатной температуре в течение 1 часа. Реакционную смесь выливают в смесь лед - 1 н. HCl для подкисления ею смеси. Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при пониженном давлении, получая при этом (7-фтор-2-(1-изохинолинил)-6-бензоксазолил)уксусную кислоту (116 мг, 78%) в виде коричневого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 3,86 (с, 2H), 7,44-7,48 (м, 1H), 7,78-7,80 (м, 1H), 7,88-7,93 (м, 2H), 8,15-8,16 (м, 2H), 8,77-8,79 (м, 1H), 9,48-9,50 (м, 1H), 12,63 (ушир.с, 1H).
МС (ESI) m/z 323 (M++1).
(Стадия 3) Синтез метил-транс-4-(1-(7-Фтор-2-(1-изохинолинил)-6-бензоксазолилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилата
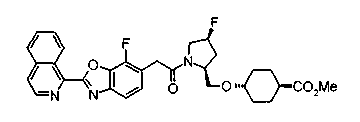
В ДМФ (5 мл) (7-фтор-2-(1-изохинолинил)-6-бензоксазолил)уксусную кислоту (116 мг, 0,36 ммоль), метил-транс-4-((4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилат (соединение, синтезированное в стадии (3) примера 21) (93 мг, 0,36 ммоль), EDC·HCl (103 мг, 0,54 ммоль), HOBt (73 мг, 0,54 ммоль) и триэтиламин (75 мкл, 0,54 ммоль) перемешивают при комнатной температуре в течение 12 часов. Реакционную смесь выливают в воду. Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при пониженном давлении, получая при этом метил-транс-4-(1-(7-Фтор-2-(1-изохинолинил)-6-бензоксазолилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилат (192 мг, 95%) в виде коричневого твердого вещества.
1H-ЯМР (CDCl3) δ: 1,25-1,54 (м, 4H), 1,97-2,51 (м, 7H), 3,26-3,38 и 3,54-3,58 (каждый м, общий 2H), 3,64-4,09 (м, 8H), 4,37-4,39 (м, 1H), 5,21 и 5,34-5,39 (каждый м, общий 1H), 7,33-7,40 (м, 1H), 7,66-7,71 (м, 1H), 7,80-7,82 (м,, 2H), 7,86-7,87 (м, 1H), 7,95 (м, 1H), 8,79-8,80 (м, 1H), 9,58-9,59 (м, 1H).
МС (ESI) m/z 564,5 (M++1).
(Стадия 4) Синтез транс-4-(1-(7-Фтор-2-(1-изохинолинил)-6-бензоксазолилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоновой кислоты
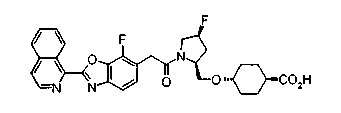
К метил-транс-4-(1-(7-Фтор-2-(1-изохинолинил)-6-бензоксазолилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилату (192 мг, 0,34 ммоль) добавляют ТГФ (4,0 мл) и 0,25 н. NaOH (4,0 мл, 1,00 ммоль). Образовавшуюся смесь перемешивают при комнатной температуре в течение 13 часов. Реакционную смесь выливают в смесь лед - 1 н. HCl для подкисления ею смеси. Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при пониженном давлении, получая при этом указанное в заголовке соединение (158 мг, 84%) в виде коричневого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 1,13-1,41 (м, 4H), 1,84-2,32 (м, 7H), 3,16-4,45 (м, 7H), 5,26-5,35 и 5,40-5,49 (каждый м, общий 1H), 7,32-7,39 (м, 1H), 7,75-7,78 (м, 1H), 7,87-7,93 (м, 2H), 8,14-8,16 (м, 2H), 8,77-8,78 (м, 1H), 9,48-9,50 (м, 1H), 12,02, (ушир.с, 1H).
МС (ESI) m/z 550,5 (M++1);
Анал. Вычисл. для С30Н29F2N3O5·1Н2О: С, 63,48; H, 5,51; N, 7,40.
Найдено: С, 63,43; H, 5,48; N, 7,14.
Пример 104
транс-4-((4S)-Фтор-1-((2-(1-индолинил)-6-бензоксазолил)ацетил)-(2S)-пирролидинилметокси)циклогексанкарбоновая кислота:
(Стадия 1) Синтез метил-(2-(1-индолинил)-6-бензоксазолил)ацетата

Индолин (0,34 мл, 3,0 ммоль) растворяют в ТГФ (30 мл). К образовавшемуся раствору добавляют тиокарбонилдиимидазол (588 мг, 3,0 ммоль) с последующим перемешиванием при комнатной температуре в течение 3 часов. К реакционной смеси добавляют метил-4-амино-3-гидроксифенилацетат (544 мг, 3,0 ммоль) и образовавшуюся смесь перемешивают при комнатной температуре в течение 2 дней. Добавляют оксид ртути(II) (желтый) (785 мг, 3,0 ммоль) и образовавшуюся смесь перемешивают при 70°С в течение 6 часов. После охлаждения до комнатной температуры реакционную смесь фильтруют через целит с последующим промыванием метанолом. Фильтрат перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси хлороформ/этилацетат (10/1) метил-(2-(1-индолинил)-6-бензоксазолил)ацетат (200 мг, 22%) получают в виде коричневого твердого вещества.
1H-ЯМР (CDCl3) (3,30: (т, J=8,6 Гц, 2H), 3,70 (с, 2H), 3,71 (с, 3H), 4,32 (т, J=8,3 Гц, 2H), 7,00 (дт, J=7,3, 1,0 Гц, 1H), 7,13 (дд, J=8,1, 6,4 Гц, 1H), 7,23 (д, J=6,8 Гц, 1H), 7,28 (д, J=7,3 Гц, 1H), 7,36 (д, J=1,2 Гц, 1H), 7,42 (д, J=8,1 Гц, 1H), 7,97 (д, J=8,1 Гц, 1H).
МС (ESI) m/z 309 (M++1).
(Стадия 2) Синтез (2-(1-индолинил)-6-бензоксазолил)уксусной кислоты
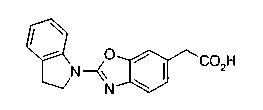
К метил-(2-(1-индолинил)-6-бензоксазолил)ацетату (200 мг, 0,649 ммоль) добавляют ТГФ/метанол (6/3 мл) и 1 н. NaOH (3 мл). Образовавшуюся смесь перемешивают при комнатной температуре в течение 1,5 часа. Реакционную смесь перегоняют при пониженном давлении для удаления растворителя. К остатку добавляют 1 н. HCl для подкисления остатка. Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при пониженном давлении, получая при этом (2-(1-индолинил)-6-бензоксазолил)уксусную кислоту (161 мг, 84%) в виде коричневого твердого вещества.
1H-ЯМР (ДМСО) δ: 3,27 (т, J=8,6 Гц, 2H), 3,65 (с, 2H), 4,28 (т, J=8,3 Гц, 2H), 7,00 (т, J=7,3 Гц, 1H), 7,13 (дд, J=8,1, 2,0 Гц, 1H), 7,28 (т, J=6,9 Гц, 2H), 7,38 (д, J=8,1 Гц, 1H), 7,46 (с, 1H), 7,97 (д, J=7,8 Гц, 1H), 12,32 (ушир., 1H).
МС (ESI) m/z 249 (M++1).
(Стадия 3) Синтез метил-транс-4-((4S)-Фтор-1-((2-(1-индолинил)-6-бензоксазолил)ацетил)-(2S)-пирролидинилметокси)циклогексанкарбоксилата
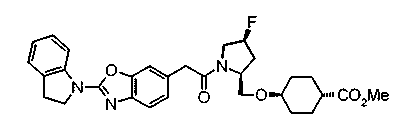
В ДМФ (5 мл) (2-(1-индолинил)-6-бензоксазолил)уксусную кислоту (161 мг, 0,547 ммоль), метил-транс-4-((4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилат (соединение, синтезированное в стадии (3) примера 21) (142 мг, 0,547 ммоль), EDC·HCl (157 мг, 0,821 ммоль), HOBt (111 мг, 0,821 ммоль) и триэтиламин (0,38 мл, 2,74 ммоль) перемешивают при комнатной температуре в течение 15 часов. Реакционную смесь выливают в ледяную воду с последующей экстракцией этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси хлороформ/ацетон (10/1) метил-транс-4-((4S)-фтор-1-((2-(1-индолинил)-6-бензоксазолил)ацетил)-(2S)-пирролидинилметокси)циклогексанкарбоксилат (180 мг, 61%) получают в виде бесцветного масла.
1H-ЯМР (CDCl3) δ: 1,13-1,53 (м, 5H), 1,96-2,51 (м, 6H), 3,22-3,38 (м, 4H), 3,50 (т, J=8,1 Гц, 1H), 3,64 и 3,66 (каждый с, общий 3H, амидные изомеры), 3,68-4,03 (м, 4H), 4,24 и 4,34 (кв. и м, J=7,6 Гц, общий 1H, амидные изомеры), 4,31 (т, J=8,6 Гц, 2H), 5,24 (дкв., J=53,1, 4,4 Гц, 1H), 6,99 (т, J=7,3 Гц, 1H), 7,10 (м, 1H), 7,23 (д, J=7,l Гц, 1H), 7,27 (т, J=7,6 Гц, 1H), 7,36 (дд, J=8,3,l-2 Гц, 1H), 7,40 и 7,42 (каждый д, каждый J=7,3 Гц, общий 1H, амидные изомеры), 7,96 (д, J=8,1 Гц, 1H).
МС (ESI) m/z 536 (M++1).
(Стадия 4) Синтез транс-4-((4S)-фтор-1-((2-(1-индолинил)-6-бензоксазолил)ацетил)-(2S)-пирролидинилметокси)циклогексанкарбоновой кислоты
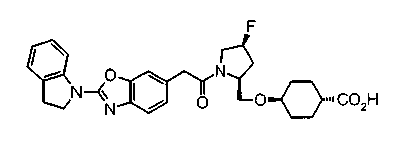
К метил-транс-4-((4S)-фтор-1-((2-(1-индолинил)-6-бензоксазолил)ацетил)-(2S)-пирролидинилметокси)циклогексанкарбоксилату (180 мг, 0,336 ммоль) добавляют ТГФ/метанол (8/4 мл) и 1 н. NaOH (4 мл). После перемешивания при комнатной температуре в течение 17 часов реакционную смесь перегоняют при пониженном давлении для удаления растворителя. Остаток подкисляют 1 н. HCl. Таким образом осажденные кристаллы собирают фильтрованием, промывают водой и сушат при пониженном давлении, получая при этом указанное в заголовке соединение (147 мг, 84%) в виде бесцветного твердого вещества.
ИК (ATR) ν 2937, 2860, 1722, 1635, 1601, 1570, 1487, 1439 см-1;
1H-ЯМР (ДМСО-d6) δ: 1,19-1,39 (м, 5H), 1,83-2,21 (м, 7H), 3,17 (т, J=9,3 Гц, 1H), 3,27 (т, J=8,6 Гц, 1H), 3,40-3,94 (м, 5H), 4,13 и 4,33 (каждый м, общий 1H, амидные изомеры), 4,28 (т, J=8,6 Гц, 2H), 5,31 и 5,36 (дт и д, J=54,1, 4,4 и 54,1 Гц, соответственно, общий 1H, амидные изомеры), 6,98 (т, J=7,3 Гц, 1H), 7,09 (т, J=8,8 Гц, 1H), 7,27 (т, J=7,8 Гц, 1H), 7,29 (т, J=7,1 Гц, 1H), 7,37 (т, J=4,2 Гц, 1H), 7,40 и 7,42 (д и с, J=2,7 Гц, общий 1H, амидные изомеры), 7,97 (д, J=8,1 Гц, 1H), 12,03 (с, 1H).
МС (ESI) m/z 522 (M++1);
Анал. Вычисл. для С29Н32FN3O5 ·0,4H2О: C, 65,87; H, 6,25; N, 7,95; F, 3,59.
Найдено: C, 65,93; H, 6,27; N, 7,71; F, 3,45.
Пример 105
транс-4-(1-((7-Фтор-2-(1-индолинил)-6-бензоксазолил)ацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоновая кислота:
(Стадия 1) Синтез метил-(7-фтор-2-(1-индолинил)-6-бензоксазолил)ацетата
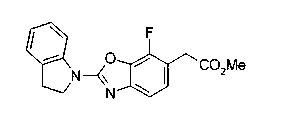
Индолин (0,49 мл, 4,36 ммоль) растворяют в ТГФ (20 мл). К образовавшемуся раствору добавляют N,N'-тиокарбонилдиимидазол (863 мг, 4,36 ммоль). Образовавшуюся смесь перемешивают при комнатной температуре в течение 14 часов. К реакционной смеси добавляют метил-4-амино-2-фтор-3-гидроксифенилацетат (1,0 г, 5,0 ммоль) с последующим перемешиванием при 70°С в течение 1 дня. К реакционной смеси добавляют оксид ртути(II) (желтый) (944 мг, 4,36 ммоль) и образовавшуюся смесь нагревают при 70°С в течение 15 часов. После охлаждения до комнатной температуры реакционную смесь фильтруют через целит с последующим промыванием метанолом. Фильтрат перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси хлороформ/этилацетат (10/1) метил-(7-фтор-2-(1-индолинил)-6-бензоксазолил)ацетат (330 мг, 23%) получают в виде светло-коричневого твердого вещества.
1H-ЯМР (CDCl3) δ: 3,31 (т, J=8,5 Гц, 2H), 3,72 (с, 3H), 3,76 (с, 2H), 4,33 (т, J=8,3 Гц, 2H), 7,02 (т, J=7,3 Гц, 1H), 7,09 (т, J=6,6 Гц, 1H), 7,23 (т, J=8,0 Гц, 2H), 7,29 (д, J=8,3 Гц, 1H), 7,99 (д, J=8,O Гц, 1H).
МС (ESI) m/z 327 (M++1).
(Стадия 2) Синтез (7-фтор-2-(1-индолинил)-6-бензоксазолил)уксусной кислоты
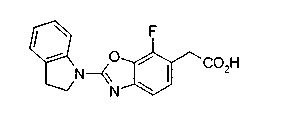
К метил-(7-фтор-2-(1-индолинил)-6-бензоксазолил)ацетату (330 мг, 1,01 ммоль) добавляют ТГФ/метанол (2:1, 12 мл) и 1 н. NaOH (4 мл). После перемешивания при комнатной температуре в течение 14 часов реакционную смесь перегоняют при пониженном давлении для удаления растворителя. Остаток подкисляют 1 н. HCl. Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при пониженном давлении, получая при этом (7-фтор-2-(1-индолинил)-6-бензоксазолил)уксусную кислоту (284 мг, 90%) в виде светло-коричневого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 3,28 (т, J=8,6 Гц, 2H), 3,72 (с, 2H), 4,32 (д, J=8,6 Гц, 2H), 7,03 (д, J=7,3 Гц, 1H), 7,18(т, J=6,9 Гц, 1H), 7,24 (д, J=8,1 Гц, 1H), 7,27-7,32 (м, 2H), 7,95 (д, J=7,8 Гц, 1H), 12,47 (ушир., 1H).
МС (ESI) m/z 313 (M++1).
(Стадия 3) Синтез метил-транс-4-(1-((7-фтор-2-(1-индолинил)-6-бензоксазолил)ацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилата

В ДМФ (4 мл) (7-фтор-2-(1-индолинил)-6-бензоксазолил)уксусную кислоту (156 мг, 0,50 ммоль), метил-транс-4-((4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилат (соединение, синтезированное в стадии (3) примера 21) (130 мг, 0,50 ммоль), EDC·HCl (144 мг, 0,75 ммоль), HOBt (101 мг, 0,75 ммоль) и триэтиламин (0,35 мл, 2,50 ммоль) перемешивают при комнатной температуре в течение 3 дней. Реакционную смесь выливают в ледяную воду с последующей экстракцией этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией с использованием тонкослойной пластины, посредством чего из элюатных фракций смеси хлороформ/ацетон (10/1) метил-транс-4-(1-((7-Фтор-2-(1-индолинил)-6-бензоксазолил)ацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилат (279 мг, 100%) получают в виде коричневого масла.
1H-ЯМР (CDCl3) δ: 1,19-1,58 (м, 4H), 1,97-2,53 (м, 7H), 3,25 (м, 1H), 3,30 (т, J=8,8 Гц, 2H), 3,34 (м, 1H), 3,52-4,06 (м, 8H, включая амидные изомеры и 3,69 с, 1H), 4,32 (т, J=8,5 Гц, 2H), 4,37 (м, 1H), 5,26 и 5,30 (каждый дт, J=54,0, 4,4 и 53,2, 3,7 Гц, общий 1H, амидные изомеры), 7,01 (т, J=7,6 Гц, 1H), 7,10 (кв., J=7,3 Гц, 1H), 7,22 (т, J=6,3 Гц, 2H), 7,28 (т, J=7,8 Гц, 1H), 7,98 (д, J=8,1 Гц, 1H).
МС (ESI) m/z 566 (M++1).
(Стадия 4) Синтез транс-4-(1-((7-Фтор-2-(1-индолинил)-6-бензоксазолил)ацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоновой кислоты
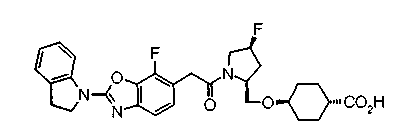
К метил-транс-4-(1-((7-Фтор-2-(1-индолинил)-6-бензоксазолил)ацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилату (279 мг, 0,50 ммоль) добавляют смесь ТГФ/метанол (2:1, 15 мл) и 1 н. NaOH (5 мл). Образовавшуюся смесь перемешивают при комнатной температуре в течение 15 часов. Реакционную смесь перегоняют при пониженном давлении для удаления растворителя. Остаток подкисляют 1 н. HCl. Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при пониженном давлении, получая при этом указанное в заголовке соединение (210 мг, 78%) в виде бесцветного твердого вещества.
ИК (ATR) ν 2939, 2862, 1716, 1635, 1576, 1487, 1452, 1408 см-1; 1H-ЯМР (ДМСО-d6) δ: 1,14-1,41 (м, 4H), 1,85-2,38 (м, 7H), 3,20 (т, J=9,8 Гц, 1H), 3,29 (т, J=8,8 Гц, 2H), 3,40-4,15 (м, 6H), 4,32 (т, J=8,3 Гц, 2H), 4,37 (м, 1H), 5,33 и 5,41 (каждый д, J=54,9 и 53,5 Гц, общий 1H, амидные изомеры), 7,03 (т, J=7,3 Гц, 1H), 7,08 и 7,11 (каждый д, каждый J=6,6 Гц, общий 1Н, амидные изомеры), 7,24 (дт, J=8,1, 1,9 Гц, 1H), 7,29 и 7,31 (каждый д, каждый J=7,8 Гц, общий 2H, амидные изомеры), 7,96 (д, J=8,l Гц, 1H), 12,05 (ушир., 1H).
МС (ESI) m/z 522 (M++1);
Анал. Вычисл. для С29Н31F2N3O5 (1H2О: C, 62,47; H, 5,97; N, 7,54; F, 6,81.
Найдено: C, 62,42; H, 5,87; N, 7,47; F, 6,88.
Пример 106
4-(1-((2-(5-фтор-1-метилиндолил)-6-бензоксазолил)ацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексилуксусная кислота:
(Стадия 1) Синтез метил-4-((4S)-фтор-(2S)-пирролидинилметокси)фенилацетата
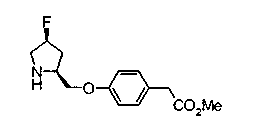
Диизопропилазодикарбоксилат (2,81 мл, 13,6 ммоль) в ТГФ (70 мл) добавляют по каплям к N-трет-бутоксикарбонил-(4S)-фтор-(2S)-пирролидинилметанолу (2,48 г, 11,3 ммоль), трифенилфосфину (3,56 г, 13,6 ммоль) и метил-4-гидроксифенилацетату (1,88 г, 11,3 ммоль) при комнатной температуре. После завершения добавления реакционную смесь перемешивают при 70°С в течение 3 часов. Реакционную смесь охлаждают до комнатной температуры и затем перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси гексан/этилацетат (от 2/1 до 4/1) получают метил-4-(N-трет-бутоксикарбонил)-(4S)-фтор-(2S)-пирролидинилметокси)фенилацетат.Образовавшееся соединение растворяют в метиленхлориде (50 мл). К образовавшемуся раствору добавляют трифторуксусную кислоту (20 мл). После перемешивания образовавшейся смеси при комнатной температуре в течение 1 часа растворитель отгоняют при пониженном давлении. Остаток нейтрализуют насыщенным водным раствором бикарбоната натрия с последующей экстракцией смесью хлороформ/метанол (10/1). Экстракт сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси хлороформ/метанол (10/1) метил-4-((4S)-фтор-(2S)-пирролидинилметокси)фенилацетат (1,89 г, 63%) получают в виде бесцветного масла.
1H-ЯМР (CDCl3) δ: 1,90 (ушир.с, 1H), 1,96-2,02 (м, 1H), 2,16-2,31 (м, 1H), 2,90-3,03 (м, 1H), 3,35 (дд, J=13,2, 20,8 Гц, 1H), 3,52 (ушир.с, 1H), 3,56 (с, 2H), 3,67 (с, 3H), 3,96-4,04 (м, 2H), 5,16-5,30 (м, 1H), 6,87 (д, J=8,4 Гц, 2H), 7,18 (д, J=8,4 Гц, 2H).
МС (ESI) m/z 268 (M++1).
(Стадия 2) Синтез метил-4-((4S)-фтор-(2S)-пирролидинилметокси)циклогексилацетата
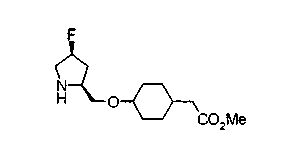
В смеси этанол/уксусная кислота (10/1, 55 мл) метил-4-((4S)-фтор-(2S)-пирролидинилметокси)фенилацетат (1.89 г, 7,08 ммоль) и катализатор родий-оксид алюминия (5%, 500 мг) подвергают каталитическому гидрированию в течение 18 часов при комнатной температуре под давлением газообразного водорода 4 атм. Катализатор отфильтровывают от реакционной смеси. Фильтрат перегоняют при пониженном давлении для удаления растворителя. Образовавшееся масло выливают в насыщенный водный раствор бикарбоната натрия для нейтрализации им масла с последующей экстракцией смесью хлороформ/метанол (10/1). Экстракт сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя, получая при этом метил-((4S)-фтор-(2S)-пирролидинилметокси)циклогексилацетат (1,88 г, 97%) в виде бесцветного масла.
1H-ЯМР (CDCl3), смесь цис и транс изомерs, δ: 1,23-2,16 (ряд м, 10 H), 2,19-2,23 (м, 4H), 2,79-2,92 (м, 1H), 3,16-3,55 (ряд м, 5H), 3,65 (с, 3H), 5,30 (д, J=54,8 Гц, 1H).
МС (ESI) m/z 274 (M++1).
(Стадия 3) Синтез метил-4-(1-((2-(5-фтор-1-метил-3-индолил)-6-бензоксазолил)ацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексилацетата

HOBt (18,0 мг, 0,14 ммоль) в ДМФ (10 мл) добавляют к (2-(5-фтор-1-метил-3-индолил)-6-бензоксазолил)уксусной кислоте (219 мг, 0,68 ммоль), метил-4-((4S)-фтор-(2S)-пирролидинилметокси)циклогексилацетату (185 мг, 0,68 ммоль) и EDC·HCl (142 мг, 0,74 ммоль). Образовавшуюся смесь перемешивают при комнатной температуре в течение 18 часов. К остатку добавляют воду с последующей экстракцией этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией с использованием тонкослойного силикагеля, посредством чего из этилацетатных элюатных фракций метил-4-(1-((2-(5-фтор-1-метил-3-индолил)-6-бензоксазолил)ацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексилацетат (334 мг, 85%) получают в виде бесцветного аморфного вещества.
МС (ESI) m/z 579 (M++1).
(Стадия 4) Синтез 4-(1-((2-(5-фтор-1-метил-3-индолил)-6-бензоксазолил)ацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексилуксусной кислоты
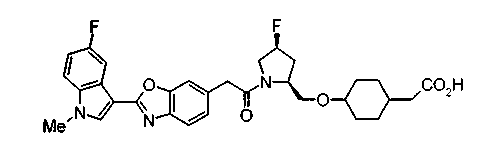
К метил-4-(1-((2-(5-фтор-1-метил-3-индолил)-6-бензоксазолил)ацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексилацетату (315 мг, 0,54 ммоль) добавляют смесь ТГФ/метанол (1/1, 20 мл) и 0,25 н. NaOH (10,9 мл, 2,72 ммоль). Образовавшуюся смесь перемешивают при комнатной температуре в течение 6 часов. Реакционную смесь выливают в 1 н. HCl для подкисления смеси с последующей экстракцией смесью хлороформ/метанол (10/1). Экстракт сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси хлороформ/метанол (10/1) указанное в заголовке соединение (260 мг, 85%) получают в виде бесцветного аморфного вещества.
1H-ЯМР (ДМСО-d6), смесь амидных изомеров, смесь цис и транс изомеров, δ: 1,53-2,60 (ряд м, 14H), 3,44-4,67 (ряд м, 6H), 4,24 (с, 3H), 3,22-4,45 (ряд м, 7H), 5,55-5,74 (м, 1H), 7,45-7,56 (м, 2H), 7,83 (д, J=9,2 Гц, 1H), 7,91-7,94 (м, 2H), 8,28 (дд, J=2,4, 9,6 Гц, 1H), 8,66 (д J=2,8 Гц, 1H), 12,23 (ушир.с, 1H).
МС (ESI) m/z 566 (M++1).
Пример 107
транс-4-(N-(1-((5-Хлор-2-фтор-4-((1-метил-3-индолилкарбонил)амино)фенил)ацетил)-(4S)-фтор-(2S)-пирролидинилметил)амино)циклогексанкарбоновая кислота:
(Стадия 1) Синтез 1-трет-бутоксикарбонил-(4S)-фторпролиналя
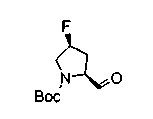
К раствору оксалилхлорида (0,4 мл, 4,605 ммоль) в метиленхлориде (4,0 мл) добавляют по каплям ДМСО (0,65 мл, 9,209 ммоль) в потоке газообразного азота и реакционную смесь перемешивают при такой же температуре в течение 15 минут.К реакционной смеси добавляют раствор 1-трет-бутоксикарбонил-(4S)-фтор-(2S)-пирролидинилметанола (504,8 мг, 2,302 ммоль) в метиленхлориде (5,0 мл) при -78°С с использованием шприца. Реакционную смесь перемешивают при такой же температуре в течение 1 часа. К смеси добавляют диизопропилэтиламин (2,0 мл, 11,51 ммоль) при -78°С. После перемешивания при такой же температуре в течение 30 минут реакционную смесь нагревают до комнатной температуры и разбавляют хлороформом. Раствор в хлороформе промывают водой, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя, получая при этом 1-трет-бутоксикарбонил-(4S)-фторпропиналь в виде светло-желтого аморфного вещества. Образовавшееся соединение применяют для следующей реакции без дополнительной очистки.
1H-ЯМР (CDCl3) δ: 1,43, 1,46 (общий 9Н, с, t-Bu), 2,16-2,49 (2H, м), 3,44-3,70 (1H, м), 3,71-3,96 (1H, м), 4,17, 4,29 (общий 1H, д, J=11,4 Гц), 5,19 (1H, д, J=50,0 Гц), 9,55 и, 9,60 (общий 1Н, с, CHO).
(Стадия 2) Синтез метил-транс-4-(N-(1-трет-бутоксикарбонил)-(4S)-фтор-(2S)-пирролидинилметил)амино)циклогексанкарбоксилата

Триацетоксиборогидрид натрия (1,22 г, 5,756 ммоль) в ТГФ (16 мл) добавляют к 1-трет-бутоксикарбонил-(4S)-фторпролиналю и метил-транс-4-аминоциклогексанкарбоксилату (362,0 мг, 2,302 ммоль) при перемешивании при 0°С.После перемешивания реакционной смеси в течение 1 часа ее разбавляют хлороформом. Добавляют насыщенный водный раствор бикарбоната натрия с последующей экстракцией смесью хлороформ-метанол (10:1, об./об.). Экстракт сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций от смеси гексан-этилацетат (1:1, об./об.) до смеси хлороформ-метанол (10:1, об./об.) метил-транс-4-(N-(1-трет-бутоксикарбонил)-(4S)-фтор-(2S)-пирролидинилметил)амино)циклогексанкарбоксилат (776,1 мг, 94% для двух стадий) получают в виде светло-коричневого масла.
1H-ЯМР (CDCl3) δ: 0,98-1,50 (общий 13H, м, включая 9H, с при (1,45), 1,88-2,12 (5H, м), 2,13-2,30 (2H, м), 2,35-3,07 (общий 4H, ряд м), 3,43-4,12 (общий 6H, ряд м, включая 3H, с при (3,64), 5,17 (1H, д, J=54,0 Гц).
(Стадия 3) Синтез метил-транс-4-(N-(1-трет-бутоксикарбонил)-(4S)-фтор-(2S)-пирролидинилметил)трифторацетиламино)циклогексанкарбоксилата
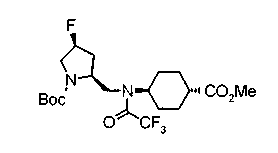
Метил-транс-4-(N-(1-трет-бутоксикарбонил)-(4S)-фтор-(2S)-пирролидинилметил)амино)циклогексанкарбоксилат (776,1 мг, 2,165 ммоль) растворяют в метиленхлориде (15 мл). К образовавшемуся раствору при перемешивании при 0°С добавляют триэтиламин (0,91 мл, 6,496 ммоль) и трифторуксусную кислоту (0,46 мл, 3,248 ммоль) с последующим перемешиванием в течение 3 часов при такой же температуре. К реакционной смеси добавляют воду и смесь экстрагируют этилацетатом. Экстракт сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси гексан-этилацетат (4:1, об./об.) метил-транс-4-(N-(1-трет-бутоксикарбонил)-(4S)-фтор-(2S)-пирролидинилметил)трифторацетиламино)циклогексанкарбоксилат (864,0 мг, 88%) получают в виде светло-коричневого масла
1H-ЯМР (CDCl3) δ: 0,12-2,29 (общий 20H, м, включая 9H, с при (1,42), 3,20-3,79 (общий 8H, ряд м, включая 3H, с при δ: 3,66), 4,62 и 4,70 (общий 1H, м), 5,24 (1H, ушир.д, J=46,8 Гц).
(Стадия 4) Синтез метил-транс-4-(N-((4S)-фтор-(2S)-пирролидинилметил)трифторацетиламино)циклогексанкарбоксилата
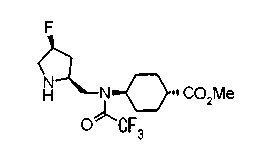
Метил-транс-4-(N-(1-трет-бутоксикарбонил)-(4S)-фтор-(2S)-пирролидинилметил)трифторацетиламино)циклогексанкарбоксилат (864,0 мг, 1,901 ммоль) растворяют в диоксане (5 мл). К образовавшемуся раствору добавляют 4 н. HCl/диоксан (20 мл) при перемешивании при 0°С. После перемешивания при комнатной температуре в течение 18 часов реакционную смесь перегоняют при пониженном давлении для удаления растворителя, получая при этом метил-транс-4-(N-((4S)-фтор-(2S)-пирролидинилметил)трифторацетиламино)циклогексанкарбоксилат в виде светло-желтого масла. Образовавшееся соединение применяют для следующей реакции без дополнительной очистки.
(Стадия 5) Синтез метил-транс-4-(N-(1-((5-хлор-2-фтор-4-((1-метил-3-индолилкарбонил)амино)фенил)ацетил)-(4S)-фтор-(2S)-пирролидинилметил)трифторацетиламино)циклогексанкарбоксилата:
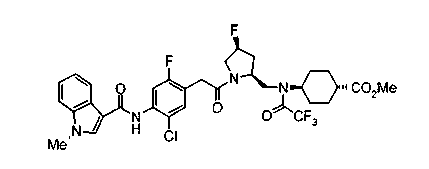
В ДМФ (18 мл) триэтиламин (0,26 мл, 1,865 ммоль) и EDC·HCl (357,6 мг, 1,865 ммоль) добавляют к метил-транс-4-(N-((4S)-фтор-(2S)-пирролидинилметил)трифторацетиламино)циклогексанкарбоксилату (486,0 мг, 1,243 ммоль), (5-хлор-2-фтор-4-((1-метил-3-индолилкарбонил)амино)фенил)уксусной кислоте (448,7 мг, 1,243 ммоль) и HOBt (33,6 мг, 0,249 ммоль). Образовавшуюся смесь перемешивают в течение 18 часов. Реакционную смесь разбавляют этилацетатом. Разбавленную смесь промывают последовательно насыщенным водным раствором бикарбоната натрия и 1 н. HCl, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси гексан-этилацетат (1:1, об./об.) метил-транс-4-(N-(1-((5-хлор-2-фтор-4-((1-метил-3-индолилкарбонил)амино)фенил)ацетил)-(4S)-фтор-(2S)- пирролидинилметил)трифторацетиламино)циклогексанкарбоксилат (736,9 мг, 85%) получают в виде светло-коричневого масла.
1H-ЯМР (CDCl3) δ: 1,45-1,72 (4H, м), 1,72-1,91 (3H, м), 2,03-2,18 (2H, м), 2,29 (1H, м), 2,50 (1H, м), 3,45-4,20 (общий 13H, ряд м, включая 3H, с при δ: 3,68, и 3H, с при δ: 3,88), 4,67 (1H, м), 5,33 (1H, ушир.д, J=53,2 Гц), 7,28-7,45 (4H, м), 7,80 (1H, с), 8,13 (1H, м), 8,30 (1H, с), 8,52 (1H, д, J=12,0 Гц).
(Стадия 6) Синтез транс-4-(N-(1-((5-хлор-2-фтор-4-((1-метил-3-индолилкарбонил)амино)фенил)ацетил)-(4S)-фтор-(2S)-пирролидинилметил)амино)циклогексанкарбоновой кислоты
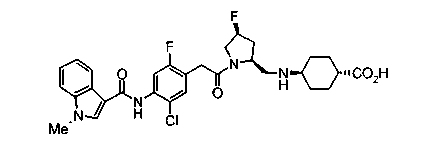
Метил-транс-4-(N-(1-((5-хлор-2-фтор-4-((1-метил-3-индолилкарбонил)амино)фенил)ацетил)-(4S)-фтор-(2S)-пирролидинилметил)трифторацетиламино)циклогексанкарбоксилат (309,1 мг, 0,443 ммоль) растворяют в ТГФ (6,0 мл). К образовавшемуся раствору добавляют 0,25 н. NaOH (6,0 мл) с последующим перемешиванием при комнатной температуре в течение 18 часов. Реакционную смесь перегоняют при пониженном давлении для удаления растворителя. Остаток нейтрализуют 1 н. HCl и затем очищают ионообменной смолой и колоночной хроматографией с обращенной фазой при среднем давлении, получая при этом указанное в заголовке соединение (51,6 мг, 20%) в виде белого аморфного вещества.
1H-ЯМР (CD3OD) δ: 1,28-1,59 (4H, м), 2,06-2,21 (4H, м), 2,21-2,35 (2H, м), 2,35-2,59 (общий 1H, м), 3,10 (1H, м), 3,78 (2Н, с), 3,85-4,15 (общий 5H, ряд м, включая 3H, с при δ: 3,91), 4,48-4,70 (3H, м), 5,42 (1H, д, J=52,7 Гц), 7,27 (1H, дд, J=8,0 Гц), 7,32 (1H, дд, J=8,0 Гц), 7,46 (1H, д, J=8,0 Гц), 7,51 (1H, д, J=8,0 Гц), 8,00 и 8,03 (общий 1H, с), 8,06 (1H, с), 8,14 и 8,16 (общий 1H, с), 8,34 (2H, ушир.с);
МС (ESI) m/z 587 (M++1).
Пример 108
транс-4-(N-(1-((7-Фтор-2-(1-метил-3-индолил)-6-бензоксазолил)ацетил)-(4S)-фтор-(2S)-пирролидинилметил)амино)циклогексанкарбоновая кислота:
(Стадия 1) Синтез метил-транс-4-(N-(1-((7-фтор-2-(1-метил-3-индолил)-6-бензоксазолил)ацетил)-(4S)-фтор-(2S)-пирролидинилметил)трифторацетиламино)циклогексанкарбоксилата
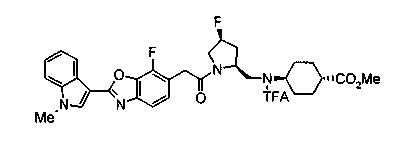
Триэтиламин (0,15 мл, 1,089 ммоль) и EDC·HCl (208,7 мг, 1,089 ммоль) в ДМФ (9,0 мл) добавляют к метил-транс-4-(N-((4S)-фтор-(2S)-пирролидинилметил)трифторацетиламино)циклогексанкарбоксилату (238,7 мг, 0,726 ммоль), (7-фтор-2-(1-метил-3-индолил)-6-бензоксазолил)уксусной кислоте (235,4 мг, 0,726 ммоль) и HOBt (19,6 мг, 0,145 ммоль). Образовавшуюся смесь перемешивают в течение 18 часов при комнатной температуре. Реакционную смесь разбавляют этилацетатом. Разбавленную смесь промывают последовательно 1 н. HCl и насыщенным водным раствором бикарбоната натрия, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси гексан-этилацетат (1:1, об./об.) метил-транс-4-(N-(1-((7-фтор-2-(1-метил-3-индолил)-6-бензоксазолил)ацетил)-(4S)-фтор-(2S)-пирролидинилметил)трифторацетиламино)циклогексанкарбоксилат (100%) получают в виде светло-коричневого масла.
1H-ЯМР (CDCl3) δ: 1,45-1,70 (5H, м), 1,72-1,89 (2H, м), 2,00-2,18 (2H, м), 2,30 (1H, м), 2,55 (1H, м), 3,50-4,17 (общий 13H, ряд м, включая 3H, с при δ: 3,67, и 3H, с при δ: 3,92), 4,67 (1H, м), 5,32 (1H, ушир.д, J=53,2 Гц), 7,31-7,50 (5H, м), 7,98 (1H, м), 8,44 (1H, м).
(Стадия 2) Синтез транс-4-(N-(1-((7-фтор-2-(1-метил-3-индолил)-6-бензоксазолил)ацетил)-(4S)-фтор-(2S)-пирролидинилметил)амино)циклогексанкарбоновой кислоты
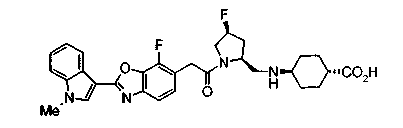
Метил-транс-4-(N-(1-((7-фтор-2-(1-метил-3-индолил)-6-бензоксазолил)ацетил)-(4S)-фтор-(2S)-пирролидинилметил)трифторацетиламино)циклогексанкарбоксилат (145,8 мг, 0,211 ммоль) растворяют в ТГФ (4,0 мл). К образовавшемуся раствору добавляют 0,25 н. NaOH (4,0 мл) с последующим перемешиванием при комнатной температуре в течение 18 часов. Реакционную смесь перегоняют при пониженном давлении для удаления растворителя. Остаток нейтрализуют 1 н. HCl и затем очищают ионообменной смолой и колоночной хроматографией с обращенной фазой при среднем давлении, получая при этом указанное в заголовке соединение (36,0 мг, 30%) в виде белого аморфного вещества.
1H-ЯМР (CD3OD) δ: 1,20-1,56 (5H, м), 1,92-2,57 (6H, м), 3,05 (1H, м), 3,67-4,16 (общий 9H, м, включая 3H, с при δ: 3,94), 4,40-4,70 (1H, м), 5,43 (1H, ушир.д, J=52,4 Гц), 7,10-7,55 (5H, м), 8,11 (1H, с), 8,30 (1H, д, J=8,0 Гц), 8,44 (1H, ушир.с);
МС (ESI) m/z 551 (M++1).
Пример 109
1-(2-(1-((5-Хлор-2-фтор-4-((1-метил-3-индолилкарбонил)амино)фенил)ацетил)-(4S)-фтор-(2R)-пирролидинил)этил)-4-пиперидинкарбоновая кислота:
(Стадия 1) Синтез 1-(трет-бутоксикарбонил)-(2S)-хлорметил-(4S)-фторпирролидина
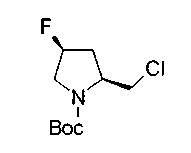
Тетрахлорид углерода (3,30 мл, 34,2 ммоль) в ацетонитриле (120 мл) добавляют по каплям к 1-(трет-бутоксикарбонил)-(4S)-фтор-(2S)-пирролидинилметанолу (5,00 г, 22,8 ммоль), цианиду калия (2,97 г, 45,6 ммоль), трибутилфосфину (6,83 мл, 27,4 ммоль) и 18-краун-6-эфиру (0,60 г, 2,28 ммоль) при перемешивании при 0°С. После завершения добавления реакционную смесь перемешивают при комнатной температуре в течение 19 часов и при 80°С в течение 9 часов. После охлаждения реакционной смеси до комнатной температуры и отфильтровывания таким образом осажденных кристаллов фильтрат перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси н-гекан-этилацетат (4:1, об./об.) 1-(трет-бутоксикарбонил)-(2S)-хлорметил-(4S)-фторпирролидин (2,05 г, 46%) получают в виде желтого твердого вещества.
1H-ЯМР (CDCl3) δ: 1,50 (ушир.с, 9H), 2,16 (м, 1H), 2,53 (м, 1H), 3,41-4,17 (м, 5H), 5,24 (м, 1H).
(Стадия 2) Синтез (1-(трет-бутоксикарбонил)-(4S)-фтор-(2R)-пирролидинил)ацетонитрила.

В ДМСО (50 мл) 1-(трет-бутоксикарбонил)-(2S)-хлорметил-(4S)-фторпирролидин (2,01 г, 8,46 ммоль) и цианид натрия (0,83 г, 16,9 ммоль) перемешивают при 80°С в течение 21 часа. После охлаждения до комнатной температуры к реакционной смеси добавляют воду с последующей экстракцией этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси н-гексан-этилацетат (3:1, об./об.) (1-(трет-бутоксикарбонил)-(4S)-фтор-(2R)-пирролидинил)ацетонитрил (1,67 г, 86%) получают в виде желтого масла.
ИК (ATR) ν 2250 см-1;
1H-ЯМР (CDCl3) δ: 1,46 (ушир.с, 9H), 2,20-2,43 (м, 2H), 2,59 (м, 1H), 3,00 (м, 1H), 3,48-3,75 (м, 2H), 4,22 (м, 1H), 5,25 (м, 1H).
МС (ESI) m/z 229 (M++1).
(Стадия 3) Синтез (1-(трет-бутоксикарбонил)-(4S)-фтор-(2R)-пирролидинил)уксусной кислоты
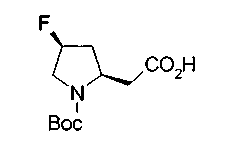
В метаноле (36 мл) (1-(трет-бутоксикарбонил)-(4S)-фтор-(2R)-пирролидинил)ацетонитрил (1,67 г, 7,32 ммоль) и 0,25 н. NaOH (44 мл, 11,0 ммоль) нагревают при кипячении с обратным холодильником в течение 24 часов. После охлаждения до комнатной температуры реакционную смесь перегоняют при пониженном давлении для удаления растворителя. Остаток растворяют в воде. Водный раствор подкисляют 1 н. HCl с последующей экстракцией этилацетатом. Экстракт сушат над безводным сульфатом магния и перегоняют при пониженном давлении для удаления растворителя, получая при этом (1-(трет-бутоксикарбонил)-(4S)-фтор-(2R)-пирролидинил)уксусную кислоту (1,37 г, 76%) в виде коричневого твердого вещества.
1H-ЯМР (CDCl3) δ: 1,47 (с, 9H), 2,16-2,27 (м, 2H), 2,63 (м, 1H), 3,02 (м, 1H), 3,43-3,79 (м, 2H), 4,34 (м, 1H), 5,23 (м, 1H).
МС (ESI) m/z 248 (M++1).
(Стадия 4) Синтез 2-(1-(трет-бутоксикарбонил)-(4S)-фтор-(2R)-пирролидинил)этанола
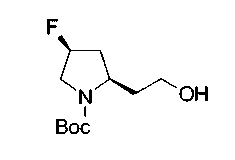
В ТГФ (30 мл) растворяют (1-(трет-бутоксикарбонил)-(4S)-фтор-(2R)-пирролидинил)уксусную кислоту (1,37 г, 5,54 ммоль). К образовавшемуся раствору добавляют по каплям при перемешивании при 0°С раствор комплекса 10 М борандиметилсульфид (0,68 мл, 7,20 ммоль). После завершения добавления реакционную смесь нагревают при кипячении с обратным холодильником в течение 3 часов. Реакционную смесь охлаждают до комнатной температуры и затем перегоняют при пониженном давлении для удаления растворителя. Остаток обрабатывают насыщенным водным раствором бикарбоната натрия с последующей экстракцией хлороформом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя, получая при этом 2-(1-(трет-бутоксикарбонил)-(4S)-фтор-(2R)-пирролидинил)этанол (1,19 г, 92%) в виде желтого масла.
1H-ЯМР (CDCl3) δ: 1,48 (с, 9H), 1,76-2,27 (м, 4H), 3,55-3,73 (м, 4H), 4,20-4,30 (м, 2H), 5,23 (м, 1H).
МС (ESI) m/z 234 (M++1).
(Стадия 5) Синтез этил-1-(2-(1-(трет-бутоксикарбонил)-(4S)-фтор-(2R)-пирролидинил)этил)-4-пиперидинкарбоксилата
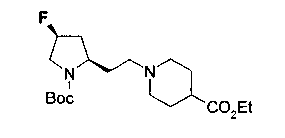
В метиленхлориде (50 мл) растворяют 2-(1-(трет-бутоксикарбонил)-(4S)-фтор-(2R)-пирролидинил)этанол (1,19 г, 5,10 ммоль) и триэтиламин (1,07 мл, 7,65 моль). К образовавшемуся раствору при перемешивании при 0°С добавляют по каплям метансульфонилхлорид (0,43 мл, 5,61 ммоль). После перемешивания при такой же температуре в течение 1 часа в реакционную смесь добавляют насыщенный водный раствор NH4Cl с последующей экстракцией хлороформом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя, получая при этом мезилат (1,60 г) в виде желтого масла. Образовавшийся мезилат (1,60 г), этил-4-пиперидинацетат (1,20 мл, 7,48 ммоль) и карбонат калия (0,71 г, 5,14 ммоль) в ацетонитриле нагревают при кипячении с обратным холодильником в течение 1,5 часа. Реакционную смесь охлаждают до комнатной температуры. Осадок отфильтровывают и фильтрат перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси хлороформ-метанол (10:1, об./об.) этил-1-(2-(1-(трет-бутоксикарбонил)-(4S)-фтор-(2R)-пирролидинил)этил)-4-пиперидинкарбоксилат (831 мг, 44%) получают в виде желтого масла.
1H-ЯМР (CDCl3) δ: 1,24 (т, J=7,1 Гц, 3H), 1,46 (с, 9H), 1,62-2,47 (м, 12H), 2,83-2,90 (м, 2H), 3,49-3,93 (м, 3H), 4,12 (кв., J=7,1 Гц, 2H), 4,18 (м, 1H), 5,18 (м, 1H).
МС (ESI) m/z 373 (M++1).
(Стадия 6) Синтез этил-1-(2-((4S)-фтор-(2R)-пирролидинил)этил)-4-пиперидинкарбоксилата
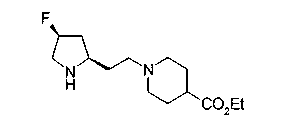
Этил-1-(2-(1-(трет-бутоксикарбонил)-(4S)-фтор-(2R)-пирролидинил)этил)-4-пиперидинкарбоксилат (831 мг, 2,23 ммоль) растворяют в метиленхлориде (10 мл). После добавления к образовавшемуся раствору при 0°С трифторуксусной кислоты (5,0 мл) температуре реакционной смеси снова дают возможность повыситься до комнатной температуры и перемешивание проводят в течение 1 часа. Реакционную смесь перегоняют при пониженном давлении для удаления растворителя. Таким образом полученный остаток нейтрализуют насыщенным водным раствором бикарбоната натрия с последующей экстракцией хлороформом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя, получая при этом этил-1-(2-((4S)-фтор-(2S)-пирролидинил)этил)-4-пиперидинкарбоксилат (466 мг, 77%) в виде желтого масла.
1H-ЯМР (CDCl3) δ: 1,25 (т, J=7,1 Гц, 3H), 1,68-2,16 (м, 8H), 2,21-2,35 (м, 2H), 2,40-2,58 (м, 2H), 2,80-3,07 (м, 2H), 3,29-3,76 (м, 3H), 4,13 (кв., J=7,1 Гц, 2H), 4,16 (м, 1H), 5,22 (м, 1H).
МС (ESI) m/z 273 (M++1).
(Стадия 7) Синтез этил-1-(2-(1-((5-Хлор-2-фтор-4-((1-метил-3-индолилкарбонил)амино)фенил)ацетил)-(4S)-фтор-(2R)-пирролидинил)этил)-4-пиперидинкарбоксилата
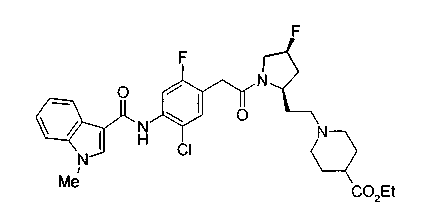
К (5-хлор-2-фтор-4-((1-метил-3-индолилкарбонил)амино)фенил)уксусной кислоте (334 мг, 0,93 ммоль), этил-1-(2-((4S)-фтор-(2R)-пирролидинил)этил)-4-пиперидинкарбоксилату (252 мг, 0,93 ммоль), HOBt (25,0 мг, 0,19 ммоль) и DMAP (23,0 мг, 0,19 ммоль) добавляют ДМФ (9,0 мл) и EDC·HCl (266 мг, 1,39 ммоль). Образовавшуюся смесь перемешивают при комнатной температуре в течение 20 часов. К реакционной смеси добавляют воду с последующей экстракцией хлороформом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси этилацетат-ацетон (1:1, об./об.) этил-1-(2-(1-((5-хлор-2-фтор-4-((1-метил-3-индолилкарбонил)амино)фенил)ацетил)-(4S)-фтор-(2R)-пирролидинил)этил)-4-пиперидинкарбоксилат (269 мг, 47%) получают в виде желтого аморфного вещества.
1H-ЯМР (CDCl3) δ: 1,25 (т, J=7,4 Гц, 3H), 1,74-2,40 (м, 12H), 2,88-2,95 (м, 2H), 3,52-3,87 (м, 5H), 3,88 (с, 3H), 4,09-4,33 (м, 3H), 5,30 (м, 1H), 7,33-7,45 (м, 4H), 7,81 (с, 1H), 8,14 (м, 1H), 8,30 (м, 1H), 8,52 и 8,53 (каждый d J=11,5 Гц, общий 1H).
МС (ESI) m/z 616 (M++1).
(Стадия 8) Синтез 1-(2-(1-((5-хлор-2-фтор-4-((1-метил-3-индолилкарбонил)амино)фенил)ацетил)-(4S)-фтор-(2R)-пирролидинил)этил)-4-пиперидинкарбоновой кислоты
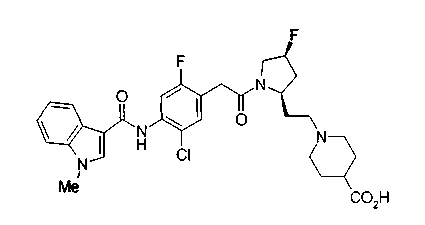
К этил-1-(2-(1-((5-хлор-2-фтор-4-((1-метил-3-индолилкарбонил)амино)фенил)ацетил)-(4S)-фтор-(2R)-пирролидинил)этил)-4-пиперидинкарбоксилату (269 мг, 0,44 ммоль) добавляют ТГФ (4,5 мл) и 0,25 н. NaOH (2,62 мл, 0,66 ммоль). Образовавшуюся смесь перемешивают при комнатной температуре в течение 21 часа. Реакционную смесь перегоняют при пониженном давлении для удаления растворителя. Остаток нейтрализуют 1 н. HCl и очищают ионообменной смолой (НР-20, Mitsubishi Chemical), получая при этом указанное в заголовке соединение (160 мг, 62%) в виде светло-желтого твердого вещества.
ИК (ATR) ν 3419, 2940, 1644, 1583, 1511, 1465 см-1;
1H-ЯМР (ДМСО-d6) δ: 1,45-1,58 (м, 2H), 1,74-2,36 (м, 9H), 2,73-2,87 (м, 2H), 3,41-3,87 (м, 7H), 3,88 (с, 3H), 4,09 и 4,20 (каждый м, общий 1H), 5,32 и 5,39 (каждый м, общий 1H), 7,21 (м, 1H), 7,27 (м, 1H), 7,44 и 7,49 (каждый д, J=7,6 Гц, общий 1H), 7,54 (д, J=8,1 Гц, 1H), 7,71 (д, J=11,2 Гц, 1H), 8,14 (д, J=7,6 Гц, 1H), 8,30 (с, 1H), 9,29 (м, 1H).
МС (ESI) m/z 587 (M++1);
Анал. Вычисл. для С30Н33ClF2N4O4 ·0,75H2О: C, 60,00; H, 5,79; N, 9,33.
Найдено: С, 60,08; H, 6,00; N, 9,12.
Пример 110
транс-4-(((4S)-Фтор-1-(2-(5-фтор-2-метилфениламино)-7-фтор-6-бензоксазолилацетил)-(2S)-пирролидинил)карбониламино)циклогексанкарбоновая кислота:
(Стадия 1) Синтез метил-транс-4-((1-трет-бутоксикарбонил-(4S)-фтор-(2S)-пирролидинилкарбониламино)циклогексанкарбоксилата
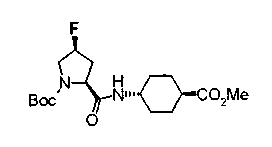
Метил-транс-4-аминоциклогексанкарбоксилат (1,02 г, 6,481 ммоль) и триэтиламин (2,26 мл, 16,20 ммоль) растворяют в ДМФ (20 мл). К образовавшемуся раствору добавляют 1-трет-бутоксикарбонил-(4S)-фтор-(2S)-пролин (1,51 г, 6,481 ммоль), HOBt (175,2 мг, 1,296 ммоль) и EDC·HCl (1,86 г, 9,722 ммоль) и образовавшуюся смесь перемешивают при комнатной температуре в течение 18 часов. Реакционную смесь разбавляют этилацетатом. Разбавленную смесь промывают последовательно 1 н. HCl и насыщенным водным раствором бикарбоната натрия, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси гексан-этилацетат (от 1:1 до 1:3, об./об.) метил-транс-4-((1-трет-бутоксикарбонил-(4S)-фтор-(2S)-пирролидинил)карбониламино)циклогексанкарбоксилат (1,21 г, 50%) получают в виде масла.
1H-ЯМР (CDCl3) δ: 1,03-1,20 (2H, м), 1,32-1,63 (общий 12H, м), 1,89-2,07 (5H, м), 2,23 (1H, м), 2,55 (1H, ушир.с, NH), 3,45-3,84 (общий 6H, м), 4,33 (1H, м), 5,18 (1H, д, J=52,0 Гц).
(Стадия 2) Синтез метил-транс-4-(((4S)-фтор-(2S)-пирролидинил)карбониламино)циклогексанкарбоксилата
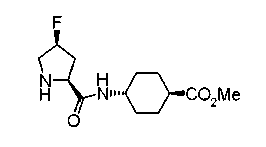
Метил-транс-4-(1-трет-бутоксикарбонил-(4S)-фтор-(2S)-пирролидинилкарбониламино)циклогексанкарбоксилат (1,21 г, 3,249 ммоль) растворяют в метиленхлориде (20 мл). К образовавшемуся раствору добавляют трифторуксусную кислоту (10 мл) при 0°С.Образовавшуюся смесь перемешивают при комнатной температуре в течение 3,5 часа. Реакционную смесь перегоняют при пониженном давлении для удаления растворителя. Остаток растворяют в хлороформе. Раствор в хлороформе нейтрализуют промыванием насыщенным водным раствором бикарбоната натрия с последующей экстракцией смесью хлороформ-метанол (10:1, об./об.). Экстракт сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя, получая при этом метил-транс-4-(((4S)-фтор-(2S)-пирролидинил)карбониламино)циклогексанкарбоксилат. Образовавшееся соединение применяют для следующей реакции без дополнительной очистки.
1H-ЯМР (CDCl3) δ: 1,07-1,35 (2H, м), 1,43-1,65 (2H, м), 1,88-2,14 (5H, м), 2,15-2,49 (3H, м), 3,06-3,38 (2H, м), 3,60-3,88 (общий 5H, м), 5,16 (1H, ушир.д, J=53,2 Гц), 7,39 (1H, ушир.с, NH).
(Стадия 3) Синтез метил-транс-4-(((4S)-фтор-1-(2-(5-фтор-2-метилфениламино)-7-фтор-6-бензоксазолилацетил)-(2S)-пирролидинил)карбониламино)циклогексанкарбоксилата
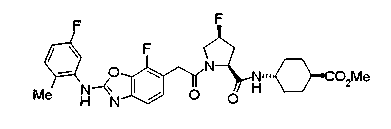
К вышеописанному метил-транс-4-(((4S)-фтор-(2S)-пирролидинил)карбониламино)циклогексанкарбоксилату (81,5 мг, 0,299 ммоль), 2-(5-фтор-2-метилфениламино)-7-фтор-6-бензоксазолилуксусной кислоте (92,3 мг, 0,299 ммоль) и HOBt (8,1 мг, 0,60 ммоль) добавляют ДМФ (4,0 мл) и EDC·HCl (86,1 мг, 0,449 ммоль). Образовавшуюся смесь перемешивают при комнатной температуре в течение 18 часов. Реакционную смесь разбавляют этилацетатом. Разбавленную смесь промывают 1 н. HCl и насыщенным водным раствором бикарбоната натрия, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси хлороформ-метанол (20:1, об./об.) метил-транс-4-((4S)-фтор-1-(2-(5-фтор-2-метоксифениламино)-7-фтор-6-бензоксазолилацетил)-(2S)-пирролидинил)карбониламино)циклогексанкарбоксилат (10%) получают в виде кристаллического порошка. Образовавшееся соединение применяют для следующей реакции без дополнительной очистки.
1H-ЯМР (CDCl3) δ: 1,00-1,30 (2H, м), 1,42-1,63 (2H, м), 1,79-2,08 (5H, м), 2,08-2,36 (5H, м), 3,59-4,06 (общий 8H, ряд м), 4,59 и 4,74 (общий 1H, д, J=9,6 Гц), 5,27 и 5,31 (общий 1H, д, J-52,4 Гц), 6,74 (1H, м), 6,97-7,17 (2H, м), 7,22 (1H, м), 7,41 (1H, м), 8,01 (2H, м).
(Стадия 4) Синтез транс-4-(((4S)-фтор-1-(2-(5-фтор-2-метоксифениламино)-7-фтор-6-бензоксазолилацетил)-(2S)-пирролидинил)карбониламино)циклогексанкарбоновой кислоты

К вышеописанному метил-транс-4-(((4S)-фтор-1-(2-(5-фтор-2-метоксифениламино)-7-фтор-6-бензоксазолилацетил)-(2S)-пирролидинил)карбониламино)циклогексанкарбоксилату добавляют ТГФ (4,0 мл) и 0,25 н. NaOH (4,0 мл). Образовавшуюся смесь перемешивают при комнатной температуре в течение 7 часов. Реакционную смесь перегоняют при пониженном давлении для удаления растворителя и остаток нейтрализуют 1 н. HCl. Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при 50°С при пониженном давлении, получая при этом указанное в заголовке соединение (142,5 мг, 85% для 2 стадий) в виде кристаллического порошка.
ИК (ATR) ν 2937, 1639, 1579, 1538 см-1;
1H-ЯМР (ДМСО-d6) δ: 1,10-1,45 (5H, м), 1,76 (2H, м), 1,90 (2H, м), 2,04-2,50 (общий 5H, м), 3,42-4,01 (общий 5H, ряд м), 4,40 и 4,63 (общий 1H, д, J=9,6 Гц), 5,25 и 5,34 (общий 1H, д, J=52,4 Гц), 6,89 (1H, м), 7,02-7,48 (4H, м), 7,90 (1H, м), 10,03 (1H, ушир.с), 12,05 (1H, ушир.с, CO2H).
МС (ESI) m/z 559 (M++1);
Анал. Вычисл. для С28Н29F3N4O5. H2О: C, 58,33; H, 5,42; N, 9,72; F, 9,89.
Найдено: C, 58,08; H, 5,38; N, 9,45; F, 9,59.
Пример 111
транс-4-((1-((5-Хлор-2-фтор-4-((1-метил-3-индолилкарбонил)амино)фенилацетил)-(4S)-фтор-(2S)-пирролидинил)карбониламино)циклогексанкарбоновая кислота:
(Стадия 1) Синтез метил-транс-4-((1-трет-бутоксикарбонил-(4S)-фтор-(2S)-пирролидинил)карбониламино)циклогексанкарбоксилата
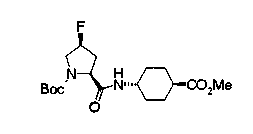
Метил-транс-4-аминоциклогексанкарбоксилат (1,02 г, 6,481 ммоль) растворяют в ДМФ (20 мл). К образовавшемуся раствору добавляют триэтиламин (2,26 мл, 16,20 ммоль) при комнатной температуре. После перемешивания в течение 5 минут к реакционной смеси добавляют 1-трет-бутоксикарбонил-(4S)-фтор-(2S)-пролин (1,51 г, 6,481 ммоль), HOBt (175,2 мг, 1,296 ммоль) и EDC·HCl (1,86 г, 9,722 ммоль). Образовавшуюся смесь перемешивают в течение 18 часов при комнатной температуре. Реакционную смесь разбавляют этилацетатом. Разбавленную смесь промывают последовательно 1 н. HCl и насыщенным водным раствором бикарбоната натрия, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси гексан-этилацетат (от 1:1 до 1:3, об./об.) метил-транс-4-((1-трет-бутоксикарбонил- (4S)-фтор-(2S)-пирролидинил)карбониламино)циклогексанкарбоксилат (1,21 г, 50%) получают в виде масла.
1H-ЯМР (CDCl3) δ: 1,03-1,20 (2H, м), 1,32-1,63 (общий 12H, м), 1,89-2,07 (5H, м), 2,23 (1H, м), 2,55 (1H, ушир.с, NH), 3,45-3,84 (общий 6H, м), 4,33 (1H, м), 5,18 (1H, д, J=52,0 Гц).
(Стадия 2) Синтез метил-транс-4-(((4S)-фтор-(2S)-пирролидинил)карбониламино)циклогексанкарбоксилат

Метил-транс-4-((1-трет-бутоксикарбонил-(4S)-фтор-(2S)-пирролидинилкарбониламино)циклогексанкарбоксилат (55,3 мг, 0,148 ммоль) растворяют в метиленхлориде (2,0 мл). К образовавшемуся раствору добавляют трифторуксусную кислоту (1,0 мл) при 0°С. Образовавшуюся смесь перемешивают при комнатной температуре в течение 2,5 часа. Реакционную смесь перегоняют при пониженном давлении для удаления растворителя. Таким образом полученный остаток разбавляют хлороформом. Раствор в хлороформе нейтрализуют насыщенным водным раствором бикарбоната натрия с последующей экстракцией смесью хлороформ-метанол (10:1, об./об.). Экстракт сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя, в результате чего метил-транс-4-(((4S)-фтор-(2S)-пирролидинил)карбониламино)циклогексанкарбоксилат получают в виде аморфного вещества. Образовавшееся соединения применяют для следующей реакции без дополнительной очистки.
1H-ЯМР (CDCl3) δ: 1,07-1,35 (2H, м), 1,43-1,65 (2H, м), 1,88-2,14 (5H, м), 2,15-2,49 (3H, м), 3,06-3,38 (2H, м), 3,60-3,88 (общий 5H, м), 5,16 (1H, ушир.д, J=53,2 Гц), 7,39 (1H, ушир.с, NH).
(Стадия 3) Синтез метил-транс-4-((1-((5-хлор-2-фтор-4-((1-метил-3-индолилкарбонил)амино)фенилацетил)-(4S)-фтор-(2S)-пирролидинил)карбониламино)циклогексанкарбоксилата
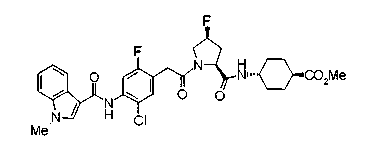
Вышеописанный метил-транс-4-(((4S)-фтор-(2S)-пирролидинил)карбониламино)циклогексанкарбоксилат (40,4 мг, 0,148 ммоль), 5-хлор-2-фтор-4-((1-метил-3-индолилкарбонил)амино)фенилуксусную кислоту (53,6 мг, 0,148 ммоль) и 1-HOBt (4,0 мг, 0,030 ммоль) растворяют в ДМФ (2,0 мл). К образовавшемуся раствору добавляют EDC·HCl (42,7 мг, 0,223 ммоль) и смесь перемешивают при комнатной температуре в течение 18 часов. Реакционную смесь разбавляют этилацетатом. Разбавленную смесь промывают последовательно 1 н. HCl и насыщенным водным раствором бикарбоната натрия, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси хлороформ-метанол (10:1, об./об.) метил-транс-4-((1-((5-хлор-2-фтор-4-((1-метил-3-индолилкарбонил)амино)фенилацетил)-(4S)-фтор-(2S)-пирролидинил)карбониламино)циклогексанкарбоксилат (62,0 мг, 68% для двух стадий) получают в виде светло-желтого аморфного вещества.
1H-ЯМР (CDCl3) δ: 1,00-2,32 (общий 12H, ряд м), 3,45-4,07 (общий 11H, ряд м), 4,55 и 4,71 (общий 1H, д, J=10,0 Гц)/ 5,26 и 5,29 (общий 1H, д, J=52,8 Гц), 7,27-7,45 (4H, м), 7,79 (1H, м), 8,12 (1H, м), 8,29 (1H, м), 8,54 (1H, дд, J=12,4 Гц).
(Стадия 4) Синтез транс-4-((1-((5-хлор-2-фтор-4-((1-метил-3-индолилкарбонил)амино)фенилацетил)-(4S)-фтор-(2S)-пирролидинил)карбониламино)циклогексанкарбоновой кислоты
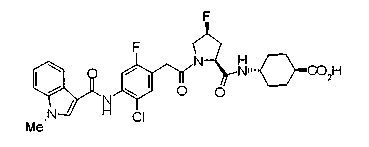
К метил-транс-4-((1-((5-хлор-2-фтор-4-((1-метил-3-индолилкарбонил)амино)фенилацетил)-(4S)-фтор-(2S)-пирролидинил)карбониламино)циклогексанкарбоксилату (62,0 мг, 0,101 ммоль) добавляют ТГФ (1,5 мл) и 0,25 н. NaOH (1,5 мл). Образовавшуюся смесь перемешивают при комнатной температуре в течение 6 часов. Реакционную смесь перегоняют при пониженном давлении для удаления растворителя. Остаток нейтрализуют 1 н. HCl. Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при 50°С при пониженном давлении, получая при этом указанное в заголовке соединение (56,3 мг, 93%) в виде белого аморфного вещества.
1H-ЯМР (ДМСО-d6) δ: 1,11-1,42 (4H, м), 1,74 (2H, м), 1,89 (2H, м), 2,05-2,52 (3H, м), 3,37-4,01 (общий 8H, ряд м), 4,40 и 4,64 (общий 1H, д, J=10,0 Гц), 5,25 и 5,36 (общий 1Н, д, J=52,4 Гц), 7,16-7,95 (общий 6H, ряд м), 8,15 (1H, д, J=8,0 Гц), 8,31 (1H, с), 9,31 (1H, м), 12,05 (1Н, с, CO2H).
МС (ESI) m/z 601 (M++1).
Пример 112
транс-4-((1-((3-Хлор-4-((1-изохинолинилкарбонил)амино)фенилацетил)-(4S)-фтор-(2S)-пирролидинил)карбониламино)циклогексанкарбоновая кислота:
(Стадия 1) Синтез метил-транс-4-((1-трет-бутоксикарбонил-(4S)-фтор-(2S)-пирролидинил)карбониламино)циклогексанкарбоксилата
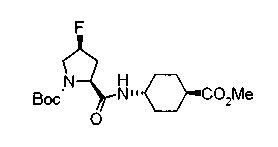
Метил-транс-4-аминоциклогексанкарбоксилат (1,02 г, 6,481 ммоль) растворяют в ДМФ (20 мл). К образовавшемуся раствору добавляют триэтиламин (2,26 мл, 16,20 ммоль) при комнатной температуре и смесь перемешивают в течение 5 минут. К реакционной смеси добавляют 1-трет-бутоксикарбонил-(4S)-фтор-(2S)-пролин (1,51 г, 6,481 ммоль) HOBt (175,2 мг, 1,296 ммоль) и EDC·HCl (1,86 г, 9,722 ммоль). Образовавшуюся смесь перемешивают при комнатной температуре в течение 18 часов. Реакционную смесь разбавляют этилацетатом. Разбавленную смесь промывают 1 н. HCl и насыщенным водным раствором бикарбоната натрия, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси гексан-этилацетат (от 1:1 до 1:3, об./об.) метил-транс-4-((1-трет-бутоксикарбонил-(4S)-фтор-(2S)-пирролидинил)карбониламино)циклогексанкарбоксилат (1,21 г, 50%) получают в виде масла.
1H-ЯМР (CDCl3) δ: 1,03-1,20 (2H, м), 1,32-1,63 (общий 12H, м), 1,89-2,07 (5H, м), 2,23 (1H, м), 2,55 (1H, ушир.с, NH), 3,45-3,84 (общий 6H, м), 4,33 (1H, м), 5,18 (1H, д, J=52,0 Гц).
(Стадия 2) Синтез метил-транс-4-(((4S)-фтор-(2S)-пирролидинил)карбониламино)циклогексанкарбоксилата
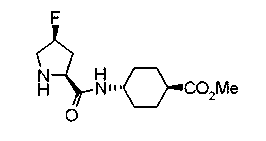
Метил-транс-4-((1-трет-бутоксикарбонил-(4S)-фтор-(2S)-пирролидинил)карбониламино)циклогексанкарбоксилат (1,21 г, 3,249 ммоль) растворяют в метиленхлориде (20 мл). К образовавшемуся раствору добавляют трифторуксусную кислоту (10 мл) при 0°С. После перемешивания при комнатной температуре в течение 3,5 часа реакционную смесь перегоняют при пониженном давлении для удаления растворителя. Остаток растворяют в хлороформе. Образовавшийся раствор нейтрализуют насыщенным водным раствором бикарбоната натрия с последующей экстракцией смесью хлороформ-метанол (10:1, об./об.). Экстракт сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя, получая при этом метил-транс-4-(((4S)-фтор-(2S)-пирролидинил)карбониламино)циклогексанкарбоксилат в виде густой вязкой жидкости. Образовавшееся соединение используют для следующей стадии без дополнительной очистки.
1H-ЯМР (CDCl3) δ: 1,07-1,35 (2H, м), 1,43-1,65 (2H, м), 1,88-2,14 (5H, м), 2,15-2,49 (3H, м), 3,06-3,38 (2H, м), 3,60-3,88 (общий 5H, м), 5,16 (1H, ушир.д, J=53,2 Гц), 7,39 (1H, ушир.с, NH).
(Стадия 3) Синтез метил-транс-4-((1-((3-хлор-4-((1-изохинолинилкарбонил)амино)фенилацетил)-(4S)-фтор-(2S)-пирролидинил)карбониламино)циклогексанкарбоксилат
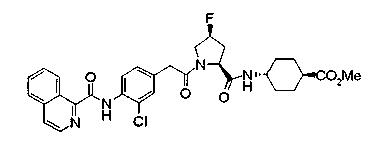
Вышеописанный метил-транс-4-(((4S)-фтор-(2S)-пирролидинил)карбониламино)циклогексанкарбоксилат (80,6 мг, 0,296 ммоль), 3-хлор-4-((1-изохинолинилкарбонил)амино)фенилуксусную кислоту (100,9 мг, 0,296 ммоль) и 1-HOBt (8,0 мг, 0,059 ммоль) растворяют в ДМФ (4,0 мл). К образовавшемуся раствору добавляют EDC·HCl (85,1 мг, 0,444 ммоль). Образовавшуюся смесь перемешивают в течение 18 часов при комнатной температуре. Реакционную смесь разбавляют этилацетатом. Разбавленную смесь промывают последовательно 1 н. HCl и насыщенным водным раствором бикарбоната натрия, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси хлороформ-метанол (20:1, об./об.) метил-транс-4-((1-((3-хлор-4-((1-изохинолинилкарбонил)амино)фенилацетил)-(4S)-фтор-(2S)-пирролидинил)карбониламино)циклогексанкарбоксилат (172,1 мг, 98%) получают в виде густой вязкой жидкости.
1H-ЯМР (CDCl3) δ: 0,98-1,23 (2H, м), 1,43-1,65 (2H, м), 1,88-2,10 (6H, м), 2,24 (1H, м), 3,52-4,06 (общий 8H, ряд м), 4,52 и 4,74 (общий 1H, д, J=9,6 Гц), 5,26 (1H, д, J=53,3 Гц), 5,96 и 6,32 (общий 1H, д, J=8,5 Гц), 7,24 и 7,28 (общий 1H, с), 7,39 и 7,44 (общий 1H, с), 7,74 (2H, м), 7,89 (2H, м), 8,59 (1H, м), 8,66 (1H, д, J=8,0 Гц), 8,71 (1H, д, J=8,4 Гц), 9,70 (1H, д, J=8,4 Гц), 11,03 и 11,07 (общий 1H, с).
(Стадия 4) Синтез транс-4-((1-(3-Хлор-4-((1-изохинолинилкарбонил)амино)фенилацетил)-(4S)-фтор-(2S)-пирролидинилкарбониламино)циклогексанкарбоновой кислоты
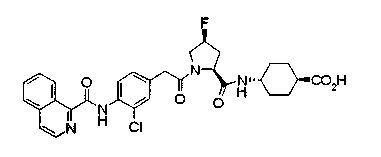
К метил-транс-4-((1-((3-хлор-4-((1-изохинолинилкарбонил)амино)фенилацетил)-(4S)-фтор-(2S)-пирролидинил)карбониламино)циклогексанкарбоксилату (172,1 мг, 0,289 ммоль) добавляют ТГФ (4,0 мл) и 0,25 н. NaOH (4,0 мл). Образовавшуюся смесь перемешивают при комнатной температуре в течение 7 часов. Реакционную смесь перегоняют при пониженном давлении для удаления растворителя. Остаток нейтрализуют 1 н. HCl. Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при 50°С при пониженном давлении, получая при этом указанное в заголовке соединение (147,5 мг, 88%) в виде аморфного вещества.
ИК (ATR) ν 2940, 1652, 1517 см-1;
1H-ЯМР (ДМСО-d6) δ: 1,11-1,44 (4H, м), 1,76 (2H, м), 1,90 (2H, м), 2,07-2,62 (3H, м), 3,40-3,99 (общий 5H, ряд м), 4,41 и 4,61 (общий 1H, д, J=9,6 Гц), 5,26 и 5,34 (общий 1H, д, J=53,3 Гц), 7,23-7,96 (общий 5H, ряд м), 8,09-8,27 (3H, м), 8,67 (1H, д, J=5,6 Гц), 9,32 (1H, д, J=8,8 Гц), 10,83 (1H, с), 12,05 (1H, ушир.с, CO2H).
МС (ESI) m/z 581 (M++1);
Анал. Вычисл. для С30Н30ClFN4O5·0,75H2О: C, 60,61; H, 5,34; N, 9,42; Cl, 5,96; F, 3,20.
Найдено: C, 60,50; H, 5,31; N, 9,24; Cl, 6,09; F, 2,95.
Пример 113
4-((1-((5-Хлор-2-фтор-4-(1-метил-3-индолилкарбониламино)фенил)ацетил)-(4S)-фтор-(2S)-пирролидинил)карбонил)-1-пиперазинилуксусная кислота:
(Стадия 1) Синтез метил-4-((1-((5-хлор-2-фтор-4-(1-метил-3-индолилкарбониламино)фенил)ацетил)-(4S)-фтор-(2S)-пирролидинил)карбонил)-1-пиперазинилацетата

В ДМФ (10 мл) растворяют (5-хлор-2-фтор-4-(1-метил-3-индолилкарбониламино)фенил)уксусную кислоту (300 мг, 0,832 ммоль) и метил-4-(((4S)-фтор-(2S)-пирролидинил)карбонил)-1-пиперазинилацетат (300 мг, 1,10 ммоль). К образовавшемуся раствору добавляют EDC·HCl (239 мг, 1,25 ммоль), DMAP (кат.) и HOBt (каталитическое количество). Образовавшуюся смесь перемешивают при комнатной температуре в течение 12 часов. К реакционной смеси добавляют воду (100 мл) с последующей экстракцией этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над сульфатом магния и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси хлороформ-метанол (20:1) метил-4-((1-((5-хлор-2-фтор-4-(1-метил-3-индолилкарбониламино)фенил)ацетил)-(4S)-фтор-(2S)-пирролидинил)карбонил)-1-пиперазинилацетат (419 мг, 82%) получают в виде бесцветной пены.
1H-ЯМР (CDCl3) δ: 2,04-2,62 (ряд м, 6H), 3,23-4,14 (ряд м, 16H), 4,76-5,39 (м, 2H), 7,32-7,52 (м, 4H), 7,79 (с, 1H), 8,12 (дд, J=9,3,5,1 Гц, 1H), 8,29 (с, 1H), 8,47-8,51 (м, 1H).
МС (ESI) m/z 616 (М++1).
(Стадия 2) Синтез 4-((1-((5-хлор-2-фтор-4-(1-метил-3-индолилкарбониламино)фенил)ацетил)-(4S)-фтор-(2S)-пирролидинил)карбонил)-1-пиперазинилуксусной кислоты
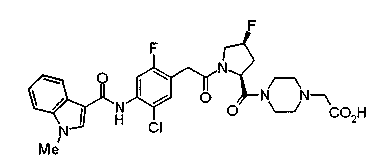
К метил-4-((1-((5-хлор-2-фтор-4-(1-метил-3-индолилкарбониламино)фенил)ацетил)-(4S)-фтор-(2S)-пирролидинил)карбонил)-1-пиперазинилацетату (410 мг, 0,666 ммоль) добавляют ТГФ (10 мл) и 0,25 н. NaOH (5,3 мл, 1,33 ммоль). Образовавшуюся смесь перемешивают при комнатной температуре в течение 15 часов. К реакционной смеси добавляют воду (50 мл) и водный раствор нейтрализуют 1 н. HCl с последующей экстракцией смесью 20% хлороформ-метанол (2×100 мл). Экстракт сушат над безводным сульфатом магния и перегоняют при пониженном давлении для удаления растворителя, в результате чего указанное в заголовке соединение (240 мг, 60%) получают в виде бесцветного аморфного вещества.
1H-ЯМР (ДМСО) δ: 2,00-4,11 (ряд м, 19H), 4,92 и 5,21 (д, J=9,8 Гц, каждый, общий 1H), 5,31 и 5,45 (м, каждый, общий 1Н), 7,20-7,30 (м, 2H), 7,41 и 7,52 (д, J=7,8 Гц, каждый, общий 1H), 7,56 (д, J=8,3 Гц, 1H), 7,72 (д, J=11,0 Гц, 1Н), 8,16 (д, J=7,8 Гц, 1H), 8,31 (с, 1H), 9,31 (с, 1H).
МС (ESI) m/z 602 (M++1);
Анал. Вычисл. для С29Н30ClF2N5O5·3,75 H2О; C, 52,02; H, 5,64; N, 10,46.
Найдено: C, 51,59; H, 5,25; N, 10,13.
Пример 114
транс-4-(1-((2-(2-Хлорфениламино)-7-фтор-6-бензоксазолил)ацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоновая кислота:
(Стадия 1) Синтез метил-транс-4-(1-((2-(2-хлорфениламино)-7-фтор-6-бензоксазолил)ацетил)-(4S)-метокси-(2S)-пирролидинилметокси)циклогексанкарбоксилата
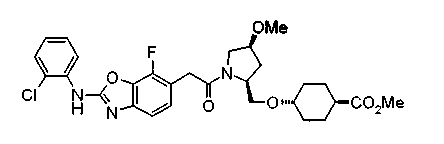
В ДМФ (3 мл) (2-(2-хлорфениламино)-7-фтор-6-бензоксазолил)уксусную кислоту (100 мг, 0,369 ммоль), метил-транс-4-((4S)-метокси-(2S)-пирролидинилметокси)циклогексанкарбоксилат (118 мг, 0,369 ммоль), EDC·HCl (106 мг, 0,554 ммоль), HOBt (75 мг, 0,554 ммоль) и триэтиламин (0,26 мл, 1,85 ммоль) перемешивают при комнатной температуре в течение 14 часов. Реакционную смесь выливают в ледяную воду с последующей экстракцией этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией с использованием тонкослойной пластины силикагеля, посредством чего из элюатных фракций смеси хлороформ/ацетон (10/1, об./об.) метил-транс-4-(1-((2-(2-хлорфениламино)-7-фтор-6-бензоксазолил)ацетил)-(4S)-метокси-(2S)-пирролидинилметокси)циклогексанкарбоксилат (151 мг, 71%) получают в виде бесцветного масла.
1H-ЯМР (CDCl3) δ: 1,14-1,68 (м, 4H), 1,92-2,36 (м, 6H), 3,21-3,29 (м, 1H), 3,30 и 3,33 (каждый с, общий 3H, амидные изомеры), 3,45-3,61 (м, 2H), 3,64 и 3,67 (каждый с, общий 3H, амидные изомеры), 3,71(с, 1H), 3,74-4,06 (м, 5H), 4,21-4,37 (м, 1H), 7,04 (т, J=7,6 Гц, 1H), 7,14 (т, J=7,1 Гц, 1H), 7,24 (д, J=6,6 Гц, 1H), 7,36 и 7,41 (каждый д, J=7,8 и 8,1 Гц соответственно, общий 2H, амидные изомеры), 7,58 и 7,65 (м и ушир., общий 1H, амидные изомеры), 8,52 (д, J=8,3 Гц, 1H).
МС (ESI) m/z 574 (M++1), 576 (M++3).
(Стадия 2) Синтез транс-4-(1-((2-(2-хлорфениламино)-7-фтор-6-бензоксазолил)ацетил)-(4S)-метокси-(2S)-пирролидинилметокси)циклогексанкарбоновой кислоты
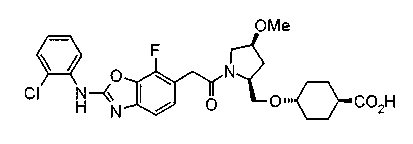
Метил-транс-4-(1-((2-(2-хлорфениламино)-7-фтор-6-бензоксазолил)ацетил)-(4S)-метокси-(2S)-пирролидинилметокси)циклогексанкарбоксилат (151 мг, 0,263 ммоль) растворяют в смеси ТГФ/метанол (2:1, 6 мл). К образовавшемуся раствору добавляют 1 н. NaOH (2 мл) и смесь перемешивают при комнатной температуре в течение 18 часов. Реакционную смесь перегоняют при пониженном давлении для удаления растворителя. Остаток подкисляют 1 н. HCl. Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при пониженном давлении. Образовавшиеся сырые кристаллы очищают хроматографией с использованием тонкослойной пластины силикагеля. Фракции элюирования смесью хлороформ/метанол (20/1) собирают и отверждают смесью хлороформ/метанол/этилацетат/н-гексан, посредством чего указанное в заголовке соединение (80 мг, 54%) получают в виде бесцветного твердого вещества.
ИК (ATR) ν 3406, 2937, 2864, 1697, 1639, 1593, 1572, 1446 см-1;
1H-ЯМР (ДМСО) δ: 1,11-1,41 (м, 4H), 1,82-2,21 (м, 1Н), 3,19 (м, 1H), 3,22 и 3,25 (каждый с, общий 3H, амидные изомеры), 3,28-4,31 (м, 8H), 7,03 и 7,06 (каждый т, каждый J=7,8 Гц, общий 1H, амидные изомеры), 7,15 (дд, J=7,8, 3,2 Гц, 1H), 7,21 (дд, J=7,8, l,O Гц, 1H), 7,42 (дт, J=6,6, l,O Гц, 1H), 7,54 (дд, J=8,1, l,O Гц, 1H), 8,05 (д, J=7,6 Гц, 1H).
МС (ESI) m/z 560 (M++1), 562 (M++3);
Анал. Вычисл. для С28Н31ClFN3O6·0,5H2О: C, 59,10; H, 5,67; N, 7,38.
Найдено: C, 59,10; H, 5,65; N, 7,20.
Пример 115
транс-4-(1-((5-Хлор-2-фтор-4-(1-метил-3-индолилкарбониламино)фенил)ацетил)-(4R)-метокси-(2S)- пирролидинилметокси)циклогексанкарбоновая кислота:
(Стадия 1) Синтез транс-4-(1-(трет-бутоксикарбонил)-(4R)-метокси-(2S)-пирролидинилметокси)циклогексанкарбоновой кислоты
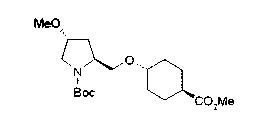
Метилиодид (436 мг, 7,00 ммоль) и транс-4-(1-(трет-бутоксикарбонил)-(4R)-метокси-(2S)-пирролидинилметокси)циклогексанкарбоновую кислоту (500 мг, 1,40 ммоль) растворяют в ДМФ (10 мл). При перемешивании при 0°С к образовавшемуся раствору порциями добавляют гидрид натрия (112 мг, 2,80 ммоль). После перемешивания при такой же температуре в течение 3 часов в реакционную смесь добавляют воду (50 мл) с последующей экстракцией этилацетатом (200 мл). Экстракт промывают насыщенным раствором соли (2×100 мл), сушат над безводным сульфатом магния и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси хлороформ-этилацетат (10:1) метил-транс-4-(1-(трет-бутоксикарбонил)-(4R)-метокси-(2S)-пирролидинилметокси)циклогексанкарбоксилат (441 мг, 85%) получают в виде бесцветного масла.
1H-ЯМР (CDCl3) δ: 1,24 (м, 2H), 1,46 (м, 11H), 2,01-2,26 (ряд м, 7H), 3,19-4,11 (ряд м, 13H).
МС (ESI) m/z 372 (M++1);
(Стадия 2) Синтез метил-транс-4-(1-(5-хлор-2-фтор-4-(1-метил-3-индолилкарбониламино)фенил)ацетил)-(4R)-метокси-(2S)- пирролидинилметокси)циклогексанкарбоксилата
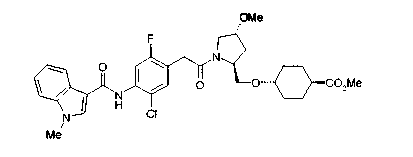
К метил-транс-4-(1-(трет-бутоксикарбонил)-(4R)-метокси-(2S)-пирролидинилметокси)циклогексанкарбоксилату (440 мг, 1,18 ммоль) добавляют диоксан (10 мл) и смесь 4 н. HCl/диоксан (10 мл). Образовавшуюся смесь перемешивают при комнатной температуре в течение 15 часов. Реакционную смесь перегоняют при пониженном давлении для удаления растворителя. Образовавшееся твердое вещество растворяют в ДМФ (10 мл) и триэтиламине (821 мкл, 5,90 ммоль). К образовавшемуся раствору добавляют (5-хлор-2-фтор-4-((1-метил-3-индолилкарбониламино)фенил)уксусную кислоту (426 мг, 1,18 ммоль), EDC·HCl (304 мг, 1,77 ммоль) и HOBt (239 мг, 1,77 ммоль). Образовавшуюся смесь перемешивают при комнатной температуре в течение 15 часов. К реакционной смеси добавляют этилацетат (100 мл) и Н2О (100 мл) для отделения слоя этилацетата. Слой этилацетата промывают насыщенным раствором соли (2×100 мл), сушат над безводным сульфатом магния и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси хлороформ-этилацетат (2:1) метил-транс-4-(1-((5-хлор-2-фтор-4-(1-метил-3-индолилкарбониламино)фенил)ацетил)-(4R)-метокси-(2S)-пирролидинилметокси)циклогексанкарбоксилат (401 мг, 55%) получают в виде бесцветной пены.
1H-ЯМР (CDCl3) δ: 1,08-1,28 (м, 2H), 1,31-1,59 (м, 2H), 1,93-2,28 (ряд м, 7H), 3,10-4,33 (ряд м, 18H), 7,34-7,44 (м, 4H), 7,82 (м, 1H), 8,14 (м, 1H), 8,30 (с, 1H), 8,48-8,53 (м, 1H).
(Стадия 3) Синтез транс-4-(1-((5-Хлор-2-фтор-4-(1-метил-3-индолилкарбониламино)фенил)ацетил)-(4R)-метокси-(2S)-пирролидинилметокси)циклогексанкарбоновой кислоты
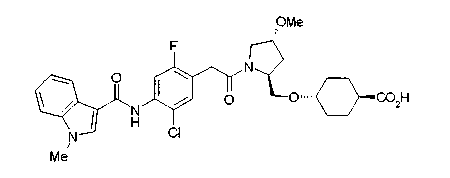
Метил-транс-4-(1-((5-хлор-2-фтор-4-(1-метил-3-индолилкарбониламино)фенил)ацетил)-(4R)-метокси-(2S)-пирролидинилметокси)циклогексанкарбоксилат (400 мг, 0,651 ммоль) растворяют в ТГФ (5 мл). К образовавшемуся раствору добавляют 0,25 н. NaOH (5,2 мл, 1,30 ммоль) и смесь перемешивают в течение 15 часов. Реакционную смесь выливают в 1 н. HCl (100 мл) с последующей экстракцией смесью хлороформ-метанол (5:1, 2×100 мл). Экстракт сушат над безводным сульфатом магния и перегоняют при пониженном давлении для удаления растворителя. К остатку добавляют этилацетат и изопропиловый эфир для кристаллизации остатка. Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении и сушат при пониженном давлении, получая при этом указанное в заголовке соединение (247 мг, 63%) в виде бесцветного аморфного вещества.
1H-ЯМР (ДМСО-d6) δ: 1,09-1,40 (ряд м, 4H), 1,83-2,18 (ряд м, 1Н), 3,19-4,30 (ряд м, 15H), 7,19-7,29 (м, 2H), 7,41-7,45 (м, 1H), 7,55 (д, J=7,8 Гц, 1H), 7,67-7,71 (м, 1H), 8,14 (д, J=7,8 Гц, 1H), 8,29 (с, 1H), 9,31 (с, 1H).
МС (ESI) m/z 600 (M++1);
Анал. Вычисл. для С31Н35ClFN3O6 ·0,5H2О: C, 61,13; H, 5,96; N, 6,90.
Найдено: C, 61,10; H, 6,06; N, 6,64.
Пример 116
транс-4-(1-((5-Хлор-2-фтор-4-(1-метил-3-индолилкарбониламино)фенил)ацетил)-(4S)-метокси-(2S)-пирролидинилметокси)циклогексанкарбоновая кислота:
(Стадия 1) Синтез метил-транс-4-(1-(трет-бутоксикарбонил)-(4S)-метокси-(2S)-пирролидинилметокси)циклогексанкарбоксилата
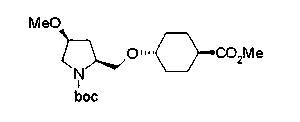
Метил-транс-4-(1-трет-бутоксикарбонил-(4S)-гидрокси-(2S)-пирролидинилметокси)циклогексанкарбоксилат (600 мг, 1,68 ммоль) растворяют в ДМФ (12 мл). К образовавшемуся раствору добавляют гидрид натрия (60% в масле) (134 мг, 3,36 ммоль) и метилиодид (0,21 мл, 3,36 ммоль) при перемешивании при 0°С в потоке газообразного азота. После перемешивания при комнатной температуре в течение 14 часов реакционную смесь выливают в ледяную воду с последующей экстракцией этилацетатом. Экстракт промывают ледяной водой и насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают флэш-хроматографией на колонке с силикагелем (Biotage flush-chromatography systems, KP-SIL 32-63 нм, 60А, н-гексан-этилацетат (4/1)), получая при этом метил-транс-4-(1-(трет-бутоксикарбонил)-(4S)-метокси-(2S)-пирролидинилметокси)циклогексанкарбоксилат (50 мг, 8%, более полярная фракция) в виде бесцветного масла.
1H-ЯМР (CDCl3) δ: 1,17-1,31 (м, 2H), 1,39-1,52 (м, 10H), 1,57 (с, 2H), 1,95-2,12 (м, 4H), 2,19 (д, J=13,4 Гц, 1H), 2,26 (т, J=11,2 Гц, 1H), 3,23 (м, 1H), 3,30 (с, 3H), 3,31-3,63 (м, 3H), 3,66 (с, 3H), 3,67-3,81 (м, 1H), 3,86-4,03 (м, 2H).
МС (ESI) m/z 372 (M++1).
(Стадия 2) Синтез метил-транс-4-((4S)-метокси-(2S)-пирролидинилметокси)циклогексанкарбоксилата
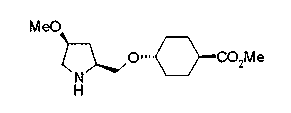
Метил-транс-4-(1-трет-бутоксикарбонил)-(4S)-метокси-(2S)-пирролидинилметокси)циклогексанкарбоксилат (50 мг, 0,135 ммоль) растворяют в метиленхлориде (5 мл). К образовавшемуся раствору добавляют трифторуксусную кислоту (0,5 мл) и смесь перемешивают при комнатной температуре в течение 14 часов. Реакционную смесь перегоняют при пониженном давлении для удаления растворителя. Остаток подщелачивают 1 н. NaOH с последующей экстракцией метиленхлоридом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя, получая при этом метил-транс-4-((4S)-метокси-(2S)-пирролидинилметокси)циклогексанкарбоксилат (59 г, 100%) в виде желтого масла.
1H-ЯМР (CDCl3) δ: 1,22-1,57 (м, 5H), 1,96-2,20 (м, 5H), 2,32 (м, 2H), 3,33 (с, 3H), 3,34-3,57 (м, 3H), 3,66 (с, 3H), 3,67-3,81 (м, 2H), 3,94 (м, 1H), 4,11 (м, 1H).
МС (ESI) m/z 272 (M++1).
(Стадия 3) Синтез метил-транс-4-(1-((5-хлор-2-фтор-4-(1-метил-3-индолилкарбониламино)фенил)ацетил)-(4S)-метокси-(2S)-пирролидинилметокси)циклогексанкарбоксилата:
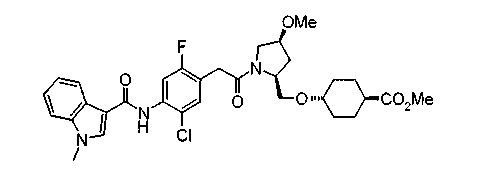
В ДМФ (2 мл) (5-хлор-2-фтор-4-(1-метил-3-индолилкарбониламино)фенил)уксусную кислоту (49 мг, 0,135 ммоль), метил-транс-4-((4S)-метокси-(2S)-пирролидинилметокси)циклогексанкарбоксилат (59 мг, 0,135 ммоль), EDC·HCl (39 мг, 0,203 ммоль), HOBt (27 мг, 0,203 ммоль) и триэтиламин (94 мкл, 0,675 ммоль) перемешивают при комнатной температуре в течение 20 часов. Реакционную смесь выливают в ледяную воду с последующей экстракцией этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией с использованием тонкослойной пластины силикагеля, посредством чего из элюатных фракций смеси хлороформ/ацетон (10/1) метил-транс-4-(1-((5-хлор-2-фтор-4-(1-метил-3-индолилкарбониламино)фенил)ацетил)-(4S)-метокси-(2S)-пирролидинилметокси)циклогексанкарбоксилат (117 мг, 100%) получают в виде желтого масла.
1H-ЯМР (CDCl3) δ: 1,25 (м, 2H), 1,46 (м, 2H), 1,94-2,14 (м, 5H), 2,19-2,14 (м, 5H), 2,19-2,33 (м, 2H), 3,25 (м, 1H), 3,30 и 3,33 (каждый с, общий 3H, амидные изомеры), 3,46-3,61 (м, 3H), 3,64 и 3,66 (каждый с, общий 3H, амидные изомеры), 3,67-3,86 (м,3H), 3,88 (с, 3H), 3,95 и 4,00 (каждый м, общий 1H, амидные изомеры), 4,21 и (кв. и м, J=7,1 Гц, общий 1Н, амидные изомеры), 7,30-7,46 (м, 4H), 7,80 (с, 1H), 8,14 (д, J=5,6 Гц, 1H), 8,29 (с, 1H), 8,48 и 8,51 (каждый д, J=9,3 и 9,5 Гц соответственно, общий 1H).
МС (ESI) m/z 614 (M++1), 616 (M++3).
(Стадия 4) Синтез транс-4-(1-((5-хлор-2-фтор-4-(1-метил-3-индолилкарбониламино)фенил)ацетил)-(4S)-метокси-(2S)-пирролидинилметокси)циклогексанкарбоновой кислоты
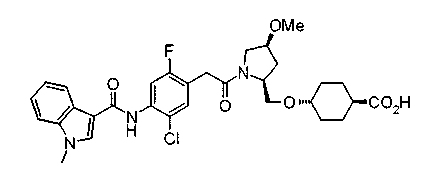
К метил-транс-4-(1-((5-хлор-2-фтор-4-(1-метил-3-индолилкарбониламино)фенил)ацетил)-(4S)-метокси-(2S)-пирролидинилметокси)циклогексанкарбоксилату (117 мг, 0,135 ммоль) добавляют смесь ТГФ/метанол (2:1, 6 мл) и 1 н. NaOH (2 мл). Образовавшуюся смесь перемешивают при комнатной температуре в течение 16 часов. Реакционную смесь перегоняют при пониженном давлении для удаления растворителя. Остаток подкисляют 1 н. HCl. Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при пониженном давлении, получая при этом указанное в заголовке соединение (78 мг, 96% (3 стадии)) в виде бесцветного твердого вещества.
ИК (ATR) ν 3423, 2937, 1701, 1664, 1626, 1587, 1522, 1402 см-1;
1H-ЯМР (ДМСО-d6) δ: 1,12-1,42 (м, 4H), 1,82-2,19 (м, 7H), 3,23 и 3,26 (каждый с, общий 3H, амидные изомеры), 3,44-3,83 (м, 5H), 3,89 (с, 3H), 3,94 и 4,25 (м и кв., J=5,8 Гц, общий 1H, амидные изомеры), 4,03 (ушир., 1H), 7,22 (т, J=7, 3 Гц, 1H), 7,27 (т, J=6,8 Гц, 1H), 7,42 и 7,45 (каждый д, каждый J=7,6 Гц, общий 1Н, амидные изомеры), 7,65 (д, J=8,1 Гц, 1H), 7,68 и 7,70 (д, J=11,2 и 11,0 Гц соответственно, общий 1H, амидные изомеры), 8,15 (д, J=7,8 Гц, 1H), 8,31 (д, J=2,2 Гц, 1H), 9,31 (с, 1H).
МС (ESI) m/z 600 (M++1), 602 (M++3);
Анал. Вычисл. для С31Н35ClFN3O6·0,8H2О: C, 60,59; H, 6,00; N, 6,84.
Найдено: C, 60,60; H, 5,97; N, 6,74.
Пример 117
транс-4-((4S)-Аллилокси-(1-((5-хлор-2-фтор-4-(1-метил-3-индолилкарбониламино)фенил)ацетил)-(2S)-пирролидинилметокси)циклогексанкарбоновая кислота:
(Стадия 1) Синтез этил-транс-4-((4S)-аллилокси-1-(трет-бутоксикарбонил)-(2S)-пирролидинилметокси)циклогексанкарбоксилата

Этил-транс-4-(1-(трет-бутоксикарбонил)-(4S)-гидрокси-(2S)-пирролидинилметокси)циклогексанкарбоксилат (810 мг, 2,18 ммоль) растворяют в ДМФ (15 мл). К образовавшемуся раствору порциями добавляют при перемешивании при 0°С аллилбромид (0,378 мл, 4,36 ммоль) и гидрид натрия (60% в масле, 175 мг, 4,37 ммоль). После перемешивания реакционной смеси при комнатной температуре в течение 2,5 часа далее добавляют аллилбромид (0,189 мл, 2,18 ммоль) и гидрид натрия (60% в масле, 88 мг, 2,18 ммоль). Образовавшуюся смесь перемешивают при комнатной температуре в течение 2 часов. Реакционную смесь выливают в ледяную воду и затем подкисляют 1 н. HCl. Реакционную смесь экстрагируют этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом магния и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси н-гексан-этилацетат (2:1, об./об.) этил-транс-4-((4S)-аллилокси-1-(трет-бутоксикарбонил)-(2S)-пирролидинилметокси)циклогексанкарбоксилат (626 мг, 70%) получают в виде светло-желтого масла.
МС (ESI) m/z 412 (M++1).
(Стадия 2) Синтез этил-транс-4-((4S)-аллилокси-(2S)-пирролидинилметокси)циклогексанкарбоксилата
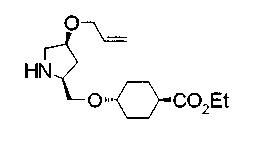
Этил-транс-4-((4S)-аллилокси-1-(трет-бутоксикарбонил)-(2S)-пирролидинилметокси)циклогексанкарбоксилат (308 мг, 0,75 ммоль) растворяют в метиленхлориде (5 мл). К образовавшемуся раствору добавляют трифторуксусную кислоту (1 мл) и образовавшуюся смесь перемешивают при комнатной температуре в течение 2 часов. Реакционную смесь перегоняют при пониженном давлении для удаления растворителя. Остаток нейтрализуют насыщенным водным раствором бикарбоната натрия. Смесь экстрагируют смесью хлороформ-метанол (5:1, об./об.) Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом магния и перегоняют при пониженном давлении для удаления растворителя, получая при этом этил-транс-4-((4S)-аллилокси-(2S)-пирролидинилметокси)циклогексанкарбоксилат (230 мг, 99%) в виде светло-желтого масла.
1H-ЯМР (CDCl3) δ: 1,24 (м, общий 4H), 1,45 (кв., J=11,6 Гц, 2H), 1,55 (м, 1H), 1,85-1,58 (ряд м, общий 4H), 2,25 (м, 2H), 2,92 и 2,95 (дд, J=5,2, 2,8 Гц, каждый, общий 1H), 3,06-3,09 (м, 1Н), 3,62 (м, 2H), 3,51 (м, 2H), 4,93 (м, 2H), 4,06 (м, 1H), 4,10 (кв., J=7,2 Гц, 2H), 4,46 (м, 1H), 5,15 (м, 1H), 5,25 (м, 2H), 5,88 (м, 1H).
МС (LC-МС) m/z 312 (M++1).
(Стадия 3) Синтез этил-транс-4-((4S)-аллилокси-(1-((5-хлор-2-фтор-4-(1-метил-3-индолилкарбониламино)фенил)ацетил)-(2S)-пирролидинилметокси)циклогексанкарбоксилата
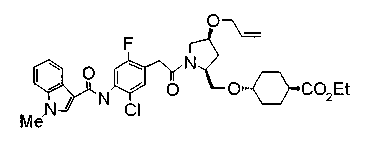
Этил-транс-4-((4S)-аллилокси-(2S)-пирролидинилметокси)циклогексанкарбоксилат (202 мг, 0,65 ммоль) и (5-хлор-2-фтор-4-(1-метил-3-индолилкарбониламино)фенил)уксусную кислоту (234 мг, 0,65 ммоль) растворяют в ДМФ (7 мл). К образовавшемуся раствору добавляют EDC·HCl (188 мг, 0,98 ммоль), HOBt (2,5 мг, 0,02 ммоль) и DMAP (2,5 мг, 0,02 ммоль) и образовавшуюся смесь перемешивают при комнатной температуре в течение 14 часов. К реакционной смеси добавляют воду с последующей экстракцией этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом магния и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси хлороформ-метанол (20:1, об./об.) этил-транс-4-((4S)-аллилокси-(1-((5-хлор-2-фтор-4-(1-метил-3-индолилкарбониламино)фенил)ацетил)-(2S)-пирролидинилметокси)циклогексанкарбоксилат (358 мг, 84%) получают в виде желтого масла.
ИК (ATR) ν 1724, 1643, 1514 см-1;
1H-ЯМР (CDCl3) δ: 1,24 (м, 3H), 1,26 (м, 2H), 1,46 (м, 2H), 1,96-2,10 (ряд м, общий 4H), 2,26 (м, 2H), 3,24 (м, 1H), 3,50-3,59 (ряд м, общий 3H), 3,72 (м, 2H), 3,82 (м, 1H), 3,89 (с, 3H), 3,96 (д, J=5,2 Гц, 1H), 4,04 (м, 1H), 4,10 (м, 3H), 4,24 (м, 1H), 4,56 (м, 1H), 5,20 (м, 1H), 5,28 (м, 1H), 5,88 (м, 1Н), 7,35 (м, 2H), 7,41 (м, 2H), 7,81 (д, J=2,0 Гц, 1H), 8,13 (м, 1H), 8,30 (м, 1H), 8,50 (дд, J=12,4, 9,6 Гц, 1H).
МС (ESI) m/z 655 (M++1);
Анал. Вычисл. для С35Н41ClFN3O6·0,25 H2O: C, 63,82; H, 6,35; N, 6,38.
Найдено: С, 63,86; H, 6,32; N, 6,23.
(Стадия 4) Синтез транс-4-((4S)-аллилокси-1-((5-хлор-2-фтор-4-(1-метил-3-индолилкарбониламино)фенил)ацетил)-(2S)-пирролидинилметокси)циклогексанкарбоновой кислоты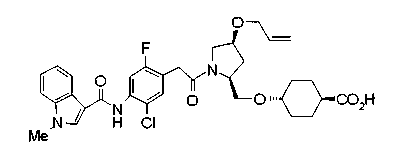
Этил-транс-4-((4S)-аллилокси-(1-((5-хлор-2-фтор-4-(1-метил-3-индолилкарбониламино)фенил)ацетил)-(2S)-пирролидинилметокси)циклогексанкарбоксилат (244 мг, 0,37 ммоль) растворяют в ТГФ (3,5 мл). К образовавшемуся раствору добавляют 0,25 н. NaOH (3,5 мл) с последующим перемешиванием при 50°С в течение 5 часов. После охлаждения до комнатной температуры реакционную смесь концентрируют при пониженном давлении. Концентрат нейтрализуют 1 н. HCl с последующей экстракцией смесью хлороформ-метанол (5:1, об./об.). Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом магния и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси хлороформ-метанол (10:1, об./об.) указанное в заголовке соединение (145 мг, 63%) получают в виде белого твердого вещества.
ИК (KBr) ν 2935, 1724, 1616, 1513 см-1;
1H-ЯМР (ДМСО-d6) δ: 1,60 (м, 2H), 1,31 (м, 2H), 1,83-1,99 (ряд м, общий 4H), 2,09 (м, 2H), 3,14 (м, 1H), 3,23 (m/ 1H), 3,35-3,79 (ряд м, общий 5H), 3,85 (с, 3H), 3,88-3,96 (ряд м, общий 3H), 4,02-4,13 (ряд м, общий 2H), 5,13 (м, 1H), 5,23 (м, 1H), 5,87 (м, 1H), 7,20 (т, J=7,2 Гц, 1H), 7,26 (т, J=7,2 Гц, 1H), 7,40 (т, J=8,0 Гц, 1H), 7,53 (д, J=8,0 Гц, 1H), 7,67 и 7,68 (д, J=10,8 Гц, общий 1H), 8,12 (д, J=8,0 Гц, 1H), 8,24 (д, J=6,0 Гц, 1H), 9,29 (с, 1H).
МС (ESI) m/z 27 (M++1);
Анал. Вычисл. С33Н37ClFN3O6 ·0,5H2О: C, 62,41; H, 6,03; N, 6,62.
Найдено: C, 62,33; H, 5,96; N, 6,46.
Пример 118
транс-4-(1-((5-Хлор-2-фтор-4-(1-метил-3-индолилкарбониламино)фенил)ацетил)-(4S)-пропокси-(2S)-пирролидинилметокси)циклогексанкарбоновая кислота:
(Стадия 1) Синтез этил-транс-((4S)-пропокси-(2S)-пирролидинилметокси)циклогексанкарбоксилата
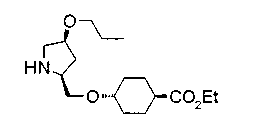
Этил-транс-4-(1-(трет-бутоксикарбонил)-(4S)-аллилокси-(2S)-пирролидинилметокси)циклогексанкарбоксилат (318 мг, 0,77 ммоль) растворяют в этаноле (8 мл). К образовавшемуся раствору добавляют катализатор 5% палладий-уголь (50 мг). Образовавшуюся смесь подвергают каталитическому гидрированию при комнатной температуре в течение 48 часов при давлении газообразного водорода 1 атм. После удаления катализатора из реакционной смеси фильтрованием фильтрат перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси н-гексан-этилацетат (4:1, об./об.) получают масло (275 мг). Образовавшееся масло растворяют в метиленхлориде (7 мл). К образовавшемуся раствору добавляют трифторуксусную кислоту (2 мл) и смесь перемешивают при комнатной температуре в течение 2 часов. Реакционную смесь перегоняют при пониженном давлении для удаления растворителя. Остаток нейтрализуют насыщенным водным раствором бикарбоната натрия с последующей экстракцией смесью хлороформ-метанол (10:1, об./об.). Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом магния и перегоняют при пониженном давлении для удаления растворителя, получая при этом этил-транс-4-((4S)-пропокси-(2S)-пирролидинилметокси)циклогексанкарбоксилат (208 мг,86%) в виде желтого масла
1H-ЯМР (CDCl3) δ: 0,91 (т, J=7,2 Гц, 3H), 1,24 (т, J=1,2Ez, 3H), 1,27 (м, 2H), 1,38-1,66 (ряд м, общий 6H), 1,99 (м, 3H), 2,07 (м, 2H), 2,24 (м, 1H), 2,89 и 2,92 (д, J=5,6 Гц, каждый, общий 1H), 3,02 и 3,05 (д, J=2,4 Гц, каждый, общий 1H), 3,24 (м, 2H), 3,32 (дт, J=6,8, 1,2 Гц, 2H), 3,49 (м, 2H), 3,98 (м, 1H), 4,11 (кв., J=7,2 Гц, 2H).
МС (ESI) m/z 314 (M++1).
(Стадия 2) Синтез этил-транс-4-(1-((5-хлор-2-фтор-4-(1-метил-3-индолилкарбониламино)фенил)ацетил)-(4S)-пропокси-(2S)-пирролидинилметокси)циклогексанкарбоксилата

В ДМФ (7 мл) растворяют (5-хлор-2-фтор-4-((1-метил-3-индолилкарбонил)амино)фенил)уксусную кислоту (238 мг, 0,66 ммоль) и этил-транс-4-((4S)-пропокси-(2S)-пирролидинилметокси) циклогексанкарбоксилат (208 мг, 0,66 ммоль). К образовавшемуся раствору добавляют EDC·HCl (190 мг, 0,99 ммоль), HOBt (5 мг, 0,04 ммоль) и DMAP (5 мг, 0,04 ммоль). Образовавшуюся смесь перемешивают при комнатной температуре в течение 14 часов. К реакционной смеси добавляют воду с последующей экстракцией этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом магния и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси хлороформ-метанол (20:1, об./об.) этил-транс-4-(1-((5-хлор-2-фтор-4-(1-метил-3-индолилкарбониламино)фенил)ацетил)-(4S)-пропокси-(2S)-пирролидинилметокси)циклогексанкарбоксилат (424 мг, 98%) получают в виде белого кристаллического порошка.
ИК (ATR) 2935, 1726, 1647, 1514 см-1;
1H-ЯМР (CDCl3) δ: 0,93 (м, 3H), 1,25 (м, 4H), 1,46 (м, 2H), 1,58 (м, 2H), 1,97-2,06 (ряд м, общий 6H), 2,24 (м, 2H), 3,24 (м, 1H), 3,35 (м, 2H), 3,43 (м, 1H), 3,49-3,59 (ряд м, общий 3H), 3,72 (м, 1H), 3,86 (м, 1H), 3,89 и 3,90 (ряд с, общий 3H), 4,02 (м, 1H), 4,11 (м, 2H), 4,26 (м, 1H), 7,35 (м, 2H), 7,41 (м, 2H), 7,81 (м, 1H), 8,14 (м, 1H), 8,30 (ушир.с, 1H), 8,50 (м, 1H).
Анал. Вычисл. для С35Н43ClFN3O6: С, 64,06; H, 6,61; N, 6,40.
Найдено: С, 63,92; H, 6,70; N, 76,24.
(Стадия 3) транс-4-(1-((5-Хлор-2-фтор-4-(1-метил-3-индолилкарбониламино)фенил)ацетил)-(4S)-пропокси-(2S)-пирролидинилметокси)циклогексанкарбоновая кислота
Этил-транс-4-(1-((5-хлор-2-фтор-4-(1-метил-3-индолилкарбониламино)фенил)ацетил)-(4S)-пропокси-(2S)-пирролидинилметокси)циклогексанкарбоксилат (411 мг, 0,63 ммоль) растворяют в ТГФ (5 мл). К образовавшемуся раствору добавляют 0,25 н. NaOH (5 мл). Образовавшуюся смесь перемешивают при комнатной температуре в течение 14 часов. Реакционную смесь концентрируют при пониженном давлении и подкисляют 1 н. HCl с последующей экстракцией смесью хлороформ-метанол (5:1, об./об.). Экстракт сушат над безводным сульфатом магния и растворитель отгоняют при пониженном давлении. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси хлороформ-метанол (20:1, об./об.) указанное в заголовке соединение(253 мг, 64%) получают в виде белого твердого вещества.
ИК (ATR) 2935, 1724, 1616, 1513 см-1;
1H-ЯМР (ДМСО-d6) δ: 0,84 (м, 3H), 1,15 (м, 2H) 1,30 (м, 2H), 1,47 (м, 3H), 1,85-1,98 (м, 4H), 2,02 (м, 1H), 2,11 (м, 1H), 3,12 (м, 1H), 3,23 (м, 2H), 3,35 (м, 3H), 3,44-3,52 (м, 2H), 3,84 (с, 3H), 4,00 (м, 3H), 4,20 (м, 1H), 7,20 (дт, J=7,6, 2,2 Гц, 1H), 7,25 (дт, J=7,7, 2,2 Гц, 1H), 7,39 (дт, J=8,0, 3,4 Гц, 1H), 7,52 (дд, J=8,0, 2,2 Гц, 1H), 7,66 (ддд, J=11,0, 6,6, 3,4 Гц, 1H), 8,11 (дд, J=7,8, 2,2 Гц, 1H), 8,82 (м, 1H), 9,29 (с, 1H).
МС (ESI) m/z 629 (M++1);
Анал. Вычисл. для С33Н39ClFN3O6 0,75H2О: C, 61,77; H, 6,36; N, 6,55.
Найдено: C, 61,73; H, 6,18; N, 6,42.
Пример 119
транс-4-(1-((5-Хлор-2-фтор-4-(1-метил-3-индолилкарбониламино)фенил)ацетил)-(4S)-циклогексилокси-(2S)-пирролидинилметокси)циклогексанкарбоновая кислота:
(Стадия 1) Синтез метил-транс-4-(1-трет-бутоксикарбонил-(4S)-циклогексилокси-(2S)-пирролидинилметокси)циклогексанкарбоксилата
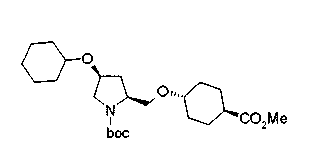
В смеси метанол/HCl (40/1, 20,5 мл) метил-4-((4S)-фенокси-(2S)-пирролидинилметокси)бензоат (560 мг, 1,71 ммоль) и катализатор родий-оксид алюминия (1,30 г) подвергают каталитическому гидрированию при комнатной температуре в атмосфере водорода при 4 кг/см2 в течение 4 дней. Катализатор отфильтровывают от реакционной смеси. Фильтрат перегоняют при пониженном давлении для удаления растворителя, получая при этом гидрохлорид метил-4-((4S)-циклогексилокси-(2S)-пирролидинилметокси)циклогексанкарбоксилата в виде твердого вещества. Образовавшееся соединение используют для следующей реакции без дополнительной очистки.
В смеси 1,4-диоксан/вода (1:1, 20 мл) ди-трет-бутилдикарбонат (448 мг, 2,15 ммоль) добавляют к гидрохлориду метил-4-((4S)-циклогексилокси-(2S)-пирролидинилметокси)циклогексанкарбоксилата (1,71 ммоль) и бикарбонату натрия (862 мг, 10,3 ммоль) и образовавшуюся смесь перемешивают при комнатной температуре в течение 18 часов. Реакционную смесь экстрагируют этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси н-гексан/этилацетат (2/1) метил-4-(1-трет-бутоксикарбонил-(4S)-циклогексилокси-(2S)-пирролидинилметокси)циклогексанкарбоксилат (642 мг, 85%) получают в виде бесцветного масла.
Таким образом полученный метил-4-(1-трет-бутоксикарбонил-(4S)-циклогексилокси-(2S)-пирролидинилметокси)циклогексанкарбоксилат (642 мг, 1,46 ммоль) растворяют в метаноле. К образовавшемуся раствору добавляют метоксид натрия (789 мг, 14,6 ммоль) и смесь нагревают при кипячении с обратным холодильником в течение 19 часов. После охлаждения до комнатной температуры реакционную смесь перегоняют при пониженном давлении для удаления растворителя. Остаток подкисляют 1 н. HCl с последующей экстракцией этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси н-гексан/этилацетат (20/1, об./об.) целевой метил-транс-4-(1-трет-бутоксикарбонил-(4S)-циклогексилокси-(2S)-пирролидинилметокси) циклогексанкарбоксилат (90 мг, 14% (3 стадии) получают в виде бесцветного масла.
Кроме того, получают цис-изомер (90 мг, 14% (3 стадии); неполярная фракция) в виде бесцветного масла и смесь (30 мг) обоих изомеров.
Транс-изомер: 1H-ЯМР (CDCl3) δ: 1,16-1,31 (м, 8H), 1,42 (с, 9H), 1,63-2,31 (м, 14H), 3,21-3,33 (м, 3H), 3,42-3,63 (м, 2H), 3,66 (с, 3H), 3,71-4,00 (м, 1H), 4,11(м, 1H);
МС (ESI) m/z 440 (M++1).
Цис-изомер: 1H-ЯМР (CDCl3) δ: 1,19-1,32 (м, 8H), 1,45 (с, 9H), 1,57-2,18 (м, 13H), 2,34 (ушир., 1H), 3,22-3,99 (м, 1H), 4,13 (м, 1H);
МС (ESI) m/z 440 (M++1).
(Стадия 2) Синтез метил-транс-4-((4S)-циклогексилокси-(2S)-пирролидинилметокси)циклогексанкарбоксилата
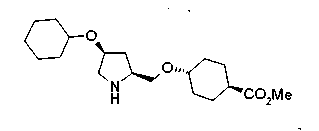
Метил-транс-4-(1-трет-бутоксикарбонил-(4S)-циклогексилокси-(2S)-пирролидинилметокси)циклогексанкарбоксилат (90 мг, 0,205 ммоль) растворяют в метиленхлориде (10 мл). К образовавшемуся раствору добавляют трифторуксусную кислоту (1 мл) и смесь перемешивают при комнатной температуре в течение 19 часов. Реакционную смесь перегоняют при пониженном давлении для удаления растворителя. Остаток делают щелочным добавлением метиленхлорида и 1 н. NaOH с последующей экстракцией метиленхлоридом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя, в результате чего метил-транс-4-((4S)-циклогексилокси-(2S)-пирролидинилметокси)циклогексанкарбоксилат (16 мг, 23%) получают в виде желтого масла. Образовавшееся соединение используют для следующей реакции без дополнительной очистки.
1H-ЯМР (CDCl3) δ: 1,14-1,38 (м, 7Н), 1,41-1,63 (м, 4H), 1,86 (с, 2H), 1,99-2,21 (м, 5H), 2,22-2,36 (м, 1H), 2,43 (м, 2H), 2,92-3,07 (м, 2H), 3,44-3,56 (м, 2H), 3,66 (с, 3H), 4,15 (м, 1H).
МС (ESI) m/z 340 (M++1).
(Стадия 3) Синтез метил-транс-4-(1-((5-хлор-2-фтор-4-(1-метил-3-индолилкарбониламино)фенил)ацетил)-(4S)-циклогексилокси-(2S)-пирролидинилметокси)циклогексанкарбоксилата
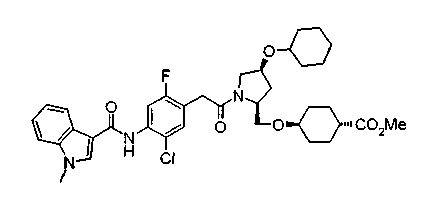
В ДМФ (1 мл) (5-хлор-2-фтор-4-((1-метил-3-индолилкарбонил)амино)фенил)уксусную кислоту (17 мг, 47,1 мкмоль), метил-транс-4-(4S)-циклогексилокси-(2S)-пирролидинилметокси)циклогексанкарбоксилат (16 мг, 47,1 мкмоль), EDC·HCl (13,5 мг, 70,7 мкмоль), HOBt (9,6 мг, 70,0 мкмоль) и триэтиламин (32,8 мкл, 236 мкмоль) перемешивают при комнатной температуре в течение 17 часов. Реакционную смесь выливают в ледяную воду с последующей экстракцией этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией с использованием тонкослойной пластины силикагеля, посредством чего из элюатных фракций смеси хлороформ/ацетон (10/1, об./об.), метил-транс-4-(1-((5-хлор-2-фтор-4-(1-метил-3-индолилкарбониламино)фенил)ацетил)-(4S)-циклогексилокси-(2S)-пирролидинилметокси)циклогексанкарбоксилат (38 мг, 100%) получают в виде бесцветного масла.
1H-ЯМР (CDCl3) δ: 1,19-1,32 (м, 8H), 1,38-1,52 (м, 2H), 1,72 (м, 2H), 1,83 (м, 2H), 1,94-2,31 (м, 6H), 3,20-3,34 (м, 2H), 3,42-3,59 (м, 3H), 3,64 и 3,66 (каждый с, общий 3H, амидные изомеры), 3,69-3,76 (м, 2H), 3,80 (дд, J=8,6, 4,9 Гц, 1H), 3,87 (м, 1H), 3,880 и 3,883 (каждый с, общий 3H, амидные изомеры), 4,18-4,28 (м, 2H), 7,33-7,42 (м, 4H), 7,80 (д, J=2,2 Гц, 1H), 8,11-8,14 (м, 1H), 8,27 и 8,29 (каждый с, общий 1H, амидные изомеры), 8,47 и 8,50 (каждый д, каждый J=10,5 Гц, общий 1H, амидные изомеры).
МС (ESI) m/z 682 (M++1), 684 (M++3).
(Стадия 4) Синтез транс-4-(1-((5-хлор-2-фтор-4-(1-метил-3-индолилкарбониламино)фенил)ацетил)-(4S)-циклогексилокси-(2S)-пирролидинилметокси)циклогексанкарбоновой кислоты
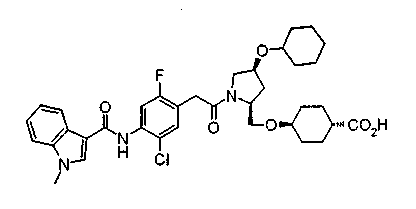
К метил-транс-4-(1-((5-хлор-2-фтор-4-(1-метил-3-индолилкарбониламино)фенил)ацетил)-(4S)-циклогексилокси-(2S)- пирролидинилметокси)циклогексанкарбоксилату (38 мг, 47,1 мкмоль) добавляют ТГФ/метанол (2:1, 3 мл) и 1 н. NaOH (1 мл). Образовавшуюся смесь перемешивают при комнатной температуре в течение 13 часов. Реакционную смесь перегоняют при пониженном давлении для удаления растворителя и остаток подкисляют 1 н. HCl. Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при пониженном давлении, получая при этом указанное в заголовке соединение (34 мг, 100%) в виде бесцветного твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 1,13-2,22 (м, 14H), 3,22 (м, 1H), 3,50-3,86 (м, 4H), 3,89 (с, 3H), 3,99-4,33 (м, 2H), 7,22 (т, J=7,1 Гц, 1H), 7,42 и 7,45 (каждый д, каждый J=7,1 Гц общий 1H, амидные изомеры), 7,56 (д, J=8,3 Гц, 1H), 7,68 и 7,70 (каждый д, J=11,0 и 10,5 Гц соответственно, общий 1H, амидные изомеры), 8,15 (д, J=7,8 Гц, 1H), 8,30 и 8,31 (каждый с, общий 1H, амидные изомеры), 9,31 (с, 1H).
МС (ESI) m/z 669 (M++1), 671 (M++3).
Пример 120
транс-4-(1-((5-Хлор-2-фтор-4-(1-метил-3-индолилкарбониламино)фенил)ацетил)-(4S)-диметилкарбамоилметокси-(2S)-пирролидинилметокси)-1-циклогексанкарбоновая кислота:
(Стадия 1) Синтез гидрохлорида метил-4-((4S)-гидрокси-(2S)-пирролидинилметокси)бензоата
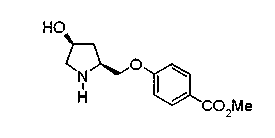
К метил-4-(1-трет-бутоксикарбонил-(4S)-гидрокси-(2S)- пирролидинилметокси)бензоату (1,0 г, 2,85 ммоль) добавляют смесь 4 н. HCl-диоксан (10 мл). Образовавшуюся смесь перемешивают при комнатной температуре в течение 15 часов. Реакционную смесь перегоняют при пониженном давлении для удаления растворителя. Образовавшийся остаток кристаллизуют добавлением эфира. Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении и сушат при пониженном давлении, получая при этом гидрохлорид метил-4-((4S)-гидрокси-(2S)-пирролидинилметокси)бензоата (660 мг, 80%) в виде бесцветного аморфного вещества.
1H-ЯМР (ДМСО-d6) δ: 1,75 (м, 1H), 2,33 (м, 1H), 3,09-3,23 (м, 2H), 3,82 (с, 3H), 4,01 (м, 1H), 4,34 (м, 2H), 4,43 (м, 1H), 5,56 (д, J=3,4 Гц, 1H), 7,09 (д, J=8,8 Гц, 2H), 7,95 (д, J=8,8 Гц, 2H).
МС (ESI) m/z 252 (M++1).
(Стадия 2) Синтез метил-4-(1-(трет-бутоксикарбонил)-(4S)-гидрокси-(2S)-пирролидинилметокси)-1-циклогексанкарбоксилата
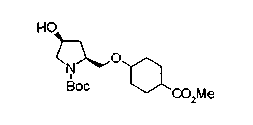
Гидрохлорид метил-4-((4S)-гидрокси-(2S)-пирролидинилметокси)бензоата (660 мг, 2,29 ммоль) растворяют в смеси метанол-уксусная кислота (10:1, 33 мл). К образовавшемуся раствору добавляют катализатор родий-оксид алюминия (500 мг) и образовавшуюся смесь подвергают каталитическому гидрированию при комнатной температуре в течение 48 часов при 4 атм. Катализатор отфильтровывают от реакционной смеси. Фильтрат перегоняют при пониженном давлении для удаления растворителя. Образовавшийся остаток растворяют в смеси ацетонитрил-вода (1:1, 50 мл). К образовавшемуся раствору добавляют триэтиламин (637 мкл, 4,58 ммоль) и ди-трет-бутилдикарбонат (600 мг, 2,75 ммоль). Образовавшуюся смесь перемешивают при комнатной температуре в течение 15 часов. Реакционную смесь экстрагируют хлороформом (2×200 мл). Экстракт сушат над безводным сульфатом магния и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси хлороформ-метанол (20:1) метил-4-(1-(трет-бутоксикарбонил)-(4S)-гидрокси-(2S)-пирролидинилметокси)-1-циклогексанкарбоксилат (818 мг, 100%) получают в виде бесцветного масла.
1H-ЯМР (CDCl3) δ: 1,26-2,36 (ряд м, 20 H), 3,34-4,21 (ряд м, 8H), 4,81-5,08 (м, 2H).
(Стадия 3) Синтез метил-4-((4S)-бензилоксиметокси-1-(трет-бутоксикарбонил)-(2S)-пирролидинилметокси)-1-циклогексанкарбоксилата
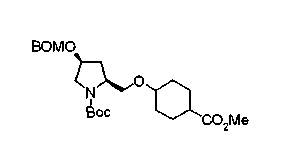
Метил-4-(1-(трет-бутоксикарбонил)-(4S)-гидрокси-(2S)-пирролидинилметокси)-1-циклогексанкарбоксилат (818 мг, 2,29 ммоль) растворяют в метиленхлориде (20 мл). К образовавшемуся раствору добавляют бензилхлорметиловый эфир (476 мкл, 3,44 ммоль) и DIEA (599 мкл, 3,44 ммоль). Образовавшуюся смесь нагревают при кипячении с обратным холодильником в течение 15 часов. После охлаждения до комнатной температуры в реакционную смесь добавляют воду (50 мл) с последующей экстракцией хлороформом (200 мл). Экстракт сушат над безводным сульфатом магния и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси хлороформ-этилацетат (10:1) метил-4-((4S)-бензилоксиметокси-1-(трет-бутоксикарбонил)-(2S)-пирролидинилметокси)-1-циклогексанкарбоксилат (1,07 г, 98%) получают в виде бесцветного масла.
МС (ESI) m/z 478 (M++1).
Стадия 4) Синтез метил-транс-4-((4S)-бензилоксиметокси-1-(трет-бутоксикарбонил)-(2S)-пирролидинилметокси)-1-циклогексанкарбоксилата
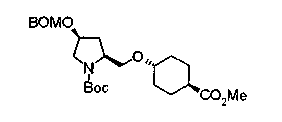
Метил-4-((4S)-бензилоксиметокси-1-(трет-бутоксикарбонил)-(2S)-пирролидинилметокси)-1-циклогексанкарбоксилат (1,07 г, 2,24 ммоль) растворяют в метаноле (50 мл). К образовавшемуся раствору добавляют метоксид натрия (363 мг, 6,72 ммоль). Образовавшуюся смесь нагревают при кипячении с обратным холодильником в течение 15 часов в потоке газообразного азота. После охлаждения до комнатной температуры реакционную смесь выливают в 1 н. HCl (100 мл) с последующей экстракцией хлороформом (2×200 мл). Экстракт сушат над безводным сульфатом магния и перегоняют при пониженном давлении для удаления растворителя, получая при этом смесь (приблизительно 1:1) метил-1,4-цис- и -транс-циклогексанкарбоксилатов. транс-Изомер очищают флэш-хроматографией на колонке силикагеля, посредством чего из элюатных фракций смеси гексан-этилацетат (4:1) метил-транс-4-((4S)-бензилоксиметокси-1-(трет-бутоксикарбонил)-(2S)-пирролидинилметокси)-1-циклогексанкарбоксилат (400 мг, 37%) получают в виде бесцветного масла.
1H-ЯМР (CDCl3) δ: 1,2,6 (м, 2H), 1,45 (м, 11H), 1,98-2,25 (м, 7H), 3,24-3,96 (ряд м, общий 9H), 4,60 (с, 2H), 4,77 (м, 2H), 7,28-7,38 (м, 5H).
(Стадия 5) Синтез метил-транс-4-(1-(трет-бутоксикарбонил)-4S-гидрокси-(2S)-пирролидинилметокси)-1-циклогексанкарбоксилата

Метил-транс-4-((4S)-бензилоксиметокси-1-(трет-бутоксикарбонил)-(2S)-пирролидинилметокси)-1-циклогексанкарбоксилат (390 мг, 0,817 ммоль) растворяют в метаноле (50 мл). К образовавшемуся раствору добавляют катализатор 5% палладий/уголь (40 мг). Реакционную смесь подвергают каталитическому гидрированию при комнатной температуре в течение 15 часов. Реакционную смесь фильтруют для удаления катализатора и фильтрат перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси хлороформ-метанол (20:1) метил-транс-4-(1-(трет-бутоксикарбонил)-(4S)-гидрокси-(2S)- пирролидинилметокси)-1-циклогексанкарбоксилат (281 мг, 96%) получают в виде бесцветного масла.
1H-ЯМР (CDCl3) δ: 1,28 (м, 2H), 1,46 (м, 11H), 1,86-2,36 (ряд м, 7H), 3,31-3,63 (ряд м, 4H), 3,66 (с, 3H), 3,92-4,21 (ряд м, 3H), 4,85 и 5,06 (д, J=11,5 Гц, каждый, общий 1H).
МС (ESI) m/z 358 (M++1).
(Стадия 6) Синтез метил-транс-4-(1-(трет-бутоксикарбонил)-(4S)-диметилкарбамоилметокси-(2S)-пирролидинилметокси)-1-циклогексанкарбоксилата
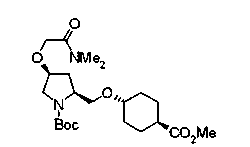
К метил-транс-4-(1-(трет-бутоксикарбонил)-(4S)-гидрокси-(2S)-пирролидинилметокси)-1-циклогексанкарбоксилату (280 мг, 0,780 ммоль) добавляют ДМФ (10 мл) и N,N-диметилбромацетамид (195 мг, 1,18 ммоль). При перемешивании при 0°С порциями добавляют гидрид натрия (62 мг, 1,56 ммоль). После перемешивания реакционной смеси при комнатной температуре в течение 1 часа в нее выливают 1 н. HCl (50 мл) с последующей экстракцией этилацетатом (200 мл). Экстракт промывают насыщенным раствором соли (2×100 мл), сушат над безводным сульфатом магния и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси хлороформ-этилацетат (1:1) метил-транс-4-(1-(трет-бутоксикарбонил)-(4S)-диметилкарбамоилметокси-(2S)-пирролидинилметокси)-1-циклогексанкарбоксилат (247 мг, 72%) получают в виде бесцветного масла.
1H-ЯМР (CDCl3) δ: 1,26 (м, 2H), 1,45 (м, 11H), 1,98 (м, 5H), 2,25 (м, 2H), 2,95 (с, 3H), 3,01 (с, 3H), 3,22 (м, 1H), 3,43 (м, 2H), 3,50-3,96 (ряд м, 6H, включая с, 3H, при δ: 3,66), 4,12 (м, 3H).
МС (ESI) m/z 443 (M++1).
(Стадия 7) Синтез метил-транс-4-((4S)-диметилкарбамоилметокси-(2S)-пирролидинилметокси)-1-циклогексанкарбоксилата
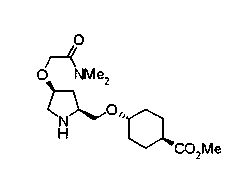
К метил-транс-4-(1-(трет-бутоксикарбонил)-(4S)-диметилкарбамоилметокси-(2S)-пирролидинилметокси)-1-циклогексанкарбоксилату (245 мг, 0,554) добавляют диоксан (10 мл) и смесь 4 н. HCl/диоксан (10 мл). Образовавшуюся смесь перемешивают при комнатной температуре в течение 15 часов. Реакционную смесь перегоняют при пониженном давлении для удаления растворителя, посредством чего метил-транс-4-((4S)-диметилкарбамоилметокси-(2S)-пирролидинилметокси)-1-циклогексанкарбоксилат (210 мг, 100%) получают в виде бесцветного масла.
МС (ESI) m/z 343 (M++1).
(Стадия 8) Синтез метил-транс-4-(1-((5-хлор-2-фтор-4-(1-метил-3-индолилкарбониламино)фенил)ацетил)-(4S)-диметилкарбамоилметокси-(2S)-пирролидинилметокси)-1-циклогексанкарбоксилата
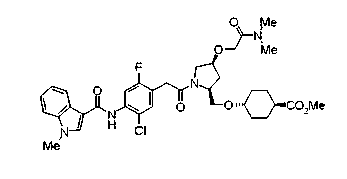
В ДМФ (10 мл) триэтиламин (771 мкл, 5,54 ммоль) (5-хлор-2-фтор-4-((1-метил-3-индолилкарбонил)амино)фенил)уксусную кислоту (200 мг, 0,554 ммоль), EDC·HCl (159 мг, 0,831 ммоль) и HOBt (112 мг, 0,831 ммоль) добавляют к метил-транс-4-((4S)-диметилкарбамоилметокси-(2S)-пирролидинилметокси)-1-циклогексанкарбоксилату (210 мг, 0,554 ммоль) и образовавшуюся смесь перемешивают при комнатной температуре в течение 15 часов. К реакционной смеси добавляют этилацетат (200 мл) и воду (100 мл). Таким образом отделенный органический слой промывают насыщенным раствором соли (100 мл), сушат над безводным сульфатом магния и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси хлороформ-метанол (10:1) метил-транс-4-(1-((5-хлор-2-фтор-4-(1-метил-3-индолилкарбониламино)фенил)ацетил)-(4S)-диметилкарбамоилметокси-(2S)-пирролидинилметокси)-1-циклогексанкарбоксилат (288 мг, 76%) получают в виде желтого масла.
1H-ЯМР (CDCl3) δ: 1,24 (м, 2H), 1,45 (м, 2H), 1,84-2,31 (ряд м, 7H), 2,96-3,01 (м, 6H), 3,22 (м, 1H), 3,50-4,23 (ряд м, 17H), 7,27 (м, 4H), 7,80 (с, 1H), 8,12-8,14 (м, 1H), 8,29 (с, 1H), 8,49 (дд, J=12,0, 8,6 Гц, 1H). МС (ESI) m/z 685 (M++1).
(Стадия 9) Синтез транс-4-(1-((5-хлор-2-фтор-4-(1-метил-3-индолилкарбониламино)фенил)ацетил)-(4S)-диметилкарбамоилметокси-(2S)-пирролидинилметокси)-1-циклогексанкарбоновой кислоты

К метил-транс-4-(1-((5-хлор-2-фтор-4-(1-метил-3-индолилкарбониламино)фенил)ацетил)-(4S)-диметилкарбамоилметокси-(2S)-пирролидинилметокси)-1-циклогексанкарбоксилату (280 мг, 0,409 ммоль) добавляют ТГФ (5 мл) и 0,25 н. NaOH (3,3 мл, 0,825 ммоль). Образовавшуюся смесь перемешивают при комнатной температуре в течение 15 часов. Реакционную смесь выливают в 1 н. HCl (100 мл) с последующей экстракцией смесью хлороформ-метанол (5:1, 2×100 мл). Экстракт сушат над безводным сульфатом магния и перегоняют при пониженном давлении для удаления растворителя. Остаток растворяют в хлороформе и к этому раствору добавляют гексан в пропорциях, при которых происходит осаждение. Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении и сушат при пониженном давлении, получая при этом указанное в заголовке соединение (180 мг, 66%) в виде светло-желтого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 1,16-1,37 (м, 4H), 1,85-2,17 (м, 7H), 2,82 (д, J=4,4 Гц, 3H), 2,92 (д, J=6,8 Гц, 3H), 3,17-4,22 (ряд м, 14H), 7,20-7,30 (м, 2H), 7,44 (дд, J=11,2, 6,8 Гц, 1H), 7,56 (д, J=8,1 Гц, 1H), 7,70 (дд, J=11,2, 6,8 Гц, 1H), 8,15 (д, J=7,8 Гц, 1H), 8,31 (с, 1H), 9,31 (с, 1H).
МС (FAB) m/z 671 (M++1);
Анал. Вычисл. для C34H40ClFN4О7·0,75 H2О: C, 59,64; H, 6,11; N, 8,18.
Найдено: C, 60,03; H, 6,16; N, 7,82.
Пример 121
транс-4-(1-((5-Хлор-2-фтор-4-(1-метил-3-индазолилкарбониламино)фенил)ацетил)-(4S)-метокси-(2S)-пирролидинилметокси)циклогексанкарбоновая кислота:
(Стадия 1) Синтез метил-транс-4-(1-((5-хлор-2-фтор-4-(1-метил-3-индазолилкарбониламино)фенил)ацетил)-(4S)-метокси-(2S)-пирролидинилметокси)циклогексанкарбоксилата
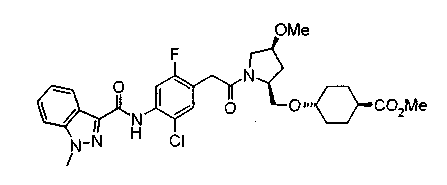
В ДМФ (3 мл) (5-хлор-2-фтор-4-(1-метил-3-индазолилкарбониламино)фенил)уксусную кислоту (133 мг, 0,369 ммоль), метил-транс-4-((4S)-метокси-(2S)-пирролидинилметокси)циклогексанкарбоксилат (100 мг, 0,369 ммоль), EDC·HCl (106 мг, 0,554 ммоль), HOBt (75 мг, 0,554 ммоль) и триэтиламин (0,26 мл, 1,85 ммоль) перемешивают при комнатной температуре в течение 14 часов. Реакционную смесь выливают в ледяную воду с последующей экстракцией этилацетатом. Экстракт сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией с использованием тонкослойной пластины силикагеля (проявленной в смеси хлороформ/ацетон (20/1)), получая при этом метил-транс-4-(1-((5-хлор-2-фтор-4-(1-метил-3-индазолилкарбониламино)фенил)ацетил)-(4S)-метокси-(2S)-пирролидинилметокси)циклогексанкарбоксилат (166 мг, 73%) в виде желтого масла.
1H-ЯМР (CDCl3) δ: 1,13-1,52 (м, 4H), 1,90-2,16 (м, 6H), 2,89 (м, 1H), 3,21-3,27 (м, 1H), 3,30 и 3,33 (каждый с, общий 3H, амидные изомеры), 3,42-3,59 (м, 3H), 3,64 и 3,66 (каждый с, общий 3H, амидные изомеры), 3,67-4,03 (м, 1H), 7,34 (м, 1H), 7,46 (с, 2H), 8,39 (д, J=8,3 Гц, 1H), 8,48 и 8,52 (каждый д, каждый J=10,0 Гц, общий 1H, амидные изомеры), 9,49 (д, J=4,2 Гц, 1H).
МС (ESI) m/z 615 (M++1), 617 (M++3).
(Стадия 2) Синтез транс-4-(1-((5-хлор-2-фтор-4-(1-метил-3-индазолилкарбониламино)фенил)ацетил)-(4S)-метокси-(2S)-пирролидинилметокси)циклогексанкарбоновой кислоты
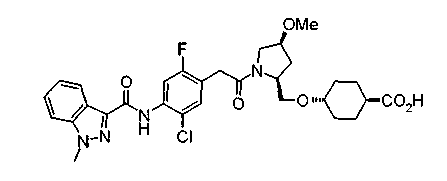
Метил-транс-4-(1-((5-хлор-2-фтор-4-(1-метил-3-индазолилкарбониламино)фенил)ацетил)-(4S)-метокси-(2S)-пирролидинилметокси)циклогексанкарбоксилат (166 мг, 0,270 ммоль) растворяют в смеси ТГФ/метанол (2:1, 6 мл). К образовавшемуся раствору добавляют 1 н. NaOH (2 мл). После перемешивания реакционной смеси при комнатной температуре в течение 17 часов растворитель отгоняют при пониженном давлении. К остатку добавляют 1 н. HCl. Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при пониженном давлении, получая при этом указанное в заголовке соединение (130 мг, 80%) в виде светло-желтого твердого вещества.
ИК (ATR) ν 3363, 2937, 2862, 1726, 1685, 1643, 1621, 1587, 1527, 1406 см-1;
1H-ЯМР (ДМСО-d6) δ: 1,12-1,42 (м, 4H), 1,82-2,22 (м, 7H), 3,16 (м, 1H), 3,22 и 3,26 (каждый с, общий 3H, амидные изомеры), 3,43-3,99 (м, 6H), 4,02 (с, 1H), 4,21 (с, 3H), 4,24 (м, 1H), 7,37 (т, J=7,3 Гц, 1H), 7,46 и 7,50 (каждый д, каждый J=7,3 Гц, общий 1H, амидные изомеры), 7,82 (д, J=8,3 Гц, 1H), 8,04 и 8,06 (каждый д, каждый J=11,3 Гц, 1H, амидные изомеры), 8,20 (д, J=8,1 Гц, 1H), 9,72 (с, 1H);
МС (ESI) m/z 601 (M++1), 603 (M++3);
Анал. Вычисл. для C30H34ClFN4О6·0,5H2О: C, 59,06; H, 5,78; N, 9,18; Cl, 5,81; F, 3,11.
Найдено: C, 58,80; H, 5,64; N, 9,03; Cl, 6,00; F, 3,08.
Пример 122
транс-4-((4R)-Гидрокси-1-((2-(2-метилфениламино)-6-бензоксазолил)ацетил)-(2S)-пирролидинилметокси)циклогексанкарбоновая кислота:
(Стадия 1) Синтез метил-4-((4R)-гидрокси-(2S)-пирролидинилметокси)циклогексанкарбоксилата

Метил-4-(N-(трет-бутоксикарбонил-(4R)-гидрокси-(2S)- пирролидинилметокси)бензоат (4,016 г, 11,43 ммоль) растворяют в метиленхлориде (60,0 мл). При перемешивании при 0°С к образовавшемуся раствору добавляют трифторуксусную кислоту (30 мл). Образовавшуюся смесь перемешивают при комнатной температуре в течение 3 часов. Растворитель затем отгоняют при пониженном давлении. Остаток растворяют в этаноле (80 мл) с последующим каталитическим гидрированием в автоклаве в течение 20 часов с катализатором родий-оксид алюминия (5%, 1,01 г) при давлении водорода 9,5 кг/см2. Реакционную смесь фильтруют через целит для удаления катализатора и растворитель отгоняют при пониженном давлении. Остаток растворяют в смеси хлороформ-метанол (10:1, об./об.). Образовавшийся раствор промывают насыщенным водным раствором бикарбоната натрия, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя, получая при этом метил-4-((4R)-гидрокси-(2S)-пирролидинилметокси)циклогексанкарбоксилат (2,46 г, 86%) в виде коричневого масла. Образовавшееся соединение используют для следующей реакции без дополнительной очистки.
1H-ЯМР (CDCl3) δ: 1,10-2,45 (общий 11H, ряд м), 3,13-3,90 (общий 9H, ряд м, включая 3H, с при δ: 3,65), 4,17 (1H, м), 4,65 (1H, м), 9,37 (1H, ушир.с, NH).
(Стадия 2) Синтез метил-транс- и -цис-4-(N-карбобензокси-(4R)-гидрокси-(2S)-пирролидинилметокси)циклогексанкарбоксилатов

Метил-4-((4R)-гидрокси-(2S)- пирролидинилметокси)циклогексанкарбоксилат (2,46 г, 9,790 ммоль) растворяют в метиленхлориде (50,0 мл). При перемешивании при 0°С к образовавшемуся раствору добавляют карбобензоксихлорид (от 30 до 35% раствор в толуоле, 8,70 мл, 14,68 ммоль) и насыщенный водный раствор бикарбоната натрия (2,5 мл) с последующим перемешиванием при комнатной температуре в течение 2 дней. Реакционную смесь разбавляют хлороформом. Разбавленную смесь промывают 1 н. HCl, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси гексан-этилацетат (1:1, об./об.) получают смесь транс- и цис-диастереомеров. Смесь можно разделить хроматографией при среднем давлении на колонке с силикагелем. Из элюатных фракций смеси гексан-этилацетат (1:3, об./об.) получают метил-транс-4-(N-карбобензокси-(4R)-гидрокси-(2S)-пирролидинилметокси)циклогексанкарбоксилат (555,1 мг, 15%) и метил-цис-4-(N-карбобензокси-(4R)-гидрокси-(2S)-пирролидинилметокси)циклогексанкарбоксилат (2,14 г, 57%).
1H-ЯМР (CDCl3) (транс-изомер) δ: 1,09-1,30 (2H, м), 1,31-1,52 (2H, м), 1,55-1,83 (3H, м), 1,83-2,09 (3H, м), 2,11-2,29 (2H, м), 3,13 (1H, м), 3,40-3,73 (общий 7H, м, включая 3H, с при δ: 3,67), 4,12 (1H, bc), 4,49 (1H, ушир.с), 5,01-5,28 (2H, м), 7,33 (5H, м, ArH);
1H-ЯМР (CDCl3) (цис-изомер) δ: 1,30-1,51 (2H, м), 1,52-1,88 (общий 6H, м), 1,90-2,12 (2H, м), 2,19 (1H, м), 2,31 (1H, м), 3,27-3,78 (общий 8H, м, включая 3H, с при δ: 3,64), 4,12 (1H, bc), 4,52 (1H, ушир.с), 5,00-5,28 (2H, м), 7,31 (5H, м, ArH).
(Стадия 3) Синтез метил-транс-((4R)-гидрокси-(2S)-пирролидинилметокси)циклогексанкарбоксилата
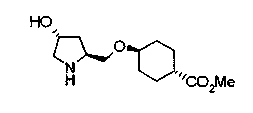
Метил-транс-4-(N-карбобензокси-(4R)-гидрокси-(2S)-пирролидинилметокси)циклогексанкарбоксилат (555,1 мг, 1,418 ммоль) растворяют в этаноле (11 мл). К образовавшемуся раствору добавляют катализатор 5% палладий/уголь (сырой, 100 мг) и смесь подвергают каталитическому восстановлению при комнатной температуре и при нормальном давлении. Катализатор отфильтровывают от реакционной смеси. Фильтрат перегоняют при пониженном давлении для удаления растворителя, получая при этом метил-транс-4-((4R)-гидрокси-(2S)-пирролидинилметокси)циклогексанкарбоксилат (361,6 мг, сырой). Соединение используют для следующей реакции без дополнительной очистки.
1H-ЯМР (CDCl3) δ: 1,12-1,32 (3H, м), 1,35-1,55 (2H, м), 1,65 (1H, м), 1,74-1,93 (3H, м), 1,93-2,30 (3H, м), 2,82-3,58 (общий 6H, ряд м), 3,66 (3Н, с, OMe), 4,40 (1H, ушир.).
(Стадия 4) Синтез метил-транс-(4R)-гидрокси-1-((2-(2-метилфениламино)-6-бензоксазолил)ацетил)-(2S)-пирролидинилметокси)циклогексанкарбоксилата
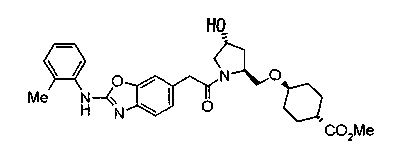
Метил-транс-4-((4R)-гидрокси-(2S)-пирролидинилметокси)циклогексанкарбоксилат (50,5 мг, 0,201 ммоль), (2-(2-метилфениламино)-6-бензоксазолил)уксусную кислоту (56,7 мг, 0,201 ммоль) и HOBt (5,4 мг, 0,040 ммоль) растворяют в ДМФ (2,0 мл). К образовавшемуся раствору добавляют EDC·HCl (57,8 мг, 0,301 ммоль) с последующим перемешиванием при комнатной температуре в течение 16 часов. Реакционную смесь разбавляют этилацетатом. Разбавленную смесь промывают 1 н. HCl, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают колоночной хроматографией с использованием тонкослойной пластины силикагеля, посредством чего из элюатных фракций смеси хлороформ-метанол (10:1, об./об.) метил-транс-4-((4R)-гидрокси-1-((2-(2-метилфениламино)-6-бензоксазолил)ацетил)-(2S)-пирролидинилметокси)циклогексанкарбоксилат (55,5 мг, 53%) получают в виде светлого масла.
1H-ЯМР (CDCl3) δ: 1,01-1,19 (2H, м), 1,29-1,50 (2H, м), 1,79-2,06 (6H, м), 2,10-2,23 (2H, м), 2,35 (3Н, с, ArMe), 3,12 (1H, м), 3,32-3,59 (3H, м), 3,61 (3Н, с, OMe), 3,71 (2Н, с, CH2), 3,79 (1H, дд, J=4,4, 10,0 Гц, CH2), 4,36 (1H, м), 4,52 (1H, м), 7,01-7,45 (общий 8H, ряд м, ArH, NH).
(Стадия 3) Синтез транс-4-((4R)-гидрокси-1-((2-(2-метилфениламино)-6-бензоксазолил)ацетил)-(2S)-пирролидинилметокси)циклогексанкарбоновой кислоты
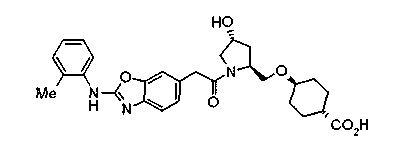
Метил-транс-4-((4R)-гидрокси-1-((2-(2-метилфениламино)-6-бензоксазолил)ацетил)-(2S)-пирролидинилметокси)циклогексанкарбоксилат (55,5 мг, 0,106 ммоль) растворяют в ТГФ (1,0 мл). К образовавшемуся раствору добавляют 0,25 н. NaOH (1,0 мл) с последующим перемешиванием при комнатной температуре в течение 15 часов. Реакционную смесь перегоняют при пониженном давлении для удаления растворителя. К остатку добавляют 1 н. HCl (0,3 мл). Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при 50°C при пониженном давлении, получая при этом указанное в заголовке соединение (39,3 мг, 73%) в виде светло-коричневого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 0,98-1,39 (4H, м), 1,72-2,03 (6H, м), 2,11 (1H, м), 2,29 (3Н, с, ArMe), 3,04-3,95 (8H, м), 4,09 (1H, м), 4,25, 4,32 (общий 1H, м), 7,00-7,87 (общий 8H, ряд м, ArH, NH), 9,75 (1H, ушир.с, CO2H).
МС (ESI) m/z 508 (M++1).
Пример 123
транс-4-(1-((2-(2-Метилфениламино)-6-бензоксазолил)ацетил))-(4S)-фенилтио-(2S)-пирролидинилметокси)циклогексанкарбоновая кислота:
(Стадия 1) Синтез метил-транс-4-(N-трет-бутоксикарбонил)-(4R)-метансульфонилокси-(2S)-пирролидинилметокси)циклогексанкарбоксилата
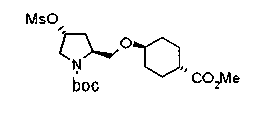
Метил-транс-4-(N-(трет-бутоксикарбонил)-(4R)-гидрокси-(2S)- пирролидинилметокси)циклогексанкарбоксилат (301,6 мг, 0,844 ммоль) растворяют в метиленхлориде (6,0 мл). К образовавшемуся раствору добавляют при перемешивании при 0°С триэтиламин (0,47 мл, 3,375 ммоль) и метансульфонилхлорид (0,13 мл, 1,687 ммоль). Реакционную смесь перемешивают при такой же температуре в течение 2,5 часа. Реакционную смесь разбавляют хлороформом. Разбавленную смесь промывают 1 н. HCl, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси гексан-этилацетат (1:1, об./об.) метил-транс-4-(N-трет-бутоксикарбонил)-(4R)-метансульфонил-(2S)-пирролидинилметокси)циклогексанкарбоксилат (361,1 мг, 98%) получают в виде бесцветного прозрачного масла.
1H-ЯМР (CDCl3) δ: 1,12-1,27 (2E, м), 1,35-1,52 (10H, м, включая 9H, с при δ: 1,45), 1,64 (1H, м), 1,90-2,05 (4H, м), 2,18-2,40 (3H, м), 3,01 (3Н, с, MeSO3), 3,17 (1H, м), 3,43-3,85 (общий 7H, м, включая 3H, с при δ: 3,64), 3,95-4,12 (1H, м), 5,25 (1H, м, MsOCH).
(Стадия 2) Синтез метил-транс-4-(N-трет-бутоксикарбонил)-(4S)-фенилтио-(2S)-пирролидинилметокси)циклогексанкарбоксилата
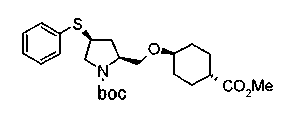
Фторид цезия (125,9 мг, 0,829 ммоль) сушат при пониженном давлении при 180°С в течение 40 минут.Реакционному сосуду дают возможность охладиться до комнатной температуры в потоке газообразного азота. К реакционной смеси добавляют ДМФ (2,0 мл) и тиофенол (0,11 мл, 1,078 ммоль). При перемешивании при комнатной температуре добавляют по каплям метил-транс-4-(N-(трет-бутоксикарбонил)-(4R)-метансульфонил-(2S)-пирролидинилметокси)циклогексанкарбоксилат (361,1 мг, 0,829 ммоль) в ДМФ (3,5 мл). Реакционную смесь перемешивают далее в течение 18 часов при 50°С и затем разбавляют этилацетатом. Разбавленную смесь промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси гексан-этилацетат (8:1, об./об.) метил-транс-4-(N-(трет-бутоксикарбонил)-(4S)-фенилтио-(2S)-пирролидинилметокси)циклогексанкарбоксилат (367,2 мг, 98%) получают в виде бесцветного прозрачного масла.
1H-ЯМР (CDCl3) δ: 1,15-1,32 (2H, м, CH2), 1,35-1,56 (11H, м, включая 9H, с при δ: 1,46), 1,93-2,10 (5H, м, CH2, CH), 2,27 (1H, м, CH2), 2,45 (1H, м, CH2), 3,14-3,27 (2H, м), 3,44-3,79 (общий 6H, м, включая 3H, с при δ: 3,67), 3,81-4,07 (2H, м), 7,20-7,45 (общий 5H, ряд м, ArH).
(Стадия 3) Синтез метил-транс-4-((4S)-фенилтио-(2S)-пирролидинилметокси)циклогексанкарбоксилата
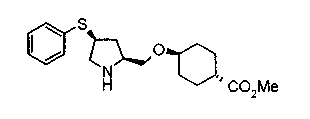
Метил-транс-4-(N-(трет-бутоксикарбонил)-(4S)-фенилтио-(2S)-пирролидинилметокси)циклогексанкарбоксилат (367,2 мг, 0,817 ммоль) растворяют в метиленхлориде (7,0 мл). К образовавшемуся раствору добавляют трифторуксусную кислоту (3,5 мл) при перемешивании при 0°С.Реакционную смесь перемешивают далее при комнатной температуре в течение 1,5 часа. Из реакционной смеси растворитель отгоняют при пониженном давлении. Остаток разбавляют хлороформом с последующим промыванием насыщенным водным раствором бикарбоната натрия, сушкой над сульфатом натрия и перегонкой при пониженном давлении для удаления растворителя, в результате чего получают метил-транс-4-((4S)-фенилтио-(2S)-пирролидинилметокси)циклогексанкарбоксилат (256,3 мг, 90%). Образовавшееся соединение используют для следующей реакции без дополнительной очистки.
1H-ЯМР (CDCl3) δ: 1,17-1,33 (2H, м), 1,35-1,55 (3H, м), 1,91-2,18 (5H, м, CH2, CH, NH), 2,19-2,39 (2H, м), 2,95 (1H, дд, J=4,8, 11,6 Гц, CH2), 3,13-3,33 (3H, м), 3,38-3,54 (2H, м), 3,65 (3Н, с, OMe), 3,68 (1H, м), 7,11-7,40 (общий 5H, ряд м, ArH).
(Стадия 4) Синтез метил-транс-4-(1-((2-(2-метилфениламино)-6-бензоксазолил)ацетил))-(4S)-фенилтио-(2S)-пирролидинилметокси)циклогексанкарбоксилата
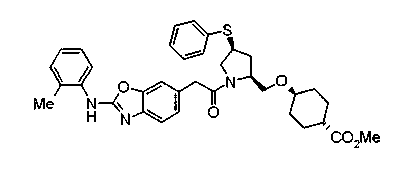
Метил-транс-4-((4S)-фенилтио-(2S)-пирролидинилметокси)циклогексанкарбоксилат (256,3 мг, 0,733 ммоль), (2-(2-метилфениламино)-6-бензоксазолил)уксусную кислоту (207,0 мг, 0,733 ммоль) и HOBt (19,8 мг, 0,147 ммоль) растворяют в ДМФ (9,0 мл). При перемешивании при комнатной температуре добавляют EDC·HCl (210,9 мг, 1,100 ммоль). Образовавшуюся смесь перемешивают далее при комнатной температуре в течение 18 часов. Реакционную смесь разбавляют этилацетатом. Разбавленную смесь промывают 1 н. HCl, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси хлороформ-метанол (15:1, об./об.) метил-транс-4-(1-((2-(2-метилфениламино)-6-бензоксазолил)ацетил))-(4S)-фенилтио-(2S)-пирролидинилметокси)циклогексанкарбоксилат (количественный выход) получают в виде светло-коричневого аморфного вещества.
1H-ЯМР (CDCl3) δ: 1,04-1,29 (2H, м), 1,30-1,51 (2H, м), 2,78-2,12 (5H, м), 2,19 (1H, м), 2,34 (3H, с, ArMe), 2,37 (1H, м), 3,12 (1H, м), 3,23 (1H, дд, J=10,0 Гц), 3,49 (1H, м), 3,55-3,67 (6H, м, включая 3H, с при δ: 3,61), 3,71 (1H, м), 3,88 (1H, м), 4,22 (1H, м), 6,95-7,10 (2H, м, ArH), 7,15-7,40 (9H, м, ArH), 7,90 (1Н, д, J=8,0 Гц, ArH), 7,99 (1H, с, NH).
(Стадия 5) Синтез транс-4-(1-((2-(2-метилфениламино)-6-бензоксазолил)ацетил)-(4S)-фенилтио-(2S)-пирролидинилметокси)циклогексанкарбоновой кислоты
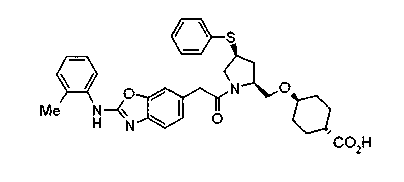
Метил-транс-4-(1-((2-(2-метилфениламино)-6-бензоксазолил)ацетил)-(4S)-фенилтио-(2S)-пирролидинилметокси) циклогексанкарбоксилат (187,2 мг, 0,305 ммоль) растворяют в ТГФ (4,0 мл). К образовавшемуся раствору добавляют 0,25 н. NaOH (4,0 мл) с последующим перемешиванием при комнатной температуре в течение 2 дней. Из реакционной смеси растворитель отгоняют при пониженном давлении. Остаток подкисляют 1 н. HCl (1,5 мл). Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при 50°С при пониженном давлении, получая при этом указанное в заголовке соединение (160,3 мг, 88%) в виде аморфного вещества.
ИК (ATR) ν 1693, 1639, 1573, 1438 см-1;
1H-ЯМР (ДМСО-d6) (1,00-1,21 (2H, м), 1,22-1,38 (2H, м), 1,75-1,97 (5H, м), 2,11 (1H, м), 2,30 (3Н, с, ArMe), 2,42 (1H, м), 3,01-4,15 (общий 9H, ряд м), 7,01 (1H, д, J=8,0 Гц, ArH), 7,08 (1H, дд, J=7,6 Гц, ArH), 7,20-7,44 (9H, м, ArH), 7,79 (1H, д, J=8,0 Гц, ArH), 9,62 (1H, ушир.с).
МС (ESI) m/z 600 (M++1);
Анал. Вычисл. для С34Н37N3O5S·0,5H2О: C, 67,08; H, 6,29; N, 6,90; S, 5,27.
Найдено: C, 67,02; H, 6,05; N, 6,84; S, 5,29.
Пример 124
транс-4-(1-((2-(2-Метилфениламино)-6-бензоксазолил)ацетил)-(4S)-фенилсульфонил-(2S)-пирролидинилметокси)циклогексанкарбоновая кислота:
(Стадия 1) Синтез метил-транс-4-(1-((2-(2-метилфениламино)-6-бензоксазолилацетил))-(4S)-фенилсульфонил-(2S)-пирролидинилметокси)циклогексанкарбоксилата

Метил-транс-4-(1-((2-(2-метилфениламино)-6-бензоксазолил)ацетил)-(4S)-фенилтио-(2S)-пирролидинилметокси)циклогексанкарбоксилат (282,9 мг, 0,461 ммоль) растворяют в метиленхлориде (6,0 мл). К образовавшемуся раствору добавляют м-хлорпербензойную кислоту (198,9 мг, 1,152 ммоль) перемешивают при 0°С. Реакционную смесь перемешивают при такой же температуре в течение 3,5 часа и при комнатной температуре в течение 5 часов. Реакционную смесь разбавляют смесью хлороформ-метанол (10:1, об./об.). Разбавленную смесь промывают насыщенным водным раствором бикарбоната натрия, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси хлороформ-метанол (15:1, об./об.) метил-транс-4-(1-((2-(2-метилфениламино)-6-бензоксазолил)ацетил)-(4S)-фенилсульфонил-(2S)-пирролидинилметокси)циклогексанкарбоксилат (количественный выход) получают в виде светло-коричневого аморфного вещества.
1H-ЯМР (CDCl3) δ: 0,95-1,55 (4H, м), 1,70-2,50 (общий 10H, ряд м, включая общий 3H, с при δ: 2,34 и 2,37), 3,00-4,34 (общий 12H, ряд м, включая 3H, с при δ: 3,63), 6,85-8,15 (общий 13H, ряд м, ArH, NH).
МС (ESI) m/z 646 (M++1).
(Стадия 2) Синтез транс-4-(1-((2-(2-метилфениламино)-6-бензоксазолил)ацетил))-(4S)-фенилсульфонил-(2S)-пирролидинилметокси)циклогексанкарбоновой кислоты
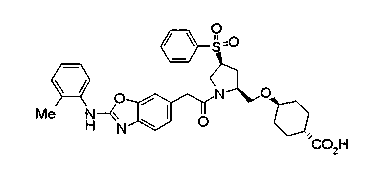
Метил-транс-4-(1-((2-(2-метилфениламино)-6-бензоксазолил)ацетил))-(4S)-фенилсульфонил-(2S)-пирролидинилметокси)циклогексанкарбоксилат (297,6 мг, 0,461 ммоль) растворяют в ТГФ (6,0 мл). К образовавшемуся раствору добавляют 0,25 н. NaOH (6,0 мл) с последующим перемешиванием при комнатной температуре в течение 18 часов. Из реакционной смеси растворитель отгоняют при пониженном давлении. Остаток подкисляют 1 н. HCl (1,7 мл). Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при 50°С при пониженном давлении, получая при этом указанное в заголовке соединение (268,4 мг, 92%) в виде аморфного вещества.
ИК (ATR) ν 1695, 1639, 1575, 1446 см-1;
1H-ЯМР (ДМСО-d6) δ: 0,97-1,22 (2H, м), 1,22-1,40 (2H, м), 1,73-1,98 (4H, м), 2,07-2,25 (3H, м), 2,30 (3Н, с, ArMe), 3,03-4,45 (общий 9H, ряд м), 6,99 (1H, д, J=8,0 Гц, ArH), 7,08 (1H, дд, J=7,2 Гц, ArH), 7,24 (4H, м, ArH), 7,65-7,96 (общий 6H, ряд м, ArH), 9,64 (1H, ушир.с).
МС (ESI) m/z 632 (M++1);
Анал. Вычисл. для С34Н37N3O7S·0,75H2O: C, 63,29; H, 6,01; N, 6,51; S, 4,97.
Найдено: C, 63,15; H, 5,71; N, 6,33; S, 4,95.
Пример 125
транс-4-(1-((5-Хлор-2-фтор-4-((1-метил-3-индолилкарбонил)амино)фенил)ацетил)-(4S)-метилтио-(2S)-пирролидинилметокси)циклогексанкарбоновая кислота:
(Стадия 1) Синтез транс-4-(N-(трет-бутоксикарбонил)-(4S)-метилтио-(2S)-пирролидинилметокси)циклогексанкарбоновой кислоты
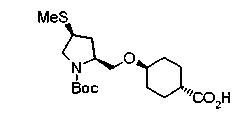
Метил-транс-4-(N-(трет-бутоксикарбонил)-(4R)-метансульфонилокси-(2S)-пирролидинилметокси)циклогексанкарбоксилат (95,3 мг, 0,219 ммоль) растворяют в ДМФ (2,0 мл). К образовавшемуся раствору добавляют тиометоксид натрия (46,0 мг, 0,656 ммоль) при комнатной температуре в потоке газообразного азота. После перемешивания в течение 18 часов при 60°С реакционную смесь охлаждают и затем разбавляют этилацетатом. Раствор в этилацетате промывают 1 н. HCl, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси гексан-этилацетат (1:1, об./об.) транс-4-(N-(трет-бутоксикарбонил)-(4S)-метилтио-(2S)-пирролидинилметокси)циклогексанкарбоновую кислоту (77,2 мг, 95%) получают в виде прозрачного масла.
1H-ЯМР (CDCl3) δ: 1,17-1,34 (2H, м), 1,37-1,55 (11H, м, включая 9H, с при δ: 1,46), 1,91 (1H, м), 1,96-2,10 (4H, м), 2,13 (3H, с, SMe), 2,30 (1H, м), 2,38 (1H, м), 3,07-3,18 (2H, м), 3,23 (1H, м), 3,43-4,06 (общий 4H, ряд м).
(Стадия 2) Синтез метил-транс-4-(N-(трет-бутоксикарбонил)-(4S)-метилтио-(2S)-пирролидинилметокси)циклогексанкарбоксилата
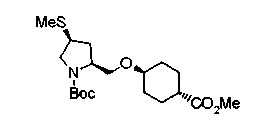
В бензоле (5,0 мл) и метаноле (0,5 мл) растворяют транс-4-(N-(трет-бутоксикарбонил)-(4S)-метилтио-(2S)-пирролидинилметокси)циклогексанкарбоновую кислоту (77,2 мг, 0,207 ммоль). При перемешивании при 0°С добавляют триметилсилилдиазометан (2 М раствор в гексане, 1 мл) и образовавшуюся смесь перемешивают при комнатной температуре в течение 30 минут. К реакционной смеси при 0°С добавляют уксусную кислоту. Из образовавшейся смеси растворитель отгоняют при пониженном давлении с последующим разбавлением этилацетатом. Раствор в этилацетате промывают насыщенным водным раствором бикарбоната натрия, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя, посредством чего метил-транс-4-(N-(трет-бутоксикарбонил)-(4S)-метилтио-(2S)-пирролидинилметокси)циклогексанкарбоксилат (75,6 мг, 94%) получают в виде светло-желтого масла. Соединение используют для следующей реакции без дополнительной очистки.
1H-ЯМР (CDCl3) δ: 1,15-1,32 (2H, м), 1,36-1,54 (11H, м, включая 9H, с при δ: 1,46), 1,85-2,08 (5H, м), 2,13 (3H, с, SMe), 2,26 (1H, м), 2,38 (1H, м), 3,05-3,16 (2H, м), 3,21 (1H, м), 3,42-4,05 (общий 7H, ряд м, включая 3H, с при δ: 3,66).
(Стадия 3) Синтез метил-транс-4-((4S)-метилтио-(2S)- пирролидинилметокси)циклогексанкарбоксилата
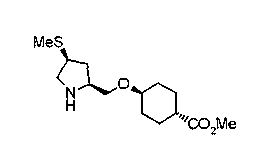
Метил-транс-4-(N-(трет-бутоксикарбонил)-(4S)-метилтио-(2S)-пирролидинилметокси)циклогексанкарбоксилат (75,6 мг, 0,195 ммоль) растворяют в метиленхлориде (4,0 мл). К образовавшемуся раствору добавляют трифторуксусную кислоту (2,0 мл) при 0°С. Образовавшуюся смесь перемешивают в течение 2,5 часа при комнатной температуре. Из реакционной смеси растворитель отгоняют при пониженном давлении. Остаток разбавляют хлороформом. Раствор в хлороформе нейтрализуют насыщенным водным раствором бикарбоната натрия с посредующей экстракцией смесью хлороформ-метанол (10:1, об./об.). Экстракт сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя, посредством чего метил-транс-4-((4S)-метилтио-(2S)-пирролидинилметокси)циклогексанкарбоксилат получают в виде светло-желтого масла. Соединение используют для следующей стадии без дополнительной очистки.
1H-ЯМР (CDCl3) δ: 1,18-1,52 (6H, м), 1,94-2,12 (7H, м, включая 3H, с при δ: 2,10), 2,20-2,31 (2H, м), 2,90 (1H, дд, J=8,0, 14,0 Гц), 3,11-3,32 (4H, м), 3,43 (1H, дд, J=6,2, 9,4 Гц), 3,49 (1H, дд, J=5,0, 9,4 Гц).
(Стадия 4) Синтез метил-транс-4-(1-((5-хлор-2-фтор-4-((1-метил-3-индолилкарбонил)амино)фенил)ацетил)-(4S)-метилтио-(2S)-пирролидинилметокси)циклогексанкарбоксилата
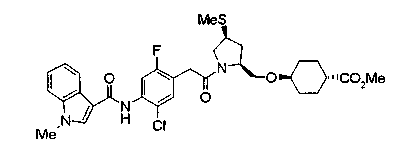
Метил-транс-4-((4S)-метилтио-(2S)-пирролидинилметокси)циклогексанкарбоксилат (161,6 мг, 0,562 ммоль) растворяют в ДМФ (7,0 мл). К образовавшемуся раствору добавляют (5-хлор-2-фтор-4-((1-метил-3-индолилкарбонил)амино)фенил)уксусную кислоту (202,8 мг, 0,562 ммоль), HOBt (15,2 мг, 0,112 ммоль) и EDC·HCl (161,7 мг, 0,843 ммоль). Образовавшуюся смесь перемешивают при комнатной температуре в течение 18 часов. Реакционную смесь разбавляют этилацетатом. Разбавленную смесь промывают последовательно 1 н. HCl и насыщенным водным раствором бикарбоната натрия, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси гексан-этилацетат (1:2, об./об.) метил-транс-4-(1-((5-хлор-2-фтор-4-((1-метил-3-индолилкарбонил)амино)фенил)ацетил)-(4S)-метилтио-(2S)-пирролидинилметокси)циклогексанкарбоксилат (328,8 мг, 93%) получают в виде светло-желтого масла.
1H-ЯМР (CDCl3) δ: 1,09-1,33 (2H, м), 1,36-1,54 (2H, м), 1,90-2,11 (5H, м), 2,15 (3H, с, SMe), 2,17-2,59 (общий 2H, ряд м), 3,11-3,23 (2H, м), 3,30 (1H, дд, J=10,0 Гц), 3,52-3,98 (общий 11H, ряд м, включая 3H, с при δ: 3,62 и 3H, с при 3,89), 4,19-4,44 (общий 1H, м), 7,30-7,46 (4H, м), 7,81 (1H, д, J=4,4 Гц), 8,14 (1H, м), 8,30 (1H, с), 8,51 (1H, дд, J=10,8 Гц).
(Стадия 5) Синтез транс-4-(1-((5-хлор-2-фтор-4-((1-метил-3-индолилкарбонил)амино)фенил)ацетил)-(4S)-метилтио-(2S)-пирролидинилметокси)циклогексанкарбоновой кислоты

Метил-транс-4-(1-((5-хлор-2-фтор-4-((1-метил-3-индолилкарбонил)амино)фенил)ацетил)-(4S)-метилтио-(2S)-пирролидинилметокси)циклогексанкарбоксилат (146,6 мг, 0,234 ммоль) растворяют в ТГФ (3,0 мл). К образовавшемуся раствору добавляют 0,25 н. NaOH (3,0 мл) и метанол (0,5 мл) с последующим перемешиванием при комнатной температуре в течение 0,5 часа. Реакционную смесь концентрируют при пониженном давлении и концентрат нейтрализуют 1 н. HCl. Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при 50°С при пониженном давлении, получая при этом указанное в заголовке соединение (135,0 мг, 94%) в виде белого аморфного вещества.
ИК (ATR) ν 2935, 1641, 1517 см-1;
1H-ЯМР (ДМСО-d6) δ: 1,08-1,43 (4H, м), 1,76-2,05 (5H, м), 2,14 (3Н, с, SMe), 2,16 (1H, м), 2,35 (1H, м), 3,09-3,47 (4H, м), 3,55-3,66 (2H, м), 3,71 (1H, с), 3,80-4,38 (общий 5H, ряд м, включая 3Н, с, при (3,89), 7,22 (1H, дд, J=7,2 Гц), 7,28 (1H, дд, J=7,2 Гц), 7,43 (1H, д, J=7,2 Гц), 7,56 (1H, д, J=7,2 Гц), 7,70 (1H, м), 8,15 (1H, д, J=7,2 Гц), 8,31 (1H, с), 9,32 (1H, с).
МС (ESI) m/z 616 (M++1);
Анал. Вычисл. для С31Н35ClFN3O5S·0,5H2О: C, 59,56; H, 5,80; N, 6,72; Cl, 5,67; F, 3,04; S, 5,13.
Найдено: C, 59,39; H, 5,53; N, 6,78; Cl, 5,74; F, 2,99; С, 5,12.
Пример 126
транс-4-(1-((2-(5-Фтор-2-метилфениламино)-7-фтор-6-бензоксазолил)ацетил)-(4S)-метилтио-(2S)-пирролидинилметокси)циклогексанкарбоновая кислота:
(Стадия 1) Синтез метил-транс-4-(1-((2-(5-Фтор-2-метилфениламино)-7-фтор-6-бензоксазолил)ацетил)-(4S)-метилтио-(2S)-пирролидинилметокси)циклогексанкарбоксилата
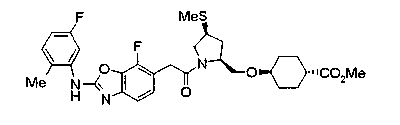
Метил-транс-4-((4S)-метилтио-(2S)-пирролидинилметокси)циклогексанкарбоксилат (169,4 мг, 0,589 ммоль) растворяют в ДМФ (7,0 мл). К образовавшемуся раствору добавляют (2-(5-фтор-2-метилфениламино)-7-фтор-6-бензоксазолил)уксусную кислоту (187,6 мг, 0,589 ммоль), HOBt (15,9 мг, 0,118 ммоль) и EDC·HCl (169,5 мг, 0,884 ммоль). Образовавшуюся смесь перемешивают при комнатной температуре в течение 18 часов. Реакционную смесь разбавляют этилацетатом. Разбавленную смесь промывают последовательно 1 н. HCl и насыщенным водным раствором бикарбоната натрия, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси гексан-этилацетат (1:2, об./об.) метил-транс-4-(1-((2-(5-Фтор-2-метилфениламино)-7-фтор-6-бензоксазолил)ацетил)-(4S)-метилтио-(2S)-пирролидинилметокси)циклогексанкарбоксилат (336,0 мг, 97%) получают в виде светло-желтого аморфного вещества.
1H-ЯМР (CDCl3) δ: 1,10-1,35 (2H, м), 1,36-1,55 (2H, м), 1,90-2,61 (общий 13H, ряд м, включая 3H, с при δ: 2,15 и 3H, с при δ: 2,32), 3,13-3,25 (2H, м), 3,31 (1H, дд, J=9,6 Гц), 3,54-3,80 (общий 7H, ряд м, включая 3H, с при δ: 3,65), 3,87-4,00 (1H, м), 4,20-4,45 (общий 1H, м), 6,75 (1H, м), 6,98 (1H, ушир.с), 7,07-7,18 (2H, м), 7,24 (1H, м), 8,11 (1H, дд, J=2,8, 11,2 Гц).
(Стадия 2) Синтез транс-4-(1-((2-(5-Фтор-2-метилфениламино)-7-фтор-6-бензоксазолил)ацетил)-(4S)-метилтио-(2S)-пирролидинилметокси)циклогексанкарбоновой кислоты
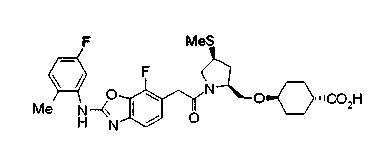
Метил-транс-4-(1-((2-(5-Фтор-2-метилфениламино)-7-фтор-6-бензоксазолил)ацетил)-(4S)-метилтио-(2S)-пирролидинилметокси)циклогексанкарбоксилат (153,5 мг, 0,261 ммоль) растворяют в ТГФ (3,0 мл). К образовавшемуся раствору добавляют 0,25 н. NaOH (3,0 мл). Образовавшуюся смесь перемешивают при комнатной температуре в течение 8 часов. Реакционную смесь концентрируют при пониженном давлении и концентрат нейтрализуют 1 н. HCl. Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при 50°С при пониженном давлении, получая при этом указанное в заголовке соединение (138,8 мг, 93%) в виде белого аморфного вещества.
ИК (ATR) ν 2935, 1639, 1577 см-1;
1H-ЯМР (ДМСО-d6) δ: 1,05-1,43 (4H, м), 1,64-2,04 (5H, м), 2,13 (3Н, с, SMe), 2,15 (1H, м), 2,30 (3Н, с, ArMe), 2,33 (1H, м), 2,95-3,40 (3H, м), 3,54-3,82 (общий 4H, ряд м), 3,83-4,38 (общий 2H, ряд м), 6,90 (1H, м), 7,08 (1H, м), 7,21 (1H, дд, J=3,2,8,4 Гц), 7,26 (1H, дд, J=7,6 Гц), 7,93 (1H, дд, J=3,2,11,2 Гц), 10,05 (1H, ушир.с, NH), 12,05 (1H, ушир.с, CO2H).
МС (ESI) m/z 574 (M++1);
Анал. Вычисл. для С29Н33F2N3O5S·0,5H2О: C, 59,78; H, 5,88; N, 7,21; F, 6,52; S, 5,50.
Найдено: С, 59,89; H, 5,65; N, 7,21; F, 6,43; S, 5,44.
Пример 127
транс-4-(1-((5-Хлор-2-Фтор-4-((1-метил-3-индазолилкарбонил)амино)фенил)ацетил)-(4S)-метилтио-(2S)-пирролидинилметокси)циклогексанкарбоновая кислота:
(Стадия 1) Синтез метил-транс-4-(1-((5-хлор-2-фтор-4-((1-метил-3-индазолилкарбонил)амино)фенил)ацетил)-(4S)-метилтио-(2S)-пирролидинилметокси)циклогексанкарбоксилата
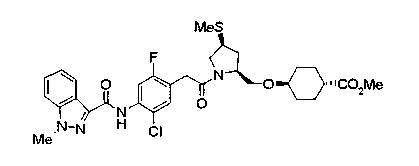
Метил-транс-4-((4S)-метилтио-(2S)-пирролидинилметокси)циклогексилкарбоксилат (163,2 мг, 0,568 ммоль) растворяют в ДМФ (7,0 мл). К образовавшемуся раствору добавляют (5-хлор-2-фтор-4- ((1-метил-3-имидазолилкарбонил)амино)фенил)уксусную кислоту (205,4 мг, 0,568 ммоль), HOBt (15,3 мг, 0,114 ммоль) и EDC·HCl (163,3 мг, 0,852 ммоль) с последующим перемешиванием при комнатной температуре в течение 18 часов. Реакционную смесь разбавляют этилацетатом. Разбавленную смесь промывают последовательно 1 н. HCl и насыщенным водным раствором бикарбоната натрия, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси гексан-этилацетат (1:2, об./об.) метил-транс-4-(1-((5-хлор-2-фтор-4-((1-метил-3-индазолилкарбонил)амино)фенил)ацетил)-(4S)-метилтио-(2S)-пирролидинилметокси)циклогексанкарбоксилат (348,7 мг, 97%) получают в виде светло-желтого аморфного вещества.
1H-ЯМР (CDCl3) δ: 1,10-1,33 (2H, м), 1,37-1,55 (2H, м), 1,92-2,11 (5H, м), 2,15 (3Н, с, SMe), 2,25 (1H, м), 2,33-2,59 (общий 1H, м), 3,12-3,36 (3H, м), 3,52-3,99 (общий 8H, ряд м, включая 3H, с при δ: 3,62), 4,17 (3H, с), 4,19-4,45 (общий 1H, м), 7,29-7,42 (2H, м), 7,45-7,54 (2H, м), 8,38 (1H, д, J=8,0 Гц), 8,51 (1H, дд, J=12,0 Гц), 9,50 (1H, с).
(Стадия 2) Синтез транс-4-(1-((5-хлор-2-фтор-4-((1-метил-3-индазолилкарбонил)амино)фенил)ацетил)-(4S)-метилтио-(2S)-пирролидинилметокси)циклогексанкарбоновой кислоты
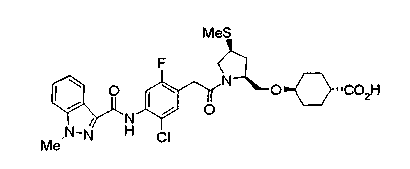
Метил-транс-4-(1-((5-хлор-2-фтор-4-((1-метил-3-индазолилкарбонил)амино)фенил)ацетил)-(4S)-метилтио-(2S)-пирролидинилметокси)циклогексанкарбоксилат (154,7 мг, 0,245 ммоль) растворяют в ТГФ (3,0 мл). К образовавшемуся раствору добавляют 0,25 н. NaOH (3,0 мл) и метанол (1,0 мл). Образовавшуюся смесь перемешивают при комнатной температуре в течение 18 часов. Реакционную смесь концентрируют при пониженном давлении и концентрат нейтрализуют 1 н. HCl. Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при 50°С при пониженном давлении, получая при этом указанное в заголовке соединение (132,2 мг, 87%) в виде белого аморфного вещества.
ИК (ATR) ν 2937, 1621, 1529 см-1;
1H-ЯМР (ДМСО-d6) δ: 1,07-1,42 (4H, м), 1,62-2,41 (общий 10H, ряд м, включая 3Н, с, при δ: 2,14), 2,95-3,47 (общий 3H, ряд м), 3,52-3,92 (общий 4H, ряд м), 4,00-4,39 (общий 5H, ряд м, включая 3Н, с, при δ: 4,22), 7,37 (1H, дд, J=7,6 Гц), 7,49 (1H, д, J=7,6 Гц), 7,54 (1H, дд, J=7,6 Гц), 7,83 (1H, д, J=8,4 Гц), 8,06 (1H, дд, J=6,4,11,2 Гц), 8,21 (1H, д, J=8,4 Гц), 9,73 (1Н, с, NH), 12,05 (1H, ушир.с, CO2H).
МС (ESI) m/z 617 (M++1);
Анал. Вычисл. для С30Н34ClFN4O5S·0,5H2О: C, 57,55; H, 5,63; N, 8,95; Cl, 5,66; F, 3,03; S, 5,12.
Найдено: C, 57,69; H, 5,43; N, 8,92; Cl, 5,67; F, 3,04; С, 5,18.
Пример 128
транс-4-(1-((5-Хлор-2-фтор-4-((1-метил-3-индолилкарбонил)амино)фенил)ацетил)-(4S)-метансульфонил-(2S)-пирролидинилметокси)циклогексанкарбоновая кислота:
(Стадия 1) Синтез метил-транс-4-(1-((5-хлор-2-фтор-4-((1-метил-3-индолилкарбонил)амино)фенил)ацетил)-(4S)-метансульфонил-(2S)-пирролидинилметокси)циклогексанкарбоксилата
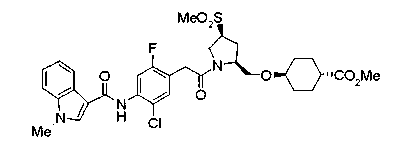
Метил-транс-4-(1-((5-хлор-2-фтор-4-((1-метил-3-индолилкарбонил)амино)фенил)ацетил)-(4S)-метилтио-(2S)-пирролидинилметокси)циклогексанкарбоксилат (182,2 мг, 0,289 ммоль) растворяют в метиленхлориде (4,0 мл). К образовавшемуся раствору добавляют м-хлорпербензойную кислоту (149,7 мг, 0,867 ммоль) при перемешивании при 0°С. Перемешивание проводят далее при такой же температуре в течение 2 часов. Реакционную смесь разбавляют смесью хлороформ-метанол (10:1, об./об.). Разбавленную смесь промывают насыщенным водным раствором бикарбоната натрия, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищали хроматографией с использованием тонкослойной пластины силикагеля, посредством чего из элюатных фракций смеси хлороформ-метанол (10:1, об./об.) метил-транс-4-(1-((5-хлор-2-фтор-4-((1-метил-3-индолилкарбонил)амино)фенил)ацетил)-(4S)-метансульфонил-(2S)-пирролидинилметокси)циклогексанкарбоксилат (159,1 мг, 83%) получают в виде желтого масла.
1H-ЯМР (CDCl3) δ: 1,09-1,34 (2H, м), 1,35-1,55 (2H, м), 1,88-2,14 (5H, м), 2,27 (1H, м), 2,42-2,67 (общий 1H, м), 2,92 и 2,94 (общий 3Н, с, SO2Me), 3,14-3,33 (2H, м), 3,44-3,95 (общий 11H, ряд м, включая общий 3H, с при δ: 3,62 и 3,67, и 3H, с при 3,90), 4,04-4,60 (общий 2H, ряд м), 7,30-7,47 (4H, м), 7,83 (1H, с), 8,13 (1H, м), 8,31 (1H, с), 8,53 (1H, дд, J=12,0 Гц).
(Стадия 2) Синтез транс-4-(1-((5-хлор-2-фтор-4-((1-метил-3-индолилкарбонил)амино)фенил)ацетил)-(4S)-метансульфонил-(2S)-пирролидинилметокси)циклогексанкарбоновой кислоты
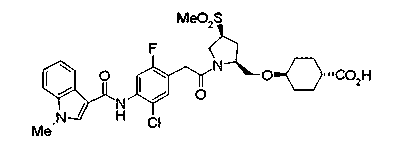
Метил-транс-4-(1-((5-хлор-2-фтор-4-((1-метил-3-индолилкарбонил)амино)фенил)ацетил)-(4S)-метансульфонил-(2S)-пирролидинилметокси)циклогексанкарбоксилат (159,1 мг, 0,240 ммоль) растворяют в ТГФ (3,0 мл). К образовавшемуся раствору добавляют 0,25 н. NaOH (3,0 мл). Образовавшуюся смесь перемешивают при комнатной температуре в течение 4 часов. Реакционную смесь концентрируют при пониженном давлении. Остаток нейтрализуют 1 н. HCl. Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при 35°С при пониженном давлении в течение 3 дней. Сырые кристаллы очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси хлороформ-метанол (20:1, об./об.) указанное в заголовке соединение (107,4 мг, 69%) получают в виде светло-коричневого аморфного вещества.
1H-ЯМР (ДМСО-d6) δ: 1,07-1,45 (4H, м), 1,72-2,06 (5H, м), 2,06-2,49 (2H, м), 3,04 и 3,06 (общий 3Н, с, SO2Me), 3,13-4,50 (общий 12H, ряд м, включая 3H, с при δ: 3,89), 7,22 (1H, дд, J=7,6 Гц), 7,28 (1H, дд, J=7,6 Гц), 7,44 (1H, д, J=7,6 Гц), 7,56 (1H, д, J=7,6 Гц), 7,71 (1H, м), 8,15 (1H, д, J=7,6 Гц), 8,31 (1Н, с), 9,33 (1Н, с, NH), 12,09 (1H, ушир.с, CO2H).
МС (ESI) m/z 648 (M++1).
Пример 129
транс-4-(1-((5-Хлор-2-фтор-4-((1-метил-3-индазолилкарбонил)амино)фенил)ацетил)-(4S)-метансульфонил-(2S)-пирролидинилметокси)циклогексанкарбоновая кислота:
(Стадия 1) Синтез метил-транс-4-(1-((5-хлор-2-фтор-4-((1-метил-3-индазолилкарбонил)амино)фенил)ацетил)-(4S)-метансульфонил-(2S)-пирролидинилметокси)циклогексанкарбоксилата
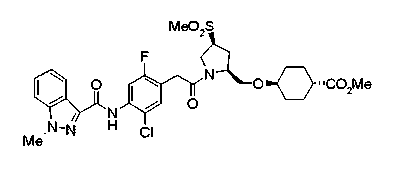
Метил-транс-4-(1-((5-хлор-2-фтор-4-((1-метил-3-индазолилкарбонил)амино)фенил)ацетил)-(4S)-метилтио-(2S)-пирролидинилметокси)циклогексанкарбоксилат (194,0 мг, 0,307 ммоль) растворяют в метиленхлориде (4,0 мл). К образовавшемуся раствору при перемешивании при 0°С добавляют м-хлорпербензойную кислоту (159,1 мг, 0,922 ммоль). Перемешивание проводят далее при такой же температуре в течение 3 часов. Реакционную смесь разбавляют этилацетатом. Раствор в этилацетате промывают последовательно водным раствором сульфита натрия и насыщенным водным раствором бикарбоната натрия, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси хлороформ-метанол (20:1, об./об.) метил-транс-4-(1-((5-хлор-2-фтор-4-((1-метил-3-индазолилкарбонил)амино)фенил)ацетил)-(4S)-метансульфонил-(2S)-пирролидинилметокси)циклогексанкарбоксилат (количественный выход) получают в виде белого аморфного вещества.
1H-ЯМР (CDCl3) δ: 1,12-1,33 (2H, м), 1,37-1,55 (2H, м), 1,92-2,13 (4H, м), 2,20-2,67 (общий 3H, ряд м), 2,92 и 2,95 (общий 3Н, с, SO2Me), 3,25 (1H, м), 3,46-3,92 (общий 9H, ряд м, включая общий 3H, с при δ: 3,63 и 3,66), 4,14 (1H, м), 4,18 (3Н, с, NMe), 4,39 и 4,55 (общий 1H, м), 7,30-7,42 (2H, м), 7,42-7,54 (2H, м), 8,39 (1H, д, J=8,0 Гц), 8,53 (1H, дд, J=12,4 Гц), 9,51 (1H, с).
(Стадия 2) Синтез транс-4-(1-((5-хлор-2-фтор-4-((1-метил-3-индазолилкарбонил)амино)фенил)ацетил)-(4S)-метансульфонил-(2S)-пирролидинилметокси)циклогексанкарбоновой кислоты
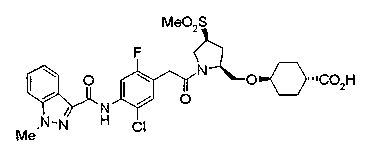
Метил-транс-4-(1-((5-хлор-2-фтор-4-((1-метил-3-индазолилкарбонил)амино)фенил)ацетил)-(4S)-метансульфонил-(2S)- пирролидинилметокси)циклогексанкарбоксилат (203,8 мг, 0,307 ммоль) растворяют в ТГФ (4,0 мл). К образовавшемуся раствору добавляют 0,25 н. NaOH (4,0 мл) и метанол (0,5 мл). Образовавшуюся смесь перемешивают при комнатной температуре в течение 3,5 часа. Реакционную смесь концентрируют при пониженном давлении. После нейтрализации остатка 1 н. HCl смесь разбавляют водой с последующей экстракцией смесью хлороформ-метанол (10:1, об./об.). Экстракт сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси хлороформ-метанол (10:1, об./об.) указанное в заголовке соединение (количественный выход) получают в виде белого аморфного вещества.
ИК (ATR) ν 2935, 1621, 1525 см-1;
1H-ЯМР (CDCl3) δ: 1,11-1,34 (2H, м), 1,38-1,57 (2H, м), 1,80-2,14 (5H, м), 2,30 (1H, м), 2,49 и 2,60 (общий 1H, м), 2,92 и 2,95 (общий 3Н, с, SO2Me), 3,25 (1H, м), 3,46-3,92 (6H, м), 4,06-4,60 (общий 5H, ряд м, включая 3H, с при δ: 4,17), 7,29-7,42 (2H, м), 7,42-7,55 (2H, м), 8,38 (1H, д, J=8,0 Гц), 8,53 (1H, дд, J=12,0 Гц), 7,44 (1H, д, J=7,6 Гц), 7,56 (1H, д, J=7,6 Гц), 7,71 (1H, м), 8,15 (1H, д, J=7, 6 Гц), 9,51 (1H, с).
МС (ESI) m/z 649 (M++1);
Анал. Вычисл. для С30Н34ClFN4O7S.0,5H2O 1,5HC1: C, 50,55; H, 5,16; N, 7,86; Cl, 12,43; F, 2,67; S, 4,50.
Найдено: C, 50,53; H, 4,75; N, 7,62; Cl, 12,43; F, 2,62; S, 4,40.
Пример 130
транс-4-(1-((5-Хлор-2-фтор-4-(1-метил-3-индолилкарбониламино)фенил)ацетил)-(2S)-пирролидинилметокси)-1-циклогексанкарбоновая кислота:
(Стадия 1) Синтез метил-транс-4-((2S)-пирролидинилметокси)-1-циклогексанкарбоксилата
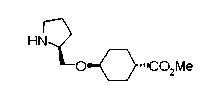
Метил-4-((2S)-пирролидинилметокси)бензоат (2,0 г, 7,36 ммоль) растворяют в смеси уксусная кислота-метанол (1:10, 55 мл). К образовавшемуся раствору добавляют катализатор родий/оксид алюминия (1 г) с последующим каталитическим гидрированием при комнатной температуре и давлении 3,8 атм в течение 15 часов. Катализатор отфильтровывают от реакционной смеси. Фильтрат перегоняют при пониженном давлении для удаления растворителя, посредством чего метил-4-((2S)-пирролидинилметокси)-1-циклогексанкарбоксилат (1,71 г) получают в виде бесцветного масла. Образовавшееся соединение растворяют в смеси ацетонитрил-вода (1:1, 40 мл). К образовавшемуся раствору добавляют триэтиламин (1,5 мл, 10,6 ммоль) и ди-трет-бутилдикарбонат (1,7 г, 7,80 ммоль) и образовавшуюся смесь перемешивают при комнатной температуре в течение 15 часов. Реакционную смесь разбавляют этилацетатом (300 мл). Разбавленную смесь промывают последовательно 1 н. HCl (100 мл) и насыщенным раствором соли (100 мл), сушат над безводным сульфатом магния и перегоняют при пониженном давлении для удаления растворителя, посредством чего метил-4-(1-(трет-бутоксикарбонил)-(2S)- пирролидинилметокси)-1-циклогексанкарбоксилат (2,26 г) получают в виде бесцветного масла. Образовавшееся масло растворяют в метаноле (50 мл). К образовавшемуся раствору добавляют метоксид натрия (1,07 г, 19,9 ммоль) с последующим нагреванием при кипячении с обратным холодильником в течение 15 часов. Реакционную смесь охлаждают и выливают в 1 н. HCl (100 мл) с последующей экстракцией хлороформом (2×100 мл). Экстракт сушат над безводным сульфатом магния и перегоняют при пониженном давлении для удаления растворителя. Маслянистый остаток растворяют в смеси метанол/бензол (1:4, 60 мл) и при перемешивании при комнатной температуре к образовавшемуся раствору по частям добавляют (триметилсилил)диазометан (2М раствор в гексане) до тех пор, пока исчезновение карбоновой кислоты не будет подтверждено ТСХ. Образовавшуюся смесь перегоняют при пониженном давлении для удаления растворителя, получая при этом смесь 1:1 цис-транс-изомеров метил-4-((2S)-пирролидинилметокси)-1-циклогексанкарбоксилата в виде масла. Образовавшуюся смесь очищают колоночной флэш-хроматографией (Biotage), посредством чего из элюатных фракций смеси гексан-этилацетат (4:1) получают транс-изомер. транс-Изомер растворяют в трифторуксусной кислоте (5 мл) и метиленхлориде (5 мл). Смесь перемешивают при комнатной температуре в течение 15 минут. Из реакционной смеси растворитель отгоняют при пониженном давлении. Остаток нейтрализуют насыщенным водным раствором бикарбоната натрия с последующей экстракцией хлороформом (200 мл). Экстракт сушат над безводным сульфатом магния и перегоняют при пониженном давлении для удаления растворителя, в результате чего метил-транс-4-((2S)-пирролидинилметокси-1-циклогексанкарбоксилат (504 мг) получают в виде светло-желтого масла
1H-ЯМР (CDCl3) δ: 1,20-1,29 (м, 2H), 1,34-1,51 (м, 3H), 1,66-2,10 (ряд м, 7H), 2,23-2,31 (м, 1H), 2,83-2,89 (м, 1H), 2,95-3,01 (м, 1H), 3,20-3,28 (м, 2H), 3,32-3,36 (м, 1H), 3,44-3,48 (м, 1H), 3,66 (с, 3H).
МС (ESI) m/z 242 (M++1).
(Стадия 2) Синтез метил-транс-4-(1-((5-хлор-2-фтор-4-(1-метил-3-индолилкарбониламино)фенил)ацетил)-(2S)-пирролидинилметокси)-1-циклогексанкарбоксилата
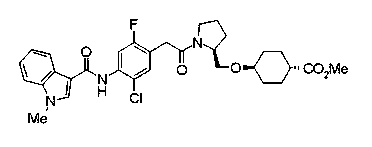
В ДМФ (10 мл) EDC·HCl (274 мг, 1,43 ммоль), DMAP (каталитическое количество) и HOBt (каталитическое количество) добавляют к (5-хлор-2-фтор-4-((1-метил-3-индолилкарбонил)амино)фенилуксусной кислоте (344 мг, 0,953 ммоль) и метил-транс-4-((2S)-пирролидинилметокси)-1-циклогексанкарбоксилату (230 мг, 0,953 ммоль) и образовавшуюся смесь перемешивают при комнатной температуре в течение 15 часов. К реакционной смеси добавляют этилацетат (200 мл) и насыщенный раствор соли (100 мл). Таким образом отделенный органический слой промывают насыщенным раствором соли (100 мл), сушат над безводным сульфатом магния и перегоняют при пониженном давлении для удаления растворителя. Из элюатных фракций смеси хлороформ-этилацетат (4:1) метил-транс-4-(1-((5-хлор-2-фтор-4-(1-метил-3-индолилкарбониламино)фенил)ацетил)-(2S)-пирролидинилметокси)-1-циклогексанкарбоксилат (556 мг, 100%) получают в виде светло-желтого масла.
1H-ЯМР (CDCl3) δ: 1,12-2,32 (ряд м, 13H), 3,15-4,25 (ряд м, 14H), 7,32-7,44 (м, 4H), 7,81 (м, 1H), 8,14 (м, 1H), 8,29 (ушир.с, 1H), 8,48-8,52 (м, 1Н).
МС (ESI) m/z 584 (M++1).
(Стадия 3) Синтез транс-4-(1-((5-хлор-2-фтор-4-(1-метил-3-индолилкарбониламино)фенил)ацетил)-(2S)-пирролидинилметокси)-1-циклогексанкарбоновой кислоты
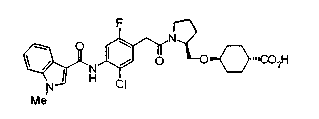
К метил-4-(1-((5-хлор-2-фтор-4-(1-метил-3-индолилкарбониламино)фенил)ацетил)-(2S)-пирролидинилметокси)-1-циклогексанкарбоксилату (556 мг, 0,953 ммоль) добавляют ТГФ (10 мл) и 0,25 н. NaOH (10 мл, 2,50 ммоль). Образовавшуюся смесь перемешивают при комнатной температуре в течение 15 часов. Реакционную смесь выливают в 1 н. HCl (100 мл) с последующей экстракцией смесью хлороформ-метанол (5:1, 2×100 мл). Экстракт сушат над безводным сульфатом магния и перегоняют при пониженном давлении для удаления растворителя. К остатку добавляют хлороформ и гексан. Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении и сушат при пониженном давлении, получая при этом указанное в заголовке соединение (400 мг, 74%) в виде бесцветного твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 1,13-2,34 (ряд м, 13H), 3,16-4,24 (ряд м, общий 11H), 7,32-7,44 (м, 4H), 7,81 (с, 1H), 8,11-8,14 (м, 1H), 8,29 (с, 1H), 8,46-8,51 (м, 1H). МС (FAB) m/z 570 (M++1);
Анал. Вычисл. для С30Н33ClN3O5·0,25 H2О: C, 62,71; H, 5,88; N, 6,96.
Найдено: С, 62,55; H, 5,99; N, 6,96.
Пример 131
транс-4-(1-((2-(6-Фтор-1-метил-3-индолил)-6-бензоксазолил)ацетил)-(2S)-пирролидинилметокси)-1-циклогексанкарбоновая кислота:
(Стадия 1) Синтез метил-транс-4-(1-((2-(6-фтор-1-метил-3-индолил)-6-бензоксазолил)ацетил)-(2S)-пирролидинилметокси)-1-циклогексанкарбоксилата
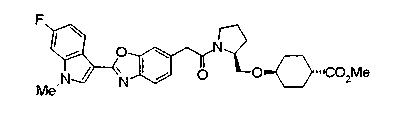
В ДМФ (10 мл), EDC·HCl (177 мг, 0,926 ммоль), DMAP (каталитическое количество) и HOBt (каталитическое количество) добавляют к (2-(6-фтор-1-метил-3-индолилкарбониламино)-6-бензоксазолил)уксусной кислоте (200 мг, 0,617 ммоль) и метил-транс-4-((2S)-пирролидинилметокси)-1-циклогексанкарбоксилату (149 мг, 0,617 ммоль) и образовавшуюся смесь перемешивают при комнатной температуре в течение 15 часов. К реакционной смеси добавляют этилацетат (200 мл) и насыщенный раствор соли (100 мл). Таким образом отделенный органический слой промывают насыщенным раствором соли (100 мл), сушат над безводным сульфатом магния и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси хлороформ-метанол (10:1) метил-транс-4-(1-((2-(6-Фтор-1-метил-3-индолил)-6-бензоксазолил)ацетил)-(2S)-пирролидинилметокси)-1-циклогексанкарбоксилат (338 мг, 100%) получают в виде светло-желтого масла.
1H-ЯМР (CDCl3) δ: 1,11-1,48 (ряд м, 4H), 1,86-2,06 (м, 8H), 2,18-2,35 (м, 1Н) 3,16-4,27 (ряд м, 14H), 7,05-7,24 (м, 3H), 7,50-7,52 (м, 1H), 7,62-7,67 (м, 1H), 7,90 (с, 1H), 8,38 (дд, J=8,8, 5,4 Гц, 1H).
МС (ESI) m/z 549 (M++1).
(Стадия 2) Синтез транс-4-(1-((2-(6-фтор-1-метил-3-индолил)-6-бензоксазолил)ацетил)-(2S)-пирролидинилметокси)-1-циклогексанкарбоновой кислоты
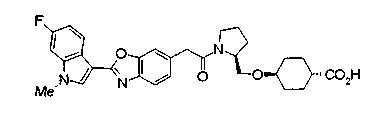
К метил-транс-4-(1-((2-(6-фтор-1-метил-3-индолилкарбониламино)-6-бензоксазолил)ацетил)-(2S)-пирролидинилметокси)-1-циклогексанкарбоксилату (338 мг, 0,617 ммоль) добавляют ТГФ (10 мл) и 0,25 н. NaOH (10 мл, 2,50 ммоль). Образовавшуюся смесь перемешивают при комнатной температуре в течение 15 часов. Реакционную смесь выливают в 1 н. HCl (100 мл) с последующей экстракцией смесью хлороформ-метанол (5:1, 2×100 мл). Экстракт сушат над безводным сульфатом магния и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси хлороформ-метанол (10:1) указанное в заголовке соединение (202 мг, 49%) получают в виде бесцветного аморфного вещества.
1H-ЯМР (ДМСО) δ: 1,07-1,35 (м, 4H), 1,83-1,93 (м, 8H), 2,13 (м, 1H), 3,12-4,21 (ряд м, 11H), 7,14-7,22 (м, 2H), 7,51-7,54 (м, 2H), 7,63 (д, J=8,1 Гц, 1H), 8,28-8,33 (м, 2H).
МС (FAB) m/z 534 (M++1);
Анал. Вычисл. для С30Н32N3O5·0,5 H2О: C, 66,41; H, 6,13; N, 7,74.
Найдено: C, 66,60; H, 6,23; N, 7,46.
Пример 132
транс-4-(4-(5-Хлор-2-фтор-4-((1-метил-1Н-3-индолилкарбонил)амино)фенилацетил)-(3S)-морфолинилметокси)циклогексанкарбоновая кислота:
(Стадия 1) Синтез метил-4-(4-N-бензилоксикарбонил-(3S)-морфолинилметокси)бензоата
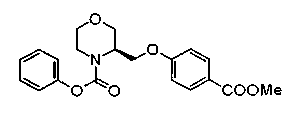
В ТГФ (15 мл) растворяют 4-N-бензилоксикарбонил-(3S)-морфолинметанол (1,42 г, 5,65 ммоль), метил-4-гидроксибензоат (860 мг, 5,65 ммоль) и трифенилфосфин (1,93 г, 7,35 ммоль). К образовавшемуся раствору добавляют DIAD (1,44 мл, 7,35 ммоль). Образовавшуюся смесь нагревают при кипячении с обратным холодильником в течение 18 часов. Реакционную смесь охлаждают при комнатной температуре и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем (хроматографическая система при среднем давлении: YAMAZEN YFLC-5404-FC, хлороформ, (37 мм×300 мм, 12 мл/мин), получая при этом метил-4-(4-N-бензилоксикарбонил-(3S)-морфолинилметокси)бензоат (2,18 г, 100%) в виде бесцветного масла.
1H-ЯМР (CDCl3) δ: 3,20-4,40 (м, 9H), 3,88 (д, J=7,8 Гц, 3H), 4,96 (м, 2H), 6,88 (д, J=8,8 Гц, 2H), 7,54 (м, 5H), 7,90 (д, J=8,8 Гц, 2H).
МС (ESI) m/z, 386 (M++1).
(Стадия 2) Синтез метил-4-(4-трет-бутоксикарбонил-(3S)-морфолинилметокси)циклогексанкарбоксилата
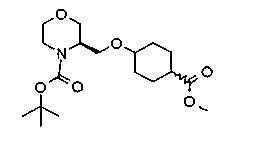
В смеси метанол/трифторуксусная кислота (40 мл, 1:1) растворяют метил-4-(4-N-бензилоксикарбонил-(3S)-морфолинилметокси)бензоат (2,18 г, 5,65 ммоль). К образовавшемуся раствору добавляют катализатор 50% родий-оксид алюминия/уголь (1 г) с последующим каталитическим гидрированием при комнатной температуре в течение 48 часов при давлении водорода 5 атм. Катализатор отфильтровывают от реакционной смеси. Фильтрат перегоняют при пониженном давлении для удаления растворителя. Остаток растворяют в ТГФ (20 мл). Добавляют триэтиламин (3,9 мл, 28,3 ммоль) и ди-трет-бутилдикарбонат (1,85 г, 8,5 ммоль) и образовавшуюся смесь перемешивают в течение 18 часов при комнатной температуре. Из реакционной смеси растворитель отгоняют при пониженном давлении. К остатку добавляют воду и смесь экстрагируют этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом магния и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем (хроматографическая система при среднем давлении: YAMAZEN YFLC-5404-FC), получая при этом метил-4-(4-трет-бутоксикарбонил-(3S)-морфолинилметокси)циклогексанкарбоксилат в виде густой вязкой жидкости.
МС (ESI) m/z 252 (M++1).
(Стадия 3) Синтез метил-транс-4-(4-трет-бутоксикарбонил-(3S)-морфолинилметокси)циклогексанкарбоксилата

Смесь цис- и транс-метил-4-(4-трет-бутоксикарбонил-(3S)-морфолинилметокси)циклогексанкарбоксилатов (450 мг, 1,21 ммоль), полученную в вышеописанной стадии, разделяют хроматографией на колонке с силикагелем (Biotage, флэш-хроматография №2, 195-s, толуол/этилацетат, 9:1), получая при этом метил-транс-4-(4-трет-бутоксикарбонил-(3S)-морфолинилметокси)циклогексанкарбоксилат (45 мг, 10%) в виде бесцветного масла.
1H-ЯМР (CDCl3) δ: 1,28 (м, 2H), 1,42 (м, 2H), 1,48 (с, 9H), 2,05 (м, 4H), 2,28 (м, 1H), 3,02 (м, 1H), 3,25 (м, 1H), 3,48 (м, 4H), 3,65 (с, 3H), 3,70 (т, J=9,1 Гц, 1H), 3,83 (д, J=8,3 Гц, 1H), 3,96 (д, J=11,3 Гц, 2H).
МС (ESI) m/z 357 (M++1).
(Стадия 4) Синтез метил-транс-4-(3S)-морфолинилметокси) циклогексанкарбоксилата

Метил-транс-4-(4-трет-бутоксикарбонил-(3S)-морфолинилметокси)циклогексанкарбоксилат (45 мг, 0,13 ммоль) растворяют в смеси метиленхлорид/трифторуксусная кислота (15 мл, 2:1). Образовавшийся раствор перемешивают в течение 2 часов при комнатной температуре. Из реакционной смеси растворитель отгоняют при пониженном давлении. Остаток нейтрализуют насыщенным водным раствором бикарбоната натрия. После экстракции этилацетатом экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом магния и перегоняют при пониженном давлении для удаления растворителя, получая при этом метил-транс-4-((3S)-морфолинилметокси)циклогексанкарбоксилат (29 мг, 91%) в виде бесцветного масла.
1H-ЯМР (ДМСО) δ: 1,20 (м, 2H), 1,48 (AB тип кв., J=10,5 Гц, 2Н), 2,05 (м, 4Н), 2,88 (м, 1Н), 2,95 (м, 1H), 3,00 (м, 1H), 3,20 (м, 1H), 3,25 (м, 2H), 3,40 (дд, J-4,0,8,8 Гц, 1H), 3,53 (дт, J=3,0, 10,5 Гц, 1H), 3,66 (с, 3H), 3,77 (дт, J=2,5, 8,8 Гц, 2H).
МС (ESI) m/z 258 (M+1)+.
(Стадия 5) Синтез транс-4-(4-(5-хлор-2-фтор-4-((1-метил-1Н-3-индолилкарбонил)амино)фенилацетил)-(3S)-морфолинилметокси)циклогексанкарбоновой кислоты
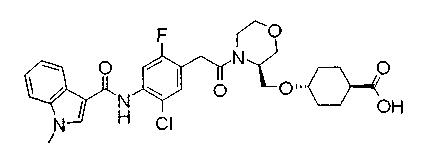
В ДМФ (2,5 мл) метил-транс-4-((3S)-морфолинилметокси)циклогексанкарбоксилат (29 мг, 0,11 ммоль), (5-хлор-2-фтор-4-((1-метил-3-индолилкарбонил)амино)фенилуксусную кислоту (41 мг, 0,1 ммоль), EDC·HCl (33 мг, 0,17 ммоль), HOBt (29 мг, 0,21 ммоль) и DMAP (каталитическое количество) перемешивают в течение 18 часов при комнатной температуре. Образовавшуюся смесь разбавляют этилацетатом (50 мл). Разбавленную смесь промывают 1 н. HCl и насыщенным раствором соли, сушат над безводным сульфатом магния и перегоняют при пониженном давлении. К остатку добавляют ТГФ (6 мл) и 0,25 М NaOH (0,68 мл, 0,17 ммоль) и смесь перемешивают в течение 18 часов при комнатной температуре. Реакционную смесь перегоняют при пониженном давлении для удаления растворителя. К остатку добавляют 1 н. HCl. Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при пониженном давлении, получая при этом указанное в заголовке соединение (57 мг, 86%) в виде бесцветного твердого вещества.
1H-ЯМР (ДМСО-d6) (1,20 (м, 3H), 1,35 (м, 3H), 1,92 (м, 3H), 2,18 (м, 1H), 2,90 (м, 1H), 3,52 (м, 2H), 3,50-3,85 (м, 1H), 3,88 (с, 3H), 4,05 и 4,30 (2 м, общий, 2H), 7,22 (т, J=7,0 Гц, 1H), 7,28 (т, J=7,5 Гц, 1H), 7,40 (дд, J=7,8 Гц, 19,1 ГЦ, 1H), 7,55 (д, J=8,3 Гц, 1H), 7,70 (дд, J=5,8 Гц, 10,7 Гц, 1H), 8,15 (д, J=8,6 Гц, 1H), 8,31 (с, 1H), 9,31 (с, 1H).
МС (ESI) m/z 587 (M+1)+;
Анал. Вычисл. для С30Н33ClFN3O6·С, 61,48; H, 5,68; N, 7,17.
Найдено: С, 61,06; H, 5,73; N, 6,88.
Пример 133
транс-4-(1-((5-Хлор-2-фтор-4-((1-метил-1Н-3-индолилкарбонил)амино)фенилацетил)-(4S)-метил-(2S)-пирролидинилметокси)циклогексанкарбоновая кислота:
(Стадия 1) Синтез (2R,5S)-2-фенил-3-окса-1-азабицикло(3.3.0)октан-8-она
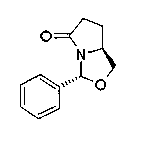
В толуоле (500 мл) (5S)-гидроксиметилпирролидин-2-он (72 г, 0,63 моль), бензальдегид (79,6 г, 0,75 моль) и п-толуолсульфокислоту (1,6 г, 9,4 ммоль) нагревают при кипячении с обратным холодильником в течение 48 часов с использованием отделителя (ловушки) воды Дина-Старка. После охлаждения реакционной смеси до комнатной температуры к ней добавляют воду (300 мл) с последующей экстракцией этилацетатом. Экстракт промывают насыщенным водным раствором бикарбоната натрия и насыщенным раствором соли, сушат над безводным сульфатом магния и перегоняют при пониженном давлении для удаления растворителя. Остаток перегоняют при пониженном давлении, получая при этом (2R,5S)-2-фенил-3-окса-1-азабицикло(3.3.0)октан-8-он (71 г, 56%) в виде светло-желтого масла.
1H-ЯМР (CDCl3) δ: 1,95 (м, 1H), 2,30 (м, 1H), 2,58 (м, 1H), 2,80 (м, 1H), 3,48 (т, J=8,0 Гц, 1H), 4,15 (м, 1H), 4,24 (м, 1H), 6,32 (с, 1H), 7,32 (м, 3H), 7,40 (м, 2H).
МС (ESI) m/z 204 (M+1)+.
(Стадия 2) Синтез (2R,5S,7S)-7-метил-2-фенил-3-окса-1-азабицикло(3.3.0)октан-8-она
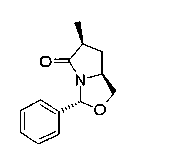
К раствору (2R,5S)-2-фенил-3-окса-1-азабицикло(3.3.0)октан-8-она (5,08 г, 25 ммоль) в ТГФ (30 мл) добавляют по каплям при -78°С при перемешивании диизопропиламид лития (2,0 М раствор в ТГФ, 13,1 мл, 26,3 ммоль). После перемешивания реакционной смеси при такой же температуре в течение 15 минут к ней добавляют метилиодид (7,78 мл, 125 ммоль) и перемешивание проводят дополнительно в течение 30 минут при -40°С. Реакционную смесь выливают в смесь лед-насыщенный водный раствор хлорида аммония с последующей экстракцией этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом магния и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем (Yamazen, среднее давление, линейный градиент смеси н-гексан-этилацетат от 4:1 до 1:1, 30 мин/мин, (50 мм×300 мм, диапазон 0,32), получая при этом (2R,5S,7S)-7-метил-2-фенил-3-окса-1-азабицикло(3.3.0)октан-8-он (3,8 г, 70%) в виде бесцветного масла
1H-ЯМР (CDCl3) δ: 1,23 (д, J=7,3 Гц, 3H), 1,54 (м, 1H, 3-H), 2,62 (м, 1H), 2,95 (м, 1H, 4-H), 3,52 (т, J=7,5 Гц, 1H), 4,09 (т, J=7,5 Гц, 1H, 2-Е), 4,22 (дд, J=6,5,8,O Гц), 6,33 (с, 1H), 7,32 (м, 3H), 7,46 (м, 2H).
МС (ESI) m/z 218 (M+1)+.
(Стадия 3) Синтез 1-N-бензилоксикарбонил-(4S)-метил-(2S)-пирролидинилметанола

Литийалюминийгидрид (1,05 г, 26,2 ммоль) суспендируют в ТГФ (10 мл). К образовавшейся суспензии добавляют по каплям при перемешивании при 60°С (2R,5S,7S)-7-метил-2-фенил-3-окса-1-азабицикло(3.3.0)октан-8-он (3,79 г, 17,5 ммоль) в ТГФ (30 мл). После завершения добавления реакционную смесь нагревают при кипячении с обратным холодильником в течение 1 часа. Реакционную смесь охлаждают до комнатной температуры и затем выливают в тиосульфат натрия (6,5 г, 26,2 ммоль) и лед (500 см3) с последующей экстракцией этилацетатом (500 мл). Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом магния и перегоняют при пониженном давлении для удаления растворителя. К остатку добавляют смесь этанол/уксусная кислота (45 мл, 1:2) и 10% палладий на угле (400 мг) и образовавшуюся смесь подвергают каталитическому гидрированию в течение 24 часов при давлении газообразного водорода 3,5 атм. Из реакционной смеси катализатор отфильтровывают.Фильтрат перегоняют при пониженном давлении для удаления растворителя. К остатку добавляют толуол для удаления воды азеотропной перегонкой. К остатку добавляют смесь ТГФ/вода (4:1, 35 мл) и карбонат калия (2,54 г, 18,4 ммоль). По каплям добавляют бензилоксикарбонилхлорид (30-35% раствор в толуоле, 10,2 мл, 17,9 ммоль) при перемешивании образовавшейся смеси при 0°С.После завершения добавления реакционную смесь перемешивают далее в течение 30 минут при такой же температуре. Реакционную смесь выливают в охлажденный раствор этилацетата и насыщенного водного раствора хлорида аммония и смешанный раствор экстрагируют этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом магния и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем (Yamazen, среднее давление, линейный градиент смеси н-гексан-этилацетат от 4:1 до 7:3, 30 мл/ми, (50 мм×150 мм, диапазон 0,32), получая при этом 1-N-бензилоксикарбонил-(4S)-метил-(2S)-пирролидинилметанола (2,46 г, 56%) в виде бесцветного масла.
1H-ЯМР (CDCl3) δ: 1,01 (д, J=6,1 Гц, 3H), 1,12 (AB тип кв., J=12,5 Гц, 4-H), 1,70 (ушир., 1H), 2,18 (м, 2H), 2,82 (т, J=10,5 Гц), 3,63 (дд, J=7,4 Гц, 11,8 Гц, 1H), 3,72 (м, 1H), 3,79 (т, J=8,5 Гц), 3,98 (м, 1H), 5,14 (с, 2H), 7,36 (м, 5H).
МС (ESI) m/z 250 (M+1)+.
(Стадия 4) Синтез метил-4-(1-N-бензилоксикарбонил-(4S)-метил-(2S)-пирролидинилметокси)бензоата
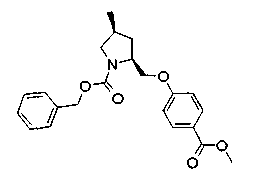
В метиленхлориде (40 мл) растворяют 1-N-бензилоксикарбонил-(4S)-метил-(2S)-пирролидинилметанол (2,06 г, 8,26 ммоль) и триэтиламин (3,45 мл, 24,8 ммоль). При перемешивании при 0°С к образовавшемуся раствору добавляют по каплям метансульфонилхлорид (1,15 мл, 14,9 ммоль). Реакционную смесь разбавляют этилацетатом и разбавленную смесь выливают в 1 М HCl с последующей экстракцией этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом магния и перегоняют при пониженном давлении для удаления растворителя. К остатку добавляют ДМФ (40 мл), карбонат калия (1,71 г, 12,4 ммоль) и метил-4-гидроксибензоат (3,77 г, 24,8 ммоль). Образовавшуюся смесь перемешивают при 100°С в течение 2 часов. Реакционную смесь охлаждают до комнатной температуры и к ней добавляют эфир и воду с последующей экстракцией эфиром. Экстракт промывают 1 М NaOH (3 раза) и насыщенным раствором соли, сушат над безводным сульфатом магния и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси н-гексан/этилацетат (от 9:1 до 7:3) метил-4-(1-N-бензилоксикарбонил-(4S)-метил-(2S)-пирролидинилметокси)бензоат (2,27 г, 72%) получают в виде бесцветного масла.
1H-ЯМР (CDCl3) δ: 1,08 (м, 3H), 1,61 (м, 1H), 2,20 (м, 1H), 2,31 (м, 1H), 2,88 (т, J=10,2 Гц, 1H), 3,80-4,00 (м, 2H), 3,89 (с, 3H), 4,20 (м, 2H), 5,12 (м, 2H), 6,78 и 6,92 (д, J=8,1 Гц, общий 2H), 7,32 (м, 5H), 7,90 и 7,92 (д, J=7,8 Гц, общий 2H).
МС (ESI) m/z 384 (M+1)+. (Стадия 5) Синтез метил-транс-4-(1-N-трет-бутоксикарбонил-(4S)-метил-(2S)-пирролидинилметокси)циклогексанкарбоксилата
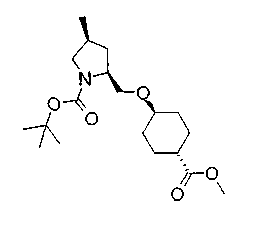
К метил-4-(1-N-бензилоксикарбонил-(4S)-метил-(2S)-пирролидинилметокси)бензоату (2,27 г, 5,92 ммоль) и 5% палладий на угле (389 мг) добавляют смесь метанол/уксусная кислота (30 мл, 10:1) и образовавшуюся смесь подвергают каталитическому гидрированию при комнатной температуре под давлением газообразного водорода 2 атм в течение 18 часов. Из реакционной смеси отфильтровывают катализатор. К фильтрату добавляют уксусную кислоту (10 мл) и катализатор родий-оксид алюминия (700 мг) и каталитическое гидрирование проводят при комнатной температуре при давлении газообразного водорода 4 атм в течение 24 часов. Из реакционной смеси отфильтровывают катализатор. Фильтрат перегоняют при пониженном давлении для удаления растворителя. К остатку добавляют метиленхлорид (30 мл), триэтиламин (2,48 мл, 17,8 ммоль) и ди-трет-бутилдикарбонат (1,94 г, 8,89 ммоль). Образовавшуюся смесь перемешивают при комнатной температуре в течение 3 часов. К реакционной смеси добавляют 15% лимонную кислоту с последующей экстракцией хлороформом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом магния и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем (Yamazen, среднее давление, линейный градиент смеси н-гексан-этилацетат от 9:1 до 1:1). К очищенному продукту добавляют этанол (50 мл) и этоксид натрия (3,02 мл, 8,9 ммоль) и смесь нагревают при кипячении с обратным холодильником в течение 18 часов. Реакционную смесь делают основной 1 М NaOH. Реакционную смесь нагревают при кипячении с обратным холодильником в течение 3 часов. После охлаждения реакционную смесь перегоняют при пониженном давлении для удаления растворителя. К остатку добавляют 15% лимонную кислоту с последующей экстракцией смесью хлороформ/метанол. Экстракт сушат на сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. К остатку добавляют смесь ТГФ/ДМФ (30 мл, 2:1), этилиодид (2,4 мл, 29,5 ммоль) и DBU (1,33 мл, 8,8 ммоль) и образовавшуюся смесь перемешивают в течение 18 часов. К реакционной смеси добавляют 15% лимонную кислоту с последующей экстракцией этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом магния и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем (Biotage, KP-SIL, 32-63 m, 1000 г, н-гексан/этилацетат, 9:1), получая при этом метил-транс-4-(1-N-трет-бутоксикарбонил-(4S)-метил-(2S)-пирролидинилметокси)циклогексанкарбоксилат (404 мг, 19%) в виде бесцветного масла.
1H-ЯМР (CDCl3) δ: 1,03 (д, J=6,6 Гц, 3H), 1,25 (т, J=7,3 Гц, 3H), 1,25-1,70 (м, 6H), 1,46 (с, 9H), 1,82 (м, 3H), 2,10 (м, 1H), 2,20 (м, 1H), 2,32 (м, 1H), 2,70 (т, J=10,0 Гц, 1H), 3,35-3,90 (м, 4H), 3,62 (дд, J=3,0, 9,0 Гц, 1H), 4,12 (кв., J=7,3 Гц, 2H).
МС (ESI) m/z 392 (M+Na)+.
(Стадия 6) Синтез транс-4-(1-(5-хлор-2-фтор-4-((1-метил-1Н-3-индолилкарбонил)амино)фенилацетил)-(4S)-метил-(2S)-пирролидинилметокси)циклогексанкарбоновой кислоты
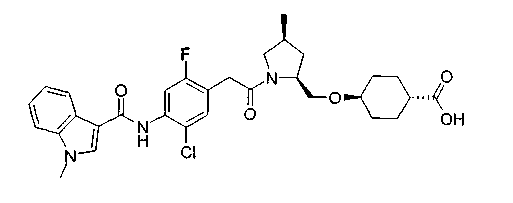
К метил-транс-4-(1-N-трет-бутоксикарбонил-(4S)-метил-(2S)-пирролидинилметокси)циклогексанкарбоксилату (147 мг, 0,397 ммоль) добавляют метиленхлорид (15 мл) и трифторуксусную кислоту (15 мл). Образовавшуюся смесь перемешивают при комнатной температуре в течение 1 часа. Из реакционной смеси растворитель отгоняют при пониженном давлении. К остатку добавляют смесь хлороформ/насыщенный водный раствор бикарбоната натрия с последующей экстракцией хлороформом. Экстракт сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток растворяют в ДМФ (5 мл) и к раствору добавляют (5-хлор-2-фтор-4-((1-метил-1Н-3-индолилкарбонил)амино)фенил)уксусную кислоту (143 мг, 0,397 ммоль), HOBt (102 мг, 0,75 ммоль), DMAP (каталитическое количество) и соль EDC·HCl (114 мг, 0,6 ммоль). Смесь перемешивают при комнатной температуре в течение 18 часов. Реакционную смесь выливают в 1 М HCl с последующей экстракцией этилацетатом. Экстракт промывают насыщенным раствором соли и сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают колоночной хроматографией на силикагеле (Yamazen, среднее давление, хлороформ, 10 мл/мин, (15 мм×300 мм). К очищенному продукту добавляют ТГФ (6 мл) и 0,25 М NaOH (3,6 мл, 0,9 ммоль) и смесь перемешивают в течение 18 часов при комнатной температуре. Реакционную смесь выливают в воду. Раствор подкисляют 1 М HCl. Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при пониженном давлении, получая при этом указанное в заголовке соединение (110 мг, 48%) в виде бесцветного твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 1,12 (д, J=5,5 Гц, 3H), 1,10-1,50 (м, 6H), 1,85-2,15 (м, 6H), 2,60 (м, 1H), 2,90 (т, J=10,5 Гц, 1H), 3,12 (м, 1H), 3,50-4,20 (м, 5H), 2,90 (с, 3H), 7,21 (т, J=7,5 Гц, 1H), 7,29 (т, J=7,5 Гц, 1H), 7,42 (д, J=7,5 Гц, 1H), 7,57 (д, J=8,1 Гц, 1H), 7,70 (м, 1H), 8,16 (д, J=7,8 Гц, 1H), 8,32 (с, 1H).
МС (ESI) m/z 585 (M+1)+;
Анал. Вычисл. для С31Н35ClFN3O5·0,5 H2О: C, 62,78; H, 6,12; N, 7,08.
Найдено: С, 62,58; H, 5,98; N, 7,35.
Пример 134
транс-4-(1-(7-Фтор-2-(5-фтор-2-метилфениламино)-6-бензоксазолил)ацетил)-(4S)-метил-(2S)-пирролидинилметокси)циклогексанкарбоновая кислота:
(Стадия 1) Синтез транс-4-(1-(7-фтор-2-(5-фтор-2-метилфениламино)-6-бензоксазолил)ацетил)-(4S)-метил-(2S)-пирролидинилметокси)циклогексанкарбоновой кислоты
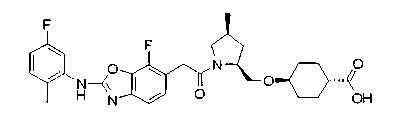
К метил-транс-4-(1-N-трет-бутоксикарбонил-(4S)-метил-(2S)-пирролидинилметокси)циклогексанкарбоксилату (147 мг, 0,397 ммоль) добавляют метиленхлорид (15 мл) и трифторуксусную кислоту (15 мл). Образовавшуюся смесь перемешивают при комнатной температуре в течение 1 часа. Реакционную смесь перегоняют при пониженном давлении для удаления растворителя. К остатку добавляют смесь хлороформ/насыщенный водный раствор бикарбоната натрия с последующей экстракцией хлороформом. Экстракт сушат над безводным сульфатом натрия и реакционную смесь перегоняют при пониженном давлении для удаления растворителя. Остаток растворяют в ДМФ (5 мл) и к образовавшемуся раствору добавляют 7-фтор-2-(5-фтор-2-метилфениламино)-6-бензоксазолил)уксусную кислоту (126 мг, 0,397 ммоль), HOBt (102 мг, 0,75 ммоль), DMAP (каталитическое количество) и соль EDC·HCl (114 мг, 0,6 ммоль). Образовавшуюся смесь перемешивают при комнатной температуре в течение 18 часов. Реакционную смесь выливают в 1 М HCl с последующей экстракцией этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем (Yamazen, среднее давление, хлороформ, 10 мл/мин, (15 мм×300 мм). К очищенному продукту добавляют ТГФ (6 мл) и 0,25 М NaOH (3,6 мл, 0,9 ммоль) и смесь перемешивают в течение 18 часов при комнатной температуре. Реакционную смесь выливают в воду. Раствор подкисляют 1 М HCl. Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при пониженном давлении, получая при этом указанное в заголовке соединение (129 мг, 60%) в виде бесцветного твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 1,01 (д, J=6,0 Гц, 3H), 1,05-1,50 (м, 6H), 1,80-2,20 (м, 6H), 2,30 (с, 3H), 2,50 (м, 1H), 2,95 (т, J=9,8 Гц, 1H), 3,12 (м, 1H), 3,40-3,60 (м, 3H), 5,71 (с, 1H), 5,80-4,00 (м, 1H), 6,90 (дт, J=2,5, 8,3 Гц, 1H), 7,06 (д, J=7,8 Гц, 1H), 7,20 (д, J=8,0 Гц, 1H), 7,26 (т, J=7,5 Гц, 1Н), 7,92 (дд, J=2,5, 11,3 Гц, 1H).
МС (ESI) m/z 542 (M+1)+;
Анал. Вычисл. для С29Н33F2N3O5·0,5 H2О: C, 63,26; H, 6,32; N, 7,63.
Найдено: C, 63,34; H, 6,17; N, 7,64.
Пример 135
транс-4-(1-(5-Хлор-2-фтор-4-((1-метил-1Н-3-индазолилкарбонил)амино) фенилацетил)-(4S)-метил-(2S)-пирролидинилметокси)циклогексанкарбоновая кислота:
(Стадия 1) Синтез транс-4-(1-(5-хлор-2-фтор-4-((1-метил-1Н-3-индазолилкарбонил)амино)фенилацетил)-(4S)-метил-(2S)-пирролидинилметокси)циклогексанкарбоновой кислоты
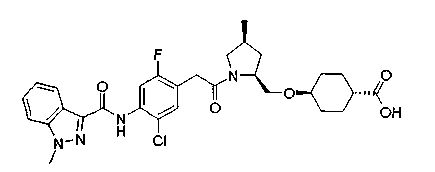
К метил-транс-4-(1-N-трет-бутоксикарбонил-(4S)-метил-(2S)- пирролидинилметокси)циклогексанкарбоксилату (147 мг, 0,397 ммоль) добавляют метиленхлорид (15 мл) и трифторуксусную кислоту (15 мл). Образовавшуюся смесь перемешивают при комнатной температуре в течение 1 часа. Реакционную смесь перегоняют при пониженном давлении для удаления растворителя. К остатку добавляют смесь хлороформ/насыщенный водный раствор бикарбоната натрия с последующей экстракцией хлороформом. Экстракт сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток растворяют в ДМФ (5 мл). К образовавшемуся раствору добавляют (2-фтор-5-хлор-4-((1-метил-1Н-3-индазолилкарбонил)амино)фенил)уксусную кислоту (144 мг, 0,397 ммоль), HOBt (102 мг, 0,75 ммоль), DMAP (каталитическое количество) и соль EDC·HCl (114 мг, 0,6 ммоль) и смесь перемешивают при комнатной температуре в течение 18 часов. Реакционную смесь выливают в 1 М HCl с последующей экстракцией этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем (Yamazen, среднее давление, хлороформ, 10 мл/мин, (15 мм×300 мм). К очищенному продукту добавляют ТГФ (6 мл) и 0,25 М NaOH (3,6 мл, 0,9 ммоль) и смесь перемешивают в течение 18 часов при комнатной температуре. Реакционную смесь выливают в воду и раствор подкисляют 1 М HCl. Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при пониженном давлении, получая при этом указанное в заголовке соединение (89 мг, 38%) в виде бесцветного твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 1,03 (д, J=6,1 Гц, 3H), 1,10-1,50 (м, 6H), 1,83-2,20 (м, 6H), 2,50 (м, 1Н), 2,90 (т, J-9,5 ГЦ, 1H), 3,13 (м, 1H), 3,50-4,05 (м, 5H), 4,21 (с, 3H), 7,39 (т, J=7,5 Гц, 1H), 7,48 (д, J=7,5 Гц, 1H), 7,54 (т, J=7,5 Гц, 1H), 7,82 (д, J-8,6 ГЦ, 1H), 8,08 (д, J=7,5 Гц, 1H), 8,21 (д, J=8,3 Гц, 1H).
МС (ESI) m/z 586 (M+1)+;
Анал. Вычисл. для С30Н34ClFN4O5·0,75 H2О: C, 60,20; H, 5,98; N, 9,36.
Найдено: C, 60,49; H, 5,99; N, 9,10.
Пример 136
транс-4-(1-((5-Хлор-2-фтор-4-((1-метил-3-индолил)карбониламино)фенил)ацетил)-(5S)-метил-(2S)-пирролидинилметокси)циклогексанкарбоновая кислота:
(Стадия 1) Синтез бензил-(2S)-N-трет-бутоксикарбониламино-5-оксогексаноата
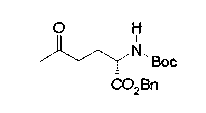
Бензил-N-трет-бутоксикарбонил-(2S)-пироглутамат (20,5 г, 64,2 ммоль) растворяют в ТГФ (500 мл). По каплям при -78°С добавляют метиллитий (1,04 М раствор в эфире, 61,7 мл, 64,2 ммоль). Температуре реакционной смеси дают возможность снова постепенно повыситься до комнатной температуры при перемешивании и образовавшуюся смесь перемешивают в течение 18 часов. Добавляют насыщенный водный раствор хлорида аммония и образовавшуюся смесь концентрируют при пониженном давлении. Концентрат экстрагируют эфиром. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси гексан/этилацетат (3/1) бензил-(2S)-N-трет-бутоксикарбониламино-5-оксогексаноат (8,37 г, 39%) получают в виде желтого масла.
1H-ЯМР (CDCl3) δ: 1,43 (с, 9H), 1,61-2,15 (ряд м, 3H), 2,09 (с, 3H), 2,41-2,55 (м, 2H), 4,30 (ушир.с, 1H), 4,70 (д, J=5,6 Гц, 1H), 5,12-5,21 (м, 2H), 7,29-7,37 (м, 5H);
МС (ESI) m/z 336 (М++Н).
(Стадия 2) Синтез N-трет-бутоксикарбонил-(5S)-метил-(2S)-пирролидинилметанола
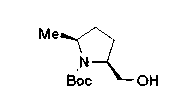
К бензил-(2S)-N-трет-бутоксикарбониламино-5-оксогексаноату (7,61 г, 22,7 ммоль) добавляют метиленхлорид (50 мл) и трифторуксусную кислоту (20 мл). Смесь перемешивают при комнатной температуре в течение 1 часа. Реакционную смесь перегоняют при пониженном давлении для удаления растворителя. К остатку добавляют толуол для удаления азеотропной перегонкой избыточной трифторуксусной кислоты при пониженном давлении. К остатку добавляют 10% палладий на угле (500 мг) и метанол (100 мл) для проведения каталитического восстановления при комнатной температуре и при нормальном давлении. Катализатор отфильтровывают от реакционной смеси и фильтрат перегоняют при пониженном давлении для удаления растворителя, получая при этом коричневое масло. К образовавшемуся маслу добавляют ди-трет-бутилдикарбонат (7,43 г, 34,0 ммоль), смесь метанол/вода (6/1, 140 мл) и 1 н. NaOH (56,7 мл, 56,7 ммоль). Образовавшуюся смесь перемешивают при комнатной температуре в течение 30 минут.Реакционную смесь концентрируют при пониженном давлении с последующей экстракцией смесью хлороформ/метанол (10/1). Экстракт сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси гексан/этилацетат (1/3) получают масло. Масло растворяют в ТГФ (100 мл) и при перемешивании при комнатной температуре добавляют комплекс боран-диметилсульфид (приблизительно 10 М раствор, 5,54 мл, 45,4 ммоль). Образовавшуюся смесь перемешивают при 60°С в течение 1 часа. После охлаждения добавляют ледяную воду и 1 н. HCl с последующей экстракцией этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси гексан/этилацетат (1/1) N-трет-бутоксикарбонил-(5S)-метил-(2S)-пирролидинилметанол (2,03 г, всего 42%) получают в виде бесцветного масла.
1H-ЯМР (CDCl3) δ: 1,17 (д, J=6,0 Гц, 3H), 1,48 (с, 9H), 1,48-1,64 (м, 2H), 1,90-2,11 (м, 2H), 3,52-3,57 (м, 1H), 3,68-3,70 (м, 1H), 3,94-4,13 (м, 2H).
(Стадия 3) Синтез метил-4-(N-трет-бутоксикарбонил-(5S)- метил-(2S)-пирролидинилметокси)бензоата
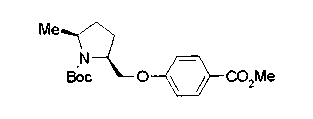
В ТГФ (50 мл) растворяют N-трет-бутоксикарбонил-(5S)-метил-(2S)-пирролидинилметанол (2,02 г, 9,38 ммоль), трифенилфосфин (2,95 г, 11,3 ммоль) и метил-4-гидроксибензоат (1,43 г, 9,38 ммоль). К образовавшемуся раствору добавляют диизопропилазодикарбоксилат (2,14 мл, 10,3 ммоль) и смесь перемешивают при комнатной температуре в течение 18 часов. Реакционную смесь перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси гексан/этилацетат (3/1) метил-4-(N-трет-бутоксикарбонил-(5S)-метил-(2S)-пирролидинилметокси)бензоат (3,27 г, 100%) получают в виде бесцветного масла.
1H-ЯМР (CDCl3) δ: 1,24 (ушир.с, 3H), 1,49 (с, 9H), 1,55-1,70 (м, 2H), 1,94-2,11 (м, 2H), 3,88 (с, 3H), 3,88 (перекрывание, 1H), 4,06-4,20 (м, 2H), 6,93-6,96 (м, 2H), 7,97 (д, J=8,8 Гц, 2H).
МС (ESI) m/z 350 (M++H).
(Стадия 4) Синтез метил-транс-4-((5S)-метил-(2S)-пирролидинилметокси)циклогексанкарбоксилата
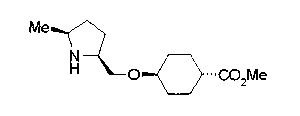
В смеси метанол/уксусная кислота (10/1, 55 мл), метил-4-(N-трет-бутоксикарбонил-(5S)-метил-(2S)-пирролидинилметокси)бензоат (3,27 г, 9,34 ммоль) и 5% родий на оксиде алюминия (0,52 г) перемешивают при комнатной температуре в течение 18 часов при давлении газообразного водорода 20 атм. Из реакционной смеси катализатор отфильтровывают и затем растворитель отгоняют при пониженном давлении. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси гексан/этилацетат (3/1) метил-4-((5S)-метил-(2S)-пирролидинилметокси)циклогексанкарбоксилат (1,74 г, 52%) получают в виде бесцветного масла. В потоке газообразного азота метил-4-((5S)-метил-(2S)-пирролидинилметокси)циклогексанкарбоксилат (1,73 г, 4,87 ммоль) растворяют в метаноле (50 мл). К образовавшемуся раствору добавляют метоксид натрия (800 мг, 14,6 ммоль) и смесь перемешивают в течение 24 часов. После охлаждения добавляют 1 н. HCl и образовавшуюся смесь концентрируют при пониженном давлении. Концентрат экстрагируют смесью хлороформ/метанол (10/1). Экстракт сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток растворяют в смеси бензол/метанол (5/1, 30 мл). При перемешивании при 0°С к раствору добавляют по каплям триметилсилилдиазометан (2,0 М раствор в гексане). После завершения добавления по каплям реакционную смесь перемешивают при комнатной температуре в течение 2 часов. Реакционную смесь затем перегоняют при пониженном давлении для удаления растворителя и остаток очищают флэш-хроматографией с использованием колонки с силикагелем, посредством чего из элюатных фракций смеси гексан/этилацетат (8/1) метил-транс-4-(N-трет-бутоксикарбонил-(5S)-метил-(2S)-пирролидинилметокси) циклогексанкарбоксилат (700 мг, 40%) получают в виде масла. Продукт растворяют в метиленхлориде (30 мл) и к образовавшемуся раствору добавляют трифторуксусную кислоту (10 мл). Смесь перемешивают при комнатной температуре в течение 7 часов. Из реакционной смеси растворитель отгоняют при пониженном давлении. К остатку добавляют насыщенный водный раствор бикарбоната натрия с последующей экстракцией смесью хлороформ/метанол (10/1). Экстракт сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя, получая при этом метил-транс-4-((5S)-метил-(2S)-пирролидинилметокси)циклогексанкарбоксилат (502 мг, 100%) в виде светло-желтого масла.
1H-ЯМР (CDCl3) δ: 1,17 (д, J=6,0 Гц, 3H), 1,94-1,33 (м, 3H), 1,41-1,54 (м, 3H), 1,76-1,90 (м, 2H), 1,98-2,08 (м, 3H), 2,22-2,29 (м, 3H), 3,14-3,30 (м, 3H), 3,39 (дд, J=6,4, 9,2 Гц, 1H), 3,52 (дд, J=4,4, 9,6 Гц, 1H), 3,66 (с, 3H).
(Стадия 5) Синтез метил-транс-4-(1-((5-хлор-2-фтор-4-((1-метил-3-индолил)карбониламино)фенил)ацетил)-(5S)-метил-(2S)-пирролидинилметокси)циклогексанкарбоксилата
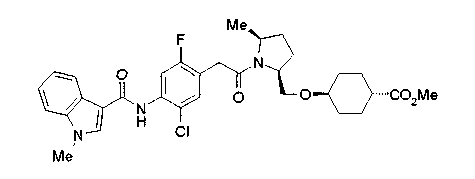
В ДМФ (10 мл) HOBt (21,0 мг, 0,16 ммоль) добавляют к (5-хлор-2-фтор-4-((1-метил-3-индолилкарбонил)амино)фенил)уксусной кислоте (283 мг, 0,78 ммоль), метил-транс-4-((5S)-метил-(2S)-пирролидинилметокси)циклогексанкарбоксилату (205 мг, 0,78 ммоль) и EDC·HCl (165 мг, 0,86 ммоль) и образовавшуюся смесь перемешивают в течение 18 часов. Реакционную смесь выливают в воду с последующей экстракцией этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией с использованием тонкослойной пластины силикагеля, посредством чего из элюатных фракций смеси гексан/этилацетат (1/5) метил-транс-4-(1-((5-хлор-2-фтор-4-((1-метил-3-индолил)карбониламино)фенил)ацетил)-(5S)-метил-(2S)-пирролидинилметокси)циклогексанкарбоксилат (404 мг, 86%) получают в виде бесцветного аморфного вещества.
1H-ЯМР (CDCl3), смесь ротамеров, δ: 1,20-1,34 (м, перекрывание, 2H), 1,29 и 1,33 (д, J=6,4 Гц, общий 3H), 1,42-2,31 (ряд м, 11H), 3,23-3,27 (м, 1H), 3,44-3,51 (м, 1H), 3,66-3,83 (м, 3H), 3,66 и 3,68 (с, общий 3H), 4,14 (ушир.с, 2H), 7,35-7,37 (м, 2H), 7,42-7,44 (м, 2H), 7,82 (с, 1H), 8,13-8,16 (м, 1H), 8,30 (с, 1H), 8,49 и 8,52 (д, J=4,8 Гц, общий 1H).
МС (ESI) m/z 598 (M++1).
(Стадия 6) Синтез транс-4-(1-((5-хлор-2-фтор-4-((1-метил-3-индолил)карбониламино)фенил)ацетил)-(5S)-метил-(2S)-пирролидинилметокси)циклогексанкарбоновой кислоты

Метил-транс-4-(1-((5-хлор-2-фтор-4-((1-метил-3-индолил)карбониламино)фенил)ацетил)-(5S)-метил-(2S)- пирролидинилметокси)циклогексанкарбоксилат (388 мг, 0,65 ммоль) растворяют в смеси ТГФ/метанол (1/1, 20 мл). К образовавшемуся раствору добавляют 0,25 н. NaOH (7,80 мл, 1,95 ммоль) и образовавшуюся смесь перемешивают при комнатной температуре в течение 18 часов. Реакционную смесь выливают в 1 н. HCl с последующей экстракцией смесью хлороформ/метанол (10/1). Экстракт сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси хлороформ/метанол (15/1) указанное в заголовке соединение (389 мг, 100%) получают в виде бесцветного аморфного вещества.
1H-ЯМР (CDCl3), смесь ротамеров, δ, 1,15-1,27 (м, перекрывание, 2H), 1,22 и 1,26 (д, J=6,0 Гц, общий 3H), 1,37-2,30 (ряд м, 11H), 3,16-3,22 (м, 1H), 3,35-3,45 (м, 1H), 3,52-3,79 (м, 3H), 3,82 (с, 3H), 4,09 (ушир.с, 2H), 7,26 (м, 2H), 7,34-7,37 (м, 2H), 7,75 (с, 1H), 8,05-8,08 (м, 1H), 8,23 (с, 1H), 8,41 и 8,44 (д, J=5,6 Гц, общий 1H).
МС (ESI) m/z 584 (M++1);
Анал. Вычисл. для С31Н35ClFN3O5·1/4H2О: C, 63,26; H, 6,08; N, 7,14.
Найдено: C, 63,33; H, 6,18; N, 7,14.
Пример 137
транс-4-(1-((2-(5-Фтор-2-метилфениламино)-7-фтор-6-бензоксазолил)ацетил)-(5S)-метил-(2S)-пирролидинилметокси)циклогексанкарбоновая кислота:
(Стадия 1) Синтез метил-транс-4-(1-((2-(5-фтор-2-метилфениламино)-7-фтор-6-бензоксазолил)ацетил)-(5S)-метил-(2S)-пирролидинилметокси)циклогексанкарбоксилата
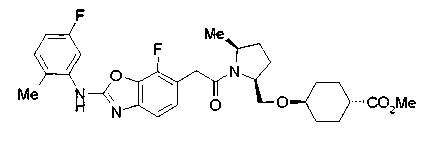
В ДМФ (10 мл) растворяют (2-(5-фтор-2-метилфениламино)-7-фтор-6-бензоксазолил)уксусную кислоту (182 мг, 0,57 ммоль), метил-транс-4-((5S)-метил-(2S)-пирролидинилметокси)циклогексанкарбоксилат (146 мг, 0,57 ммоль) и EDC·HCl (121 мг, 0,63 ммоль). К образовавшемуся раствору добавляют HOBt (15,0 мг, 0,11 ммоль) и образовавшуюся смесь перемешивают при комнатной температуре в течение 18 часов. Реакционную смесь выливают в воду с последующей экстракцией этилацетатом. Экстракт промывают водой, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией с использованием тонкослойной пластинки силикагеля (ТСХ), посредством чего из элюатных фракций смеси гексан-этилацетат (1/5) метил-транс-4-(1-((2-(5-фтор-2-метилфениламино)-7-фтор-6-бензоксазолил)ацетил)-(5S)-метил-(2S)-пирролидинилметокси)циклогексанкарбоксилат (276 мг, 87%) получают в виде бесцветного аморфного вещества.
1H-ЯМР (CDCl3), смесь ротамеров, δ: 1,22-2,24 (ряд м, 13H), 1,31 и 1,33 (д, J=6,4 Гц, общий 3H), 3,20-3,29 (м, 1H), 3,43-3,52 (м, 1H), 3,63-3,83 (ряд м, 3H), 3,67 и 3,68 (с, общий 3H), 3,89 (с, 1H), 4,17 (ушир.с, 2H), 6,74-6,78 (м, 1H), 7,10-7,17 (м, 2H), 7,23 и 7,26 (д, J=2,0 Гц, общий 1H), 8,09 и 8,12 (д, J=4,0 Гц, общий 1H).
МС (ESI) m/z 556 (M++2).
(Стадия 2) Синтез транс-4-(1-((2-(5-фтор-2-метилфениламино)-7-фтор-6-бензоксазолил)ацетил)-(5S)-метил-(2S)-пирролидинилметокси)циклогексанкарбоновой кислоты
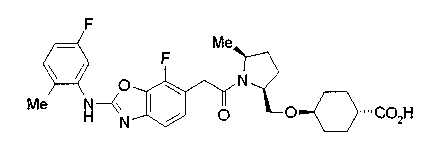
Метил-транс-4-(1-((2-(5-фтор-2-метилфениламино)-7-фтор-6-бензоксазолил)ацетил)-(5S)-метил-(2S)-пирролидинилметокси)циклогексанкарбоксилат (264 мг, 0,48 ммоль) растворяют в смеси ТГФ/метанол (1/1, 20 мл). К образовавшемуся раствору добавляют 0,25 н. NaOH (5,70 мл, 1,43 ммоль) и смесь перемешивают при комнатной температуре в течение 17 часов. Реакционную смесь выливают в 1 н. HCl с последующей экстракцией смесью хлороформ/метанол (10/1). Экстракт сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси хлороформ/метанол (15/1) указанное в заголовке соединение (173 мг, 67%) получают в виде бесцветного аморфного вещества.
1H-ЯМР (CDCl3), смесь ротамеров, δ: 1,14-2,25 (ряд м, 13H), 1,31 и 1,33 (д, J=6,4 Гц, общий 3H), 3,15-3,21 (м, 1H), 3,35-3,44 (м, 1H), 3,58-3,75 (ряд м, 3H), 3,82 (с, 1H), 4,10 (ушир.с, 2H), 6,68-6,72 (м, 1H), 7,03-7,14 (м, 3H), 7,80-7,83 (м, 1H).
МС (ESI) m/z 542 (M++1);
Анал. Вычисл. для С29Н33ClF2N3O5: С, 64,31; H, 6,14; N, 7,76.
Найдено: С, 64,02; H, 6,25; N, 7,52.
Пример 138
транс-4-(1-(5-Хлор-2-фтор-4-((1-метил-1Н-3-индолилкарбонил)амино)фенилацетил)-(4S)-метоксиметил-(2S)-пирролидинилметокси)циклогексанкарбоновая кислота:
(Стадия 1) Синтез (2R,5S,7S)-метоксиметил-2-фенил-3-окса-1-азабицикло(3.3.0)октан-8-она
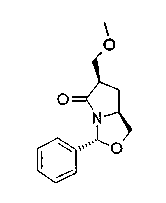
К раствору диизопропиламида лития (110 ммоль, 100 мл ТГФ), полученного из диизопропиламина (15,6 мл, 110 ммоль) и н-бутиллития (70,1 мл, 1,57 М, 110 ммоль)) добавляют (2R,5S)-2-фенил-3-окса-1-азабицикло(3.3.0)октан-8-он (10,2 г, 50 ммоль) при перемешивании при -78°С. После перемешивания при такой же температуре в течение 1 часа к реакционной смеси добавляют раствор хлорметилметилового эфира (5,7 мл, 75 ммоль) в ТГФ (50 мл) и перемешивание проводят далее при -78°С в течение 90 минут. Реакционную смесь выливают в насыщенный водный раствор хлорида аммония с последующей экстракцией этилацетатом. Экстракт промывают насыщенным водным раствором соли, сушат над сульфатом магния и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем (Yamazen, среднее давление, линейный градиент смеси н-гексан/этилацетат от 9:1 до 7:3, 30 мин/мин, (80 мм×300 мм, диапазон 0,08), получая при этом (2R,5S,7S)-7-метоксиметил-2-фенил-3-окса-1-азабицикло(3.3.0)октан-8-он (1,06 г, 9%) в виде бесцветного масла.
1H-ЯМР (CDCl3) δ: 1,94 (м, 1H, H-6), 2,52 (м, 1H, H-6), 3,09 (м, 1H, H-7), 3,38 (с, 3H, OMe), 3,53 (т, J=8,1 Гц, 1H, H-4), 3,58 (дд, J=4,0, 9,5 Гц, 1H, CH2OMe), 3,67 (дд, J=5,4 Гц, 9,4 Гц, 1H, CH2OMe), 4,08 (м, 1H, H-5), 4,22 (AB тип д, J=6,4 Гц, 1H, H-4), 6,30 (с, 1H, H-2), 7,32 (м, 3H, Ph), 7,43 (д, J=6,6 Гц, 2H, Ph).
МС (ESI) m/z 248 (M+1)+.
(Стадия 2) Синтез 1-N-бензилоксикарбонил-(4S)-метоксиметил)-(2S)-пирролидинилметанола
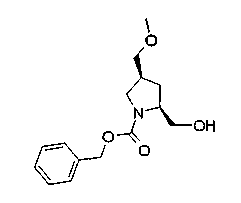
Литийалюминийгидрид (0,56 мл, 12,8 ммоль) суспендируют в ТГФ (7 мл). К образовавшейся суспензии добавляют раствор (2R,5S,7S)-7-метоксиметил-2-фенил-3-окса-1-азабицикло(3.3.0)октан-8-она (2,11 г, 8,5 ммоль) в ТГФ (10 мл) при перемешивании при 60°С. Реакционную смесь нагревают при кипячении с обратным холодильником в течение 1 часа. Реакционную смесь охлаждают и к ней добавляют тиосульфат натрия (6,5 г, 26,2 ммоль) и воду (10 мл). Реакционную смесь фильтруют через целит при пониженном давлении. Из фильтрата растворитель отгоняют при пониженном давлении. К остатку добавляют этанол (10 мл), уксусную кислоту (20 мл) и палладий на угле и образовавшуюся смесь подвергают каталитическому гидрированию при нормальном давлении в течение 3 дней. Реакционную смесь фильтруют для удаления катализатора и затем растворитель удаляют из фильтрата при пониженном давлении. К остатку добавляют смесь ТГФ/вода (4:1, 20 мл) и карбонат калия (2,35 г, 17 ммоль). При перемешивании смеси при 0°С добавляют бензилоксикарбонилхлорид (от 30 до 35% раствор в толуоле, 9,7 мл, 17 ммоль). Реакционную смесь перемешивают далее при комнатной температуре в течение 24 часов. Реакционную смесь выливают в этилацетат и насыщенный водный раствор хлорида аммония с последующей экстракцией этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом магния и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем (Yamazen, среднее давление, линейный градиент смеси н-гексан/этилацетат от 4:1 до 1:9, 30 мин/мин, (50 мм×150 мм, диапазон 0,32), получая при этом 1-N-бензилоксикарбонил-(4S)-метоксиметил-(2S)-пирролидинилметанол (1,61 г, 69%) в виде бесцветного масла.
1H-ЯМР (CDCl3) δ: 3,01 (м, 1H, 3-H), 2,18 (м, 1H, 3-H), 2,40 (м, 1H, 4-H), 3,08 (т, J=10,5 Гц, 1H, 5-H), 3,30 (м, 1H, CH2OMe), 3,31 (с, 3H, OMe), 3,38 (дд, J=4,5, 9,1 Гц, 1H, CH2OMe), 3,62 (дд, J=7,2,11,7 Гц, 1H, CH2OH), 3,70 (м, 1H, CH2OH), 3,81 (т, J=9,0 ГЦ, 1H, 5-H), 4,00 (м, 1H, 2-H), 4,88 (ушир., 1H, OH), 5,12 (AB тип д, J=13,0 Гц, 2H), 7,35 (м, 5H, Ph).
МС (ESI) m/z 280 (M+1)+.
(Стадия 3) Синтез метил-4-(1-N-бензилоксикарбонил-(4S)-метоксиметил-(2S)-пирролидинилметокси)бензоата
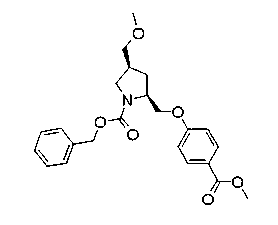
В метиленхлориде (20 мл) растворяют 1-N-бензилоксикарбонил-(4S)-метоксиметил)-(2S)-пирролидинилметанол (1,6 г, 5,7 ммоль) и триэтиламин (4,8 мл, 34 ммоль). К образовавшемуся раствору добавляют раствор метансульфонилхлорида (1,6 мл, 21 ммоль) в метиленхлориде (8 мл) при перемешивании при 0°С.Реакционную смесь перемешивают в течение 1 часа при такой же температуре. Реакционную смесь разбавляют этилацетатом и раствор выливают в 1 М HCl. Смешанный раствор экстрагируют этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом магния и перегоняют при пониженном давлении для удаления растворителя. Остаток растворяют в ДМФ (28 мл) и к образовавшемуся раствору добавляют карбонат калия (1,2 г, 8,6 ммоль) и метил-4-гидроксибензоат (2,6 г, 17 ммоль). Образовавшуюся смесь перемешивают при 100°С в течение 2 часов. После охлаждения к реакционной смеси добавляют эфир и воду с последующей экстракцией эфиром. Экстракт промывают 1 М NaOH (3 раза), сушат над безводным сульфатом магния и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем (Yamazen, среднее давление, линейный градиент смеси н-гексан/этилацетат от 9:1 до 7:3, (50 мм×300 мм), получая при этом метил-4-(1-N-бензилоксикарбонил-(4S)-метоксиметил-(2S)- пирролидинилметокси)бензоат (1,46 г, 62%) в виде бесцветного масла.
1H-ЯМР (CDCl3) δ: 1,78 (м, 1H), 2,32 (м, 1H), 2,48 (м, 1H), 3,10 (т, J=10,2 Гц, 1H), 3,30 (с, 3H), 3,42 (м, 3H), 3,85 (с, 3H), 4,20 (м, 3H), 5,10 (м, 2H), 6,90 (м, 2H), 7,32 (м, 5H), 7,90 (м, 2H).
МС (ESI) m/z 414 (M+1)+.
(Стадия 4) Синтез метил-транс-4-(1-N-трет-бутоксикарбонил-(4S)-метоксиметил-(2S)-пирролидинилметокси)циклогексанкарбоксилата
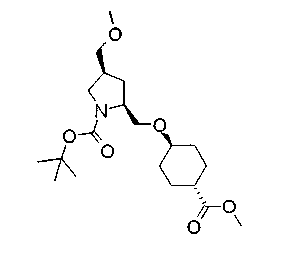
В смешанном растворителе метанол/уксусная кислота (100 мл, 10:1) метил-4-(1-N-бензилоксикарбонил-(4S)-метоксиметил-(2S)-пирролидинилметокси)бензоат (1,45 г, 3,51 ммоль) и 10% палладий на угле (300 мл) подвергают каталитическому гидрированию в течение 3 часов при комнатной температуре и при нормальном давлении. Катализатор отфильтровывают от реакционной смеси. К фильтрату добавляют уксусную кислоту (10 мл) и катализатор родий/оксид алюминия (435 мг) и смесь подвергают каталитическому гидрированию в течение 24 часов при давлении газообразного водорода 4 атм. Катализатор отфильтровывают от реакционной смеси и фильтрат перегоняют при пониженном давлении для удаления растворителя. Остаток растворяют в метиленхлориде (18 мл) и к образовавшемуся раствору добавляют триэтиламин (1,47 мл, 10,5 ммоль) и ди-трет-бутилдикарбонат (1,15 г, 5,3 ммоль). Перемешивание проводят в течение 6 часов при комнатной температуре. Реакционную смесь выливают в 15% водный раствор лимонной кислоты с последующей экстракцией хлороформом. Экстракт промывают насыщенным раствором соли и сушат над безводным сульфатом магния. После удаления растворителя отгонкой при пониженном давлении остаток растворяют в метаноле и к раствору добавляют метоксид натрия (285 мг, 5,27 ммоль). Образовавшуюся смесь нагревают при кипячении с обратным холодильником в течение 18 часов. После охлаждения реакционную смесь выливают в насыщенный водный раствор лимонной кислоты с последующей экстракцией хлороформом. Экстракт сушат над безводным сульфатом натрия. После удаления растворителя отгонкой при пониженном давлении остаток растворяют в смеси метанол/бензол (1:4, 18 мл). При перемешивании при 0°С к раствору добавляют триметилсилилдиазометан (2,64 мл, 2,0 М раствор в н-гексане, 5,27 ммоль). Реакционную смесь перемешивают далее в течение 3 часов при комнатной температуре с последующей перегонкой при пониженном давлении для удаления растворителя. Остаток очищают колоночной хроматографией при среднем давлении с использованием силикагеля (Biotage, KP-SIL, 32-63 мкм, 75М, н-гексан/этилацетат, 4:1, об./об.), получая при этом метил-транс-4-(1-N-трет-бутоксикарбонил-(4S)-метоксиметил-(2S)-пирролидинилметокси)циклогексанкарбоксилат (473 мг, 35%) в виде бесцветного масла.
1H-ЯМР (CDCl3) δ: 1,25 (м, 3H), 1,48 (с, 9H), 2,00 (м, 4H), 2,20 (м, 2H), 2,38 (м, 1H), 2,92 (т, J=9,5 Гц, 1H), 3,20 (м, 1H), 3,33 (с, 3H), 3,40-3,90 (м, 8H), 3,62 (с, 3H).
МС (ESI) m/z 386 (M+1)+.
(Стадия 5) Синтез транс-4-(1-(5-хлор-2-фтор-4-((1-метил-1Н-3-индолилкарбонил)амино)фенилацетил)-(4S)-метоксиметил-(2S)-пирролидинилметокси)циклогексанкарбоновой кислоты
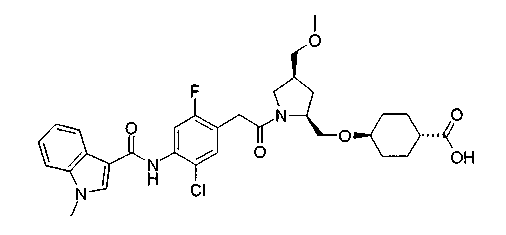
В метиленхлориде (15 мл) растворяют метил-транс-4-(1-N-трет-бутоксикарбонил-(4S)-метоксиметил-(2S)-пирролидинилметокси)циклогексанкарбоксилат (157 мг, 0,406 ммоль). К образовавшемуся раствору добавляют трифторуксусную кислоту (15 мл). Образовавшуюся смесь перемешивают при комнатной температуре в течение 2 часов. Реакционную смесь перегоняют при пониженном давлении для удаления растворителя и остаток растворяют в смеси хлороформ/насыщенный водный раствор бикарбоната натрия с последующей экстракцией хлороформом. Экстракт сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток растворяют в ДМФ (2 мл). К образовавшемуся раствору добавляют (5-хлор-2-фтор-4-((1-метил-1Н-3-индолилкарбонил)амино)фенил)уксусную кислоту (146 мг, 0,406 ммоль), HOBt (104 мг, 0,77 ммоль), DMAP (каталитическое количество) и соль EDC·HCl (117 мг, 0,61 ммоль). Образовавшуюся смесь перемешивают при комнатной температуре в течение 18 часов. Реакционную смесь выливают в 1 М HCl с последующей экстракцией этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом магния и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией со средним давлением на колонке с силикагелем (Yamazen, среднее давление, хлороформ/метанол, от 10:0 до 20:1, 20 мин/мин, (50 мм×150 мм). Очищенный продукт растворяют в ТГФ (4 мл) и к раствору добавляют 0,25 М NaOH (2,4 мл, 0,61 ммоль). Образовавшуюся смесь перемешивают в течение 18 часов при комнатной температуре. Реакционную смесь подкисляют 1 М HCl. Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при пониженном давлении, получая при этом указанное в заголовке соединение (140 мг, 56%) в виде бесцветного твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 1,20-2,80 (м, 15H), 3,10-4,30 (м, 1Н), 3,30 (с, 3H), 3,90 (с, 3H), 7,21 (т, J=7,5 Гц, 1H), 7,27 (т, J=7,5 Гц, 1H), 7,41 (д, J=7,3 Гц, 1H), 7,55 (д, J=8,1 Гц, 1H), 7,70 (д, J=11,2 Гц, 1Н), 8,14 (д, J=7,5 Гц, 1H), 8,31 (с, 1Н), 9,30 (с, 1Н).
МС (ESI) m/z 615 (M+1)+;
Анал. Вычисл. для С30Н32ClF2N3O5·0,75H2О: C, 59,90; H, 5,61; N, 7,31.
Найдено: C, 59,97; H, 5,55; N, 7,31.
Пример 139
транс-4-(1-(5-Хлор-2-фтор-4-((1-метил-1Н-индазол-3-индазолилкарбонил)амино)фенилацетил)-(4S)-метоксиметил-(2S)-пирролидинилметокси)циклогексанкарбоновая кислота:
(Стадия 1) Синтез транс-4-(1-(5-хлор-2-фтор-4-((1-метил-1Н-3-индазолилкарбонил)амино)фенилацетил)-(4S)-метоксиметил-(2S)-пирролидинилметокси)циклогексанкарбоновой кислоты
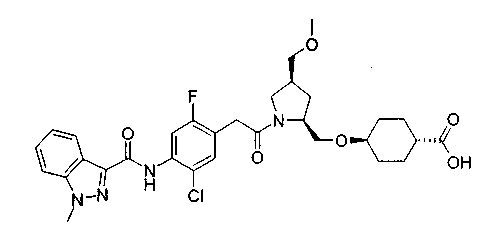
К раствору метил-транс-4-(1-N-трет-бутоксикарбонил-(4S)-метоксиметил-(2S)-пирролидинилметокси)циклогексанкарбоксилата (157 мг, 0,406 ммоль) в метиленхлориде (15 мл) добавляют трифторуксусную кислоту (15 мл). Образовавшуюся смесь перегоняют при комнатной температуре в течение 2 часов. Реакционную смесь перегоняют при пониженном давлении для удаления растворителя. К остатку добавляют смесь хлороформ/насыщенный водный раствор бикарбоната натрия с последующей экстракцией хлороформом. Экстракт сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток растворяют в ДМФ (2 мл) и к раствору добавляют (5-хлор-2-фтор-4-((1-метил-1Н-индазолилкарбонил)амино)фенил)уксусную кислоту (147 мг, 0,406 ммоль), HOBt (104 мг, 0,77 ммоль), DMAP (каталитическое количество) и соль EDC·HCl (117 мг, 0,61 ммоль). Образовавшуюся смесь перемешивают при комнатной температуре в течение 18 часов. Реакционную смесь выливают в 1 М HCl с последующей экстракцией этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом магния и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем (Yamazen, среднее давление, смесь хлороформ/метанол от 10:1 до 20:1, 20 мин/мин, (50 мм×150 мм). Очищенный продукт растворяют в ТГФ (4 мл) и к раствору добавляют 0,25 М NaOH (2,4 мл, 0,61 ммоль). Образовавшуюся смесь перемешивают в течение 18 часов при комнатной температуре. Реакционную смесь подкисляют 1 М HCl. Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при пониженном давлении, посредством чего получают белое твердое вещество (154 мг, 62%).
1H-ЯМР (ДМСО-d6) δ: 1,20-2,80 (м, 15H), 3,10-4,30 (м, 7H), 3,30 (с, 3H), 3,90 (с, 3H), 7,37 (т, J=7,5 Гц, 1H), 7,46 (д, J=7,1 Гц, 1H), 7,53 (т, J=8,0 Гц, 1H), 7,82 (д, J=8,3 Гц, 1H), 8,06 (д, J=11,5 Гц, 1H), 8,20 (д, J=7,6 Гц, 1H), 9,71 (с, 1H).
МС (ESI) m/z 616 (M+1)+;
Анал. Вычисл. для С31Н36ClFN4O6·0,25H2О: C, 62,13; H, 6,11; N, 6,79.
Найдено: C, 62,04; H, 6,15; N, 6,75.
Пример 140
транс-4-(1-(7-Фтор-2-(5-фтор-2-метилфениламино)-6-бензоксазолилацетил)-(4S)-метоксиметил-(2S)-пирролидинилметокси)циклогексанкарбоновая кислота:
(Стадия 1) Синтез транс-4-(1-(7-фтор-2-(5-фтор-2-метилфениламино)-6-бензоксазолилацетил-(4S)-метоксиметил-(2S)-пирролидинилметокси)циклогексанкарбоновой кислоты

К раствору метил-транс-4-(1-N-трет-бутоксикарбонил-(4S)-метоксиметил-(2S)-пирролидинилметокси)циклогексанкарбоксилата (157 мг, 0,406 ммоль) в метиленхлориде (15 мл) добавляют трифторуксусную кислоту (15 мл). Образовавшуюся смесь перемешивают при комнатной температуре в течение 2 часов. Реакционную смесь перегоняют при пониженном давлении для удаления растворителя. Остаток растворяют в смеси хлороформ/насыщенный водный раствор бикарбоната натрия с последующей экстракцией хлороформом. Экстракт сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток растворяют в ДМФ (2 мл). К образовавшемуся раствору добавляют 7-фтор-2-(5-фтор-2-метилфениламино)-6-бензоксазолуксусную кислоту (147 мг, 0,406 ммоль), HOBt (104 мг, 0,77 ммоль), DMAP (каталитическое количество) и соль EDC·HCl (129 мг, 0,61 ммоль). Смесь перемешивают при комнатной температуре в течение 18 часов. Реакционную смесь выливают в 1 М HCl с последующей экстракцией этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом магния и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем (Yamazen, среднее давление, смесь хлороформ/метанол от 10:0 до 20:1, 20 мин/мин, (50 мм×150 мм). Очищенный продукт растворяют в ТГФ (4 мл) и к раствору добавляют 0,25 М NaOH (2,4 мл, 0,61 ммоль). Образовавшуюся смесь перемешивают в течение 18 часов при комнатной температуре. Реакционную смесь подкисляют 1 М HCl. Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при пониженном давлении, получая при этом указанное в заголовке соединение (110 мг, 47%) в виде бесцветного твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 1,20-1,60 (м, 6H), 1,80-3,80 (м, 9H), 2,31 (с, 3H), 3,10-4,30 (м, 7H), 3,25 (с, 3H), 6,88 (дт, J=2,4,8,5 Гц, 1H), 7,05 (т, J=7,5 Гц, 1H), 7,20 (д, J=8,1 Гц, 1H), 7,25 (т, J=7,5 Гц, 1H), 7,92 (д, J=10,8 Гц, 1H). МС (ESI) m/z 572 (M+1)+;
Анал. Вычисл. для С30Н35ClF2N3O6·0,25H2О: C, 62,54; H, 6,21; N, 7,29.
Найдено: C, 62,46; H, 6,23; N, 7,29.
Пример 141
транс-4-((1-(5-Хлор-2-фтор-4-((1-метил-3-индолил)карбониламино)фенил)ацетил-(5S)-метоксиметил-(2S)-пирролидинилметокси)циклогексанкарбоновая кислота:
(Стадия 1) Синтез (2S)-бензилоксиметил-N-трет-бутоксикарбонил-(5S)-гидроксиметилпирролидин

В смеси метанол/ТГФ/вода (5/3/2, 100 мл) растворяют (2S)-бензоилоксиметил-(5S)-бензилоксиметил-N-трет-бутоксикарбонилпирролидин (3,34 г, 7,85 ммоль). К образовавшемуся раствору добавляют 1 н. NaOH (25,0 мл, 25,0 ммоль) и образовавшуюся смесь перемешивают при комнатной температуре в течение 7 часов. Реакционную смесь концентрируют при пониженном давлении. Остаток экстрагируют смесью хлороформ/метанол (10/1). Экстракт сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси гексан/этилацетат (от 3/1 до EtOAc) (2S)-бензилоксиметил-N-трет-бутоксикарбонил-(5S)-гидроксиметилпирролидин (1,46 г, 58%) получают в виде бесцветного масла.
1H-ЯМР (CDCl3) δ: 1,41 (с, 9H), 1,57 (ушир.с, 1H), 1,95-1,97 (м, 2H), 2,05-2,18 (м, 1H), 3,36 (т, J=8,4 Гц, 1H), 3,56-3,62 (м, 2H), 3,67-3,72 (м, 2H), 3,95 (ушир.с, 1H), 4,03 (ушир.с, 1H), 4,51 (с, 1H), 7,28-7,37 (м, 5H).
МС (FAB) m/z 322 (M++1).
(Стадия 2) Синтез (2S)-бензилоксиметил-N-трет-бутоксикарбонил-(5S)-метоксиметилпирролидина
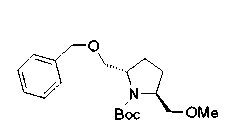
В ДМФ (50 мл) растворяют (2S)-бензилоксиметил-N-трет-бутоксикарбонил-(5S)-гидроксиметилпирролидин (1,46 г, 4,55 ммоль). При перемешивании при 0°С к образовавшемуся раствору порциями добавляют гидрид натрия (60% в масле, 218 мг, 5,46 ммоль). После перемешивания при такой же температуре в течение 10 минут добавляют метилиодид (1,42 мл, 22,8 ммоль) и образовавшуюся смесь перемешивают далее при комнатной температуре в течение 18 часов. Реакционную смесь выливают в 1 н. HCl с последующей экстракцией эфиром. Экстракт промывают водой, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси гексан/этилацетат (5/1) (2S)-бензилоксиметил-N-трет-бутоксикарбонил-(5S)-метоксиметилпирролидин (1,13 г, 74%) получают в виде бесцветного масла.
1H-ЯМР (CDCl3), смесь ротамеров, δ: 1,40 и 1,47 (с, общий 9H), 1,86-2,02 (м, 4H), 3,20-3,68 (ряд м, 4H), 3,34 (с, 3H), 3,86-4,00 (м, 2H), 4,46-4,58 (м, 2H), 7,27-7,34 (м, 5H).
(Стадия 3) Синтез N-трет-бутоксикарбонил-(5S)-гидроксиметил-(2S)-метоксиметилпирролидина

В метаноле (30 мл) (2S)-бензилоксиметил-N-трет-бутоксикарбонил-(5S)-метоксиметилпирролидин (1,12 г, 3,34 ммоль) и 10% палладий на угле (163 мг) подвергают каталитическому гидрированию при комнатной температуре и при нормальном давлении в течение 18 часов. Катализатор отфильтровывают от реакционной смеси и фильтрат перегоняют при пониженном давлении для удаления растворителя, в результате чего N-трет-бутоксикарбонил-(5S)-гидроксиметил-(2S)-метоксиметилпирролидин (866 мг, 100%) получают в виде бесцветного масла.
1H-ЯМР (CDCl3) δ: 1,49 (с, 9H), 1,57-1,70 (м, 1H), 1,87-1,98 (м, 2H), 2,014-2,14 (м, 1H), 3,17-4,02 (ряд м, 6H), 3,35 (с, 3H).
(Стадия 4) Синтез метил-4-(N-трет-бутоксикарбонил-(5S)-метоксиметил-(2S)-пирролидинилметокси)бензоата
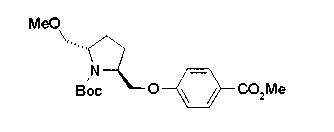
В ТГФ (30 мл) растворяют N-трет-бутоксикарбонил-(5S)-гидроксиметил-(2S)-метоксиметилпирролидин (865 мг, 3,53 ммоль), трифенилфосфин (1,11 г, 4,23 ммоль) и метил-4-гидроксибензоат (536 мг, 3,53 ммоль). К образовавшемуся раствору добавляют DIAD (803 мкл, 3,88 ммоль) и образовавшуюся смесь перемешивают при 60°С в течение 2 часов. После охлаждения до комнатной температуры реакционную смесь перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси гексан/этилацетат (3/1) метил-4-(N-трет-бутоксикарбонил-(5S)-метоксиметил-(2S)-пирролидинилметокси)бензоат (1,13 г, 84%) получают в виде бесцветного масла.
1H-ЯМР (CDCl3), смесь ротамеров, δ: 1,48 (с, 9H), 1,94-2,14 (м, 4H), 3,26-4,27 (ряд м, 6H), 3,36 (с, 3H), 3,88 и 3,89 (с, общий 3H), 6,93 и 6,96 (д, J=8,8 Гц, общий 2H), 7,96 и 7,99 (д, J=4,0 Гц, общий 2H).
(Стадия 5) Синтез метил-транс-4-(N-трет-бутоксикарбонил)-(5S)-метоксиметил-(2S)-пирролидинилметокси) циклогексанкарбоксилата

В смеси этанол/уксусная кислота (10/1, 55 мл) метил-4-(N-трет-бутоксикарбонил-(5S)-метоксиметил-(2S)-пирролидинилметокси)бензоат (1,02 г, 2,69 мл) и 5% родий на оксиде алюминия (500 мг) подвергают каталитическому гидрированию при комнатной температуре в течение 2,5 часа при давлении газообразного водорода 8 атм. Из реакционной смеси катализатор отфильтровывают и фильтрат перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси гексан/этилацетат (3/1)) метил-4-(N-трет-бутоксикарбонил-(5S)-метоксиметил-(2S)-пирролидинилметокси)циклогексанкарбоксилат (771 мг, 74%) получают в виде бесцветного масла. Масло растворяют в метаноле (770 мг, 1,20 ммоль). К образовавшемуся раствору добавляют метоксид натрия (324 мг, 5,99 ммоль) с последующим нагреванием при кипячении с обратным холодильником в течение 18 часов. После охлаждения реакционную смесь нейтрализуют 1 н. HCl с последующей экстракцией смесью хлороформ/метанол (10/1). Экстракт сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя, получая при этом масло. Масло растворяют в смеси бензол/метанол (10/1, 22 мл) с последующим добавлением по каплям триметилсилилдиазометана (2,0 М раствор в гексане, 0,50 мл, 0,25 ммоль). После перемешивания реакционной смеси при комнатной температуре в течение 1 часа растворитель отгоняют при пониженном давлении. Остаток очищают флэш-хроматографией на колонке с использованием силикагеля, посредством чего из элюатных фракций смеси гексан/этилацетат (5/1) метил-транс-4-(N-трет-бутоксикарбонил)-(5S)-метоксиметил-(2S)-пирролидинилметокси)циклогексанкарбоксилат) 178 мг, 23%) получают в виде бесцветного масла.
МС (ESI) m/z 386 (M++1).
(Стадия 6) Синтез метил-транс-4-((5S)-метоксиметил-(2S)-пирролидинилметокси)циклогексанкарбоксилата
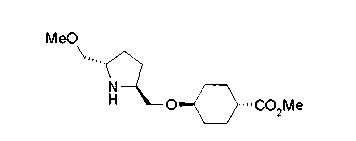
Метил-транс-4-(N-трет-бутоксикарбонил)-(5S)-метоксиметил-(2S)-пирролидинилметокси)циклогексанкарбоксилат (175 мг, 0,45 ммоль) растворяют в метиленхлориде (20 мл). К образовавшемуся раствору добавляют трифторуксусную кислоту (7 мл). Образовавшуюся смесь перемешивают при комнатной температуре в течение 30 минут. Реакционную смесь перегоняют при пониженном давлении для удаления растворителя. Остаток нейтрализуют насыщенным водным раствором бикарбоната натрия с последующей экстракцией смесью хлороформ/метанол (10/1). Экстракт сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя, посредством чего метил-транс-4-((5S)-метоксиметил-(2S)-пирролидинилметокси)циклогексанкарбоксилат (130 мг, 100%) получают в виде светло-желтого масла.
МС (ESI) m/z 286 (M++1).
(Стадия 7) Синтез метил-транс-4-(1-((5-хлор-2-фтор-4-((1-метил-3-индолил)карбониламино)фенил)ацетил-(5S)-метоксиметил-(2S)-пирролидинилметокси)циклогексанкарбоксилата

В ДМФ (10 мл) HOBt (18,2 мг, 0,14 ммоль) добавляют к (5-хлор-2-фтор-4-((1-метил-3-индолилкарбонил)амино)фенилуксусной кислоте (162 мг, 0,45 ммоль), метил-транс-4-(5S)-метоксиметил-(2S)-пирролидинилметокси)циклогексанкарбоксилату (128 мг, 0,45 ммоль) и EDC·HCl (103 мг, 0,54 ммоль) и образовавшуюся смесь перемешивают при комнатной температуре в течение 18 часов. Реакционную смесь выливают в воду с последующей экстракцией этилацетатом. Экстракт промывают водой, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси гексан-этилацетат (1/5) метил-транс-4-((1-(5-хлор-2-фтор-4-((1-метил-3-индолил)карбониламино)фенил)ацетил-(5S)-метоксиметил-(2S)-пирролидинилметокси)циклогексанкарбоксилат (244 мг, 87%) получают в виде бесцветного аморфного вещества.
1H-ЯМР (CDCl3), смесь ротамеров, δ: 1,09-2,25 (ряд м, 12H), 3,05-4,20 (ряд м, 10H), 3,27 и 3,31 (с, общий 3H), 3,55 и 3,61 (с, общий 3H), 3,84 (с, 3H), 7,28-7,32 (м, 2H), 7,36-7,41 (м, 2H), 7,76 (д, J=2,4 Гц, 1H), 8,01-8,10 (м, 1H), 8,24 (с, 1H), 8,43 и 8,46 (с, общий 1H). МС (ESI) m/z 628 (M++1).
(Стадия 8) Синтез транс-4-(1-((5-хлор-2-фтор-4-((1-метил-3-индолил)карбониламино)фенил)ацетил-(5S)-метоксиметил-(2S)-пирролидинилметокси)циклогексанкарбоновой кислоты
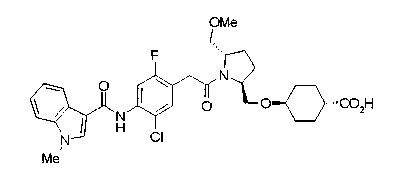
В смеси ТГФ/метанол (1/1, 20 мл) растворяют метил-транс-4-(1-((5-хлор-2-фтор-4-((1-метил-3-индолил)карбониламино)фенил)ацетил-(5S)-метоксиметил-(2S)-пирролидинилметокси)циклогексанкарбоксилат (241 мг, 0,39 ммоль). К образовавшемуся раствору добавляют 0,25 н. NaOH (7,67 мл, 1,92 ммоль). Образовавшуюся смесь перемешивают при комнатной температуре в течение 18 часов. Реакционную смесь выливают в 1 н. HCl с последующей экстракцией смесью хлороформ/метанол (10/1). Экстракт сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси хлороформ/метанол (15/1) указанное в заголовке соединение (204 мг, 87%) получают в виде бесцветного аморфного вещества.
1H-ЯМР (CDCl3), смесь ротамеров, δ: 1,05-2,32 (ряд м, 12H), 3,10-4,25 (ряд м, 10H), 3,30 и 3,35 (с, общий 3H), 3,85 и 3,86 (с, общий 3H), 7,30-7,35 (м, 2H), 7,38-7,44 (м, 2H), 7,79 (д, J=1,2 Гц, 1H), 8,08-8,12 (м, 1H), 8,28 (с, 1H), 8,45 и 8,48 (д, J=6,0 Гц, общий 1H). МС (ESI) m/z 613 (M++1);
Анал. Вычисл. для С32Н37ClFN3O6: С, 62,59; H, 6,07; N, 6,84.
Найдено: С, 62,45; H, 6,30; N, 6,65.
Пример 142
транс-4-(1-((5-Хлор-2-фтор-4-(1-метил-3-индолилкарбониламино)фенил)ацетил)-(4S)-(N-метилацетамидо)-(2S)-пирролидинилметокси)-1-циклогексанкарбоновая кислота:
(Стадия 1) Синтез метил-транс-4-((4S)-азидо-1-(трет-бутоксикарбонил)-(2S)-пирролидинилметокси)-1-циклогексанкарбоксилата
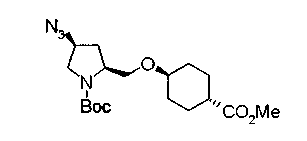
Метил-транс-4-(1-(трет-бутоксикарбонил)-(4S)-метансульфонилокси-(2S)-пирролидинилметокси)-1-циклогексанкарбоксилат (530 мг, 1,22 ммоль) растворяют в ДМФ (10 мл) и к образовавшемуся раствору добавляют LiN3 (119 мг, 2,43 ммоль). Смесь перемешивают при 80°С в течение 5 часов. После охлаждения реакционную смесь разбавляют этилацетатом (300 мл). Раствор в этилацетате промывают насыщенным раствором соли, сушат над безводным сульфатом магния и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси хлороформ-этилацетат (от 20:1 до 10:1) метил-транс-4-((4S)-азидо-1-(трет-бутоксикарбонил)-(2S)-пирролидинилметокси)-1-циклогексанкарбоксилат (423 мг, 91%) получают в виде светло-желтого масла.
1H-ЯМР (CDCl3) δ: 1,21-1,30 (м, 2H), 1,46 (м, 11 H, включая с, 9H, при δ: 1,46), 2,00-2,36 (ряд м, 7H), 3,20-4,13 (ряд м, 10H, включая с, 3H, при δ: 3,66).
(Стадия 2) Синтез метил-транс-4-((4S)-амино-1-(трет-бутоксикарбонил)-(2S)-пирролидинилметокси)-1-циклогексанкарбоксилата

В метаноле (20 мл) катализатор 5% палладий/уголь (400 мг) добавляют к метил-транс-4-((4S)-азидо-1-(трет-бутоксикарбонил)-(2S)-пирролидинилметокси)-1-циклогексанкарбоксилату (420 мг, 1,10 ммоль) и каталитическое гидрирование проводят в течение 15 часов при комнатной температуре при нормальном давлении. После удаления катализатора фильтрованием фильтрат перегоняют при пониженном давлении для удаления растворителя, посредством чего метил-транс-4-((4S)-амино-1-(трет-бутоксикарбонил)-(2S)-пирролидинилметокси)-1-циклогексанкарбоксилат (391 мг, 100%) получают в виде светло-желтого масла.
МС (ESI) m/z 357 (M++1);
(Стадия 3) Синтез метил-транс-4-(1-(трет-бутоксикарбонил)-(4S)-трифторацетамидо-(2S)-пирролидинилметокси)-1-циклогексанкарбоксилата
Метил-транс-4-((4S)-амино-1-(трет-бутоксикарбонил)-(2S)-пирролидинилметокси)-1-циклогексанкарбоксилат (390 мг, 1,09 ммоль) растворяют в метиленхлориде (10 мл). При перемешивании при 0°С к образовавшемуся раствору добавляют диизопропилэтиламин (381 мкл, 2,19 ммоль) и трифторуксусный ангидрид (227 мкл, 1,64 ммоль). После перемешивания в течение 2 часов при такой же температуре к реакционной смеси добавляют воду (50 мл) с последующей экстракцией этилацетатом (200 мл). Экстракт промывают насыщенным раствором соли (100 мл), сушат над безводным сульфатом магния и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси хлороформ-этилацетат (10:1) метил-транс-4-(1-(трет-бутоксикарбонил)-(4S)-трифторацетамидо-(2S)-пирролидинилметокси)-1-циклогексанкарбоксилат (375 мг, 76%) получают в виде желтого масла.
1H-ЯМР (CDCl3) δ: 1,22-2,50 (ряд м, 20H), 3,27-3,69 (ряд м, 7H, включая с, 3H, при d 3,67), 3,96-4,15 (м, 2H), 4,62 (м, 1H), 8,45 и 8,56 (м, каждый, общий 1H).
МС (ESI) m/z 453 (M++1).
(Стадия 4) Синтез метил-транс-4-(1-(трет-бутоксикарбонил)-(4S)-N-метилтрифторацетамидо-(2S)-пирролидинилметокси)-1-циклогексанкарбоксилата
В ДМФ (10 мл) растворяют метил-транс-4-(1-(трет-бутоксикарбонил)-(4S)-трифторацетамидо-(2S)-пирролидинилметокси)-1-циклогексанкарбоксилат (375 мг, 0,829 ммоль) и MeI (258 мкл, 4,15 ммоль). К образовавшемуся раствору добавляют по частям гидрид натрия (40 мг, 0,995 ммоль) при перемешивании при 0°С. После перемешивания в течение 1 часа при такой же температуре к реакционной смеси добавляют 1 н. HCl (50 мл) с последующей экстракцией этилацетатом (200 мл). Экстракт промывают насыщенным раствором соли (100 мл), сушат над безводным сульфатом магния и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси хлороформ-этилацетат (10:1) метил-транс-4-(1-(трет-бутоксикарбонил)-(4S)-N-метилтрифторацетамидо-(2S)-пирролидинилметокси)-1-циклогексанкарбоксилат (202 мг, 52%) получают в виде желтого масла.
МС (ESI) m/z 467 (M++1).
(Стадия 5) Синтез метил-транс-4-(1-(трет-бутоксикарбонил)-(4S)-N-метилацетамидо-(2S)-пирролидинилметокси)-1-циклогексанкарбоксилата
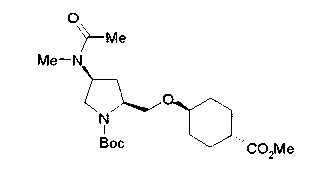
Метил-транс-4-(1-(трет-бутоксикарбонил)-(4S)-N-метилтрифторацетамидо-(2S)-пирролидинилметокси)-1-циклогексанкарбоксилат (200 мг, 0,429 ммоль) растворяют в смеси ТГФ-метанол (5:1, 6 мл). К образовавшемуся раствору добавляют 2 М водный раствор (4 мл) Na2CO3. После перемешивания в течение 3 часов реакционную смесь разбавляют этилацетатом (100 мл). Раствор в этилацетате промывают насыщенным раствором соли (100 мл), сушат над безводным сульфатом магния и перегоняют при пониженном давлении для удаления растворителя. Остаток растворяют в метиленхлориде (20 мл). К образовавшемуся раствору добавляют триэтиламин (119 мкл, 0,859 ммоль) и ацетиленхлорид (46 мкл, 0,644 ммоль) при перемешивании при 0°С. Реакционную смесь перемешивают при комнатной температуре и разбавляют этилацетатом (100 мл). Разбавленную смесь промывают насыщенным раствором соли (100 мл), сушат над безводным сульфатом магния и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси хлороформ-метанол (20:1) метил-транс-4-(1-(трет-бутоксикарбонил)-(4S)-N-метилацетамидо-(2S)-пирролидинилметокси)-1-циклогексанкарбоксилат (90 мг, 51%) получают в виде бесцветного масла.
1H-ЯМР (CDCl3) δ: 1,25 (м, 2H), 1,45 (м, 11H), 1,98-2,29 (ряд м, 10H), 2,86 и 2,92 (с, каждый, общий 3H), 3,02-3,30 (м, 2H), 3,62-3,92 (ряд м, 7H, включая с, 3H, при δ: 3,66), 4,29 и 5,14 (м, каждый, общий 1H).
(Стадия 6) Синтез гидрохлорида метил-транс-4-(4S)-N-метилацетамидо-(2S)-пирролидинилметокси)-1-циклогексанкарбоксилата
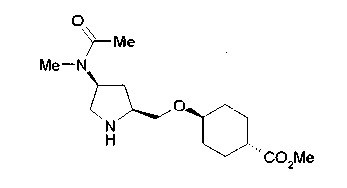
Метил-транс-4-(1-(трет-бутоксикарбонил)-(4S)-N-метилацетамидо-(2S)-пирролидинилметокси)-1-циклогексанкарбоксилат (90 мг, 0,218 ммоль) растворяют в диоксане (5 мл). К образовавшемуся раствору добавляют раствор 4 н. HCl/диоксан (10 мл). Образовавшуюся смесь перемешивают при комнатной температуре в течение 5 часов. Реакционную смесь перегоняют при пониженном давлении для удаления растворителя, посредством чего гидрохлорид метил-транс-4-((4S)-N-метилацетамидо-(2S)-пирролидинилметокси)-1-циклогексанкарбоксилата (80 мг) получают в виде светло-желтого масла.
МС (ESI) m/z 313 (M++1).
(Стадия 7) Синтез метил-транс-4-(1-((5-хлор-2-фтор-4-(1-метил-3-индолилкарбониламино)фенил)ацетил)-(4S)-(N-метилацетамидо)-(2S)-пирролидинилметокси)-1-циклогексанкарбоксилата
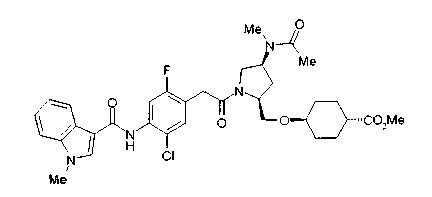
Гидрохлорид метил-транс-4-((4S)-N-метилацетамидо-(2S)-пирролидинилметокси)-1-циклогексанкарбоксилата (80 мг, сырой) растворяют в ДМФ (10 мл). К образовавшемуся раствору добавляют 5-хлор-2-фтор-4-(1-метил-3-индолилкарбониламино)фенил)уксусную кислоту (79 мг, 0,218 мг), триэтиламин (303 мкл, 2,18 ммоль), EDC·HCl (63 мг, 0,327 ммоль) и HOBt (44 мг, 0,327 ммоль). Образовавшуюся смесь перемешивают при комнатной температуре в течение 15 часов. К реакционной смеси добавляют этилацетат (100 мл) и воду (100 мл) для отделения слоя этилацетата. Слой этилацетата промывают насыщенным раствором соли (100 мл), сушат над безводным сульфатом магния и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси хлороформ-метанол (10:1) метил-транс-4-(1-((5-хлор-2-фтор-4-(1-метил-3-индолилкарбониламино)фенил)ацетил)-(4S)-(N-метилацетамидо)-(2S)-пирролидинилметокси)-1-циклогексанкарбоксилат (120 мг, 84%) получают в виде желтой густой вязкой жидкости.
1H-ЯМР (CDCl3) δ: 1,07-2,23 (ряд м, 14H), 2,87 и 2,94 (с, каждый, общий 3H), 3,18 (м, 2H), 3,40-3,95 (ряд м, 11H), 4,25 (м, 1H), 4,36 и 5,22 (м, каждый, общий 1Н), 7,33-7,42 (м, 4H), 7,82 (с, 1Н), 8,13-8,15 (м, 1H), 8,29 (с, 1H), 8,49-8,54 (м, 1H). МС (ESI) m/z 655 (M++1).
(Стадия 8) Синтез транс-4-(1-((5-хлор-2-фтор-4-(1-метил-3-индолилкарбониламино)фенил)ацетил)-(4S)-(N-метилацетамидо)-(2S)-пирролидинилметокси)-1-циклогексанкарбоновой кислоты
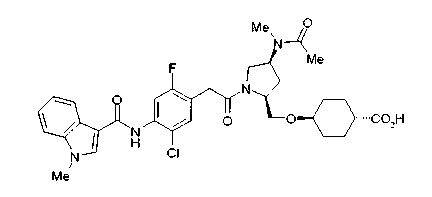
Метил-транс-4-(1-((5-хлор-2-фтор-4-(1-метил-3-индолилкарбониламино)фенил)ацетил)-(4S)-(N-метилацетамидо)-(2S)-пирролидинилметокси)-1-циклогексанкарбоксилат (115 мг, 0,176 ммоль) растворяют в ТГФ (5 мл). К образовавшемуся раствору добавляют 0,25 н. NaOH (4 мл, 1 ммоль). После перемешивания при комнатной температуре в течение 15 часов реакционную смесь выливают в 1 н. HCl (100 мл) с последующей экстракцией смесью хлороформ-метанол (5:1, 2×100 мл). Экстракт сушат над безводным сульфатом магния и перегоняют при пониженном давлении для удаления растворителя. Остаток растворяют в хлороформе. К образовавшемуся раствору добавляют гексан до тех пор, пока не произойдет осаждение кристаллов. Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении и сушат, получая при этом указанное в заголовке соединение (87 мг, 77%) в виде светло-желтого аморфного вещества.
1H-ЯМР (ДМСО-d6) δ: 1,14-1,38 (м, 4H), 1,87-2,16 (м, 10H).
2,75 и 2,91 (с, каждый, общий 3H), 3,17-5,05 (ряд м, 12H), 7,20-7,30 (м, 2H), 7,40-7,44 (м, 1H), 7,56 (д, J=8,1 Гц, 1H), 7,70 (м, 1H), 8,15 (д, J=7,8 Гц, 1H), 8,31 (с, 1H), 9,31 (с, 1H).
МС (ESI) m/z 642 (M++1);
Анал. Вычисл. для С33Н38ClFN3O6: С, 61,82; H, 5,97; N, 8,74.
Найдено: С, 59,72; H, 6,26; N, 7,68.
Пример 143
транс-4-(1-(5-Хлор-2-фтор-4-(1-метил-3-индолилкарбониламино)фенилацетил)-4,4-дифтор-(2S)-пирролидинилметокси)циклогексанкарбоновая кислота и цис-4-(1-(5-хлор-2-фтор-4-(1-метил-3-индолилкарбониламино)фенилацетил)-4,4-дифтор-(2S)-пирролидинилметокси)циклогексанкарбоновая кислота:
(Стадия 1) Синтез метил-4-(1-(5-хлор-2-фтор-4-(1-метил-3-индолилкарбониламино)фенилацетил)-4,4-дифтор-(2S)-пирролидинилметокси)циклогексанкарбоксилата

В ДМФ (5 мл) растворяют (5-хлор-2-фтор-4-((1-метил-3-индолилкарбониламино)фенил)уксусную кислоту (208 мг, 0,58 ммоль) и метил-4-(4,4-дифтор-(2S)-пирролидинилметокси)циклогексанкарбоксилат (160 мг, 0,58 ммоль). К образовавшемуся раствору добавляют EDC·HCl (167 мг, 0,87 ммоль), HOBt (2,5 мг, 0,02 ммоль) и DMAP (2,5 мг, 0,02 ммоль) и образовавшуюся смесь перемешивают при комнатной температуре в течение 14 часов. Реакционную смесь разбавляют этилацетатом. Разбавленную смесь промывают насыщенным раствором соли, сушат над безводным сульфатом магния и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси хлороформ-метанол (30:1, об./об.) метил-4-(1-(5-хлор-2-фтор-4-(1-метил-3-индолилкарбониламино)фенилацетил)-4,4-дифтор-(2S)-пирролидинилметокси)циклогексанкарбоксилат (смесь двух диастереомеров (335 мг, 93%) получают в виде светло-коричневого кристаллического порошка.
ИК (ATR) ν 1726, 1658, 1518 см-1;
1H-ЯМР (CDCl3) δ: 1,26 (м, 1H), 1,46 (м, 2H), 1,63-1,85 (ряд м, общий 5H), 1,99 (м, 2H), 2 35 (м, 1H), 2,55 (м, 2H), 3,51 (м, 1H), 3,58 (дд, J=10,8, 6,8 Гц, 1H), 3,66 и 3,67 (с, общий 3H), 3,71 (м, 1H), 3,83 (м, 1H), 3,88 (с, 3H), 4,49 (м, 1H), 7,33-7,42 (ряд м, общий 4H), 7,80-7,81 (ряд с, общий 1H), 8,00 (с, 1H), 8,12 (м, 1H), 8,30 (с, 1H), 8,49-8,55 (ряд д, J=12,0 Гц, общий 1H).
МС (LC-МС) m/z 621 (M++1).
(Стадия 2) Синтез транс-4-(1-(5-хлор-2-фтор-4-(1-метил-3-индолилкарбониламино)фенилацетил)-4,4-дифтор-(2S)-пирролидинилметокси)циклогексанкарбоновой кислоты и цис-4-(1-(5-хлор-2-фтор-4-(1-метил-3-индолилкарбониламино)фенилацетил)-4,4-дифтор-(2S)-пирролидинилметокси)циклогексанкарбоновой кислоты

К метил-4-(1-(5-хлор-2-фтор-4-(1-метил-3-индолилкарбониламино)фенилацетил)-4,4-дифтор-(2S)-пирролидинилметокси)циклогексанкарбоксилату (620 мг, 0,53 ммоль) добавляют ТГФ (4,5 мл) и 0,25 н. NaOH (4,5 мл). Образовавшуюся смесь перемешивают при комнатной температуре в течение 14 часов. Реакционную смесь перегоняют при пониженном давлении для удаления растворителя. Остаток подкисляют 1 н. HCl с последующей экстракцией смесью хлороформ-метанол (5:1, об./об.). Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом магния и перегоняют при пониженном давлении для удаления растворителя. Хроматографией с использованием тонкослойной пластины силикагеля (ТСХ Whatman) остаток разделяют на два диастереомера, в результате чего из элюатных фракций хлороформ-метанол (40:1, об./об.×3) транс-4-(1-(5-хлор-2-фтор-4-(1-метил-3-индолилкарбониламино)фенилацетил)-4,4-дифтор-(2S)-пирролидинилметокси)циклогексанкарбоновую кислоту (53 мг, 16%) получают в виде белого твердого вещества.
ИК (ATR) ν 1653, 1518 см-1;
1H-ЯМР (ДМСО-d6) δ: 1,11-1,31 (ряд м, общий 3H), 1,44 (м, 2H), 1,99 (м, 4H), 2,25 (м, 1H), 2,52 (м, 2H), 3,18 (м, 1H), 3,54 (м, 2H), 3,72 (м, 1H), 3,85 (с, 3H), 3,90 (м, 1H), 4,46 (м, 1H), 7,34 (м, 3H), 7,38 (м, 2H), 7,80 (с, 1H), 8,11 (м, 1H), 8,29 (с, 1H), 8,51 (дд, J=12,0,6,0 Гц, 1H), 8,49 и 8,50 (д, J=12,0 Гц, общий 1H).
МС (ESI) m/z 607 (M++1).
Дальнейшее элюирование дает цис-4-(1-(5-хлор-2-фтор-4-(1-метил-3-индолилкарбониламино)фенилацетил)-4,4-дифтор-(2S)-пирролидинилметокси)циклогексанкарбоновую кислоту (246 мг, 67%) в виде белого твердого вещества.
ИК (KBr) ν 1653, 1521 см-1; 1H-ЯМР (ДМСО-d6) 6 1,47 (м, 2H), 1,65-1,86 (ряд м, общий 6H), 2,34 (м, 1H), 2,51-2,60 (ряд м, общий 2H), 3,44 (м, 2H), 3,52 и 3,58 (AB кв., J=12,3 Гц, 2H), 3,75 (м, 1H), 3,83 (м, 1H), 3,85 (с, 3H), 3,93 (м, 1H), 4,49 (м, 1H), 7,34 (м, 3H), 7,39 (д, J=6,4 Гц, 2H), 7,79 и 7,81 (с, общий 1H), 8,11 (м, 1H), 8,28 (с, 1H), 8,48 (д, J=12,0 Гц, 1H).
МС (ESI) m/z 607 (M++1);
Анал. Вычисл. для С30Н31ClF3N3O5 (H2О: C, 57,74; H, 5,33; N, 6,73.
Найдено: C, 57,55; H, 5,06; N, 6,52.
Пример 144
транс-4-((2S)-((5-Хлор-2-фтор-4-(1-метил-3-индолилкарбониламино)фенил)-N-метилацетамидо)-1-пропокси)-1-циклогексанкарбоновая кислота:
(Стадия 1) Синтез метил-4-((2S)-N-метиламино-1-пропокси)-1-циклогексанкарбоксилата

В метаноле (30 мл) катализатор родий/оксид алюминия (2 г) добавляют к метил-4-((2S)-N-метиламино-1-пропокси)бензоату (1,83 г, 8,20 ммоль) и трифторуксусной кислоте (1,9 мл, 24,6 ммоль) и образовавшуюся смесь подвергают каталитическому гидрированию в течение 15 часов при давлении газообразного водорода 20 атм. Катализатор отфильтровывают от реакционной смеси и фильтрат перегоняют при пониженном давлении для удаления растворителя. Остаток делают основным насыщенным водным раствором бикарбоната натрия с последующей экстракцией хлороформом (2×100 мл). Экстракт сушат над безводным сульфатом магния и перегоняют при пониженном давлении для удаления растворителя, в результате чего метил-4-((2S)-N-метиламино-1-пропокси)-1-циклогексанкарбоксилат (1,56 г, 83%) получают в виде светло-желтого масла.
1H-ЯМР (CDCl3) δ: 0,99-1,02 (м, 3H), 1,20-2,03 (ряд м, 8H), 2,24-2,44 (м, 4H), 2,74 (м, 1H), 3,18-3,44 (ряд м, 3H), 3,67 (м, 3H).
МС (ESI) m/z 230 (M++1).
(Стадия 2) Синтез метил-4-((2S(-(N-трет-бутоксикарбонил)-N-метиламино)-1-пропокси)-1-циклогексанкарбоксилата
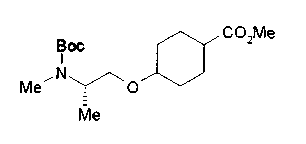
Метил-4-((2S)-N-метиламино-1-пропокси)-1-циклогексанкарбоксилат, полученный в вышеописанной стадии, растворяют в ацетонитриле (25 мл) и воде (25 мл). К образовавшемуся раствору добавляют триэтиламин (1,9 мл, 13,5 ммоль) и ди-трет-бутилдикарбонат (2,2 г, 10,1 ммоль). Образовавшуюся смесь перемешивают при комнатной температуре в течение 15 часов. Реакционную смесь экстрагируют этилацетатом (100 мл). Экстракт промывают насыщенным раствором соли (100 мл), сушат над безводным сульфатом магния и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси гексан-этилацетат (4:1) метил-4-((2S)-(N-трет-бутоксикарбонил)-N-метиламино)-1-пропокси)-1-циклогексанкарбоксилат (1,83 г, 82%) получают в виде бесцветного масла.
1H-ЯМР (CDCl3) δ: 1,09-1,12 (м, 3H), 1,24-2,33 (ряд м, 18H), 2,75 (м, 3H), 3,20-3,44 (м, 3H), 3,66 (м, 3H), 4,10-4,34 (м, 1H).
МС (ESI) m/z 330 (M++1).
(Стадия 3) Синтез метил-транс-4-((2S)-(N-(трет-бутоксикарбонил)-N-метиламино)-1-пропокси)-1-циклогексанкарбоксилата
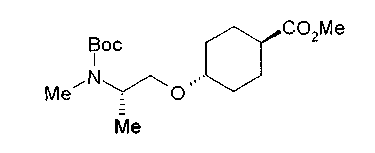
Метил-4-((2S)-(N-(трет-бутоксикарбонил)-N-метиламино)-1-пропокси)-1-циклогексанкарбоксилат (1,83 г, 5,56 ммоль) растворяют в сухом метаноле (30 мл). К образовавшемуся раствору добавляют метоксид натрия (900 мг, 16,7 ммоль) и смесь нагревают при кипячении с обратным холодильником в течение 15 часов. После охлаждения до комнатной температуры реакционную смесь выливают в 1 н. HCl (100 мл) с последующей экстракцией этилацетатом (2×100 мл). Экстракт промывают насыщенным раствором соли (100 мл), сушат над безводным сульфатом магния и перегоняют при пониженном давлении для удаления растворителя. Остаток растворяют в смеси 20% метанол-бензол (20 мл) и к образовавшемуся раствору по частям добавляют триметилсилилдиазометан (2,0 М раствор к гексане) до тех пор, пока исчезновение карбоновой кислоты как исходного материала не будет подтверждено ТСХ. Из реакционной смеси растворитель отгоняют при пониженном давлении. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси гексан-этилацетат (4:1) метил-транс-4-((2S)-(N-(трет-бутоксикарбонил)-N-метиламино-1-пропокси)-1-циклогексанкарбоксилат (786 мг, 43%) получают в виде бесцветного масла.
1H-ЯМР (CDCl3) δ: 1,09 (д, J=6,8 Гц, 3H), 1,21 (м, 2H), 1,46 (м, 11 H, включая с, 9H, при δ: 1,46), 2,02 (м, 4H), 2,26 (м, 1H), 2,73 (ушир.с, 3H), 3,18-3,47 (м, 3H), 3,66 (с, 3H), 4,11-4,34 (м, 1H).
МС (ESI) m/z 330 (M++1).
(Стадия 4) Синтез гидрохлорида метил-транс-4-((2S)-метиламино-1-пропокси)-1-циклогексанкарбоксилата
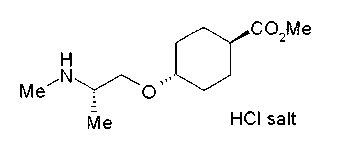
Метил-транс-4-((2S)-(N-(трет-бутоксикарбонил)-N-метиламино)-1-пропокси)-1-циклогексанкарбоксилат (786 мг, 2,39 ммоль) растворяют в диоксане (10 мл). К образовавшемуся раствору добавляют раствор 4 н. HCl/диоксан (15 мл). Реакционную смесь перемешивают при комнатной температуре в течение 15 часов. Реакционную смесь перегоняют при пониженном давлении для удаления растворителя. Остаток отверждают обработкой эфиром, в результате чего гидрохлорид метил-транс-4-((2S)-метиламино-1-пропокси)-1-циклогексанкарбоксилата (500 мг, 79%) получают в виде бесцветного аморфного вещества.
1H-ЯМР (ДМСО) δ: 1,16-1,24 (м, 5H), 1,31-1,40 (м, 2H), 1,87-1,91 (м, 2H), 1,96-1,99 (м, 2H), 2,24-2,30 (м, 1H), 2,49 (с, 3H), 3,21-3,28 (м, 2H), 3,47-3,60 (ряд м, 7H), 8,73 (ушир.с, 2H).
МС (ESI) m/z 230 (M++1).
(Стадия 5) Синтез метил-транс-4-((2S)-((5-хлор-2-фтор-4-(1-метил-3-индолилкарбониламино)фенил)-N-метилацетамидо)-1-пропокси)-1-циклогексанкарбоксилата

Гидрохлорид метил-транс-4-((2S)-метиламино-1-пропокси)-1-циклогексанкарбоксилата (200 мг, 753 ммоль) и (5-хлор-2-фтор-4-(1-метил-3-индолилкарбониламино)фенил)уксусную кислоту (272 мг, 0,753 ммоль) растворяют в ДМФ (10 мл). К образовавшемуся раствору добавляют триэтиламин (523 мкл, 3,76 ммоль), EDC·HCl (217 мг, 1,13 ммоль) и HOBt (153 мг, 1,13 ммоль). Образовавшуюся смесь перемешивают при комнатной температуре в течение 15 часов. К реакционной смеси добавляют этилацетат (100 мл) и воду (100 мл) для разделения ее на слои. Таким образом отделенный слой этилацетата промывают насыщенным раствором соли (2×100 мл), сушат над безводным сульфатом магния и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси хлороформ-метанол (10:1) метил-транс-4-((2S)-((5-хлор-2-фтор-4-(1-метил-3-индолилкарбониламино)фенил)-N-метилацетамидо)-1-пропокси)-1-циклогексанкарбоксилат (400 мг, 93%) получают в виде желтого вязкого масла.
1H-ЯМР (CDCl3) δ: 1,11-1,14 (м, 3H), 1,15-1,29 (м, 2H), 1,40-1,49 (м, 2H), 2,00 (м, 4H), 2,21-2,30 (м, 1H), 2,81 и 2,90 (с, каждый, общий 3H), 3,17 (м, 1H), 3,36-3,49 (м, 2H), 3,59-3,89 (ряд м, 8H, включая с, 3H, при δ: 3,85), 4,12 и 4,80 (м, каждый, общий 1H), 7,31-7,41 (м, 4H), 7,78 (д, J=1,7 Гц, 1H), 8,13 (дд, J=6,1, 3,2 Гц, 1H), 8,27 (с, 1H), 8,49 (д, J=12,9 Гц, 1H).
МС (ESI) m/z 572 (M++1).
(Стадия 6) Синтез транс-4-((2S)-((5-хлор-2-фтор-4-(1-метил-3-индолилкарбониламино)фенил)-N-метилацетамидо)-1-пропокси)-1-циклогексанкарбоновой кислоты
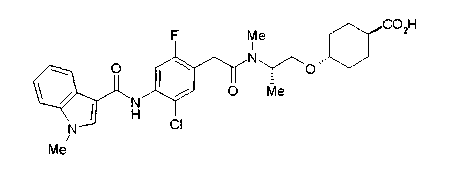
Метил-транс-4-((2S)-((5-хлор-2-фтор-4-(1-метил-3-индолилкарбониламино)фенил)-N-метилацетамидо)-1-пропокси)-1-циклогексанкарбоксилат (400 мг, 0,699 ммоль) растворяют в ТГФ (10 мл). К образовавшемуся раствору добавляют 0,25 н. NaOH (5,6 мл, 1,40 ммоль). Образовавшуюся смесь перемешивают при комнатной температуре в течение 15 часов. Реакционную смесь выливают в 1 н. HCl (50 мл) с последующей экстракцией хлороформом (2×100 мл). Экстракт сушат над безводным сульфатом магния и перегоняют при пониженном давлении для удаления растворителя. Остаток растворяют в хлороформе. К образовавшемуся раствору по частям добавляют гексан, чтобы вызвать кристаллизацию. Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении и сушат, получая при этом указанное в заголовке соединение (260 мг, 67%) в виде бесцветного аморфного вещества.
1H-ЯМР (ДМСО-d6) δ: 1,01-1,34 (ряд м, 7H), 1,89 (м, 4H), 2,15 (м, 1H), 2,70 и 2,90 (с, каждый, общий 3H, вследствие характера двойной связи С(О)-N-связи в амиде), 3,21-3,92 (ряд м, 8H), 4,18 и 4,61 (м, каждый, 1H, вследствие характера двойной связи С(О)-N-связи в амиде), 7,20-7,69 (ряд м, 5H), 8,16 (м, 1H), 8,31 (с, 1Н), 9,30 (с, 1H), 12,04 (с, 1H).
МС (FAB) m/z 558 (M++1);
Анал. Вычисл. для С29Н33ClFN3O5: С, 62,42; H, 5,96; N, 7,53,
Найдено: С, 62,09; H, 6,09; N, 7,26.
Пример 145
транс-4-((2S)-((7-Фтор-2-((5-фтор-2-метилфенил)амино)-6-бензоксазолил)-N-метилацетамидо)-1-пропокси)-1-циклогексанкарбоновая кислота:
(Стадия 1) Синтез метил-транс-4-((2S)-((7-фтор-2-((5-фтор-2-метилфенил)амино)-6-бензоксазолил)-N-метилацетамидо)-1-пропокси)-1-циклогексанкарбоксилата
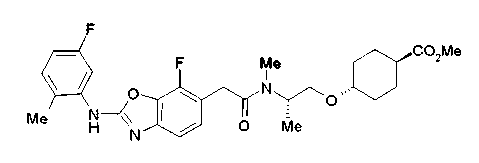
В ДМФ (10 мл) триэтиламин (523 мкл, 3,76 ммоль) EDC·HCl (217 мг, 1,13 ммоль) и HOBt (153 мг, 1,13 ммоль) добавляют к гидрохлориду метил-транс-4-((2S)-N-метиламино-1-пропокси)-1-циклогексанкарбоксилата (200 мг, 0,753 ммоль) и метил-7-фтор-2- ((5-фтор-2-метилфенил)амино)-6-бензоксазолил)ацетату (239 мг, 0,753 моль) и образовавшуюся смесь перемешивают при комнатной температуре в течение 15 часов. К реакционной смеси добавляют этилацетат (100 мл) и воду (100 мл) для разделения ее на слои. Таким образом полученный слой этилацетата промывают насыщенным раствором соли (2×100 мл), сушат над безводным сульфатом магния и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси хлороформ-метанол (20:1) метил-транс-4-((2S)-((7-Фтор-2-((5-фтор-2-метилфенил)амино)-6-бензоксазолил)-N-метилацетамидо)-1-пропокси)-1-циклогексанкарбоксилат (399 мг, 100%) получают в виде желтого вязкого масла.
1H-ЯМР (CDCl3) δ: 1,08-1,48 (м, 7H), 1,99 (м, 4H), 2,28 (м, 4H), 2,77-3,94 (ряд м, 11H), 4,19 и 4,83 (м, каждый, общий 1H), 6,73 (м, 1Н), 7,03-7,21 (м, 3H), 7,44 (м, 1H), 8,00-8,04 (м, 1H).
МС (ESI) m/z 572 (M++1).
(Стадия 2) Синтез транс-4-((2S)-((7-фтор-2-((5-фтор-2-метилфенил)амино)-6-бензоксазолил)-N-метилацетамидо)-1-пропокси)-1-циклогексанкарбоновой кислоты

Метил-транс-4-((2S)-((7-фтор-2-((5-фтор-2-метилфенил)амино)-6-бензоксазолил)-N-метилацетамидо)-1-пропокси)-1-циклогексанкарбоксилат (399 мг, 0,753 ммоль) растворяют в ТГФ (10 мл). К образовавшемуся раствору добавляют 0,25 н. NaOH (6 мл, 1,50 ммоль). Образовавшуюся смесь перемешивают при комнатной температуре в течение 15 часов. Реакционную смесь выливают в 1 н. HCl (50 мл) с последующей экстракцией хлороформом (2×100 мл). Экстракт сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток растворяют в хлороформе. Добавляют гексан до тех пор, пока не произойдет осаждение твердого вещества. Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении и сушат, получая при этом указанное в заголовке соединение (210 мг, 54%) в виде бесцветного аморфного вещества.
1H-ЯМР (ДМСО-d6) δ: 1,00-1,40 (ряд м, 7H), 1,89 (м, 4H), 2,15 (м, 1H), 2,30 (с, 3H), 2,69 и 2,90 (с, каждый, общий 3H, вследствие характера двойной связи С(О)-N-связи в амиде), 3,19 (м, 1H), 3,33-3,47 (м, 4H), 3,73-3,84 (м, 2H), 4,19 и 4,63 (м, каждый, общий 1H, вследствие характера двойной связи С(О)-N-связи в амиде), 6,89 (дт, J=8,3, 2,7 Гц, 1H), 7,03 и 7,07 (т, J=7,8 Гц, общий 1H, вследствие характера двойной связи С(О)-N-связи в амиде), 7,21 (д, J=7,8 Гц, 1H), 7,27 (т, J=7,8 Гц, 1H), 7,94 (дд, J=ll,5,2,5 Гц, 1H), 10,04 (ушир.с, 1Н), 12,06 (ушир.с, 1H).
МС (FAB) m/z 516 (M++1);
Анал. Вычисл. для C27H31F2N3О5: С, 62,90; H, 6,06; N, 8,15, Найдено: С, 62,92; Н, 6,25; N, 7,86.
Пример 146
4-(1-((2-((5-Фтор-2-метилфениламино)-6-бензоксазолил)ацетил)-(4S)-фтор-(2S)-пирролидинилметокси)бензойная кислота:
(Стадия 1) Синтез метил-(2-(5-фтор-2-метилфениламино)-6-бензоксазолил)ацетата
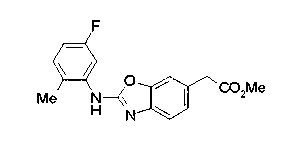
В метаноле (50 мл) 5-фтор-2-метилфенилизотиоцианат (2,00 г, 12,0 ммоль) добавляют к метил-4-амино-3-гидроксифенилацетату (2,17 г, 12,0 ммоль) и образовавшуюся смесь перемешивают при комнатной температуре в течение 27 часов. К реакционной смеси добавляют оксид ртути(II) (желтый) (3,12 г, 14,4 ммоль) с последующим перемешиванием при 70°С в течение 4 часов. После охлаждения до комнатной температуры реакционную смесь фильтруют через целит с последующим промыванием метанолом. Фильтрат перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси хлороформ-этилацетат (10/1) метил-(2-(5-фтор-2-метилфениламино)-6-бензоксазолил)ацетат (1,73 г, 46%) получают в виде коричневого масла.
1H-ЯМР (CDCl3) δ: 2,13 (с, 3H), 3,705 (с, 2H), 3,711 (с, 3H), 6,74 (дт, J=8,3, 2,7 Гц, 1H), 6,81 (ушир., 1H), 7,15 (дд, J=8,1, 1,7 Гц, 2H), 7,31 (д, J=1,2 Гц, 1H), 7,44 (д, J=8,1 Гц, 1H), 8,09 (дд, J=11,0, 2,7 Гц, 1H).
МС (ESI) m/z 315 (M++1).
(Стадия 2) Синтез (2-(5-фтор-2-метилфениламино)-6-бензоксазолил)уксусной кислоты
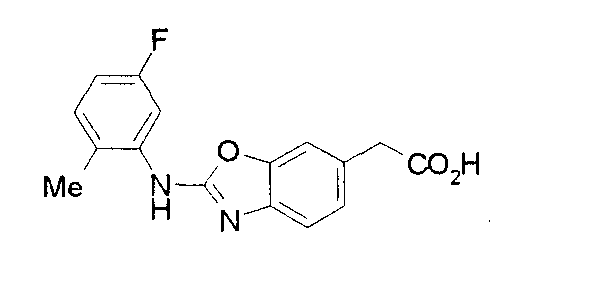
Метил-(2-(5-фтор-2-метилфениламино)-6-бензоксазолил)ацетат (1,73 г, 5,50 ммоль) растворяют в смеси ТГФ/метанол (2:1, 30 мл). К образовавшемуся раствору добавляют 1 н. NaOH (20 мл) и смесь перемешивают при комнатной температуре в течение 3,5 часа. Реакционную смесь перегоняют при пониженном давлении для удаления растворителя. Остаток подкисляют 1 н. HCl. Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при пониженном давлении, получая при этом (2-(5-фтор-2-метилфениламино)-6-бензоксазолил)уксусную кислоту (1,60 г, 97%) в виде бесцветного кристаллического порошка.
1H-ЯМР (ДМСО-d6) δ: 2,49 (с, 3H), 3,64 (д, J=1,7 Гц, 2H), 6,87 (дт, J=8,3, 1,5 Гц, 1H), 7,11 (д, J=8,1 Гц, 1H), 7,25 (т, J=7,3 Гц, 1H), 7,37 (д, J=8,1 Гц, 1H), 7,41 (с, 1H), 7,95 и 7,98 (каждый с, общий 1H, амидные изомеры), 9,80 (ушир., 1H).
МС (ESI) m/z 301 (M++1).
(Стадия 3) Синтез метил-4-(1-((2-((5-фтор-2-метилфениламино)-6-бензоксазолил)ацетил)-(4S)-фтор-(2S)-пирролидинилметокси)бензоата
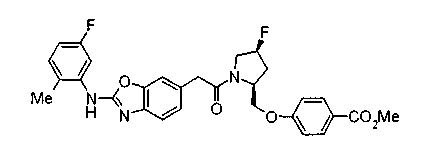
В ДМФ (5 мл) (2-(5-фтор-2-метилфениламино)-6-бензоксазолил)уксусную кислоту (300 мг, 1,0 ммоль), метил-4- ((4S)-фтор-(2S)-пирролидинилметокси)бензоат (253 мг, 1,0 ммоль), EDC·HCl (288 мг, 1,5 ммоль), HOBt (203 мг, 1,5 ммоль) и триэтиламин (0,70 мл, 5,0 ммоль) перемешивают при комнатной температуре в течение 17 часов. Реакционную смесь выливают в ледяную воду с последующей экстракцией этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси н-гексан/этилацетат (1/4) метил-4-(1-((2-((5-фтор-2-метилфениламино)-6-бензоксазолил)ацетил)-(4S)-фтор-(2S)-пирролидинилметокси)бензоат (630 мг, 100%) получают в виде бесцветного аморфного вещества.
1H-ЯМР (CDCl3) δ: 2,05-2,62 (м, 5H), 3,73 (д, J=3,9 Гц, 2H), 3,80 (м, 1H), 3,86 (с, 3H), 3,90-4,10 (м, 2H), 4,46-4,68 (м, 2H), 5,23-5,38 (м, 1H), 6,73 (дт, J=8,1, 2,4 Гц, 1H), 6,86 и 6,98 (каждый д, каждый J=8,8 Гц, общий 2H, амидные изомеры), 7,12 (м, 3H), 7,26 (с, 1H), 7,29 (т, J=9,0 Гц, 1H), 7,43 (т, J=8,1 Гц, 1H), 7,95 и 7,99 (каждый д, каждый J=8,8 Гц, общий 2H, амидные изомеры), 8,05 и 8,08 (каждый с, общий 1H, амидные изомеры).
МС (ESI) m/z 536 (M++1).
(Стадия 4) Синтез 4-(1-((2-(5-фтор-2-метилфениламино)-6-бензоксазолил)ацетил)-(4S)-фтор-(2S)-пирролидинилметокси)бензойной кислоты
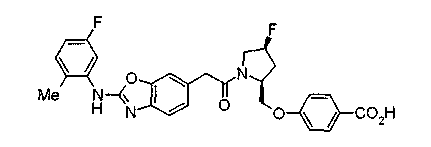
Метил-4-(1-((2-(5-фтор-2-метилфениламино)-6-бензоксазолил)ацетил)-(4S)-фтор-(2S)-пирролидинилметокси)бензоат (630 мг, 1,0 ммоль) растворяют в смеси ТГФ/метанол (20/10 мл). К образовавшемуся раствору добавляют 1 н. NaOH (20 мл). Образовавшуюся смесь перемешивают при комнатной температуре в течение 23 часов. Из реакционной смеси растворитель отгоняют при пониженном давлении. Остаток подкисляют 1 н. HCl. Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при пониженном давлении, получая при этом указанное в заголовке соединение (501 мг, 96%) в виде светло-розового твердого вещества.
ИК (ATR) ν 2983, 1684, 1639, 1604, 1576, 1541, 1508, 1423 см-1;
1H-ЯМР (ДМСО-d6) δ: 2,24 (м, 2H), 2,30 (с, 3H), 3,67-4,10 (м, 5H), 4,21-4,71 (м, 2H), 5,38 и 5,45 (каждый д, J=54,6 и 53,1 Гц соответственно, общий 1H, амидные изомеры), 6,87 (дт, J=8,5, 2,2 Гц, 1Н), 7,03-7,13 (м, 3H), 7,25 (т, J=7,6 Гц, 1H), 7,36 и 7,39 (каждый с, общий 2H, амидные изомеры}, 7,87 (дд, J=9,0, 2,2 Гц, 2H), 7,95 (д, J=11,0 Гц, 1H), 9,80 (ушир., 1H).
МС (ESI) m/z 522 (M++1);
Анал. Вычисл. для C28H25FN3О5·0,7H2О (0,4HC1: C, 61,29; H, 4,92; N, 7,66; Cl, 2,58; F, 6,92.
Найдено: C, 61,13; H, 4,74; N, 7,38; Cl, 2,57; F, 6,87.
Пример 147
4-(1-((3-Хлор-4-((1-метил-3-индолилкарбонил)амино)фенил)ацетил)-(4S)-фтор-(2S)-пирролидинилметокси)бензойная кислота:
(Стадия 1) Синтез этил-(3-хлор-4-((1-метил-3-индолилкарбонил)амино)фенил)ацетата
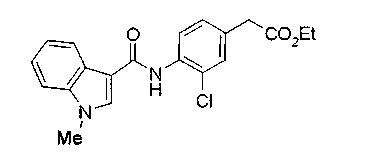
В ДМФ (20 мл) EDC·HCl (1,44 г, 7,49 ммоль) добавляют к 1-метил-3-индолилкарбоновой кислоте (1,01 г, 5,71 ммоль), этил-4-амино-3-хлорфенилацетату (1,22 г, 5,71 ммоль), HOBt (0,86 г, 6,34 ммоль) и DMAP (0,14 г, 1,15 ммоль) и образовавшуюся смесь перемешивают при 70°С в течение 18 часов. После охлаждения до комнатной температуры в реакционную смесь добавляют воду с последующей экстракцией этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси н-гексан-этилацетат (1:1, об./об.) этил-(3-хлор-4-((1-метил-3-индолилкарбонил)амино)фенил)ацетат (639 мг, 30%) получают в виде желтого твердого вещества.
1H-ЯМР (CDCl3) δ: 1,27 (т, J=7,1 Гц, 3H), 3,58 (с, 2H), 3,89 (с, 3H), 4,17 (кв., J=7,1 Гц, 2H), 7,24 (дд, J=8,3, 2,0 Гц, 1H), 7,32-7,43 (м, 4H), 7,81 (с, 1H), 8,16 (м, 1H), 8,28 (ушир.с, 1H), 8,59 (д, J=8,3 Гц, 1H).
МС (ESI) m/z 371 (M++1).
(Стадия 2) Синтез (3-хлор-4-((1-метил-3-индолилкарбонил)амино)фенил)уксусной кислоты
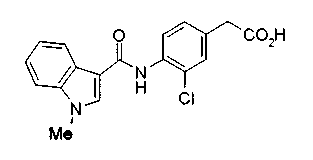
Этил-(3-хлор-4-((1-метил-3-индолилкарбонил)амино)фенил)ацетат (639 мг, 1,72 ммоль) растворяют в ТГФ (17,5 мл). К образовавшемуся раствору добавляют 0,25 н. NaOH (10,3 мл, 2,58 ммоль) с последующим перемешиванием при комнатной температуре в течение 4 часов. Реакционную смесь выливают в 1 н. HCl (15 мл). Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при пониженном давлении, получая при этом (3-хлор-4-((1-метил-3-индолилкарбонил)амино)фенил)уксусную кислоту (549 мг, 93%) в виде бесцветного твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 3,61 (с, 2H), 3,89 (с, 3H), 7,17-7,28 (м, 3H), 7,43 (д, J=1,7 Гц, 1H), 7,53 (д, J=8,3 Гц, 1H), 7,69 (д, J=8,3 Гц, 1H), 8,14 (д, J=7,8 Гц, 1H), 8,26 (с, 1H), 9,26 (с, 1H).
(Стадия 3) Синтез метил-4-(1-((3-хлор-4-((1-метил-3-индолилкарбонил)амино)фенил)ацетил)-(4S)-фтор-(2S)-пирролидинилметокси)бензоата
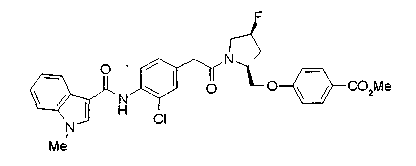
В ДМФ (5,0 мл), EDC·HCl (161 мг, 0,84 ммоль) добавляют к (3-хлор-4-((1-метил-3-индолилкарбонил)амино)фенил)уксусной кислоте (240 мг, 0,70 ммоль), метил-4-((4S)-фтор-(2S)-пирролидинилметокси)бензоату (177 мг, 0,70 ммоль), HOBt (114 мг, 0,84 ммоль) и DMAP (17,0 мг, 0,14 ммоль) и образовавшуюся смесь перемешивают при комнатной температуре в течение 24 часов. К реакционной смеси добавляют воду с последующей экстракцией этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из этилацетатных элюатных фракций метил-4-(1-((3-хлор-4-((1-метил-3-индолилкарбонил)амино)фенил)ацетил)-(4S)-фтор-(2S)-пирролидинилметокси)бензоат (176 мг, 43%) получают в виде светло-желтого аморфного вещества.
1H-ЯМР (CDCl3) δ: 2,03-2,69 (м, 2H), 3,59 (д, J=15,2 Гц, 1H), 3,64 (д, J=15,2 Гц, 1H), 3,68-4,19(м, 9H, включая синглет, 3H, при δ: 3,86, и синглет, 3H, при δ: 3,87), 4,47-4,63 (м, 2H), 5,36 (м, 1H), 6,98 (д, J=8,8 Гц, 2H), 7,18 (д, J=8,3 Гц, 1Н), 7,32-7,42 (м, 4H), 7,80 (с, 1Н), 7,95 (д, J=8,8 Гц, 2H), 8,13 (м, 1H), 8,27 (ушир.с, 1H), 8,56 (м, 1H).
МС (ESI) m/z 578 (M++1).
(Стадия 4) Синтез 4-(1-((3-хлор-4-((1-метил-3-индолилкарбонил)амино)фенил)ацетил)-(4S)-фтор-(2S)-пирролидинилметокси)бензойной кислоты
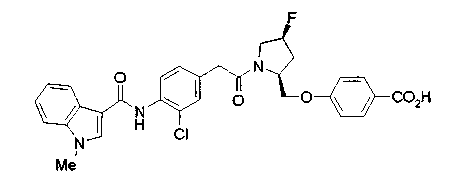
Метил-4-(1-((3-хлор-4-((1-метил-3-индолилкарбонил)амино)фенил)ацетил)-(4S)-фтор-(2S)-пирролидинилметокси)бензоат (176 мг, 0,30 ммоль) растворяют в ТГФ (3,0 мл). К образовавшемуся раствору добавляют 0,25 н. NaOH (1,83 мл, 0,45 ммоль). Образовавшуюся смесь перемешивают при комнатной температуре в течение 19 часов и при 60°С в течение 5 часов. Реакционную смесь выливают в 1 н. HCl (5,0 мл). Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при пониженном давлении, получая при этом указанное в заголовке соединение (120 мг, 71%) в виде бесцветного твердого вещества.
ИК (ATR) ν 1708, 1650, 1604, 1579, 1511, 1469 см-1;
1H-ЯМР (ДМСО-d6) δ: 2,26-2,33 (м, 2H), 3,69 (д, J=15,9 Гц, 1H), 3,75 (д, J=15,9 Гц, 1H), 3,80-3,97 (м, 7H, включая синглет, 3H, при δ: 3,89), 4,40-4,44 (м, 2H), 5,46 (м, 1H), 7,07 (д, J=8,8 Гц, 2H), 7,18-7,28 (м, 2H), 7,39 и 7,42 (каждый ушир.с, общий 1H), 7,53 (д, J=8,1 Гц, 1H), 7,70 (д, J=8,1 Гц, 1Н), 7,87 (д, J=8,8 Гц, 2H), 8,14 (д, J=7,8 Гц, 1H), 8,26 (с, 1Н), 9,26 (с, 1H), 12,60 (ушир.с, 1H).
МС (ESI) m/z 564 (M++1);
Анал. Вычисл. для С30Н27ClFN3O5: C, 63,89; H, 4,83; N, 7,45. Найдено: C, 63,50; H, 5,01; N, 7,13.
Пример 148
3-Амино-4-((4S)-фтор-1-((2-метилфениламино)-6-бензоксазолилацетил)-(2S)-пирролидинилметокси)бензойная кислота:
(Стадия 1) Синтез метил-4-((4S)-фтор-1-((2-метилфениламино)-6-бензоксазолилацетил)-(2S)-пирролидинилметокси)-3-нитробензоата

В ДМФ (10 мл) растворяют ((2-метилфениламино)-6-бензоксазолил) уксусную кислоту (391 мг, 1,38 ммоль) и метил-4-((4S)-фтор-(2S)-пирролидинилметокси)-3-нитробензоат (412 мг, 1,38 ммоль). К образовавшемуся раствору добавляют EDC·HCl (405 мг, 2,11 ммоль), HOBt (2,5 мг, 0,02 ммоль) и DMAP (2,5 мг, 0,02 ммоль) и образовавшуюся смесь перемешивают при комнатной температуре в течение 18 часов. К реакционной смеси добавляют воду с последующей экстракцией этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси хлороформ-метанол (20:1, об./об.) метил-4-((4S)-фтор-1-((2-метилфениламино)-6-бензоксазолилацетил)-(2S)-пирролидинилметокси-3-нитробензоат (460 мг, 59%) получают в виде желтого твердого вещества.
1H-ЯМР (CDCl3) δ: 2,12 (м, 2H), 2,34 (с, 3H), 2,67 (д, J=17,2 Гц, 1H), 3,73 (м, 1H), 3,82 (м, 1H), 3,92 [s, 3H), 4,03 (м, 1H), 4,11 (м, 1H), 4,58 (ушир., 1H), 4,72 (ушир., 1H), 5,31 (д, J=58,1 Гц, 1H), 6,73 (м, 1H), 6,94 (м, 1H), 7,09 (м, 2H), 7,25 (м, 2H), 7,32 (м, 3H), 8,08 (м, 1H), 8,16 (м, 1H).
(Стадия 2) Синтез метил-3-амино-4-((4S)-фтор-1-((2-метилфениламино)-6-бензоксазолилацетил)-(2S)-пирролидинилметокси)бензоата
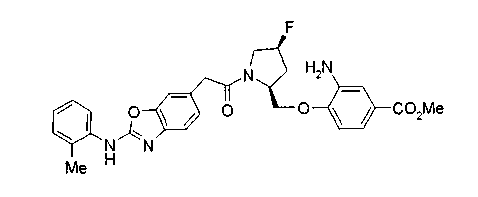
В этаноле (5 мл) и ТГФ (2 мл) метил-4-((4S)-фтор-1-((2-метилфениламино)-6-бензоксазолилацетил)-(2S)-пирролидинилметокси-3-нитробензоат (460 мг, 0,82 ммоль) и 5% палладий на угле (500 мг) подвергают каталитическому гидрированию в течение 60 часов при нормальном давлении. Из реакционной смеси катализатор отфильтровывают и фильтрат перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси хлороформ-метиловый сложный эфир (10:1, об./об.) метил-3-амино-4-((4S)-фтор-1-((2-метилфениламино)-6-бензоксазолилацетил)-(2S)-пирролидинилметокси)бензоат (192 мг, 44%) получают в виде коричневого твердого вещества.
ИК (KBr) ν 1708, 1639, 1573 см-1;
1H-ЯМР (CDCl3) δ: 2,12 (м, 2H), 2,36 (с, 3H), 2,47 (дд, J=16,0, 21,5 Гц, 1H), 3,73 (м, 2H), 3,84 (с, 3H), 4,11 (ушир., 1H), 4,16 (м, 1H), 4,40 (дд, J=4,8, 8,8 Гц, 1H), 4,49 (ушир., 1H), 4,73 (ушир., 1H), 5,33 (ряд дт, J=4,4,52,8 Гц, общий 1H), 6,90 (м, 1H), 7,08 (д, J=7,2 Гц, 2H), 7,23 (м, 2H), 7,30 (д, J=7,2 Гц, 1H), 7,36 (дд, J=ll,2, 12,8 Гц, 1H), 7,43 (м, 1H), 8,09 (д, J=8,0 Гц, 2H).
МС (ESI) m/z 533 (M++H);
Анал. Вычисл. для С29Н29FN4O5·2,5H2О: C, 60,30; H, 5,93; N, 9,70.
Найдено: C, 60,48; 11,2, H, 5,13; N, 9,26.
(Стадия 3) Синтез 3-амино-метил-4-((4S)-фтор-1-((2-метилфениламино)-6-бензоксазолилацетил)-(2S)-пирролидинилметокси)бензойной кислоты
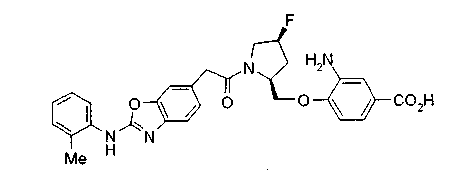
Метил-3-амино-4-((4S)-фтор-1-((2-метилфениламино-6-бензоксазолилацетил)-(2S)-пирролидинилметокси)бензоат (191 мг, 0,36 ммоль) растворяют в ТГФ (3 мл). В образовавшемуся раствору добавляют 0,25 н. NaOH (3 мл) и образовавшуюся смесь нагревают при кипячении с обратным холодильником в течение 5 часов. После охлаждения реакционную смесь концентрируют при пониженном давлении для удаления растворителя и остаток разбавляют смесью хлороформ-метанол (5:1, об./об.). Раствор промывают 1 н. HCl, сушат над безводным сульфатом магния и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси хлороформ-метанол (5:1, об./об.) указанное в заголовке соединение (76 мг, 41%) получают в виде коричневого твердого вещества.
ИК (ATR) ν 1639, 1573 см-1;
1H-ЯМР (ДМСО-d6) δ: 2,27 (с, 3H), 2,49 (с, 1H), 3,7-4,1 (ряд м, общий 4H), 4,24 (м, 2H), 4,46 (м, 2H), 5,42 (ряд д, J=53,2 Гц, общий 1H), 6,86 (д, J=8,0 Гц, 1H), 7,04 (т, J=14,4 Гц, 2H), 7,05 (с, 1H), 7,14 (м, 1H), 7,22 (м, общий 3H), 7,33 (д, J=5,6 Гц, 1H), 7,78 (д, J=8,4 Гц, 2H), 9,67 (ушир., 1H).
МС (ESI) 519 (M++1).
Пример 149
4-(1-(3-Хлор-4-((1-метил-3-индолилкарбонил)амино)фенилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)-2-метоксибензойная кислота:
(Стадия 1) Синтез этил-4-(1-(3-хлор-4-((1-метил-3-индолилкарбонил)амино)фенилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)-2-метоксибензоата
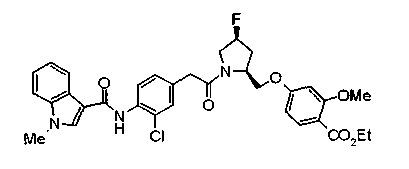
В ДМФ (14 мл) EDC·HCl (173,2 мг, 0,904 ммоль) добавляют к этил-4-((4S)-фтор-(2S)-пирролидинилметокси)-2-метоксибензоату (179, 1 мг, 0,602 ммоль), 3-хлор-4-((1-метил-3-индолилкарбонил)амино)фенилуксусной кислоте (206,4 мг, 0,602 ммоль) и HOBt (32,6 мг, 0,241 ммоль) и образовавшуюся смесь перемешивают при комнатной температуре в течение 18 часов. Реакционную смесь разбавляют этилацетатом. Разбавленную смесь промывают последовательно 1 н. HCl и насыщенным водным раствором бикарбоната натрия, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси хлороформ-метанол (25:1, об./об.) этил-4-(1-(3-хлор-4-((1-метил-3-индолилкарбонил)амино)фенилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)-2-метоксибензоат (100%) получают в виде аморфного вещества.
1H-ЯМР (CDCl3) δ: 1,35 (3H, t, J=7,6 Гц, OCH2Me), 1,72-2,70 (общий 2H, ряд м), 3,52-4,18 (общий 11H, ряд м, включая 3Н, с, при δ: 3,34 и 3H, с при δ: 3,92), 4,30 (2H, кв., J=7,6 Гц, OCH2Me), 4,50-4,66 (2H, м), 5,31 (1H, д, J=52,4 Гц), 6,40-6,64 (общий 2H, м), 7,20 (1H, м), 7,29-7,45 (4H, м), 7,75-7,88 (2H, м), 8,14 (1H, м), 8,25 (1H, м), 8,57 (1H, м).
(Стадия 2) Синтез 4-(1-(3-хлор-4-((1-метил-3-индолилкарбонил)амино)фенилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)-2-метоксибензойной кислоты
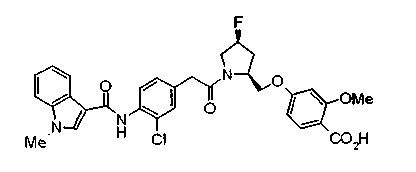
Этил-4-(1-(3-хлор-4-((1-метил-3-индолилкарбонил)амино)фенилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)-2-метоксибензоат (374,6 мг, 0,602 ммоль) растворяют в ТГФ (8,0 мл). К образовавшемуся раствору добавляют 0,25 н. NaOH (8,0 мл) с последующим перемешиванием при комнатной температуре в течение 18 часов. Реакционную смесь концентрируют.Концентрат затем нейтрализуют 1 н. HCl (2,5 мл). Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при 50°С и пониженном давлении, получая при этом указанное в заголовке соединение (345,8 мг, 97%) в виде аморфного вещества.
ИК (ATR) ν 1608, 1511 см-1;
1H-ЯМР (ДМСО-d6) 5 2,15-2,40 (2H, м), 3,40-4,78 (общий 13H, м, включая 3H, с при δ: 3,84 и 3H, с при δ: 3,91), 5,42, 5,49 (общий 1H, ушир.д, J=52,0 Гц), 6,50-6,80 (2H, м), 7,23 (3H, м), 7,44 (1H, д, J=10,0 Гц), 7,57 (1H, д, J=10,0 Гц), 7,70 (2H, м), 8,16 (1H, м), 8,29 (1H, с), 9,32 (1H, м), 12,15 (1H, ушир.с, CO2H).
МС (ESI) m/z 594 (M++1);
Анал. Вычисл. для C31H29ClFN3О6·H2О: C, 60,83; H, 5,11; N, 6,87; Cl, 5,79; F, 3,10.
Найдено: C, 60,53; H, 5,01; N, 6,71; Cl, 5,69; F, 3,09.
Пример 150
6-(1-(3-Хлор-4-(1-метил-3-индолил)карбониламинофенилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)никотиновая кислота:
(Стадия 1) Синтез метил-6-(1-(3-хлор-4-(1-метил-3-индолил)карбониламинофенилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)никотината
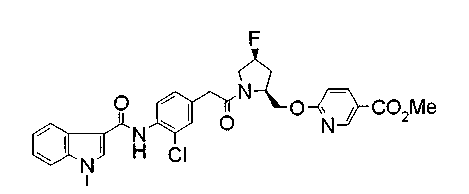
Метил-6-(1-трет-бутоксикарбонил-(4S)-фтор-(2S)-пирролидинилметокси)никотинат (197 мг, 0,50 ммоль) растворяют в метиленхлориде (10 мл). При перемешивании при 0°С добавляют трифторуксусную кислоту (10 мл) и образовавшуюся смесь перемешивают при комнатной температуре в течение 30 минут. Из реакционной смеси растворитель отгоняют при пониженном давлении. К остатку добавляют насыщенный водный раствор бикарбоната натрия с последующей экстракцией метиленхлоридом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток используют для следующей реакции без дополнительной очистки. В ТГФ (5,0 мл) и ацетонитриле (5,0 мл) EDC·HCl (144 мг, 0,75 ммоль) добавляют к образовавшемуся соединению, (3-хлор-4-(1-метил-3-индолил)карбониламинофенил)уксусной кислоте (171 мг, 0,5 ммоль), HOBt (70 мг, 0,5 ммоль) и триэтиламину (208 мкл, 1,5 ммоль) при 0°С. Образовавшуюся смесь перемешивают при комнатной температуре в течение 16 часов. К реакционной смеси добавляют воду с последующей экстракцией этилацетатом. Экстракт промывают насыщенным водным раствором бикарбоната натрия и 2 М водным раствором лимонной кислоты, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией с использованием тонкослойной пластины силикагеля (ТСХ), посредством чего из элюатных фракций смеси хлороформ-метанол (95:5, об./об.) метил-6-(1-(3-хлор-4-(1-метил-3-индолил)карбониламинофенилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)никотинат (330 мг, 100%) получают в виде бесцветного масла.
1H-ЯМР (CDCl3) δ: 2,10-2,55 (м, 2H), 3,55-4,05 (м, 10Н), 4,25-4,85 (м, 3Н), 5,24-5,37 (м, 1H), 6,78 (т, J=8,8 Гц, 1H), 7,25-7,44 (м, 5H), 7,80 (д, J=4,6 Гц, 1H), 8,13-8,25 (м, 3H), 8,54-8,59 (м, 1H), 8,80-8,86 (м, 1H).
(Стадия 2) Синтез 6-(1-(3-хлор-4-(1-метил-3-индолил)карбониламинофенилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)никотиновой кислоты
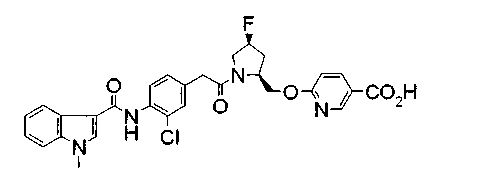
Метил-6-(1-(3-хлор-4-(1-метил-3-индолил)карбониламинофенилацетил)-(4S)-фтор-(2S)-пирролидинилметокси)никотинат (330 мг, 0,5 ммоль) растворяют в ТГФ (10 мл) и метаноле (15 мл). К образовавшемуся раствору добавляют 1 н. NaOH (1,0 мл, 1,0 ммоль). Образовавшуюся смесь перемешивают при 70°С в течение 18 часов. После охлаждения реакционную смесь подкисляют водой и 1 н. HCl. Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при пониженном давлении, получая при этом указанное в заголовке соединение (270 мг, 96%) в виде белого твердого вещества.
ИК (ATR) ν 2983, 1600, 1511, 1222 см-1;
1H-ЯМР (ДМСО-d6) δ: 2,20-2,40 (м, 2H), 3,50-4,00 (м, 7H), 4,10-4,80 (м, 3H), 5,38-5,52 (м, 1H), 6,90-6,93 (м, 1H), 7,18-7,28 (м, 1H), 7,41 (с, 1Н), 7,54 (д, J=8,3 Гц, 1H), 7,65-7,68 (м, 1H), 8,14-8,20 (м, 2H), 8,26 (с, 1Н), 8,68-8,73 (м, 1H), 9,29 (с, 1H).
МС (FAB) m/z 565 (M+H)+;
Анал. Вычисл. для C29H26C1FN4О5·0,5 H2О: C, 60,68; H, 4,74; N, 9,76.
Найдено: C, 60,49; H, 4,72; N, 9,56.
Пример 151
4-(3,4-Дегидро-1-((2-(2-метилфениламино)-6-бензоксазолил)ацетил)-(2S)-пирролидинилметокси)бензойная кислота:
(Стадия 1) Синтез метил-4-(3,4-дегидро-1-((2-(2-метилфениламино)-6-бензоксазолил)ацетил)-(2S)-пирролидинилметокси)бензоата

В ДМФ (7,5 мл) растворяют (2-(2-метилфениламино)-6-бензоксазолил)уксусную кислоту (223 мг, 0,79 ммоль), метил-4-(3,4-дегидро-(2S)-пирролидинилметокси)бензоат (184 мг, 0,79 ммоль), HOBt (21,0 мг, 0,16 ммоль) и триэтиламин (0,16 мл, 1,15 ммоль). К образовавшемуся раствору добавляют EDC·HCl (227 мг, 1,15 ммоль) и образовавшуюся смесь перемешивают при комнатной температуре в течение 12 часов. К реакционной смеси добавляют воду с последующей экстракцией этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из этилацетатных элюатных фракций метил-4-(3,4-дегидро-1-((2-(2-метилфениламино)-6-бензоксазолил)ацетил)-(2S)-пирролидинилметокси)бензоат (331 мг, 84%) получают в виде желтого твердого вещества.
1H-ЯМР (CDCl3) δ: 2,37 (с, 3H), 3,71 (с, 2H), 3,84 (с, 3H), 4,20 (м, 1H), 4,31-4,35 (м, 2H), 4,42 (дд, J=9,5, 5,4 Гц, 1H), 5,10 (м, 1H), 5,87-5,95 (м, 2H), 6,86 (д, J=8,8 Гц, 2H), 7,05-7,09 (м, 2H), 7,16 (д, J=1,2 Гц, 1H), 7,22 (д, J=8,1 Гц, 1H), 7,31 (т, J=8,1 Гц, 1H), 7,37 (д, J=8,1 Гц, 1H), 7,93 (д, J=8,8 Гц, 2H), 8,19 (д, J=7,6 Гц, 1H).
МС (ESI) 498 (M++1).
(Стадия 2) Синтез 4-(3,4-дегидро-1-((2-(2-метилфениламино)-6-бензоксазолил)ацетил)-(2S)-пирролидинилметокси)бензойной кислоты
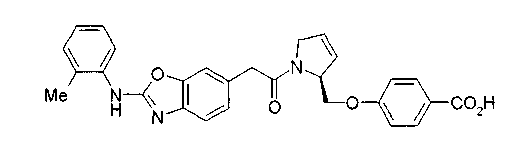
Метил-4-(3,4-дегидро-1-((2-(2-метилфениламино)-6-бензоксазолил)ацетил)-(2S)-пирролидинилметокси)бензоат (331 мг, 0,67 ммоль) растворяют в ТГФ (7,0 мл). К образовавшемуся раствору добавляют 0,25 н. NaOH (4,00 мл, 1,00 ммоль) с последующим перемешиванием при комнатной температуре в течение 6 часов. Реакционную смесь выливают в 1 н. HCl (10 мл). Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при пониженном давлении, получая при этом указанное в заголовке соединение (241 мг, 75%) в виде светло-желтого твердого вещества.
ИК (ATR) ν 3060, 2921, 1681, 1639, 1604, 1573, 1509, 1423 см-1;
1H-ЯМР (ДМСО-d6) δ: 2,29 (с, 3H), 3,71 (с, 2H), 4,23-4,25 (м, 2H), 4,33 (м, 1H), 4,22 (м, 1H), 5,18 (ушир.с, 1H), 5,96-6,02 (м, 2H), 6,96 (д, J=8,8 Гц, 2H), 7,02-7,09 (м, 2H), 7,21-7,23 (м, 3H), 7,30 (ушир.с, 1H), 7,79 (д, J=8,3 Гц, 1H), 7,85 (д, J=8,8 Гц, 2H), 9,63 (ушир.с, 1H).
МС (FAB) 484 (M++1);
Анал. Вычисл. для С28Н25FN3O5. 0,5H2О·C, 68,28; H, 5,32; N, 8,53.
Найдено: C, 68,03; H, 5,35; N, 8,42.
Пример 152
4-((3S)-Метокси-1-((2-(2-метилфениламино)-6-бензоксазолил)ацетил-(2R)-пирролидинилметокси)бензойная кислота:
(Стадия 1) Синтез метил-4-(1-(трет-бутоксикарбонил)-(3S)-метокси-(2R)-пирролидинилметокси)бензоата
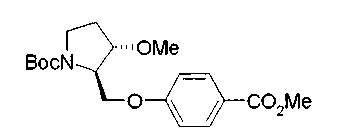
Метил-4-((3S)-гидрокси-(2R)-пирролидинилметокси)бензоат (501 мг, 1,43 ммоль) растворяют в ДМФ (7,5 мл). К образовавшемуся раствору добавляют по частям гидрид натрия (60% в масле, 68 мг, 1,71 ммоль) при перемешивании при 0°С. После перемешивания при 0°С в течение 30 минут добавляют метилиодид (0,27 мл, 4,28 ммоль). Образовавшуюся смесь перемешивают при такой же температуре в течение 1 часа. Добавляют насыщенный водный раствор хлорида аммония с последующей экстракцией этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси н-гексан-этилацетат (3:1, об./об.) метил-4-(1-(трет-бутоксикарбонил)-(3S)-метокси-(2R)-пирролидинилметокси)бензоат (569 мг, 100%) получают в виде желтого масла.
1H-ЯМР (CDCl3) δ: 1,48 (ушир.с, 9H), 1,95-2,19 (м, 2H), 3,34 (с, 3H), 3,38-3,54 (м, 2H), 3,89 (с, 3H), 3,93-4,30 (м, 4H), 6,96 (д, J=8,6 Гц, 2H), 7,98 (д, J=8,6 Гц, 2H).
(Стадия 2) Синтез метил-4-((3S)-метокси-(2R)-пирролидинилметокси)бензоата
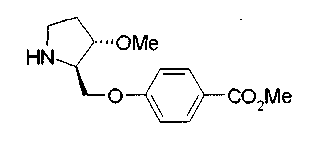
Метил-4-(1-(трет-бутоксикарбонил)-(3S)-метокси-(2R)-пирролидинилметокси)бензоат (569 мг, 1,56 ммоль) растворяют в метиленхлориде (10 мл). К образовавшемуся раствору добавляют трифторуксусную кислоту (5,0 мл) при перемешивании при 0°С. Образовавшуюся смесь перемешивают при комнатной температуре в течение 3 часов. Из реакционной смеси растворитель отгоняют при пониженном давлении. Остаток нейтрализуют насыщенным водным раствором бикарбоната натрия с последующей экстракцией хлороформом. Экстракт сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя, в результате чего метил-4-((3S)-метокси-(2R)-пирролидинилметокси)бензоат (356 мг, 86%) получают в виде желтого масла.
1H-ЯМР (CDCl3) δ: 1,86-2,01 (м, 3H), 3,02-3,15 (м, 2H), 3,35 (с, 3H), 3,45 (м, 1H), 3,81 (м, 1H), 3,88 (с, 3H), 3,95-4,02 (м, 2H), 6,92 (д, J=8,0 Гц, 2H), 7,98 (д, J=8,0 Гц, 2H).
(Стадия 3) Синтез метил-4-((3S)-метокси-1-((2-(2-метилфениламино)-6-бензоксазолилацетил-(2R)-пирролидинилметокси)бензоата
В ДМФ (7,0 мл) EDC·HCl (193 мг, 1,01 ммоль) добавляют к (2-(2-метилфениламино)-6-бензоксазолил)уксусной кислоте (189 мг, 0,67 ммоль), метил-4-((3S)-метокси-(2R)-пирролидинилметокси)бензоату (178 мг, 0,67 ммоль), HOBt (18,0 мг, 0,13 ммоль) и триэтиламину (0,14 мл, 1,01 ммоль) и образовавшуюся смесь перемешивают при комнатной температуре в течение 24 часов. Реакционную смесь разбавляют этилацетатом. Разбавленную смесь промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из этилацетатных элюатных фракций метил-4-((3S)-метокси-1-((2-(2-метилфениламино)-6-бензоксазолилацетил)-(2R)-пирролидинилметокси)бензоат (384 мг, 100%) получают в виде светло-желтого аморфного вещества.
1H-ЯМР (CDCl3) δ: 2,11 (м, 1H), 2,23 (м, 1H), 2,36 (с, 3H),
3,30 (с, 3H), 3,56-3,68 (м, 2H), 3,71 (с, 2H), 3,85 (с, 3H), 3,98 (м, 1H), 4,10 (дд, J=10,0, 6,8 Гц, 1H), 4,29 (дд, J=10,0, 3,2 Гц, 1H), 4,44 (м, 1H), 6,91 (д, J=9,0 Гц, 2H), 7,04-7,08 (м, 2H), 7,19 (д, J=2,2 Гц, 1H), 7,21 (м, 1H), 7,29 (м, 1H), 7,34 (д, J=7,9 Гц, 1H), 7,94 (д, J=9,0 Гц, 2H), 7,98 (д, J=8,1 Гц, 1H), 8,01 (ушир.с, 1H).
МС (ESI) m/z 530 (M++1).
(Стадия 4) Синтез 4-((3S)-метокси-1-((2-(2-метилфениламино)-6-бензоксазолил)ацетил-(2R)-пирролидинилметокси)бензойной кислоты
Метил-4-((3S)-метокси-1-((2-(2-метилфениламино)-6-бензоксазолилацетил)-(2R)-пирролидинилметокси)бензоат (384 мг, 0,73 ммоль) растворяют в ТГФ (7,5 мл). К образовавшемуся раствору добавляют 0,25 н. NaOH (4,40 мл, 1,09 ммоль) с последующим перемешиванием при комнатной температуре в течение 5 часов. Реакционную смесь выливают в 1 н. HCl (10 мл). Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при пониженном давлении, получая при этом указанное в заголовке соединение (300 мг, 80%) коричневого твердого вещества.
ИК (ATR) ν 2927, 1681, 1639, 1604, 1575, 1486, 1438 см-1;
1H-ЯМР (ДМСО-d6) δ: 2,08 (м, 1H), 2,22 (м, 1H), 2,30 (с, 3H), 3,22 (с, 3H), 3,60 (м, 1H), 3,67 (м, 1H), 3,73 (с, 2H), 3,91 (м, 1H), 3,97 (м, 1Н), 4,21-4,23 (м, 2H), 7,00-7,08 (м, 4H), 7,22-7,25 (м, 3H), 7,31 (ушир.с, 1H), 7,81 (д, J=8,3 Гц, 1H), 7,87 (д, J=8,6 Гц, 2H), 9,59 (ушир.с, 1H).
МС (FAB) m/z 516 (M++1);
Анал. Вычисл. для C29Н29N3О6.H2О·C, 65,28; H, 5,86; N, 7,88, Найдено: C, 65,57; H, 5,95; N, 7,87.
Пример 153
4-(1-(2-(2-Метилфениламино)-6-бензоксазолилацетил)-(4R)-тиазолидинилметокси)бензойная кислота:
(Стадия 1) Синтез метил-4-(1-(2-(2-метилфениламино)-6-бензоксазолилацетил)-(4R)-тиазолидинилметокси)бензоата
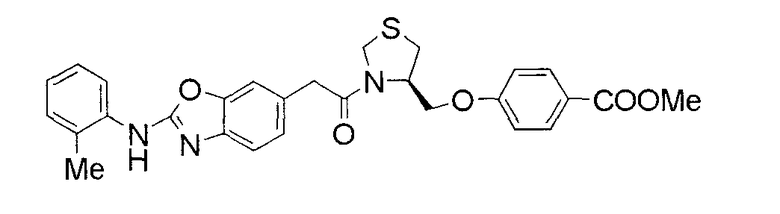
Метил-4-((4R)-тиазолидинилметокси)бензоат (354 мг, 1,4 ммоль) (2-(2-метилфениламино)-6-бензоксазолил)уксусную кислоту (395 мг, 1,4 ммоль), HOBt (189 мг, 1,4 ммоль) и триэтиламин (583 мкл, 4,2 ммоль) растворяют в метиленхлориде (15 мл). При перемешивании при 0°С добавляют EDC·HCl (403 мг, 2,1 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 16 часов. Из реакционной смеси растворитель отгоняют при пониженном давлении. К остатку добавляют воду с последующей экстракцией этилацетатом. Экстракт промывают последовательно насыщенным водным раствором бикарбоната натрия, 2 М водным раствором лимонной кислоты и насыщенным водным раствором бикарбоната натрия, сушат на безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси н-гексан-этилацетат (1:1, об./об.) метил-4-(1-(2-(2-метилфениламино)-6-бензоксазолилацетил)-(4R)-тиазолидинилметокси)бензоат (600 мг, 83%) получают в виде желтого масла.
1H-ЯМР (CDCl3) δ: 2,34 и 2,36 (общий 3H, каждый с), 3,05-3,18 (м, 2H), 3,80-4,94 (м, 10H), 6,81-7,41 (м, 9H), 7,97 (д, J=8,8 Гц, 2H), 8,06 (д, J=8,0 Гц, 1H).
(Стадия 2) Синтез 4-(1-(2-(2-метилфениламино)-6-бензоксазолилацетил)-(4R)-тиазолидинилметокси)бензойной кислоты
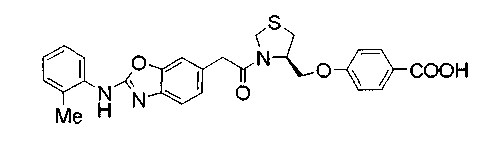
Метил-4-(1-(2-(2-метилфениламино)-6-бензоксазолилацетил)-(4R)-тиазолидинилметокси)бензоат (600 мг, 1,16 ммоль) растворяют в ТГФ (5,0 мл) и этаноле (3,0 мл). К образовавшемуся раствору добавляют 1 н. NaOH (1,5 мл, 1,5 ммоль). Образовавшуюся смесь перемешивают при 70°С в течение 18 часов. После охлаждения реакционную смесь перегоняют при пониженном давлении для удаления растворителя. Остаток подкисляют 1 н. HCl. Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при пониженном давлении, получая при этом указанное в заголовке соединение (560 мг, 96%) в виде белого кристаллического порошка.
ИК (KBr) v 2987, 2900, 1639, 1575, 1241, 754 см-1;
1H-ЯМР (ДМСО-d6) δ: 2,30 (с, 3H), 3,05-3,30 (м, 3H), 3,70-4,30 (м, 3H), 4,56-5,00 (м, 3H), 7,06-7,33 (м, 9H), 7,80-7,88 (м, 3H).
МС (FAB) m/z 504 (M++1);
Анал. Вычисл. для С27Н25N3O5S: С, 64,40; H, 5,00; N, 8,34; S, 6,37.
Найдено: C, 63,76; H, 4,98; N, 8,18; S, 6,17.
Пример 154
4-(2-((2-(2-Метилфениламино)-6-бензоксазолил)-N-метилацетамидо)этокси)бензойная кислота:
(Стадия 1) Синтез метил-4-(2-(N-метиламино)этокси)бензоата
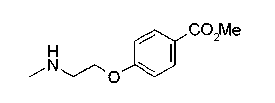
В ТГФ (100 мл) растворяют N-(трет-бутоксикарбонил)-2-метиламино)этанол (3,03 г, 17,3 ммоль). К образовавшемуся раствору добавляют метил-4-гидроксибензоат (2,77 г, 18,2 ммоль) и при перемешивании при 0°С в потоке газообразного азота добавляют трифенилфосфин (6,35 г, 24,2 ммоль) и DIAD (3,5 мл, 24,5 ммоль). Образовавшуюся смесь перемешивают далее при комнатной температуре в течение 18 часов. Из реакционной смеси растворитель отгоняют при пониженном давлении. К остатку добавляют воду с последующей экстракцией этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом магния и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси н-гексан-этилацетат (4:1, об./об.) метил-4-(2-(N-(трет-бутоксикарбонил)-N-метиламино)этокси)бензоат (4,09 г, 76%) получают в виде желтого масла. Образовавшееся соединение (933 м, 3,01 ммоль) растворяют в метиленхлориде (3 мл). К образовавшемуся раствору добавляют трифторуксусную кислоту (1 мл) при перемешивании при 0°С. Реакционную смесь перемешивают далее при комнатной температуре в течение 2 часов. Из реакционной смеси растворитель отгоняют при пониженном давлении. Остаток нейтрализуют насыщенным водным раствором бикарбоната натрия с последующей экстракцией смесью хлороформ-метанол (5:1, об./об.). Экстракт промывают насыщенным водным раствором бикарбоната натрия, сушат над безводным сульфатом магния и перегоняют при пониженном давлении для удаления растворителя, посредством чего метил-4-(2-(N-метиламино)этокси)бензоат (618 мг, 98%) получают в виде желтого масла.
1H-ЯМР (CDCl3) δ: 2,54 (с, 3H), 3,02 (дд, J=5,0 Гц, 2H), 3,88 (д, J=6,0 Гц, 3H), 4,14 (дд, J=5,0 Гц, 2H), 6,80 (д, J=8,8 Гц, 1H), 6,91 (д, J=9,0 Гц, 1H), 7,91 (д, J=9,0 Гц, 1H), 7,98 (д, J=8,8 Гц, 1H).
(Стадия 2) Синтез метил-4-(2-((2-(2-метилфениламино)-6-бензоксазолил)-N-метилацетамидо)этокси)бензоата
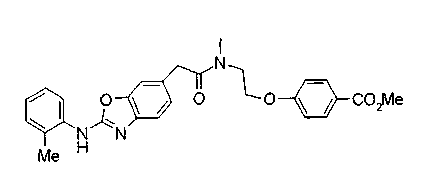
В ДМФ (6 мл) растворяют 2-(2-метилфениламино)-6-бензоксазолилуксусную кислоту (154 мг, 0,55 ммоль) и метил-4-(2-(N-метиламино)этокси)бензоат (117 мг, 0,55 ммоль). К образовавшемуся раствору добавляют EDC·HCl (157 мг, 0,81 ммоль), HOBt (5 мг, 0,04 ммоль) и DMAP (5 мг, 0,04 ммоль). Образовавшуюся смесь перемешивают при комнатной температуре в течение 18 часов. К реакционной смеси добавляют воду с последующей экстракцией этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом магния и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси хлороформ-метанол (10:1, об./об.) метил-4-(2-((2-(2-метилфениламино)-6-бензоксазолил)-N-метилацетамидо)этокси)бензоат (207 мг, 80%) получают в виде желтого масла.
ИК (ATR) ν 1710, 1631, 1573 см-1;
1H-ЯМР (CDCl3) δ: 2,36 (с, 3H), 3,16 (ряд д, J=2,4 Гц, общий 2H), 3,79 (м, 3H), 3,87 (д, J=2,4 Гц, 2H), 3,87 (д, J=2,4 Гц, 2H), 3,92 (м, 1H), 4,23 (ряд т, J=4,8 Гц, общий 1H), 6,87 (м, 2H), 7,07 (т, J=6,4 Гц, 1H), 7,22 (м, 1H), 7,30 (м, 1H), 7,37 (д, J=8,0 Гц, 1H), 7,95 (м, 2H), 8,04 (ушир., 2H), 8,07 (д, J=7,2 Гц, 1H).
МС(ESI) m/z 474 (M+H)+;
Анал. Вычисл. для С27Н27FN3O5·H2О: C, 65,98; H, 5,95; N, 8,55.
Найдено: C, 65,98; H, 5,73; N, 7,68.
(Стадия 3) Синтез 4-(2-((2-(2-метилфениламино)-6-бензоксазолил)-N-метилацетамино)этокси)бензойной кислоты
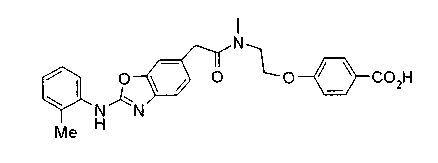
Метил-4-(2-((2-(2-метилфениламино)-6-бензоксазолил)-N-метилацетамино)этокси)бензоат (206,9 мг, 0,44 ммоль) растворяют в ТГФ (5 мл). К образовавшемуся раствору добавляют 0,25 н. NaOH (5 мл) и образовавшуюся смесь перемешивают при комнатной температуре в течение 2 часов. К реакционной смеси добавляют NaOH (500 мг) с последующим нагреванием при кипячении с обратным холодильником в течение 3 часов. После охлаждения реакционную смесь перегоняют при пониженном давлении для удаления растворителя. Остаток разбавляют смесью хлороформ-метанол (5:1, об./об.). Раствор промывают 1 н. HCl, сушат над безводным сульфатом магния и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси хлороформ-метанол (20:1, об.) указанное в заголовке соединение (101 мг, 51%) получают в виде светло-красного твердого вещества.
ИК (ATR) v 1683, 1637, 1604, 1573 см-1;
1H-ЯМР (CDCl3) δ: 2,34 (с, 3H), 3,47 (с, 2H), 3,71 (кв., J=7,2 Гц, 2H), 3,77 (с, 2H), 3,91 (м, 1H), 4,20 (м, 3H), 6,78 (д, J=8,0 Гц, 1H), 6,83 (д, J=8,8 Гц, 1H), 7,07 (м, 2H), 7,22 (м, 2H), 7,32 (м, 1H), 7,62 (м, 1H), 7,74 (д, J=8,0 Гц, 1H), 8,02 (т, J=9,2 Гц, 2H).
МС (ESI) m/z 460 (M+H)+;
Анал. Вычисл. для С26Н25FN3O5·H2О: C, 65,45; H, 5,70; N, 8,80.
Найдено: C, 65,35; H, 5,72; N, 8,25.
Пример 155
4-((4R)-Метокси-1-((2-(2-метилфениламино)-6-бензоксазолил)ацетил)-(3S)-пирролидинилокси)бензойная кислота:
(Стадия 1) Синтез 1-бензил-(3S,4S)-дигидрокси-2,5-диоксопирролидина
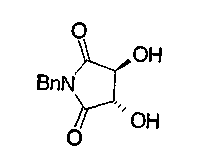
В ксилоле (500 мл) D-винную кислоту (25,0 г, 0,17 моль) и бензиламин (19,6 г, 0,18 ммоль) нагревают при кипячении с обратным холодильником в течение 18 часов с использованием отделителя воды Дина-Старка. После охлаждения реакционную смесь перегоняют при пониженном давлении для удаления растворителя, посредством чего 1-бензил-(3S,4S)-дигидрокси-2,5-диоксопирролидин (33,7 г, 90%) получают в виде коричневого твердого вещества.
ИК (KBr) v 3291, 1710, 1434 см-1;
1H-ЯМР (CD3OD) δ: 4,40 (с, 2H), 4,64 (с, 2H), 7,25-7,33 (м, 5H).
МС (FAB) m/z 222 (M++1).
(Стадия 2) Синтез 1-бензил-(3S,4R)-дигидроксипирролидина
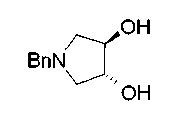
При перемешивании при 0°С 1-бензил-(3S,4S)-дигидрокси-2,5-диоксопирролидин (17,3 г, 78,3 ммоль) добавляют к суспензии литийалюминийгидрида (8,91 г, 235 ммоль) в ТГФ (500 мл). Реакционную смесь нагревают при кипячении с обратным холодильником в течение 18 часов. После охлаждения реакционной смеси до 0°С к ней добавляют этилацетат (50 мл). Образовавшуюся смесь перемешивают в течение 30 минут и затем добавляют ледяную воду. Реакционную смесь фильтруют через целит. Фильтрат сушат над безводным сульфатом магния и перегоняют при пониженном давлении для удаления растворителя, получая при этом 1-бензил-(3R,4R)-дигидроксипирролидин (9,60 г, 63%) в виде красного масла.
1H-ЯМР (CDCl3) δ: 2,45-2,47 (м, 2H), 2,94-2,98 (м, 2H), 3,63 (с, 2H), 4,08 (с, 2H), 7,24-7,33 (м, 5H).
МС (ESI) m/z 194 (M++1).
(Стадия 3) Синтез 1-(трет-бутоксикарбонил)-(3R,4R)-дигидроксипирролидина
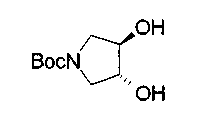
В этилацетате (400 мл), 5% палладий на угле (влажн. 53,1%, 4,20 г) добавляют к 1-бензил-(3R,4R)-дигидроксипирролидину (9,60 г, 49,7 ммоль) и ди-трет-бутилдикарбонату (10,8 г, 49,7 ммоль) и образовавшуюся смесь подвергают каталитическому гидрированию при комнатной температуре и нормальном давлении в течение 14 часов. Из реакционной смеси катализатор отфильтровывают и фильтрат перегоняют при пониженном давлении для удаления растворителя, посредством чего 1-(трет-бутоксикарбонил)-(3R,4R)- дигидроксипирролидин (5,64 г, 35%) получают в виде бесцветного твердого вещества.
1H-ЯМР (CDCl3) δ: 1,39 (с, 9H), 3,11 (дд, J=ll,3, 3,4 Гц, 2H), 3,34-3,38 (м, 2H), 3,86-3,87 (м, 2H), 5,03-5,04 (м, 2H).
МС (ESI) m/z 189 (M++1-CH3).
(Стадия 4) Синтез 1-(трет-бутоксикарбонил)-(4R)-(трет-бутилдиметилсилилокси)-(3R)-гидроксипирролидина
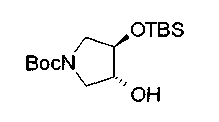
К раствору 1-(трет-бутоксикарбонил)-(3R,4R)-дигидроксипирролидина (5,64 г, 27,8 ммоль) в ТГФ (50 мл) добавляют по частям гидрид натрия (60% в масле, 1,10 г, 27,5 ммоль) при перемешивании при 0°С. Реакционную смесь перемешивают при комнатной температуре в течение 4 часов. К реакционной смеси добавляют трет-бутилдиметилсилилхлорид (TBSCl) (4,15 г, 27,5 ммоль) с последующим перемешиванием в течение 3 часов. К реакционной смеси добавляют насыщенный водный раствор хлорида аммония с последующей экстракцией этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси н-гексан-этилацетат (2:1, об./об.) 1-(трет-бутоксикарбонил)-(4R)-(трет-бутилдиметилсилилокси)-(3R)-гидроксипирролидин (5,27 г, 60%) получают в виде бесцветного масла.
1H-ЯМР (CDCl3) δ: 0,07 (с, 3H), 0,08 (с, 3H), 0,87 (с, 9H), 1,46 (с, 9H), 3,20-3,36 (м, 2H), 3,52-3,65 (м, 2H), 4,06-4,12 (м, 2H).
МС (ESI) m/z 318 (M++1).
(Стадия 5) Синтез метил-4-(1-(трет-бутоксикарбонил)-(4R)-(трет-бутилдиметилсилилокси)-(3S)-пирролидинилокси)бензоата
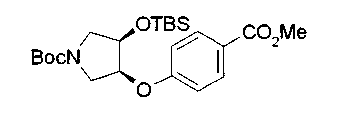
В ТГФ (15 мл), DIAD (3,60 мл, 18,3 ммоль) добавляют к 1-(трет-бутоксикарбонил)-(4R)-(трет-бутилдиметилсилилокси)-(3R)-гидроксипирролидину (5,27 г, 16,6 ммоль), метил-4-гидроксибензоату (2,53 г, 16,6 ммоль) и трифенилфосфину (4,79 г, 18,3 ммоль) и образовавшуюся смесь нагревают при кипячении с обратным холодильником в течение 6 часов. Реакционную смесь охлаждают до комнатной температуры и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси н-гексан-этилацетат (5:1, об./об.) метил-4-(1-(трет-бутоксикарбонил)-(4R)-(трет-бутилдиметилсилилокси)-(3S)-пирролидинилокси)бензоат и небольшое количество метил-4-гидроксибензоата получают в виде желтого масла.
1H-ЯМР (CDCl3) δ: -0,05 (с, 3H), 0,03 (с, 3H), 0,81 (с, 9H), 1,47 (с, 9H), 3,38 (м, 1H), 3,48-3,64 (м, 2H), 3,72 (м, 1H), 3,89 (с, 3H), 4,43 (м, 1H), 4,72 (м, 1H), 6,92 (д, J=8,8 Гц, 2H), 7,97 (д, J=8,8 Гц, 2H).
МС (ESI) m/z 437 (M++1-CH3).
(Стадия 6) Синтез метил-4-(1-(трет-бутоксикарбонил)-(4R)- гидрокси-(3S)-пирролидинилокси)бензоата
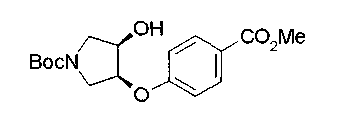
К вышеописанному метил-4-(1-(трет-бутоксикарбонил)-(4R)-(трет-бутилдиметилсилилокси)-(3S)-пирролидинилокси)бензоату и небольшому количеству метил-4-гидроксибензоата (всего 4,75 г) добавляют смесь уксусная кислота-вода-ТГФ (3:1:1, об./об., 50 мл). Образовавшуюся смесь перемешивают при комнатной температуре в течение 23 часов. Реакционную смесь нейтрализуют насыщенным водным раствором бикарбоната натрия с последующей экстракцией этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси н-гексан-этилацетат (1:1, об./об.) метил-4-(1-(трет-бутоксикарбонил)-(4R)-гидрокси-(3S)-пирролидинилокси)бензоат (3,86 г, 71% для двух стадий) получают в виде бесцветного масла.
1H-ЯМР (CDCl3) δ: 1,45 (ушир.с, 9H), 2,45 (м, 1H), 3,39-3,58 (м, 2H), 3,68-3,82 (м, 2H), 3,90 (с, 3H), 4,49 (м, 1H), 4,80 (м, 1H), 6,96 (д, J=8,1 Гц, 2H), 8,00-8,03 (м, 2H).
МС (ESI) m/z 323 (M++1-CH3).
(Стадия 7) Синтез метил-4-(1-(трет-бутоксикарбонил)-(4R)-метокси-(3S)-пирролидинилокси)бензоата
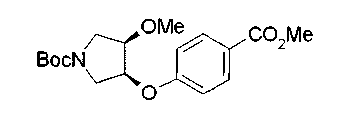
В ТГФ (10 мл) гидрид натрия (60% в масле, 72,0 мг, 1,79 ммоль) добавляют по частям к метил-4-(1-(трет-бутоксикарбонил)-(4R)-гидрокси-(3S)-пирролидинилокси)бензоату (505 мг, 1,50 ммоль) и метилиодиду (0,30 мл, 1,79 ммоль) при перемешивании при 0°С. Образовавшуюся смесь перемешивают далее при такой же температуре в течение 2 часов. К реакционной смеси добавляют насыщенный водный раствор хлорида аммония с последующей экстракцией этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси н-гексан-этилацетат (3:1, об./об.) метил-4-(1-(трет-бутоксикарбонил)-(4R)-метокси-(3S)-пирролидинилокси)бензоат (657 мг, 100%) получают в виде бесцветного масла.
1H-ЯМР (CDCl3) δ: 1,45 (ушир.с, 9H), 3,41 (с, 3H), 3,44-3,72 (м, 4H), 3,89 (с, 3H), 4,04 (м, 1H), 4,87 (м, 1H), 6,96 (д, J=8,0 Гц, 2H), 7,98-8,00 (м, 2H).
(Стадия 8) Синтез метил-4-((4R)-метокси-(3S)-пирролидинилокси)бензоата
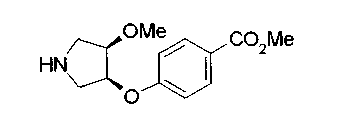
Метил-4-(1-(трет-бутоксикарбонил)-(4R)-метокси-(3S)-пирролидинилокси)бензоат (601 мг, 1,71 ммоль) растворяют в метиленхлориде (10 мл). К образовавшемуся раствору добавляют трифторуксусную кислоту (5 мл) при перемешивании при 0°С. Реакционную смесь перемешивают далее в течение 2,5 часа при комнатной температуре. Из реакционной смеси растворитель отгоняют при пониженном давлении. Остаток нейтрализуют насыщенным водным раствором бикарбоната натрия с последующей экстракцией хлороформом. Экстракт сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя, посредством чего метил-4-((4R)-метокси-(3S)-пирролидинилокси)бензоат (339 мг, 79%) получают в виде желтого масла.
1H-ЯМР (CDCl3) δ: 3,11-3,20 (м, 3H), 3,28 (дд, J=12,5, 5, 6 Гц, 1H), 3,38 (с, 3H), 3,89 (с, 3H), 3,99 (м, 1H), 4,79 (м, 1H), 6,96 (д, J=8,5 Гц, 2H), 7,98 (д, J=8,5 Гц, 2H).
(Стадия 9) Синтез метил-4-((4R)-метокси-1-((2-(2-метилфениламино)-6-бензоксазолил)ацетил)-(3S)-пирролидинилокси)бензоата
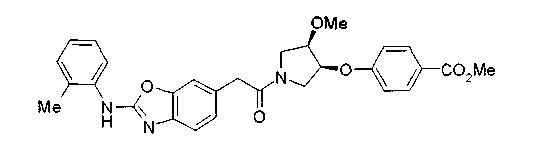
В ДМФ (5,0 мл) EDC·HCl (192 мг, 1,00 ммоль) добавляют к (2-(2-метилфениламино)-6-бензоксазолил)уксусной кислоте (189 мг, 0,67 ммоль), метил-4-((4R)-метокси-(3S)-пирролидинилокси)бензоату (168 мг, 0,67 ммоль), HOBt (18,0 мг, 0,13 ммоль) и триметиламину (0,14 мл, 1,00 ммоль) и образовавшуюся смесь перемешивают при комнатной температуре в течение 24 часов. К реакционной смеси добавляют воду с последующей экстракцией этилацетатом. Экстракт сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из этилацетатных элюатных фракций метил-4-((4R)-метокси-1-((2-(2-метилфениламино)-6-бензоксазолил)ацетил)-(3S)-пирролидинилокси)бензоат (345 мг, 100%) получают в виде желтого масла.
1H-ЯМР (CDCl3) δ: 2,34 (с, 3H), 3,36 (с, 3H), 3,54-3,81 (м, 6H), 3,84 и 3,87 (каждый с, общий 3H), 4,05 (м, 1H), 4,88 (м, 1H), 6,88-6,93 (м, 2H), 7,02-7,08 (м, 4H), 7,20-7,37 (м, 4H), 7,90-7,99 (м, 4H).
МС (ESI) m/z 516 (M++1).
(Стадия 10) Синтез 4-((4R)-метокси-1-((2-(2-метилфениламино)-6-бензоксазолил)ацетил)-(3S)-пирролидинилокси)бензойной кислоты
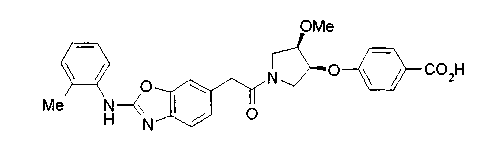
Метил-4-((4R)-метокси-1-((2-(2-метилфениламино)-6-бензоксазолил)ацетил)-(3S)-пирролидинилокси)бензоат (345 мг, 0,67 ммоль) растворяют в ТГФ (7,0 мл). К образовавшемуся раствору добавляют 0,25 н. NaOH (4,01 мл, 1,00 ммоль). Образовавшуюся смесь перемешивают при комнатной температуре в течение 7 часов. Реакционную смесь выливают в 1 н. HCl (3,0 мл). Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при пониженном давлении, получая при этом указанное в заголовке соединение (218 мг, 65%) в виде бесцветного твердого вещества.
ИК (ATR) ν 2935, 1683, 1639, 1602, 1575, 1508, 1440 см-1;
1H-ЯМР (ДМСО-d6) δ: 2,30 (с, 3H), 3,52 и 3,28 (каждый с, общий 3H), 3,41-3,65 (м, 2H), 3,68 и 3,71 (каждый с, общий 2H), 3,79-3,99 (м, 2H), 4,12 и 4,19 (каждый м, общий 1H), 5,11 и 5,17 (каждый м, общий 1H), 7,03-7,11 (м, 4H), 7,22-7,28 (м, 3H), 7,31 (д, J=8,8 Гц, 1H), 7,79 (д, J-7,9 Гц, 1H), 7,88 (д, J=8,8 Гц, 2H), 9,85 (ушир.с, 1H).
МС (FAB) m/z 502 (M++1);
Анал. Вычисл. для C28H27N3О6·1,5H2О: C, 63,63; H, 5,72; N, 7,95.
Найдено: C, 63,69; H, 5,55; N, 8,01.
Пример 156
транс-4-(1-((2-(5-Фтор-2-метилфениламино)-7-фтор-6-бензоксазолил)ацетил)-(2S)-метоксиметил-(4R)-пирролидинилокси)циклогексанкарбоновая кислота:
(Стадия 1) Синтез 1-трет-бутоксикарбонил-(2S)-трет-бутилдифенилсилилоксиметил-(4S)-(4-нитробензоилокси)пирролидина

В ТГФ (300 мл) DIAD (4,35 мл, 23,0 ммоль) добавляют к 1-трет-бутоксикарбонил-(2S)-трет-бутилдифенилсилилоксиметил-(4R)-гидроксипирролидину (10,51 г, 23,0 ммоль), 4-нитробензойной кислоте (3,85 г, 23,0 ммоль) и трифенилфосфину (6,03 г, 23,0 ммоль) и образовавшуюся смесь перемешивают при комнатной температуре в течение 2 часов. Из реакционной смеси растворитель отгоняют при пониженном давлении. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси н-гексан/этилацетат (5/1) 1-трет-бутоксикарбонил-(2S)-трет-бутилдифенилсилилоксиметил-(4S)-(4-нитробензоилокси)пирролидин (15,39 г, 100%) получают в виде бесцветного аморфного вещества.
1H-ЯМР (CDCl3) δ: 1,02 (с, 9H), 1,36 и 1,45 (каждый с, общий 9H, амидные изомеры), 2,39-2,64 (м, 2H), 3,44-3,78 (м, 2H), 3,87 (дд, J=13,0, 5,4 Гц, 1H), 3,98-4,24 (м, 2H), 5,56 (ушир., 1H), 7,26 (м, 2H), 7,28-7,41 (м, 4H), 7,51-7,65 (м, 4H), 8,01 (д, J=8,1 Гц, 2H), 8,16 (д, J=7,8 Гц, 2H).
МС (ESI) m/z 606 (M++1).
(Стадия 2) Синтез 1-трет-бутоксикарбонил-(4S)-гидрокси-(2S)-(4-нитробензоилоксиметил)пирролидина
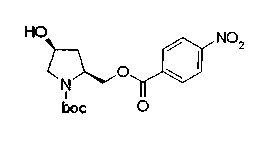
В ТГФ (500 мл) растворяют 1-трет-бутоксикарбонил-(2S)-трет-бутилдифенилсилилоксиметил-(4S)-(4-нитробензоилокси)пирролидин (15,4 г, 24,5 ммоль). К образовавшемуся раствору добавляют раствор 1,0 М хлорид тетрабутиламмония - ТГФ (25,4 мл, 25,4 ммоль) при перемешивании при 0°С. Температуру реакционной смеси постепенно повышают опять до комнатной температуры, при которой перемешивание проводят в течение 14 часов. К реакционной смеси добавляют воду с последующей экстракцией этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси н-гексан/этилацетат (2/1) и хлороформ/ацетон 1-трет-бутоксикарбонил-(4S)-гидрокси-(2S)-(4-нитробензоилоксиметил)пирролидин (2,53 г, 27,2%) получают в виде бесцветного масла.
1H-ЯМР (CDCl3) δ: 1,45 (с, 9H), 1,90-2,16 (м, 2H), 2,24 (м, 1H), 3,42 (д, J=12,2 Гц, 1H), 3,68-3,80 (м, 1H), 4,22 и 4,36 (каждый ушир., общий 1H, амидные изомеры), 4,51-4,72 (м, 3H), 8,23-8,29 (м, 4H).
МС (ESI) m/z 367 (M++1).
(Стадия 3) Синтез этил-4-(1-трет-бутоксикарбонил-(2S)-(4-нитробензоилоксиметил)-(4R)-пирролидинилокси)бензоата
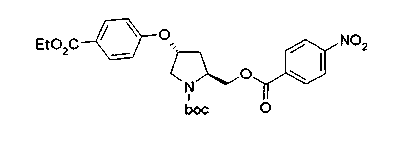
В ТГФ (100 мл) DIAD (1,36 мл, 6,91 ммоль) добавляют к 1-трет-бутоксикарбонил-(4S)-гидрокси-(2S)-(4-нитробензоилоксиметил)пирролидину (2,53 г, 6,91 ммоль), этил-4-гидроксибензоату (1,15 г, 6,91 ммоль) и трифенилфосфину (1,81 г, 6,91 ммоль) и образовавшуюся смесь перемешивают при комнатной температуре в течение 14 часов. Реакционную смесь перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем и собирают элюатные фракции смеси хлороформ/этилацетат (5/1) с последующей флэш-хроматографией на колонке с силикагелем ((4×40 см, хлороформ/этилацетат (5/1)), получая при этом этил-4-(1-трет-бутоксикарбонил-(2S)-(4-нитробензоилоксиметил)-(4R)-пирролидинилокси)бензоат (2,55 г, 72%) в виде бесцветного масла
1H-ЯМР (CDCl3) δ: 1,38 (дт, J=7,1, 2,0 Гц, 3H), 1,56 (с, 9H), 2,12-2,32 (м, 2H), 2,44 (м, 1H), 3,60 (дд, J=12,2, 4,4 Гц, 1H), 3,83 и 3,99 (каждый ушир., общий 1H, амидные изомеры), 4,35 (дкв., J=7,1, 2,0 Гц, 2H), 4,41-4,62 (м, 2H), 4,96 (с, 1H), 6,86 (д, J=6,8 Гц, 2H), 7,99 (д, J=7,3 Гц, 2H), 8,19 (д, J=7,3 Гц, 2H), 8,27 (д, J=8,3 Гц, 1H), 8,28 (д, J=7,3 Гц, 1H).
МС (ESI) m/z 515 (M++1).
(Стадия 4) Синтез этил-4-(1-трет-бутоксикарбонил-(2S)-гидроксиметил-(4R)-пирролидинилокси)бензоата
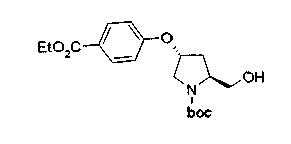
В этаноле (100 мл) карбонат калия (685 мг, 4,96 ммоль) добавляют к этил-4-(1-трет-бутоксикарбонил-(2S)-(4-нитробензоилоксиметил)-(4R)-пирролидинилокси)бензоату (2,55 г, 4,96 ммоль) и образовавшуюся смесь перемешивают при комнатной температуре в течение 24 часов. Из реакционной смеси растворитель отгоняют при пониженном давлении. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси хлороформ/этилацетат (5/1) этил-4-(1-трет-бутоксикарбонил-(2S)-гидроксиметил-(4R)-пирролидинилокси)бензоат (1,36 г, 75%) получают в виде бесцветного масла.
1H-ЯМР (CDCl3) δ: 1,38 (т, J=7,1 Гц, 3H), 1,46 (с, 9H), 1,89 (ушир., 1H), 2,34 (м, 1H), 3,58-3,97 (м, 4H), 4,05-4,26 (м, 1H), 4,35 (кв., J=7,1 Гц, 2H), 4,69 и 4,88 (каждый ушир., общий 1H, амидные изомеры), 6,87 (д, J=8,8 Гц, 2H), 8,00 (д, J=8,5 Гц, 2H).
МС (ESI) m/z 366 (M++1).
(Стадия 5) Синтез гидрохлорида этил-((2S)-гидроксиметил-(4R)-пирролидинилокси)бензоата
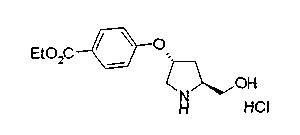
Этил-4-(1-трет-бутоксикарбонил-(2S)-гидроксиметил-(4R)-пирролидинилокси)бензоат (1,36 г, 3,72 ммоль) растворяют в диоксане (50 мл). К образовавшемуся раствору добавляют раствор 4 н. HCl/диоксан (30 мл) и смесь перемешивают при комнатной температуре в течение 3,5 часа. Реакционную смесь перегоняют при пониженном давлении для удаления растворителя, в результате чего гидрохлорид этил-4-((2S)-гидроксиметил-(4R)-пирролидинилокси)бензоата (1,21 г, 100%) получают в виде коричневого масла. Образовавшееся соединение применяют для следующей реакции без дополнительной очистки.
(Стадия 6) Синтез гидрохлорида этил-4-((2S)-гидроксиметил-(4R)-пирролидинилокси)циклогексанкарбоксилата
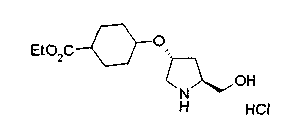
В этаноле (30 мл) гидрохлорид этил-4-((2S)-гидроксиметил-(4R)-пирролидинилокси)бензоата (1,21 г, 3,72 ммоль) и родий на оксиде алюминия (1,2 г) подвергают каталитическому гидрированию при комнатной температуре в течение 3 дней при давлении газообразного водорода 4 кг/см2. Из реакционной смеси катализатор отфильтровывают и фильтрат перегоняют при пониженном давлении для удаления растворителя, в результате чего гидрохлорид этил-4-((2S)-гидроксиметил-(4R)-пирролидинилокси)циклогексанкарбоксилата получают в виде масла. Образовавшееся соединение применяют для следующей реакции без дополнительной очистки.
(Стадия 7) Синтез этил-4-(1-трет-бутоксикарбонил-(2S)-гидроксиметил-(4R)-пирролидинилокси)циклогексанкарбоксилата
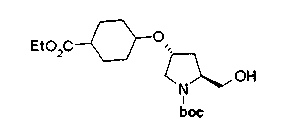
В диоксане (30 мл) ди-трет-бутилдикарбонат (812 мг, 3,72 ммоль) добавляют к гидрохлориду этил-4-((2S)-гидроксиметил-(4R)-пирролидинилокси)циклогексанкарбоксилата (3,72 ммоль) и насыщенному водному раствору бикарбоната натрия (10 мл) и образовавшуюся смесь перемешивают при комнатной температуре в течение 2 дней. К реакционной смеси добавляют этилацетат.Образовавшуюся смесь промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя, в результате чего получают этил-4-(1-трет-бутоксикарбонил-(2S)-гидроксиметил-(4R)-пирролидинилокси)циклогексанкарбоксилат (1,28 г, 93% (3 стадии)) в виде коричневого масла. Образовавшееся соединение применяют для следующей реакции без дополнительной очистки.
(Стадия 8) Синтез метил-транс-4-(1-трет-бутоксикарбонил-(2S)-бензилоксиметоксиметил-(4R)-пирролидинилокси)циклогексанкарбоксилата
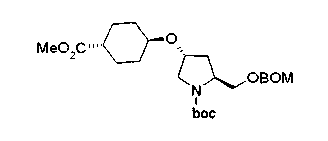
Этил-4-(1-трет-бутоксикарбонил-(2S)-гидроксиметил-(4R)-пирролидинилокси)циклогексанкарбоксилат (1,28 г, 3,45 ммоль) растворяют в метиленхлориде (30 мл). К образовавшемуся раствору добавляют N,N-диизопропилэтиламин (1,20 мл, 6,90 ммоль) и бензилоксикарбонилхлорид (BOMCl) (0,72 мл, 5,18 ммоль). Образовавшуюся смесь перемешивают при комнатной температуре в течение 14 часов в потоке газообразного азота. Реакционную смесь выливают в воду с последующей экстракцией метиленхлоридом. Экстракт промывают 1 н. HCl и насыщенным водным раствором бикарбоната натрия, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси н-гексан/этилацетат (2/1) этил-4-(1-трет-бутоксикарбонил-(2S)-бензилоксиметилоксиметил-(4R)-пирролидинилокси)циклогексанкарбоксилат (1,02 г, 60%) получают в виде бесцветного масла. Образовавшееся соединение изомеризуют в следующей стадии.
В этаноле этоксид натрия (1,41 г, 20,7 ммоль) добавляют к этил-4-(1-трет-бутоксикарбонил-(2S)-бензилоксиметилоксиметил-(4R)-пирролидинилокси)циклогексанкарбоксилату (1,02 г, 2,07 ммоль). Образовавшуюся смесь нагревают при кипячении с обратным холодильником в течение 13 часов. После охлаждения реакционной смеси до комнатной температуры растворитель отгоняют при пониженном давлении. Остаток подкисляют 1 н. HCl с последующей экстракцией этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток растворяют в смеси метанол/толуол (1:10, 22 мл). К образовавшемуся раствору добавляют 2,0 М раствор в гексане (1,04 мл, 2,07 ммоль) триметилсилилдиазометана. Образовавшуюся смесь перемешивают при комнатной температуре в течение 5 часов. Реакционную смесь перегоняют при пониженном давлении для удаления растворителя. Остаток очищают флэш-хроматографией на колонке с силикагелем ((3×30 см, элюирование смесью н-гексан/этилацетат (10/1)) и хроматографией с использованием тонкослойной пластины силикагеля (ТСХ) (проявление в смеси н-гексан/этилацетат (10/1)), получая при этом метил-транс-4-(1-трет-бутоксикарбонил-(2S)-бензилоксиметилоксиметил-(4R)-пирролидинилокси)циклогексанкарбоксилат (326 мг, 33% (2 стадии) в виде бесцветного масла
1H-ЯМР (CDCl3) δ: 1,20-1,30 (м, 3H), 1,39-1,51 (м, 11H), 1,92-2,22 (м, 6H), 2,25 (tt, J=11,8, 2,9 Гц, 1H), 3,24 (тт, J=10,3, 3,7 Гц, 1H), 3,30-3,64 (м, 2H), 3,66 (с, 3H), 3,75 (ушир., 1H), 4,02 и 4,09 (каждый ушир., общий 1H, амидные изомеры), 4,21 (ушир., 1H), 4,58 (с, 2H), 4,73 (д, J=4,6 Гц, 2H), 7,29 (м, 1Н), 7,33 (с, 2H), 7,34 (с, 2H).
МС (ESI) m/z 478 (M++1).
(Стадия 9) Синтез метил-транс-4-(1-трет-бутоксикарбонил-(2S)-гидроксиметил-(4R)-пирролидинилокси)циклогексанкарбоксилата
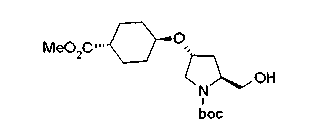
В метаноле (10 мл) метил-транс-4-(1-трет-бутоксикарбонил-(2S)-бензилоксиметилоксиметил-(4R)-пирролидинилокси)циклогексанкарбоксилат (326 мг, 0,683 ммоль) и 5% палладий на угле (влажн.) (326 мг) подвергают каталитическому гидрированию при комнатной температуре в течение 14 часов. Из реакционной смеси катализатор отфильтровывают и фильтрат перегоняют при пониженном давлении для удаления растворителя, получая при этом метил-транс-4-(1-трет-бутоксикарбонил-(2S)-гидроксиметил-(4R)-пирролидинилокси)циклогексанкарбоксилат (247 мг, 100%) в виде бесцветного масла. Образовавшееся соединение применяют для следующей реакции без дополнительной очистки.
1H-ЯМР (CDCl3) δ: 1,21-1,33 (м, 3H), 1,39 (м, 1H), 1,47 (с, 9H), 1,61-1,71 (м, 1H), 1,95-2,10 (м, 5H), 2,26 (м, 1H), 3,24 (м, 1H), 3,33-3,51 (м, 2H), 3,53 и 3,56 (каждый д, J=6,8 и 7,1 Гц соответственно, общий 1H, амидные изомеры), 3,66 (с, 3H), 3,68 (м, 1H), 4,09 (ушир., 2H).
МС (ESI) m/z 358 (M++1).
(Стадия 10) Синтез метил-транс-4-(1-трет-бутоксикарбонил-(2S)-метоксиметил-(4R)-пирролидинилокси)циклогексанкарбоксилата
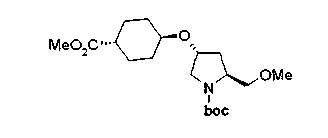
Метил-транс-4-(1-трет-бутоксикарбонил-(2S)-гидроксиметил-(4R)-пирролидинилокси)циклогексанкарбоксилат (247 мг, 0,683 ммоль) растворяют в ДМФ (5 мл). К образовавшемуся раствору по частям добавляют гидрид натрия (60% в масле, 55 мг, 1,37 ммоль) при перемешивании при 0°С в потоке газообразного азота. После перемешивания реакционной смеси при такой же температуре в течение 30 минут к ней добавляют метилиодид (85 мкл, 1,37 ммоль). Перемешивание проводят дополнительно при такой же температуре в течение 4 часов. Добавляют гидрид натрия (60% в масле, 55 мг, 1,37 ммоль) и метилиодид (85 мкл, 1,37 ммоль) и смесь перемешивают при комнатной температуре в течение 14 часов. Реакционную смесь выливают в воду с последующей экстракцией хлороформом. Экстракт промывают насыщенным водным раствором бикарбоната натрия и насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси н-гексан/этилацетат (2/1) транс-4-(1-трет-бутоксикарбонил-(2S)-метоксиметил-(4R)-пирролидинилокси)циклогексанкарбоксилат (260 мг, 100%) получают в виде бесцветного масла.
1H-ЯМР (CDCl3) δ: 1,20-1,32 (м, 3H), 1,39-1,52 (м, 10H), 1,91-2,13 (м, 6H), 2,21-2,29 (м, 1H), 3,25 (м, 1H), 3,34 (с, 3H), 3,37-3,53 (м, 4H), 3,66 (с, 3H), 3,79 и 4,05 (каждый ушир., общий 1H, амидные изомеры), 4,14 и 4,21 (каждый ушир., общий 1H, амидные изомеры).
МС (ESI) m/z 372 (M++1).
(Стадия 11) Синтез метил-транс-4-((2S)-метоксиметил-(4R)-пирролидинилокси)циклогексанкарбоксилата
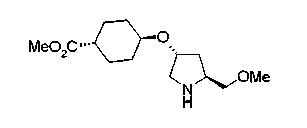
Метил-транс-4-(1-трет-бутоксикарбонил-(2S)-метоксиметил-(4R)-пирролидинилокси)циклогексанкарбоксилат (260 мг, 0,70 ммоль) растворяют в метиленхлориде (10 мл). К образовавшемуся раствору добавляют трифторуксусную кислоту (2 мл) и смесь перемешивают при комнатной температуре в течение 14 часов. Из реакционной смеси растворитель отгоняют при пониженном давлении. Остаток делают основным 1 н. NaOH с последующей экстракцией метиленхлоридом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя, посредством чего метил-транс-4-((2S)-метоксиметил-(4R)-пирролидинилокси)циклогексанкарбоксилат (150 мг, 81%) получают в виде желтого масла.
1H-ЯМР (CDCl3) δ: 1,21-2,39 (м, 11H), 2,87 (дд, J=11,5,3,2 Гц, 1H), 3,05 (дд, J=11,5, 4,9 Гц, 1H), 3,20-3,34 (м, 2H), 3,35 (с, 3H), 3,48 (м, 2H), 3,66 (с, 3H), 4,07 и 4,14 (каждый ушир., общий 1H, амидные изомеры).
МС (ESI) m/z 272 (M++1).
(Стадия 12) Синтез метил-транс-4-(1-((2-(5-Фтор-2-метилфениламино)-7-фтор-6-бензоксазолил)ацетил)-(2S)-метоксиметил-(4R)-пирролидинилокси)циклогексанкарбоксилата
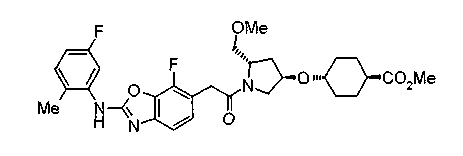
В ДМФ (2 мл) (2-(5-фтор-2-метилфениламино)-7-фтор-6-бензоксазолил)уксусную кислоту (59 мг, 0,184 ммоль), метил-транс-4-((2S)-метоксиметил-(4R)-пирролидинилокси)циклогексанкарбоксилат (50 мг, 0,184 ммоль), EDC·HCl (53 мг, 0,276 ммоль), HOBt (37 мг, 0,276 ммоль) и триэтиламин (128 мкл, 0,920 ммоль) перемешивают при комнатной температуре в течение 3 дней. К реакционной смеси добавляют воду с последующей экстракцией этилацетатом. Экстракт промывают насыщенным раствором соли и нагревают при кипячении с обратным холодильником над безводным сульфатом натрия. После охлаждения реакционную смесь перегоняют при пониженном давлении для удаления растворителя. Остаток очищают колоночной хроматографией с использованием тонкослойной пластины силикагеля (элюент хлороформ/ацетон (7/1)), получая при этом метил-транс-4-(1-((2-(5-фтор-2-метилфениламино)-7-фтор-6-бензоксазолил)ацетил)-(2S)-метоксиметил-(4R)-пирролидинилокси)циклогексанкарбоксилат (99 мг, 94%) в виде желтого масла.
1H-ЯМР (CDCl3) δ: 1,17-1,58 (м, 4H), 1,91-2,29 (м, 6H), 2,30 (с, 3H), 3,24 (м, 1H), 3,31 и 3,36 (каждый с, общий 3H, амидные изомеры), 3,38-3,53 (м, 3H), 3,65 и 3,66 (с, 3H), 3,67-3,70 (м, 1H), 3,72 (с, 2H), 3,81-3,92 (м, 1H), 4,35-4,39 (м, 2H), 6,74 (дт, J=8,1, 2,2 Гц, 1H), 7,09-7,16 (м, 2H), 7,22 (д, J=8,1 Гц, 1H), 8,06 (дд, J=11,0, 2,4 Гц, 1H).
МС (ESI) m/z 572 (M++1).
(Стадия 13) Синтез транс-4-(1-((2-(5-Фтор-2-метилфениламино)-7-фтор-6-бензоксазолил)ацетил)-(2S)-метоксиметил-(4R)-пирролидинилокси)циклогексанкарбоновой кислоты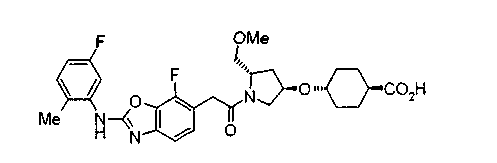
Метил-транс-4-(1-((2-(5-фтор-2-метилфениламино)-7-фтор-6-бензоксазолил)ацетил)-(2S)-метоксиметил-(4R)-пирролидинилокси)циклогексанкарбоксилат (99 мг, 0,173 ммоль) растворяют в смеси ТГФ/метанол (4/2 мл). К образовавшемуся раствору добавляют 1 н. NaOH (2 мл). После перемешивания при комнатной температуре в течение 13 часов реакционную смесь перегоняют при пониженном давлении для удаления растворителя. К остатку добавляют 1 н. HCl. Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при пониженном давлении. Сырые кристаллы очищают колоночной хроматографией с использованием тонкослойной пластины силикагеля (ТСХ) (проявляющий раствор хлороформ/метанол (20/1)), получая при этом указанное в заголовке соединение (61 мг, 63%) в виде бесцветного твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 1,12-1,41 (м, 5H), 1,86-2,20 (м, 6H), (с, 3H), 3,23 (с, 3H), 3,38-3,98 (м, 1Н), 4,09 и 4,31 (каждый м, общий 2H, амидные изомеры), 6,89(дт, J=8,3, 2,9 Гц, 1H), 7,09 (д, J=7,8 Гц, 1H), 7,19 и 7,20 (каждый д, каждый J=8,1 Гц, общий 1H, амидные изомеры), 7,26 (т, J=7,8 Гц, 1H), 7,89-7,93 (м, 1H), 10,05 (ушир., 1H), 12,06 (ушир., 1H).
МС (ESI) m/z 558 (M++1).
Пример 157
транс-4-(1-((5-Хлор-2-фтор-4-(1-метил-3-индолилкарбониламино)фенил)ацетил)-(2S)-метоксиметил-(4R)-пирролидинилметокси)циклогексанкарбоновая кислота:
(Стадия 1) Синтез метил-транс-4-(1-((5-хлор-2-фтор-4-(1-метил-3-индолилкарбониламино)фенил)ацетил)-(2S)-метоксиметил-(4R)-пирролидинилметокси)циклогексанкарбоксилата
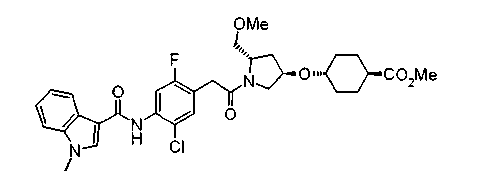
В ДМФ (2 мл) (5-хлор-2-фтор-4-(1-метил-3-индолилкарбониламино)фенил)уксусную кислоту (66 мг, 0,184 ммоль), метил-транс-4-((2S)-метоксиметил-(4R)-пирролидинилметокси)циклогексанкарбоксилат (50 мг, 0,184 ммоль), EDC·HCl (53 мг, 0,276 ммоль), HOBt (37 мг, 0,276 ммоль) и триэтиламин (128 мкл, 0,920 ммоль) перемешивают при комнатной температуре в течение 3 дней. Реакционную смесь выливают в ледяную воду с последующей экстракцией. Экстракт промывают ледяной водой и насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией с использованием тонкослойной пластины силикагеля (ТСХ) (проявление смесью хлороформ/ацетон (7/1)), получая при этом метил-транс-4-(1-((5-хлор-2-фтор-4-(1-метил-3-индолилкарбониламино)фенил)ацетил)-(2S)-метоксиметил-(4R)-пирролидинилметокси)циклогексанкарбоксилат (99 мг, 88%) в виде желтого масла.
1H-ЯМР (CDCl3) δ: 1,22-1,56 (м, 4H), 1,92-2,38 (м, 6H), 3,21-3,32 (м, 1H), 3,33 и 3,35 (каждый с, общий 3H, амидные изомеры), 3,37-3,49 (м, 2H), 3,61 (д, J=5,4 Гц, 1H), 3,64 и 3,66 (каждый с, общий 3H, амидные изомеры), 3,67-3,72 (м, 2H), 3,84 (м, 1H), 3,88 (с, 3H), 4,23-4,39 (м, 2H), 7,33-7,45 (м, 4H), 7,81 (с, 1H), 8,14 (м, 1H), 8,29 (с, 1H), 8,49 и 8,50 (каждый д, каждый J=12,0 Гц, общий 1H, амидные изомеры).
МС (ESI) m/z 614 (M++1), 616 (M++3).
(Стадия 2) Синтез транс-4-(1-((5-хлор-2-фтор-4-(1-метил-3-индолилкарбониламино)фенил)ацетил)-(2S)-метоксиметил-(4R)-пирролидинилметокси)циклогексанкарбоновой кислоты
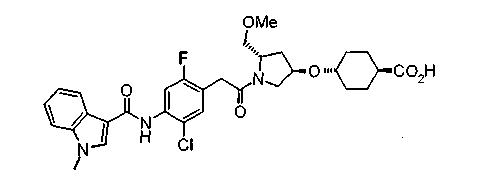
Метил-транс-4-(1-((5-хлор-2-фтор-4-(1-метил-3-индолилкарбониламино)фенил)ацетил)-(2S)-метоксиметил-(4R)-пирролидинилметокси)циклогексанкарбоксилат (99 мг, 0,161 ммоль) растворяют в смеси ТГФ/метанол (2:1, 6 мл). К образовавшемуся раствору добавляют 1 н. NaOH (2 мл). После перемешивания при комнатной температуре в течение 13 часов реакционную смесь перегоняют при пониженном давлении для удаления растворителя. Остаток подкисляют 1 н. HCl. Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при пониженном давлении. Сырые кристаллы очищают хроматографией с использованием тонкослойной пластины силикагеля (ТСХ) (проявление смесью хлороформ/метанол (20/1)), получая при этом указанное в заголовке соединение (35 мг, 36%) в виде бесцветного твердого вещества.
ИК (ATR) ν 3417, 2935, 1724, 1641, 1620, 1518, 1404 см-1;
1H-ЯМР (ДМСО) δ: 1,11-1,41 (м, 4H), 1,87-2,19 (м, 7H), 3,24 (с, 3H), 3,31 (с, 1Н), 3,35-3,56 (м, 3H), 3,67 (с, 2H), 3,68-3,86 (м, 1H), 3,89 (с, 3H), 4,09 и 4,33 (каждый м, общий 2H, амидные изомеры), 7,21 (т, J=6,9 Гц, 1H), 7,27 (дт, J=8,1,1,0 Гц, 1H), 7,45 (т, J=7,3 Гц, 1H), 7,55 (д, J=8,3 Гц, 1H), 7,69 и 7,70 (каждый д, J=11,0 и 11,3 Гц соответственно, общий 1H, амидные изомеры), 8,14 (д, J=7,6 Гц, 1H), 8,31 (с, 1H), 9,31 (с, 1H), 12,05 (ушир., 1H).
МС (ESI) m/z 600 (M++1), 602 (M++3);
Анал. Вычисл. для С31Н35ClFN3O6·0,6H2О: C, 60,95; H, 5,97; Cl, 5,80;F, 3,11; N, 6,88.
Найдено: C, 60,79; H, 5,99; Cl, 5,83; F, 3,02; N, 6,83.
Пример 158
транс-4-(1-((5-хлор-2-фтор-4-(1-метил-3-индазолилкарбониламино)фенил)ацетил)-(2S)-метоксиметил-(4R)-пирролидинилметокси)циклогексанкарбоновая кислота:
(Стадия 1) Синтез метил-транс-4-(1-((5-хлор-2-фтор-4-(1-метил-3-индазолилкарбониламино)фенил)ацетил)-(2S)-метоксиметил-(4R)-пирролидинилметокси)циклогексанкарбоксилата
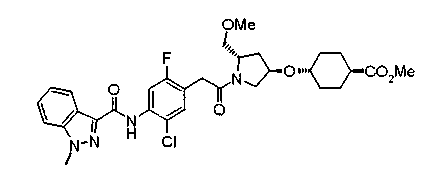
В ДМФ (2 мл) (5-хлор-2-фтор-4-(1-метил-3-индазолилкарбониламино)фенил)уксусную кислоту (137 мг, 0,380 ммоль), метил-транс-4-((2S)-метоксиметил-(4R)-пирролидинилокси)циклогексанкарбоксилат (103 мг, 0,380 ммоль), EDC·HCl (109 мг, 0,570 ммоль), HOBt (77 мг, 0,570 ммоль) и триэтиламин (0,26 мл, 1,9 ммоль) перемешивают при комнатной температуре в течение 21 часа. Реакционную смесь выливают в ледяную воду с последующей экстракцией этилацетатом. Экстракт промывают ледяной водой и насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией с использованием тонкослойной пластины силикагеля (ТСХ) (проявляющий раствор смесь хлороформ/ацетон (7/1)), получая при этом метил-транс-4-(1-((5-хлор-2-фтор-4-(1-метил-3-индазолилкарбониламино)фенил)ацетил)-(2S)-метоксиметил-(4R)-пирролидинилметокси)циклогексанкарбоксилат (198 мг, 85%) в виде бесцветного масла.
1H-ЯМР (CDCl3) δ: 1,15-1,51 (м, 4H), 1,78 и 1,80 (каждый с, общий 2H, амидные изомеры), 1,91-2,29 (м, 6H), 3,25 (м, 1H), 3,32 и 3,36 (каждый с, общий 3H, амидные изомеры), 3,38-3,50 (м, 2H), 3,62 и 3,66 (каждый с, общий 3H, амидные изомеры),3,69 (м, 1H), 3,87 (с, 1H), 3,90 (с, 3H), 4,25-4,39 (м, 2H), 7,22 (т, J=7,3 Гц, 1H), 7,35-7,46 (м, 4H), 8,01 (с, 1H), 8,43 и 8,44 (каждый д, каждый J=3,2 Гц, общий 1H, амидные изомеры).
МС (ESI) m/z 615 (M++1), 617 (M++3).
(Стадия 2) Синтез транс-4-(1-((5-хлор-2-фтор-4-(1-метил-3-индазолилкарбониламино)фенил)ацетил)-(2S)-метоксиметил-(4R)-пирролидинилметокси)циклогексанкарбоновой кислоты
Метил-транс-4-(1-((5-хлор-2-фтор-4-(1-метил-3-индазолилкарбониламино)фенил)ацетил)-(2S)-метоксиметил-(4R)-пирролидинилметокси)циклогексанкарбоксилат (198 мг, 0,322 ммоль) растворяют в смеси ТГФ/метанол (2:1, 12 мл). К образовавшемуся раствору добавляют 1 н. NaOH (4 мл). После перемешивания при комнатной температуре в течение 13 часов реакционную смесь перегоняют при пониженном давлении для удаления растворителя. Остаток подкисляют 1 н. HCl. Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при пониженном давлении, получая при этом указанное в заголовке соединение(145 мг, 75%) в виде бесцветного аморфного вещества.
ИК (ATR) ν 3361, 2939, 2864, 1724, 1685, 1620, 1529, 1408 см-1;
1H-ЯМР (ДМСО-d6) δ: 1,13-1,43 (м, 4H), 1,84-2,21 (м, 7H), 3,25 (с, 3H), 3,34-3,57 (м, 4H), 3,68 (д, J=4,4 Гц, 2H), 3,74 (кв., J=18,6 Гц, 1H), 4,09 и 4,35 (каждый м, общий 2H, амидные изомеры), 4,22 (с, 3H), 7,38 (т, J=6,8 Гц, 1H), 7,51 (т, J=7,8 Гц, 1H), 7,54 (т, J=7,8 Гц, 1H), 7,83 (д, J=8,5 Гц, 1H), 8,07 (дд, J=11,2, 1,2 Гц, 1H), 8,21 (дд, J=8,1, 1,2 Гц, 1H), 9,72 (с, 1H), 12,07 (ушир., 1H).
МС (ESI) m/z 601 (M++1), 603 (M++3);
Анал. Вычисл. для C30H34ClFN4О6·0,5H2О·0,1HC1: C, 58,71; H, 5,76; Cl, 6,35; F, 3,10; N, 9,13.
Найдено: C, 58,83; H, 5,66; Cl, 6,60; F, 3,06; N, 9,14.
Пример 159
4-(1-((2-(5-Фтор-2-метилфениламино)-7-фтор-6-бензоксазолил)ацетил)-(2S)-метоксиметил-(4R)-пирролидинилокси)бензойная кислота:
(Стадия 1) Синтез метил-4-(1-((2-(5-фтор-2-метилфениламино)-7-фтор-6-бензоксазолил)ацетил)-(2S)-метоксиметил-(4R)-пирролидинилокси)бензоата
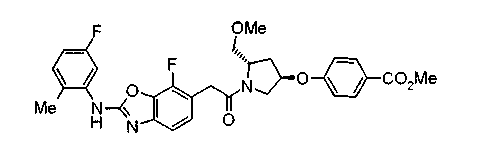
В ДМФ (2 мл) (2-(5-фтор-2-метилфениламино)-7-фтор-6-бензоксазолил)уксусную кислоту (127 мг, 0,400 ммоль), метил-4-((2S)-метоксиметил-(4R)-пирролидинилокси)бензоат (106 мг, 0,400 ммоль), EDC·HCl (115 мг, 0,600 ммоль), HOBt (81 мг, 0,600 ммоль) и триэтиламин (0,28 мл, 2,00 ммоль) перемешивают при комнатной температуре в течение 21 часа. Реакционную смесь выливают в ледяную воду с последующей экстракцией этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией с использованием тонкослойной пластины силикагеля (ТСХ) (проявляющий раствор смесь хлороформ/ацетон (5/1)), получая при этом метил-4-(1-((2-(5-фтор-2-метилфениламино)-7-фтор-6-бензоксазолил)ацетил)-(2S)-метоксиметил-(4R)-пирролидинилокси) бензоат (118 м, 52%) в виде бесцветного аморфного вещества.
1H-ЯМР (CDCl3) δ: 2,23-2,43 (м, 5H; включая 2,32 м.д., с, 3H), 3,35 и 3,39 (каждый с, общий 3H, амидные изомеры), 3,46-3,92 (м, 8H; включая 3,79 м.д., с, 3H), 4,40 и 4,47 (каждый м, общий 1H, амидные изомеры), 5,02 (м, 1Н), 6,72-6,85 (м, 3H), 7,05 (ушир., 1H), 7,13 (д, J=8,3 Гц, 1H), 7,15 (д, J=7,3 Гц, 1H), 7,20 (д, J=8,0 Гц, 1H), 7,92 (д, J=9,0 Гц, 2H), 8,12 (дд, J=11,0, 2,7 Гц, 1H).
МС (ESI) m/z 566 (M++1).
(Стадия 2) Синтез 4-(1-((2-(5-фтор-2-метилфениламино)-7-фтор-6-бензоксазолил)ацетил)-(2S)-метоксиметил-(4R)-пирролидинилокси)бензойной кислоты
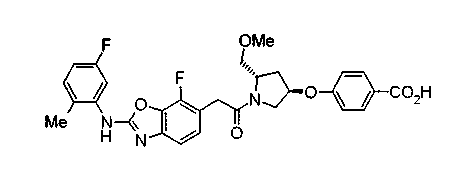
Метил-4-(1-((2-(5-фтор-2-метилфениламино)-7-фтор-6-бензоксазолил)ацетил)-(2S)-метоксиметил-(4R)-пирролидинилокси)бензоат (118 мг, 0,209 ммоль) растворяют в смеси ТГФ/метанол (2:1, 12 мл). К образовавшемуся раствору добавляют 1 н. NaOH (4 мл). После перемешивания при комнатной температуре в течение 18 часов реакционную смесь перегоняют при пониженном давлении для удаления растворителя. Остаток подкисляют 1 н. HCl. Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при пониженном давлении, получая при этом указанное в заголовке соединение (92 мг, 80%) в виде бесцветного твердого вещества.
ИК (ATR) ν 2939, 1684, 1639, 1604, 1577, 1506, 1452, 1244 см-1;
1H-ЯМР (ДМСО-d6) δ: 2,17 (м, 1H), 2,30 (с, 3H), 2,32 (м, 1H), 3,32 и 3,35 (каждый с, общий 3H, амидные изомеры), 3,48 (м, 1H), 3,51-3,58 (м, 1H), 3,73 (д, J=7,6 Гц, 1H), 3,79 (д, J=10,2 Гц, 1H), 3,82-4,00 (м, 2H), 4,22 и 4,50 (каждый м, общий 1H, амидные изомеры), 5,13 и 5,18 (каждый м, общий 1H, амидные изомеры), 6,89 (дт, J=8,5, 1,7 Гц, 1H), 7,00 и 7,01 (каждый д, каждый J=7,6 Гц, общий 2H, амидные изомеры), 7,06 и 7,09 (каждый д, J=7,1 и 4,4 Гц соответственно, общий 1H, амидные изомеры), 7,19 (д, J=8,8 Гц, 1H), 7,26 (т, J=7,8 Гц, 1H), 7,88 (д, J=8,3 Гц, 2H), 7,92 (д, J=11,0 Гц, 1H), 10,03 (ушир., 1H), 12,63 (ушир., 1H).
МС (ESI) m/z 552 (M++1);
Анал. Вычисл. для С29Н27FN3O6·0,5H2О: C, 62,14; H, 5,03; F, 6,78; N, 7,50.
Найдено: C, 62,33; H, 5,01; F, 6,70; N, 7,40.
Пример 160
4-(1-((2-(5-Фтор-2-метилфениламино)-7-фтор-6-бензоксазолилацетил)-(3R)-пирролидинилокси)циклогексанкарбоновая кислота:
(Стадия 1) Синтез этил-4-(1-бензил-(3R)-пирролидинилокси)бензоата
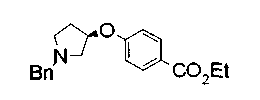
В ТГФ (30 мл) DIAD (5,2 мл, 36,7 ммоль) добавляют к 1-бензил-(2S)-гидроксипирролидину (5,0 г, 28,2 ммоль), этил-4-гидроксибензоату (4,6 г, 28 ммоль) и трифенилфосфину (9,6 г, 36,7 ммоль) при перемешивании при 0°С. Реакционную смесь перемешивают при комнатной температуре в течение 18 часов. Из реакционной смеси растворитель отгоняют при пониженном давлении. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси н-гексан-этилацетат (от 4:1 до 1:1, об./об.) этил-4-(1-бензил-(3R)-пирролидинилокси)бензоат (5,8 г, 64%) получают в виде аморфного вещества.
1H-ЯМР (CDCl3) δ: 1,36 (т, J=7,1 Гц, 3H), 1,67 (ушир.с, 1Н), 1,95-2,04 (м, 1H), 2,30-2,33 (м, 1H), 2,58-2,62 (м, 1H), 2,73-2,78 (м, 2H), 2,96-3,00 (м, 1H), 3,67 (AB кв., J=7,0 Гц, 2H), 4,33 (кв., J=7,1 Гц, 2H), 4,86-4,89 (м, 1H), 6,83 (д, J=9,0 Гц, 2H), 7,25-7,32 (м, 5H), 7,96 (д, J=9,0 Гц, 2H).
(Стадия 2) Синтез этил-4-(1-трет-бутоксикарбонил)-(3R)-пирролидинилокси)циклогексанкарбоксилата
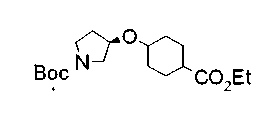
В этаноле (10 мл) и уксусной кислоте (1,0 мл) этил-4-(1-бензил-(3R)-пирролидинилокси)бензоат (3,8 г, 11,7 ммоль) и 5% родий на оксиде алюминия (1,9 г) подвергают каталитическому гидрированию в течение 24 часов под давлением газообразного водорода 5 атм. Из реакционной смеси катализатор отфильтровывают и фильтрат перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси н-гексан-этилацетат (от 5:1 до 4:1, об./об.) этил-4-(1-трет-бутоксикарбонил)-(3R)-пирролидинилокси)циклогексанкарбоксилат (1,9 г, 47%) получают в виде светло-желтого масла.
(Стадия 3) Синтез этил-транс-4-(1-трет-бутоксикарбонил)-(3R)-пирролидинилокси)циклогексанкарбоксилата

Этил-4-(1-трет-бутоксикарбонил)-(3R)-пирролидинилокси)циклогексанкарбоксилат (1,7 г, 4,98 ммоль) и метоксид натрия (20% раствор в этаноле) (3,5 мл) нагревают при кипячении с обратным холодильником в течение 3 часов в этаноле (15 мл). После охлаждения реакционную смесь разбавляют водой с последующей экстракцией этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси н-гексан-этилацетат (4:1, об./об.) этил-транс-4-(1-трет-бутоксикарбонил)-(3R)-пирролидинилокси)циклогексанкарбоксилат (280 мг, 16%) получают в виде бесцветного масла.
1H-ЯМР (CDCl3) δ: 1,20-1,35 (м, 5H), 1,40-1,50 (м, 11H), 1,80-2,05 (м, 6H), 2,20-2,30 (м, 1H), 3,20-3,50 (м, 5H), 4,10-4,20 (м, 3H).
(Стадия 4) Синтез этил-4-(1-(2-(5-фтор-2-метилфениламино)-7-фтор-6-бензоксазолилацетил)-(3R)-пирролидинилокси)циклогексанкарбоксилата
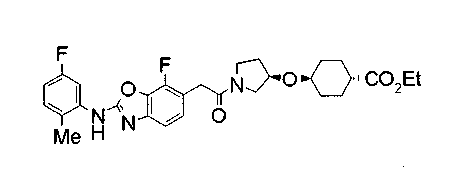
Этил-транс-4-(1-трет-бутоксикарбонил)-(3R)-пирролидинилокси)циклогексанкарбоксилат (280 мг, 0,82 ммоль) растворяют в метиленхлориде (5,0 мл). При перемешивании при 0°С к образовавшемуся раствору добавляют трифторуксусную кислоту (5,0 мл). Реакционную смесь перемешивают при комнатной температуре в течение 0,5 часа. Из реакционной смеси растворитель отгоняют при пониженном давлении. Остаток нейтрализуют насыщенным водным раствором бикарбоната натрия с последующей экстракцией метиленхлоридом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя (образовавшийся продукт используют для следующей реакции без дополнительной очистки). В ТГФ (5,0 мл) и ацетонитриле (5,0 мл) EDC·HCl (119 мг, 0,62 ммоль) добавляют к остатку (0,41 ммоль), (2-(5-фтор-2-метилфениламино)-7-фтор-6-бензоксазолил)уксусной кислоте (130 мг, 0,41 ммоль), HOBt (84 мг, 0,41 ммоль) и триэтиламину (170 мкл, 1,23 ммоль) при охлаждении льдом при 0°С.Реакционную смесь перемешивают при комнатной температуре в течение 16 часов и перегоняют при пониженном давлении для удаления растворителя. Остаток разбавляют водой с последующей экстракцией этилацетатом. Экстракт промывают последовательно насыщенным водным раствором бикарбоната натрия, 2 М водным раствором лимонной кислоты и насыщенным водным раствором бикарбоната натрия, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают колоночной хроматографией с использованием тонкослойной пластины силикагеля (ТСХ) (проявляющий раствор н-гексан-этилацетат (1:3, об./об.)), получая при этом этил-4-(1-(2-(5-фтор-2-метилфениламино)-7-фтор-6-бензоксазолилацетил)-(3R)-пирролидинилокси)циклогексанкарбоксилат (170 мг, 77%) в виде бесцветного масла.
1H-ЯМР (CDCl3) δ: 1,19-1,38 (м, 5H), 1,39-1,55 (м, 2H), 1,85-2,10 (м, 6H), 2,19-2,30 (м, 1H), 2,31 (с, 3H), 3,20-3,32 (м, 1H), 3,50-3,80 (м, 6H), 4,07-4,14 (м, 2H), 4,20-4,27 (м, 1H), 6,73-6,77 (м, 1H), 7,02 (ушир.с, 1H), 7,12-7,26 (м, 4H), 8,08-8,11 (м, 1H).
(Стадия 5) Синтез 4-(1-(2-(5-фтор-2-метилфениламино)-7-фтор-6-бензоксазолилацетил)-(3R)-пирролидинилокси)циклогексанкарбоновой кислоты
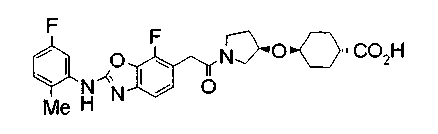
Этил-4-(1-(2-(5-фтор-2-метилфениламино)-7-фтор-6-бензоксазолилацетил)-(3R)-пирролидинилокси)-циклогексанкарбоксилат (170 мг, 0,31 ммоль) растворяют в ТГФ (5,0 мл) и метаноле (3,0 мл). К образовавшемуся раствору добавляют 1 н. NaOH (1,0 мл, 1,0 ммоль). Образовавшуюся смесь перемешивают при 70°С в течение 18 часов. Реакционную смесь охлаждают и перегоняют при пониженном давлении для удаления растворителя. Остаток нейтрализуют 1 н. HCl. Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при пониженном давлении, получая при этом указанное в заголовке соединение (140 мг, 87%) в виде белого твердого вещества.
ИК (KBr) ν 2940, 1639, 1610, 1577, 1454, 1070 см-1;
1H-ЯМР (ДМСО-d6) δ: 1,10-1,25 (м, 2H), 1,30-1,45 (м, 2H), 1,80-2,00 (м, 6H), 2,10-2,20 (м, 1H), 2,29 (с, 3H), 3,30-3,80 (м, 7H), 4,20-4,29 (м, 1H), 6,86-6,91 (м, 1H), 7,09 (т, J=6,8 Гц, 1H), 7,20-7,27 (м, 2H), 7,92 (д, J=11,4 Гц, 1H).
МС (FAB) m/z 514 (M+H)+;
Анал. Вычисл. для C27E29F2N3О5·0,8H2О: C, 61,43; H, 5,84; N, 7,96.
Найдено: C, 61,64; H, 5,79; N, 7,77.
Пример 161
транс-4-(1-((7-Фтор-2-(1-метил-3-индолил)-6-бензоксазолил)ацетил)-(2S)-метоксиметил-(4R)-пирролидинилметокси)циклогексанкарбоновая кислота:
(Стадия 1) Синтез метил-транс-4-(1-((7-фтор-2-(1-метил-3-индолил)-6-бензоксазолил)ацетил)-(2S)-метоксиметил-(4R)-пирролидинилметокси)циклогексанкарбоксилата
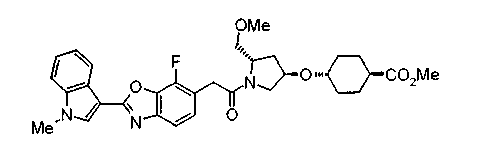
В ДМФ (2 мл) (7-фтор-2-(1-метил-3-индолил)-6-бензоксазолил)уксусную кислоту (122 мг, 0,376 ммоль), метил-транс-4-((2S)-метоксиметил-(4R)-пирролидинилметокси) циклогексанкарбоксилат (102 мг, 0,376 ммоль), EDC·HCl (108 мг, 0,564 ммоль), HOBt (76 мг, 0,564 ммоль) и триэтиламин (0,26 мл, 1,88 ммоль) перемешивают при комнатной температуре в течение 21 часа. Реакционную смесь выливают в ледяную воду с последующей экстракцией этилацетатом. Экстракт промывают ледяной водой и насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией с использованием тонкослойной пластины силикагеля (ТСХ) (проявляющий раствор хлороформ/ацетон (10/1)), получая при этом метил-транс-4-(1-((7-Фтор-2-(1-метил-3-индолил)-6-бензоксазолил)ацетил)-(2S)-метоксиметил-(4R)-пирролидинилметокси)циклогексанкарбоксилат (175 мг, 84%) в виде коричневого масла.
1H-ЯМР (CDCl3) δ: 1,18-1,53 (м, 4H), 1,82 (с, 1H), 1,93-2,31 (м, 7H), 3,25 (м, 1H), 3,33 и 3,34 (каждый с, общий 3H, амидные изомеры), 3,42 (д, J=9,8 Гц, 2H), 3,61 и 3,63 (каждый с, общий 3H, амидные изомеры), 3,65 (с, 1H), 3,66-3,88 (м, 2H), 4,15 (с, 3H), 4,23-4,34 (м, 2H), 7,33 (т, J=6,1 Гц, 1H), 7,39 (д, J=7,3 Гц, 1H), 7,45 (м, 2H), 8,37 (д, J=8,1 Гц, 1H), 8,49 и 8,51 (каждый д, каждый J=11,7 Гц, общий 1H, амидные изомеры), 9,48 (с, 1H).
МС (ESI) m/z 578 (M++1).
(Стадия 2) Синтез транс-4-(1-((7-фтор-2-(1-метил-3-индолил)-6-бензоксазолил)ацетил)-(2S)-метоксиметил-(4R)-пирролидинилметокси)циклогексанкарбоновой кислоты

Метил-транс-4-(1-((7-фтор-2-(1-метил-3-индолил)-6-бензоксазолил)ацетил)-(2S)-метоксиметил-(4R)-пирролидинилметокси)циклогексанкарбоксилат (175 мг, 0,324 ммоль) растворяют в смеси ТГФ/метанол (8/4 мл). К образовавшемуся раствору добавляют 1 н. NaOH (4 мл). После перемешивания при комнатной температуре в течение 15 часов реакционную смесь перегоняют при пониженном давлении для удаления растворителя. Остаток подкисляют 1 н. HCl. Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при пониженном давлении, получая при этом указанное в заголовке соединение (129 мг, 73%) в виде бесцветного твердого вещества.
ИК (ATR) ν 2937, 2864, 1724, 1626, 1583, 1502, 1442, 1369 см-1;
1H-ЯМР (ДМСО-d6) δ: 1,10-1,41 (м, 4H), 1,83-2,19 (м, 7H), 3,24 (с, 3H), 3,7-3,38 (м, 1H), 3,42 (д, J=4,7 Гц, 2H), 3,51 и 3,55 (каждый дд, J=10,7, 4,2 и 10,7, 2,9 Гц соответственно, общий 1H, амидные изомеры), 3,70 (дд, J=10,5,5,4 Гц, 1H), 3,81 (с, 3H), 3,91 (с, 3H), 4,10 и 4,34 (каждый м, общий 2H, амидные изомеры), 7,22 (т, J=6,6 Гц, 1H), 7,33 (дкв, J=7,1, 1,0 Гц, 1H), 7,35 (дкв, J=7,1, 1,0 Гц, 1H), 7,47 и 7,48 (каждый д, J=8,1 и 8,3 Гц соответственно, общий 1H, амидные изомеры), 7,63 (дд, J=6,8,1,5 Гц, 1H), 8,29 (дд, J=6,3, 1,5 Гц, 1Н), 8,44 (с, 1H), 12,05 (с, 1H).
МС (ESI) m/z 564 (M++1);
Анал. Вычисл. для C31H34FN3О6·0,5H2О: C, 65,02; H, 6,16; F, 3,32; N, 7,34.
Найдено: C, 64,72; H, 6,15; F, 3,21; N, 7,28.
Пример 162
4-(1-(5-Хлор-2-фтор-4-(1-метил-3-инлолил)карбониламинофенилацетил)-(3R)-пирролидинилметокси)бензойная кислота:
(Стадия 1) Синтез 1-бензил-(3R)-цианопирролидина
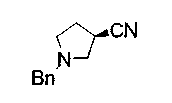
В метиленхлориде (25 мл) растворяют 1-бензил-(3S)-гидроксипирролидин (4,0 г, 22,6 ммоль) и триэтиламин (9,1 мл, 66 ммоль). При перемешивании при 0°С добавляют по каплям метансульфонилхлорид (3,76 г, 33 ммоль). После завершения добавления реакционную смесь перемешивают при комнатной температуре в течение часа и затем перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси н-гексан:этилацетат (1:4, об./об.) образовавшийся продукт получают в виде светло-желтого масла. Масло растворяют в ДМСО (25 мл) и к образовавшемуся раствору добавляют цианид натрия (6,0 г, 113 ммоль). Образовавшуюся смесь перемешивают при 60°С в течение 18 часов. Реакционную смесь выливают в воду с последующей экстракцией этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над без сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси н-гексан:этилацетат (от 3:1 до 1:1, об./об.) 1-бензил-(3R)-цианопирролидин (3,2 г, 77%) получают в виде светло-желтого масла.
1H-ЯМР (CDCl3) δ: 2,05-2,30 (м, 2H), 2,58-2,70 (м, 3H), 2,80-3,05 (м, 2H), 3,64 (AB кв., J=12,9 Гц, 2H), 7,25-7,34 (м, 5H).
(Стадия 2) Синтез метил-1-бензил-(3R)-пирролидинилкарбоксилата
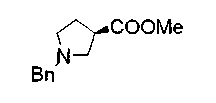
В концентрированной HCl (15 мл) 1-бензил-(3R)-цианопирролидин (2,0 г, 10,75 ммоль) нагревают при кипячении с обратным холодильником в течение 0,5 часа. После охлаждения реакционную смесь перегоняют при пониженном давлении для удаления растворителя. Остаток растворяют в метаноле (10 мл). При перемешивании при -500C добавляют тионилхлорид (2,6 мл). Смесь перемешивают далее при комнатной температуре в течение 18 часов. Из реакционной смеси растворитель отгоняют при пониженном давлении. Остаток нейтрализуют насыщенным водным раствором бикарбоната натрия с последующей экстракцией хлороформом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси н-гексан-этилацетат (от 2:1 до 1:2, об./об.) метил-1-бензил-(3R)-пирролидинилкарбоксилат (1,6 г, 70%) получают в виде бесцветного масла.
1H-ЯМР (CDCl3) δ: 2,08-2,12 (м, 2H), 2,50-2,69 (м, 3H), 2,88-3,03 (м, 2H), 3,62 (с, 3H), 3,67 (с, 3H), 7,25-7,32 (м, 5H).
(Стадия 3) Синтез метил-1-трет-бутоксикарбонил-(3R)-пирролидинилкарбоксилата
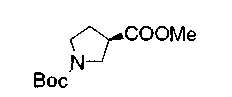
Метил-1-бензил-(3R)-пирролидинилкарбоксилат (1,6 г, 7,3 ммоль) и гидроксид палладия на угле (300 мг) подвергают каталитическому гидрированию в метаноле (15 мл) при нормальном давлении в течение 18 часов. Из реакционной смеси катализатор отфильтровывают и фильтрат перегоняют при пониженном давлении для удаления растворителя, в результате чего получают бесцветное масло. Масло растворяют в метиленхлориде (20 мл). К образовавшемуся раствору добавляют ди-трет-бутилдикарбонат (2,0 г, 9,5 ммоль) и триэтиламин (2,0 мл). Образовавшуюся смесь перемешивают при комнатной температуре в течение 6 часов. Из реакционной смеси растворитель отгоняют при пониженном давлении. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси н-гексан:этилацетат (от 5/1 до 1/1, об./об.) метил-1-трет-бутоксикарбонил-(3R)-пирролидинилкарбоксилат (1,2 г, 72%) получают в виде бесцветного масла.
1H-ЯМР (CDCb) δ: 1,46 (с, 9H), 2,12 (ушир.с, 2H), 3,04-3,06 (м, 1H), 3,33-3,36 (м, 1H), 3,48-3,70 (м, 3H), 3,71 (с, 3H).
(Стадия 4) Синтез 1-трет-бутоксикарбонил-(3R)-пирролидинилкарбоновой кислоты
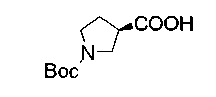
Метил-1-трет-бутоксикарбонил-(3R)-пирролидинилкарбоксилат (1,6 г, 6,98 ммоль) растворяют в ТГФ (15 мл) и метаноле (7 мл). К образовавшемуся раствору добавляют 1 н. NaOH (10 мл, 10 ммоль). Смесь перемешивают при 70°С в течение 18 часов. Реакционную смесь охлаждают и перегоняют при пониженном давлении для удаления растворителя. Остаток нейтрализуют 1 н. HCl. Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при пониженном давлении, получая при этом 1-трет-бутоксикарбонил-(3R)-пирролидинилкарбоновую кислоту (1,5 г, 80%) в виде белого кристаллического твердого вещества.
1H-ЯМР (CDCl3) δ: 1,46 (с, 9H), 2,10-2,20 (м, 2H), 3,08-3,11 (м, 1H), 3,36-3,62 (м, 4H).
(Стадия 5) Синтез 1-трет-бутоксикарбонил-(3R)-пирролидинметанола
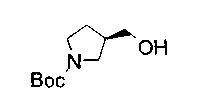
В ТГФ (15 мл) комплекс боран-диметилсульфид (1,0 М раствор в ТГФ) (8,0 мл, 8,0 ммоль) добавляют к 1-трет-бутоксикарбонил- (3R)-пирролидинилкарбоновой кислоте (1,1 г, 5,11 ммоль) при перемешивании при 0°С.Реакционную смесь перемешивают при комнатной температуре в течение 3 часов и затем нагревают при кипячении с обратным холодильником в течение 3 часов. После охлаждения реакционную смесь перегоняют при пониженном давлении для удаления растворителя. К остатку добавляют воду с последующей экстракцией этилацетатом. Экстракт промывают водой, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя, получая при этом 1-трет-бутоксикарбонил-(3R)-пирролидинметанол (1,2 г, 100%) в виде бесцветного масла.
1H-ЯМР (CDCl3) δ: 1,45 (с, 9H), 1,80-2,00 (м, 1H), 2,30-2,45 (м, 1H), 3,05-3,15 (м, 1H), 3,20-3,70 (м, 6H).
(Стадия 6) Синтез этил-4-(1-трет-бутоксикарбонил)-(3R)-пирролидинилметокси)бензоата
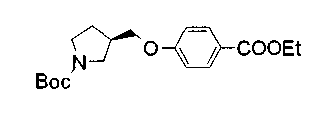
В ТГФ (15 мл), DIAD (1,34 г, 6,64 ммоль) добавляют к 1-трет-бутоксикарбонил-(3R)-пирролидинметанолу (1,1 г, 5,11 ммоль), этил-4-гидроксибензоату (848 мг, 5,11 ммоль) и трифенилфосфину (1,74 г, 6,64 ммоль) при перемешивании при 0°С. Реакционную смесь перемешивают далее при комнатной температуре в течение 18 часов. Из реакционной смеси растворитель отгоняют при пониженном давлении. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси н-гексан:этилацетат (1:1, об./об.) этил-4-(1-трет-бутоксикарбонил)-(3R)-пирролидинилметокси)бензоат (800 мг, 45%) получают в виде светло-желтого масла.
1H-ЯМР (CDCl3) δ: 1,38 (т, J=7,1 Гц, 3H), 1,75-1,85 (м, 1H), 2,00-2,15 (м, 1H), 2,62-2,75 (м, 1H), 3,15-3,65 (м, 4H), 3,85-4,05 (м, 2H), 4,34 (кв., J=7,1 Гц, 2H), 6,90 (д, J=8,5 Гц, 2H), 7,99 (д, J=8,5 Гц, 2H).
(Стадия 7) Синтез этил-4-(1-((5-хлор-2-фтор-4-(1-метил-3-индолил)карбониламинофенил)ацетил)-(3R)-пирролидинилметокси)бензоата
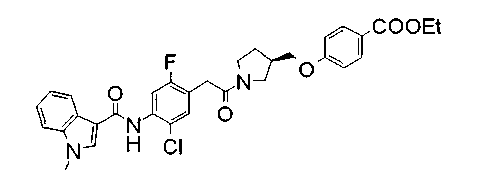
Этил-4-(1-трет-бутоксикарбонил)-(3R)-пирролидинилметокси)бензоат (150 мг, 0,42 ммоль) растворяют в метиленхлориде (5,0 мл). К образовавшемуся раствору добавляют трифторуксусную кислоту (5,0 мл) при перемешивании при 0°С.Реакционную смесь перемешивают далее при комнатной температуре в течение 0,5 часа. Из реакционной смеси растворитель отгоняют при пониженном давлении. Остаток нейтрализуют насыщенным водным раствором бикарбоната натрия с последующей экстракцией метиленхлоридом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Образовавшийся остаток используют для следующей реакции без дополнительной очистки. В ТГФ (5,0 мл) и ацетонитриле (5,0 мл) EDC·HCl (144 мг, 0,75 ммоль) добавляют к образовавшемуся маслу, (5-хлор-2-фтор-4-(1-метил-3-индолил)карбониламинофенил)уксусной кислоте (180 мг, 0,5 ммоль), HOBt (70 мг, 0,5 ммоль) и триэтиламину (208 мкл, 1,5 ммоль) при 0°С.Образовавшуюся смесь перемешивают в течение 16 часов. Из реакционной смеси растворитель отгоняют при пониженном давлении. К остатку добавляют воду с последующей экстракцией этилацетатом. Экстракт промывают последовательно насыщенным водным раствором бикарбоната натрия, 2 М водным раствором лимонной кислоты и насыщенным водным раствором бикарбоната натрия, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией с использованием тонкослойной пластины силикагеля (ТСХ), посредством чего из элюатных фракций смеси н-гексан-этилацетат (1:4, об./об.) этил-4-(1-(5-хлор-2-фтор-4-(1-метил-3-инлолил)карбониламинофенилацетил)-(3R)-пирролидинилметокси)бензоат (140 мг, 55%) получают в виде бесцветного масла.
1H-ЯМР (CDCl3) δ: 1,32-1,39 (м, 3H), 1,80-2,30 (м, 2H), 2,62-2,88 (м, 1H), 3,35-4,10 (м, 8H), 4,20-4,40 (м, 2H), 6,88 (д, J=7,1 Гц, 2H), 7,34-7,45 (м, 4H), 7,81 (д, J=7,1 Гц, 1H), 7,99 (д, J=7,1 Гц, 2H), 8,12-8,14 (м, 1H), 8,25-8,30 (м, 1H), 8,48-8,53 (м, 1H).
(Стадия 8) Синтез 4-(1-((5-хлор-2-фтор-4-(1-метил-3-индолил)карбониламинофенилацетил)-(3R)-пирролидинилметилокси)бензойной кислоты

Этил-4-(1-(5-хлор-2-фтор-4-(1-метил-3-инлолил)карбониламинофенилацетил)-(3R)-пирролидинилметокси)бензоат (140 мг, 0,24 ммоль) растворяют в ТГФ (10 мл) и метаноле (5,0 мл). К образовавшемуся раствору добавляют 1 н. NaOH (1,0 мл, 1,0 ммоль). Образовавшуюся смесь перемешивают при 70°С в течение 18 часов. Реакционную смесь перегоняют при пониженном давлении для удаления растворителя. Остаток разбавляют водой и затем подкисляют 1 н. HCl. Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при пониженном давлении, получая при этом указанное в заголовке соединение (160 мг, 100%) в виде белого кристаллического твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 1,70-2,20 (м, 2H), 2,60-2,80 (м, 1H), 3,20-3,90 (м, 9H), 4,02-4,18 (м, 2H), 7,03-7,06 (м, 2H), 7,20-7,29 (м, 2H), 7,47 (дд, J=2,7,7,5, 1H), 7,56 (д, J=8,0 Гц, 1H), 7,70 (дд, J=2,9,11,2 Гц, 1H), 7,88-7,91 (м, 1H), 8,15 (д, J=7,5 Гц, 1H), 8,31 (с, 1H), 9,31 (д, J=2,9 Гц, 1H).
МС (ESI) m/z 564 (M+H)+.
Пример 163
транс-4-(1-(5-Хлор-2-фтор-4-(1-метил-3-индолил)карбониламинофенилацетил)-(3R)-пирролидинилметилокси)циклогексанкарбоновая кислота:
(Стадия 1) Синтез этил-4-(1-трет-бутоксикарбонил-(3R)-пирролидинилметокси)циклогексанкарбоксилата

Этил-4-(1-трет-бутоксикарбонил-(3R)-пирролидинилметокси)бензоат (650 мг, 1,86 ммоль) и 5% родий-оксид алюминия (300 мг) подвергают каталитическому гидрированию в этаноле (10 мл) и уксусной кислоте (1,0 мл) под давлением газообразного водорода 5 атм в течение 24 часов. Из реакционной смеси катализатор отфильтровывают и фильтрат перегоняют при пониженном давлении для удаления растворителя, в результате чего этил-4-(1-трет-бутоксикарбонил-(3R)-пирролидинилметокси)циклогексанкарбоксилат (660 мг, 100%) получают в виде бесцветного масла. Образовавшееся соединение используют для следующей стадии без дополнительной очистки.
(Стадия 2) Синтез метил-цис- и -транс-4-(1-трет-бутоксикарбонил)-(3R)-пирролидинилметокси)циклогексанкарбоксилатов
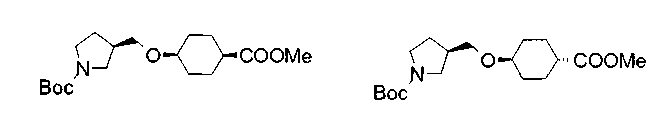
Этил-4-(1-трет-бутоксикарбонил-(3R)-пирролидинилметокси)циклогексанкарбоксилат (640 мг, 1,91 ммоль) и раствор этоксида натрия в этаноле (4,0 ммоль) нагревают при кипячении с обратным холодильником в течение 3 часов в этаноле (20 мл). После охлаждения реакционную смесь перегоняют при пониженном давлении для удаления растворителя. Остаток разбавляют этилацетатом. Раствор в этилацетате промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя, получая при этом 4-(1-трет-бутоксикарбонил-3R-пирролидинилметокси)циклогексанкарбоновую кислоту. Образовавшийся продукт растворяют в толуоле (16 мл) и метаноле (4,0 мл). Триметилсилилдиазометан (2,0 М раствор в гексане) (1,4 мл) добавляют по каплям к образовавшемуся раствору. После перемешивания при комнатной температуре в течение 1 часа реакционную смесь перегоняют при пониженном давлении для удаления растворителя. Остаток очищают колоночной флэш-хроматографией с использованием силикагеля, посредством чего из элюатных фракций смеси н-гексан:этилацетат (4:1, об./об.) метил-4-(1-трет-бутоксикарбонил)-(3R)-пирролидинилметокси)циклогексанкарбоксилат (270 мг, 41% для цис-изомера, 120 мг, 18% для транс-изомера) получают в виде бесцветного масла.
Цис изомер; 1H-ЯМР (CDCl3) δ: 1,39-2,00 (м, 19H), 2,30-2,50 (м, 2H), 3,00-3,10 (м, 1H), 3,22-3,55 (м, 6H), 3,66 (с, 3H).
Транс изомер; 1H-ЯМР (CDCl3) δ: 1,18-1,28 (м, 2H), 1,40-1,55 (м, 11H), 1,90-2,10 (м, 6H), 2,20-2,50 (м, 2H), 3,00-3,55 (м, 7H), 3,66 (с, 3H).
(Стадия 3) Синтез метил-транс-4-(1-((5-хлор-2-фтор-4-(1-метил-3-индолил)карбониламинофенил)ацетил)-(3R)-пирролидинилметилокси)циклогексанкарбоксилат
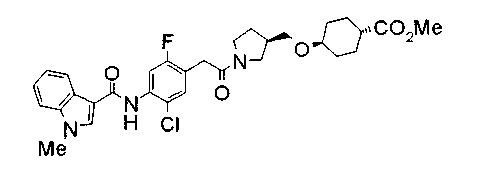
Метил-транс-4-(1-трет-бутоксикарбонил)-(3R)-пирролидинилметокси)циклогексанкарбоксилат (120 мг, 0,35 ммоль) растворяют в метиленхлориде (5,0 мл). К образовавшемуся раствору добавляют трифторуксусную кислоту (5,0 мл) при перемешивании при 0°С.Реакционную смесь перемешивают далее при комнатной температуре в течение 0,5 часа. Из реакционной смеси растворитель отгоняют при пониженном давлении. К остатку добавляют насыщенный водный раствор бикарбоната натрия с последующей экстракцией метиленхлоридом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Таким образом полученный сырой продукт используют для следующей реакции без дополнительной очистки. В ТГФ (5,0 мл) и ацетонитриле (5,0 мл) EDC·HCl (100 мг, 0,52 ммоль) добавляют к сырому продукту, (5-хлор-2-фтор-4-(1-метил-3-индолил)карбониламинофенил)уксусной кислоте (126 мг, 0,35 ммоль), HOBt (48 мг, 0,35 ммоль) и триэтиламину (139 мкл, 1,0 ммоль) при перемешивании при 0°С.Реакционную смесь перемешивают далее при комнатной температуре в течение 16 часов. Из реакционной смеси растворитель отгоняют при пониженном давлении. Остаток разбавляют водой с последующей экстракцией этилацетатом. Экстракт промывают последовательно насыщенным водным раствором бикарбоната натрия, 2 М водным раствором лимонной кислоты и насыщенным водным раствором бикарбоната натрия, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хлороформом с использованием тонкослойной пластины силикагеля (ТСХ), посредством чего из элюатных фракций смеси н-гексан:этилацетат (1:7, об./об.) метил-транс-4-(1-((5-хлор-2-фтор-4-(1-метил-3-индолил)карбониламинофенил)ацетил)-(3R)-пирролидинилметилокси) циклогексанкарбоксилат (110 мг, 54%) получают в виде бесцветного масла.
1H-ЯМР (CDCl3) δ: 1,10-1,31 (м, 2H), 1,35-1,50 (м, 2H), 1,52-1,85 (м, 2H), 1,90-2,10 (м, 6H), 2,15-2,30 (м, 1H), 2,40-2,60 (м, 1H), 3,20-3,80 (м, 10H), 3,89 (с, 3H), 7,33-7,44 (с, 4H), 7,80 (с, 1H), 8,12-8,14 (м, 1H), 8,29 (с, 1H), 8,48-8,52 (м, 1H).
(Стадия 4) Синтез транс-4-(1-((5-хлор-2-фтор-4-(1-метил-3-индолил)карбониламинофенил)ацетил)-(3R)-пирролидинилметилокси)циклогексанкарбоновой кислоты
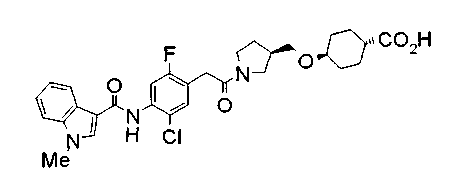
Метил-транс-4-(1-((5-хлор-2-фтор-4-(1-метил-3-индолил)карбониламинофенилацетил)-(3R)-пирролидинилметокси)циклогексанкарбоксилат (110 мг, 0,2 ммоль) растворяют в ТГФ (10 мл) и метаноле (5,0 мл). К образовавшемуся раствору добавляют 1 н. NaOH (1,0 мл, 1,0 ммоль). Образовавшуюся смесь перемешивают при 70°С в течение 18 часов. После охлаждения реакционную смесь перегоняют при пониженном давлении для удаления растворителя. Остаток нейтрализуют 1 н. HCl. Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при пониженном давлении, получая при этом указанное в заголовке соединение (100 мг, 100%) в виде белого кристаллического твердого вещества.
ИК (ATR) ν 1614, 1517, 1403, 1099 см-1; 1H-ЯМР (ДМСО-d6) δ: 1,10-1,21 (м, 2H), 1,30-1,40 (м, 2H), 1,50-1,75 (м, 1H), 1,80-2,05 (м, 5H), 2,10-2,40 (м, 2H), 3,05-3,80 (м, 9H), 3,89 (с, 3H), 7,19-7,29 (м, 2H), 7,45 (д, J=7,3 Гц, 1H), 7,55 (д, J=8,3 Гц, 1H), 7,69 (д, J=11,0 Гц, 1H), 8,15 (д, J=7,8 Гц, 1H), 8,30 (с, 1H), 9,31 (с, 1H).
МС (FAB) m/z 570 (M+H)+;
Анал. Вычисл. для С30Н33ClFN3O5: С, 63,21; H, 5,83; N, 7,37; Cl, 6,22; F, 3,33.
Найдено: C, 62,86; H, 5,71; N, 7,15; Cl, 5,99; F, 3,19.
Пример 164
транс-4-(1-((5-Хлор-2-фтор-4-((1-метил-3-индолилкарбонил)амино)фенил)ацетил)-(5R)-метоксиметил-(2S)-пирролидинилметокси)циклогексанкарбоновая кислота:
(Стадия 1) Синтез (5S)-бензилоксиметил-N-трет-бутоксикарбонил-(2S)-пирролидинкарбальдегида
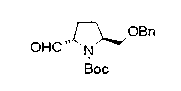
К раствору оксалилхлорида (1,58 мл, 18,1 ммоль) в метиленхлориде (30 мл) добавляют по каплям ДМСО (1,93 мл, 27,2 ммоль) при перемешивании при -78°С.К реакционной смеси при такой же температуре добавляют раствор (5S)-бензилоксиметил-N-трет-бутоксикарбонил-(2S)-пирролидинметанола (2,91 г, 9,05 ммоль) в метиленхлориде (20 мл). При температуре реакции, повышенной от -78°С до -40°С, перемешивание проводят в течение 3 часов. К реакционной смеси добавляют триэтиламин (6,31 мл, 45,3 ммоль) и смесь перемешивают при 40°С в течение 2 часов. Реакционную смесь разбавляют насыщенным водным раствором хлорида аммония с последующей экстракцией хлороформом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси н-гексан/этилацетат (4:1, об./об.) (5S)-бензилоксиметил-N-трет-бутоксикарбонил-(2S)-пирролидинкарбальдегид (2,90 г, 100%) получают в виде светло-желтого масла.
1H-ЯМР (CDCb) δ: 1,42 и 1,43 (каждый с, общий 9H), 1,85-2,04 (м, 3H), 2,16-2,35 (м, 1H), 3,41-3,45 и 3,55-3,59 (каждый м, общий 1H), 3,61-3,63 (м, 1H), 4,07-4,30 (м, 2H), 4,48-4,57 (м, 2H), 7,27-7,35 (м, 5H), 9,52 и 9,58 (каждый с, общий 1H).
(Стадия 2) Синтез (2S)-бензилоксиметил-N-трет-бутоксикарбонил-(5R)-гидроксиметилпирролидина и (2S)-бензилоксиметил-N-трет-бутоксикарбонил-(5S)-гидроксиметилпирролидина
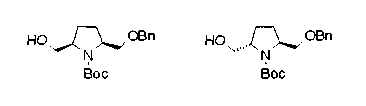
В метаноле (30 мл) растворяют (5S)-бензилоксиметил-N-трет-бутоксикарбонил-(2S)-пирролидинкарбальдегид (2,90 г, 9,08 ммоль). К образовавшемуся раствору добавляют карбонат калия (1,50 г, 10,9 ммоль) и смесь нагревают при кипячении с обратным холодильником в течение 10 часов. После охлаждения до комнатной температуры реакционную смесь перегоняют при пониженном давлении для удаления растворителя. К остатку добавляют воду с последующей экстракцией этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя, в результате чего получают (5S)-бензилоксиметил-N-трет-бутоксикарбонилпирролидинкарбальдегид (2,52 г). Борогидрид натрия (0,60 г, 15,9 ммоль) в метаноле (20 мл) добавляют к (5S)-бензилоксиметил-N-трет-бутоксикарбонилпирролидинкарбальдегиду (2,52 г, 7,89 ммоль) при перемешивании при 0°С.Реакционную смесь перемешивают при комнатной температуре в течение 20 часов. Смесь концентрируют при пониженном давлении для удаления растворителя. К остатку добавляют воду с последующей экстракцией этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси н-гексан/этилацетат (3:1, об./об.) (2S)-бензилоксиметил-N-трет-бутоксикарбонил-(5R)-гидроксиметилпирролидин (1,42 г, 56%) получают в виде светло-желтого масла.
1H-ЯМР (CDCl3) (2S,5R) δ: 1,43 (с, 9H), 1,87-2,01 (т, 4Н), 3,44-3,52 (т, 2Н), 3,74-3,78 (т, 1Н), 3,92-4,01 (т, 2Н), 4,50-4,57 (т, 1Н), 4,70 (т, 1Н), 7,27-7,37 (т, 5Н).
Кроме того, в виде светло-желтого масла получают (2S)-бензилоксиметил-N-трет-бутоксикарбонил-(5S)-гидроксиметилпирролидин (0,65 г, 26%).
1H-ЯМР (CDCl3) (2S,5S) δ: 1,41 (с, 9H), 1,93-2,16 (м, 4Н), 3,33-3,38 (м, 1Н), 3,52-3,60 (м, 2Н), 3,66-3,72 (м, 1Н), 3,95-4,02 (м, 2Н), 4,29 (м, 1Н), 4,48-4,54 (м, 2Н), 7,28-7,36 (м, 5Н).
(Стадия 3) Синтез (2S)-бензилоксиметил-N-трет-бутоксикарбонил-(5R)-метоксиметилпирролидина

В ДМФ (5 мл) суспендируют (2S)-бензилоксиметил-N-трет-бутоксикарбонил-(5R)-гидроксиметилпирролидин (190 мг, 0,59 ммоль) и гидрид натрия (28 мг, 1,17 ммоль). К образовавшейся суспензии добавляют метилиодид (44 мкл, 0,71 ммоль) при перемешивании при 0°С. Реакционную смесь перемешивают далее при комнатной температуре в течение 2 дней. К реакционной смеси добавляют воду с последующей экстракцией этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси н-гексан/этилацетат (5:1, об./об.) (2S)-бензилоксиметил-N-трет-бутоксикарбонил-(5R)-метоксиметилпирролидин (183 мг, 92%) получают в виде бесцветного масла.
1H-ЯМР (CDCl3) δ: 1,44 (с, 9H), 1,87-1,99 (м, 4H), 3,28-3,34 (м, общий 5 H, включая с, 3H, при δ: 3,31), 3,49 (м, 1H), 3,51-3,61 (м, 1H), 3,96 (м, 2H), 4,52 (с, 2H), 7,25-7,33 (м, 5H).
(Стадия 4) Синтез N-трет-бутоксикарбонил-(5R)-метоксиметил-(2S)-пирролидинметанола
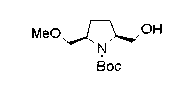
(2S)-Бензилоксиметил-N-трет-бутоксикарбонил-(5R)- метоксиметилпирролидин (183 мг, 0,55 ммоль) растворяют в метаноле (10 мл). В присутствии 10% палладия на угле (40 мг, приблизительно 20 масс.%) образовавшийся раствор подвергают каталитическому гидрированию в течение 15 часов. Из реакционной смеси катализатор отфильтровывают и фильтрат перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси н-гексан/этилацетат (2:1, об./об.) N-трет-бутоксикарбонил-(5R)-метоксиметил-(2S)-пирролидинметанол (116 мг, 87%) получают в виде бесцветного масла.
1H-ЯМР (CDCl3) δ: 1,48 (с, 9H), 1,87-2,01 (м, 4H), 3,36 (с, 3Н), 3,38-3,39 (м, 1Н), 3,45-3,51 (м, 1H), 3,78-3,99 (м, 3H), 4,66-4,69 (м, 1H).
(Стадия 5) Синтез метил-4-((5R)-метоксиметил-(2S)-пирролидинилметокси)бензоата
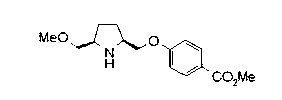
DIAD (1,14 мл, 5,79 ммоль) в ТГФ (20 мл) добавляют к N-трет-бутоксикарбонил-(5R)-метоксиметил-(2S)-пирролидинметанолу (950 мг, 3,87 ммоль), метил-4-гидроксибензоату (648 мг, 4,26 ммоль) и трифенилфосфину (1,22 г, 4,65 ммоль) и образовавшуюся смесь нагревают при кипячении с обратным холодильником в течение 10 часов. После охлаждения до комнатной температуры реакционную смесь перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси н-гексан/этилацетат (6:1, об./об.) получают метил-4-(N-трет-бутоксикарбонил-(5R)-метоксиметил-(2S)-пирролидинилметокси)бензоат (1,62 г).
Образовавшийся продукт (1,62 г) растворяют в метиленхлориде (15 мл). К образовавшемуся раствору добавляют трифторуксусную кислоту (15 мл). Реакционную смесь перемешивают при комнатной температуре в течение 17 часов. Реакционную смесь делают основной насыщенным водным раствором бикарбоната натрия с последующей экстракцией хлороформом. Экстракт промывают насыщенным раствором соли, сушат на безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси хлороформ/метанол (20:1, об./об.) метил-4-((5R)-метоксиметил-(2S)-пирролидинилметокси)бензоат (1,03 г, 95% для 2 стадий) получают в виде светло-желтого масла.
1H-ЯМР (CDCl3) δ: 1,49-2,01 (м, 5H), 3,27-3,33 (м, 1H), 3,37-3,44 (м, общий 5H, включая с, 3H, при δ: 3,37), 3,53-3,59 (м, 1H), 3,87-4,00 (м, общий 5H, включая с, 3H, при δ: 3,88), 6,09 (д, J=8,8 Гц, 2H), 7,97 (д, J=8,8 Гц, 2H).
(Стадия 6) Синтез метил-4-(N-трет-бутоксикарбонил-(5R)-метоксиметил-(2S)-пирролидинилметокси)циклогексанкарбоксилата
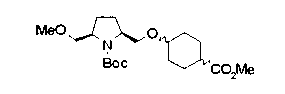
Метил-4-((5R)-метоксиметил-(2S)-пирролидинилметокси)бензоат (1,03 г, 3,69 ммоль) растворяют в смеси метанол/трифторуксусная кислота (21 мл, 20:1, об./об.) К образовавшемуся раствору добавляют родий на оксиде алюминия (0,50 г) и образовавшуюся смесь подвергают каталитическому гидрированию в течение 1 дня при давлении газообразного водорода 10 атм. Из реакционной смеси катализатор отфильтровывают и фильтрат перегоняют при пониженном давлении для удаления растворителя, в результате чего получают трифторацетат метил-4-((5R)-метоксиметил-(2S)-пирролидинилметокси)циклогексанкарбоксилата (1,15 г).
К образовавшемуся продукту (1,15 г) добавляют смесь диоксан/насыщенный водный раствор бикарбоната натрия (30 мл, 1:1, об./об.) и ди-трет-бутилдикарбонат (0,81 г, 3,71 ммоль) и образовавшуюся смесь перемешивают при комнатной температуре в течение 2 часов. Реакционную смесь подкисляют 1 н. HCl с последующей экстракцией этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси н-гексан/этилацетат (5:1, об./об.) метил-4-(N-трет-бутоксикарбонил-(5R)-метоксиметил-(2S)-пирролидинилметокси)циклогексанкарбоксилат (1,32 г, 93% для 2 стадий) получают в виде бесцветного масла.
1H-ЯМР (CDCl3) δ: 1,46 (с, 9H), 1,64-1,67 (м, 2H), 1,80-1,98 (м, 6H), 2,10-2,34 (м, 5H), 3,32-3,39 (м, общий 5H, включая с, 3H, при δ: 3,35), 3,46-3,63 (м, 3H), 3,67 (с, 3H), 3,91 (м, 2H).
(Стадия 7) Синтез метил-транс-4-(N-трет-бутоксикарбонил-(5R)-метоксиметил-(2S)-пирролидинилметокси)циклогексанкарбоксилата и метил-цис-4-(N-трет-бутоксикарбонил-(5R)-метоксиметил-(2S)-пирролидинилметокси)циклогексанкарбоксилата
Метил-4-(N-трет-бутоксикарбонил-(5R)-метоксиметил-(2S)-пирролидинилметокси)циклогексанкарбоксилат (1,32 г, 3,42 ммоль) растворяют в метаноле (10 мл). К образовавшемуся раствору добавляют метоксид натрия (0,55 г, 10,2 ммоль) и смесь нагревают при кипячении с обратным холодильником в течение 20 часов. После охлаждения до комнатной температуры реакционную смесь концентрируют при пониженном давлении для удаления растворителя. К остатку добавляют воду с последующей экстракцией этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя, в результате чего получают сырой продукт. Сырой продукт растворяют в смеси метанол/бензол (10 мл, 1:4, об./об.). К образовавшемуся раствору добавляют триметилсилилдиазометан (2,0 М раствор в гексане, 680 мкл, 1,36 ммоль) и смесь перемешивают далее при комнатной температуре в течение 3 часов. Из реакционной смеси растворитель отгоняют при пониженном давлении. Остаток очищают колоночной флэш-хроматографией с использованием силикагеля, посредством чего из элюатных фракций смеси н-гексан/этилацетат (7:1, об./об.) метил-транс-4-(N-трет-бутоксикарбонил-(5R)-метоксиметил-(2S)-пирролидинилметокси)циклогексанкарбоксилат (321 мг, 24%) получают в виде светло-желтого масла.
1H-ЯМР (CDCl3) (1,4-транс): δ: 1,22-1,33 (м, 2H), 1,41-1,51 (м, общий 11H, включая с, 9H, при δ: 1,46), 1,87-2,07 (м, 8Н), 2,24-2,29 (м, 1H), 3,17-3,63 (м, общий 8H, включая с, 3H, при δ: 3,35), 3,66 (с, 3H), 3,87-3,97 (м, 2H).
Кроме того, метил-цис-4-(N-трет-бутоксикарбонил-(5R)-метоксиметил-(2S)-пирролидинилметокси)циклогексанкарбоксилат (349 мг, 26%) получают в виде бесцветного масла.
1H-ЯМР (CDCl3): (1,4-цис): δ: 1,43-1,52 (м, общий 11H, включая с, 9H, при δ: 1,46), 1,64-1,67 (м, 2H), 1,79-1,97 (м, 8H), 2,32-2,36 (м, 1H), 3,29-3,52 (м, общий 8H, включая с, 3H, при δ: 3,35), 3,66 (с, 3H), 3,88-3,94 (м, 2H).
(Стадия 8) Синтез метил-транс-4-((5R)-метоксиметил-(2S)-пирролидинилметокси)циклогексанкарбоксилата
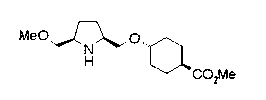
Метил-транс-4-(N-трет-бутоксикарбонил-(5R)-метоксиметил-(2S)-пирролидинилметокси)циклогексанкарбоксилат (321 мг, 0,83 ммоль) растворяют в метиленхлориде (3 мл). К образовавшемуся раствору добавляют трифторуксусную кислоту (3 мл) и смесь перемешивают при комнатной температуре в течение 1 часа. Реакционную смесь делают основной насыщенным водным раствором бикарбоната натрия с последующей экстракцией хлороформом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя, получая при этом метил-транс-4-((5R)-метоксиметил-(2S)-пирролидинилметокси)циклогексанкарбоксилат (240 мг, 100%) в виде светло-желтого масла.
1H-ЯМР (CDCl3) δ: 1,21-1,33 (м, 2H), 1,41-1,50 (м, 2H), 1,80-1,86 (м, 3H), 1,99-2,09 (м, 5H), 2,23-2,30 (м, 1H), 3,18-3,26 (м, 1H), 3,29-3,44 (м, общий 8H, включая с, 3H, при δ: 3,36), 3,49-3,52 (м, 1H), 3,66 (с, 3H).
(Стадия 9) Синтез метил-транс-4-(1-((5-хлор-2-фтор-4-((1-метил-3-индолилкарбонил)амино)фенил)ацетил)-(5R)-метоксиметил-(2S)-пирролидинилметокси)циклогексанкарбоксилата

В ДМФ (5 мл) (5-хлор-2-фтор-4-((1-метил-3-индолилкарбонил)амино)фенил)уксусную кислоту (168 мг, 0,47 ммоль), метил-транс-4-((5R)-метоксиметил-(2S)-пирролидинилметокси)циклогексанкарбоксилат (133 мг, 0,47 ммоль), EDC·HCl (134 мг, 0,70 ммоль), HOBt (94 мг, 0,70 ммоль) и триэтиламин (100 мкл, 0,71 ммоль) перемешивают при комнатной температуре в течение 20 часов. Реакционную смесь разбавляют водой с последующей экстракцией этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси н-гексан/этилацетат (от 1:1 до 4:5, об./об.) метил-транс-4-(1-((5-хлор-2-фтор-4-((1-метил-3-индолилкарбонил)амино)фенил)ацетил)-(5R)-метоксиметил-(2S)-пирролидинилметокси)циклогексанкарбоксилат (251 мг, 86%) получают в виде светло-желтого масла.
1H-ЯМР (CDCl3) δ: 1,14-1,32 (м, 2H), 1,40-1,53 (м, 2H), 1,85-2,10 (м, 8H), 2,23-2,32 (м, 1H), 3,20-3,25 (м, 1H), 3,39-3,84 (м, 12H), 3,87 (с, 3H), 4,11-4,24 (м, 2H), 7,30-7,42 (м, 4H), 7,79 (с, 1Н), 8,11-8,15 (м, 1H), 8,28 (с, 1H), 8,49 (дд, J=1,5, 12,0 Гц, 1H).
МС (ESI) m/z 628,5 (M++1).
(Стадия 10) Синтез транс-4-(1-((5-хлор-2-фтор-4-((1-метил-3-индолилкарбонил)амино)фенил)ацетил)-(5R)-метоксиметил-(2S)-пирролидинилметокси)циклогексанкарбоновой кислоты
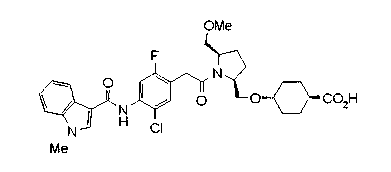
Метил-транс-4-(1-((5-хлор-2-фтор-4-((1-метил-3-индолилкарбонил)амино)фенил)ацетил)-(5R)-метоксиметил-(2S)-пирролидинилметокси)циклогексанкарбоксилат (251 мг, 0,40 ммоль) растворяют в ТГФ (3 мл). К образовавшемуся раствору добавляют 0,5 н. NaOH (3,0 мл, 1,50 ммоль) и образовавшуюся смесь перемешивают при комнатной температуре в течение 15 часов. Реакционную смесь выливают в смесь лед - 1 н. HCl. Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении. Сырые кристаллы очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси хлороформ/метанол (от 50:1 до 20:1, об./об.) указанное в заголовке соединение (160 мг, 65%) получают в виде белого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 1,14-1,40 (м, 4H), 1,74-1,90 (м, 8H), 2,06-2,17 (м, 1H), 3,16-3,55 (м, 8H), 3,79-3,84 (м, 2H), 3,88 (с, 3H), 3,99-4,06 (м, 1H), 4,18-4,25 (м, 1Н), 7,18-7,28 (м, 2H), 7,40-7,43 (м, 1H), 7,55 (д, J=8,1 Гц, 1H), 7,66-7,69 (м, 1H), 8,14 (д, J=8,1 Гц, 1H), 8,30 (с, 1H), 9,30 (с, 1H), 12,02 (ушир.с, 1H).
МС (ESI) m/z 614 (M++1).
Анал. Вычисл. для С32Н37ClFN3O6: С, 62,59; H, 6,07; N, 6,84; F, 3,09; Cl, 5,77.
Найдено: C, 62,43; H, 6,20; N, 6,59; F, 2,93; Cl, 5,47.
Пример 165
транс-4-(1-((2-(5-Фтор-2-метилфениламино)-7-фтор-6-бензоксазолил)ацетил)-(5R)-метоксиметил-(2S)-пирролидинилметокси)циклогексанкарбоновая кислота:
(Стадия 1) Синтез метил-транс-4-(1-((2-(5-фтор-2-метилфениламино)-7-фтор-6-бензоксазолил)ацетил)-(5R)-метоксиметил-(2S)-пирролидинилметокси)циклогексанкарбоксилата
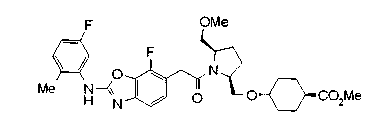
В ДМФ (5 мл) (2-(5-фтор-2-метилфениламино)-7-фтор-6-бензоксазолил)уксусную кислоту (123 мг, 0,39 ммоль), метил-транс-4-((5R)-метоксиметил-(2S)-пирролидинилметокси)циклогексанкарбоксилат (110 мг, 0,39 ммоль), EDC·HCl (110 мг, 0,57 ммоль), HOBt (78 мг, 0,58 ммоль) и триэтиламин (80 мкл, 0,57 ммоль) перемешивают при комнатной температуре в течение 20 часов. Реакционную смесь разбавляют водой с последующей экстракцией этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси н-гексан/этилацетат (1:1, об./об.) метил-транс-4-(1-((2-(5-Фтор-2-метилфениламино)-7-фтор-6-бензоксазолил)ацетил)-(5R)-метоксиметил-(2S)-пирролидинилметокси)циклогексанкарбоксилат (223 мг, 99%) получают в виде светло-желтого масла.
1H-ЯМР (CDCl3) δ: 1,20-1,33 (м, 2H), 1,40-1,53 (м, 2H), 1,86-2,11 (м, 8H), 2,23-2,27 (м, 1H), 2,30 (с, 3H), 3,19-3,28 (м, 1H), 3,34-3,71 (м, общий 10H), 3,83-3,97 (м, 2H), 4,19-4,25 (м, 2H), 6,72-6,76 (м, 1H), 7,05-7,35 (м, 4H), 8,04-8,07 (дд, J=2,4, 10,7 Гц, 1H).
МС (ESI) m/z 586,4 (M++1).
(Стадия 2) Синтез транс-4-(1-((2-(5-Фтор-2-метилфениламино)-7-фтор-6-бензоксазолил)ацетил)-(5R)-метоксиметил-(2S)-пирролидинилметокси)циклогексанкарбоновой кислоты
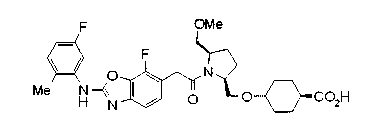
Метил-транс-4-(1-((2-(5-фтор-2-метилфениламино)-7-фтор-6-бензоксазолил)ацетил)-(5R)-метоксиметил-(2S)-пирролидинилметокси)циклогексанкарбоксилат (223 мг, 0,38 ммоль) растворяют в ТГФ (3 мл). К образовавшемуся раствору добавляют 0,5 н. NaOH (3,0 мл, 1,50 ммоль). Образовавшуюся смесь перемешивают при комнатной температуре в течение 15 часов. Реакционную смесь выливают в смесь лед - 1 н. HCl с последующей экстракцией этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Сырые кристаллы перекристаллизовывают из смеси н-гексан/этилацетат, получая при этом указанное в заголовке соединение (169 мг, 78%) в виде белого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 1,13-1,36 (м, 4H), 1,75-1,94 (м, 8H), 2,14 (м, 1H), 2,28 (с, 3H), 3,15-3,53 (м, 8H), 3,86-3,88 (м, 2H), 3,90-4,02 (м, 1Н), 4,21-4,23 (м, 1H), 6,86-6,89 (м, 1H), 7,02-7,04 (м, 1H), 7,18-7,26 (м, 2H), 7,90-7,93 (м, 1H).
МС (ESI) m/z 572 (M++1).
Анал. Вычисл. для С30Н35FN3O6: С, 63,04; H, 6,17; N, 7,35; F, 6,65.
Найдено: C, 63,01; H, 6,35; N, 6,96; F, 6,28.
Пример 166
транс-4-(1-((5-Хлор-2-фтор-4-((1-метил-3-индазолилкарбонил)амино)фенил)ацетил)-(5R)-метоксиметил-(2S)-пирролидинилметокси)циклогексанкарбоновая кислота:
(Стадия 1) Синтез метил-транс-4-(1-((5-хлор-2-фтор-4-((1-метил-3-индазолилкарбонил)амино)фенил)ацетил)-(5R)-метоксиметил-(2S)-пирролидинилметокси)циклогексанкарбоксилата
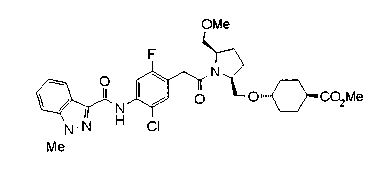
В ДМФ (3 мл) (5-хлор-2-фтор-4-((1-метил-3-индазолилкарбонил)амино)фенил)уксусную кислоту (56 мг, 0,15 ммоль), метил-транс-4-((5R)-метоксиметил-(2S)-пирролидинилметокси)циклогексанкарбоксилат (60 мг, 0,15 ммоль), EDC·HCl (45 мг, 0,23 ммоль), HOBt (32 мг, 0,24 ммоль) и триэтиламин (33 мкл, 0,24 ммоль) перемешивают при комнатной температуре в течение 2 дней. Реакционную смесь разбавляют водой с последующей экстракцией этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси хлороформ/метанол (40:1, об./об.) метил-транс-4-(1-((5-хлор-2-фтор-4-((1-метил-3-индазолилкарбонил)амино)фенил)ацетил)-(5R)-метоксиметил-(2S)-пирролидинилметокси)циклогексанкарбоксилат (101 мг, 100%) получают в виде бесцветного масла.
1H-ЯМР (CDCl3) δ: 1,21-1,32 (м, 2H), 1,41-1,53 (м, 2H), 1,85-2,05 (м, 8H), 2,23-2,32 (м, 1H), 3,20-3,25 (м, 1H), 3,35-3,84 (м, 12H), 4,13-4,26 (м, общий 5H, включая c, 3H при δ: 4,16), 7,31-7,39 (м, 2H), 7,44-7,49 (м, 2H), 8,39 (д, J=8,3 Гц, 1H), 8,51 (д, J=11,7 Гц, 1H), 9,49 (с, 1H).
(Стадия 2) Синтез транс-4-(1-((5-хлор-2-фтор-4-((1-метил-3-индазолилкарбонил)амино)фенил)ацетил)-(5R)-метоксиметил-(2S)-пирролидинилметокси)циклогексанкарбоновой кислоты
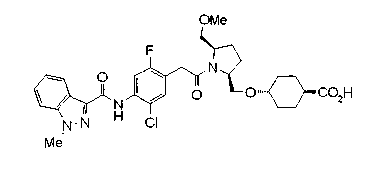
Метил-транс-4-(1-((5-хлор-2-фтор-4-((1-метил-3-индазолилкарбонил)амино)фенил)ацетил)-(5R)-метоксиметил-(2S)-пирролидинилметокси)циклогексанкарбоксилат (101 мг, 0,16 ммоль) растворяют в ТГФ (2 мл). К образовавшемуся раствору добавляют 0,5 н. NaOH (1,0 мл, 0,50 ммоль) и смесь перемешивают при комнатной температуре в течение 15 часов. Реакционную смесь выливают в смесь лед - 1 н. HCl с последующей экстракцией этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси хлороформ/метанол (40:1, об./об.) указанное в заголовке соединение (78 мг, 79%) получают в виде белого твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 1,11-1,48 (м, 4H), 1,74-2,01 (м, 8H), 2,14-2,17 (м, 1H), 3,16-3,55 (м, 8H), 3,80-3,89 (м, 2H), 3,97-4,07 (м, 1H), 4,17-4,26 (м, общий 4H, включая c, 3H при δ: 4,21), 7,34-7,38 (м, 1H), 7,45-7,48 (м, 1H), 7,51-7,55 (м, 1H), 7,81 (д, J=8,6 Гц, 1H), 8,03-8,07 (м, 1H), 8,20 (д, J=8,3 Гц, 1H), 9,71 (с, 1H), 12,06 (ушир.с, 1H).
МС (LC) m/z 614,8 (M++1), 613,6 (M+-1).
Анал. Вычисл. для C31H36ClFN4О6: C, 60,53; H, 5,90; N, 9,11; F, 3,09; Cl, 5,76.
Найдено: C, 60,56; H, 5,97; N, 8,71; F, 3,07; Cl, 5,70.
Пример 167
транс-4-(1-((2-(5-Фтор-2-метилфениламино)-7-фтор-6-бензоксазолил)ацетил)-(5S)-метоксиметил-(2S)-пирролидинилметокси)циклогексанкарбоновая кислота:
(Стадия 1) Синтез метил-транс-4-(1-((2-(5-фтор-2-метилфениламино)-7-фтор-6-бензоксазолил)ацетил)-(5S)- метоксиметил-(2S)-пирролидинилметокси)циклогексанкарбоксилата

В ДМФ (10 мл) растворяют (2-(5-фтор-2-метилфениламино)-7-фтор-6-бензоксазолил)уксусную кислоту (228 мг, 0,71 ммоль), метил-транс-4-((5S)-метоксиметил-(2S)-пирролидинилметокси)циклогексанкарбоксилат (186 мг, 0,65 ммоль) и EDC·HCl (163 мг, 0,85 ммоль). К образовавшемуся раствору добавляют HOBt (26,0 мг, 0,20 ммоль) и образовавшуюся смесь перемешивают при комнатной температуре в течение 18 часов. Реакционную смесь выливают в воду с последующей экстракцией этилацетатом. Экстракт промывают водой (три раза), сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают колоночной хроматографией с использованием тонкослойной пластины силикагеля (ТСХ), посредством чего из элюатных фракций смеси гексан-этилацетат (1/3) метил-транс-4-(1-((2-(5-фтор-2-метилфениламино)-7-фтор-6-бензоксазолил)ацетил)-(5S)-метоксиметил-(2S)-пирролидинилметокси)циклогексанкарбоксилат (331 мг, 87%) получают в виде бесцветного аморфного вещества.
1H-ЯМР (CDCl3), смесь ротамеров, δ: 1,12-2,32 (ряд м, 12H), 2,31 и 2,32 (с, общий 3H), 3,11-4,25 (ряд м, 10Н), 3,30, 3,31 и 3,39 (с, общий 3H), 3,63 и 3,67 (с, общий 3H), 6,73-6,78 (м, 1H), 7,11-7,16 (м, 2H), 7,23-7,27 (м, 2H), 8,07-8,12 (м, 1H).
МС (ESI) m/z 586 (M++1).
(Стадия 2) Синтез транс-4-(1-((2-(5-фтор-2-метилфениламино)-7-фтор-6-бензоксазолил)ацетил)-(5S)-метоксиметил-(2S)-пирролидинилметокси)циклогексанкарбоновой кислоты
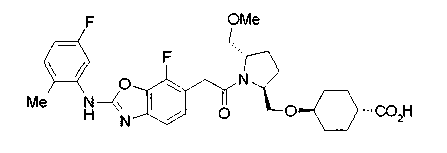
Метил-транс-4-(1-((2-(5-фтор-2-метилфениламино)-7-фтор-6-бензоксазолил)ацетил)-(5S)-метоксиметил-(2S)-пирролидинилметокси)циклогексанкарбоксилат (313 мг, 0,53 ммоль) растворяют в смеси ТГФ/метанол (1/1, 20 мл). К образовавшемуся раствору добавляют водный 0,25 н. NaOH (12,8 мл, 3,20 ммоль) и образовавшуюся смесь перемешивают при комнатной температуре в течение 18 часов. Реакционную смесь выливают в 1 н. HCl с последующей экстракцией смесью хлороформ/метанол (10/1). Экстракт сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси хлороформ/метанол (15/1) указанное в заголовке соединение (288 мг, 94%) получают в виде бесцветного аморфного вещества.
1H-ЯМР (CDCl3), смесь ротамеров, δ: 1,10-2,26 (ряд м, 12H), 2,29 и 2,31 (с, общий 3H), 3,07-4,28 (ряд м, 11H), 2,29 и 3,31 (с, общий 3H), 7,30-7,35 (м, 2H), 6,76 (дт, J=2,0,8,0 Гц, 1H), 7,11-7,21 (ряд м, 3H), 7,11-7,21 (ряд м, 3H), 7,82 и 7,90 (д, J=6,4 Гц, общий 1H).
МС (ESI) m/z 571 (M++1);
Анал. Вычисл. для С30Н35F2N3O6: С, 63,04; H, 6,17; N, 7,35. Найдено: С, 63,29; H, 6,32; N, 7,35.
Пример 168
транс-4-(1-((5-Хлор-2-фтор-4-((1-метил-3-индазолил)карбонил)аминофенил)ацетил)-(5S)-метоксиметил-(2S)-пирролидинилметокси)циклогексанкарбоновая кислота:
(Стадия 1) Синтез метил-транс-4-(1-((5-хлор-2-фтор-4-((1-метил-3-индазолил)карбонил)аминофенил)ацетил)-(5S)-метоксиметил-(2S)-пирролидинилметокси)циклогексанкарбоксилата
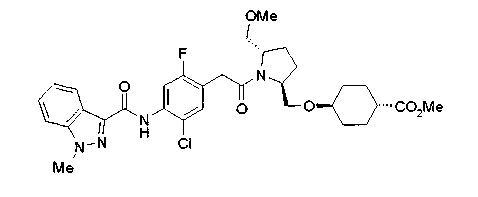
В ДМФ (10 мл) HOBt (29,0 мг, 0,21 ммоль) добавляют к (5-хлор-2-фтор-4-((1-метил-3-индазолил)карбонил)аминофенил)уксусной кислоте (280 мг, 0,78 ммоль), метил-транс-4-((5S)-метоксиметил-(2S)-пирролидинилметокси)циклогексанкарбоксилату (201 мг, 0,70 ммоль) и EDC·HCl (175 мг, 0,92 ммоль) и образовавшуюся смесь перемешивают при комнатной температуре в течение 18 часов. Реакционную смесь выливают в воду с последующей экстракцией этилацетатом. Экстракт промывают водой (три раза), сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией с использованием тонкослойной пластины силикагеля (ТСХ), посредством чего из элюатных фракций смеси гексан/этилацетат (1/5) метил-транс-4-(1-((5-хлор-2-фтор-4-((1-метил-3-индазолил)карбонил)аминофенил)ацетил)-(5S)-метоксиметил-(2S)-пирролидинилметокси)циклогексанкарбоксилат (322 мг, 73%) получают в виде бесцветного аморфного вещества.
1H-ЯМР (CDCl3), смесь ротамеров, δ: 1,10-2,30 (ряд м, 12H), 3,13-4,25 (ряд м, 10H), 3,33 и 3,37 (с, общий 3H), 3,61 и 3,67 (с, общий 3H), 4,18 (с, 3H), 7,33-7,37 (м, 1H), 7,43-7,51 (м, 3H), 8,40 (д, J=8,0 Гц, 1H), 8,50 и 8,53 (д, J=12,0 Гц, общий 1H), 9,50 (с, 1H).
МС (ESI) m/z 629 (M++1).
(Стадия 2) Синтез транс-4-(1-((5-хлор-2-фтор-4-((1-метил-3-индазолил)карбонил)аминофенил)ацетил)-(5S)-метоксиметил-(2S)-пирролидинилметокси)циклогексанкарбоновой кислоты
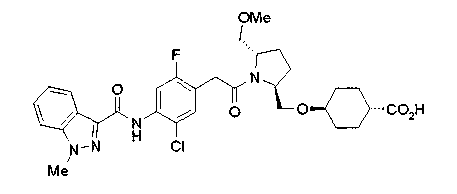
Метил-транс-4-(1-((5-хлор-2-фтор-4-((1-метил-3-индазолил)карбонил)аминофенил)ацетил)-(5S)-метоксиметил-(2S)-пирролидинилметокси)циклогексанкарбоксилат (305 мг, 0,49 ммоль) растворяют в смеси ТГФ/метанол (1/1, 20 мл). К образовавшемуся раствору добавляют 0,25 н. NaOH (11,6 мл, 2,91 ммоль) и смесь перемешивают при комнатной температуре в течение 18 часов. Реакционную смесь выливают в 1 н. HCl с последующей экстракцией смесью хлороформ/метанол (10/1). Экстракт сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси хлороформ/метанол (15/1) указанное в заголовке соединение (311 мг, 100%) получают в виде бесцветного аморфного вещества. 1H-ЯМР (CDCl3), смесь ротамеров, δ: 1,10-2,35 (ряд м, 12H), 3,14-4,26 (ряд м, 12H), 3,32 и 3,37 (с, общий 3H), 8,37-8,40 (м, 1H), 8,49 и 8,52 (с, общий 1H), 9,50 (с, 1H).
МС (ESI) m/z 615 (M++1);
Анал. Вычисл. для С31Н36ClFN4O6: C, 60,53; H, 5,90; N, 9,11.
Найдено: C, 60,67; H, 6,07; N, 8,80.
Пример 169
транс-4-(1-((5-Хлор-2-фтор-4-((1-метил-3-индазолилкарбонил)амино)фенил)ацетил)-(3S)-метокси-(2R)-пирролидинилметокси)циклогексанкарбоновая кислота:
(Стадия 1) Синтез N-бензилоксикарбонил-(2R)-трет-бутилдиметилсилилоксиметил-(3S)-метоксипирролидина
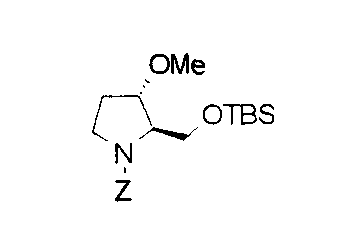
В ДМФ (10 мл) метилиодид (0,53 мл, 8,51 ммоль) добавляют к N-бензилоксикарбонил-(2R)-трет-бутилдиметилсилилоксиметил-(3S)-гидроксипирролидину (2,60 г, 7,11 ммоль) и гидриду натрия (0,34 г, 24,2 ммоль) при перемешивании при 0°С. Реакционную смесь перемешивают далее при такой же температуре в течение 13 часов. К реакционной смеси добавляют воду с последующей экстракцией этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси н-гексан/этилацетат (6:1, об./об.) N-бензилоксикарбонил-(2R)-трет-бутилдиметилсилилоксиметил-(3S)- метоксипирролидин (2,73 г, 100%) получают в виде бесцветного масла.
1H-ЯМР (CDCl3) δ: 0,05 (с, 6H), 0,90 и 0,93 (каждый с, общий 9H), 2,02-2,08 (м, 2H), 3,35-3,37 (каждый с, общий 3H), 3,41-3,64 (м, 3H), 3,75-3,98 (м, 3H), 5,08-5,27 (м, 2H), 7,32-7,40 (м, 5H).
Стадия 2) Синтез N-бензилоксикарбонил-((3S)-метокси-(2R)-пирролидинметанола
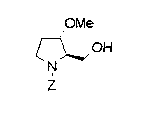
В ТГФ (15 мл) растворяют N-бензилоксикарбонил-(2R)-трет-бутилдиметилсилилоксиметил-(3S)-метоксипирролидин (2,73 г, 7,19 ммоль). К образовавшемуся раствору добавляют фторид тетрабутиламмония (TBAF) (1 М раствор в ТГФ, 14,4 мл, 14,4 ммоль) при перемешивании при 0°С. Реакционную смесь перемешивают далее при комнатной температуре в течение 18 часов. Реакционную смесь концентрируют при пониженном давлении. К остатку добавляют 1 н. HCl с последующей экстракцией этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси хлороформ/метанол (20:1, об./об.) N-бензилоксикарбонил-(3S)-метокси-(2R)-пирролидинметанол (2,01 г, 100%) получают в виде бесцветного масла.
1H-ЯМР (CDCl3) δ: 1,98 (м, 2H), 3,34 (с, 3H), 3,41-3,74 (м, 5H), 3,88 и 4,01 (каждый м, общий 1H), 5,14 (с, 2H), 7,30-7,36 (м, 5H).
МС (ESI) m/z 265,9 (M++1).
(Стадия 3) Синтез метил-4-((3S)-метокси-(2R)-пирролидинилметокси)бензоата

В ТГФ (20 мл) DIAD (1,69 мл, 8,58 ммоль) добавляют к N-бензилоксикарбонил-(3S)-метокси-(2R)-пирролидинметанолу (1,90 г, 7,16 ммоль), метил-4-гидроксибензоату (1,20 г, 7,89 ммоль) и трифенилфосфину (2,25 г, 8,58 ммоль) и образовавшуюся смесь нагревают при кипячении с обратным холодильником в течение 12 часов. После охлаждения до комнатной температуры реакционную смесь перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси н-гексан/этилацетат (1:1, об./об.) получают метил-4-(N-бензилоксикарбонил-(3S)-метокси-(2R)-пирролидинилметокси)бензоат.Образовавшееся соединение растворяют в метаноле (50 мл) с последующим добавлением 10% палладия на угле (1,50 г). Смесь подвергают каталитическому гидрированию в течение 20 часов при нормальном давлении. Из реакционной смеси катализатор отфильтровывают и фильтрат перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси хлороформ/метанол (30:1, об./об.) метил-4-((3S)-метокси- (2R)-пирролидинилметокси)бензоат (1,39 г, 73% для 2 стадий) получают в виде коричневого масла.
1H-ЯМР (CDCl3) δ: 1,87-2,01 (м, 2H), 3,03-3,18 (м, 2H), 3,35 (с, 3H), 3,43-3,47 (м, 1H), 3,79-3,82 (м, 1H), 3,89 (с, 3H), 3,95-4,02 (м, 2H), 6,91-6,93 (м, 2H), 7,97-8,00 (м, 2H).
(Стадия 4) Синтез метил-4-(N-трет-бутоксикарбонил-(3S)-метокси-(2R)-пирролидинилметокси)циклогексанкарбоксилата
Метил-4-((3S)-метокси-(2R)-пирролидинилметокси)бензоат (1,39 г, 5,24 ммоль) растворяют в смеси метанол/уксусная кислота (22 мл, 10:1, об./об.). К образовавшемуся раствору добавляют катализатор родий/оксид алюминия (0,55 г) и смесь подвергают каталитическому гидрированию в течение 2 дней при давлении газообразного водорода 10 атм. Из реакционной смеси катализатор отфильтровывают и фильтрат перегоняют при пониженном давлении для удаления растворителя. Остаток растворяют в хлороформе. Образовавшийся раствор промывают насыщенным водным раствором бикарбоната натрия, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя, получая при этом метил-4-((3S)-метокси-(2R)-пирролидинилметокси)циклогексанкарбоксилат (1,42 г). Образовавшийся продукт (1,42 г), ди-трет-бутилдикарбонат (1,26 г, 5,77 ммоль) и DMAP (0,06 г, 0,49 ммоль) перемешивают при комнатной температуре в течение 20 часов в ацетонитриле (20 мл). Из реакционной смеси растворитель отгоняют при пониженном давлении. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси н-гексан/этилацетат (от 4:1 до 3:1, об./об.) метил-4-(N-трет-бутоксикарбонил-(3S)-метокси-(2R)-пирролидинилметокси)циклогексанкарбоксилат (1,67 г, 86% для 2 стадий) получают в виде светло-желтого масла.
МС (ESI) m/z 372 (M++1).
(Стадия 5) Синтез метил-транс-4-((3S)-метокси-(2R)-пирролидинилметокси)циклогексанкарбоксилата
Метил-4-(N-трет-бутоксикарбонил-(3S)-метокси-(2R)-пирролидинилметокси)циклогексанкарбоксилат (1,67 г, 4,50 ммоль) растворяют в метаноле (15 мл). К образовавшемуся раствору добавляют метоксид натрия (0,73 г, 13,5 ммоль). Образовавшуюся смесь нагревают при кипячении с обратным холодильником в течение 24 часов. После охлаждения до комнатной температуры реакционную смесь концентрируют при пониженном давлении. Остаток подкисляют 1 н. HCl с последующей экстракцией этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток растворяют в смеси метанол/бензол (20 мл, 1:4, об./об.) с последующим добавлением триметилсилилдиазометана (2,0 М раствор в гексане, 1,10 мл, 1,10 ммоль). Образовавшуюся смесь перемешивают далее при комнатной температуре в течение 2 часов. Из реакционной смеси растворитель отгоняют при пониженном давлении. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси н-гексан/этилацетат (2:1, об./об.) метил-транс-4-(N-трет-бутоксикарбонил)-(3S)-метокси-(2R)-пирролидинилметокси)циклогексанкарбоксилат получают в виде бесцветного масла. Образовавшееся соединение (60 г) растворяют в метиленхлориде (3 мл). К образовавшемуся раствору добавляют трифторуксусную кислоту (3 мл). Образовавшуюся смесь перемешивают при комнатной температуре в течение 1 часа. Реакционную смесь делают основной насыщенным водным раствором бикарбоната натрия с последующей экстракцией хлороформом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя, в результате чего метил-транс-4-(3S)-метокси-(2R)-пирролидинилметокси)циклогексанкарбоксилат (40 мг, 3% для 3 стадий) получают в виде коричневого масла.
1H-ЯМР (CDCl3) δ: 1,21-1,29 (м, 2H), 1,42-1,52 (м, 2H), 1,72-2,08 (м, 6H), 2,23-2,31 (м, 1H), 2,99-3,02 (м, 2H), 3,15-3,51 (м, общий 8H, включая с, 3H, при δ: 3,31), 3,64-3,66 (м, общий 4H, включая с, 3H, при δ: 3,66).
(Стадия 6) Синтез метил-транс-4-(1-((5-хлор-2-фтор-4-((1-метил-3-индолилкарбонил)амино)фенил)ацетил)-(3S)-метокси-(2R)-пирролидинилметокси)циклогексанкарбоксилата
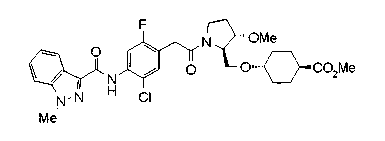
В ДМФ (3 мл) (5-хлор-2-фтор-4-((1-метил-3-индолилкарбонил)амино)фенил)уксусную кислоту (53 мг, 0,15 ммоль), метил-транс-4-((3S)-метокси-(2R)-пирролидинилметокси)циклогексанкарбоксилат (40 мг, 0,15 ммоль), EDC·HCl (42 мг, 0,22 ммоль), HOBt (30 мг, 0,22 ммоль) и триэтиламин (31 мкл, 0,22 ммоль) перемешивают при комнатной температуре в течение 3 часов. Реакционную смесь выливают в воду. Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении. Сырые кристаллы очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси хлороформ/метанол (60:1, об./об.) метил-транс-4-(1-((5-хлор-2-фтор-4-((1-метил-3-индолилкарбонил)амино)фенил)ацетил)-(3S)-метокси-(2R)-пирролидинилметокси)циклогексанкарбоксилат (70 мг, 77%) получают в виде бесцветного масла.
1H-ЯМР (CDCl3) δ: 1,12-1,26 (м, 2H), 1,38-1,52 (м, 2H), 1,94-2,07 (м, 5H), 2,16-2,28 (м, 2H), 3,17-3,24 (м, 1H), 3,33 (с, 3H), 3,44-3,74 (м, общий 9H, включая с, 3H, при δ: 3,62), 3,84-3,89 (м, 1H), 4,17 (с, 3H), 4,22-4,25 (м, 1H), 7,31-7,49 (м, 4H), 8,38 (д, J=8,1 Гц, 1H), 8,51 (д, J=11,8 Гц, 1H), 9,49 (с, 1H).
МС (ESI) m/z 614,8 (M++1).
(Стадия 7) Синтез транс-4-(1-((5-хлор-2-фтор-4-((1-метил-3-индолилкарбонил)амино)фенил)ацетил)-(3S)-метокси-(2R)-пирролидинилметокси)циклогексанкарбоновой кислоты

Метил-транс-4-(1-((5-хлор-2-фтор-4-((1-метил-3-индолилкарбонил)амино)фенил)ацетил)-(3S)-метокси-(2R)-пирролидинилметокси)циклогексанкарбоксилат (70 мг, 0,11 ммоль) растворяют в ТГФ (1,5 мл). К образовавшемуся раствору добавляют 0,25 н. NaOH (1,4 мл, 0,35 ммоль) и смесь перемешивают при комнатной температуре в течение 2 часов. Реакционную смесь выливают в смесь лед - 1 н. HCl. Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при пониженном давлении, получая при этом указанное в заголовке соединение (57 мг, 83%) в виде белого твердого вещества.
1H-ЯМР (CDCl3) δ: 1,13-1,37 (м, 4H), 1,85-2,18 (м, 7H), 3,15-3,84 (м, 11H), 3,95-3,96 и 4,11-4,14 (каждый м, общий 1H), 4,22 (с, 3H), 7,35-7,39 (м, 1H), 7,50-7,56 (м, 2H), 7,82 (д, J=8,6 Гц, 1H), 8,07 (д, J=11,3 Гц, 1Н), 8,21 (д, J=8,3 Гц, 1H), 9,72 (с, 1Н), 12,10 (ушир.с, 1H).
МС (LC) m/z 600,8 (M++1), 599,4 (M+-1);
Анал. Вычисл. для С30Н34ClFN4O6: С, 59,95; H, 5,70; N, 9,32; F, 3,16; Cl, 5,90.
Найдено: C, 59,71; H, 5,85; N, 8,89; F, 3,00; Cl, 5,88.
Пример 170
транс-4-(1-((2,5-Дихлор-4-((1-метил-1Н-3-индолилкарбонил)амино)фенилацетил)-(4S)-метокси-(2S)-пирролидинилметокси)циклогексанкарбоновая кислота:
(Стадия 1) Синтез транс-4-(1-((2,5-дихлор-4-((1-метил-1Н-3-индолилкарбонил)амино)фенилацетил)-(4S)-метокси-(2S)-пирролидинилметокси)циклогексанкарбоновой кислоты
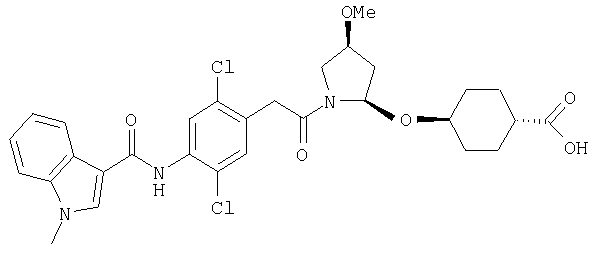
В ДМФ (2 мл) растворяют метил-транс-4-(N-трет-бутоксикарбонил-(4S)-метокси-(2S)-пирролидинилметокси)циклогексанкарбоксилат (100 мг, 0,37 ммоль). К образовавшемуся раствору добавляют (2,5-дихлор-4-((1-метил-1Н-3-индолилкарбонил)амино)фенил)уксусную кислоту (140 мг, 0,37 ммоль), HOBt (95 мг, 0,70 ммоль), DMAP (каталитическое количество) и соль EDC·HCl (107 мг, 0,56 ммоль). Образовавшуюся смесь перемешивают при комнатной температуре в течение 18 часов. Реакционную смесь выливают в 1 М HCl с последующей экстракцией этилацетатом три раза. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом магния и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем (Yamazen, среднее давление, хлороформ/метанол, от 10:0 до 97:3, 20 мл/мин, (50 мм×150 мм). Очищенный сложный эфир растворяют в ТГФ (4 мл) и к образовавшемуся раствору добавляют 0,25 М NaOH (2,4 мл, 0,61 ммоль). Образовавшуюся смесь перемешивают в течение 18 часов при комнатной температуре. Из реакционной смеси растворитель отгоняют при пониженном давлении. Остаток кристаллизуют добавлением 1 М HCl. Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при пониженном давлении, получая при этом указанное в заголовке соединение (150 мг, 66%) в виде бесцветного твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 1,10-1,40 (м, 4H), 1,80-2,20 (м, 8H), 3,15-4,30 (м, 8H), 3,28 (с, 3H), 3,90 (с, 3H), 7,21 (т, J=7,5 Гц, 1H), 7,28 (т, J=7,5 Гц, 1H), 7,50 (д, J=15,2 Гц, 1H), 7,56 (д, J=8,3 Гц, 1H), 7,88 (д, J=4,1 Гц, 1H), 8,15 (д, J=8,0 Гц, 1H), 8,31 (с, 1H), 9,39 (с, 1H).
МС (ESI) m/z 617 (M+1)+;
Анал. Вычисл. для С31Н35Cl2N3O6·0,5H2О: C, 59,52; H, 5,80; N, 6,72.
Найдено: C, 59,36; H, 5,72; N, 6,68.
Пример 171
транс-4-(1-(5-Хлор-2-фтор-4-((3-бензо(d)изотиазолилкарбонил)амино)фенилацетил)-(4S)-метокси-(2S)-пирролидинилметокси)циклогексанкарбоновая кислота:
(Стадия 1) Синтез транс-4-(1-(5-хлор-2-фтор-4-((3-бензо(d)изотиазолилкарбонил)амино)фенилацетил)-(4S)-метокси-(2S)-пирролидинилметокси)циклогексанкарбоновой кислоты
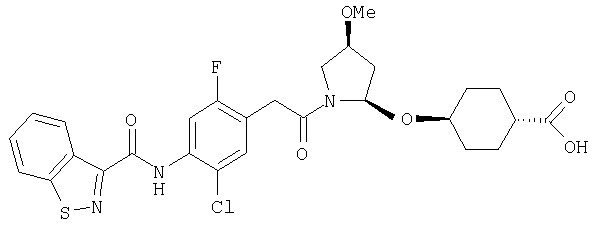
В ДМФ (2 мл) растворяют метил-транс-4-(N-трет-бутоксикарбонил-(4S)-метокси-(2S)-пирролидинилметокси)циклогексанкарбоксилат (100 мг, 0,37 ммоль). К образовавшемуся раствору добавляют (3-бензо(d)изотиазолилкарбонил)амино)фенилуксусную кислоту (135 мг, 0,37 ммоль), HOBt (95 мг, 0,70 ммоль), DMAP (каталитическое количество) и соль EDC·HCl (107 мг, 0,56 ммоль). Образовавшуюся смесь перемешивают при комнатной температуре в течение 18 часов. Реакционную смесь выливают в 1 М HCl с последующей экстракцией этилацетатом (три раза). Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом магния и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем (Yamazen, среднее давление, хлороформ/метанол, от 10:0 до 97:3, 20 мл/мин, 50 мм × 150 мм). Очищенный сложный эфир растворяют в ТГФ (4 мл) и к образовавшемуся раствору добавляют 0,25 М NaOH (2,4 мл, 0,61 ммоль). После перемешивания в течение 18 часов при комнатной температуре, реакционную смесь перегоняют при пониженном давлении для удаления растворителя. Остаток кристаллизуют добавлением 1 М HCl. Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при пониженном давлении, получая при этом указанное в заголовке соединение (150 мг, 67%) в виде бесцветного твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 1,10-1,40 (м, 4H), 1,80-2,20 (м, 8H), 3,15-4,30 (м, 8H), 3,28 (с, 3H), 7,51 (дд, J=7,0 Гц, 1H), 7,66 (т, J=7,5 Гц, 1H), 7,73 (т, J=7,5 Гц, 1H), 7,95 (дд, J=6,0,10,6 Гц, 1H), 8,38 (д, J=8,1 Гц, 1H), 8,81 (д, J=8,3 Гц, 1H), 10,30 (с, 1H), 12,05 (с, 1H).
МС (ESI) m/z 605 (M+1)+;
Анал. Вычисл. для C29H31ClFN3О6S·0,5H2О: C, 56,81; H, 5,26; N, 6,85.
Найдено: C, 56,78; H, 5,15; N, 6,86
Пример 172
транс-4-(1-((5-Хлор-2-фтор-4-(3-индазолилкарбониламино)фенил)ацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоновая кислота:
(Стадия 1) Синтез метил-1-(4-метоксибензил)-3-индазолилкарбоксилата

Метил-3-индазолилкарбоксилат (2,0 г, 11,4 ммоль) растворяют в ДМФ (20 мл). К образовавшемуся раствору добавляют 4-метоксибензилхлорид (1,7 мл, 12,5 ммоль) и карбонат калия (2,35 г, 17,0 ммоль). Образовавшуюся смесь перемешивают при 80°С в течение 15 часов. После охлаждения реакционную смесь выливают в воду (50 мл) с последующей экстракцией этилацетатом (200 мл). Экстракт промывают насыщенным раствором соли (2×100 мл), сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси гексан-этилацетат (4:1) метил-1-(4-метоксибензил)-3-индазолилкарбоксилат (полярные фракции, 838 мг, 25%) получают в виде светло-желтого масла и 2-(4-метоксибензил)-содержащий изомер (неполярные фракции, 500 мг, 15%) получают в виде светло-желтого масла.
1H-ЯМР (CDCl3) δ: 3,76 (с, 3H), 4,05 (с, 3H), 5,64 (с, 2H), 6,82 (д, J=8,5 Гц, 2H), 7,20 (д, J=8,5 Гц, 2H), 7,30 (дд, J=8,1, 4,2 Гц, 1H), 7,36-7,37 (м, 2H), 8,23 (дд, J=8,1, 1,0 Гц, 1H).
МС(ESI) m/z 297 (M++1).
(Стадия 2) Синтез 1-(4-метоксибензил)-3-индазолилкарбоновой кислоты
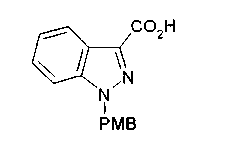
Метил-1-(4-метоксибензил)-3-индазолилкарбоксилат (830 мг, 2,80 ммоль) растворяют в ТГФ (22 мл). К образовавшемуся раствору добавляют 0,25 н. NaOH (22 мл, 5,60 ммоль). Образовавшуюся смесь перемешивают в течение 15 часов при комнатной температуре. Реакционную смесь выливают в 1 н. HCl (50 мл) с последующей экстракцией хлороформом (2×100 мл). Экстракт сушат над безводным сульфатом магния и перегоняют при пониженном давлении для удаления растворителя. Остаток растворяют в хлороформе и к образовавшемуся раствору добавляют гексан до тех пор, пока не произойдет осаждение. Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении и сушат в течение 12 часов при пониженном давлении, получая при этом 1-(4-метоксибензил)-3-индазолилкарбоновую кислоту (630 мг, 80%) в виде бесцветного аморфного вещества.
1H-ЯМР (ДМСО-d6) δ: 3,70 (с, 3H), 5,69 (с, 2H), 6,88 (д, J=8,8 Гц, 2H), 7,26 (д, J=8,8 Гц, 2H), 7,29-7,32 (м, 1H), 7,43-7,48 (м, 1Н), 7,84 (д, J=8,6 Гц, 1H), 8,08 (д, J=8,6 Гц, 1H), 13,06 (ушир.с, 1H).
МС (ESI) m/z 283 (M++1).
(Стадия 3) Синтез этил-(5-хлор-2-фтор-4-(1-(4-метоксибензил)-3-индазолилкарбониламино)фенил)ацетата

В метиленхлориде (10 мл) растворяют 1-(4-метоксибензил)-3-индазолилкарбоновую кислоту (630 мг, 2,23 ммоль). К образовавшемуся раствору добавляют оксалилхлорид (292 мкл, 3,53 ммоль) и ДМФ (1 капля). Образовавшуюся смесь перемешивают до тех пор, пока смесь не станет однородной. Из реакционной смеси растворитель отгоняют при пониженном давлении. Остаток растворяют в метиленхлориде (20 мл). К образовавшемуся раствору добавляют этил-(4-амино-5-хлор-2-фторфенил)ацетат (517 мг, 2,23 ммоль) и триэтиламин (621 мкл, 4,46 ммоль). Образовавшуюся смесь нагревают при кипячении с обратным холодильником в течение в течение 15 часов. После охлаждения в реакционную смесь добавляют воду (50 мл) с последующей экстракцией хлороформом (200 мл). Экстракт сушат над безводным сульфатом магния и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси гексан-этилацетат (4:1) этил-(5-хлор-2-фтор-4-(1-(4-метоксибензил)-3-индазолилкарбониламино)фенил)ацетат (881 мг, 80%) получают в виде светло-желтого аморфного вещества.
1H-ЯМР (CDCl3) δ: 1,27 (т, J=7,1 Гц, 3H), 3,62 (с, 2H), 3,77 (с, 3H), 4,19 (кв., J=7,1H, 2H), 5,59 (с, 2H), 6,85 (д, J=8,8 Гц, 2H), 7,22 (д, J=8,8 Гц, 2H), 7,24-7,42 (м, 4H), 8,39 (д, J=8,1 Гц, 1H), 8,54 (д, J=11,7 Гц, 1H), 9,56 (с, 1Н).
МС (ESI) m/z 496 (M++1).
(Стадия 4) Синтез этил-(5-хлор-2-фтор-4-(3-индазолилкарбониламино)фенил)ацетата
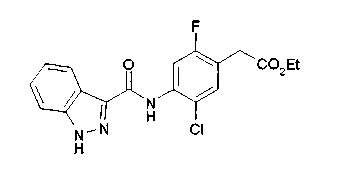
Смесь анизола (288 мкл, 2,66 ммоль), трифторуксусной кислоты (10 мл) и этил-(5-хлор-2-фтор-4-(1-(4-метоксибензил)-3-индазолилкарбониламино)фенил)ацетата (880 мг, 1,77 ммоль) нагревают при кипячении с обратным холодильником в течение 15 часов. После охлаждения реакционную смесь перегоняют при пониженном давлении для удаления растворителя. К остатку добавляют воду (50 мл). Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении и промывают водой. Таким образом полученные сырые кристаллы перекристаллизовывают из смеси хлороформ-метанол, в результате чего этил-(5-хлор-2-фтор-4-(3-индазолилкарбониламино)фенил)ацетат (531 мг, 80%) получают в виде бесцветного кристаллического порошка.
1H-ЯМР (ДМСО-d6) δ: 1,20 (т, J=7,1 Гц, 3H), 3,75 (с, 2H), 4,12 (кв., J=7,1 Гц, 2H), 7,34 (т, J=7,8 Гц, 1H), 7,49 (дт, J=8,1, l,0 Гц, 1H), 7,63 (д, J=7,8 Гц, 1H), 7,71 (д, J=8,1 Гц, 1H), 8,16 (д, J=11,5 Гц, 1H), 8,21 (д, J=8,1 Гц, 1H), 9,79 (с, 1H).
МС (ESI) m/z 376 (M++1).
(Стадия 5) Синтез (5-хлор-2-фтор-4-(3-индазолилкарбониламино)фенил)уксусной кислоты
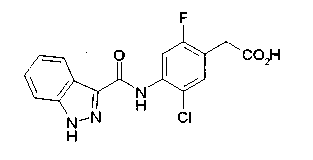
Этил-(5-хлор-2-фтор-4-(3-индазолилкарбониламино)фенил)ацетат (531 мг, 1,41 ммоль) растворяют в метаноле (50 мл). К образовавшемуся раствору добавляют 0,25 н. NaOH (12 мл, 3 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 15 часов. Реакционную смесь выливают в 1 н. HCl (100 мл). Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при пониженном давлении в течение 15 часов, получая при этом (5-хлор-2-фтор-4- (3-индазолилкарбониламино)фенил)уксусную кислоту (480 мг, 98%) в виде бесцветного кристаллического порошка.
1H-ЯМР (ДМСО-d6) δ: 3,63 (с, 2H), 7,34 (т, J=7,6 Гц, 1H), 7,49 (т, J=7,6 Гц, 1H), 7,62 (м, 1Н), 7,72 (д, J=8,3 Гц, 1H), 8,13 (д, J=11,2 Гц, 1H), 8,21 (д, J=8,1 Гц, 1H), 9,79 (с, 1Н), 13,96 (ушир.с, 1H).
(Стадия 6) Синтез метил-транс-4-(1-((5-хлор-2-фтор-4-(3-индазолилкарбониламино)фенил)ацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилата
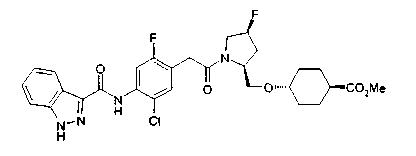
В ДМФ (10 мл) растворяют (5-хлор-2-фтор-4-(3-индазолилкарбониламино)фенил)уксусную кислоту (300 мг, 0,863 ммоль) и метил-транс-4-((4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилат (соединение, синтезированное в стадии 3 примера 21) (224 мг, 0,863 ммоль). К образовавшемуся раствору добавляют EDC·HCl (248 мг, 1,29 ммоль), HOBt (каталитическое количество) и DMAP (каталитическое количество). Образовавшуюся смесь перемешивают при комнатной температуре в течение 15 часов. К реакционной смеси добавляют этилацетат (200 мл) и воду (200 мл). Слой этилацетата промывают насыщенным раствором соли (2×100 мл), сушат над безводным сульфатом магния и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке силикагеля, посредством чего из элюатных фракций смеси хлороформ-метанол (20:1) метил-транс-4- (1-((5-хлор-2-фтор-4-(3-индазолилкарбониламино)фенил)ацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилат (223 мг, 44%) получают в виде бесцветного твердого вещества.
1H-ЯМР (ДМСО-d6) δ: 1,20-1,35 (м, 2H), 1,36-1,54 (м, 2H), 1,96-2,12 (м, 4H), 2,20-2,58 (м, 3H), 3,24-4,12 (ряд м, 10H), 4,36 и 4,47 (м, каждый, общий 1H, вследствие характера двойной связи С(О)-N-связи в амиде), 5,25 и 5,38 (м, каждый, общий 1H, due вследствие характера двойной связи С(О)-N-связи в амиде), 7,26 (м, 1H), 7,36-7,40 (м, 1H), 7,47-7,49 (м, 1H), 8,20 (т, J=13,4 Гц, 1H), 8,33 (д, J=8,1 Гц, 1H), 9,50 (д, J=8,1 Гц, 1H), 11,7 (с, 1H).
МС (ESI) m/z 589 (M++1).
(Стадия 7) Синтез транс-4-(1-((5-хлор-2-фтор-4-(3-индазолилкарбониламино)фенил)ацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоновой кислоты

Метил-транс-4-(1-((5-хлор-2-фтор-4-(3-индазолилкарбониламино)фенил)ацетил)-(4S)-фтор-(2S)-пирролидинилметокси)циклогексанкарбоксилат (223 мг, 0,379 ммоль) растворяют в ТГФ (5 мл). К образовавшемуся раствору добавляют 0,25 н. NaOH (4 мл, 1 ммоль). Образовавшуюся смесь перемешивают при комнатной температуре в течение 15 часов. Реакционную смесь выливают в 1 н. HCl (100 мл) с последующей экстракцией смесью хлороформ-метанол (5:1, 2×100 мл). Экстракт сушат над безводным сульфатом магния и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси хлороформ-метанол (от 10:1 до 5:1) указанное в заголовке соединение (125 мг, 57%) получают в виде бесцветного аморфного вещества.
1H-ЯМР (ДМСО-d6) δ: 1,17-1,38 (м, 4H), 1,86-2,23 (ряд м, 7H), 3,17-4,37 (ряд м, 8H), 5,26-5,49 (м, 1H), 7,34 (т, J=7,6 Гц, 1H), 7,48-7,53 (м, 2H), 7,72 (д, J=8,3 Гц, 1H), 8,12 (дд, J=11,5,4,9 Гц, 1H), 8,22 (д, J=8,3 Гц, 1Н), 9,79 (с, 1H), 13,90 (ушир.с, 1Н).
МС (ESI) m/z 575 (M++1);
Анал. Вычисл. для С28Н29ClF2N4O5: C, 58,49; H, 5,08; N, 9,74.
Найдено: C, 58,32; H, 5,28; N, 9,22.
Пример 173
транс-4-(1-((5-Хлор-2-фтор-4-((1-метил-3-индолилкарбонил)амино)фенил)ацетил)-(5R)-изопропил-(2S)-пирролидинилметокси)циклогексанкарбоновая кислота:
(Стадия 1) Синтез бензил-(2S)-(N-(трет-бутоксикарбонил)амино-6-метил-5-оксо)гептаноата

В ТГФ (60 мл) изопропилмагнийхлорид (2,0 М раствор в эфире, 15,0 мл, 30,0 ммоль) добавляют к бензил-1-(трет-бутоксикарбонил)-L-пироглутамату (8,02 г, 25,1 ммоль) при перемешивании при -78°С.После перемешивания при такой же температуре в течение 2,5 часов реакционную смесь подкисляют насыщенным водным раствором хлорида аммония и 1 н. HCl при такой же температуре. Образовавшуюся смесь перемешивают при комнатной температуре в течение 14 часов. Реакционную смесь концентрируют при пониженном давлении для удаления растворителя с последующей экстракцией этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают флэш-хроматографией Biotage на колонке с силикагелем, посредством чего из элюатных фракций смеси н-гексан/этилацетат (6:1, об./об.) бензил-(2S)-((трет-бутоксикарбонил)амино-6-метил-5-оксо)гептаноат (1,79 г, 20%) получают в виде светло-желтого масла.
1H-ЯМР (CDCl3) δ: 1,05 (д, J=7,0 Гц, 6H), 1,43 (с, 9H), 1,92 (м, 1H), 2,10 (м, 1H), 2,42-2,58 (м, 3H), 4,31 (м, 1H), 5,09 (м, 1H), 5,13 и 5,20 (AB кв., J=12,2 Гц, 2H), 7,35 (м, 5H);
МС (ESI) m/z 364 (M++1).
(Стадия 2) Синтез гидрохлорида (5S)-бензилоксикарбонил-2-изопропил-1-пирролидина
К бензил-(2S)-((трет-бутоксикарбонил)амино-6-метил-5-оксо)гептаноату (3,83 г,10,5 ммоль) добавляют 4,0 н. HCl (раствор в диоксане, 6 мл). Образовавшуюся смесь перемешивают в течение 3 часов при комнатной температуре. Реакционную смесь перегоняют при пониженном давлении для удаления растворителя, получая при этом гидрохлорид (5S)-бензилоксикарбонил-2-изопропил-1-пирролидина (3,05 г, 100%) в виде коричневого масла.
1H-ЯМР (CDCl3) δ: 1,35 (д, J=7,2 Гц, 6H), 3,48 (м, 1H), 2,72 (м, 1H), 2,42-2,58 (м, 3H), 3,56 (м, 1H), 5,21 и 5,25 (AB кв., J-7,7 Гц, 2H), 7,33-7,41 (м, 5H).
(Стадия 3) Синтез 1-(трет-бутоксикарбонил)-(5R)-изопропил-L-пролина
В этаноле (20 мл) растворяют гидрохлорид (5S)-бензилоксикарбонил-2-изопропил-1-пирролидина (3,05 г, 10,5 ммоль). К образовавшемуся раствору добавляют 10% палладий на угле (750 мг) и смесь подвергают каталитическому гидрированию при комнатной температуре и нормальном давлении в течение 18 часов. После удаления катализатора фильтрованием фильтрат перегоняют при пониженном давлении для удаления растворителя, в результате чего получают коричневое твердое вещество. Образовавшийся продукт растворяют в смеси ацетонитрил-вода (1:1, об./об., 50 мл). К образовавшемуся раствору добавляют ди-трет-бутилдикарбонат (2,29 г, 10,5 ммоль) и триэтиламин (2,93 мл, 21,0 ммоль) и смесь перемешивают при комнатной температуре в течение 2 часов. Реакционную смесь концентрируют при пониженном давлении для удаления растворителя. К остатку добавляют 1 н. HCl с последующей экстракцией этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом магния и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси н-гексан/этилацетат (1:1, об./об.) 1-(трет-бутоксикарбонил)-(5R)-изопропил-L-пролин (2,18 г, 81%) получают в виде белого твердого вещества.
1H-ЯМР (CDCl3) δ: 0,91 (м, 6H), 1,48 (с, 9H), 1,80-1,86 (м, 2H), 1,95-2,35 (ряд м, общий 4H), 3,73 (м, 1H), 4,34 (ушир.с, 1H).
МС (ESI) m/z 258 (M++1).
(Стадия 4) Синтез 1-(трет-бутоксикарбонил)-(5R)-изопропил-(2S)-пирролидинилметанола
В ТГФ (40 мл) растворяют 1-(трет-бутоксикарбонил)-(5R)-изопропил-L-пролин (2,18 г, 8,48 ммоль). К образовавшемуся раствору добавляют комплекс борандиметилсульфид (1,70 мл, 17,0 ммоль). Образовавшуюся смесь перемешивают при 60°С в течение 2 часов. К реакционной смеси добавляют воду при 0°С и затем смесь перегоняют при пониженном давлении для удаления растворителя. К остатку добавляют 1 н. HCl с последующей экстракцией этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом магния и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси н-гексан/этилацетат (3:1, об./об.) 1-(трет-бутоксикарбонил)-(5R)-изопропил-(2S)-пирролидинилметанол (530 мг, 96%) получают в виде бесцветного масла.
1H-ЯМР (CDCl3) δ: 0,86 (д, J=6,8 Гц, 3H), 0,92 (д, J=6,8 Гц, 3H), 1,47 (с, 9H), 1,65 и 1,67 (с, общий, 1H), 1,74 (м, 3H), 1,99 (м, 1H), 3,52 (т, J=9,6 Гц, 1Н), 3,66 (м, 2H), 4,00 (м, 1H), 5,06 (м, 1H).
МС (ESI) m/z 244 (M++1).
(Стадия 5) Синтез метил-4-(1-(трет-бутоксикарбонил)-(5R)-изопропил-(2S)-пирролидинилметокси)бензоата
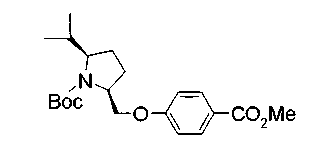
В ТГФ (30 мл) DIAD (1,85 мл, 9,39 ммоль) добавляют по каплям к 1-(трет-бутоксикарбонил)-(5R)-изопропил-(2S)-пирролидинилметанолу (1,90 г, 7,81 ммоль), трифенилфосфину (2,46 мл, 9,38 ммоль) и метил-4-гидроксибензоату (1,19 г, 7,82 ммоль). После завершения добавления реакционную смесь перемешивают при комнатной температуре в течение 14 часов. Из реакционной смеси растворитель отгоняют при пониженном давлении. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси н-гексан/этилацетат (4:1, об./об.) метил-4-(1-(трет-бутоксикарбонил)-(5R)-изопропил-(2S)-пирролидинилметокси)бензоат (2,97 г, 100%) получают в виде светло-желтого масла
1H-ЯМР (CDCl3) δ: 0,86 и 0,90 (д, J=6,8 Гц, общий 6H, вследствие характера двойной связи С(О)-N-связи в амиде), 1,26-1,44 (м, 1Н), 1,47 (с, 9H), 1,79 (м, 2H), 1,98 (м, 3H), 3,63 (м, 1H), 3,88 (с, 3H), 4,16 (м, 1H), 4,23 (м, 1H), 6,94 (д, J=8,8 Гц, 2H), 7,97 (д, J=8,8 Гц, 2H).
МС (ESI) m/z 378 (M++1).
(Стадия 6) Синтез метил-4-(1-(трет-бутоксикарбонил)-(5R)-изопропил-(2S)-пирролидинилметокси)циклогексанкарбоксилата
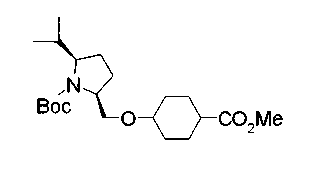
Метил-4-(1-(трет-бутоксикарбонил)-(5R)-изопропил-(2S)-пирролидинилметокси)бензоат (2,97 г, 7,81 ммоль) растворяют в метиленхлориде (15 мл). К образовавшемуся раствору добавляют трифторуксусную кислоту (3,5 мл). После перемешивания в течение 3 часов при комнатной температуре реакционную смесь перегоняют при пониженном давлении для удаления растворителя, в результате чего получают желтое масло. Образовавшееся желтое масло растворяют в этаноле (35 мл). К образовавшемуся раствору добавляют катализатор родий-оксид алюминия (1,40 г) и каталитическое гидрирование проводят в течение 14 часов при давлении газообразного водорода 12 атм. После удаления катализатора фильтрованием фильтрат перегоняют при пониженном давлении для удаления растворителя, в результате чего получают светло-коричневое твердое вещество (1,60 г). Образовавшееся соединение растворяют в смеси ацетонитрил-вода (1:1, об./об., 40 мл). К образовавшемуся раствору добавляют ди-трет-бутилдикарбонат (1,23 г, 5,63 ммоль) и триэтиламин (786 мкл, 5,64 ммоль) и смесь перемешивают при комнатной температуре в течение 2 часов. Реакционную смесь концентрируют при пониженном давлении для удаления растворителя. К остатку добавляют 1 н. HCl с последующей экстракцией этилацетатом. Экстракт промывают насыщенным водным раствором бикарбоната натрия, сушат над безводным сульфатом магния и перегоняют при пониженном давлении для удаления растворителя, посредством чего метил-4-(1-(трет-бутоксикарбонил)-(5R)-изопропил-(2S)-пирролидинилметокси)циклогексанкарбоксилат (светло-желтое масло, 2,18 г, 100%) получают в виде смеси цис-транс-изомеров (приблизительно 4:1, определено по 1Н ЯМР-спектру).
1H-ЯМР (CDCl3) δ: 0,81 и 0,88 (д, J=6,8 Гц, общий 6H, вследствие характера двойной связи С(О)-N-связи в амиде), 1,45 (с, 9H), 1,47-1,74 (ряд м, общий 4H), 1,79-1,92 (ряд м, общий 6H), 2,04 (с, 3H), 2,34 (м, 1Н), 3,23 (м, 1H), 3,47 (м, 1H), 3,56 (м, 2H), 3,67 (с, 3H), 3,91 (м, 1H).
(Стадия 7) Синтез метил-транс-4-((5R)-изопропил-(2S)-пирролидинилметокси)циклогексанкарбоксилата
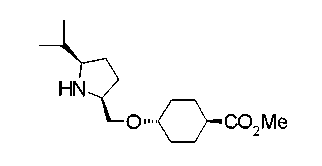
Метил-4-(1-(трет-бутоксикарбонил)-(5R)-изопропил-(2S)-пирролидинилметокси)циклогексанкарбоксилат (2,18 г, 5,54 ммоль) и метоксид натрия (914 мг, 16,9 ммоль) нагревают при кипячении с обратным холодильником в течение 14 часов в метаноле (50 мл). После охлаждения до комнатной температуры реакционную смесь концентрируют при пониженном давлении. К остатку добавляют 1 н. HCl с последующей экстракцией этилацетатом. Экстракт промывают насыщенным водным раствором бикарбоната натрия, сушат над безводным сульфатом магния и перегоняют при пониженном давлении для удаления растворителя, в результате чего получают желтое масло. Образовавшееся масло растворят в бензоле (40 мл) и метаноле (10 мл). К образовавшемуся раствору добавляют 2М раствор в гексане (1,4 мл, 2,8 ммоль) триметилсилилдиазометана и образовавшуюся смесь перемешивают при комнатной температуре в течение 2 часов. После добавления уксусной кислоты (500 мкл, 0,30 ммоль) растворитель отгоняют при пониженном давлении. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси н-гексан/этилацетат (6:1) получают транс-изомер в виде светло-желтого масла (740 мг). Образовавшийся продукт растворяют в метиленхлориде (12 мл). К образовавшемуся раствору добавляют трифторуксусную кислоту (3 мл) и смесь перемешивают при комнатной температуре в течение 2 часов. Из реакционной смеси растворитель отгоняют при пониженном давлении. Остаток нейтрализуют насыщенным водным раствором бикарбоната натрия с последующей экстракцией смесью хлороформ-метанол (5:1, об./об.). Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом магния и перегоняют при пониженном давлении для удаления растворителя, в результате чего метил-транс-4-((5R)-изопропил-(2S)-пирролидинилметокси)-циклогексанкарбоксилат (576 мг, 35%) получают в виде светло-желтого твердого вещества.
1H-ЯМР (CDCl3) δ: 0,97 (д, J=6,4 Гц, 3H), 1,11 (д, J=6,4 Гц, 3H), 1,25 (м, 2H), 1,47 (м, 2H), 1,72 (м, 1H), 1,81 (м, 1H), 1,89-2,11 (ряд м, общий 7H), 2,26 (tt, J=11,6, 3,6 Гц, 1H), 3,17 (м, 1H), 3,33 (тт, J=10,4, 3,6 Гц, 1H), 3,64 (м, 1H), 3,66 (с, 3H), 3,76 (м, 2H).
МС (ESI) m/z 284 (M++1).
(Стадия 8) Синтез метил-транс-4-(1-((5-хлор-2-фтор-4-((1-метил-3-индолилкарбонил)амино)фенил)ацетил)-(5R)-изопропил-(2S)-пирролидинилметокси)циклогексанкарбоксилата
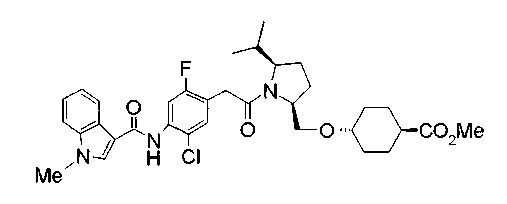
В ДМФ (5 мл) EDC·HCl (151 мг, 0,81 ммоль), HOBt (2,5 мг, 0,02 ммоль) и DMAP (2,5 мг, 0,02 ммоль) добавляют к (5-хлор-2-фтор-4-((1-метил-3-индолилкарбонил)амино)фенил)уксусной кислоте (171 мг, 0,54 ммоль) и метил-транс-4-((5R)-изопропил-(2S)-пирролидинилметокси)циклогексанкарбоксилату (152 мг, 0,54 ммоль) и образовавшуюся смесь перемешивают при комнатной температуре в течение 14 часов. К реакционной смеси добавляют воду с последующей экстракцией этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом магния и перегоняют при пониженном давлении для удаления растворителя. Остаток очищают хроматографией на колонке с силикагелем, посредством чего из элюатных фракций смеси хлороформ-метанол (40:1, об./об.) метил-транс-4-(1-((5-хлор-2-фтор-4-((1-метил-3-индолилкарбонил)амино)фенил)ацетил)-(5R)-изопропил-(2S)-пирролидинилметокси)циклогексанкарбоксилат (159 мг, 50%) получают в виде светло-желтого масла.
ИК (ATR) ν 2945, 1730, 1637, 1514, 1400 см-1;
1H-ЯМР (CDCl3) δ: 0,73 и 0,87 (д, J=6,8 Гц, общий 3H, вследствие характера двойной связи С(О)-N-связи в амиде), 0,81 и 0,94 (д, J=6,8 Гц, общий 3H, вследствие характера двойной связи С(О)-N-связи в амиде), 1,19 (м, 2H), 1,39 (м, 2H), 1,64 (м, 1H), 1,84-2,00 (ряд м, общий 6H), 1,96 (с, 3H), 2,21 (м, 1H), 2,28 (м, 1H), 3,16 (м, 1H), 3,34 (м, 2H), 3,45 (м, 1H), 3,58 (с, 3H), 3,71 (м, 1H), 3,96 (м, 1H), 4,08 (м, 2H), 7,25 (м, 2H), 7,30 (м, 2H), 7,69 (м, 1H), 8,05 (дд, J=6,0, 2,8 Гц, 1H), 8,18 (с, 1H), 8,39 и 8,41 (д, J=12,0 Гц, общий 1H, вследствие характера двойной связи С(О)-N-связи в амиде).
МС (ESI) m/z 626 (M++1);
Анал. Вычисл. для С34Н41С1FN3O5·0,75 H2О: C, 63,84; H, 6,70; N, 6,57.
Найдено: C, 63,66; H, 6,59; N, 6,54.
(Стадия 9) Синтез транс-4-(1-((5-хлор-2-фтор-4-((1-метил-3-индолилкарбонил)амино)фенил)ацетил)-(5R)-изопропил-(2S)-пирролидинилметокси)циклогексанкарбоновой кислоты
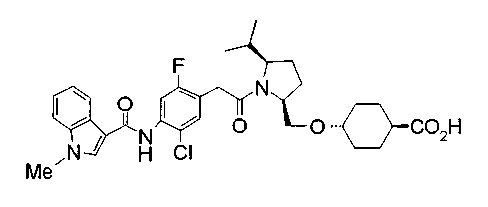
В ТГФ (2 мл) и метаноле (1 мл) растворяют метил-транс-4-(1-((5-хлор-2-фтор-4-((1-метил-3-индолилкарбонил)амино)фенил)ацетил)-(5R)-изопропил-(2S)-пирролидинилметокси)циклогексанкарбоксилат (100 мг, 0,16 ммоль). К образовавшемуся раствору добавляют 0,25 н. NaOH (2 мл) и образовавшуюся смесь нагревают при кипячении с обратным холодильником в течение 2 часов при комнатной температуре. После охлаждения до комнатной температуры реакционную смесь концентрируют при пониженном давлении для удаления растворителя. Концентрат подкисляют 1 н. HCl. Таким образом осажденные кристаллы собирают фильтрованием при пониженном давлении, промывают водой и сушат при пониженном давлении, получая при этом указанное в заголовке соединение (81 мг, 83%) в виде белого твердого вещества.
ИК (ATR) ν 2937, 1724, 1620, 1514, 1402 см-1;
1H-ЯМР (ДМСО-d6) δ: 0,75 и 0,90 (д, J=6,4 Гц, общий 3H, вследствие характера двойной связи С(О)-N-связи в амиде), 0,80 и 0,96 (д, J=6,4 Гц, общий 3H, вследствие характера двойной связи С(О)-N-связи в амиде), 1,13-1,23 (м, 3H), 1,33 (м, 2H), 1,71 (м, 2H), 1,88 (м, 4H), 1,98 (м, 2H), 2,11 (м, 1H), 2,21 (м, 1H), 3,21 (м, 3H), 3,72 (м, 2H), 4,16 (м, 1H), 7,18 (т, 0=7,2 Гц, 1H), 7,32 (д, J=7,2 Гц, 1H), 7,47 (д, J=8,0 Гц, 1H), 7,75 (д, J=11,2 Гц, 1H), 8,12 (д, J=7,6 Гц, 1H), 8,24 (с, 1Н), 9,07 (с, 1H).
МС (ESI) m/z 612 (M++1);
Анал. Вычисл. для С33Н39ClF2N3O5: С, 64,75; H, 6,42; N, 6,86.
Найдено: С, 64,54; H, 6,50; N, 6,73.
Испытание 1: Оценка in vitro испытуемых соединений
Испытание (1) с оценкой in vitro
Трансдуцированные клетки СНО, интенсивно экспрессирующие интегрины haα4 и β1 высевали в планшете Costar 3599 (3×104 клеток/100 мкл/лунку) и их культивировали в течение 2 дней. После промывания среды буфером А* дважды добавляли 50 мкл/лунку Eu3+-hVCAM-1 D1D7-IgG, разведенного до 2 нМ буфером** для анализа. К содержимому лунки добавляли 50 мкл/лунку испытуемого соединения, разведенного буфером для анализа с 2% ДМСО (в присутствии или отсутствие 6% сывороточного альбумина человека) (в лунку для анализа Scatchard, добавляли раствор, разведенный другим образом). После перемешивания в течение 5 минут на смесителе (для планшета) планшет выдерживали при комнатной температуре в течение 1 часа. Затем планшет промывали четыре раза буфером А и добавляли 100 мкл/лунку реагента усиления (DELFIA). Планшет встряхивали в течение 5 минут на смесителе с последующим измерением интенсивности флуоресценции флуорометром с временным разрешением (DELFIA Wallac). Из отношения связывания, которое получают из следующей формулы расчета: ((FT-FNS)-(FI-FNS))/(FT-FNS)×100, можно определить IC50 (концентрацию, ингибирующую 50% связывания клеток СНО с hVCAM-1 D1D7-IgG) испытуемого соединения. В вышеуказанной формуле FT означает интенсивность флуоресценции лунки без испытуемого соединения, FNS означает интенсивность флуоресценции лунки без испытуемого соединения и антитела против hα4 (SG/73) и FI означает интенсивность флуоресценции лунки, содержащей испытуемое соединение. Величину Kd, указывающую эффективность связывания и Bmax (максимум связывания) оценивали в диапазоне от 0,06 до 20 нМ по Scatchard. Результаты приводятся в таблице 1.
Величину Ki вычисляли на основании:
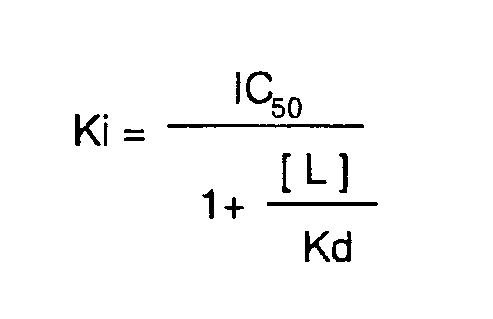
((L) означает концентрацию лиганда).
(*буфер А: 25 мМ HEPES (рН 7,5), 150 мМ NaCl, 1 мМ Са2+, 1 мМ Mg2+, 4 мМ Mn2+; **буфер для анализа: 25 мМ HEPES (рН 7,5), 150 мМ NaCl, 1 мМ Са2+, 1 мМ Mg2+, 4 мМ Mn2+, 0,1% BSA, 20 мкМ DTPA с 6% альбумином сыворотки человека (С/N A-1653, SIGMA) или без него).
Испытание (2) с оценкой in vitro
В 96-луночном микропланшете hVCAM-1 D1D7-IgG (600 нг/мл в TSM) иммобилизовали при 4°С (50 мкл/лунку). После блокирования добавлением 100 мкл/лунку раствора 2% BSA-TSM добавляли 150 мкл/лунку (2,1×105/лунку) клеток Jurkat, меченых BCECF-AM, и 50 мкл/лунку испытуемого соединения и планшет выдерживали при 37°С в течение 1 часа. Количество испытуемого соединения регулировали, чтобы оно имело конечную концентрацию от 0,1 нг/мл до 100 нг/мл (0,5% ДМСО). Лунку заполняли нижеописанной средой и герметизировали приспособлением для заклеивания планшета (продукт Sumitomo Bakelite). Планшет затем переворачивали и оставляли в таком положении при комнатной температуре в течение 30 минут. Затем несвязавшиеся клетки удаляли. После отсасывания среды клетки солюбилизировали 0,1% раствором NP-40 и интенсивность флуоресценции измеряли ридером флуоресценции (возбуждение при 485 нм/измеряли при 550 нм). Из отношения связывания, которое можно получить по следующей формуле: ((FT-FNS)-(FI-FNS))/(FT-FNS)×100, можно определить IC50 (концентрацию, ингибирующую 50% связывания hVCAM-1 D1D7-IgG с клетками Jarkat) испытуемого соединения. В вышеуказанном уравнении FT означает интенсивность флуоресценции лунки без испытуемого соединения, FNS означает интенсивность флуоресценции лунки без испытуемого соединения и hVCAM-1 D1D7-IgG и FI означает интенсивность флуоресценции лунки, содержащей испытуемое соединение.
(TSM: 25 мМ Трис-HCl (рН 8,0)-150 мМ NaCl-2 мМ MgCl2; среда: RPMI (без FACS); BCECF-AM (Dojin Kagaku))


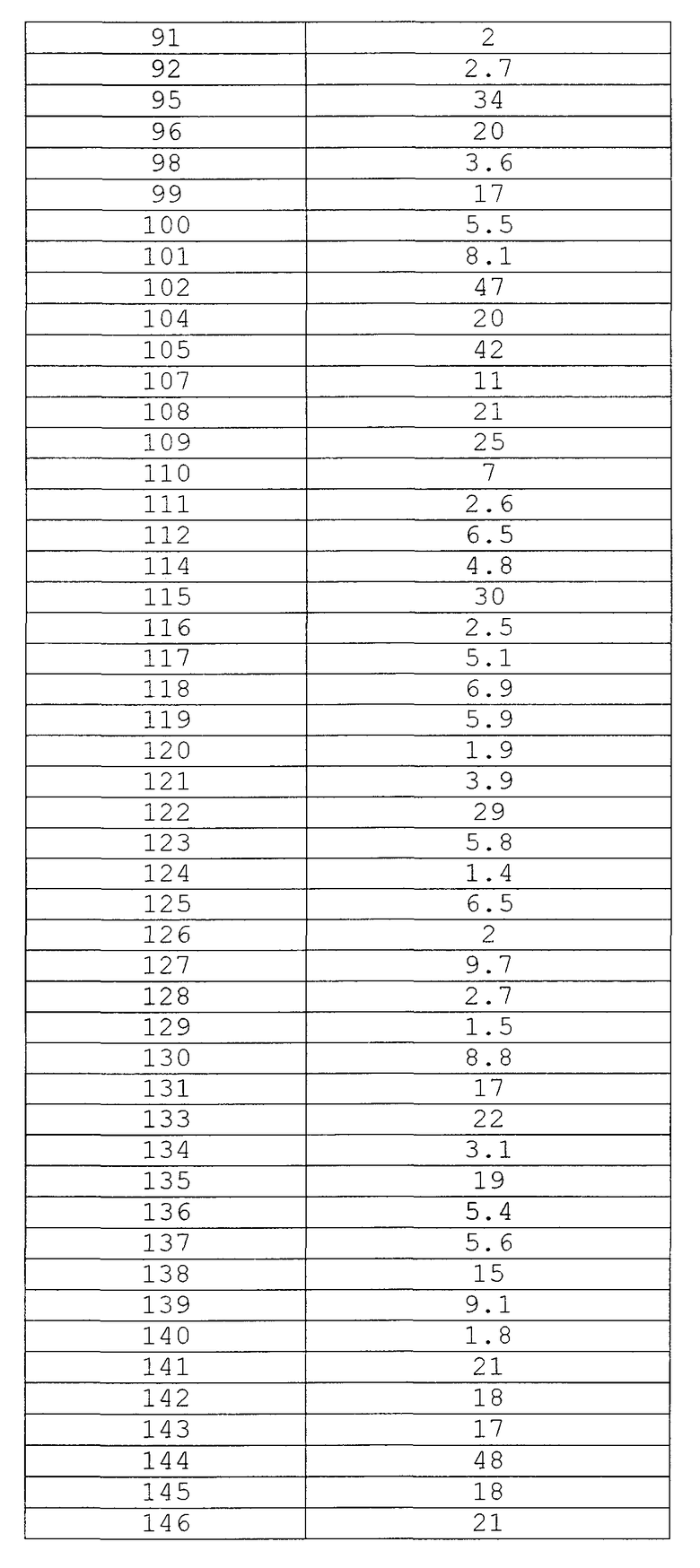

Испытание 2: оценка испытуемых соединений in vivo
Испытание трансмиграции эозинофилов у мышей, активно сенсибилизированных аскарисом (антиген Ascaris suum у свиней):
Сообщалось, что трансмиграцию эозинофилов индуцировали активной сенсибилизацией аскарисом (Int. Arch. Immunolog., 108, 11-18 (1995)). Испытуемые соединения оценивали способом, описанным в указанной литературе. Испытуемые соединения, каждое, вводили перорально или подкожно два или три раза в день. Вычисляли общее число клеток и число эозинофилов в BALF спустя 48 часов после сенсибилизации и сравнивали результаты для группы, которой вводили испытуемое соединение, и группы, которой не вводили испытуемое соединение.
Ингибирующее действие против плеврита у крысы, сенсибилизированной соединением 48/80:
Внутриплевральной инокуляцией самцов крыс CD/IGS 7-недельного возраста (Carles River Japan) 50 мкг соединения 48/80 (Sigma) вызывали плеврит.Плевральный экссудат в течение 24 часов собирали вместе с буфером и подсчитывали число эозофилов в экссудате. Испытуемое соединение перорально или подкожно вводили один или два раза с использованием подходящего растворителя, такого как 0,5% МС (водный раствор метилцеллюлозы). Эффективность его сравнивали с эффективностью группы без испытуемого соединения.
Испытание 3: Оценка пероральной биологической доступности с использованием биоанализа на мышах
Испытуемое соединение суспендировали или растворяли в подходящей для введения среде, чтобы получить концентрацию 1 мг/мл. Самкам мышей Balb/C от 7- до 9-недельного возраста перорально вводили 10 мг/кг образовавшейся суспензии или раствора. Через пятнадцать минут после введения кровь отбирали из нижней полой вены при анестезии эфиром и из крови отделяли сыворотку. Концентрацию каждого испытуемого соединения определяли оценкой уровня его в сыворотке из калибровочной кривой, полученной с ингибирующей активностью VCAM-1/VLA-4 в виде индекса или измеряя концентрации с использованием ЖХ/МС/МС.Результаты приводятся в таблице 2.
Таблица 2
Результаты оценки по биоанализу мыши

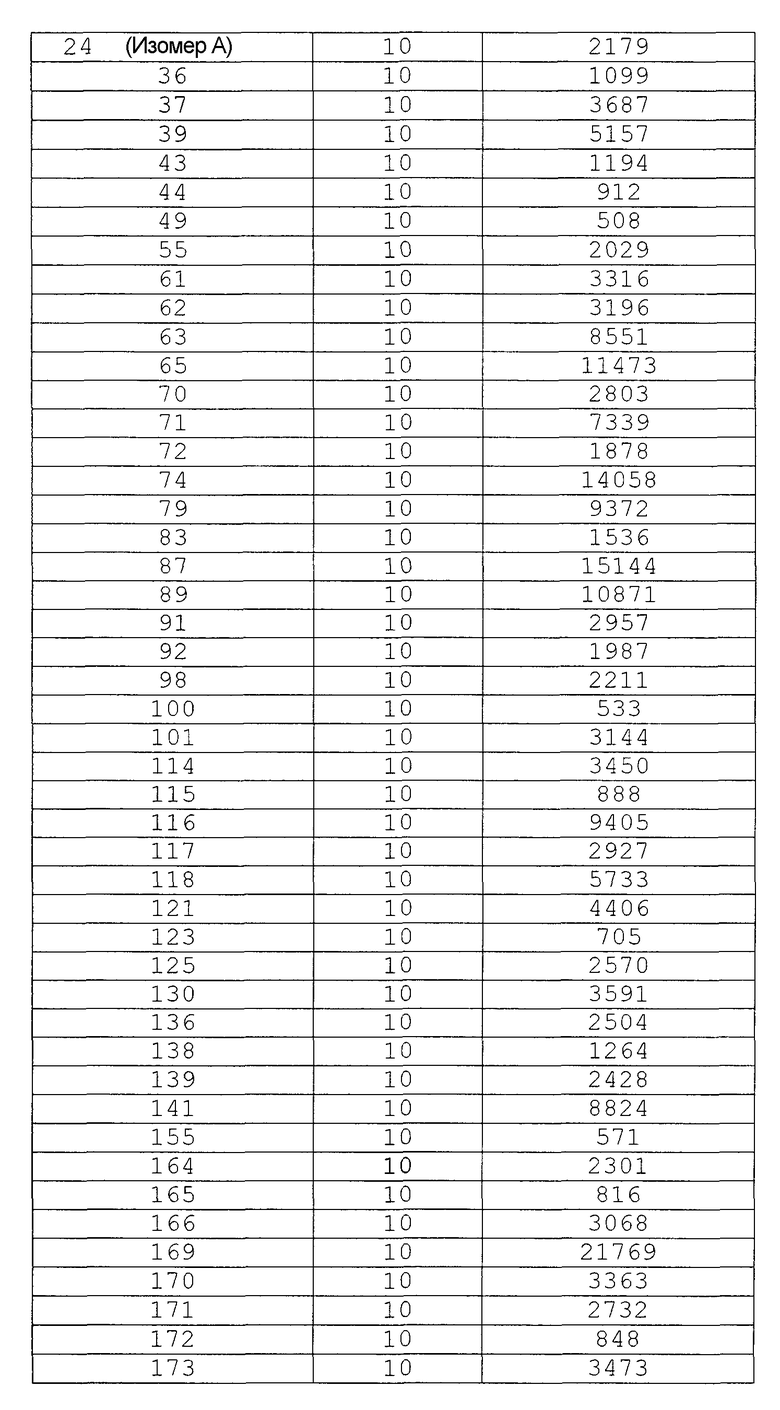
Пример 4 оценки: Испытания по фармакокинетике и пероральной биологической доступности
Фармакокинетический параметр испытуемого соединения, перорально введенного крысам или собакам, описан ниже. Результаты приводятся в таблице 3.
Оценка фармакокинетических параметров и пероральной биологической доступности
крыса
2F: пероральная биологическая доступность;
3CLtot(мл/мин/кг): видимая прозрачность плазмы
Промышленная применимость
Соединения изобретения или их соли селективно ингибируют связывание молекул адгезии клеток с VLA-4 и проявляют высокую пероральную биологическую доступность, так что они являются пригодными в качестве профилактического или лечебного средства для различных заболеваний, опосредованных миграцией и адгезией лейкоцитов, таких как воспалительные заболевания, аутоиммунные заболевания, метастазы, бронхиальная астма, риностеноз, диабет, артрит, псориаз, рассеянный склероз, воспалительные кишечные заболевания и отторжение при трансплантации. Они являются очень эффективными при пероральном введении и их можно вводить в течение продолжительного периода времени, так что они обладают высокой клинической эффективностью.
| название | год | авторы | номер документа |
|---|---|---|---|
| БИАРИЛЬНЫЕ ПРОИЗВОДНЫЕ В КАЧЕСТВЕ ИНГИБИТОРОВ БЕЛОК-БЕЛКОВОГО ВЗАИМОДЕЙСТВИЯ YAP/TAZ-TEAD | 2021 |
|
RU2830596C1 |
| ИНГИБИТОРЫ РЕЦЕПТОРА ФАКТОРА РОСТА ФИБРОБЛАСТОВ | 2014 |
|
RU2704112C2 |
| ИНГИБИТОРЫ ДИПЕПТИДИЛПЕПТИДАЗЫ IV | 2010 |
|
RU2574410C2 |
| ЦИКЛОАЛКЕНИЛАРИЛЬНЫЕ ПРОИЗВОДНЫЕ ДЛЯ ИНГИБИРОВАНИЯ ТРАНСПОРТНОГО БЕЛКА ХОЛЕСТЕРИНОВЫХ ЭФИРОВ | 2012 |
|
RU2597266C2 |
| ФЕНИКОЛОВЫЕ ПРОТИВОБАКТЕРИАЛЬНЫЕ СРЕДСТВА | 2013 |
|
RU2593204C2 |
| БИАРИЛ- ИЛИ ГЕТЕРОЦИКЛИЧЕСКИЕ БИАРИЛЗАМЕЩЕННЫЕ ПРОИЗВОДНЫЕ ЦИКЛОГЕКСЕНА В КАЧЕСТВЕ ИНГИБИТОРОВ СЕТР | 2014 |
|
RU2627361C2 |
| КОНДЕНСИРОВАННОЕ ЗАМЕЩЕННОЕ ПРОИЗВОДНОЕ АМИНОПИРРОЛИДИНА | 2007 |
|
RU2443698C2 |
| ЗАМЕЩЕННЫЕ ТРИЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ И СПОСОБ ПРИМЕНЕНИЯ | 2016 |
|
RU2744766C2 |
| ИНГИБИТОРЫ RMT5 | 2019 |
|
RU2814198C2 |
| НОВОЕ ПРОИЗВОДНОЕ ФЕНИЛПИРРОЛА | 2009 |
|
RU2470917C2 |
Изобретение относится к новым соединениям, представленным общей формулой (I), и их солям, обладающим свойствами ингибиторов VLA-4, к лекарственному средству на их основе и к их применению для получения лекарственного средства для лечения заболевания, вызванного клеточной адгезией.
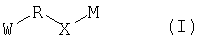
где W представляет группу следующей формулы W1-A1-W2- (i) или W3-A1-W4 (ii); R представляет -СН2-; Х представляет -С(O)- и М представляет группу следующей формулы (iii) или (iv):
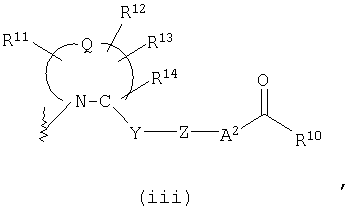
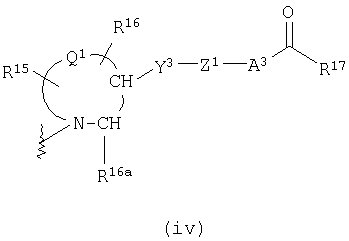
Значения заместителей W1, W2, W3, W4, A1, A2, A3, Q, Q1, R10, R11, R12, R13, R14, R15, R16, R16a, R17, Y, Y3, Z, Z1 указаны в формуле изобретения. 3 н. и 18 з.п. ф-лы, 3 табл.
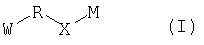
где W представляет группу следующей формулы: W1-A1-W2- (i) или W3-A1-W4 (ii):
W1-A1-W2- (i):
в которой W1 представляет фенил и нафтил, незамещенный или замещенный галогеном или C1-6алкилом, или одновалентную моноциклическую гетероциклическую группу, незамещенную или замещенную C1-6алкилом, имеющую от 5 до 6 атомов, включая N в качестве гетероатома;
А1 представляет -NH-, простую связь или -C(O)NH- и
W2 представляет двухвалентную бициклическую гетероциклическую группу, незамещенную или замещенную галогеном или C1-6алкилом, имеющую 9 атомов, включая, по меньшей мере, один гетероатом, выбранный из О, N и S,
W3-A1-W4 (ii):
в которой W3 представляет одновалентную бициклическую гетероциклическую группу, замещенную или незамещенную галогеном или С1-6алкилом, имеющую 9 или 10 атомов, включая, по меньшей мере, один гетероатом, выбранный из О, N и S,
А1 представляет -NH-, простую связь или -C(O)NH- и
W4 представляют фениленовую группу, незамещенную или замещенную атомом галогена или C1-6алкилом, С1-6алкокси, или замещенную или незамещенную галогеном двухвалентную гетероциклическую группу, имеющую от 6 до 9 атомов, включая, по меньшей мере, один гетероатом, выбранный из О и N;
R представляет -СН2-;
Х представляет -С(O)-,
и М представляет группу формулы (iii) или (iv)
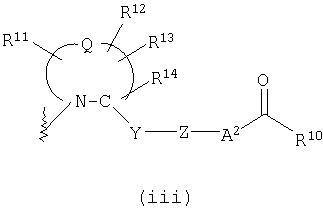
в которой фрагмент (IIIa)

представляет двухвалентную 5- или 6-членную гетероциклическую группу, где атом азота, связанный с Х и Q, представляет собой атом углерода, серы, кислорода или азота;
R11, R12 и R13 каждый независимо представляет атом водорода, гидроксигруппу, атом галогена, аминогруппу, C1-C8-алкильную группу, незамещенную или замещенную C1-С6-алкокси, С1-С8-алкоксигруппу, незамещенную или замещенную ди-С1-6-алкилкарбомаилом, незамещенную моно- или ди-С1-С8-алкиламиногруппу, незамещенную фенокси- или нафтилоксигруппу, незамещенную С1-8-валкилтиогруппу, незамещенную фенилтиогруппу, незамещенную C1-C8-алкилсульфонилгруппу, незамещенную фенилсульфонильную группу;
или R11 и R12 либо R12 и R13 могут соединяться, образуя вместе с атомом, образующим гетероциклическую группу, с которой группы R11 и R12 или группы R12 и R13 связаны, 5-членную гетероциклическую группу, включающую О в качестве гетероатома, которая может иметь 1-3 заместителя, выбранных из C1-C8-алкильных групп;
R14 представляет атом водорода;
Y представляет -CH2О-, -(СН2)2- или -СН2NH-;
Z представляет фениленовую группу, замещенную или незамещенную аминогруппой или C1-6-алкоксигруппой, незамещенную пиридиленовую группу или циклогексиленовую группу, замещенную или незамещенную С1-6алкилом;
А2 представляет простую связь и
R10 представляет гидроксил или C1-С6-алкоксигруппу;
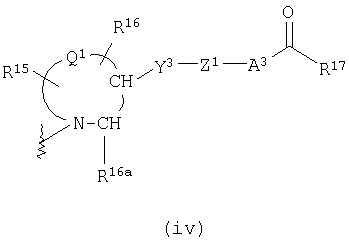
в которой фрагмент
представляет двухвалентную 5-членную гетероциклическую группу, в которой атом азота связан с X, и Q1 представляет атом углерода;
R15 и R16 каждый независимо представляет атом водорода, C1-C8-алкильную группу, незамещенную или замещенную C1-С6-алкоксигруппой или С1-C8-алкоксигруппу;
R16a представляет атом водорода;
Y3 представляет -О- или -СН2О-;
Z1 представляет незамещенную фениленовую группу;
А3 представляет простую связь и
R17 представляет гидроксигруппу или C1-С6-алкоксигруппу,
или его соль.
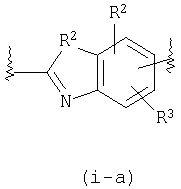
где связь с левой стороны является связью с А1, связь с правой стороны является связью с R;
X1 представляет атом кислорода или атом серы
и R2 и R3 каждый независимо представляют атом водорода, атом галогена и C1-С6-алкоксигруппу.
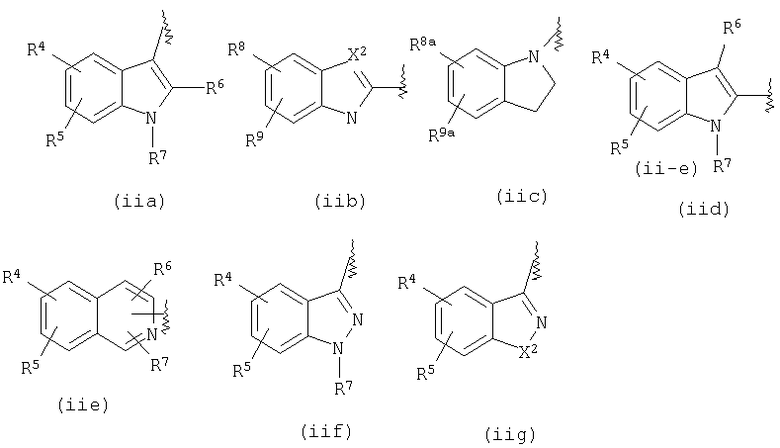
в которой X2 представляет атом кислорода или серы;
R4 и R5 каждый независимо представляет атом водорода, атом галогена, C1-С6-алкильную группу;
R6 и R7 каждый независимо представляет атом водорода или С1-С6-алкильную группу и
R8, R8a, R9 и R9a каждый независимо представляет атом водорода, атом галогена или C1-С6-алкильную группу при условии, что, когда W3 представляет группу формулы (ii-c), А1 не представляет -NH-.
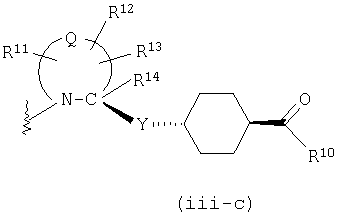
где R10, R11, R12, R13, R14, Q и Y имеют значения, как в формуле (I).
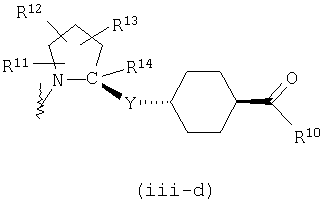
где R10, R11, R12, R13, R14 и Y имеют значения, как в формуле (I)).
| Бесколесный шариковый ход для железнодорожных вагонов | 1917 |
|
SU97A1 |
| Способ получения молочной кислоты | 1922 |
|
SU60A1 |
| WO 00/05223 A2, 03.02.2000 | |||
| Прибор, замыкающий сигнальную цепь при повышении температуры | 1918 |
|
SU99A1 |
| Дорожная спиртовая кухня | 1918 |
|
SU98A1 |
| WO 00/40088 A1, 13.07.2000 | |||
| Приспособление в пере для письма с целью увеличения на нем запаса чернил и уменьшения скорости их высыхания | 1917 |
|
SU96A1 |
| US 4221815 A, 09.09.1980 | |||
| Пресс для изготовления небьющегося стекла | 1930 |
|
SU23569A1 |
| US 4181658 A, 01.01.1980. | |||
Авторы
Даты
2006-12-27—Публикация
2001-12-28—Подача